Method Article
طريقة بسيطة وفعالة لاختبار العوامل المعدلة للمناعة لتوليد الخلايا المتغصنة ذات التحمل من الخلايا الوحيدة البشرية CD14 +
In This Article
Summary
نصف إجراء لتقييم قدرة العوامل الدوائية على توليد خلايا متغصنة من خلايا شجيرية ساذجة مشتقة من الخلايا الأحادية في المختبر والتحقق من فعاليتها عن طريق توليد الخلايا التائية التنظيمية الذاتية.
Abstract
الخلايا التغصنية التحملية (tolDCs) هي مجموعة فرعية من الخلايا التغصنية (DCs) المعروفة بتأثيرها على الخلايا التائية الساذجة نحو النمط الظاهري للخلية التائية التنظيمية (Treg). تخضع TolDCs حاليا للتحقيق كعلاجات للمناعة الذاتية والزرع ، كعلاج خلوي وطريقة لحث tolDCs من DCs الداخلية. ومع ذلك ، حتى الآن ، فإن عدد العوامل المعروفة لتحفيز tolDCs من DCs الساذجة صغير نسبيا وكانت فعاليتها في توليد Tregs in vivo غير متسقة ، لا سيما العلاجات التي تحفز tolDCs من DCs الداخلية. يوفر هذا فرصة لاستكشاف مركبات جديدة لتوليد التسامح.
نصف هنا طريقة لاختبار المركبات المعدلة للمناعة الجديدة على DCs المشتقة من الخلايا الأحادية (moDCs) في المختبر والتحقق من صحة وظائفها لتوليد Tregs ذاتية المنشأ. أولا ، نحصل على PBMCs ونعزل الخلايا الوحيدة CD14 + والخلايا التائية CD3 + باستخدام مجموعات الفصل المغناطيسي المتوفرة تجاريا. بعد ذلك ، نقوم بتمييز الخلايا الوحيدة إلى moDCs ، ونعالجها باستخدام معدل مناعي راسخ ، مثل الرابامايسين أو الديكساميثازون أو IL-10 أو فيتامين D3 ، لمدة 24 ساعة ونختبر تغييرها في علامات التحمل كتحقق من صحة البروتوكول. أخيرا ، نشارك في زراعة tolDCs المستحثة مع الخلايا التائية الذاتية في وجود تحفيز مضاد ل CD3 / CD28 ونلاحظ التغيرات في مجموعات Treg وتكاثر الخلايا التائية. نتصور استخدام هذا البروتوكول لتقييم فعالية العوامل المناعية الجديدة لإعادة برمجة DCs المتمايزة بالفعل نحو tolDC.
Introduction
الخلايا المتغصنة (DCs) هي وسطاء حاسمون بين المناعة الفطرية والتكيفية. DCs ، التي توجد بشكل أساسي في الأغشية المخاطية والجلد والأنسجة اللمفاوية ، هي الخلايا العارضة للمستضد الأولية (APCs)1. تمتص DCs البروتينات الغريبة وتعالجها وتقدمها على بروتينات التوافق النسيجي الرئيسية (MHC) للخلايا التائية الساذجة. تعبر DCs على وجه التحديد عن بروتينات معقد التوافق النسيجي الكبير من الفئة الثانية ، مثل مستضد الكريات البيض البشرية DR (HLA-DR) في البشر. تعد حالة تنشيط الترابط المستمر عند التعرض للمستضد أمرا بالغ الأهمية لاستجابة الخلايا التائية النهائية2. تعبر DCs غير الناضجة عن مستقبلات التعرف على الأنماط المختلفة (PRRs) التي تتعرف على فئات الجزيئات التي تسمى الأنماط الجزيئية المرتبطة بمسببات الأمراض (PAMPs) ، مثل مكون الجدار البكتيري ، عديد السكاريد الدهني (LPS) 3. عند تحفيز PRR ، تصبح DCs ناضجة وتقوم بتنظيم البروتينات التحفيزية المشتركة للخلايا التائية المهمة ، مثل CD80 و CD86 و CD40 ، وتفرز السيتوكينات المؤيدة للالتهابات مثل عامل نخر الورم ألفا (TNFα) ، مما يسهل تمايز الخلايا التائية الساذجة إلى مستجيب تقليدي أو خلايا تائية مساعدة2. على العكس من ذلك ، إذا توقف نضج التيار المستمر أو إذا تطورت البلدان النامية في بيئة تحمل ، يمكن للبلدان النامية أن تولد حالة تيار مستمر (tolDCs)4. تقلل TolDCs من تنظيم مستقبلات الخلايا التائية الكلاسيكية المشاركة في تنظيم مستقبلات التسامح مثل ترابط موت الخلايا المبرمج 1 (PD-L1) ومخفف الخلايا الليمفاوية B و T (BTLA) وتوليد السيتوكينات المثبطة مثل الإنترلوكين 10 (IL-10) وتحويل عامل النمو بيتا (TGF-β) 4. هذه ليست قائمة شاملة بعلامات التسامح ، وفي الواقع ، هناك إجماع محدود حول علامات tolDC المناسبة لتحديد حالة tolDC5. بالنظر إلى ذلك ، نقترح توليد الخلايا التائية التنظيمية (Treg) كعلامة وظيفية يجب استخدامها لمقارنة فعالية عوامل الحث المختلفة tolDC.
بالإضافة إلى حالات تنشيط التيار المستمر / الناضجة ، يمكن أيضا تصنيف DCs بناء على نسبها أو موقع الأنسجة ، حيث تعرض كل مجموعة فرعية وظائف مختلفة قليلا. في حين أن تقسيم tolDC / DC الناضج أقل تحديدا وموجود أكثر كسلسلة متصلة ، فإن أقسام النسب لها علامات محددة جيدا في كل من الإنسان والفئران. تتشكل سلائف التيار المستمر في نخاع العظام ، ولكن هناك نوعان فرعيان رئيسيان من DCs بناء على نسبها: 1) الخلايا المتغصنة البلازمية (pDCs) ، والتي تستمد من السلالات اللمفاوية و 2) الخلايا المتغصنة التقليدية (cDCs) ، والتي تستمد من السلالات النخاعية. في البشر ، تنضج pDCs في الأعضاء اللمفاوية ، وتعبر عن CD303 ، وتستجيب بشكل كبير للالتهابات الفيروسية6. وفي الوقت نفسه ، تنضج CD11c التي تعبر عن cDCs في الأنسجة المحيطية وتوجد في نوعين فرعيين متميزين ، CD1c + cDC1s و CD141 + cDC2 ، والتي يولد كل منهما استجابات مميزة للخلاياالتائية 7. علاوة على ذلك ، يمكن أن توجد جميع cDCs في الحالات الفرعية المقيمة في الأنسجة (CD103-) أو المهاجرة (CD103 +)8. أخيرا ، في ظل ظروف معينة ، يمكن تحفيز الخلايا من سلالات الخلايا الوحيدة (CD14 +) نحو النمط الظاهري للخلية المتغصنة ويتم تحديدها على أنها CD14- و CD141 + و CD1c + 9. هذه الخلايا ، المعروفة باسم DCs المشتقة من الخلايا الوحيدة (moDCs) ، هي الأكثر استخداما لتحليل خارج الجسم الحي في البشر حيث تشكل الخلايا الوحيدة ما يقرب من 10-30٪ من خلايا الدم المحيطية البشرية أحادية النواة (PBMCs) ، بينما تشكل pDCs 1-3٪ 10 فقط. هذا يجعل moDCs خيارا جذابا ، ولكن من المعروف أيضا أن moDCs أكثر التهابا من cDCs النموذجية المعزولة من الأنسجةالأولية 9.
يوجد حاليا فئتان عريضتان من الجهود المبذولة لتوظيف tolDCs لتوليد التسامح السريري. أولا ، يتم إنشاء tolDCs من الخلايا الوحيدة لاستخدامها كعلاج للخلايا. في هذا النموذج ، يتم تمييز moDCs عادة باستخدام IL-4 / GM-CSF بالتزامن مع معدلات المناعة مثل فيتامين D3 أو الرابامايسين (rapa) أو IL-10 أو ديكساميثازون أو مجموعات من هؤلاء11،12. تم استكشاف tolDCs هذه كعلاجات خلوية ذاتية للمناعة الذاتية وعمليات الزرع13. الاستخدام الآخر ل tolDCs هو إعادة برمجة DCs الداخلية تجاه tolDCs باستخدام الأدوية المجانية أو الناقلات النانوية لتقديم كل من معدل المناعة والمستضد ذي الأهمية14،15،16. ومع ذلك ، فإن تحريض DCs المتمايزة بالفعل هو أكثر صعوبة ، نظرا لتطوير أنماط ظاهرية استقلابية قوية من DCs والتي تتناقض عادة مع استقلاب tolDC17،18. هذا مستوى مرتفع لمعظم معدلات المناعة الدوائية. لهذا السبب ، تشير معظم دراسات إعادة برمجة التيار المستمر الداخلية إلى قمع فعال للتيار المستمر وغالبا ما يكون بعض تحريض Treg ، ولكنها تفتقر إلى النجاح السريري ، غالبا بسبب نقص ثبات الخلايا التائية15،19،20. هذا يسلط الضوء على الحاجة إلى استراتيجيات لتحديد عوامل تحريض tolDC المحتملة من DCs الحالية.
هنا ، نقدم طريقة للتقييم المختبري للعوامل المعدلة للمناعة مقابل moDCs المتمايزة مع المقياس النهائي لتحريض Treg الذاتي. تم تصميم هذا البروتوكول لتقييم فعالية العوامل المعدلة للمناعة لإعادة برمجة moDCs البشرية المتمايزة بالفعل نحو التسامح. علاوة على ذلك ، يتحقق هذا البروتوكول من صحة وظائف tolDCs المعاد برمجتها لإنشاء Tregs مقابل خلايا T ذاتية المنشأ معزولة من نفس عينة PBMC. هذا على عكس البروتوكولات الأخرى التي تحفز التسامح أثناء التمايز و / أو تحدي tolDCs مع الخلايا التائية من المتبرعين الخيفي21. في هذا البروتوكول ، نستخدم عامل التسامح المشترك rapa كمثال ولكننا نوضح أيضا الفعالية المحدودة ل moDCs المعالجة بالرابا لتوليد Tregs. في نتائجنا التمثيلية ، نظهر أيضا فعالية العلاجات المناعية الشائعة الأخرى مثل IL-10 وديكساميثازون وفيتامين D3. نتصور استخدام هذا البروتوكول لفحص عوامل تحريض tolDC التي يحتمل أن تكون أكثر فاعلية مقابل moDCs22 التي تم إنشاؤها بالفعل.
Protocol
تم الحصول على جميع عينات الخلايا أحادية النواة للدم المحيطي البشري (PBMC) من مركز المناعة البشرية بجامعة بنسلفانيا من متبرعين مجهولي الهوية بموافقة مسبقة من مجلس المراجعة المؤسسية بجامعة بنسلفانيا (IRB) بموافقة المريض.
اختياري: بينما في هذه الطريقة ، استخدمنا PBMCs المعزولة حديثا التي تم الحصول عليها من مختبر أكاديمي ، يمكن عزل PBMCs إما من الدم الكامل أو منتجات الدم المخصبة بفصادة الكريات الدم. نوصي باستخدام طريقة الطرد المركزي لتدرج الكثافة ، حيث أن هذه طريقة راسخة وموثوقة موصوفة في مكان آخر23.
1. عزل الخلايا الوحيدة / الخلايا التائية وتمايز moDC
- عزل الخلايا الوحيدة والخلايا التائية من PBMCs - اليوم 1
- الحصول على 200 مليون PBMCs بشرية من متبرع سليم. احتفظ بالخلايا في أنبوب سعة 15 مل وانقلها على الثلج.
- Aliquot 50 مل من عازلة الفصل (متوفرة في مجموعات الفصل المتاحة تجاريا) في أنبوب مخروطي الشكل.
ملاحظة: يمكن أيضا استبدال المخزن المؤقت للفصل ب DPBS بمصل بقري جنيني بنسبة 2٪ (FBS) و 1 ملي مولار حمض إيثيلين ديامين تترا أسيتيك (EDTA). - قم بإزالة أنبوب PBMC من الجليد واملأه ب Separation Buffer. جهاز طرد مركزي عند 300 × جم لمدة 5 دقائق.
- شفط المادة الطافية باستخدام ماصة مصلية سعة 10 مل. أعد تعليق حبيبات الخلية في 4 مل من الوسط الموصى به باستخدام ماصة مصلية.
- قسم التعليق إلى أنبوبين مختلفين سعة 15 مل ، مع إضافة 2 مل لكل أنبوب (5 × 107 خلايا / مل لكل أنبوب). قم بتسمية أنبوب واحد "T" والآخر "الخلايا الأحادية".
- استرجع مجموعة عزل الخلايا الأحادية البشرية واتبع بروتوكول الشركة المصنعة لعزل الخلايا الوحيدة من الأنبوب المسمى أحادي الخلية.
- استرجع مجموعة عزل الخلايا التائية البشرية واتبع بروتوكول الشركة المصنعة للأنبوب الثاني لعزل الخلايا التائية.
- طلاء الخلايا الوحيدة لتمايز وتجميد الخلايا التائية - اليوم 1
- سخن 50 مل من وسط ثقافة moDC (الجدول 1) عند 37 درجة مئوية لمدة 10 دقائق على الأقل.
- الطرد المركزي الأنابيب سعة 15 مل مع الخلايا الوحيدة المخصبة والأنبوب 15 مل مع الخلايا التائية من الخطوة 1.1 عند 250 × جم لمدة 5 دقائق.
- شفط المادة الطافية. أعد تعليق الخلايا الوحيدة في 1 مل من وسيط ثقافة moDC والخلايا التائية في وسط زراعة الخلايا التائية (الجدول 1) عن طريق سحب العينة لأعلى ولأسفل. تأكد من تشتيت الحبيبات بشكل صحيح.
- عد الخلايا باستخدام عداد الخلايا الآلي أو مقياس الدم اليدوي باستخدام تلطيخ التربان الأزرق.
ملاحظة: بالنسبة للبيانات التمثيلية ، تم عزل 10 ملايين خلية تائية و 3 ملايين خلية وحيدية. - خذ الأنبوب مع الخلايا الوحيدة وأضف 9 مل من وسيط ثقافة moDC الدافئ إلى التعليق للحصول على حجم نهائي يبلغ 10 مل. ثم أضف 100 ميكرولتر لكل من 10 ميكروغرام / مل من مخزون GM-CSF و 10 ميكروغرام / مل من مخزون IL-4 للحصول على تركيز نهائي قدره 100 نانوغرام / مل من كل من GM-CSF و IL-4 في الوسائط. انقل المعلق إلى طبق بتري وقم بتسميته باسم "moDC" (اليوم 1) واحتضانه عند 37 درجة مئوية مع 5٪ ثاني أكسيد الكربون2.
- خذ أنبوب الخلية التائية واخلط 1 مل من وسط تجميد الخلايا التائية (الجدول 1) مع 1 مل من تعليق الخلايا التائية. يقسم إلى اثنين من cryovials سعة 2 مل (1 مل / قارورة) ؛ ختم بإحكام (التركيز النهائي ل 5 ملايين خلية لكل قارورة). ضع المبردات في غرفة تجميد مع أنابيب موازنة في آبار غير مستخدمة. قم بتخزين الحجرة في درجة حرارة -80 درجة مئوية طوال الليل ، ثم انقل المبردات إلى خزان تبريد.
- في اليوم 4 ، قم بتحديث الوسط بإضافة 5 مل من وسيط ثقافة moDC الطازج وأضف 100 ميكرولتر لكل من مخزون GM-CSF و IL-4. ستكون moDCs المتمايزة جاهزة في اليوم 7.
2. إضافة أدوية معدلة للمناعة لتوليد moDCs تحمل المنشأ
- قم بإعداد لوحة moDC.
- في اليوم 7 ، استرجع moDCs المتمايزة من الحاضنة وانقل تعليق خلية moDC إلى أنبوب سعة 50 مل.
- جهاز الطرد المركزي التعليق عند 250 × جم لمدة 5 دقائق. قم بشفط المادة الطافية وإعادة تعليق حبيبات الخلية في 1 مل من وسائط ثقافة moDC الدافئة عن طريق سحب العينات لأعلى ولأسفل. عد الخلايا باستخدام مقياس الدم وتخفيف الخلايا إلى تركيز 3 × 105 خلايا / مل في وسط ثقافة moDC دافئ يحتوي على 100 نانوغرام / مل GM-CSF و IL-4.
- أضف 3 × 104 خلايا / بئر في 100 ميكرولتر إلى العدد المطلوب من الآبار في صفيحة زراعة الأنسجة ذات القاع المسطح 96 بئر.
ملاحظة: بالنسبة للنتائج التمثيلية، استخدمنا ما مجموعه 48 بئرا (أربعة شروط تم إجراؤها في ثلاث مرات أعدت لأربعة تحليلات مختلفة في القسمين 3 و 4)، ولكن يمكن تعديل ذلك لما يصل إلى 60 بئرا. املأ جميع الآبار المتبقية ب 100 ميكرولتر / بئر PBS لمنع الجفاف ، وخاصة الآبار الخارجية. نوصي بإعداد لوحات مختلفة لكل طريقة من طرق التحليل. - أضف 1 ميكرولتر / بئر من الأدوية المعدلة للمناعة إلى الآبار المرغوبة (هنا 10 نانوغرام / مل رابا). احتضان اللوحة طوال الليل عند 37 درجة مئوية مع 5٪ ثاني أكسيد الكربون2.
ملاحظة: إذا كنت تتضمن التحفيز المناعي في اليوم 8 ، فقم بإعداد الآبار للدواء المناعي مع وبدون التحفيز المناعي. يعد استخدام التحفيز المناعي للناضجين أمرا اختياريا.
- إعادة إذابة الخلايا التائية.
- في اليوم 8 ، استرجع اثنين من cryovials من خزان التبريد وقم بإذابة الجليد في حمام حبة ساخن أو حمام مائي عند 37 درجة مئوية حتى تبدأ المحتويات في الذوبان (في <3 دقائق).
- عندما تبدأ المحتويات في الذوبان ، انقل القوارير إلى غطاء مزرعة الخلايا وأنبوب 1 مل من وسائط زراعة الخلايا التائية الدافئة في القارورة لإذابة الجليد بسرعة. انقل محتويات القارورة بالكامل إلى أنبوب سعة 50 مل. اشطف المبردات ب 1 مل من وسط زراعة الخلايا التائية لضمان نقل جميع الخلايا إلى الأنبوب.
- قم بتعبئة التعليق بمحلول تلطيخ التدفق (الجدول 1) إلى 15 مل. جهاز طرد مركزي عند 200 × جم لمدة 10 دقائق وشفط المادة الطافية. ثم, أعد تعليق الحبيبات في 5 مل من محلول تلطيخ التدفق وجهاز الطرد المركزي مرة أخرى.
- استنشاق المادة الطافية وإعادة تعليق الخلايا في 1 مل من وسط زراعة الخلايا التائية الدافئة. عد الخلايا باستخدام مقياس الدم.
ملاحظة: يجب أن تكون الجدوى >70٪ في هذه المرحلة؛ إذا بقيت كميات كبيرة من الخلايا الميتة ، فقم بنقلها إلى أنبوب جديد ، وأضف 10 مل من محلول صبغة الخلية ، وجهاز الطرد المركزي عند 200 × جم لمدة 5 دقائق ، وأعد تعليقها في 1 مل من وسائط الخلايا التائية ، وأعد العد. - أضف 9 مل من وسط زراعة الخلايا التائية الدافئة لعمل حجم نهائي يبلغ 10 مل. انقل المعلق إلى طبق بتري. قم بتسميته على أنه "الخلايا التائية المعاد إذابتها" واحتضانه طوال الليل عند 37 درجة مئوية مع 5٪ ثاني أكسيد الكربون2 للسماح للخلايا بالراحة.
- اغسل لوحة moDC وأضف المحفز المناعي إذا رغبت في ذلك.
- في اليوم 8 ، قم بالطرد المركزي للوحة moDC (من اليوم 7) عند 300 × جم لمدة 5 دقائق.
- شفط المادة الطافية ، واغسلها باستخدام HBSS الدافئ ، وكرر الطرد المركزي ، والشفط مرة أخرى ، وأعد تعليق الخلايا في وسط ثقافة moDC دافئ يحتوي على GM-CSF و IL-4 (100 ميكرولتر / بئر).
ملاحظة: احرص على عدم إزعاج الخلايا. قم بإمالة اللوحة أثناء الشفط. يمكن أن يبقى ما يقرب من 10 ميكرولتر في البئر. - في حالة استخدام التحفيز المناعي ، أضف 1 ميكرولتر / بئر من 100x مخزون LPS (أو عامل محفز مناعي آخر) إلى الآبار المرغوبة. احتضان اللوحة طوال الليل عند 37 درجة مئوية مع 5٪ ثاني أكسيد الكربون2.
3. تحليل التدفق ل moDC (التحقق + التسامح)
- تحليل التدفق للتحقق من صحة moDC
- في اليوم 8 ، قم بإعداد كوكتيلات الأجسام المضادة للجنة التحقق من الصحة ، مستهدفة العلامات التالية: HLA-DR و CD14 و الليكتين من النوع C الخاص بالخلايا المتغصنة (DC-SIGN) و CD1c و CD40 كما هو موضح في الجدول 2. تمييع جميع الأجسام المضادة بمحلول صبغة التدفق.
ملاحظة: تم تصميم اللوحة لمقياس تدفق الليزر الأحمر / الأزرق ذو 7 قنوات. - استرجع لوحة moDC من الحاضنة. الطرد المركزي للوحة على حرارة 300 × جم لمدة 5 دقائق. قم بإزالة المواد الطافية. اختياري: احتفظ بالمواد الطفية لتحليل ELISA للسيتوكينات IL-10 و TNFα باستخدام المجموعات المتوفرة تجاريا وفقا لتعليمات الشركات المصنعة.
- أضف 200 ميكرولتر / بئر من محلول تلطيخ التدفق. جهاز الطرد المركزي للوحة على حرارة 300 × جم لمدة 5 دقائق.
- شفط المادة الطافية وأضف 50 ميكرولتر / بئر من الجسم المضاد المثبط لربط مستقبلات Fc المخفف 1: 200 في محلول تلطيخ التدفق لمنع الارتباط غير المحدد. احتضان في درجة حرارة الغرفة (RT) لمدة 30 دقيقة.
- أضف 50 ميكرولتر / بئر من كوكتيل الأجسام المضادة للوحة التحقق من الصحة المحضر.
- قم بإعداد أدوات التحكم في التعويض في اللوحة أو في أنابيب سعة 1.5 مل عن طريق خلط 50 ميكرولتر من حبات التعويض مع 50 ميكرولتر من كل جسم مضاد مخفف. احتضان اللوحة عند 4 درجات مئوية لمدة 1 ساعة.
ملاحظة: يتم استخدام حبات التعويض هنا بدلا من الخلايا للتعويض بسبب التعبير المنخفض المحتمل عن العلامات على moDCs. - يغسل عن طريق الطرد المركزي عند 300 × جم لمدة 5 دقائق ، وإزالة المادة الطافية ، وإعادة التعليق في 200 ميكرولتر من محلول تلطيخ التدفق. قم بغسلتين.
- بعد الغسيل النهائي ، قم بجهاز الطرد المركزي مرة أخرى وأعد تعليق الخلايا في 110 ميكرولتر / بئر من محلول تلطيخ التدفق. العينات جاهزة الآن لتحليل قياس التدفق الخلوي.
- في اليوم 8 ، قم بإعداد كوكتيلات الأجسام المضادة للجنة التحقق من الصحة ، مستهدفة العلامات التالية: HLA-DR و CD14 و الليكتين من النوع C الخاص بالخلايا المتغصنة (DC-SIGN) و CD1c و CD40 كما هو موضح في الجدول 2. تمييع جميع الأجسام المضادة بمحلول صبغة التدفق.
- تحليل التدفق ل moDC (لوحة التسامح)
- على غرار الخطوة 3.1 في اليوم 8 ، قم بإعداد كوكتيلات الأجسام المضادة للوحة التسامح ، مستهدفة العلامات التالية: CD86 و PD-L1 و DC-SIGN و CD1c و BTLA و CD40 (الجدول 2).
- كرر الخطوات 3.1.2-3.1.8 ، واستبدل كوكتيل الأجسام المضادة بكوكتيل لوحة التسامح .
4. تحليل تدفق الخلايا التائية
- اجمع بين الخلايا التائية وخلايا التحمل المعالجة.
- في اليوم 9 ، استرجع طبق بتري الخلية التائية المعاد إذابته من الحاضنة وانقل جميع الخلايا التائية إلى أنبوب سعة 50 مل. قم بتعبئة محلول تلطيخ التدفق.
- اختياري: في حالة إجراء تحليل تكاثر الخلايا التائية ، قسم الخلايا التائية إلى أنبوبين.
- باستخدام الأنبوب الأول ، قم بالدوران لأسفل عند 250 × جم لمدة 5 دقائق وقم بإزالة المادة الطافية. تلطخ هذا الأنبوب بصبغة تكاثر الخلايا وفقا لتعليمات الشركة المصنعة.
ملاحظة: استخدمنا صبغة قابلة للإصلاح eFluor 670 ، والتي تتطلب خطوة حضانة مدتها 30 دقيقة ، متبوعة بخطوتي غسيل. نقترح استخدام أنابيب مخروطية سعة 50 مل لمنع فقدان الخلايا واستخدام HBSS مع 10٪ HIFBS للغسيل بعد التلوين. - استخدم الأنبوب الثاني الذي يحتوي على خلايا تائية غير ملطخة لتحليل Treg. وبالمثل ، قم بالدوران عند 250 × جم لمدة 5 دقائق ، وقم بإزالة المادة الطافية ، وأعد تعليقها في وسط زراعة الخلايا الدافئة ، واحتفظ بها في الحاضنة أثناء عملية التلوين. إذا لم تكن هناك حاجة إلى تكاثر الخلايا التائية ، فقم بتدوير جميع الخلايا التائية واستبدلها بوسائط زراعة الخلايا التائية الدافئة.
- باستخدام الأنبوب الأول ، قم بالدوران لأسفل عند 250 × جم لمدة 5 دقائق وقم بإزالة المادة الطافية. تلطخ هذا الأنبوب بصبغة تكاثر الخلايا وفقا لتعليمات الشركة المصنعة.
- عد الخلايا واحصل على ما لا يقل عن 4 ملايين (لتحليل Treg فقط) أو 8 ملايين (لتحليل انتشار Treg و T).
- استرجع لوحة moDC من الحاضنة مع الآبار المتبقية ، وجهاز الطرد المركزي عند 300 × جم لمدة 5 دقائق ، وقم بتقطيع المواد الطاففة. أضف 200 ميكرولتر / خلايا تائية بئر عند 1.6 × 105 خلايا / بئر. أضف الخلايا التائية غير الملوثة للوحات تحليل Treg والخلايا التائية الملطخة لألواح تكاثر الخلايا التائية.
ملاحظة: سيحافظ هذا على نسبة خلية T إلى moDC تبلغ 5: 1 ، حيث تتوسع وحدات moDCs الأولية 3 ×104 بشكل طفيف. - أضف 25 ميكرولتر / مل من كوكتيل الأجسام المضادة المضادة ل CD3 / CD28 إلى جميع المجموعات باستثناء آبار التحكم السلبية لتحفيز الخلايا التائية. احتضان اللوحة لمدة 72 ساعة عند 37 درجة مئوية مع 5٪ ثاني أكسيد الكربون2 حتى اليوم 12.
ملاحظة: تأكد من استخدام الخلايا التائية الملطخة لتحليل التكاثر وغير ملوثة لتحليل Treg.
- تحليل تدفق Treg
- تلطيخ علامة السطح
- في اليوم 12 ، قم بإعداد كوكتيلات الأجسام المضادة للوحة Treg (الجدول 2).
- انقل جميع معلقات الخلايا من لوحة الثقافة المكونة من 96 بئرا إلى لوحة قاع على شكل حرف V مع محلول تلطيخ التدفق. احتفظ بالمواد الطافية لتحليل السيتوكين.
- اغسل الخلايا 2x عن طريق الطرد المركزي (200 × جم لمدة 5 دقائق متبوعا ب 200 ميكرولتر من محلول بقع التدفق). خصص بعض الخلايا لضوابط التعويض. ضع واحدة جانبا لتلوين FOXP3 وأدوات التحكم غير الملطخة.
ملاحظة: نقترح تمشيط 10 ميكرولتر من جميع العينات قبل الدوران النهائي في الخطوة 4.2.1.3 للحصول على ضوابط التعويض اللازمة. يوفر هذا عينة تمثيلية لجميع تعبيرات مستوى السطح لكل علامة على الخلايا. - بعد الغسيل الثاني ، قم بجهاز الطرد المركزي عند 200 × جم لمدة 5 دقائق في درجة حرارة الغرفة والشفق ، ثم أضف 50 ميكرولتر / بئر الجسم المضاد المثبط لربط مستقبلات Fc (مخفف 1: 200 في محلول تلطيخ التدفق). احتضن في درجة حرارة الغرفة لمدة 10 دقائق.
- أضف 50 ميكرولتر / بئر من كوكتيل الأجسام المضادة Treg Panel المحضر.
- لعناصر التحكم في التعويض ، امزج 50 ميكرولتر من خلايا التعويض غير الملوثة مع 50 ميكرولتر من كل جسم مضاد ملطخ.
- احتضان اللوحة وأدوات التحكم في التعويض عند 4 درجات مئوية لمدة 1 ساعة. اغسل الطبق مرة واحدة باستخدام محلول Flow Stain Solution وجهاز الطرد المركزي على حرارة 300 × جم لمدة 5 دقائق.
- وصمة عار مع صبغة حية / ميتة قريبة من الأشعة تحت الحمراء مخففة في HBSS (1: 1,000) عند 200 ميكرولتر / بئر. احتضان عند 4 درجات مئوية لمدة 30 دقيقة.
- اغسل الطبق مرة واحدة بمحلول تلطيخ التدفق (200 ميكرولتر / بئر) عند 300 × جم لمدة 5 دقائق.
- وصمة عار مع FoxP3 وفقا لتعليمات الشركة المصنعة ، الأمر الذي سيتطلب حضانة بين عشية وضحاها. لمحة موجزة عن بروتوكول تلطيخ FoxP3 موصوفة أدناه .
- قم بإعداد حل عمل التثبيت / النفاذية FoxP3 وفقا لتعليمات الشركة المصنعة. امزج جزءا واحدا من تركيز التثبيت / النفاذية FoxP3 مع 3 أجزاء من تخفيف التثبيت / النفاذية FoxP3. تحضير 200 ميكرولتر من محلول العمل لكل عينة.
- احتضان جميع العينات في 200 ميكرولتر / بئر من محلول التثبيت / النفاذية العاملة. اتركيه عند 4 درجات مئوية لمدة 1 ساعة.
- تحضير 1x النفاذية عازلة: امزج جزءا واحدا من 10x نفاذية المخزن المؤقت (تم الحصول عليه من مجموعة تجارية) مع 9 أجزاء من الماء المقطر.
- اغسل الطبق 2x باستخدام 1x permeabilization Buffer (200 ميكرولتر / بئر) عند 300 × جم لمدة 5 دقائق.
- وصمة عار بالجسم المضاد FoxP3 (PE-Cy5.5 ، تخفيف 1: 300 في 1x النفاذية عازلة): أضف 100 ميكرولتر / بئر من الجسم المضاد FoxP3 المخفف واحتضنه عند 4 درجات مئوية طوال الليل.
- اغسل الطبق 2x باستخدام 1x permeabilization Buffer (200 ميكرولتر / بئر) عند 300 × جم لمدة 5 دقائق.
- أعد تعليق الخلايا في 110 ميكرولتر / بئر من محلول تلطيخ التدفق.
- إجراء تحليل قياس التدفق الخلوي.
- تلطيخ علامة السطح
- تحليل تكاثر الخلايا التائية
- قم بإعداد كوكتيلات الأجسام المضادة للوحة انتشار T (الجدول 2).
- انقل جميع معلقات الخلايا من لوحة الثقافة المكونة من 96 بئرا إلى لوحة قاع على شكل حرف V مع محلول تلطيخ التدفق. احتفظ بالمواد الطاففية لتحليل السيتوكين.
- اغسل الخلايا 2x عن طريق الطرد المركزي (200 × جم لمدة 5 دقائق متبوعا ب 200 ميكرولتر من محلول بقع التدفق). خصص بعض الخلايا لضوابط التعويض. ضع واحدة جانبا لتلوين FOXP3 وأدوات التحكم غير الملطخة.
ملاحظة: نقترح تمشيط 10 ميكرولتر من جميع العينات قبل الدوران النهائي في الخطوة 4.3.3 للحصول على ضوابط التعويض اللازمة. يوفر هذا عينة تمثيلية لجميع تعبيرات مستوى السطح لكل علامة على الخلايا. - بعد الغسيل الثاني ، جهاز الطرد المركزي (200 × جم لمدة 5 دقائق في درجة حرارة الغرفة) والشفط ، ثم أضف 50 ميكرولتر / بئر الجسم المضاد لمثبط ربط مستقبلات Fc (مخفف 1: 200 في محلول تلطيخ التدفق). احتضن في درجة حرارة الغرفة لمدة 10 دقائق.
- أضف 50 ميكرولتر / بئر من كوكتيل الأجسام المضادة للوحة T Proliferation المحضرة.
- لعناصر التحكم في التعويض ، امزج 50 ميكرولتر من خلايا التعويض غير الملوثة مع 50 ميكرولتر من كل جسم مضاد ملطخ.
- احتضان اللوحة وأدوات التحكم في التعويض عند 4 درجات مئوية لمدة 1 ساعة. اغسل الطبق مرة واحدة باستخدام محلول Flow Stain Solution وجهاز الطرد المركزي على حرارة 300 × جم لمدة 5 دقائق.
- وصمة عار مع صبغة حية / ميتة قريبة من الأشعة تحت الحمراء مخففة في HBSS (1: 1,000) عند 200 ميكرولتر / بئر. احتضان عند 4 درجات مئوية لمدة 30 دقيقة.
- اغسل الطبق مرة واحدة بمحلول تلطيخ التدفق (200 ميكرولتر / بئر) عند 300 × جم لمدة 5 دقائق.
- إجراء تحليل قياس التدفق الخلوي.
النتائج
لقد وصفنا بروتوكولا ل PBMCs البشرية ، وعزل كل من خلايا CD3 + T والخلايا الوحيدة CD14 + باستخدام مجموعات الفصل المغناطيسي المتاحة تجاريا ، وتمييز الخلايا الوحيدة إلى CD14- و HLA-DR + و CD141 + و CD1c + moDCs باستخدام GM-CSF و IL-4 ، ومعالجتها لمدة 24 ساعة ، والزراعة المشتركة مع الخلايا التائية الذاتية مع التحفيز المضاد ل CD3 / CD28 لمدة 72 ساعة. يظهر الرسم التخطيطي التجريبي في الشكل 1.
عزل الخلايا الوحيدة / الخلايا التائية وتمايز moDC
بالنسبة لنتائجنا التمثيلية الأولية ، تم شراء 200 مليون PBMCs بشرية من مركز المناعة البشرية بجامعة بنسلفانيا (HIC) من متبرع سليم واحد ومعالجتها كما هو موضح في أقسام البروتوكول 1 و 2. تم سحب الدم في اليوم 1 وعزله باستخدام تجزئة فيكول القياسية في مرفق التحالف الدولي للموئل. استخدمنا 100 مليون PBMCs لعزل الخلايا التائية والخلايا الوحيدة ، ولكل منها غلة 10 ملايين خلية تائية و 3 ملايين خلية وحيدة ، على التوالي. تم تحليل الخلايا الوحيدة و moDCs بعد تمايز GM-CSF / IL-4 في اليوم 7 عن طريق قياس التدفق الخلوي. لاحظنا مجموعتين متميزتين في الخلايا الوحيدة غير المتمايزة ، CD14 + الكلاسيكية ، HLA-DR- الخلايا الوحيدة (>45٪) ، ومجموعة صغيرة من خلايا CD14- و HLA-DR + التي عبرت عن كميات قليلة من CD1c ولا CD141. في المقابل ، في اليوم 7 من التمايز ، لاحظنا معظم الخلايا التي كانت CD14- و HLA-DR + و CD141 + و CD1c + ، مما يشير إلى moDCs (الشكل 2). حصلنا على ما يقرب من 4 ملايين moDCs من 3 ملايين وحيدة في البداية.
تحليل التدفق ل moDC (التحقق + التسامح)
في اليوم 7 ، تم احتضان moDCs مع rapa لمدة 24 ساعة ، وغسلها ، واحتضانها باستخدام LPS لمدة 24 ساعة ، ثم تم تحليلها عن طريق قياس التدفق الخلوي في اليوم 9 عبر خطوة البروتوكول 3. وشملت مجموعات العلاج: 1) عدم المعالجة + عدم المعالجة (UT) ، 2) عدم المعالجة + 0.1 ميكروغرام / مل LPS (LPS) ، 3) 10 نانوغرام / مل رابا + عدم المعالجة (رابا) ، أو 4) 10 نانوغرام / مل رابا + 0.1 ميكروغرام / مل لبس (LPS + رابا). أدى العلاج بالرابا ، مع وبدون LPS ، إلى انخفاض أعداد CD1c + و DC-SIGN + من UT ، على الرغم من أن النسب المئوية ظلت >50٪ (الشكل 3 أ). كما تم تحليل MoDCs في اليوم 9 للتعبير عن علامات نضج التيار المستمر ، CD86 و CD40. لاحظنا زيادة ملحوظة في CD86 عندما تم التعامل مع moDCs باستخدام LPS ، والذي تم منعه عندما تمت معالجة moDCs مسبقا باستخدام rapa (الشكل 3 ب). عندما تم تطبيع الإشارة إلى عناصر تحكم UT ، لاحظنا انخفاضا كبيرا في كل من CD40 و CD86 في مجموعات علاج الرابا وعدم وجود زيادة في الإشارة مع مجموعات LPS + rapa (الشكل 3C ، D). لوحظ هذا النمط نفسه لعلامات التحمل ، PD-L1 و BTLA ، مع تقليل علاج rapa من الإشارة ومنع زيادة الاستجابة لتحفيز LPS (الشكل 3E ، F). يشير هذا إلى أن علاج رابا منع نضوج LPS ولكنه حد في نفس الوقت من التعبير عن علامات التحمل المنشأ.
تحليل التدفق ل Treg
قمنا بعد ذلك بتحليل الخلايا التائية الذاتية بعد الزراعة المشتركة مع moDCs والتحفيز بتحفيز CD3 / CD28 في اليوم 12 بنسبة 1: 5 moDC: الخلايا التائية باستخدام خطوة البروتوكول 4.2. حددنا مجموعات Treg بواسطة CD4 + و CD25 + و FoxP3 + (الشكل 4) 24. تضمنت العينات الخلايا التائية بدون تحفيز (تحكم سلبي) ، والخلايا التائية مع تحفيز CD3 / CD28 ولكن بدون moDCs ، والخلايا التائية مع تحفيز CD3 / CD28 والزراعة المشتركة مع مجموعات moDC الأربع من الفقرة السابقة. لاحظنا وجود عدد واضح من Treg وزيادة ملحوظة في Treg عندما تمت إضافة moDCs إلى الثقافة المشتركة. ومع ذلك ، لم يكن هناك فرق كبير في تردد Treg بين moDC الأربعة ، على عكس بعض تقارير الأدبيات التي توضح زيادة توليد Treg من tolDCs المعالجة بالرابا (الشكل 5 أ) 25.
تحليل تدفق تكاثر الخلايا التائية
قمنا أيضا بتحليل عينتنا التمثيلية لتكاثر الخلايا التائية باستخدام خطوة البروتوكول 4.3. تم تحفيز الثقافات المشتركة للخلايا التائية بالمثل كما هو الحال في تحليل Treg ثم تم تحليلها عن طريق التدفق لصبغة تكاثر الخلايا إما CD4 + أو CD8 + الخلايا التائية (الشكل 5 ب). لاحظنا أن moDCs المعالجة بالرابا لديها انخفاض معتدل في تكاثر الخلايا التائية في كل من مقصورات الخلايا التائية CD4 + و CD8 + مقارنة ب moDCs المعالجة ب LPS و moDCs غير المعالجة عند تحفيز CD3 / CD28.
تحليل عينات إضافية من المرضى ومعدلات المناعة:
تشير نتائجنا التمثيلية إلى أن moDCs المعالجة بالرابا تقلل من علامات نضج التيار المستمر مثل CD86 و CD40 وتقلل من تكاثر الخلايا التائية إلى تحفيز CD3 / CD28 غير المحدد. ومع ذلك ، فإن moDCs المعالجة ب Rapa لها تأثير ضئيل على العلامات الإيجابية للتسامح ، مثل PD-L1 أو BTLA ولا تزيد من أعداد Treg عند تحفيز CD3 / CD28. لاستكشاف ما إذا كان سيتم ملاحظة نتائج مماثلة للخلايا التائية مع مرضى آخرين ومعدلات المناعة ، كررنا تجربة الزراعة المشتركة الذاتية من عينات بشرية إضافية (ليصبح المجموع 4 أو 5 اعتمادا على التحليل). اختبرنا كذلك 1 ميكرومتر ديكساميثازون (Dex) ، 10 نانوغرام / مل IL-10 (IL-10) ، 1 ميكروغرام / مل عديد السكاريد الدهني (LPS) ، أو 1 نانومتر فيتامين D3 (VD3) بالإضافة إلى 10 نانوغرام / مل رابا كمعدلات مناعية معطاة في الخطوة 2.1.4 مع حذف التحفيز المناعي. قمنا أيضا بتضمين عينة تم إعطاؤها Dex في الخطوة 2.1.4 وعولجت ب 0.1 ميكروغرام / مل LPS في الخطوة 2.3.3 في اليوم 8 (Dex + LPS). اختبرنا أولا المواد الطافية من moDC (بدون إضافة الخلايا التائية) إما بعد 24 ساعة أو 72 ساعة من الخطوة 2.3.3 في اليوم 8 للسيتوكين التحمل الشائع IL-10 والسيتوكين الالتهابي TNFα (الشكل 6A-D). لاحظنا أن moDCs المعالجة بالرابا لم تزيد من IL-10 في أي عينات في 24 ساعة أو 72 ساعة ، لكن العينات المعالجة ب IL-10 زادت بشكل كبير من إنتاج IL-10 في 24 ساعة ، حتى بعد خطوتي غسيل لإزالة IL-10 المضاف خارجيا. (الشكل 6 أ). لاحظنا أيضا أن moDCs المعالجة ب Dex زادت بشكل كبير من إنتاج IL-10 ولكن فقط بعد الراحة لمدة 72 ساعة (الشكل 6 ب). لاحظنا كذلك أنه لم ينتج أي معدل مناعي بمفرده TNFα ، ولكن المعالجة المسبقة ل Dex قللت من متوسط توليد TNFα عند علاج LPS في 24 ساعة ، على الرغم من أن هذه النتيجة لم تكن ذات دلالة إحصائية (الشكل 6 ج). تظهر البيانات أيضا أنه في حين أن تعبير moDC ل PD-L1 لا يزداد بواسطة أي معدل مناعي في 24 ساعة ، فقد لوحظت زيادات كبيرة في PD-L1 + moDCs في المجموعات المعالجة Dex + LPS و Rapa في 72 ساعة (الشكل 6E ، F). مثل عينتنا التمثيلية الفردية ، نلاحظ أيضا قمع تعبير CD86 من جميع المجموعات المعالجة بمعدل المناعة في كل من 24 ساعة و 72 ساعة (الشكل 6G ، H). تؤكد هذه أن معدلات المناعة يمكن أن تزيد من علامات التحمل ل moDCs ، على الرغم من تأخير التأثير.
قمنا بتحليل استجابات الخلايا التائية بعد الزراعة المشتركة في اليوم 12. لاحظنا أن moDCs المعالجة بمعدل المناعة لم تزيد من تكاثر الخلايا التائية CD4 + بالنسبة لضوابط moDC غير المعالجة على غرار التقارير المنشورةالأخرى 26 (الشكل 6I). ومن المثير للاهتمام ، أننا لم نلاحظ زيادات كبيرة في مجموعات Treg لأي معدل مناعي معالج moDCs في العينة الأكبر (الشكل 6J). نعتقد أن هذا النقص في الأهمية يرجع إلى التباين الكبير بين عينات المرضى. لا يبدو أن عينتين من المرضى (1 و 2) تزيد من Tregs إلى أي علاج ، بينما أظهر الاثنان الآخران (3 و 4) زيادات مع جميع العلاجات المعدلة للمناعة تقريبا (الشكل 6J). يسلط هذا الضوء على الحاجة إلى إجراء تحليل للمعدلات المناعية مع عينات متعددة من المرضى ويشير إلى أن تكاثر Treg عبر moDCs المعالجة بمعدل المناعة متغير للغاية بين المرضى.

الشكل 1: تخطيطي نظرة عامة تجريبية. يتم عزل الخلايا الوحيدة والخلايا التائية من PBMCs ، والخلايا الوحيدة المتمايزة إلى moDCs ، وتحديها بعوامل معدلة للمناعة لتوليد tolDCs ، ويتم زراعتها بشكل مشترك مع الخلايا التائية. الاختصارات: PBMCs = خلايا الدم المحيطية أحادية النواة. moDCs = الخلايا المتغصنة المشتقة من الخلايا الأحادية ؛ tolDCs = الخلايا المتغصنة ذات التحمل المرضي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
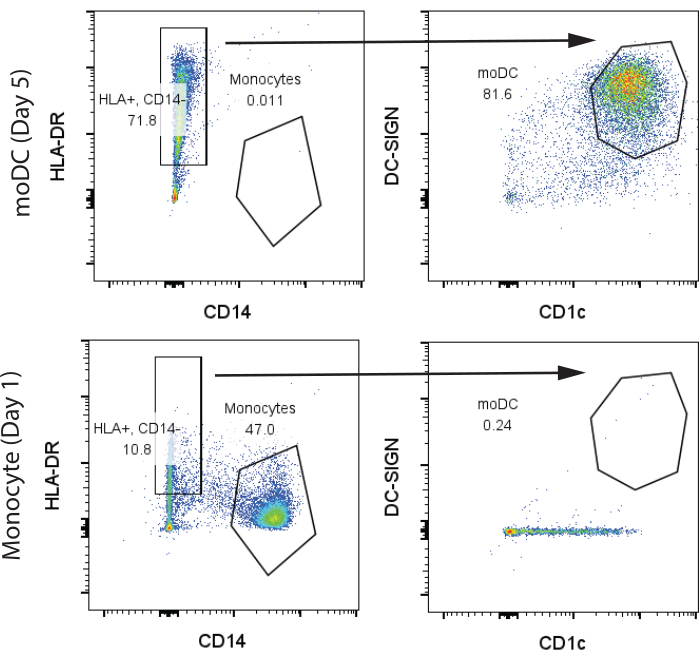
الشكل 2: استراتيجية البوابات التمثيلية لتحديد الخلايا الوحيدة CD14 + و HLA-DR و CD14- و HLA-DR + و CD1c + و DC-SIGN + moDCs. تم تحليل العينات في اليوم 7. الاختصارات: moDC = خلية شجيرية مشتقة من الخلية الأحادية ؛ HLA-DR = مستضد الكريات البيض البشرية-DR ؛ DC-SIGN = ليكتين من النوع C الخاص بالخلية المتغصنة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: تحليل قياس التدفق الخلوي ل moDCs بعد علاج rapa و / أو LPS. في اليوم 6 ، تم تحضين 105 moDCs بمعدلات مناعية لمدة 24 ساعة ، ثم تم غسلها واحتضانها مع أو بدون 0.1 ميكروغرام / مل LPS لمدة 24 ساعة. في اليوم 9 ، تم غسل moDCs وتحليلها عن طريق قياس التدفق الخلوي. (أ) تحديد الخلايا الوحيدة CD14 + و HLA-DR و CD14- و HLA-DR + و CD1c + و DC-SIGN + moDCs. (ب) الرسوم البيانية التمثيلية لإشارة moDC CD86 بعد المعالجة ؛ متوسط شدة التألق ل (C) CD86 و (D) CD40 و (E) PD-L1 و (F) BTLA. كانت العينات في ثلاث نسخ فنية (N = 3) من نفس PBMCs للمريض. تم تحديد الأهمية عن طريق ANOVA أحادي الاتجاه مقارنة بمجموعة UT. * ص < 0.05 ، ** ص < 0.01 ، *** ص < 1 × 10-3 ، ****ص < 1 × 10-4. الاختصارات: PBMCs = خلايا الدم المحيطية أحادية النواة. moDCs = الخلايا المتغصنة المشتقة من الخلايا الأحادية ؛ HLA-DR = مستضد الكريات البيض البشرية-DR ؛ رابا = رابامايسين ؛ LPS = عديدات السكاريد الدهني. MFI = متوسط شدة التألق ؛ BTLA = مخفف الخلايا الليمفاوية B و T; PD-L1 = ترابط موت الخلية المبرمج 1 ؛ UT = غير معالج ؛ LPS moDC= moDCs المعالجة ب 0.1 ميكروغرام / مل LPS في اليوم 8 ؛ Rapa moDC = moDCs المعالجة ب 10 نانوغرام / مل رابا في اليوم 7 ثم تغسل في اليوم 8 ؛ Rapa + LPS moDCs = moDCs المعالجة ب 10 نانوغرام / مل رابا في اليوم 7 ثم غسلها ومعالجتها 0.1 ميكروغرام / مل LPS في اليوم 8. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
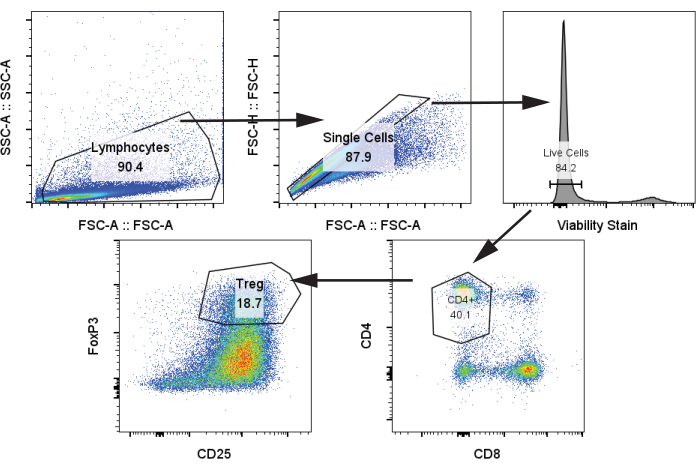
الشكل 4: استراتيجية البوابات التمثيلية لتحديد CD4 + و CD25 + و FoxP3 + Tregs. تم تحليل العينة من الخلايا التائية المذابة في اليوم 12. المختصرات: SSC-A = منطقة ذروة التشتت الجانبية. FSC-A = منطقة ذروة الانتثار الأمامية؛ Tregs = الخلايا التائية التنظيمية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: تحليل الخلايا التائية التمثيلية للزراعة المشتركة للخلايا التائية moDC-T في اليوم 12. (أ) مخططات التدفق التمثيلية CD25 مقابل FoxP3 لخلايا CD4 + T الحية والمفردة لتحديد Tregs. يحتوي العمود الأيسر على عناصر تحكم: الخلايا التائية فقط (أعلى) والخلايا التائية المحفزة CD3/CD28 (أسفل). العمود الأوسط: moDCs بدون علاج رابا ، العمود الأيمن: moDcs مع علاج رابا. بالنسبة للعمودين الأوسط والأيمن ، فإن الصف العلوي عبارة عن عينات بدون LPS والجزء السفلي مع معالجة LPS. (ب) بوابة تمثيلية لتكاثر الخلايا التائية. تم رسم الخلايا التائية CD4 + (يسار) أو CD8 + (يمين) ضد بقعة التكاثر. يشار إلى القمم ل 0 أو 1 أو 2 أو 3 انقسامات خلايا. يتم تصنيف الرسوم البيانية بنوع علاج moDC. الاختصارات: رابا = رابامايسين ؛ LPS = عديدات السكاريد الدهني. moDCs = الخلايا المتغصنة المشتقة من الخلايا الأحادية ؛ الخلايا التائية فقط = الخلايا التائية التي لا تحتوي على moDCs بدون علاج CD3 / CD28 ؛ UT = غير معالج ؛ LPS moDC = moDCs المعالجة 0.1 ميكروغرام / مل LPS في اليوم 8 ؛ Rapa moDC = moDCs المعالجة ب 10 نانوغرام / مل رابا في اليوم 7 ثم غسلها في اليوم 8. لاحظ أن علاج الرابا يزيد من الكميات النسبية للخلايا مع 0 قسم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: تحليل عينات متعددة من الخلايا moDC / T مع معدلات منيعة إضافية. عولجت MoDCs ب 1 ميكرومتر ديكساميثازون ، 10 نانوغرام / مل IL-10 ، 1 ميكروغرام / مل عديد السكاريد الدهني ، أو 1 نانومتر فيتامين D3 بالإضافة إلى 10 نانوغرام / مل رابا كمعدلات مناعية معطاة في الخطوة 2.1.4 مع حذف التحفيز المناعي. قمنا أيضا بتضمين عينة تم إعطاؤها Dex في الخطوة 2.1.4 وعولجت ب 0.1 ميكروغرام / مل LPS في الخطوة 2.3.3 في اليوم 8 (Dex + LPS). (أ ، -د) تحليل السيتوكين ل moDCs. تم اختبار المواد الطرافية ل IL-10 إما (A) 24 ساعة أو (B) 72 ساعة بعد الخطوة 2.3.3 أو تم اختبارها بحثا عن TNFα ل C) 24 ساعة أو (D) 72 ساعة بعد الخطوة 2.3.3 باستخدام مجموعات ELISA التجارية. ن = 5. (E-H) تحليل علامات سطح moDC. وبالمثل ، تم تحليل moDCs عن طريق قياس التدفق الخلوي ل PD-L1 عند (E) 24 ساعة أو (F) 72 ساعة أو ل CD86 عند (G) 24 ساعة أو (H) 72 ساعة. (ط) تحليل تكاثر الخلايا التائية. تم تحليل الخلايا التائية CD4 + في اليوم 12 لتكاثر الخلايا التائية وتم حساب عدد انقسامات الخلايا لكل 100 خلية تائية. تم تحضين العينات بنسبة 1: 5 moDC: T ، N = 4. (ه) تحليل Treg. تم تحليل MoDCs المتمايزة عن خمسة مرضى مختلفين بطريقة مماثلة كما في الشكل 5. اليسار ، moDCs غير المعالجة. على اليمين ، moDCs المعالجة ب 10 نانوغرام / مل رابا. يمثل كل خط ملون عينة مختلفة من المريض. تم تحديد الأهمية من خلال طريقة واحدة ANOVA. * ص < 0.05 ، ** ص < 0.01.الاختصارات: rapa = rapamycin. LPS = عديدات السكاريد الدهني. TNFα = عامل نخر الورم-ألفا. moDCs = الخلايا المتغصنة المشتقة من الخلايا الأحادية ؛ UT = غير معالج ؛ LPS moDC = moDCs المعالجة 0.1 ميكروغرام / مل LPS ؛ Rapa moDC = moDCs المعالجة ب 10 نانوغرام / مل رابا ، Dex = moDCs المعالجة ب 1 ميكرومتر ديكساميثازون ، IL-10 = moDCs المعالجة ب 10 نانوغرام / مل IL-10 ، VD3 = moDCs المعالجة ب 1 نانومتر فيتامين D3 ، Dex + LPS = moDCs المعالجة ب 1 ميكرومتر ديكساميثازون في اليوم 7 ثم 0.1 ميكروغرام / مل LPS في اليوم 8. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| وسيط ثقافة moDC | حل تلطيخ التدفق | وسط ثقافة الخلايا التائية | خلية تائية تجميد متوسطة | |
| القاعدة الإعلامية | RPMI 1640 | HBSS | RPMI 1640 | وسائط ثقافة الخلايا التائية |
| العنصر 1 | 10٪ FBS معطل بالحرارة (HI-FBS) | 1٪ BSA مع / v | 10٪ FBS معطل بالحرارة (HI-FBS) | 10٪ DMSO |
| العنصر 2 | 1x البنسلين الستربتومايسين | 0.1 ملي EDTA | 1x البنسلين الستربتومايسين | غير متاح |
| العنصر 3 | غير متاح | غير متاح | 1 ملي مولار هيبس | غير متاح |
| العنصر 4 | غير متاح | غير متاح | 1 × أحماض أمينية غير أساسية | غير متاح |
| المكون 5 | غير متاح | غير متاح | 50 ميكرومتر β ميركابتو إيثانول | غير متاح |
الجدول 1: وصف كواشف زراعة الخلايا
| خشب | جسم | فلوروفور | التخفيف | قناة |
| التحقق | HLA-DR | أليكسا فلور 488 | 1:500 | أزرق 1 |
| CD14 | PE | 1:500 | أزرق 2 | |
| علامة التيار المستمر | بيركب - سي 5.5 | 1:500 | أزرق 3 | |
| CD1c | PE-Cy7 | 1:500 | أزرق 4 | |
| سي دي 40 | جنود الدربان | 1:500 | أحمر 1 | |
| تحمل | سي دي 86 | فيتك | 1:500 | أزرق 1 |
| PD-L1 | PE | 1:5000 | أزرق 2 | |
| علامة التيار المستمر | بيركب - سي 5.5 | 1:500 | أزرق 3 | |
| CD1c | PE-Cy7 | 1:500 | أزرق 4 | |
| BTLA | جنود الدربان | 1:250 | أحمر 1 | |
| سي دي 40 | إيفلور APC 780 | 1:500 | أحمر 3 | |
| تريج | CD4 | أليكسا فلور 488 | 1:500 | أزرق 1 |
| CD8 | PE-Cy7 | 1:500 | أزرق 4 | |
| سي دي 25 | جنود الدربان | 1:500 | أحمر 1 | |
| T الانتشار | CD4 | أليكسا فلور 488 | 1:500 | أزرق 1 |
| سي دي 69 | PE | 1:500 | أزرق 2 | |
| CD8 | PE-Cy7 | 1:500 | أزرق 4 | |
| * يتم تخفيف جميع الأجسام المضادة في محلول البقع المتدفقة | ||||
الجدول 2: وصف لوحات الأجسام المضادة لقياس التدفق الخلوي
Discussion
نصف هنا طريقة موثوقة ومتعددة الاستخدامات لتقييم وظائف العوامل المعدلة للمناعة لحث tolDCs من moDCs والتحقق من صحة وظائفها لتوليد Tregs من الخلايا التائية الذاتية خارج الجسم الحي. هناك العديد من الخطوات الحاسمة في هذا البروتوكول. أولا ، الخلايا الوحيدة هي خلايا حساسة معروفة ويجب الحصول عليها من PBMCs الطازجة وليست المجمدة مسبقا للحصول على أفضل النتائج. يجب عزل الخلايا الوحيدة في أسرع وقت ممكن ووضعها في كوكتيل التمايز. عادة ما يكون ضعف إنتاج الخلايا الوحيدة أو ارتفاع معدلات موت الخلايا الوحيدة في أول 24 ساعة ناتجة عن دورات التجميد / الذوبان أو فترات طويلة بين عزل PBMCs والخلايا الوحيدة. ثانيا ، يجب أن تكون السيتوكينات المستخدمة لتمايز moDCs ووسائط زراعة الخلايا التائية من مصدر عالي الجودة. عادة ما يكون التمايز الضعيف بين moDCs بسبب الجودة الرديئة أو التركيزات غير الصحيحة للسيتوكينات. ثالثا ، نوصي بتجميد الخلايا التائية بين اليوم الأول واليوم السابع وعدم الاحتفاظ بها في المزرعة للحفاظ على نمطها الظاهري الساذج وغير المحفز. رابعا ، إذا كان من المفيد السماح ل moDCs المعالجة بالراحة لمدة تصل إلى 72 ساعة للسماح بالزيادات في علامات التحمل مثل PD-L1 و IL-10 كما هو موضح في الشكل 6. أخيرا ، كما هو موضح في بياناتنا ، هناك تباين كبير في قدرة المريض على توليد Treg ، لذلك يجب تشغيل كل عنصر تحكم مع كل عينة مريض لاستخلاص النتائج. نوصي باختبار عينات متعددة من المرضى.
في نتائجنا التمثيلية ، اخترنا تصميما تجريبيا مقيدا إلى حد ما لإظهار التسامح بشريط مرتفع. اخترنا تركيزا منخفضا إلى حد ما من رابا (10 نانوغرام / مل) ، تم تحضنه فقط مع moDCs المتمايزة بالفعل لمدة 24 ساعة ثم تم تحضينها في نسبة الخلايا التائية 1: 5 moDC: T لمدة 72 ساعة مع تحفيز CD3 / CD28 غير النوعي. هذا البروتوكول متعدد الاستخدامات للغاية حيث يمكن تغيير أي من الحالات التالية بسهولة: تركيز المعدل المناعي ، ووقت حضانة المعدل المناعي ، سواء حدث الحضانة بالتزامن مع تمايز moDC أو بشكل منفصل ، ونسبة الزراعة المشتركة للخلايا التائية moDC: ، ووقت حضانة الزراعة المشتركة ، والتحفيز المشترك للخلايا التائية. كل هذه العوامل يمكن أن تغير مدى سهولة علاج moDC في تحفيز توليد Treg. وتجدر الإشارة إلى استخدام تحفيز CD3 / CD28 غير المحدد للحث على تكاثر الخلايا التائية. يمكن استبدال هذا بسهولة بمستضد ذي أهمية - مستضد تحكم مثل تجمعات الببتيد CEFT مع عينات المرضى الأصحاء أو المستضدات الذاتية مثل الأنسولين مع عينات مرضى السكري من النوع1 27،28. سيوفر هذا بيانات تحمل خاصة بالمستضد ، والتي من المحتمل أن تكون مختلفة عن التسامح بوساطة Treg غير المحدد.
على الرغم من تعدد الاستخدامات ، إلا أن هذا البروتوكول له بعض القيود. وهي تقتصر على عدد قليل فقط من علامات tolDC و CD86 و CD40 و PD-L1 و BTLA. هذه علامات مقبولة بشكل عام وقيود على عدد القنوات المتاحة في مقياس التدفق الخلوي في المختبر. يمكن أيضا اختيار علامات أخرى مثل ILT-3 و ILT-4 أو غيرها25. لا يقيم هذا البروتوكول أيضا أنواعا أخرى من المجموعات الفرعية للخلايا التائية المثبطة ، مثل الخلايا التائية التنظيمية من النوع 1 (Tr1) ، والتي يمكن أن تظهر أنماطا ظاهرية وقائية قوية في الجسم الحي29. ومع ذلك ، فإننا نؤكد أن هذا البروتوكول يقيم وظائف DCs لتوليد FoxP3 + CD25 + Tregs الكلاسيكية ، وهو ما يكفي للفحص الأولي للمركبات المناعية الجديدة وتقييم قدرة تحمل التيار المستمر
جانب آخر مثير للاهتمام لتقييم moDC البشري هو تباين المريض والحد المحدود من IL-10 و PD-L1 و BLTA ، والأهم من ذلك ، استجابة Treg لمعدلات المناعة الموضحة في نتائجنا التمثيلية ، لا سيما بالنسبة إلى rapa. تظهر الأدبيات نتائج متضاربة. شوهدت نتائج مماثلة لهذه الورقة في كل من الفئران المعالجة بالرابا والتيار المستمر البشري ، مما يدل على انخفاض في علامات نضج التيار المستمر (CD80 / CD86 / CD40) ومنع إطلاق IL-2 من الخلايا التائية عند عدم تحفيزها على وجه التحديد ، ولكن لا يوجد موت الخلايا التائية أو جيل Treg26،30. ومع ذلك ، تظهر دراسات أخرى على كل من البشر والفئران أن DCs المعالجة بالرابا خارج الجسم الحي تظهر مستويات عالية من جيل Treg25. Rapa هو هدف ميكانيكي لمثبط الرابامايسين (mTOR) ، وهو بروتين كيناز في مسار إشارات PI3K / AKT / mTOR له العديد من الوظائف الخلوية الحاسمة مثل نمو الخلايا والانتشار والبقاءعلى قيد الحياة 31. غالبا ما يستخدم رابا كدواء مضاد للرفض للزرع وله فائدة سريرية راسخة في منع الاستجابات المناعية. ومع ذلك ، على وجه التحديد لاستخدامه كعامل تحريض tolDC ، يمكن أن يكون ل rapa فعالية متفاوتة من مريض لآخر.
هذا يسلط الضوء على الحاجة إلى إجراء فحص صارم في عوامل تحريض tolDC ضد مجموعات أوسع من المرضى وتحديد مركبات معدلة للمناعة جديدة. يستخدم عدد هائل من الدراسات السريرية على tolDCs البشرية إما رابا أو IL-10 أو ديكساميثازون أو فيتامين D3 كمعدلاتمناعية 32. هذا يترك مساحة كيميائية واسعة غير مستكشفة. نقدم هذا الاختبار كأداة استقصائية لتقييم إمكانات تحريض tolDC لمعدلات المناعة الجديدة وتقييم قدرتها على توليد tolDCs من DCs داخلية. هذا البروتوكول بسيط ومتعدد الاستخدامات ولا يتطلب سوى مقياس التدفق الخلوي ، ويمكن تكييفه لوظائف عالية الإنتاجية.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
نود أن نشكر مركز المناعة البشرية (HIC) بجامعة بنسلفانيا على توفير PBMCs بشرية جديدة من المتبرعين. يتم دعم التحالف الدولي للموئل جزئيا من قبل AI045008 المعاهد الوطنية للصحة P30 و P30 CA016520.
Materials
| Name | Company | Catalog Number | Comments |
| 0.1-10 µL Filtered Pipet tips | VWR | 76322-158 | General Cell Culture |
| 1.5 mL Centrifuge Tube | VWR | 77508-358 | General Cell Culture |
| 10 mL Serological Pipets | VWR | 414004-267 | General Cell Culture |
| 100-1000 µL Filtered Pipet tips | VWR | 76322-164 | General Cell Culture |
| 15 mL Conical Tube | VWR | 77508-212 | General Cell Culture |
| 20-200 µL Filtered Pipet tips | VWR | 76322-160 | General Cell Culture |
| 2-Mercaptoethanol | MP Biomedical | 194834 | T Cell Culture |
| 50 mL Conical Tube | VWR | 21008-736 | General Cell Culture |
| 60 x 15 mm Dish, Nunclon Delta | Thermo Fischer | 150326 | General Cell Culture |
| 96 Well Conical (V) Bottom Plate, Non-Treated Surface | Thermo Fischer | 277143 | General Cell Culture |
| 96 well Flat Bottom Plate | Thermo Fischer | 161093 | General Cell Culture |
| APC/Cyanine7 anti-human CD272 (BTLA) Antibody | Biolegend | 344518 | Flow Cytometry |
| Attune NxT (Red/Blue Laser, 7 Channel) | Thermo Fischer | A24863 | Flow Cytometry |
| BSA | Thermo Fischer | 15260-037 | General Cell Culture |
| CD14 Monoclonal Antibody (61D3), PE | Thermo Fischer | 12-0149-42 | Flow Cytometry |
| CD1c Monoclonal Antibody (L161), PE-Cyanine7 | Thermo Fischer | 25-0015-42 | Flow Cytometry |
| CD209 (DC-SIGN) Monoclonal Antibody (eB-h209), PerCP-Cyanine5.5 | Thermo Fischer | 45-2099-42 | Flow Cytometry |
| CD25 Monoclonal Antibody (CD25-4E3), APC | Thermo Fischer | 17-0257-42 | Flow Cytometry |
| CD274 (PD-L1, B7-H1) Monoclonal Antibody (MIH1), PE | Thermo Fischer | 12-5983-42 | Flow Cytometry |
| CD4 Monoclonal Antibody (RPA-T4), Alexa Fluor 488 | Thermo Fischer | 53-0049-42 | Flow Cytometry |
| CD40 Monoclonal Antibody (5C3), APC | Thermo Fischer | 17-0409-42 | Flow Cytometry |
| CD40 Monoclonal Antibody (5C3), APC-eFluor 780 | Thermo Fischer | 47-0409-42 | Flow Cytometry |
| CD69 Monoclonal Antibody (FN50), PE | Thermo Fischer | MA1-10276 | Flow Cytometry |
| CD86 Monoclonal Antibody (BU63), FITC | Thermo Fischer | MHCD8601 | Flow Cytometry |
| CD8a Monoclonal Antibody (RPA-T8), PE-Cyanine7 | Thermo Fischer | 25-0088-42 | Flow Cytometry |
| Conical Bottom (V-well) 96 Well Plate | Thermo Fischer | 2605 | Flow Cytometry |
| Cryogenic Vials, 2 mL | Thermo Fischer | 430488 | T Cell Culture |
| Dimethylsulfoxide (DMSO), Sequencing Grade | Thermo Fischer | 20688 | General Cell Culture |
| DPBS | Thermo Fischer | 14200166 | General Cell Culture |
| EasySep Human Monocyte Isolation Kit | Stem Cell Technologies | 19359 | Cell Separation |
| EasySep Human T Cell Isolation Kit | Stem Cell Technologies | 17951 | Cell Separation |
| EasySep Magnet | Stem Cell Technologies | 18000 | Cell Separation |
| EDTA | Thermo Fischer | AIM9260G | General Cell Culture |
| Falcon Round-Bottom Polystyrene Tubes, 5 mL | Stem Cell Technologies | 38025 | Cell Separation |
| Fc Receptor Binding Inhibitor Polyclonal Antibody | Thermo Fischer | 14-9161-73 | Flow Cytometry |
| Fetal Bovine Serum | Thermo Fischer | A5670701 | General Cell Culture |
| Fixable Viability Dye eFluor 780 | Thermo Fischer | 65-0865-18 | Flow Cytometry |
| Foxp3 / Transcription Factor Staining Buffer Set | Thermo Fischer | 00-5523-00 | Flow Cytometry |
| FOXP3 Monoclonal Antibody (PCH101), PE-Cyanine5.5 | Thermo Fischer | 35-4776-42 | Flow Cytometry |
| HBSS | Thermo Fischer | 14170-112 | General Cell Culture |
| Heat Inactivated Fetal Bovine Serum | Thermo Fischer | A5670801 | General Cell Culture |
| HEPES (1 M) | Thermo Fischer | 15630106 | moDC Cell Culture |
| HLA-DR Monoclonal Antibody (L243), Alexa Fluor 488 | Thermo Fischer | A51009 | Flow Cytometry |
| Human CD3/CD28/CD2 T Cell Activator | StemCell Technologies | 10970 | T Cell Culture |
| Human GM-CSF Recombinant Protein | Thermo Fischer | 300-03 | moDC Cell Culture |
| Human IL-10 ELISA Kit, High Sensitivity | Thermo Fischer | BMS215-2HS | ELISA |
| Human IL-4, Animal-Free Recombinant Protein | Thermo Fischer | AF-200-04 | moDC Cell Culture |
| Human PBMC (Freshly Isolated) | UPenn HIC | N/A | Cells |
| Human TNF alpha ELISA Kit | Thermo Fischer | BMS223-4 | ELISA |
| Light Microscope (DMi1) | Lucia | 391240 | General Cell Culture |
| Lipopolysaccaride (LPS) | Invivogen | tlrl-eblps | moDC Cell Culture |
| LIVE/DEAD Fixable Near-IR Dead Cell Stain Kit | Thermo Fischer | L34975 | Flow Cytometry |
| MEM Non-Essential Amino Acids Solution (100x) | Thermo Fischer | 11140050 | T Cell Culture |
| Penicillin-Streptomycin (100x) | Thermo Fischer | 15140122 | General Cell Culture |
| Pipette Controller | VWR | 77575-370 | General Cell Culture |
| Rapamycin, 98+% | Thermo Fischer | J62473.MF | moDC Cell Culture |
| RPMI 1640 with Glutamax | Thermo Fischer | 61870-036 | General Cell Culture |
| Separation Buffer | Stem Cell Technologies | 20144 | Cell Separation |
| T Cell Stimulation Cocktail (500x) | Thermo Fischer | 00-4970-93 | T Cell Culture |
| UltraComp eBead Plus Compensation Beads | Thermo Fischer | 01-3333-41 | Flow Cytometry |
| Variable Pipette Set | Fischer Scientific | 05-403-152 | General Cell Culture |
References
- Banchereau, J., et al. Immunobiology of dendritic cells. Annu Rev Immunol. 18 (1), 767-811 (2000).
- Blander, J. M., Medzhitov, R. Toll-dependent selection of microbial antigens for presentation by dendritic cells. Nature. 440 (7085), 808-812 (2006).
- Anderson, A. E., et al. LPS activation is required for migratory activity and antigen presentation by tolerogenic dendritic cells. J Leukoc Bio. 85 (2), 243-250 (2009).
- Iberg, C. A., Hawiger, D. Natural and induced tolerogenic dendritic cells. J Immunol. 204 (4), 733-744 (2020).
- Ness, S., Lin, S., Gordon, J. R. Regulatory dendritic cells, T cell tolerance, and dendritic cell therapy for immunologic disease. Front Immunol. 12, 633436 (2021).
- Ali, S., et al. Sources of type I interferons in infectious immunity: Plasmacytoid dendritic cells not always in the driver's seat. Front Immunol. 10, 778 (2019).
- Fossum, E., et al. Targeting antigens to different receptors on conventional type 1 dendritic cells impacts the immune response. J Immunol. 205 (3), 661-673 (2020).
- Kedl, R. M., et al. Migratory dendritic cells acquire and present lymphatic endothelial cell-archived antigens during lymph node contraction. Nat Comm. 8 (1), 2034 (2017).
- Chow, K. V., Sutherland, R. M., Zhan, Y., Lew, A. M. Heterogeneity, functional specialization and differentiation of monocyte-derived dendritic cells. Immun Cell Biol. 95 (3), 244-251 (2017).
- Johnson, R. K., Overlee, B. L., Sagen, J. A., Howe, C. L. Peripheral blood mononuclear cell phenotype and function are maintained after overnight shipping of whole blood. Sci Rep. 12 (1), 19920 (2022).
- Boks, M. A., et al. IL-10-generated tolerogenic dendritic cells are optimal for functional regulatory T cell induction - A comparative study of human clinical-applicable DC. Clinl Immunol. 142 (3), 332-342 (2012).
- Navarro-Barriuso, J., et al. Vitamin D3-induced tolerogenic dendritic cells modulate the transcriptomic profile of T CD4+ cells towards a functional hyporesponsiveness. Front Immunol. 11, 599623 (2021).
- Moorman, C. D., Sohn, S. J., Phee, H. Emerging therapeutics for immune tolerance: Tolerogenic vaccines T cell therapy, and IL-2 therapy. Front Immunol. 12, 657768 (2021).
- Kenison, J. E., et al. Tolerogenic nanoparticles suppress central nervous system inflammation. Proc Natl Acad Sci USA. 117 (50), 32017-32028 (2020).
- Neshat, S. Y., et al. Improvement of islet engrafts via Treg induction using immunomodulating polymeric tolerogenic microparticles. ACS Biomater Sci Eng. 9 (6), 3522-3534 (2023).
- Deak, P., Knight, R., Esser-Kahn, A. Robust tolerogenic dendritic cells via push/pull pairing of toll-like-receptor agonists and immunomodulators reduces EAE. Biomaterials. 286, 121571 (2022).
- Møller, S. H., Wang, L., Ho, P. -. C. Metabolic programming in dendritic cells tailors immune responses and homeostasis. Cell Mol Immunoly. 19 (3), 370-383 (2022).
- Adamik, J., et al. Distinct metabolic states guide maturation of inflammatory and tolerogenic dendritic cells. Nat Comm. 13 (1), 5184 (2022).
- Hals, I. K., et al. Investigating optimal β-cell-preserving treatment in latent autoimmune diabetes in adults: Results from a 21-month randomized trial. Diabetes Obes Metab. 21 (10), 2219-2227 (2019).
- Gammon, J. M., et al. Engineering the lymph node environment promotes antigen-specific efficacy in type 1 diabetes and islet transplantation. Nat Comm. 14 (1), 681 (2023).
- Sim, W. J., Malinarich, F., Fairhurst, A. -. M., Connolly, J. E. Generation of immature, mature and tolerogenic dendritic cells with differing metabolic phenotypes. J Vis Exp. (112), e54128 (2016).
- Jia, S., Kim, J., Esser-Kahn, A. P., Deak, P. High-throughput screening identification of novel immunomodulatory combinations for the generation of tolerogenic dendritic cells. Front Med. 10, 1298424 (2024).
- Dinh, B., et al. Isolation and cryopreservation of highly viable human peripheral blood mononuclear cells from whole blood: A guide for beginners. J Vis Exp. (212), e66794 (2024).
- Akkaya, B., et al. Regulatory T cells mediate specific suppression by depleting peptide-MHC class II from dendritic cells. Nat Immunol. 20 (2), 218-231 (2019).
- Stallone, G., et al. mTOR inhibitors effects on regulatory T cells and on dendritic cells. J Trans Med. 14 (1), 152 (2016).
- Dahlqvist, G., et al. Modulatory effect of rapamycin and tacrolimus on monocyte-derived dendritic cells phenotype and function. Immunobiology. 226 (1), 152031 (2021).
- Cimen Bozkus, C., Blazquez, A. B., Enokida, T., Bhardwaj, N. A T-cell-based immunogenicity protocol for evaluating human antigen-specific responses. STAR Protoc. 2 (3), 100758 (2021).
- Nakayama, M., Michels, A. W. Determining antigen specificity of human islet infiltrating T cells in type 1 diabetes. Front Immunol. 10, 365 (2019).
- Gregori, S., et al. Differentiation of type 1 T regulatory cells (Tr1) by tolerogenic DC-10 requires the IL-10-dependent ILT4/HLA-G pathway. Blood. 116 (6), 935-944 (2010).
- Taner, T., Hackstein, H., Wang, Z., Morelli, A. E., Thomson, A. W. Rapamycin-treated, alloantigen-pulsed host dendritic cells induce Ag-specific T cell regulation and prolong graft survival. Am J Transpl. 5 (2), 228-236 (2005).
- Baroja-Mazo, A., Revilla-Nuin, B., Ramírez, P., Pons, J. A. Immunosuppressive potency of mechanistic target of rapamycin inhibitors in solid-organ transplantation. World J Transplant. 6 (1), 183-192 (2016).
- Phillips, B. E., Garciafigueroa, Y., Trucco, M., Giannoukakis, N. Clinical tolerogenic dendritic cells: Exploring therapeutic impact on human autoimmune disease. Front Immunol. 8, 1279 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved