Method Article
유세포 분석에 의한 Juvenile Gilthead Seabream Head Kidney Leukocytes 의 분리, 고정 및 특성화
요약
이 원고는 길트헤드 도미의 머리-신장에서 추출한 백혈구의 분리 및 고정과 유세포 분석을 통한 생존력 평가를 설명합니다. 이 작업은 프로토콜의 표준화에 기여하고 샘플 품질을 손상시키지 않으면서 더 많은 수의 샘플을 처리하는 데 활용되어 어류 면역학 지식의 발전을 촉진합니다.
초록
면역은 유기체의 생리적 조절에 결정적인 역할을 하며, 병원체와 환경 스트레스 요인에 대한 1차 방어 역할을 합니다. 면역 세포의 분리 및 분석은 외부 압력에 대한 면역 반응에 대한 중요한 통찰력을 제공합니다. 그러나 해양 어류와 같이 연구가 덜 된 종에 대한 조화로운 프로토콜이 부족하기 때문에 데이터 해석과 종별 면역 반응에 대한 철저한 이해를 방해하는 기술 및 분석 문제가 발생하는 경우가 많습니다. 이 연구는 어린 귀도미(Sparus aurata)의 머리 신장(teleost fish의 주요 조혈 기관)에서 백혈구의 생존 능력을 특성화하고 결정하기 위해 최적화된 유세포 분석 기반 분석 절차를 설정하는 것을 목표로 했습니다. 이 절차는 Hanks의 균형 염 용액을 사용한 균질화 공정을 통해 백혈구를 분리하는 것으로 시작되었으며, 효율적인 후속 유세포 분석에 필요한 적혈구 오염을 최소화하면서 백혈구의 높은 회수율을 보장하기 위해 최적화된 Percoll 밀도 구배 원심분리 방법이 이어졌습니다. 또한 세포 반응성 염료(LIVE/DEAD Fixable Dead Cell Stain Kit)를 사용하는 새로운 기술을 사용하여 형광 염색 패턴을 기반으로 생존 세포와 사멸 세포를 구별했습니다. 3.7% 포름알데히드로 고정이 이루어졌으며 세포 형태, 생존력 및 염색 효율이 보존되었습니다. 유세포 분석 분석은 3가지 우세한 백혈구 집단인 림프구, 단핵구, 과립구를 성공적으로 식별했습니다. 이 방법을 통해 생존 능력을 시험할 수 있었을 뿐만 아니라 세포 유형을 정확하게 구별할 수 있었습니다. 유세포 분석 프로토콜의 개선은 면역 세포 분석의 정확성과 효율성을 높임으로써 어류 면역학의 한 걸음을 의미합니다. 또한 이 프로토콜은 추후 분석을 위해 세포를 고정할 수 있도록 함으로써 면역 평가에 필요한 시간과 노력을 크게 줄여 다양한 연구 분야의 연구 및 실제 응용 모두에 유용한 도구가 됩니다.
서문
면역은 유기체의 생리적 조절에 중심적인 역할을 하며, 다양한 병원체와 환경적 스트레스 요인에 대한 일차적인 방어 역할을 합니다1. 다른 척추동물과 마찬가지로 물고기는 전반적인 건강과 웰빙에 필수적인 복잡하고 역동적이며 조정된 면역 체계를 가지고 있습니다1.
텔레오스트 어류는 선천면역계와 후천면역계를 모두 가지고 있으며, 이 면역체계는 해로운 침입자를 탐지하고, 대응하고, 무력화하는 기능을 동시에 합니다2. 선천면역체계(innatureimmune system)는 1차 방어선 역할을 하여 병원체에 대한 즉각적이고 비특이적인 반응을 보이며2, 적응면역체계(adaptive immune system)는 시간이 지남에 따라 발달하여 물고기가 특정 병원체를 인식하고 면역기억을 형성할 수 있도록 보다 전문화된 반응을 제공합니다3. 어류의 면역 체계는 면역 방어를 지원하고 전반적인 건강을 유지하기 위해 전문화된 1차 림프 기관(예: 흉선 및 두부 신장)과 2차 림프 기관(예: 비장 및 점막 관련 림프 조직(MALT))에 의존합니다4. 두부 신장(head kidney)은 텔레오스트 어류(teleost fish)의 주요 조혈 기관으로, 백혈구를 포함한 면역 세포의 발달과 성숙에 중요한 역할을 한다5.
최근 몇 년 동안 여러 어종의 면역 반응을 연구하는 데 상당한 진전이 이루어졌습니다2. 초점의 핵심 영역 중 하나는 백혈구 개체군과 그들의 활동을 이해하는 것입니다. 백혈구라고도 하는 백혈구는 일반적으로 단핵구, 림프구, 과립구로 분류되며 어류의 면역 방어에 중요한 역할을 합니다. 그들은 식세포 세포를 가지고 있는데, 이 세포는 병원체를 집어삼키고 파괴하며 살균 활성 산소 종을 방출하여 침입하는 미생물을 제거하는 데 기여합니다6. 백혈구는 또한 염증 과정에 관여하여 조직 복구를 촉진하는 동시에 감염을 격리하고 근절하는 데 도움이 됩니다6. 백혈구 개체군의 풍부함과 활동은 동물의 건강과 질병에 대한 면역 상태를 나타내는 중요한 지표이다 7,8.
일부 연구에서는 불리한 환경 조건과 같은 스트레스 요인이 적혈구의 수와 형태 및 순환 백혈구의 구성을 변화시킬 수 있음을 입증했습니다 9,10. 예를 들어, Franke et al. (2024)가 검토한 바와 같이, 환경 스트레스 요인은 어류의 면역력을 손상시키고, 질병 감수성을 증가시키고, 특정 병원체의 감염성을 향상시켜 궁극적으로 질병 진행을 가속화할 수 있기 때문에 기후 변화 시나리오에서 물고기의 면역 체계를 연구하는 것이 중요합니다11. 또한, 어류 면역에 대한 이해는 기초 생물학 연구를 진전시키는 것뿐만 아니라 양식 산업과 같은 사회의 다양한 부문을 지원하는 데 필수적입니다. 양식업이 전 세계적으로 계속 확장됨에 따라 양식 어종의 건강과 복지를 보장하는 것이 점점 더 중요해지고 있습니다. 그러나 어류 복지는 여전히 비교적 새로운 연구 분야이며, 양식 어류의 면역 반응은 여전히 철저하고 표준화된 평가가 필요합니다. 면역 반응 연구의 우선 순위를 정하는 것이 가장 중요한데, 획득한 정보는 농장 동물의 복지와 회복력을 향상시키는 효과적이고 맞춤화된 접근 방식을 통해 양식업의 지속 가능성과 생산성을 향상시킬 수 있기 때문입니다.
백혈구 정량화 및 식별은 일반적으로 Bürker, Neubauer 또는 Thoma 혈구계를 사용한 수동 계수와 같은 혈액학적 방법과 염색된 혈액 도말 7,10을 사용하여 수행됩니다. 혈액 세포의 시각화 및 분화를 돕기 위해 Wright, May-Grünwald-Giemsa 및 Hemacolor와 같은 염색 키트가 종종 사용됩니다 7,12. 그러나 이러한 수동 세포 계수 기술은 지루하고 시간이 많이 걸리며 인적 오류가 발생하기 쉽습니다 8,10. 오류의 일반적인 원인으로는 혈액의 부적절한 혼합 또는 희석, 염색 문제, 혈구계 챔버의 잘못된 로딩 등이 있으며, 이 모든 것들은 부정확한 세포 수로 이어질 수 있습니다12. 또한 수동 혈액 분석에는 결과의 신뢰성과 재현성을 보장하기 위해 높은 수준의 전문 지식과 경험이 필요합니다7. 정확하고 효율적인 진단 도구에 대한 수요가 증가함에 따라 어류 개체군의 면역 상태에 대한 심층적인 이해를 제공하는 혁신적인 방법의 개발은 이 분야를 발전시키는 데 점점 더 중요한 단계가 되고 있습니다.
유세포분석은 이러한 맥락에서 강력한 도구로 부상했으며, 백혈구 집단 및 세포 생존율을 분석하기 위한 고처리량 정량적 접근 방식을 제공합니다8. 이 현대적인 진단 기술은 놀라운 정밀도로 혼합된 집단에서 개별 세포를 신속하게 검출, 계수 및 특성화할 수 있습니다13. 또한 유세포 분석은 표현형 및 기능적 특성화를 위한 동시 다중 파라미터 측정을 가능하게 합니다. 인간 임상 환경 및 수의학에서 널리 사용되지만 어류 백혈구 연구에서의 적용은 매우 제한적입니다8. 다양한 어종 1,6,8,13,14,15,16,17에 대한 일부 연구가 수행되었지만 몇 가지 중요한 과제는 여전히 해결되어야 합니다. 이러한 분석의 주요 과제 중 하나는 말초 혈액 또는 두부 신장과 같은 림프 조직에서 추출한 살아있는 백혈구의 현탁액을 얻어야 한다는 것입니다1. 백혈구의 분리는 teleost fish의 독특한 특성, 즉 핵이 있는 적혈구의 존재로 인해 어려운 경우가 많습니다. 적혈구에 대한 의도하지 않은 오염은 백혈구의 크기, 난형 모양 및 핵1의 존재로 인해 백혈구 분석을 방해할 수 있습니다. 따라서 높은 백혈구 순도를 달성하고 유세포 분석을 통해 백혈구의 표현형 및 기능적 특성을 연구하기 위해 백혈구 현탁액에서 적혈구를 제거하는 것이 필수적입니다. 포유류에서 백혈구 분리는 일반적으로 적혈구 삼투압 용해 또는 Ficoll 또는 Percoll1을 사용한 밀도 구배 분리를 포함합니다. 그러나 삼투압 용해는 적절하게 용해될 수 없는 핵이 있는 적혈구로 인해 해양 및 민물고기 모두에 효과가 없습니다1. 대신, 밀도 구배 분리는 시간이 지남에 따라 세포 안정성을 효과적으로 보존하기 때문에 물고기에 선호됩니다1. 일부 연구에서는 어린 어류에서 백혈구를 성공적으로 분리했지만, 많은 연구는 여전히 주로 성체 집단에 초점을 맞추고 있다17. 그럼에도 불구하고 생애 초기 단계는 질병 발병에 더 취약할 뿐만 아니라 규모가 작아 표본 추출 과정을 더 복잡하고 까다롭게 만듭니다. 또 다른 한계는 현재 방법이 백혈구 생존율을 평가하기 위해 즉각적인 처리가 필요하기 때문에 한 번에 제한된 수의 샘플 또는 복제로 제한되는 경우가 많다는 것입니다. 시료 처리의 지연은 세포 생존력에 부정적인 영향을 미칠 수 있으며, 이로 인해 시료 채취 공정에 추가적인 복잡성이 발생하고 전체 작업이 위태로워질 수 있습니다.
우리가 아는 한, 발표된 방법 중 어느 것도 유세포 분석에 의한 후속 생존율 분석을 위해 백혈구 세포를 성공적으로 고정하지 못했습니다. 본 연구는 Percoll 밀도 구배 분리 방법론을 사용하여 남부 유럽 국가에서 양식되는 주요 어종인 어린 금도미(Sparus aurata)의 머리 신장에서 백혈구를 분리하는 효율적인 방법을 확립하기 때문에 선구적입니다. 또한 유세포 분석을 통해 주요 백혈구 집단(림프구, 단핵구 및 과립구)을 식별하면서 살아있는 세포와 죽은 세포를 구별하는 개선된 염색 기반 기술을 제시합니다. 개선된 프로토콜에는 세포 고정이 수반되어 시술 후 최대 1개월까지 생존 가능한 세포 분석이 가능합니다. 이 유세포 분석 프로토콜의 구현은 일반적으로 면역 평가에 필요한 시간과 노력을 크게 줄일 수 있는 잠재력을 가지고 있으며, 이는 양식 부문의 연구 및 보다 실용적인 응용 프로그램 모두에 유용한 기술이 됩니다. 이 방법론을 적용하면 많은 수의 시료를 분석하고, 세포를 보존하고, 유세포 분석을 통한 지연 분석을 수행할 수 있는 이점이 있습니다. 따라서 어류의 면역 메커니즘과 세포 생존력이 다양한 환경 또는 실험 조건에 의해 어떻게 영향을 받는지에 대한 귀중한 통찰력을 얻는 것이 매우 도움이 될 수 있습니다. 또한, 이 생존력 분석은 특정 면역 세포 집단의 다중 매개변수 표현형 및 기능적 특성화와 통합될 수 있습니다. 이 접근 방식을 통해 여러 면역학적 매개변수를 보다 포괄적으로 분석하여 해당 세포 유형에 직접 연결하고 면역 반응을 보다 명확하게 이해할 수 있습니다. 이러한 발견은 양식업의 질병 관리를 위한 개선된 접근 방식을 포함하여 보다 효과적인 전략 개발에 기여할 수 있습니다.
프로토콜
이 프로토콜은 동물 실험(EU 기능 A 및 B)에서 인증을 받은 연구원이 수행해야 합니다. 동물 취급 및 검체 채취와 관련된 모든 절차는 ARRIVE 지침(Animal Research: Reporting of in vivo Experiments)을 준수해야 하며, 유럽 실험동물과학협회연맹(Federation of European Laboratory Animal Science Associations, FELASA)의 권고에 따라 동물 관리 및 사용에 대한 윤리적 기준을 준수해야 합니다. 본 연구는 이러한 모든 표준과 실험실 동물 과학에 대한 포르투갈 법률(EU 지침 2010/63; 법령 번호 113/2013). 이 연구는 IPMA의 동물 복지 및 윤리 기관(ORBEA, LABVIVOS-002-AquaClimAdapt)의 승인을 받았으며, DGAV(Directorate-General for Food and Veterinary)로 알려진 살아있는 동물 사용 국가 당국(National Authority for the Use of Live Animals)의 감독을 받고 윤리적 승인 번호 20596/25-S로 승인되었습니다.
1. 연구 모델 및 유기체의 유지 관리
참고: 이 연구는 평균 체중이 30.0 ± 5.0g이고 총 길이가 12.0 ± 2.0cm인 어린 금두미 도미(Sparus aurata)를 위해 특별히 설계되었습니다. 이 방법은 다른 어종에 직접 적용되지 않을 수 있는데, 다른 종은 백혈구 분리, 세포 고정 및 생존력 평가에 영향을 미칠 수 있는 고유한 생리학적 및 면역학적 특성을 가지고 있기 때문입니다. 다른 종에 대해서는 프로토콜에 대한 조정이 필요할 수 있으며, 각 대상 종에 대한 조건을 최적화하기 위해 예비 연구가 권장됩니다.
- 물고기 적응 (격리 기간)
- 큰 용량의 수조에 물고기를 균등하게 분배합니다(예: 각각 총 용량이 660L인 두 개의 수조 - 보충 그림 1 참조).
알림: 사용할 탱크는 효율적인 물 사용과 수질 관리를 개선할 수 있는 재순환 양식 시스템(RAS)의 일부일 수 있습니다. RAS에서 물은 시스템 내에서 지속적으로 재활용 및 처리되어 물고기에게 안정적이고 통제된 환경을 제공합니다. 이 설정은 물고기의 건강과 성장을 위한 최적의 조건을 유지하고 균일한 분포를 보장하며 연구 중 스트레스를 최소화하는 데 도움이 됩니다. - 최적의 비생물적 조건을 유지합니다.
- 자연 서식지를 모방한 조건에서 물고기를 3주 동안 격리하십시오.
온도 : 20.0 ± 0.5 °C;
용존 산소 : 7.2 ± 0.2 mg / L;
염분 : 35.0 ± 0.5 °C;
pH : 8.0 ± 0.1 단위;
광주기: 14시간 조명/10시간 어둠.
알림: 이상적인 유지 관리 조건은 어종에 따라 다를 수 있습니다. 다른 종은 요구 사항이 다를 수 있으므로 유기체의 건강과 복지를 보장하기 위해 대상 종의 특정 요구에 맞게 이러한 조건을 조정하는 것이 중요합니다. 또한 해수 온도와 광주기는 계절에 따라 변할 수 있으므로 실험실에서 자연 조건을 복제할 때 계절적 변화를 고려해야 합니다.
- 자연 서식지를 모방한 조건에서 물고기를 3주 동안 격리하십시오.
- 큰 용량의 수조에 물고기를 균등하게 분배합니다(예: 각각 총 용량이 660L인 두 개의 수조 - 보충 그림 1 참조).
- 실험 연구를 시작합니다.
- 각 사례 연구의 실험 설정 설계에 따라 필요한 수조와 물고기의 수를 정의합니다.
- 격리 기간이 끝나면 물고기를 독립적인 RAS로 옮깁니다( 보충 그림 2 참조).
- 물에서 과도한 유기 화합물을 제거하기 위해 각 시스템에 단백질 스키머를 장착하십시오. 물리적 여과 (필터 백 [400 μm], 필터 스폰지 및 유리솜); 생물학적 여과 (바이오 볼 [1.5"], 자외선 살균기 및 수중 에어 스톤); 자동 해수 냉동 시스템 및 수중 디지털 히터는 모두 온도 센서가 있는 컴퓨터 제어 시스템(ProfiLux)에 연결되어 각 탱크의 온도를 조정합니다. 용존 산소를 제어하기 위해 각 탱크에 잠긴 공기 돌.
- 실험을 진행하기 전에 새로운 시스템에서 2주 동안 물고기를 적응시킵니다.
- 일일 유지 보수 수행
- 각 배양 탱크에서 물고기 배설물을 제거하고 25% 해수 재생을 수행합니다.
- 휴대용 정밀 온도계를 사용하여 온도를 측정합니다.
- 다중 매개변수 측정 기기를 사용하여 다른 해수 비생물적 매개변수(염도, 용존 산소 및 pH)를 모니터링합니다.
- 실험 전반에 걸쳐 안정성을 보장하기 위해 필요에 따라 해수 비생물 매개변수를 조정합니다.
참고: 실험 시스템의 비생물적 조건은 각 사례 연구의 특정 요구 사항에 따라 달라질 수 있습니다. 예를 들어, 연구가 계절 변화나 해양 열파를 시뮬레이션하는 것을 목표로 하는 경우 자연적인 계절 변화를 모방하기 위해 온도와 광주기를 적절하게 조정해야 합니다. 마찬가지로, 연구가 저산소 상태 또는 해양 산성화를 시뮬레이션하는 데 초점을 맞추는 경우 바닷물의 산소 수준과 pH를 조정해야 합니다. 이를 통해 실험 조건이 가능한 한 현실적이고 관련성이 높도록 하여 연구 결과의 타당성과 적용 가능성을 높일 수 있습니다. - 1.2.4.6-1.2.4.8 단계에 설명된 대로 스트레스 또는 질병의 징후를 식별하고 관리하여 물고기의 건강과 웰빙을 평가합니다.
- 불규칙한 수영, 식욕 부진, 무기력, 공격성 또는 고립과 같은 비정상적인 행동을 찾으십시오.
- 병변, 궤양, 변색, 뻣뻣한 지느러미, 과도한 점액 또는 빠른 아가미 움직임을 포함한 질병의 징후를 확인하십시오.
- 모든 관찰 내용을 기록하고 날짜와 취한 조치를 기록합니다.
- 매주 수질 테스트를 실시합니다.
- 비색 테스트를 사용하여 암모니아(NH3/NH4), 아질산염(NO2-) 및 질산염(NO3-) 수준을 측정합니다.
알림: 이러한 모든 매개변수가 감지 가능한 수준 미만인지 확인하십시오. 수준이 한계를 초과하면 추가 물 교체를 수행하거나 폭기를 높이거나 여과를 조정하십시오.
- 비색 테스트를 사용하여 암모니아(NH3/NH4), 아질산염(NO2-) 및 질산염(NO3-) 수준을 측정합니다.
- 물고기에게 먹이를 주고 영양을 모니터링합니다.
- 어린 물고기의 특정 영양 요구 사항을 충족하는 고품질 식단을 제공합니다(식단의 자세한 구성에 대한 예는 보충 표 1 참조).
알림: 아쿠아 피드 펠릿의 크기(2-3mm)가 청소년에게 적합하여 섭취와 소화를 용이하게 하는지 확인하십시오. - 하루 물고기 평균 체중의 2%에 해당하도록 사료량을 조정합니다.
- 하루에 두 번, 아침에 한 번, 오후에 한 번 물고기에게 수동으로 먹이를 줍니다(안정적인 먹이 주기 루틴을 유지하기 위해 특정 시간을 설정).
- 어린 물고기의 특정 영양 요구 사항을 충족하는 고품질 식단을 제공합니다(식단의 자세한 구성에 대한 예는 보충 표 1 참조).
2. 물고기 표본 추출, 안락사, 해부 및 머리 신장 채취
- 수조에서 물고기를 맛보세요.
- 표본 추출 편향을 피하기 위해 수조에서 무작위로 물고기를 선택하십시오.
- 그물을 사용하여 물고기를 탱크 물로 채워진 임시 보관 용기로 부드럽게 옮깁니다.
알림: 스트레스를 줄이기 위해 취급 시간을 최소화하십시오.
- 안락사 용액을 준비합니다.
- 물고기를 담기에 적합한 적절한 용기(예: 3L 양동이)를 사용하십시오.
- 200-300 mg/L의 최종 농도를 달성하기 위해 적절한 양의 트리카인(MS-222)을 바닷물에 용해시킵니다18(주의: 보충 표 2 및 보충 파일 1 참조).
- 용액을 중탄산나트륨으로 완충하여 pH 7.2-7.5로 만듭니다.
- 안락사 용액을 투여합니다.
- 물고기를 안락사 용액에 최소 10분 동안 또는 수술 움직임이 멈추고 반사 신경 상실이 관찰될 때까지 두십시오(외부 자극에 대한 반응이 없는지 확인하여 안락사 확인).
- 물고기의 체중(g)과 총 길이(cm)를 기록합니다.
- 물고기 해부를 수행합니다.
참고: 최적의 샘플 품질과 세포 생존력을 보장하기 위해 박리 과정은 가능한 한 빨리, 이상적으로는 안락사 후 5분 이내에 완료되어야 합니다.- 샘플링 및 처리 중 변동을 최소화하기 위해 에어컨을 사용하여 실험실 온도를 19°C로 유지하십시오.
- 해부 도구(가능하면 오토클레이브 금속 기구 권장)를 소독하고 70% 에탄올로 깨끗한 작업 공간을 설정합니다(주의, 보충 표 2 참조).
- 안락사된 물고기를 멸균 해부 트레이에 옆으로 눕히고 머리가 주로 사용하지 않는 손을 향하도록 합니다.
- 메스를 사용하여 환풍구(항문)에서 아가미 방향으로 물고기의 복부 정중선을 따라 조심스럽게 절개합니다.
알림: 내부 장기가 손상되지 않도록 너무 깊게 자르지 않도록 주의하십시오. - 절개 가위를 조심스럽게 사용하여 절개 부위를 확장하고 내부 장기를 노출시킵니다. 내부 해부학적 구조를 명확하게 볼 수 있도록 신체 벽 덮개를 부드럽게 들어 올립니다.
- 두부 신장 찾기: 두부 신장은 아가미 바로 뒤, 체강의 앞쪽 등쪽 근처에 위치하며 체강의 위쪽을 따라 척추 아래 뻗어 있습니다.
참고: 머리 신장은 일반적으로 주변 조직에 비해 색이 더 어둡습니다(그림 1). - 두부 신장을 더 잘 볼 수 있도록 지방 및 결합 조직과 같은 주변 조직을 조심스럽게 제거합니다.
알림: 이 단계에서는 두부 신장 손상을 방지하기 위해 섬세한 취급이 필요합니다. - 끝이 가는 집게와 가위를 사용하여 머리 신장을 조심스럽게 들어 올리고 주위를 정밀하게 잘라 주변 조직으로부터 분리시킵니다.
알림: 손상을 방지하기 위해 티슈를 부드럽게 다루십시오. 무게가 약 30g인 물고기의 경우 머리 신장의 무게는 약 20-30mg일 것으로 예상됩니다. - 절제된 장기를 멸균 페트리 접시 내의 세포 여과기(100μm 나일론 메쉬)에 즉시 넣어 멸균 상태를 보장하고 후속 처리 단계를 용이하게 합니다.
참고: 이 시점부터는 세포 생존력을 유지하기 위해 가능한 한 빨리(5분 이내) 모든 단계를 수행해야 합니다. 샘플을 시원하게 유지하려면 얼음으로 채워진 용기에 페트리 접시를 놓고 알루미늄 호일로 덮은 상태에서 다음 단계를 수행하십시오.

그림 1: 두부 신장의 위치: (A) 아가미 뒤와 체강의 앞쪽 등쪽 부위를 따라 두부 신장의 전형적인 위치를 묘사한 그림; (B) 도미의 머리 신장의 대표적인 이미지로, 주변 조직에 비해 더 어두운 색을 강조합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 두부 신장 백혈구의 분리(그림 2)
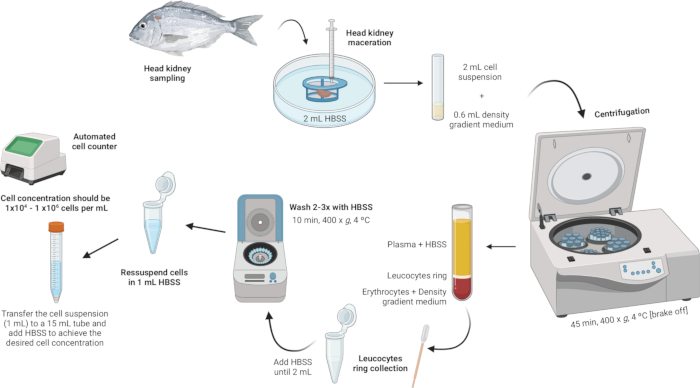
그림 2: 두부 신장에서 백혈구 분리에 대한 예시적인 설명. 프로토콜은 조직의 균질화부터 시작하여 밀도 구배 원심분리, 백혈구 고리 채취, 백혈구 고리 세척, 세포 농도의 재현탁 및 조정으로 마무리하는 여러 단계를 포함합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 조직을 균질화합니다.
- 멸균 페트리 접시에 행크스 균형 소금 용액(HBSS) 2mL를 넣습니다.
- 셀 스트레이너의 메쉬(100μm 나일론 메쉬)가 HBSS와 접촉하지만 완전히 잠기지 않았는지 확인합니다.
- 주사기의 플런저를 사용하여 세포 여과기에 머리 신장을 침식합니다. 부드러운 압력을 가하여 장기 조각이 나일론 그물망을 통과하도록 밀어 세포 현탁액을 만듭니다.
참고: 여러 샘플을 처리하는 경우amples, 세포 현탁액이 포함된 페트리 접시는 다음 단계까지 몇 분 동안 4°C의 냉장고에 보관할 수 있습니다. 이 세포 현탁액은 백혈구 분리에 사용됩니다.
- 밀도 구배 원심분리를 수행합니다.
- 밀도 1.077g/mL, 삼투압 353mOsm/kg, pH 7.4의 밀도 구배 배지 용액을 준비합니다( 보충 파일 1 참조).
참고: 삼투압은 어종에 따라 다를 수 있으므로 각 종의 특정 요구 사항을 충족하도록 밀도 구배 매체 용액의 삼투압을 조정하는 것이 중요합니다. - 5mL 폴리스티렌 둥근 바닥 튜브에 600μL의 밀도 구배 매체 용액을 조심스럽게 추가합니다.
- 세포 현탁액(2mL)을 취하여 밀도 구배 배지가 들어 있는 튜브에 천천히 추가합니다. 첫 번째 방울은 매우 중요합니다 - 밀도 구배 중간 단계를 불안정하게 만들지 않도록 매우 부드럽게 첨가하십시오.
참고: 이 작업은 3:10 비율(밀도 구배 매체: 셀 현탁액)로 수행해야 합니다. 정확하고 부드럽게 첨가하려면 멸균 1mL 파스퇴르 피펫을 사용하십시오. 밀도 구배 중간 층을 방해하지 않도록 피펫의 끝이 튜브 측면에 닿는지 확인하십시오. 샘플을 밀도 구배 매체와 혼합하지 마십시오. - 브레이크를 끈 상태에서 400 x g 에서 45 °C에서 4분 동안 튜브를 원심분리하십시오. 이렇게 하면 프로세스 중에 레이어가 그대로 유지됩니다.
참고: 원심분리 후에는 뚜렷한 층이 보여야 합니다. 백혈구는 밀도 구배 매질과 세포 파편 펠릿 사이의 계면에서 고리를 형성합니다(그림 3).
- 밀도 1.077g/mL, 삼투압 353mOsm/kg, pH 7.4의 밀도 구배 배지 용액을 준비합니다( 보충 파일 1 참조).

그림 3: 밀도 구배 매질(density gradient medium)과 세포 파편 펠릿(cellular debris pellet) 사이의 계면에서 백혈구 고리(leukocytes ring). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 백혈구 고리를 수집합니다.
- 멸균 파스퇴르 피펫을 사용하여 백혈구 고리(~100μL)를 부드럽게 흡인하고 2mL 마이크로 원심분리 튜브로 옮깁니다.
알림: 오염을 방지하기 위해 층을 크게 방해하지 않도록 주의하십시오. 백혈구 고리에 파편이나 어두운 현탁액이 포함되어 있는 것으로 보이는 경우, 순도를 보장하기 위해 수집된 백혈구 현탁액을 새로운 미니 세포 여과기(100μm)에 통과시키는 것이 좋습니다. 미니 세포 스트레이너를 2mL 마이크로 원심분리 튜브 위에 놓고 스트레이너를 통해 백혈구 현탁액을 부드럽게 옮깁니다.
- 멸균 파스퇴르 피펫을 사용하여 백혈구 고리(~100μL)를 부드럽게 흡인하고 2mL 마이크로 원심분리 튜브로 옮깁니다.
- 백혈구 고리를 씻으십시오.
- 백혈구 고리가 들어 있는 마이크로 원심분리 튜브에 HBSS를 부피가 2mL에 도달할 때까지 추가하고 세포를 부드럽게 재현탁합니다.
참고: 튜브를 얼음으로 채우고 알루미늄 호일로 덮은 용기에 보관하여 샘플을 저온으로 유지하십시오. 튜브가 얼음에 직접 닿지 않도록 하십시오. 세탁 과정 전반에 걸쳐 이 냉각 설정을 유지하십시오. - 400 × g 에서 4°C에서 10분 동안 샘플을 원심분리합니다(브레이크가 켜져 있을 수 있음).
- 원심분리 후 상등액을 조심스럽게 버리고 펠릿을 바닥에 남겨둡니다(거의 보이지 않을 수 있음).
- 펠릿에 불순물이 없어질 때까지 세척 단계(HBSS 추가, 재현탁, 원심분리 및 상등액 폐기)를 반복합니다.
- 백혈구 고리가 들어 있는 마이크로 원심분리 튜브에 HBSS를 부피가 2mL에 도달할 때까지 추가하고 세포를 부드럽게 재현탁합니다.
- 세포 농도를 재현탁하고 조정합니다.
- 세척에 사용된 것과 동일한 2mL 마이크로 원심분리 튜브 내에 1mL의 HBSS에 세포를 재현탁합니다.
- mL당 1 × 104 및 1 × 106 세포 사이의 세포 농도를 달성합니다. 초기 펠릿이 큰 경우 세포 농도를 원하는 범위로 희석하기 위해 추가 HBSS가 필요할 수 있습니다. 세포 현탁액을 15mL 튜브로 옮기고 얻은 세포 수에 따라 필요에 따라 HBSS를 더 추가합니다.
참고: 프로세스를 용이하게 하기 위해 자동화된 세포 계수기를 사용하는 것이 좋습니다.
4. 백혈구의 염색 및 고정(그림 4)
참고: LIVE/DEAD Fixable Dead Cell Stain Kit는 유세포 분석을 사용하여 고정 세포에서 세포 생존율을 평가하는 개선된 방법을 제공합니다. 이러한 분석은 세포 아민과 상호 작용하는 형광 반응성 염료를 사용합니다. 세포막이 손상되면 염료가 세포에 침투하여 세포 내부와 표면 모두에서 유리 아민과 반응하여 강렬한 형광 염색을 유발할 수 있습니다. 반대로, 생존 가능한 세포에서는 세포 표면 아민만 염료와 반응할 수 있어 상대적으로 희미한 염색을 유발할 수 있습니다. 염색 강도는 포름알데히드로 고정한 후에도 유지되며, 이는 또한 미생물의 성장을 방지하여 샘플을 보존합니다. LIVE/DEAD Fixable Dead Cell Stain Kit는 청색, 보라색, 청록색, 황색, 녹색, 적색, 근적외선 또는 근적외선(적외선)으로 제공되는 형광 염료를 제외하고는 동일합니다. 이 연구에서는 Near-IR 형광 반응성 염료를 사용했습니다. 또한 이 단색 분석을 통해 다색 실험에서 다른 파라미터를 병렬로 테스트할 수 있습니다.
- 염료를 준비합니다.
- 시약을 실온(RT)으로 가져오기: 캡을 제거하기 전에 형광 반응성 염료 바이알 하나와 무수 디메틸 설폭사이드(DMSO) 바이알이 RT에 도달하도록 합니다.
- 염료 재구성: 반응성 염료가 들어 있는 바이알에 DMSO 50μL를 추가합니다. 완전히 혼합하고 염료가 완전히 용해되었는지 확인하십시오.
- 재구성된 염료 용액을 가능한 한 빨리, 가급적이면 몇 시간 이내에 사용하십시오.
참고: 각 키트에는 5개의 반응성 염료 바이알이 포함되어 있어 최소 40개의 세포 샘플을 염색하기에 충분한 물질을 제공합니다. 그러나 재구성 후 염료의 DMSO 용액은 특히 수분에 노출될 때 상대적으로 불안정합니다. 사용하지 않은 부분은 빛과 습기로부터 보호되어 ≤-20 °C에서 최대 2주 동안 보관할 수 있습니다.
- 세포를 염색하고 고정하십시오.
참고: 세포 염색에 적합한 완충액에는 소 혈청 알부민 또는 혈청과 같은 외부 단백질을 포함하지 않는 한 Hanks의 Balanced Salt Solution(HBSS), 인산염 완충 식염수(PBS) 및 Dulbecco의 PBS(D-PBS)가 포함됩니다. 아미노 반응성 염료를 사용할 때는 세포 재현탁 및 세척을 위해 아지드화나트륨 또는 외부 단백질이 포함된 Tris 완충액 및 용액을 피하십시오. 이 연구에서는 삼투압 균형을 유지하는 데 도움이 되고 염색 과정에서 세포 대사와 생존력을 지원하는 필수 이온과 포도당을 제공하는 균형 잡힌 이온 구성으로 인해 HBSS를 사용했습니다. HBSS는 또한 외부 단백질이 없어 반응성 염료에 대한 간섭을 방지하고 정확한 생존율 평가를 보장합니다.- HBSS를 사용하여 세포를 계수하고 밀도를 mL당 1 x 106 세포로 조정한 후 이 세포 현탁액 1mL를 2mL 마이크로 원심분리 튜브로 옮깁니다.
- 매일 하나 이상의 샘플에서 세포 사멸을 유도하여 살아있는 세포와 죽은 세포 사이의 형광 강도 임계값을 설정하기 위한 대조군으로 사용합니다. 다음과 같이 마이크로 원심분리기 튜브에 샘플을 준비합니다.
튜브 1: 살아있는 세포 - 염색되지 않음
튜브 2: 살아있는 세포 - 염색
튜브 3: 죽은 세포 - 염색되지 않음
튜브 4: 죽은 세포 - 염색
참고: 이 4개의 튜브는 각 실험에서 대조군으로 단일 샘플에 대해서만 준비하면 됩니다. 나머지 샘플의 경우 두 개의 튜브(튜브 1: 샘플 - 염색되지 않음 및 튜브 2: 샘플 - 염색됨)만 필요하며, 이는 살아 있는 세포와 죽은 세포에 대한 정보를 제공하기 때문입니다.
- 매일 하나 이상의 샘플에서 세포 사멸을 유도하여 살아있는 세포와 죽은 세포 사이의 형광 강도 임계값을 설정하기 위한 대조군으로 사용합니다. 다음과 같이 마이크로 원심분리기 튜브에 샘플을 준비합니다.
- 세포 사멸에 대한 양성 대조군: 라벨링된 튜브 Dead unstained(Tube 3) 및 Dead-stained(Tube 4)를 50°C의 수조에 7분 동안 넣어 열처리로 세포 사멸을 유도합니다.
- 세포 염색: 1μL의 재구성된 형광 반응성 염료(단계 4.1.2)를 튜브 2 및 4(염색될 튜브)의 세포 현탁액 1mL에 추가하고 잘 혼합합니다.
- 빛으로부터 보호받으며 30분 동안 상온에서 배양합니다.
참고: 고정이 필요하지 않은 경우 아래 4.2.5-4.2.7 단계를 건너뛸 수 있습니다. 대신, 1% 소 혈청 알부민이 함유된 HBSS 1mL로 세포를 두 번 세척하고( 보충 파일 1 참조) HBSS 1mL에 1% 소 혈청 알부민과 함께 재현탁합니다. 가능한 한 빨리 유세포 분석기에 대한 분석을 수행합니다. 그렇지 않으면 세포가 고정되지 않아 세포 생존력이 손상될 수 있습니다. - HBSS 1mL로 세포를 두 번 세척하고 HBSS 900μL에 세포를 재현탁합니다.
- 100μL의 37% 포름알데히드를 추가합니다(주의, 보충 표 2 참조).
- RT에서 15분 동안 배양합니다.
- 1% 소 혈청 알부민(BSA)이 함유된 HBSS 1mL로 2회 세척한 다음 1% BSA가 함유된 HBSS 1mL에 세포를 재현탁합니다.
- 샘플을 4°C의 냉장고에 보관하십시오. 고정 후 1개월 이내에 세포를 분석합니다.
- 적절한 excitation 및 detection channel을 사용하여 유세포 분석으로 fixed cell suspension을 분석합니다.
알림: 올바른 여기 및 감지 채널은 사용 중인 기기에 따라 다를 수 있습니다( 보충 표 3 참조).
- HBSS를 사용하여 세포를 계수하고 밀도를 mL당 1 x 106 세포로 조정한 후 이 세포 현탁액 1mL를 2mL 마이크로 원심분리 튜브로 옮깁니다.

그림 4: 백혈구의 염색 및 고정에 대한 설명 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
5. 유세포 분석
- 데이터를 수집합니다.
참고: 유세포 분석기에서 따라야 할 절차는 사용하는 특정 세포 분석기에 따라 다를 수 있습니다. 이 연구에서는 Attune NTx 유세포 분석기를 사용하여 데이터를 획득했습니다.- 샘플을 실행합니다.
- 샘플 튜브를 s에 놓습니다.amp르 포트.
- start를 눌러 수집을 시작한 다음 이벤트 속도(events/second)가 안정화되면 record를 클릭합니다.
- 신뢰할 수 있는 분석을 위해 singlets 게이트의 각 샘플에 대해 최소 10,000개의 이벤트를 기록합니다.
- 각 샘플에 대한 모든 데이터를 저장하고 외부 드라이브 또는 클라우드 스토리지에 백업합니다.
- 데이터를 분석합니다.
참고: 유세포 분석을 위해 여러 소프트웨어 옵션을 사용할 수 있습니다. 본 연구에서는 FlowJo v10.8.119를 이용하여 데이터 분석을 수행하였다.- 데이터 파일 로드: 유세포 분석 소프트웨어를 실행하고 실험에서 획득한 .fcs 파일을 업로드합니다.
- 데이터 시각화(그림 5A): 전방 산란(FSC-A)(XX) 대 측면 산란(SSC-A)(YY)을 플롯하여 셀 크기와 입도를 평가합니다.
참고: 이 플롯은 일반적으로 세포 집단을 식별하고 산란 특성에 따라 파편을 제외하는 데 사용됩니다. - 단일항 세포 게이팅 및 다중항 제외(그림 5B): 전방 산란 영역(FSC-A) 대 전방 산란 높이(FSC-H) 플롯을 사용하여 다중항을 제외합니다. 그래프에 정렬된 모든 이벤트(단일 셀)를 포함하도록 게이트를 그리고 정렬되지 않은 이벤트(다중선)를 제외합니다. 샘플에 FSC가 매우 낮은 이벤트가 있는 경우 단일 세포의 게이트에 포함하지 않고 단일 세포만 남아 이벤트를 제외합니다.
- 백혈구 집단 식별(그림 5C): FSC-A/SSC-A 프로파일을 기반으로 3개의 백혈구 집단을 구별합니다: FSC-A높음/SSC-A높음 은 과립구, FSC-A매체/SSC-A매체 는 단핵구, FSC-A낮음/SSC-A낮음 은 림프구입니다.
- Viability gating(그림 5D): 해당 형광 채널(NIR, RL3-A)에서 viability dye staining에 대한 임계값을 설정합니다. 살아있는 세포와 죽은 세포는 LIVE/DEAD Fixable Dead Cell Stain의 염색 강도에 따라 정의됩니다: 딤 염색된 세포는 살아있는 세포로 정의되고 강하게 염색된 세포는 죽은 세포로 정의됩니다.
- 인구 통계: 각 게이트의 총 이벤트(셀)와 총 및 게이트 셀의 백분율을 포함하여 소프트웨어에서 제공하는 통계를 확인합니다.
- 데이터 내보내기: 데이터를 스프레드시트로 내보내고 추가 통계 분석을 위해 적절한 통계 소프트웨어(GraphPad, Prism 또는 R)를 사용합니다.
참고: 분석 방법의 선택은 연구 목적에 따라 다릅니다.

그림 5: 두부 신장 세포의 생존율 평가를 위한 유세포 분석 게이팅 전략: (A) 수집된 모든 이벤트의 FSC-A/SSC-A 프로파일을 나타냅니다. (B) 전방 산란(FSC-A)/전방 산란(FSC-H) 그래프의 선형성을 기반으로 한 단일 영역의 정의에 따른 다중항 제외를 나타냅니다. (C) 다중항 배제 후 FSC-A/SSC-A를 기반으로 정의된 3개의 주요 개체군을 나타냅니다. (D) Live/Dead Viability 염료 염색을 보여주는 히스토그램을 나타냅니다. 살아 있는 세포와 죽은 세포를 구별할 수 있는 임계값을 설정하기 위해 백혈구를 가벼운 열 충격(50°C, 7분)에 투여한 다음 생존능 염료로 염색했습니다. 염색 강도가 높은 세포 양성(++)은 죽은 세포이고 염색이 적은 양성 세포(+-)는 살아있는 세포입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
그림 6은 이 연구에서 설명한 프로토콜을 사용하여 어린 길트헤드 도미(Sparus aurata)의 머리 신장에서 분리된 백혈구 개체군과 세포 생존력을 보여주는 대표적인 유세포 분석 데이터를 보여줍니다. 이 그림은 두 개의 샘플, 즉 물고기가 최적의 조건에 노출된 높은 세포 생존율을 가진 샘플(그림 6A)과 세포가 열 스트레스에 노출된 낮은 세포 생존율을 가진 샘플(그림 6B)을 비교한 것입니다.
두 샘플 모두에서 본 방법은 림프구(LY), 단핵구(MO) 및 과립구(GR)의 세 가지 주요 백혈구 집단을 효과적으로 식별했습니다. 이러한 집단은 전방 산란(FSC-A) 및 측면 산란(SSC-A) 플롯에서 알 수 있듯이 세포 크기와 복잡성의 차이에 따라 구별되었습니다. 전방 산란(FSC-A)은 상대적인 세포 크기를 나타내고, 측면 산란(SSC-A)은 세포의 내부 복잡성 또는 입도를 반영하여 집단을 명확하게 분리할 수 있습니다. 최적의 조건(그림 6A)에서 백혈구 개체군은 LY 31.0%, MO 38.0%, GR 31.0%로 분포되었습니다. 그러나 열 스트레스에 노출된 샘플(그림 6B)에서는 이러한 개체군의 분포 변화가 관찰되었으며, LY는 21.3%로, MO는 45.6%로, GR은 33.1%로 비교적 안정적으로 유지되었습니다.
그림 6A1-A3 및 그림 6B1-B3에 자세히 설명된 세포 생존율에 대한 추가 분석은 두 샘플 간에 상당한 대조를 보여줍니다. 관찰할 수 있듯이, 최적의 조건에 노출된 샘플(그림 6A)은 모든 백혈구 집단에서 살아있는 세포(파란색으로 표시)가 우세하여 더 높은 생존력을 보여주었습니다. 대조적으로, 열 스트레스를 받은 샘플(그림 6B)은 세포 사멸이 유의하게 증가했으며(빨간색으로 표시된 더 강렬한 염색) LY는 50.7%, MO는 83.7%, GR은 84.5%의 세포 사멸을 보였습니다.
전반적으로, 이 결과는 백혈구 집단을 분리 및 분석하고 세포 생존력을 평가하는 데 있어 프로토콜의 효과를 명확하게 보여줍니다. 또한 이 데이터는 열 노출과 같은 스트레스 조건이 백혈구 집단 역학 및 세포 생존력에 어떤 영향을 미치는지에 대한 귀중한 통찰력을 제공합니다. 관찰된 세포 분포 및 스트레스 하에서의 생존력의 변화는 열 노출이 백혈구 집단의 균형을 방해할 뿐만 아니라 세포 건강을 손상시킨다는 것을 시사합니다. 이러한 변화는 스트레스에 대한 면역 반응을 나타낼 수 있으며, 이는 환경 스트레스 요인에 의해 촉발된 적극적인 방어 메커니즘을 나타냅니다.

그림 6: 길트헤드 도미(Sparus aurata)의 머리 신장에서 다양한 백혈구 집단의 식별 및 생존력을 보여주는 대표적인 유세포 분석 플롯: (A) 최적의 조건에 노출된 높은 세포 생존율을 가진 샘플: 왼쪽 패널은 FSC-A/SSC-A를 기반으로 한 백혈구 집단의 게이팅을 보여주며 림프구(LY), 단핵구(MO) 및 과립구(GR)를 식별합니다. LY(A.1), MO(A.2) 및 GR(A.3)의 생존력. (B) 열 스트레스를 받는 세포 생존율이 낮은 샘플: 왼쪽 패널은 FSC-A/SSC-A를 기반으로 한 백혈구 집단의 게이팅을 보여주며 림프구(LY), 단핵구(MO) 및 과립구(GR)를 식별합니다. LY(B.1), MO(B.2) 및 GR(B.3)의 생존력. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 그림 1: 총 용량이 660L인 격리 탱크의 대표 이미지. 이 그림을 다운로드하려면 여기를 클릭하십시오.
보충 그림 2: RAS 시스템 설정 이미지. (1) 프로피룩스; (2) 등기구; (3) 수족관/탱크; (4) 냉장고; (5) 수족관의 급수 꼭지; (6) 수족관 물 배출구를 위한 파란 싸이펀; (7) 섬프; (8) 단백질 스키머; (9) 기계식 필터(필터 백); (10) 기계식 필터 (파란색 스폰지 + 유리솜); (11) 생물학적 필터 (바이오 볼); (12) 서모 스탯; (13) 메인 펌프; (14) UV 살균제; (15) 온도 센서; (A) 기계식 필터(파란색 스폰지); (B) 기계식 필터(유리솜). 이 그림을 다운로드하려면 여기를 클릭하십시오.
보충 표 1: 연구에 사용된 실험 사료의 성분 조성(%) 및 근접 분석(%DM). 이 표를 다운로드하려면 여기를 클릭하십시오.
보충 표 2: 프로토콜에 사용된 시약: 건강 위험, 위험 문구, 예방 조치 문구 및 응급 처치 조치. 이 표를 다운로드하려면 여기를 클릭하십시오.
보충 표 3: 아민 반응성 LIVE/DEAD 고정 가능한 사세포 염색과 함께 사용할 수 있는 적절한 여기 및 검출 채널. 이 표를 다운로드하려면 여기를 클릭하십시오.
보충 파일 1 : 용액 준비를위한 계산. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
이 연구에서 개발된 방법은 어류 면역학 연구의 중요한 진전을 나타내며 어류 면역 반응에 대한 이해와 해양 자원의 지속 가능성을 향상시킬 것을 약속합니다. S. aurata 는 Sparidae과에 속하는 귀중한 해양 어종으로, 생리학, 면역학, 독성학, 양식학과 같은 여러 연구 분야의 실험실 연구에서 다재다능함뿐만 아니라 생태학적, 경제적 관련성 등 여러 가지 이유로 이상적인 모델 유기체로 작용합니다20. S. aurata 의 주요 장점 중 하나는 일관되고 재현 가능한 실험 조건을 보장하는 잘 확립된 사육 프로토콜을 통해 실험실에서 취급 및 사육이 용이하다는 것입니다21. 또한, 환경적 적응력(즉, 온도 및 염분 변동과 같은 광범위한 환경 조건에 대한 높은 내성)으로 인해 농업 기술을 개선하고 해양 생물에 대한 환경 영향을 평가하기 위한 연구에 이상적인 후보가 됩니다22. S. aurata는 잘 특성화된 면역 체계와 게놈 데이터의 가용성을 통해 물고기의 면역 반응, 병원체 저항성, 백신 효능 및 전반적인 건강을 파악할 수 있습니다20. 남유럽 인구의 식습관뿐만 아니라 양식업에서의 중요성을 감안할 때, 이 종에 대한 연구는 농업 관행에 직접적인 영향을 미치고 생산 및 지속 가능성을 향상시키는 동시에 업계 내 환경 문제를 해결할 수 있습니다20.
이러한 의미에서 이 프로토콜은 다음과 같은 다양한 연구 분야에서 몇 가지 이점과 잠재적인 응용 프로그램을 제공합니다: (i) 어류 면역학: S. aurata의 머리 신장에서 추출한 면역 세포에 대한 정확하고 상세한 분석을 제공하여 다양한 백혈구 집단의 식별 및 특성화를 가능하게 할 뿐만 아니라 유세포 분석을 통한 세포 생존력에 대한 강력한 평가를 가능하게 합니다. (ii) 양식 연구: 농업 기술, 영양 및 질병 관리 연구에 필수적이며, 항생제 및 화학 처리에 대한 의존도를 줄여 보다 지속 가능한 양식 관행을 촉진하는 것을 목표로 하는 미래 연구를 지원합니다. (iii) 생태독성학: 오염 물질 및 기타 환경 스트레스 요인이 어류 면역 건강에 미치는 영향을 평가하고, 환경 위험 평가 및 수생 생태계에 대한 보호 규정 제정을 위한 데이터를 제공하는 데 유용합니다. (iv) 비교 생리학: 연구자들이 다양한 환경 문제에 대한 면역 체계의 진화적 적응을 추적할 수 있도록 하여 면역 기능의 유전적, 생리학적 기초에 대한 더 깊은 이해를 제공합니다. (v) 해양 생물학 및 생태학: S. aurata의 생태학적 역할과 상호 작용에 대한 이해를 향상시켜 종 분포, 서식지 선호도 및 환경 변화가 해양 생물 다양성에 미치는 영향에 대한 통찰력을 제공합니다. (vi) 생물 의학 연구: 어류는 생물 의학 연구에서 모델 유기체로 점점 더 자주 사용되고 있습니다. 면역 세포 분리 및 분석은 신약 개발 및 의학에 중요한 세포 및 분자 측면을 이해하는 데 도움이 될 수 있습니다.
수년 동안 어류에서 백혈구의 정량화 및 식별은 Bürker, Neubauer 또는 Thoma 혈구계를 사용한 수동 계수 및 염색된 혈액 도말과 같은 전통적인 혈액학적 기술에 의존했습니다10,12. 트리판 블루 배제 테스트를 사용하여 세포 생존율을 평가한 후 현미경 검사로 15,22,23,24,25,26,27,28을 계산했습니다. 이러한 방법은 어류 면역학에 대한 이해에 기여했지만 몇 가지 한계가 있습니다. 수동 백혈구 계수는 시간이 많이 걸리고 노동 집약적이었으며, 이러한 기술의 정확도는 종종 작업자의 가변성과 인적 오류로 인해 손상되어 결과의 일관성에 큰 영향을 미쳤습니다10.
1994년, 에스테반(Esteban 등)은 농어(Dicentrarchus labrax)의 식세포 방어 기전을 평가하는 기술을 도입하여 어류 백혈구 분석에 혁명을 일으켰습니다23. 그들의 연구에서 백혈구는 Percoll 밀도 구배 원심분리를 사용하여 말초 혈액, 두, 신장 및 복막 삼출물에서 분리되었습니다23. 이러한 방법론적 발전은 백혈구 분석의 정확성과 신뢰성을 향상시키는 중요한 도약을 의미했습니다. Esteban 등의 선구적인 연구에 따라 후속 연구는 세포 집단 프로파일링 6,15,16,28,29, 세포 생존력 3,6,27,28, 식세포 활성 6,23과 같은 다양한 측면에 중점을 두고 백혈구 분석을 위한 유세포 분석 기술을 개선하고 최적화하는 것을 목표로 했습니다. 24,27,28. 다양한 gradient media(예: Ficoll vs. Percoll) 및 최적화된 원심분리 프로토콜의 사용을 포함한 분리 절차의 발전으로 분리된 백혈구의 순도와 수율이 개선되었습니다 1,8,14,26. 고급 염색 기술의 개발과 프로피듐 요오드화물(PI) 및 3,3'-디헥실록사카르보시아닌 요오드화물(DiOC6(3))과 같은 형광 염료의 사용으로 생존 가능한 세포와 생존 불가능한 세포를 보다 정확하게 구별할 수 있을 뿐만 아니라 각각 백혈구 집단의 상세한 특성을 분석할 수 있게 되었습니다16,30. 이 기술의 주요 장점 중 하나는 서로 다른 백혈구 집단(림프구, 단핵구 및 과립구)을 동시에 구별하고 각 집단의 세포 생존력을 평가할 수 있다는 것입니다. 이를 통해 연구자들은 특정 조건에서 가장 영향을 받는 집단을 식별하여 면역 반응에 대한 심층적인 통찰력을 제공하고 가장 취약한 백혈구 하위 집합을 밝힐 수 있습니다. 그러나 이러한 개선에도 불구하고 현재 방법은 여전히 한계에 직면해 있습니다. 대부분의 연구는 성체 물고기에 초점을 맞추고 있어 유년기 단계에 대한 연구에는 공백이 있습니다. 어린 어류는 크기가 작고 그에 비례하여 더 작은 면역 기관에서 고품질 샘플을 얻기가 어렵기 때문에 백혈구 추출에 고유한 어려움을 안겨줍니다17. 여기에 설명된 연구는 어린 물고기에 대한 프로토콜을 최적화하고, 세포 현탁 비율을 조정하고, Percoll 솔루션을 조정하여 백혈구 추출의 품질을 개선함으로써 이러한 문제를 구체적으로 해결합니다. 또한 기존 방법은 백혈구 생존력 평가가 즉각적으로 필요하기 때문에 한 번에 처리할 수 있는 샘플 또는 복제물의 수에 의해 제한되는 경우가 많습니다. 시료 취급이 지연되면 세포 생존율에 부정적인 영향을 미쳐 시료 채취 공정이 복잡해지고 결과가 손상될 수 있습니다. 이러한 한계를 극복하기 위해 본 연구에서는 고정 후 최대 1개월까지 세포 고정 및 분석이 가능한 새로운 염색 기술의 사용을 소개합니다. 이러한 혁신은 샘플링 일정에 더 큰 유연성을 제공하여 연구자가 편의에 따라 샘플을 처리 및 분석할 수 있도록 하여 유세포 분석 평가의 작업 흐름과 신뢰성을 크게 향상시킵니다.
이 프로토콜의 성공은 몇 가지 중요한 단계에 달려 있으며, 각 단계는 백혈구의 무결성과 생존력을 보장하기 위해 신중한 실행이 필요하며, 이는 이후에 유세포 분석으로 분석됩니다. 안락사 용액의 올바른 준비와 pH 조정은 효과적인 안락사를 위해 매우 중요합니다. 부적절하게 준비된 용액은 불완전한 안락사 또는 물고기에게 추가적인 스트레스를 초래할 수 있습니다18. 두부 신장을 정확하고 신중하게 해부하는 것은 오염을 방지하는 데 필수적입니다. 무균 상태와 조직의 무결성을 유지하는 것은 고품질 백혈구 샘플을 얻는 데 매우 중요합니다. Percoll 용액의 밀도, 삼투압 및 pH는 효율적인 백혈구 분리를 위해 올바르게 조정되어야 합니다. 멸균 피펫으로 백혈구 고리를 부드럽게 흡인하는 것은 구배층의 오염 및 방해를 방지하는 데 중요합니다. 채취 후 세포의 효과적인 세척은 Percoll 잔류물 및 기타 불순물을 제거하는 데 필수적입니다. 세척 과정을 반복하면 깨끗한 세포 펠릿을 고정할 준비가 됩니다. 반응성 염료는 부적절한 취급은 안정성을 손상시킬 수 있으므로 효과를 보장하기 위해 사용 직전에 준비해야 합니다. 적절한 염료 첨가 및 배양 시간은 살아 있는 세포와 죽은 세포를 정확하게 구별하는 데 매우 중요합니다. 3.7% 포름알데히드로 세포를 고정하는 것은 세포 형태를 보존하고 죽은 세포를 정확하게 식별하기 위한 중요한 단계입니다. 포름알데히드 농도는 정확해야 하며 부정확한 결과를 방지하기 위해 배양 시간을 엄격히 준수해야 합니다. 고정 후 세포를 세척하는 것은 후속 분석을 방해할 수 있는 과도한 염료와 포름알데히드를 제거하는 데 중요합니다. 고정된 샘플의 적절한 보관과 적시 분석은 데이터 정확성을 유지하는 데 필요합니다. 사용된 특정 염료에 맞게 excitation 및 detection channel을 조정하는 것은 정확한 유세포 분석 결과를 위해 필수적입니다.
수많은 장점에도 불구하고 이 방법에는 고려해야 할 몇 가지 제한 사항이 있습니다. 한 가지 주요 제한 사항은 종 특이적 특성인데, 프로토콜이 해양 어류인 어린 길트헤드 도미(S. aurata)에 최적화되어 있기 때문입니다. 이것은 그 효과가 다른 어종, 특히 민물고기에 적용될 때 달라질 수 있음을 의미합니다. 해양 종과 담수 종 간의 삼투압 균형의 차이로 인해 염분 조건에 적합한 용액이 담수 종에는 적합하지 않을 수 있으므로 프로토콜에 사용되는 완충액에 대한 조정이 필요할 수 있습니다. 또한 조직 구조, 세포 밀도 및 생리학적 반응의 차이로 인해 프로토콜 조정이 필요할 수 있으며, 이는 잠재적으로 다른 종 간의 재현성과 일관성에 영향을 미칠 수 있습니다.
또 다른 중요한 요소는 샘플 수집 전에 물고기를 유지 관리하는 것입니다. 각 어종은 물고기의 건강을 유지하고 실험 결과의 질을 보장하는 데 중요한 최적의 수질 조건을 가지고 있다20. 온도, 염도 및 pH와 같은 매개변수의 변화는 최적이 아닌 조건이 세포 무결성을 손상시키는 생리적 스트레스를 유발할 수 있으므로 세포 생존율 및 데이터 품질에 영향을 미칠 수 있습니다. 일관된 실험 결과를 보장하려면 (연구의 목적에 따라 최적이든 의도적으로) 차선책이든 관계없이 모든 반복 실험을 동일한 통제 조건에서 유지하는 것이 중요합니다.
취급 및 해부 기술의 가변성은 또한 두부 신장 백혈구의 품질과 양에 영향을 미칠 수 있으며, 이로 인해 작업자의 기술과 경험은 프로토콜의 성공을 위한 중요한 요소가 됩니다. 또한, 안락사와 세포 고정 사이의 지연은 생존력 감소와 편향된 결과를 초래할 수 있기 때문에 분리 과정 전반에 걸쳐 세포 생존력을 유지하는 것이 어려울 수 있습니다. 조직과 세포의 즉각적인 처리는 높은 세포 생존율을 유지하는 데 필수적이지만, 특히 많은 수의 샘플로 작업할 때 이 요구 사항을 일관되게 달성하기가 어려울 수 있습니다.
공개
저자는 연구, 분석, 데이터 해석, 집필 또는 출판을 위한 원고 제출 결정에 영향을 미칠 수 있는 재정적, 개인적 또는 직업적 이해 상충이 없음을 선언합니다.
감사의 말
이 작업은 Aqua-CLIMADAPT(PTDC/CTA-AMB/0592/2021, https://doi-org.remotexs.ntu.edu.sg/10.54499/PTDC/CTA-AMB/0592/2021) 프로젝트의 프레임워크 하에서 Fundação Portuguesa para a Ciência e Tecnologia(FCT IP)의 지원을 받았습니다. 우리는 FCT/MCTES(각각 UIDB/04378/2020 및 UIDB/50006/2020)의 국가 기금으로 자금을 지원받는 UCIBIO(Applied Molecular Biosciences Unit) 및 LAQV(Associated Laboratory for Green Chemistry Research Unit)의 지원을 받는 BioLab과 i4HB (LA/P/0140/2020)를 인정합니다. 또한 유럽연합 집행위원회(European Commission)는 글리코(GLYCOTwining) 프로젝트(그랜트 계약 제101079417호)를, FCT는 이노글리코(InnoLico, 2022.04607.PTDC)를 통해 지원을 받았습니다. Isa Marmelo는 또한 박사 학위 수여 (2020.04413.BD, https://doi-org.remotexs.ntu.edu.sg/10.54499/2020.04413.BD)에 대해 FCT I.P.를 인정합니다.
자료
| Name | Company | Catalog Number | Comments |
| Air Stones | N/A | N/A | |
| Aquafeed | SPAROS, Lda., Portugal | N/A | High-quality diet |
| Automatic Cell Counting Equipment | NanoEnteK, Korea | N/A | EVE automatic cell counter (NanoEnteK) |
| Automatic Water Refrigeration Systems | Foshan Weinuo Refrigeration Equipment Co., Ltd, China | N/A | |
| Bio balls 1.5" Aquarium Pond Filter | TMC Iberia, Portugal | N/A | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich, Germany | A7906 | |
| Bucket (3 L) | N/A | N/A | To prepare and carry out euthanasia |
| Buckets (5 L) | N/A | N/A | To transport the animals |
| Cell Strainers | Jetbiofil, China | CSS-013-100 | Cell Strainer, 100 μm nylon mesh, Sterile, Yellow |
| Centrifugue | Fisher Scientific, Germany | N/A | accuSpin Micro 17 R |
| Colorimetric Test Kit for Ammonia (NH4+/NH3) | Tropic Marin, USA | N/A | |
| Colorimetric Test Kit for Nitrate (NO3-) | Tropic Marin, USA | N/A | |
| Colorimetric Test Kit for Nitrite (NO2-) | Tropic Marin, USA | N/A | |
| Computer | N/A | N/A | To acquire and analyse the data obtained from the flow cytometer |
| Computerized Control System (Profilux) | GHL, Germany | N/A | ProfiLux 3 Outdoor |
| Deionized water | N/A | N/A | To clean the Flow Cytometer |
| Density Gradient Medium: Percoll | Cytiva, Sigma-Aldrich, Germany | 17-0891-01 | |
| Digital scale | KERN & Sohn GmbH, Germany | N/A | KERN EMS 300-3 |
| Ethanol 70% | Millipore, Supelco, Portugal | EX0281 | To keep the workspace clean |
| EVE Cell Counting Slides | NanoEnteK, Korea | N/A | |
| Falcon Tubes (15 mL) | pluriSelect Life Science, Germany | 05-00002-01 | Sterile |
| Filter bag | TMC Iberia, Portugal | N/A | 400 micron |
| Filter Sponge | N/A | N/A | |
| Flow Cytometer | ThermoFisher Scientific, USA | N/A | Attune flow cytometer |
| FlowJo v10.8.1 Software | BD Life Sciences | N/A | |
| Formaldehyde 37% | Sigma-Aldrich, Germany | 8.18708 | |
| Glass Wool | N/A | N/A | |
| Hanks' Balanced Salt Solution | Merck Life Science S.L, Portugal | H6648 | Modified, with sodium bicarbonate, without phenol red, calcium chloride and magnesium sulfate, liquid, sterile-filtered, suitable for cell culture |
| LIVE/DEAD Fixable Dead Cell Stain Kits | Life Technologies Europe, Netherlands | L10119 | Near-IR fluorescent reactive dye + DMSO |
| Main Water Pumps | EHEIM, Germany | Universal 1200 | |
| Microcentrifuge Tubes (2 mL) | BRAND, Merck, Germany | Z628034 | Sterile |
| Micropipette Tips | Sartorius, Germany | 790010, 790200, 791000 | Compatible with Sartorius, 1-10 µL, 2-20 µL, 20-200 µL, 100-1000 µL |
| Micropipettes | Sartorius, Germany | 728020, 728030, 728060, 728070 | Sartorius ProlinePlus 1-10 µL, 2-20 µL, 20-200 µL, 100-1000 µL |
| Mini Cell Strainers | pluriSelect Life Science Global Headoffice, Germany | 43-10100-50 | PluriStrainer 100 µm nylon mesh, Sterile |
| Multi-Parameter Measuring Instrument | WTW, Germany | Multi 3420 SET G + IDS digital conductivity cell (TetraCon 925) + Optical IDS DO sensor (FDO 925) + IDS pH-electrode (SenTix 940) | |
| Pasteur Pipettes (1 mL, 5 mL) | Humeau Expert du laboratoire, France | 248295 | Sterile |
| Petri dishes | Sarstedt, Germany | 82.1194.500 | 60 x 15 mm, Polystyrene, Sterile |
| pH Meter | Hanna Instruments Inc., Romania | HANNA HI2211 | |
| Polystyrene round-bottom Falcon tubes (5 mL) | Fisher Scientific, Germany | 14-959-2A | Sterile |
| Portable Precision Thermometer | Ebro Electronic, Germany | N/A | TFX 430 |
| Protein Skimmers | Mantis | N/A | Tornado 120 |
| Quality control beads/Performance test beads | Thermofisher Scientific, USA | N/A | |
| Quarantine Tanks | N/A | N/A | Tanks with 660 L total volume |
| Rectangular Glass Tanks/Aquariums | N/A | N/A | Tanks with 200 L total volume |
| Refrigerator | N/A | N/A | To store the samples at 4 °C |
| Ruler 30 cm | N/A | N/A | To measure the fish's length |
| Sodium bicarbonate | Honeywell Fluka, Germany | 31437 | Sodium hydrogen carbonate (NaHCO3) |
| Sodium chloride | Sigma-Aldrich, Germany | S9888 | |
| Sterile Dissection Tools | N/A | N/A | (e.g. scalpel, scissors, fine-tipped forceps, dissecting tray/board) |
| Submerged Digital Heaters | TMC Iberia, Portugal | 300 W, V2Therm Digital Heaters | |
| Syringes 1 mL | IVFSTORE, USA | 8300014579-MEA | Sterile, HSW Soft-Ject Syringes to macerate head-kidney |
| Temperature Sensors | GHL, Germany | PT 1000 | |
| Tricaine (MS-222) | ThermoFisher Scientific, Germany | 118000500 | Ethyl 3-aminobenzoate, methanesulfonic acid salt, 98% (C10H15NO5S) |
| Ultraviolet Water Sterilizer | EHEIM, Germany | 5305010 | ClearUVC-36 |
| Water Bath | Fisher Scientific, Germany | N/A | Fisherbrand IsotempTM (P/N U01318) |
| Water-resistant Luminaires | N/A | N/A |
참고문헌
- Samaï, H.C. et al. Procedures for leukocytes isolation from lymphoid tissues and consequences on immune endpoints used to evaluate fish immune status: A case study on roach (Rutilus rutilus). Fish Shellfish Immunol. 74, 190-204 (2018).
- Mokhtar, D. M., Zaccone, G., Alesci, A., Kuciel, M., Hussein, M. T., Sayed, R. K. A. Main components of fish immunity: An overview of the fish immune system. Fishes. 8 (2), 93 (2023).
- Lulijwa, R. et al. Characterisation of Chinook salmon (Oncorhynchus tshawytscha) blood and validation of flow cytometry cell count and viability assay kit. Fish Shellfish Immunol. 88, 179-188 (2019).
- Uribe, C., Folch, H., Enriquez, R., Moran, G. Innate and adaptive immunity in teleost fish: a review. Vet Med. 56 (10), 486-503 (2011).
- Bjørgen, H., Koppang, E. O. Anatomy of teleost fish immune structures and organs. Immunogenetics. 73 (1), 53-63 (2021).
- Santos, R. A. et al. In vitro modulation of gilthead seabream (Sparus aurata L.) leukocytes by Bacillus spp. extracellular molecules upon bacterial challenge. Fish Shellfish Immunol. 121, 285-294 (2022).
- Witeska, M., Kondera, E., Ługowska, K., Bojarski, B. Hematological methods in fish - Not only for beginners. Aquaculture. 547, 737498 (2022).
- Titus, J. et al. Development and validation of a flow cytometry method to examine circulating leukocyte subpopulations in barramundi (Lates calcarifer). Comp Immunol Rep. 6, 200142 (2024).
- Marmelo, I. et al. Eco-innovative aquafeeds biofortified with Asparagopsis taxiformis to improve the resilience of farmed white seabream (Diplodus sargus) to marine heatwave events. Heliyon. 10 (15), e35135 (2024).
- Seibel, H., Baßmann, B., Rebl, A. Blood Will Tell: What Hematological Analyses Can Reveal About Fish Welfare. Front Vet Sci. 8, 616955 (2021).
- Franke, A., Beemelmanns, A., Miest, J. J. Are fish immunocompetent enough to face climate change? Biol Lett. 20 (2), 20230346 (2024).
- Fazio, F. Fish hematology analysis as an important tool of aquaculture: A review. Aquaculture. 500, 237-242 (2019).
- Fazio, F., Saoca, C., Costa, G., Zumbo, A., Piccione, G., Parrino, V. Flow cytometry and automatic blood cell analysis in striped bass Morone saxatilis (Walbaum, 1792): A new hematological approach. Aquaculture. 513, 734398 (2019).
- Lulijwa, R., Alfaro, A. C., Merien, F., Meyer, J., Young, T. Advances in salmonid fish immunology: A review of methods and techniques for lymphoid tissue and peripheral blood leucocyte isolation and application. Fish Shellfish Immunol. 95, 44-80 (2019).
- Esteban, M. Á., Muñoz, J., Meseguer, J. Blood cells of sea bass (Dicentrarchus labrax l.). Flow cytometric and microscopic studies. Anat Rec. 258 (1), 80-89 (2000).
- Inoue, T., Moritomo, T., Tamura, Y., Mamiya, S., Fujino, H., Nakanishi, T. A new method for fish leucocyte counting and partial differentiation by flow cytometry. Fish Shellfish Immunol. 13 (5), 379-390 (2002).
- Ye, R. R. et al. Immune competence assessment in marine medaka (Orzyias melastigma)-a holistic approach for immunotoxicology. Environ Sci Pollut Res. 24 (36), 27687-27701 (2017).
- American Veterinary Medical Association. AVMA Guidelines for the Euthanasia of Animals: 2020 Edition. American Veterinary Medical Association, Schaumburg, IL (2020).
- FlowJoTM Software (for Windows). Version v10.8.1 (BD Life Sciences). At < https://www.bdbiosciences.com/en-us/products/software/flowjo-v10-software> (2023).
- Mhalhel, K. et al. Review on Gilthead Seabream (Sparus aurata) aquaculture: Life cycle, growth, aquaculture practices and challenges. J Mar Sci Eng. 11 (10), 2008 (2023).
- Toni, M., Manciocco, A., Angiulli, E., Alleva, E., Cioni, C., Malavasi, S. Review: Assessing fish welfare in research and aquaculture, with a focus on European directives. Animal. 13 (1), 161-170 (2018).
- Kır, M. Thermal tolerance and standard metabolic rate of juvenile gilthead seabream (Sparus aurata) acclimated to four temperatures. J Therm Biol. 93, 102739 (2020).
- Esteban, M. Á, Meseguer, J. Phagocytic defence mechanism in sea bass (Dicentrarchus labrax L.): An ultrastructural study. Anat Rec. 240 (4), 589-597 (1994).
- Esteban, M. Á., Mulero, V., Muñoz, J., Meseguer, J. Methodological aspects of assessing phagocytosis of Vibrio anguillarum by leucocytes of gilthead seabream (Sparus aurata L.) by flow cytometry and electron microscopy. Cell Tissue Res. 293 (1), 133-141 (1998).
- Rodríguez, A., Esteban, M. Á., Meseguer, J. Phagocytosis and peroxidase release by seabream (Sparus aurata L.) leucocytes in response to yeast cells. Anat Rec A Discov Mol Cell Evol Biol. 272 (1), 415-423 (2002).
- Hamoutene, D., Payne, J. F., Volkoff, H. Effects of tebufenozide on some aspects of lake trout (Salvelinus namaycush) immune response. Ecotoxicol Environ Saf. 69 (2), 173-179 (2007).
- Pierrard, M.-A., Roland, K., Kestemont, P., Dieu, M., Raes, M., Silvestre, F. Fish peripheral blood mononuclear cells preparation for future monitoring applications. Anal Biochem. 426 (2), 153-165 (2012).
- Guardiola, F. A., Logothetis, P., Meseguer, J., Esteban, M. Á. Evaluation of silver nanospheres on viability and innate cellular parameters of gilthead seabream (Sparus aurata L.) head-kidney leucocytes. Fish Shellfish Immunol. 69, 99-107 (2017).
- Campos-Sánchez, J. C., Guardiola, F. A., Esteban, M. Á. In vitro effects of cantharidin on gilthead seabream (Sparus aurata) head-kidney leucocytes. Fish Shellfish Immunol. 123, 20-35 (2022).
- Korytář, T., Dang Thi, H., Takizawa, F., Köllner, B. A multicolour flow cytometry identifying defined leukocyte subsets of rainbow trout (Oncorhynchus mykiss). Fish Shellfish Immunol. 35 (6), 2017-2019 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유