Method Article
Aislamiento, fijación y caracterización de leucocitos juveniles de dorada y riñón por citometría de flujo
En este artículo
Resumen
Este manuscrito describe el aislamiento y la fijación de leucocitos extraídos del riñón de cabeza de dorada y la evaluación de su viabilidad mediante citometría de flujo. Este trabajo contribuye a la estandarización de protocolos y aprovecha el procesamiento de un mayor número de muestras sin comprometer la calidad de la muestra, promoviendo avances en el conocimiento de la inmunología de peces.
Resumen
La inmunidad es crucial para la regulación fisiológica de los organismos, ya que sirve como defensa principal contra patógenos y factores estresantes ambientales. El aislamiento y el análisis de las células inmunitarias proporcionan información clave sobre las respuestas inmunitarias a las presiones externas. Sin embargo, la falta de protocolos armonizados para las especies menos estudiadas, como los peces marinos, a menudo conduce a desafíos técnicos y analíticos que dificultan la interpretación de los datos y una comprensión profunda de las respuestas inmunitarias específicas de las especies. Este estudio tuvo como objetivo establecer un procedimiento analítico optimizado basado en citometría de flujo para caracterizar y determinar la viabilidad de los leucocitos del riñón de cabeza (el principal órgano hematopoyético en los peces teleósteos) de dorada juvenil (Sparus aurata). El procedimiento comenzó con el aislamiento de leucocitos a través de un proceso de homogeneización utilizando la solución salina balanceada de Hanks, seguido de un método optimizado de centrifugación en gradiente de densidad de Percoll para garantizar altas tasas de recuperación de leucocitos con una contaminación eritrocitaria mínima requerida para un análisis eficiente de citometría de flujo posterior. Además, se empleó una técnica novedosa que utiliza un colorante reactivo a las células (LIVE/DEAD Fixable Dead Cell Stain Kit) para distinguir las células viables de las muertas en función de sus patrones de tinción fluorescentes. La fijación se logró con formaldehído al 3,7%, preservando la morfología celular, la viabilidad y la eficiencia de la tinción. El análisis de citometría de flujo identificó con éxito tres poblaciones de leucocitos predominantes: linfocitos, monocitos y granulocitos. Este método no solo permitió realizar pruebas de viabilidad, sino también la diferenciación precisa de los tipos de células. La mejora en los protocolos de citometría de flujo representa un paso adelante en la inmunología de peces al aumentar la precisión y la eficiencia del análisis de células inmunitarias. Además, al permitir la fijación de células para su posterior análisis, este protocolo reduce significativamente el tiempo y el esfuerzo necesarios para las evaluaciones inmunitarias, lo que lo convierte en una herramienta valiosa tanto para la investigación como para aplicaciones prácticas en diversos campos de investigación.
Introducción
La inmunidad desempeña un papel central en la regulación fisiológica de los organismos, actuando como defensa primaria contra una amplia gama de patógenos y factores de estrés ambiental1. Al igual que otros vertebrados, los peces tienen un sistema inmunológico complejo, dinámico y coordinado esencial para su saludy bienestar general.
Los peces teleósteos poseen sistemas inmunológicos innatos y adaptativos, que funcionan simultáneamente para detectar, responder y neutralizara los invasores dañinos. El sistema inmunitario innato actúa como la primera línea de defensa, proporcionando respuestas inmediatas e inespecíficas a los patógenos2, mientras que el sistema inmunitario adaptativo se desarrolla con el tiempo, ofreciendo una respuesta más especializada que permite a los peces reconocer patógenos específicos y establecer la memoria inmunológica3. El sistema inmunitario de los peces depende de órganos linfoides primarios especializados (es decir, timo y riñón de la cabeza) y órganos linfoides secundarios (p. ej., bazo y tejidos linfoides asociados a la mucosa (MALT)) para apoyar la defensa inmunitaria y mantener la salud general4. El riñón de la cabeza es el principal órgano hematopoyético de los peces teleósteos y desempeña un papel crucial en el desarrollo y la maduración de las células inmunitarias, incluidos los leucocitos5.
En los últimos años, se han realizado avances significativos en el estudio de las respuestas inmunitarias de varias especies de peces2. Un área clave de enfoque ha sido la comprensión de las poblaciones de leucocitos y su actividad. Los leucocitos, también conocidos como glóbulos blancos, generalmente se clasifican en monocitos, linfocitos y granulocitos y juegan un papel crucial en la defensa inmune de los peces. Poseen células fagocíticas, que se engullen y destruyen los patógenos y liberan especies bactericidas reactivas de oxígeno, contribuyendo a la eliminación de los microorganismos invasores6. Los leucocitos también están involucrados en el proceso inflamatorio, ayudando a aislar y erradicar las infecciones, al tiempo que promueven la reparación de los tejidos6. La abundancia y la actividad de las poblaciones de leucocitos son indicadores importantes del estado inmunitario en la salud y la enfermedad de los animales 7,8.
Algunos estudios han demostrado que los factores de estrés, como las condiciones ambientales adversas, pueden alterar el número y la morfología de los eritrocitos y la composición de los leucocitos circulantes 9,10. Por ejemplo, como revisaron Franke et al. (2024), es crucial estudiar el sistema inmunológico de los peces en escenarios de cambio climático, ya que los factores de estrés ambiental pueden comprometer la inmunidad de los peces, aumentar la susceptibilidad a las enfermedades y mejorar la infectividad de ciertos patógenos, lo que en última instancia acelera la progresión de la enfermedad11. Además, comprender la inmunidad de los peces es esencial no solo para avanzar en la investigación biológica fundamental, sino también para apoyar a diversos sectores de la sociedad, como la industria acuícola. A medida que la acuicultura continúa expandiéndose a nivel mundial, garantizar la salud y el bienestar de las especies de peces de cultivo es cada vez más importante. Sin embargo, el bienestar de los peces sigue siendo un área de investigación relativamente nueva, y las respuestas inmunitarias de los peces de cultivo aún requieren evaluaciones exhaustivas y estandarizadas. Priorizar los estudios de respuesta inmune es de suma importancia, ya que la información adquirida puede mejorar la sostenibilidad y la productividad de la acuicultura a través de enfoques efectivos y personalizados que mejoran el bienestar y la resiliencia de los animales de granja.
La cuantificación e identificación de leucocitos se realiza generalmente mediante métodos hematológicos, como el recuento manual con hemocitómetros Bürker, Neubauer o Thoma, así como frotis de sangre teñidos 7,10. Para ayudar en la visualización y diferenciación de las células sanguíneas, a menudo se emplean kits de tinción, como Wright, May-Grünwald-Giemsa y Hemacolor 7,12. Sin embargo, estas técnicas de recuento manual de células son tediosas, lentas y propensas a errores humanos 8,10. Las fuentes comunes de error incluyen la mezcla o dilución inadecuada de la sangre, problemas de tinción y carga incorrecta de la cámara del hemocitómetro, todo lo cual puede conducir a recuentos celulares inexactos12. Además, el análisis hematológico manual requiere un alto nivel de conocimientos y experiencia para garantizar la fiabilidad y reproducibilidad de los resultados7. A medida que aumenta la demanda de herramientas de diagnóstico precisas y eficientes, el desarrollo de métodos innovadores que proporcionen una comprensión profunda del estado inmunológico de las poblaciones de peces se convierte en un paso cada vez más importante para avanzar en este campo.
La citometría de flujo se ha convertido en una herramienta poderosa en este contexto, ya que ofrece un enfoque cuantitativo de alto rendimiento para analizar las poblaciones de leucocitos y la viabilidad celular8. Esta moderna tecnología diagnóstica permite la rápida detección, recuento y caracterización de células individuales en poblaciones mixtas con una precisión notable13. Además, la citometría de flujo permite realizar mediciones multiparamétricas simultáneas tanto para la caracterización fenotípica como para la funcional. Aunque su uso está muy extendido en el ámbito clínico humano y en la medicina veterinaria, su aplicación en el estudio de los leucocitos de peces sigue siendo muy limitada8. Si bien se han realizado algunas investigaciones sobre diferentes especies de peces 1,6,8,13,14,15,16,17, aún deben abordarse varios desafíos críticos. Uno de los principales retos de estos análisis es la necesidad de obtener suspensiones de leucocitos vivos extraídos de sangre periférica o tejidos linfoides, como el riñón de la cabeza1. El aislamiento de los leucocitos suele ser difícil debido a una característica única de los peces teleósteos: la presencia de eritrocitos nucleados. La contaminación involuntaria con eritrocitos puede interferir con el análisis de leucocitos debido a su tamaño, forma ovoide y la presencia de un núcleo1. Por lo tanto, es imperativo eliminar los eritrocitos de las suspensiones de leucocitos para lograr una alta pureza de leucocitos y estudiar las características fenotípicas y funcionales de los leucocitos mediante análisis de citometría de flujo. En los mamíferos, el aislamiento de leucocitos suele implicar la lisis osmótica de los eritrocitos o la separación del gradiente de densidad con Ficoll o Percoll1. Sin embargo, la lisis osmótica es ineficaz tanto para los peces marinos como para los de agua dulce debido a sus eritrocitos nucleados, que no pueden ser lisados adecuadamente1. En cambio, se prefiere la separación en gradiente de densidad para los peces, ya que preserva eficazmente la estabilidad celular a lo largo del tiempo1. A pesar de que algunos estudios han logrado aislar leucocitos de peces juveniles, gran parte de la investigación todavía se centra principalmente en poblaciones adultas17. No obstante, las primeras etapas de la vida no solo son más vulnerables a los brotes de enfermedades, sino que también son más pequeñas, lo que hace que el proceso de muestreo sea más complejo y desafiante. Otra limitación es que los métodos actuales a menudo se restringen a un número limitado de muestras o réplicas a la vez, ya que la evaluación de la viabilidad de los leucocitos requiere un procesamiento inmediato. Los retrasos en el procesamiento de las muestras pueden afectar negativamente a la viabilidad celular, introduciendo así más complicaciones en el proceso de muestreo y poniendo en peligro todo el trabajo.
Hasta donde sabemos, ninguno de los métodos publicados ha fijado con éxito células leucocitarias para su posterior análisis de viabilidad mediante citometría de flujo. El presente estudio es pionero, ya que establece un método eficiente para aislar leucocitos del riñón de cabeza de dorada juvenil (Sparus aurata), la principal especie de pez cultivada en los países del sur de Europa, utilizando una metodología de separación en gradiente de densidad de Percoll. También presentamos una técnica mejorada basada en la tinción que discrimina las células vivas de las muertas mientras identifica las principales poblaciones de leucocitos (linfocitos, monocitos y granulocitos) a través de la citometría de flujo. El protocolo mejorado implica la fijación de células, lo que permite el análisis de células viables hasta 1 mes después del procedimiento. La implementación de este protocolo de citometría de flujo tiene el potencial de reducir significativamente el tiempo y el esfuerzo que normalmente se requieren para las evaluaciones inmunológicas, lo que la convierte en una técnica valiosa tanto para la investigación como para aplicaciones más prácticas dentro del sector de la acuicultura. La aplicación de esta metodología proporciona ventajas para analizar un gran número de muestras, preservar las células y permitir el análisis diferido por citometría de flujo. Por lo tanto, podría ser muy útil obtener información valiosa sobre los mecanismos inmunológicos de los peces y cómo la viabilidad celular se ve influenciada por diferentes condiciones ambientales o experimentales. Además, este ensayo de viabilidad puede integrarse con la caracterización fenotípica y funcional multiparamétrica de poblaciones específicas de células inmunitarias. Este enfoque permite un análisis más exhaustivo de varios parámetros inmunológicos, vinculándolos directamente a los tipos de células correspondientes y proporcionando una comprensión más clara de las respuestas inmunitarias. Estos hallazgos podrían contribuir al desarrollo de estrategias más efectivas, incluyendo mejores enfoques para el manejo de enfermedades en la acuicultura.
Protocolo
Este protocolo debe ser realizado por investigadores certificados en experimentación animal (funciones A y B de la UE). Todos los procedimientos relacionados con la manipulación de animales y la recogida de muestras deben cumplir con las directrices ARRIVE (Animal Research: Reporting of in vivo Experiments) y adherirse a las normas éticas para el cuidado y uso de animales de acuerdo con las recomendaciones de la Federación de Asociaciones Europeas de Ciencia de Animales de Laboratorio (FELASA). El presente estudio siguió todas estas normas, así como la legislación portuguesa para la Ciencia de los Animales de Laboratorio (Directiva de la UE 2010/63; Decreto-Ley n.º 113/2013). La investigación fue aprobada por el Organismo de Ética y Bienestar Animal del IPMA (ORBEA, LABVIVOS-002-AquaClimAdapt), supervisado por la Autoridad Nacional para el Uso de Animales Vivos, conocida como Dirección General de Alimentación y Veterinaria (DGAV), con el número de autorización ética 20596/25-S.
1. Modelo de estudio y mantenimiento de los organismos
NOTA: Este estudio fue diseñado específicamente para doradas juveniles (Sparus aurata), con un peso promedio de 30.0 ± 5.0 g y una longitud total de 12.0 ± 2.0 cm. Es posible que este método no se aplique directamente a otras especies de peces, ya que las diferentes especies tienen características fisiológicas e inmunológicas únicas que pueden afectar el aislamiento de leucocitos, la fijación celular y la evaluación de la viabilidad. Es posible que se requieran adaptaciones al protocolo para otras especies, y se recomiendan estudios preliminares para optimizar las condiciones para cada especie objetivo.
- Aclimatar a los peces (Período de Cuarentena)
- Distribuya los peces de manera equitativa en tanques de gran capacidad (por ejemplo, dos tanques con una capacidad total de 660 L cada uno - ver Figura 1 suplementaria).
NOTA: Los tanques a utilizar pueden ser parte de un Sistema de Acuicultura de Recirculación (RAS), lo que permite un uso eficiente del agua y un mejor control sobre la calidad del agua. En un RAS, el agua se recicla y trata continuamente dentro del sistema, proporcionando un entorno estable y controlado para los peces. Esta configuración ayuda a mantener las condiciones óptimas para la salud y el crecimiento de los peces, asegurando una distribución uniforme y minimizando el estrés durante el estudio. - Mantener condiciones abióticas óptimas.
- Mantenga a los peces en cuarentena durante 3 semanas en condiciones que imiten su hábitat natural:
temperatura: 20,0 ± 0,5 °C;
oxígeno disuelto: 7,2 ± 0,2 mg/L;
salinidad: 35,0 ± 0,5 ‰;
pH: 8,0 ± 0,1 unidades;
Fotoperiodo: 14 h luz/10 h oscuridad.
NOTA: Las condiciones ideales de mantenimiento pueden variar entre las diferentes especies de peces. Otras especies pueden tener requisitos diferentes, por lo que es importante adaptar estas condiciones a las necesidades específicas de la especie objetivo para garantizar la salud y el bienestar de los organismos. Además, la temperatura del agua de mar y el fotoperiodo pueden cambiar con las estaciones, por lo que se deben tener en cuenta las variaciones estacionales al replicar las condiciones naturales en el laboratorio.
- Mantenga a los peces en cuarentena durante 3 semanas en condiciones que imiten su hábitat natural:
- Distribuya los peces de manera equitativa en tanques de gran capacidad (por ejemplo, dos tanques con una capacidad total de 660 L cada uno - ver Figura 1 suplementaria).
- Iniciar el estudio experimental.
- Defina el número de tanques y peces necesarios en función del diseño de configuración experimental de cada estudio de caso.
- Después del período de cuarentena, transfiera los peces a un SRA independiente (véase la Figura complementaria 2).
- Equipe cada sistema con desnatadores de proteínas para eliminar el exceso de compuestos orgánicos del agua; filtración física (bolsa filtrante [400 μm], esponja filtrante y lana de vidrio); filtración biológica (bolas biológicas [1,5"], esterilizador de agua ultravioleta y piedras de aire sumergidas); sistemas automáticos de refrigeración de agua de mar y calentadores digitales sumergidos, ambos conectados a un sistema de control computarizado (ProfiLux) con sensores de temperatura para ajustar la temperatura en cada tanque; Piedras de aire sumergidas en cada tanque para controlar el oxígeno disuelto.
- Aclimatar a los peces durante 2 semanas en los nuevos sistemas antes de continuar con el experimento.
- Realizar el mantenimiento diario
- Retire las heces de los peces de cada tanque de incubación y realice una renovación del 25% del agua de mar.
- Mida la temperatura con un termómetro de precisión portátil.
- Monitoree otros parámetros abióticos del agua de mar (salinidad, oxígeno disuelto y pH) utilizando un instrumento de medición multiparamétrico.
- Ajuste los parámetros abióticos del agua de mar según sea necesario para garantizar la estabilidad durante todo el experimento.
NOTA: Las condiciones abióticas en los sistemas experimentales pueden variar dependiendo de los requerimientos específicos de cada caso de estudio. Por ejemplo, si el estudio tiene como objetivo simular cambios estacionales u olas de calor marinas, la temperatura y el fotoperíodo deben ajustarse en consecuencia para imitar las variaciones estacionales naturales. Del mismo modo, si el estudio se centra en simular condiciones hipóxicas o acidificación de los océanos, se deben realizar ajustes en los niveles de oxígeno y el pH del agua de mar. Esto garantiza que las condiciones experimentales sean lo más realistas y relevantes posible, lo que mejora la validez y aplicabilidad de los hallazgos del estudio. - Evaluar la salud y el bienestar de los peces, identificando y gestionando los signos de estrés o enfermedad descritos en los pasos 1.2.4.6-1.2.4.8.
- Busque comportamientos anormales como natación errática, pérdida de apetito, letargo, agresión o aislamiento.
- Compruebe si hay signos de enfermedad, como lesiones, úlceras, decoloración, aletas pinzadas, mucosidad excesiva o movimiento rápido de las branquias.
- Registre todas las observaciones, anotando la fecha y las acciones tomadas.
- Realizar pruebas semanales de la calidad del agua.
- Mida los niveles de amoníaco (NH3/NH4), nitrito (NO2-) y nitrato (NO3-) mediante pruebas colorimétricas.
NOTA: Asegúrese de que todos estos parámetros estén por debajo de los niveles detectables. Si los niveles exceden los límites, realice un cambio de agua adicional, aumente la aireación o ajuste la filtración.
- Mida los niveles de amoníaco (NH3/NH4), nitrito (NO2-) y nitrato (NO3-) mediante pruebas colorimétricas.
- Alimentar y monitorear la nutrición de los peces.
- Proporcionar una dieta de alta calidad que satisfaga los requisitos nutricionales específicos de los peces juveniles (véase la Tabla Suplementaria 1 para ver un ejemplo de la composición detallada de la dieta).
NOTA: Asegúrese de que el tamaño de los pellets de alimento acuícola (2-3 mm) sea adecuado para los juveniles, facilitando la ingestión y la digestión. - Ajuste la cantidad de alimento para que corresponda al 2% del peso corporal promedio de los peces por día.
- Alimente a los peces manualmente dos veces al día, una por la mañana y otra por la tarde (establezca un horario específico para mantener una rutina de alimentación estable).
- Proporcionar una dieta de alta calidad que satisfaga los requisitos nutricionales específicos de los peces juveniles (véase la Tabla Suplementaria 1 para ver un ejemplo de la composición detallada de la dieta).
2. Toma de muestras de pescado, eutanasia, disección y recolección de riñón de la cabeza
- Pruebe los peces de los tanques.
- Seleccione los peces al azar de los tanques para evitar el sesgo de muestreo.
- Use una red para transferir suavemente los peces a un recipiente temporal lleno de agua del tanque.
NOTA: Minimice el tiempo de manipulación para reducir el estrés.
- Prepara la solución de eutanasia.
- Utilice un recipiente adecuado (por ejemplo, un cubo de 3 L) adecuado para guardar el pescado.
- Disuelva la cantidad apropiada de Tricaína (MS-222) en agua de mar para lograr una concentración final de 200-300 mg/L18 (PRECAUCIÓN Ver Tabla Suplementaria 2 y Archivo Suplementario 1).
- Tampones la solución con bicarbonato de sodio hasta un pH de 7,2-7,5.
- Administrar la solución de eutanasia.
- Coloque los peces en la solución de eutanasia durante al menos 10 minutos o hasta que se observe el cese del movimiento opercular y la pérdida de reflejos (confirme la eutanasia comprobando que no haya respuesta a estímulos externos).
- Registre el peso corporal (g) y la longitud total (cm) del pez.
- Realiza la disección de peces.
NOTA: Para garantizar una calidad óptima de la muestra y la viabilidad celular, el proceso de disección debe completarse lo más rápido posible, idealmente dentro de los 5 minutos posteriores a la eutanasia.- Asegúrese de que la temperatura del laboratorio se mantenga a 19 °C utilizando aire acondicionado para minimizar las fluctuaciones durante el muestreo y el procesamiento.
- Esterilice las herramientas de disección (preferiblemente instrumentos metálicos en autoclave siempre que sea posible) y establezca un espacio de trabajo limpio con etanol al 70% (ATENCIÓN, consulte la Tabla complementaria 2).
- Coloque el pez sacrificado de lado en una bandeja de disección estéril con la cabeza apuntando hacia la mano no dominante.
- Con un bisturí, haga una incisión cuidadosa a lo largo de la línea media ventral del pez desde la cloaca (ano) hasta las branquias.
NOTA: Tenga cuidado de no cortar demasiado profundo para evitar dañar los órganos internos. - Use con cuidado las tijeras de disección para extender la incisión y exponer los órganos internos. Levante suavemente las solapas de la pared del cuerpo para proporcionar una visión clara de la anatomía interna.
- Localice el riñón de la cabeza: El riñón de la cabeza se coloca justo detrás de las branquias, cerca de la región dorsal anterior de la cavidad corporal, y se extiende a lo largo de la parte superior de la cavidad corporal, debajo de la columna vertebral.
NOTA: El riñón de la cabeza suele ser de color más oscuro en comparación con los tejidos circundantes (Figura 1). - Limpie con cuidado cualquier tejido circundante, como la grasa y el tejido conectivo, para visualizar mejor la cabeza del riñón.
NOTA: Este paso requiere un manejo delicado para evitar dañar el riñón de la cabeza. - Con pinzas y tijeras de punta fina, levante con cuidado el riñón de la cabeza y haga cortes precisos alrededor de él para liberarlo de los tejidos circundantes.
NOTA: Manipule el pañuelo con cuidado para evitar daños. En un pez que pesa aproximadamente 30 g, se espera que el riñón de la cabeza pese alrededor de 20-30 mg. - Coloque inmediatamente el órgano extirpado en un filtro de células (malla de nailon de 100 μm) dentro de una placa de Petri estéril para garantizar la esterilidad y facilitar los pasos de procesamiento posteriores.
NOTA: A partir de este punto, todos los pasos deben realizarse lo más rápido posible (dentro de los 5 minutos) para mantener la viabilidad de la célula. Para mantener la muestra fría, realice los siguientes pasos con la placa de Petri colocada en un recipiente lleno de hielo y cubierto con papel de aluminio.

Figura 1: Posición del riñón de cabeza: (A) Ilustración que representa la ubicación típica del riñón de cabeza detrás de las branquias y a lo largo de la región dorsal anterior de la cavidad corporal; (B) Imagen representativa de la cabeza del riñón en el besugo, enfatizando su coloración más oscura en comparación con los tejidos circundantes. Haga clic aquí para ver una versión más grande de esta figura.
3. Aislamiento de leucocitos renales de cabeza (Figura 2)
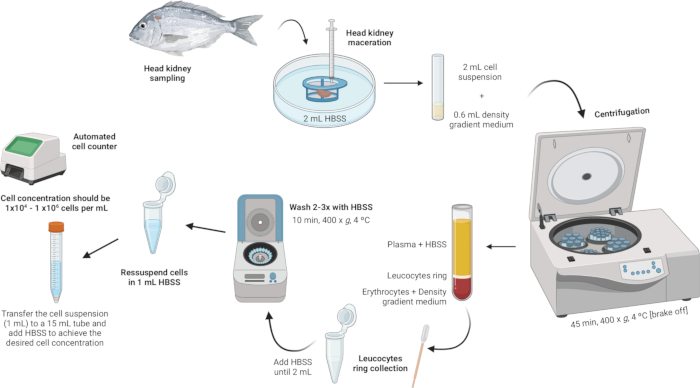
Figura 2: Descripción ilustrativa del aislamiento de leucocitos del riñón de cabeza. El protocolo implica varios pasos: comenzando con la homogeneización del tejido, seguido de la centrifugación en gradiente de densidad, la recolección del anillo de leucocitos, el lavado del anillo de leucocitos y concluyendo con la resuspensión y el ajuste de la concentración celular. Haga clic aquí para ver una versión más grande de esta figura.
- Homogeneizar el tejido.
- Coloque 2 ml de solución salina equilibrada (HBSS) de Hanks en una placa de Petri estéril.
- Asegúrese de que la malla del filtro de células (malla de nailon de 100 μm) esté en contacto con el HBSS, pero no esté completamente sumergida.
- Macerar el riñón de la cabeza en el filtro de células con el émbolo de una jeringa. Aplique una presión suave para forzar los fragmentos del órgano a través de la malla de nailon, creando una suspensión celular.
NOTA: Si se procesan varias muestras, la placa de Petri que contiene la suspensión celular se puede almacenar en el refrigerador a 4 °C durante unos minutos hasta el siguiente paso. Esta suspensión celular se utilizará para el aislamiento de leucocitos.
- Realizar centrifugación en gradiente de densidad.
- Prepare una solución de medio de gradiente de densidad con una densidad de 1,077 g/mL, una osmolaridad de 353 mOsm/kg y un pH de 7,4 (ver Archivo Suplementario 1).
NOTA: La osmolaridad puede variar entre las diferentes especies de peces, por lo que es crucial ajustar la osmolaridad de la solución del medio de gradiente de densidad para cumplir con los requisitos específicos de cada especie. - En tubos de poliestireno de fondo redondo de 5 mL, agregue con cuidado 600 μL de la solución de medio de gradiente de densidad.
- Tome la suspensión celular (2 mL) y agréguela lentamente al tubo que contiene el medio de gradiente de densidad. La primera gota es crucial: agréguela muy suavemente para evitar desestabilizar la fase media del gradiente de densidad.
NOTA: Esto debe hacerse en una proporción de 3:10 (medio de gradiente de densidad: suspensión de celdas). Utilice una pipeta Pasteur estéril de 1 mL para una adición precisa y suave. Asegúrese de que la punta de la pipeta toque el lateral del tubo para evitar alterar la capa media del gradiente de densidad. Evite mezclar la muestra con el medio de gradiente de densidad. - Centrifugar los tubos a 400 x g durante 45 min a 4 °C con el freno apagado. Esto asegura que las capas permanezcan intactas durante el proceso.
NOTA: Después de la centrifugación, deben verse capas distintas. Los leucocitos formarán un anillo en la interfaz entre el medio de gradiente de densidad y la pastilla de desechos celulares (Figura 3).
- Prepare una solución de medio de gradiente de densidad con una densidad de 1,077 g/mL, una osmolaridad de 353 mOsm/kg y un pH de 7,4 (ver Archivo Suplementario 1).

Figura 3: Los leucocitos suenan en la interfaz entre el medio de gradiente de densidad y la pastilla de desechos celulares. Haga clic aquí para ver una versión más grande de esta figura.
- Recoge el anillo de leucocitos.
- Con una pipeta Pasteur estéril, aspire suavemente el anillo leucocitario (~100 μL) y transfiéralo a un tubo de microcentrífuga de 2 mL.
NOTA: Tenga cuidado de no alterar significativamente las capas para evitar la contaminación. Si el anillo de leucocitos parece contener residuos o suspensiones oscuras, es aconsejable pasar la suspensión de leucocitos recolectada a través de un nuevo filtro de mini células (100 μm) para garantizar la pureza. Coloque el mini filtro de células sobre el tubo de microcentrífuga de 2 ml y transfiera suavemente la suspensión de leucocitos a través del filtro.
- Con una pipeta Pasteur estéril, aspire suavemente el anillo leucocitario (~100 μL) y transfiéralo a un tubo de microcentrífuga de 2 mL.
- Lavar el anillo leucocitario.
- Agregue HBSS a los tubos de microcentrífuga que contienen el anillo leucocitario hasta que el volumen alcance los 2 ml y vuelva a suspender suavemente las células.
NOTA: Mantenga los tubos en un recipiente lleno de hielo y cubierto con papel de aluminio para mantener la muestra a baja temperatura. Asegúrese de que los tubos no entren en contacto directo con el hielo. Mantenga esta configuración de enfriamiento durante todo el proceso de lavado. - Centrifugar las muestras a 400 × g durante 10 min a 4 °C (se puede poner el freno).
- Después de la centrifugación, deseche con cuidado el sobrenadante, dejando el pellet en el fondo (que puede ser casi invisible).
- Repita los pasos de lavado (agregar HBSS, resuspender, centrifugar y desechar el sobrenadante) hasta que el pellet esté libre de impurezas.
- Agregue HBSS a los tubos de microcentrífuga que contienen el anillo leucocitario hasta que el volumen alcance los 2 ml y vuelva a suspender suavemente las células.
- Resuspender y ajustar la concentración celular.
- Vuelva a suspender las células en 1 mL de HBSS dentro de los mismos tubos de microcentrífuga de 2 mL utilizados para los lavados.
- Lograr una concentración celular entre 1 × 104 y 1 × 106 células por mL. Si el gránulo inicial es grande, es posible que se requiera HBSS adicional para diluir la concentración celular al rango deseado. Transfiera la suspensión celular a un tubo de 15 mL y agregue más HBSS según sea necesario en función de los recuentos celulares obtenidos.
NOTA: Se recomienda el uso de un contador de celdas automatizado para facilitar el proceso.
4. Tinción y fijación de leucocitos (Figura 4)
NOTA: Los kits de tinción de células muertas fijables LIVE/DEAD proporcionan un método mejorado para evaluar la viabilidad celular en células fijas mediante citometría de flujo. Estos ensayos utilizan un tinte reactivo fluorescente que interactúa con las aminas celulares. Si las membranas celulares están comprometidas, el tinte puede penetrar en las células, reaccionando con aminas libres tanto en el interior como en la superficie celular, lo que resulta en una intensa tinción fluorescente. Por el contrario, en las células viables, solo las aminas de la superficie celular están disponibles para reaccionar con el colorante, lo que lleva a una tinción relativamente tenue. La intensidad de la tinción se mantiene después de la fijación con formaldehído, que también preserva la muestra al evitar el crecimiento de microorganismos. Los kits de tinción de células muertas reparables LIVE/DEAD son idénticos, excepto por el tinte fluorescente, disponible en azul, violeta, aguamarina, amarillo, verde, rojo, rojo lejano o infrarrojo cercano (infrarrojo). En este estudio, utilizamos el colorante reactivo fluorescente Near-IR. Además, este ensayo de un solo color permite probar otros parámetros en paralelo en un experimento multicolor.
- Prepara el tinte.
- Lleve los reactivos a temperatura ambiente (RT): Permita que un vial del tinte reactivo fluorescente y el vial de dimetilsulfóxido anhidro (DMSO) alcancen el RT antes de retirar las tapas.
- Reconstituya el colorante: Agregue 50 μL de DMSO al vial que contiene el colorante reactivo. Mezcle bien y asegúrese de que el tinte se haya disuelto por completo.
- Utilice la solución de tinte reconstituida lo antes posible, preferiblemente dentro de unas pocas horas.
NOTA: Cada kit incluye cinco viales individuales de colorante reactivo, lo que proporciona suficiente material para teñir al menos 40 muestras de células. Sin embargo, después de la reconstitución, la solución de DMSO del tinte es relativamente inestable, particularmente cuando se expone a la humedad. Las porciones no utilizadas pueden almacenarse hasta 2 semanas a ≤-20 °C, protegidas de la luz y la humedad.
- Tiñe y fija las células.
NOTA: Los tampones adecuados para la tinción celular incluyen la solución salina equilibrada de Hanks (HBSS), la solución salina tamponada con fosfato (PBS) y el PBS (D-PBS) de Dulbecco, siempre que no contengan proteínas extrañas como la albúmina sérica bovina o el suero. Cuando utilice un tinte amino-reactivo, evite los tampones Tris y las soluciones con azida de sodio o proteínas extrañas para la resuspensión y el lavado celular. En este estudio, utilizamos HBSS debido a su composición iónica equilibrada, que ayuda a mantener el equilibrio osmótico y proporciona iones esenciales y glucosa para apoyar el metabolismo celular y la viabilidad durante el proceso de tinción. El HBSS también está libre de proteínas extrañas, lo que evita la interferencia con el colorante reactivo y garantiza una evaluación precisa de la viabilidad.- Después de contar las células y ajustar la densidad a 1 x 106 células por mL con HBSS, transfiera 1 mL de esta suspensión celular a tubos de microcentrífuga de 2 mL.
- Para cada día, inducir la muerte celular en al menos una muestra que se utilizará como control para establecer el umbral de intensidad de fluorescencia entre las células vivas y las muertas. Prepare las muestras en tubos de microcentrífuga de la siguiente manera:
Tubo 1: Células vivas sin teñir
Tubo 2: Células vivas - teñidas
Tubo 3: Células muertas sin teñir
Tubo 4: Células muertas - teñidas
NOTA: Estos cuatro tubos solo necesitan estar preparados para una sola muestra en cada experimento como controles. Para las muestras restantes, solo son necesarios dos tubos (Tubo 1: muestra - sin teñir y Tubo 2: muestra - teñida), ya que proporcionará información sobre las células que estaban vivas y las que estaban muertas.
- Para cada día, inducir la muerte celular en al menos una muestra que se utilizará como control para establecer el umbral de intensidad de fluorescencia entre las células vivas y las muertas. Prepare las muestras en tubos de microcentrífuga de la siguiente manera:
- Control positivo de la muerte celular: Colocar el tubo marcado Muerto sin teñir (Tubo 3) y Muerto teñido (Tubo 4) en un baño de agua a 50 °C durante 7 min para inducir la muerte celular mediante tratamiento térmico.
- Tinción de las células: Añadir 1 μL del colorante reactivo fluorescente reconstituido (del paso 4.1.2) a 1 mL de la suspensión celular en los tubos 2 y 4 (tubos que se van a teñir) y mezclar bien.
- Incubar en RT durante 30 min, protegido de la luz.
NOTA: Si la fijación no es necesaria, puede omitir los pasos 4.2.5-4.2.7 a continuación. En su lugar, lavar las células dos veces con 1 mL de HBSS con 1% de albúmina sérica bovina (ver Ficha Suplementaria 1) y resuspender en 1 mL de HBSS con 1% de albúmina sérica bovina. Realice el análisis en el citómetro de flujo lo más rápido posible; De lo contrario, la viabilidad de la célula puede verse comprometida ya que las células no son fijas. - Lave las células dos veces con 1 ml de HBSS y vuelva a suspender las células en 900 μl de HBSS.
- Añadir 100 μL de formaldehído al 37% (ATENCIÓN, ver Tabla Suplementaria 2).
- Incubar durante 15 min en RT.
- Lavar dos veces con 1 mL de HBSS con 1% de albúmina sérica bovina (BSA), luego resuspender las células en 1 mL de HBSS con 1% de BSA.
- Almacene las muestras en un refrigerador a 4 °C. Analice las células dentro de 1 mes después de la fijación.
- Analice la suspensión de células fijas mediante citometría de flujo utilizando el canal de excitación y detección adecuado.
NOTA: Los canales de excitación y detección correctos pueden diferir según el instrumento que se utilice (consulte la Tabla complementaria 3).
- Después de contar las células y ajustar la densidad a 1 x 106 células por mL con HBSS, transfiera 1 mL de esta suspensión celular a tubos de microcentrífuga de 2 mL.

Figura 4: Descripción ilustrativa de la tinción y fijación de leucocitos. Haga clic aquí para ver una versión más grande de esta figura.
5. Citometría de flujo
- Adquisición de datos.
NOTA: Los procedimientos a seguir en el citómetro de flujo pueden variar según el citómetro específico utilizado. En este estudio, los datos se adquirieron utilizando el citómetro de flujo Attune NTx.- Ejecute los ejemplos.
- Coloque el tubo de muestra en el puerto de muestra.
- Comience la adquisición presionando inicio y luego haga clic en grabar una vez que la tasa de eventos (eventos/segundo) se estabilice.
- Registre un mínimo de 10.000 eventos para cada muestra en la puerta de singletes para un análisis fiable.
- Guarde todos los datos de cada muestra y haga una copia de seguridad en unidades externas o almacenamiento en la nube.
- Analice los datos.
NOTA: Para el análisis de citometría de flujo, hay varias opciones de software disponibles. En este estudio, el análisis de los datos se realizó utilizando el FlowJo v10.8.119.- Cargar archivos de datos: inicie el software de análisis de citometría de flujo y cargue los archivos .fcs adquiridos del experimento.
- Visualice los datos (Figura 5A): Trace la dispersión hacia adelante (FSC-A) (XX) frente a la dispersión lateral (SSC-A) (YY) para evaluar el tamaño y la granularidad de la celda.
NOTA: Este gráfico se usa comúnmente para identificar poblaciones de células y excluir desechos en función de sus propiedades de dispersión. - Activación de celda singlete y exclusión de múltiplos (Figura 5B): Utilice el diagrama de área de dispersión directa (FSC-A) frente a altura de dispersión directa (FSC-H) para excluir múltiplos. Dibuje una puerta para incluir todos los eventos alineados en el gráfico (celdas individuales) y excluya los no alineados (multipletes). Si la muestra tiene eventos con FSC muy bajo, exclúyalos no incluyéndolos en la puerta de la celda única, quedando solo celdas singlete.
- Identificación de las poblaciones de leucocitos (Figura 5C): Distinguir las 3 poblaciones de leucocitos en función del perfil FSC-A/SSC-A: FSC-Aalto/SSC-Aalto son granulocitos, elmedio FSC-A/SSC-A son los monocitos y FSC-Abajo/SSC-Abajo son los linfocitos.
- Activación de viabilidad (Figura 5D): Establezca el umbral para la tinción de colorante de viabilidad en el canal de fluorescencia correspondiente (NIR, RL3-A). Las células vivas frente a las células muertas se definen en función de la intensidad de la tinción con la tinción de células muertas fijables LIVE/DEAD: las células teñidas tenues se definen como células vivas, y las células fuertemente teñidas se definen como células muertas.
- Estadísticas de población: Mire las estadísticas proporcionadas por el software, incluidos los eventos totales (celdas) en cada puerta y los porcentajes de celdas totales y cerradas.
- Exportar datos: Exporte los datos a una hoja de cálculo y utilice el software estadístico adecuado (GraphPad, Prism o R) para un análisis estadístico más detallado.
NOTA: La elección de los métodos de análisis dependerá de los objetivos de la investigación.

Figura 5: Estrategia de activación por citometría de flujo para la evaluación de la viabilidad en células renales de la cabeza: (A) Representa el perfil FSC-A/SSC-A de todos los eventos recopilados. (B) Representa la exclusión de múltiplos basada en la definición de la región singlete basada en la linealidad en el gráfico de dispersión directa (FSC-A)/dispersión directa (FSC-H). (C) Representa las 3 poblaciones principales que se definieron en base a FSC-A/SSC-A, después de la exclusión de los multipletes. (D) Representa un histograma que muestra la tinción de tinte de viabilidad viva/muerta. Para establecer el umbral que permite distinguir las células vivas y muertas, los leucocitos se sometieron a un choque térmico leve (50 °C, 7 min) y luego se tiñeron con colorante de viabilidad. Las células positivas de alta intensidad de tinción (++) son las células muertas, y las células positivas de baja tinción (+-) son las células vivas. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
En la Figura 6 se presentan datos representativos de citometría de flujo que muestran poblaciones de leucocitos aislados del riñón de cabeza de dorada juvenil (Sparus aurata) y su viabilidad celular utilizando el protocolo descrito en este estudio. La figura compara dos muestras: una con alta viabilidad celular, donde los peces fueron expuestos a condiciones óptimas (Figura 6A), y otra con baja viabilidad celular, donde las células fueron expuestas a estrés térmico (Figura 6B).
En ambas muestras, el presente método identificó efectivamente tres poblaciones principales de leucocitos: linfocitos (LY), monocitos (MO) y granulocitos (GR). Estas poblaciones se distinguieron en función de las diferencias en el tamaño y la complejidad de las celdas, como lo indican los diagramas de dispersión directa (FSC-A) y dispersión lateral (SSC-A). La dispersión directa (FSC-A) indica el tamaño relativo de las células, mientras que la dispersión lateral (SSC-A) refleja la complejidad interna o granularidad de las células, lo que permite una clara separación de las poblaciones. En condiciones óptimas (Figura 6A), las poblaciones de leucocitos se distribuyeron de la siguiente manera: LY al 31,0%, MO al 38,0% y GR al 31,0%. Sin embargo, en la muestra expuesta a estrés térmico (Figura 6B), se observó un cambio en la distribución de estas poblaciones, disminuyendo el LY a 21.3%, aumentando el MO a 45.6% y el GR permaneciendo relativamente estable en 33.1%.
Un análisis más detallado de la viabilidad celular, detallado en la Figura 6A1-A3 y la Figura 6B1-B3, revela un contraste significativo entre las dos muestras. Como se puede observar, la muestra expuesta en condiciones óptimas (Figura 6A) exhibió mayor viabilidad, con predominio de células vivas (representadas en azul) en todas las poblaciones de leucocitos. Por el contrario, la muestra sometida a estrés térmico (Figura 6B) mostró un aumento significativo en la muerte celular (la tinción más intensa se muestra en rojo), con LY mostrando un 50,7% de muerte celular, MO 83,7% y GR 84,5%.
En general, los resultados demuestran claramente la eficacia del protocolo tanto en el aislamiento y análisis de las poblaciones de leucocitos como en la evaluación de la viabilidad celular. Además, los datos proporcionan información valiosa sobre cómo las condiciones estresantes, como la exposición térmica, influyen en la dinámica de las poblaciones de leucocitos y la viabilidad celular. Los cambios observados en la distribución celular y la viabilidad bajo estrés sugieren que la exposición térmica no solo altera el equilibrio de las poblaciones de leucocitos, sino que también compromete la salud celular. Estos cambios pueden indicar una respuesta inmunitaria al estrés, lo que apunta a un mecanismo de defensa activo desencadenado por los factores estresantes ambientales.

Figura 6: Gráficos representativos de citometría de flujo que ilustran la identificación y viabilidad de diferentes poblaciones de leucocitos del riñón de cabeza de dorada (Sparus aurata): (A) Muestra con alta viabilidad celular, expuesta a condiciones óptimas: El panel izquierdo muestra la activación de las poblaciones de leucocitos basada en FSC-A/SSC-A, identificando linfocitos (LY), monocitos (MO) y granulocitos (GR); Viabilidad de LY (A.1), MO (A.2) y GR (A.3). (B) Muestra con baja viabilidad celular, sometida a estrés térmico: El panel de la izquierda muestra la activación de las poblaciones de leucocitos en base a FSC-A/SSC-A, identificando linfocitos (LY), monocitos (MO) y granulocitos (GR); Viabilidad de LY (B.1), MO (B.2) y GR (B.3). Haga clic aquí para ver una versión más grande de esta figura.
Figura complementaria 1: Imagen representativa de un tanque de cuarentena con una capacidad total de 660 L. Haga clic aquí para descargar esta figura.
Figura complementaria 2: Imagen de la configuración de un sistema RAS. (1) Profilux; (2) Luminarias; (3) acuarios/tanques; (4) Refrigerador; (5) Grifos de entrada de agua en acuarios; (6) Sifón azul para salidas de agua del acuario; (7) Sumidero; (8) Espumante de proteínas; (9) Filtro mecánico (bolsa de filtro); (10) Filtro mecánico (esponja azul + lana de vidrio); (11) Filtro biológico (biobolas); (12) Termostato; (13) Bomba principal; (14) Esterilizador UV; (15) Sensor de temperatura; (A) Filtro mecánico (esponja azul); (B) Filtro mecánico (lana de vidrio). Haga clic aquí para descargar esta figura.
Tabla complementaria 1:Composición de ingredientes (%) y análisis proximal (%MS) de la dieta experimental utilizada en el estudio. Haga clic aquí para descargar esta tabla.
Tabla complementaria 2: Reactivos utilizados en el protocolo: Riesgos para la salud, indicaciones de peligro, consejos de prudencia y medidas de primeros auxilios. Haga clic aquí para descargar esta tabla.
Tabla complementaria 3: Canales de excitación y detección apropiados para utilizar con las tinciones de células muertas fijables LIVE/DEAD reactivas a aminas. Haga clic aquí para descargar esta tabla.
Ficha complementaria 1: Cálculos para la elaboración de soluciones. Haga clic aquí para descargar este archivo.
Discusión
El método desarrollado en este estudio representa un avance significativo en la investigación de la inmunología de los peces y promete mejorar la comprensión de las respuestas inmunitarias de los peces y la sostenibilidad de los recursos marinos. S. aurata es una valiosa especie de pez marino de la familia Sparidae que sirve como un organismo modelo ideal por varias razones, incluyendo su relevancia ecológica y económica, así como su versatilidad en la investigación de laboratorio en varios campos de estudio como la fisiología, la inmunología, la toxicología y la acuicultura20. Una de las principales ventajas de S. aurata es su facilidad de manejo y cría en el laboratorio, con protocolos de manejo bien establecidos que aseguran condiciones experimentales consistentes y reproducibles21. Además, su adaptabilidad ambiental (es decir, alta tolerancia a una amplia gama de condiciones ambientales, como las fluctuaciones de temperatura y salinidad) lo convierte en un candidato ideal para estudios destinados a mejorar las técnicas de cultivo y evaluar los impactos ambientales sobre los organismos marinos22. S. aurata, con su sistema inmunitario bien caracterizado y la disponibilidad de datos genómicos, permite desbloquear las respuestas inmunitarias de los peces, la resistencia a los patógenos, la eficacia de las vacunas y la salud general20. Dada su importancia en la acuicultura, así como en los hábitos alimenticios de las poblaciones del sur de Europa, la investigación sobre esta especie puede tener un impacto directo en las prácticas agrícolas, mejorando su producción y sostenibilidad, al tiempo que aborda los desafíos ambientales dentro de la industria20.
En este sentido, este protocolo ofrece varias ventajas y potenciales aplicaciones en diversas áreas de investigación, tales como: (i) Inmunología de peces: Proporciona un análisis preciso y detallado de las células inmunes del riñón de la cabeza de S. aurata, permitiendo la identificación y caracterización de diferentes poblaciones de leucocitos, así como evaluaciones robustas de su viabilidad celular por citometría de flujo; ii) Investigación en acuicultura: Esencial para el estudio de las técnicas de cultivo, la nutrición y la gestión de enfermedades, apoyando las investigaciones futuras destinadas a reducir la dependencia de los antibióticos y los tratamientos químicos, promoviendo así prácticas acuícolas más sostenibles; iii) Ecotoxicología: Valiosa para la evaluación de los efectos provocados por los contaminantes y otros factores de estrés ambiental en la salud inmunitaria de los peces, ya que proporciona datos para la evaluación de riesgos ambientales y la formulación de reglamentos de protección de los ecosistemas acuáticos; iv) Fisiología comparada: Permite a los investigadores hacer un seguimiento de las adaptaciones evolutivas del sistema inmunitario a diversos desafíos ambientales, proporcionando una comprensión más profunda de las bases genéticas y fisiológicas de la función inmunitaria; v) Biología y ecología marinas: Mejorar la comprensión de las funciones ecológicas y las interacciones de S. aurata, proporcionando información sobre la distribución de las especies, las preferencias de hábitat y los efectos de los cambios ambientales en la diversidad biológica marina; vi) Investigación biomédica: Los peces se utilizan cada vez más como organismos modelo en la investigación biomédica. El aislamiento y el análisis de células inmunitarias pueden ayudar a comprender los aspectos celulares y moleculares críticos para el descubrimiento de fármacos e incluso para la medicina.
Durante muchos años, la cuantificación e identificación de leucocitos en peces se basó en técnicas hematológicas tradicionales, como el recuento manual con hemocitómetros de Bürker, Neubauer o Thoma, así como en frotis de sangre teñidos10,12. La viabilidad celular también se evaluó mediante la prueba de exclusión de azul de tripano, seguida de recuento microscópico 15,22,23,24,25,26,27,28. Si bien estos métodos han contribuido a nuestra comprensión de la inmunología de los peces, tienen varias limitaciones. El recuento manual de leucocitos requería mucho tiempo y trabajo, y la precisión de estas técnicas a menudo se veía comprometida por la variabilidad del operador y el error humano, lo que afectaba significativamente la consistencia de los resultados10.
En 1994, Esteban et al. revolucionaron el análisis de leucocitos en peces al introducir una técnica para evaluar el mecanismo de defensa fagocítica en lubina (Dicentrarchus labrax)23. En su estudio, los leucocitos se aislaron de sangre periférica, riñón de cabeza y exudados peritoneales mediante centrifugación en gradiente de densidad de Percoll23. Este avance metodológico supuso un importante avance en la mejora de la precisión y fiabilidad del análisis de leucocitos. Siguiendo el trabajo pionero de Esteban et al., estudios posteriores han tenido como objetivo refinar y optimizar las técnicas de citometría de flujo para el análisis de leucocitos, centrándose en diversos aspectos como el perfil de la población celular 6,15,16,28,29, la viabilidad celular 3,6,27,28 y la actividad fagocítica 6,23, 24,27,28. Los avances en los procedimientos de aislamiento, incluyendo el uso de diferentes medios de gradiente (por ejemplo, Ficoll vs. Percoll) y los protocolos de centrifugación optimizados, han mejorado la pureza y el rendimiento de los leucocitos aislados 1,8,14,26. El desarrollo de técnicas de tinción avanzadas y el uso de colorantes fluorescentes, como el yoduro de propidio (PI) y el yoduro de 3,3'-dihexiloxacarbocianina (DiOC6(3)) han permitido una discriminación más precisa entre células viables y no viables, así como una caracterización detallada de las poblaciones de leucocitos, respectivamente16,30. Una de las principales ventajas de esta técnica es su capacidad para distinguir simultáneamente entre diferentes poblaciones de leucocitos (linfocitos, monocitos y granulocitos) y evaluar la viabilidad celular de cada población. Esto permite a los investigadores identificar qué poblaciones se ven más afectadas en condiciones específicas, proporcionando información más profunda sobre la respuesta inmunitaria y revelando los subconjuntos de leucocitos más vulnerables. Sin embargo, a pesar de estas mejoras, los métodos actuales aún enfrentan limitaciones. La mayoría de las investigaciones se han centrado en los peces adultos, lo que deja un vacío en el estudio de las etapas juveniles. Los peces juveniles presentan desafíos únicos para la extracción de leucocitos debido a su menor tamaño y a la dificultad de obtener muestras de alta calidad de sus órganos inmunitarios proporcionalmente más pequeños17. El estudio descrito aquí aborda específicamente estos problemas mediante la optimización del protocolo para peces juveniles, el ajuste de la proporción de suspensión celular y la solución de Percoll para mejorar la calidad de la extracción de leucocitos. Además, los métodos existentes a menudo están limitados por el número de muestras o réplicas que se pueden procesar a la vez debido a la necesidad inmediata de evaluar la viabilidad de los leucocitos. Cualquier retraso en el manejo de la muestra puede afectar negativamente a la viabilidad de la célula, complicando el proceso de muestreo y comprometiendo potencialmente los resultados. Para superar esta limitación, este estudio introduce el uso de una nueva técnica de tinción que permite la fijación y el análisis celular hasta 1 mes después de la fijación. Esta innovación proporciona una mayor flexibilidad en los programas de muestreo, lo que permite a los investigadores procesar y analizar muestras a su conveniencia, mejorando significativamente el flujo de trabajo y la fiabilidad de las evaluaciones de citometría de flujo.
El éxito de este protocolo depende de varios pasos críticos, cada uno de los cuales requiere una ejecución cuidadosa para garantizar la integridad y viabilidad de los leucocitos, que posteriormente se analizan mediante citometría de flujo. La correcta preparación de la solución de eutanasia y el ajuste del pH son fundamentales para una eutanasia eficaz. Las soluciones mal preparadas pueden resultar en una eutanasia incompleta o en un estrés adicional para los peces18. La disección precisa y cuidadosa de la cabeza del riñón es vital para evitar la contaminación. Mantener la esterilidad y la integridad de los tejidos es crucial para obtener muestras de leucocitos de alta calidad. La densidad, la osmolaridad y el pH de la solución de Percoll deben ajustarse correctamente para una separación eficiente de los leucocitos. La aspiración suave del anillo leucocitario con una pipeta estéril es fundamental para evitar la contaminación y la alteración de las capas de gradiente. El lavado eficaz de las células después de la recolección es esencial para eliminar los residuos de Percoll y otras impurezas. La repetición del proceso de lavado garantiza un pellet de celda limpia listo para la fijación. El tinte reactivo debe prepararse inmediatamente antes de su uso para garantizar su eficacia, ya que una manipulación inadecuada puede comprometer su estabilidad. La adición adecuada de colorante y el tiempo de incubación son fundamentales para distinguir con precisión entre células vivas y muertas. La fijación de las células con formaldehído al 3,7% es un paso crítico para preservar la morfología celular y garantizar una identificación precisa de las células muertas. La concentración de formaldehído debe ser precisa y los tiempos de incubación deben seguirse estrictamente para evitar resultados inexactos. Es importante lavar las células después de la fijación para eliminar cualquier exceso de colorante y formaldehído, que podría interferir con el análisis posterior. El almacenamiento adecuado de las muestras fijas y su análisis oportuno son necesarios para mantener la precisión de los datos. El ajuste de los canales de excitación y detección para que coincidan con el colorante específico utilizado es esencial para obtener resultados precisos de citometría de flujo.
A pesar de sus numerosas ventajas, este método tiene algunas limitaciones que deben tenerse en cuenta. Una limitación clave es su naturaleza específica de la especie, ya que el protocolo está optimizado para los juveniles de dorada (S. aurata), un pez marino. Esto significa que su eficacia puede variar cuando se aplica a otras especies de peces, en particular a los peces de agua dulce. Las diferencias en el equilibrio osmótico entre las especies marinas y las de agua dulce pueden requerir ajustes en los tampones utilizados en el protocolo, ya que las soluciones adecuadas para condiciones salinas pueden no ser apropiadas para las especies de agua dulce. Además, las diferencias en la estructura de los tejidos, la densidad celular y las respuestas fisiológicas pueden requerir ajustes en el protocolo, lo que podría afectar la reproducibilidad y la consistencia entre las diferentes especies.
Otro factor importante es el mantenimiento de los peces antes de la recolección de muestras. Cada especie tiene condiciones óptimas específicas de agua cruciales para mantener la salud de los peces y garantizar la calidad de los resultados experimentales20. Las variaciones en parámetros como la temperatura, la salinidad y el pH pueden afectar la viabilidad celular y la calidad de los datos, ya que las condiciones subóptimas pueden inducir estrés fisiológico que compromete la integridad celular. Para garantizar resultados experimentales consistentes, es importante mantener todas las réplicas bajo las mismas condiciones controladas, ya sean óptimas o intencionalmente subóptimas (dependiendo de los objetivos del estudio).
La variabilidad en las técnicas de manejo y disección también puede afectar la calidad y cantidad de los leucocitos renales de la cabeza, lo que hace que la habilidad y la experiencia del operador sean un factor crítico para el éxito del protocolo. Además, mantener la viabilidad celular durante todo el proceso de aislamiento puede ser un desafío, ya que cualquier retraso entre la eutanasia y la fijación celular puede resultar en una disminución de la viabilidad y resultados sesgados. El procesamiento inmediato de tejidos y células es esencial para mantener una alta viabilidad celular, pero este requisito puede ser difícil de lograr de manera consistente, especialmente cuando se trabaja con un gran número de muestras.
Divulgaciones
Los autores declaran no tener conflictos de intereses financieros, personales o profesionales que puedan haber influido en la investigación, el análisis, la interpretación de datos, la redacción o la decisión de enviar el manuscrito para su publicación.
Agradecimientos
Este trabajo contó con el apoyo de la Fundação Portuguesa para a Ciência e Tecnologia (FCT I.P.), en el marco del proyecto Aqua-CLIMADAPT (PTDC/CTA-AMB/0592/2021, https://doi-org.remotexs.ntu.edu.sg/10.54499/PTDC/CTA-AMB/0592/2021). Reconocemos al BioLab apoyado por la Unidad de Biociencias Moleculares Aplicadas (UCIBIO) y la Unidad de Investigación en Laboratorio Asociado de Química Verde – LAQV, que son financiados con fondos nacionales de FCT/MCTES (UIDB/04378/2020 y UIDB/50006/2020, respectivamente), así como al Instituto de Laboratorio Asociado para la Salud y la Bioeconomía – i4HB (LA/P/0140/2020). Este trabajo también contó con el apoyo de la Comisión Europea a través del proyecto GLYCOTwinning (Grant Agreement nº 101079417) y FCT a través de InnoGlyco (2022.04607.PTDC). Isa Marmelo también reconoce a FCT I.P. por la beca de doctorado (2020.04413.BD, https://doi-org.remotexs.ntu.edu.sg/10.54499/2020.04413.BD).
Materiales
| Name | Company | Catalog Number | Comments |
| Air Stones | N/A | N/A | |
| Aquafeed | SPAROS, Lda., Portugal | N/A | High-quality diet |
| Automatic Cell Counting Equipment | NanoEnteK, Korea | N/A | EVE automatic cell counter (NanoEnteK) |
| Automatic Water Refrigeration Systems | Foshan Weinuo Refrigeration Equipment Co., Ltd, China | N/A | |
| Bio balls 1.5" Aquarium Pond Filter | TMC Iberia, Portugal | N/A | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich, Germany | A7906 | |
| Bucket (3 L) | N/A | N/A | To prepare and carry out euthanasia |
| Buckets (5 L) | N/A | N/A | To transport the animals |
| Cell Strainers | Jetbiofil, China | CSS-013-100 | Cell Strainer, 100 μm nylon mesh, Sterile, Yellow |
| Centrifugue | Fisher Scientific, Germany | N/A | accuSpin Micro 17 R |
| Colorimetric Test Kit for Ammonia (NH4+/NH3) | Tropic Marin, USA | N/A | |
| Colorimetric Test Kit for Nitrate (NO3-) | Tropic Marin, USA | N/A | |
| Colorimetric Test Kit for Nitrite (NO2-) | Tropic Marin, USA | N/A | |
| Computer | N/A | N/A | To acquire and analyse the data obtained from the flow cytometer |
| Computerized Control System (Profilux) | GHL, Germany | N/A | ProfiLux 3 Outdoor |
| Deionized water | N/A | N/A | To clean the Flow Cytometer |
| Density Gradient Medium: Percoll | Cytiva, Sigma-Aldrich, Germany | 17-0891-01 | |
| Digital scale | KERN & Sohn GmbH, Germany | N/A | KERN EMS 300-3 |
| Ethanol 70% | Millipore, Supelco, Portugal | EX0281 | To keep the workspace clean |
| EVE Cell Counting Slides | NanoEnteK, Korea | N/A | |
| Falcon Tubes (15 mL) | pluriSelect Life Science, Germany | 05-00002-01 | Sterile |
| Filter bag | TMC Iberia, Portugal | N/A | 400 micron |
| Filter Sponge | N/A | N/A | |
| Flow Cytometer | ThermoFisher Scientific, USA | N/A | Attune flow cytometer |
| FlowJo v10.8.1 Software | BD Life Sciences | N/A | |
| Formaldehyde 37% | Sigma-Aldrich, Germany | 8.18708 | |
| Glass Wool | N/A | N/A | |
| Hanks' Balanced Salt Solution | Merck Life Science S.L, Portugal | H6648 | Modified, with sodium bicarbonate, without phenol red, calcium chloride and magnesium sulfate, liquid, sterile-filtered, suitable for cell culture |
| LIVE/DEAD Fixable Dead Cell Stain Kits | Life Technologies Europe, Netherlands | L10119 | Near-IR fluorescent reactive dye + DMSO |
| Main Water Pumps | EHEIM, Germany | Universal 1200 | |
| Microcentrifuge Tubes (2 mL) | BRAND, Merck, Germany | Z628034 | Sterile |
| Micropipette Tips | Sartorius, Germany | 790010, 790200, 791000 | Compatible with Sartorius, 1-10 µL, 2-20 µL, 20-200 µL, 100-1000 µL |
| Micropipettes | Sartorius, Germany | 728020, 728030, 728060, 728070 | Sartorius ProlinePlus 1-10 µL, 2-20 µL, 20-200 µL, 100-1000 µL |
| Mini Cell Strainers | pluriSelect Life Science Global Headoffice, Germany | 43-10100-50 | PluriStrainer 100 µm nylon mesh, Sterile |
| Multi-Parameter Measuring Instrument | WTW, Germany | Multi 3420 SET G + IDS digital conductivity cell (TetraCon 925) + Optical IDS DO sensor (FDO 925) + IDS pH-electrode (SenTix 940) | |
| Pasteur Pipettes (1 mL, 5 mL) | Humeau Expert du laboratoire, France | 248295 | Sterile |
| Petri dishes | Sarstedt, Germany | 82.1194.500 | 60 x 15 mm, Polystyrene, Sterile |
| pH Meter | Hanna Instruments Inc., Romania | HANNA HI2211 | |
| Polystyrene round-bottom Falcon tubes (5 mL) | Fisher Scientific, Germany | 14-959-2A | Sterile |
| Portable Precision Thermometer | Ebro Electronic, Germany | N/A | TFX 430 |
| Protein Skimmers | Mantis | N/A | Tornado 120 |
| Quality control beads/Performance test beads | Thermofisher Scientific, USA | N/A | |
| Quarantine Tanks | N/A | N/A | Tanks with 660 L total volume |
| Rectangular Glass Tanks/Aquariums | N/A | N/A | Tanks with 200 L total volume |
| Refrigerator | N/A | N/A | To store the samples at 4 °C |
| Ruler 30 cm | N/A | N/A | To measure the fish's length |
| Sodium bicarbonate | Honeywell Fluka, Germany | 31437 | Sodium hydrogen carbonate (NaHCO3) |
| Sodium chloride | Sigma-Aldrich, Germany | S9888 | |
| Sterile Dissection Tools | N/A | N/A | (e.g. scalpel, scissors, fine-tipped forceps, dissecting tray/board) |
| Submerged Digital Heaters | TMC Iberia, Portugal | 300 W, V2Therm Digital Heaters | |
| Syringes 1 mL | IVFSTORE, USA | 8300014579-MEA | Sterile, HSW Soft-Ject Syringes to macerate head-kidney |
| Temperature Sensors | GHL, Germany | PT 1000 | |
| Tricaine (MS-222) | ThermoFisher Scientific, Germany | 118000500 | Ethyl 3-aminobenzoate, methanesulfonic acid salt, 98% (C10H15NO5S) |
| Ultraviolet Water Sterilizer | EHEIM, Germany | 5305010 | ClearUVC-36 |
| Water Bath | Fisher Scientific, Germany | N/A | Fisherbrand IsotempTM (P/N U01318) |
| Water-resistant Luminaires | N/A | N/A |
Referencias
- Samaï, H.C. et al. Procedures for leukocytes isolation from lymphoid tissues and consequences on immune endpoints used to evaluate fish immune status: A case study on roach (Rutilus rutilus). Fish Shellfish Immunol. 74, 190-204 (2018).
- Mokhtar, D. M., Zaccone, G., Alesci, A., Kuciel, M., Hussein, M. T., Sayed, R. K. A. Main components of fish immunity: An overview of the fish immune system. Fishes. 8 (2), 93 (2023).
- Lulijwa, R. et al. Characterisation of Chinook salmon (Oncorhynchus tshawytscha) blood and validation of flow cytometry cell count and viability assay kit. Fish Shellfish Immunol. 88, 179-188 (2019).
- Uribe, C., Folch, H., Enriquez, R., Moran, G. Innate and adaptive immunity in teleost fish: a review. Vet Med. 56 (10), 486-503 (2011).
- Bjørgen, H., Koppang, E. O. Anatomy of teleost fish immune structures and organs. Immunogenetics. 73 (1), 53-63 (2021).
- Santos, R. A. et al. In vitro modulation of gilthead seabream (Sparus aurata L.) leukocytes by Bacillus spp. extracellular molecules upon bacterial challenge. Fish Shellfish Immunol. 121, 285-294 (2022).
- Witeska, M., Kondera, E., Ługowska, K., Bojarski, B. Hematological methods in fish - Not only for beginners. Aquaculture. 547, 737498 (2022).
- Titus, J. et al. Development and validation of a flow cytometry method to examine circulating leukocyte subpopulations in barramundi (Lates calcarifer). Comp Immunol Rep. 6, 200142 (2024).
- Marmelo, I. et al. Eco-innovative aquafeeds biofortified with Asparagopsis taxiformis to improve the resilience of farmed white seabream (Diplodus sargus) to marine heatwave events. Heliyon. 10 (15), e35135 (2024).
- Seibel, H., Baßmann, B., Rebl, A. Blood Will Tell: What Hematological Analyses Can Reveal About Fish Welfare. Front Vet Sci. 8, 616955 (2021).
- Franke, A., Beemelmanns, A., Miest, J. J. Are fish immunocompetent enough to face climate change? Biol Lett. 20 (2), 20230346 (2024).
- Fazio, F. Fish hematology analysis as an important tool of aquaculture: A review. Aquaculture. 500, 237-242 (2019).
- Fazio, F., Saoca, C., Costa, G., Zumbo, A., Piccione, G., Parrino, V. Flow cytometry and automatic blood cell analysis in striped bass Morone saxatilis (Walbaum, 1792): A new hematological approach. Aquaculture. 513, 734398 (2019).
- Lulijwa, R., Alfaro, A. C., Merien, F., Meyer, J., Young, T. Advances in salmonid fish immunology: A review of methods and techniques for lymphoid tissue and peripheral blood leucocyte isolation and application. Fish Shellfish Immunol. 95, 44-80 (2019).
- Esteban, M. Á., Muñoz, J., Meseguer, J. Blood cells of sea bass (Dicentrarchus labrax l.). Flow cytometric and microscopic studies. Anat Rec. 258 (1), 80-89 (2000).
- Inoue, T., Moritomo, T., Tamura, Y., Mamiya, S., Fujino, H., Nakanishi, T. A new method for fish leucocyte counting and partial differentiation by flow cytometry. Fish Shellfish Immunol. 13 (5), 379-390 (2002).
- Ye, R. R. et al. Immune competence assessment in marine medaka (Orzyias melastigma)-a holistic approach for immunotoxicology. Environ Sci Pollut Res. 24 (36), 27687-27701 (2017).
- American Veterinary Medical Association. AVMA Guidelines for the Euthanasia of Animals: 2020 Edition. American Veterinary Medical Association, Schaumburg, IL (2020).
- FlowJoTM Software (for Windows). Version v10.8.1 (BD Life Sciences). At < https://www.bdbiosciences.com/en-us/products/software/flowjo-v10-software> (2023).
- Mhalhel, K. et al. Review on Gilthead Seabream (Sparus aurata) aquaculture: Life cycle, growth, aquaculture practices and challenges. J Mar Sci Eng. 11 (10), 2008 (2023).
- Toni, M., Manciocco, A., Angiulli, E., Alleva, E., Cioni, C., Malavasi, S. Review: Assessing fish welfare in research and aquaculture, with a focus on European directives. Animal. 13 (1), 161-170 (2018).
- Kır, M. Thermal tolerance and standard metabolic rate of juvenile gilthead seabream (Sparus aurata) acclimated to four temperatures. J Therm Biol. 93, 102739 (2020).
- Esteban, M. Á, Meseguer, J. Phagocytic defence mechanism in sea bass (Dicentrarchus labrax L.): An ultrastructural study. Anat Rec. 240 (4), 589-597 (1994).
- Esteban, M. Á., Mulero, V., Muñoz, J., Meseguer, J. Methodological aspects of assessing phagocytosis of Vibrio anguillarum by leucocytes of gilthead seabream (Sparus aurata L.) by flow cytometry and electron microscopy. Cell Tissue Res. 293 (1), 133-141 (1998).
- Rodríguez, A., Esteban, M. Á., Meseguer, J. Phagocytosis and peroxidase release by seabream (Sparus aurata L.) leucocytes in response to yeast cells. Anat Rec A Discov Mol Cell Evol Biol. 272 (1), 415-423 (2002).
- Hamoutene, D., Payne, J. F., Volkoff, H. Effects of tebufenozide on some aspects of lake trout (Salvelinus namaycush) immune response. Ecotoxicol Environ Saf. 69 (2), 173-179 (2007).
- Pierrard, M.-A., Roland, K., Kestemont, P., Dieu, M., Raes, M., Silvestre, F. Fish peripheral blood mononuclear cells preparation for future monitoring applications. Anal Biochem. 426 (2), 153-165 (2012).
- Guardiola, F. A., Logothetis, P., Meseguer, J., Esteban, M. Á. Evaluation of silver nanospheres on viability and innate cellular parameters of gilthead seabream (Sparus aurata L.) head-kidney leucocytes. Fish Shellfish Immunol. 69, 99-107 (2017).
- Campos-Sánchez, J. C., Guardiola, F. A., Esteban, M. Á. In vitro effects of cantharidin on gilthead seabream (Sparus aurata) head-kidney leucocytes. Fish Shellfish Immunol. 123, 20-35 (2022).
- Korytář, T., Dang Thi, H., Takizawa, F., Köllner, B. A multicolour flow cytometry identifying defined leukocyte subsets of rainbow trout (Oncorhynchus mykiss). Fish Shellfish Immunol. 35 (6), 2017-2019 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados