Method Article
Isolement, fixation et caractérisation des leucocytes rénaux juvéniles de dorade royale par cytométrie en flux
Dans cet article
Résumé
Ce manuscrit décrit l’isolement et la fixation des leucocytes extraits de la tête-rein de la dorade royale et l’évaluation de leur viabilité par cytométrie en flux. Ce travail contribue à la normalisation des protocoles et tire parti du traitement d’un plus grand nombre d’échantillons sans compromettre la qualité des échantillons, favorisant ainsi l’avancement des connaissances en immunologie des poissons.
Résumé
L’immunité est cruciale pour la régulation physiologique des organismes, servant de défense principale contre les agents pathogènes et les facteurs de stress environnementaux. L’isolement et l’analyse des cellules immunitaires fournissent des informations clés sur les réponses immunitaires aux pressions externes. Cependant, l’absence de protocoles harmonisés pour les espèces moins étudiées, comme les poissons marins, entraîne souvent des défis techniques et analytiques qui entravent l’interprétation des données et une compréhension approfondie des réponses immunitaires spécifiques aux espèces. Cette étude visait à mettre en place une procédure analytique optimisée basée sur la cytométrie en flux pour caractériser et déterminer la viabilité des leucocytes du rein de la tête (principal organe hématopoïétique chez le poisson téléostéen) de la dorade royale juvénile (Sparus aurata). La procédure a commencé par l’isolement des leucocytes par un processus d’homogénéisation à l’aide de la solution saline équilibrée de Hanks, suivi d’une méthode de centrifugation à gradient de densité Percoll optimisée pour garantir des taux de récupération élevés des leucocytes avec une contamination érythrocytaire minimale requise pour une analyse ultérieure efficace par cytométrie en flux. De plus, une nouvelle technique utilisant un colorant réactif aux cellules (LIVE/DEAD Fixable Dead Cell Stain Kit) a été utilisée pour distinguer les cellules viables des cellules mortes en fonction de leurs motifs de coloration fluorescente. La fixation a été réalisée avec 3,7 % de formaldéhyde, préservant la morphologie cellulaire, la viabilité et l’efficacité de la coloration. L’analyse par cytométrie en flux a permis d’identifier trois populations de leucocytes prédominantes : les lymphocytes, les monocytes et les granulocytes. Cette méthode a non seulement permis des tests de viabilité, mais aussi une différenciation précise des types de cellules. L’amélioration des protocoles de cytométrie en flux représente un pas en avant dans l’immunologie des poissons en augmentant la précision et l’efficacité de l’analyse des cellules immunitaires. De plus, en permettant la fixation des cellules pour une analyse ultérieure, ce protocole réduit considérablement le temps et les efforts nécessaires aux évaluations immunitaires, ce qui en fait un outil précieux pour la recherche et les applications pratiques dans divers domaines de recherche.
Introduction
L’immunité joue un rôle central dans la régulation physiologique des organismes, agissant comme une défense primaire contre un large éventail d’agents pathogènes et de facteurs de stress environnementaux1. Comme les autres vertébrés, les poissons ont un système immunitaire complexe, dynamique et coordonné essentiel à leur santé et à leur bien-être en général1.
Les poissons téléostéens possèdent à la fois des systèmes immunitaires innés et adaptatifs, qui fonctionnent simultanément pour détecter, répondre et neutraliser les envahisseurs nuisibles2. Le système immunitaire inné agit comme la première ligne de défense, fournissant des réponses immédiates et non spécifiques aux agents pathogènes2, tandis que le système immunitaire adaptatif se développe au fil du temps, offrant une réponse plus spécialisée qui permet aux poissons de reconnaître des agents pathogènes spécifiques et d’établir une mémoire immunologique3. Le système immunitaire du poisson s’appuie sur des organes lymphoïdes primaires spécialisés (c.-à-d. le thymus et le rein de la tête) et des organes lymphoïdes secondaires (p. ex., la rate et les tissus lymphoïdes associés aux muqueuses (MALT)) pour soutenir la défense immunitaire et maintenir la santé globale4. Le rein de la tête est le principal organe hématopoïétique chez les poissons téléostéens et joue un rôle crucial dans le développement et la maturation des cellules immunitaires, y compris les leucocytes5.
Au cours des dernières années, des progrès significatifs ont été réalisés dans l’étude des réponses immunitaires de plusieurs espèces de poissons2. L’un des principaux domaines d’intérêt a été de comprendre les populations de leucocytes et leur activité. Les leucocytes, également connus sous le nom de globules blancs, sont généralement classés en monocytes, lymphocytes et granulocytes et jouent un rôle crucial dans la défense immunitaire des poissons. Ils ont des cellules phagocytaires, qui sont responsables de l’engloutissement et de la destruction des agents pathogènes et libèrent des espèces réactives bactéricides de l’oxygène, contribuant ainsi à l’élimination des micro-organismes envahisseurs6. Les leucocytes sont également impliqués dans le processus inflammatoire, aidant à isoler et à éradiquer les infections tout en favorisant la réparation des tissus6. L’abondance et l’activité des populations de leucocytes sont des indicateurs importants de l’état immunitaire en santé animale et en maladies 7,8.
Certaines études ont démontré que les facteurs de stress, tels que les conditions environnementales défavorables, peuvent modifier le nombre et la morphologie des érythrocytes ainsi que la composition des leucocytes circulants 9,10. Par exemple, comme l’ont examiné Franke et al. (2024), il est crucial d’étudier le système immunitaire des poissons dans les scénarios de changement climatique, car les facteurs de stress environnementaux peuvent compromettre l’immunité des poissons, augmenter la sensibilité aux maladies et améliorer l’infectiosité de certains agents pathogènes, accélérant ainsi la progression de la maladie11. De plus, il est essentiel de comprendre l’immunité des poissons non seulement pour faire progresser la recherche biologique fondamentale, mais aussi pour soutenir divers secteurs de la société, comme l’industrie de l’aquaculture. Alors que l’aquaculture continue de se développer à l’échelle mondiale, il devient de plus en plus important d’assurer la santé et le bien-être des espèces de poissons d’élevage. Pourtant, le bien-être des poissons reste un domaine de recherche relativement nouveau, et les réponses immunitaires des poissons d’élevage nécessitent encore des évaluations approfondies et standardisées. Il est de la plus haute importance de donner la priorité aux études sur la réponse immunitaire, car les informations acquises peuvent améliorer la durabilité et la productivité de l’aquaculture grâce à des approches efficaces et adaptées qui améliorent le bien-être et la résilience des animaux d’élevage.
La quantification et l’identification des leucocytes sont généralement effectuées à l’aide de méthodes hématologiques, telles que le comptage manuel avec des hémocytomètres Bürker, Neubauer ou Thoma, ainsi que des frottis sanguins colorés 7,10. Pour faciliter la visualisation et la différenciation des cellules sanguines, des kits de coloration, tels que Wright, May-Grünwald-Giemsa et Hemacolor, sont souvent utilisés 7,12. Cependant, ces techniques manuelles de comptage des cellules sont fastidieuses, chronophages et sujettes à l’erreur humaine 8,10. Les sources d’erreur courantes comprennent un mélange ou une dilution inadéquats du sang, des problèmes de coloration et un chargement incorrect de la chambre de l’hémocytomètre, qui peuvent tous entraîner une numération cellulaire inexacte12. De plus, l’analyse hématologique manuelle nécessite un haut niveau d’expertise et d’expérience pour garantir la fiabilité et la reproductibilité des résultats7. À mesure que la demande d’outils de diagnostic précis et efficaces augmente, le développement de méthodes innovantes qui permettent une compréhension approfondie de l’état immunitaire des populations de poissons devient une étape de plus en plus importante dans l’avancement de ce domaine.
La cytométrie en flux s’est imposée comme un outil puissant dans ce contexte, offrant une approche quantitative à haut débit pour analyser les populations de leucocytes et la viabilité cellulaire8. Cette technologie de diagnostic moderne permet de détecter, de compter et de caractériser rapidement des cellules individuelles dans des populations mixtes avec une précision remarquable13. De plus, la cytométrie en flux permet des mesures multiparamétriques simultanées pour la caractérisation phénotypique et fonctionnelle. Bien que largement utilisé dans les milieux cliniques humains et la médecine vétérinaire, son application dans l’étude des leucocytes de poisson reste très limitée8. Bien que certaines recherches aient été menées sur différentes espèces de poissons 1,6,8,13,14,15,16,17, plusieurs défis critiques doivent encore être relevés. L’un des défis majeurs de ces analyses est la nécessité d’obtenir des suspensions de leucocytes vivants extraits du sang périphérique ou des tissus lymphoïdes, tels que le rein de la tête1. L’isolement des leucocytes est souvent difficile en raison d’une caractéristique unique des poissons téléostéens : la présence d’érythrocytes nucléés. La contamination involontaire par des érythrocytes peut interférer avec l’analyse des leucocytes en raison de leur taille, de leur forme ovoïde et de la présence d’un noyau1. Il est donc impératif d’éliminer les érythrocytes des suspensions leucocytaires pour obtenir une pureté leucocytaire élevée et d’étudier les caractéristiques phénotypiques et fonctionnelles des leucocytes par analyse par cytométrie en flux. Chez les mammifères, l’isolement des leucocytes implique généralement la lyse osmotique des érythrocytes ou la séparation par gradient de densité avec Ficoll ou Percoll1. Cependant, la lyse osmotique est inefficace pour les poissons marins et d’eau douce en raison de leurs érythrocytes nucléés, qui ne peuvent pas être correctement lysés1. Au lieu de cela, la séparation par gradient de densité est préférée pour les poissons car elle préserve efficacement la stabilité cellulaire au fil du temps1. Bien que certaines études aient réussi à isoler des leucocytes de poissons juvéniles, une grande partie des recherches se concentre encore principalement sur les populations adultes17. Néanmoins, les premiers stades de la vie sont non seulement plus vulnérables aux épidémies, mais aussi de plus petite taille, ce qui rend le processus d’échantillonnage plus complexe et plus difficile. Une autre limite est que les méthodes actuelles sont souvent limitées à un nombre limité d’échantillons ou de répétitions à la fois, car l’évaluation de la viabilité des leucocytes nécessite un traitement immédiat. Les retards dans le traitement des échantillons peuvent nuire à la viabilité cellulaire, ce qui complique davantage le processus d’échantillonnage et met potentiellement en péril l’ensemble du travail.
À notre connaissance, aucune des méthodes publiées n’a réussi à fixer les cellules leucocytaires pour une analyse ultérieure de la viabilité par cytométrie en flux. La présente étude est pionnière, car elle établit une méthode efficace pour isoler les leucocytes du rein de tête de dorade royale juvénile (Sparus aurata), la principale espèce de poisson élevée dans les pays du sud de l’Europe, en utilisant une méthodologie de séparation par gradient de densité Percoll. Nous présentons également une technique améliorée basée sur la coloration qui distingue les cellules vivantes des cellules mortes tout en identifiant les principales populations de leucocytes (lymphocytes, monocytes et granulocytes) par cytométrie en flux. Le protocole amélioré implique la fixation des cellules, ce qui permet une analyse cellulaire viable jusqu’à 1 mois après la procédure. La mise en œuvre de ce protocole de cytométrie en flux a le potentiel de réduire considérablement le temps et les efforts généralement requis pour les évaluations immunitaires, ce qui en fait une technique précieuse pour la recherche et des applications plus pratiques dans le secteur de l’aquaculture. L’application de cette méthodologie offre des avantages pour l’analyse d’un grand nombre d’échantillons, la préservation des cellules et la possibilité d’une analyse retardée par cytométrie en flux. Par conséquent, il pourrait être très utile de produire des informations précieuses sur les mécanismes immunitaires des poissons et sur la façon dont la viabilité cellulaire est influencée par différentes conditions environnementales ou expérimentales. De plus, ce test de viabilité peut être intégré à la caractérisation phénotypique et fonctionnelle multiparamétrique de populations spécifiques de cellules immunitaires. Cette approche permet une analyse plus complète de plusieurs paramètres immunologiques, en les reliant directement aux types de cellules correspondants et en fournissant une compréhension plus claire des réponses immunitaires. Ces résultats pourraient contribuer à l’élaboration de stratégies plus efficaces, y compris de meilleures approches de gestion des maladies en aquaculture.
Protocole
Ce protocole doit être réalisé par des chercheurs certifiés en expérimentation animale (fonctions UE A et B). Toutes les procédures liées à la manipulation des animaux et au prélèvement d’échantillons doivent être conformes aux directives ARRIVE (Recherche sur les animaux : Rapport d’expériences in vivo ) et respecter les normes éthiques pour le soin et l’utilisation des animaux conformément aux recommandations de la Fédération des associations européennes de sciences des animaux de laboratoire (FELASA). La présente étude a suivi toutes ces normes ainsi que la législation portugaise pour la science des animaux de laboratoire (Directive UE 2010/63 ; Décret-loi n° 113/2013). La recherche a été approuvée par l’Organisme d’éthique et de bien-être animal de l’IPMA (ORBEA, LABVIVOS-002-AquaClimAdapt), supervisé par l’Autorité nationale pour l’utilisation des animaux vivants, connue sous le nom de Direction générale de l’alimentation et des affaires vétérinaires (DGAV), sous le numéro d’autorisation éthique 20596/25-S.
1. Modèle d’étude et maintenance des organismes
REMARQUE : Cette étude a été spécialement conçue pour les dorades royales juvéniles (Sparus aurata), d’un poids moyen de 30,0 ± 5,0 g et d’une longueur totale de 12,0 ± 2,0 cm. Cette méthode peut ne pas s’appliquer directement à d’autres espèces de poissons, car différentes espèces ont des caractéristiques physiologiques et immunologiques uniques qui peuvent affecter l’isolement des leucocytes, la fixation cellulaire et l’évaluation de la viabilité. Des adaptations au protocole pourraient être nécessaires pour d’autres espèces, et des études préliminaires sont recommandées afin d’optimiser les conditions pour chaque espèce cible.
- Acclimater le poisson (période de quarantaine)
- Répartissez les poissons également dans des bassins de grande capacité (p. ex., deux bassins d’une capacité totale de 660 L chacun - voir la figure supplémentaire 1).
REMARQUE : Les bassins à utiliser peuvent faire partie d’un système d’aquaculture en recirculation (SAR), ce qui permet une utilisation efficace de l’eau et un meilleur contrôle de la qualité de l’eau. Dans un SAR, l’eau est continuellement recyclée et traitée dans le système, offrant ainsi un environnement stable et contrôlé pour les poissons. Cette configuration aide à maintenir des conditions optimales pour la santé et la croissance des poissons, assurant une distribution uniforme et minimisant le stress pendant l’étude. - Maintenir des conditions abiotiques optimales.
- Gardez les poissons en quarantaine pendant 3 semaines dans des conditions imitant leur habitat naturel :
température : 20,0 ± 0,5 °C ;
oxygène dissous : 7,2 ± 0,2 mg/L ;
salinité : 35,0 ± 0,5 ‰ ;
pH : 8,0 ± 0,1 unités ;
Photopériode : 14 h clair/10 h sombre.
REMARQUE : Les conditions d’entretien idéales peuvent varier entre les différentes espèces de poissons. D’autres espèces peuvent avoir des exigences différentes, il est donc important d’adapter ces conditions aux besoins spécifiques de l’espèce cible pour assurer la santé et le bien-être des organismes. De plus, la température de l’eau de mer et la photopériode peuvent changer avec les saisons, de sorte que les variations saisonnières doivent être prises en compte lors de la reproduction des conditions naturelles en laboratoire.
- Gardez les poissons en quarantaine pendant 3 semaines dans des conditions imitant leur habitat naturel :
- Répartissez les poissons également dans des bassins de grande capacité (p. ex., deux bassins d’une capacité totale de 660 L chacun - voir la figure supplémentaire 1).
- Lancez l’étude expérimentale.
- Définissez le nombre d’aquariums et de poissons nécessaires en fonction de la conception de l’installation expérimentale de chaque étude de cas.
- Après la période de quarantaine, transférez le poisson dans un SAR indépendant (voir la figure supplémentaire 2).
- Équiper chaque système d’écumeurs de protéines pour éliminer les composés organiques excessifs de l’eau ; filtration physique (sac filtrant [400 μm], éponge filtrante et laine de verre) ; filtration biologique (boules bio [1,5"], stérilisateur d’eau ultraviolette et pierres à air immergées) ; des systèmes de réfrigération automatique à l’eau de mer et des réchauffeurs numériques immergés, tous deux reliés à un système de contrôle informatisé (ProfiLux) avec des capteurs de température pour ajuster la température dans chaque réservoir ; Pierres d’air immergées dans chaque réservoir pour contrôler l’oxygène dissous.
- Acclimatez les poissons pendant 2 semaines dans les nouveaux systèmes avant de poursuivre l’expérience.
- Effectuer l’entretien quotidien
- Retirez les excréments de poisson de chaque bassin d’incubation et effectuez un renouvellement de 25 % de l’eau de mer.
- Mesurez la température à l’aide d’un thermomètre de précision portable.
- Surveiller d’autres paramètres abiotiques de l’eau de mer (salinité, oxygène dissous et pH) à l’aide d’un instrument de mesure multiparamètre.
- Ajustez les paramètres abiotiques de l’eau de mer au besoin pour assurer la stabilité tout au long de l’expérience.
REMARQUE : Les conditions abiotiques dans les systèmes expérimentaux peuvent varier en fonction des exigences spécifiques de chaque étude de cas. Par exemple, si l’étude vise à simuler des changements saisonniers ou des vagues de chaleur marines, la température et la photopériode doivent être ajustées en conséquence pour imiter les variations saisonnières naturelles. De même, si l’étude se concentre sur la simulation de conditions hypoxiques ou d’acidification des océans, des ajustements doivent être apportés aux niveaux d’oxygène et au pH de l’eau de mer. Cela permet de s’assurer que les conditions expérimentales sont aussi réalistes et pertinentes que possible, ce qui améliore la validité et l’applicabilité des résultats de l’étude. - Évaluer la santé et le bien-être des poissons, en identifiant et en gérant les signes de stress ou de maladie, comme décrit aux étapes 1.2.4.6 à 1.2.4.8.
- Recherchez des comportements anormaux tels que la nage erratique, la perte d’appétit, la léthargie, l’agressivité ou l’isolement.
- Vérifiez les signes de maladie, y compris les lésions, les ulcères, la décoloration, les nageoires serrées, un mucus excessif ou un mouvement rapide des branchies.
- Consigner toutes les observations, en notant la date et les mesures prises.
- Effectuer des analyses hebdomadaires de la qualité de l’eau.
- Mesurer les niveaux d’ammoniac (NH3/NH4), de nitrite (NO2-) et de nitrate (NO3-) à l’aide d’essais colorimétriques.
REMARQUE : Assurez-vous que tous ces paramètres sont en dessous des niveaux détectables. Si les niveaux dépassent les limites, effectuez un changement d’eau supplémentaire, augmentez l’aération ou ajustez la filtration.
- Mesurer les niveaux d’ammoniac (NH3/NH4), de nitrite (NO2-) et de nitrate (NO3-) à l’aide d’essais colorimétriques.
- Nourrir et surveiller la nutrition des poissons.
- Fournir une alimentation de haute qualité qui répond aux besoins nutritionnels spécifiques des poissons juvéniles (voir le tableau supplémentaire 1 pour un exemple de la composition détaillée de la ration).
REMARQUE : Assurez-vous que la taille des granulés d’aquameat (2-3 mm) est adaptée aux juvéniles, facilitant l’ingestion et la digestion. - Ajustez la quantité de nourriture pour qu’elle corresponde à 2 % du poids corporel moyen du poisson par jour.
- Nourrissez les poissons manuellement deux fois par jour - une fois le matin et une fois l’après-midi (fixez une heure précise pour maintenir une routine d’alimentation stable).
- Fournir une alimentation de haute qualité qui répond aux besoins nutritionnels spécifiques des poissons juvéniles (voir le tableau supplémentaire 1 pour un exemple de la composition détaillée de la ration).
2. Échantillonnage de poissons, euthanasie, dissection et prélèvement des reins de la tête
- Échantillonnez les poissons des bassins.
- Sélectionnez des poissons au hasard dans les bassins pour éviter les biais d’échantillonnage.
- À l’aide d’un filet, transférez doucement le poisson dans un récipient de rétention temporaire rempli d’eau du réservoir.
REMARQUE : Minimisez le temps de manipulation pour réduire le stress.
- Préparez la solution d’euthanasie.
- Utilisez un contenant approprié (p. ex. un seau de 3 L) adapté pour contenir le poisson.
- Dissoudre la quantité appropriée de tricaïne (MS-222) dans l’eau de mer pour atteindre une concentration finale de 200 à 300 mg/L18 (ATTENTION Voir le tableau supplémentaire 2 et le fichier supplémentaire 1).
- Tamponnez la solution avec du bicarbonate de sodium à un pH de 7,2-7,5.
- Administrer la solution d’euthanasie.
- Placez le poisson dans la solution d’euthanasie pendant au moins 10 minutes ou jusqu’à ce que l’arrêt du mouvement operculaire et la perte des réflexes soient observés (confirmer l’euthanasie en vérifiant qu’il n’y a pas de réponse aux stimuli externes).
- Notez le poids corporel (g) et la longueur totale (cm) du poisson.
- Effectuer la dissection de poissons.
REMARQUE : Pour assurer une qualité optimale de l’échantillon et la viabilité cellulaire, le processus de dissection doit être terminé le plus rapidement possible, idéalement dans les 5 minutes suivant l’euthanasie.- S’assurer que la température du laboratoire est maintenue à 19 °C à l’aide de la climatisation pour minimiser les fluctuations pendant l’échantillonnage et le traitement.
- Stérilisez les outils de dissection (de préférence des instruments métalliques en autoclave si possible) et installez un espace de travail propre avec de l’éthanol à 70 % (ATTENTION, voir le tableau supplémentaire 2).
- Placez le poisson euthanasié sur le côté sur un plateau de dissection stérile, la tête pointant vers la main non dominante.
- À l’aide d’un scalpel, faites une incision soigneuse le long de la ligne médiane ventrale du poisson, de l’évent (anus) vers les branchies.
REMARQUE : Veillez à ne pas couper trop profondément pour éviter d’endommager les organes internes. - Utilisez soigneusement des ciseaux de dissection pour étendre l’incision et exposer les organes internes. Soulevez doucement les rabats de la paroi corporelle pour offrir une vue claire de l’anatomie interne.
- Localiser le rein de tête : Le rein de tête est positionné juste derrière les branchies, près de la région dorsale antérieure de la cavité corporelle, et s’étend le long de la partie supérieure de la cavité corporelle, sous la colonne vertébrale.
REMARQUE : Le rein de la tête est généralement de couleur plus foncée que les tissus environnants (Figure 1). - Nettoyez soigneusement tous les tissus environnants, tels que la graisse et le tissu conjonctif, pour mieux visualiser le rein de la tête.
REMARQUE : Cette étape nécessite une manipulation délicate pour éviter d’endommager la tête des reins. - À l’aide d’une pince à pointe fine et de ciseaux, soulevez délicatement la tête du rein et faites des coupes précises autour de celui-ci pour le libérer des tissus environnants.
REMARQUE : Manipulez le tissu avec précaution pour éviter de l’endommager. Chez un poisson pesant environ 30 g, le rein de la tête devrait peser environ 20 à 30 mg. - Placez immédiatement l’organe excisé dans une passoire cellulaire (maille de nylon de 100 μm) à l’intérieur d’une boîte de Pétri stérile pour garantir la stérilité et faciliter les étapes de traitement ultérieures.
REMARQUE : À partir de ce moment, toutes les étapes doivent être effectuées le plus rapidement possible (dans les 5 minutes) pour maintenir la viabilité cellulaire. Pour garder l’échantillon au frais, effectuez les étapes suivantes avec la boîte de Pétri placée sur un récipient rempli de glace et recouvert de papier d’aluminium.

Figure 1 : Position du rein de la tête : (A) Illustration illustrant l’emplacement typique du rein de la tête derrière les branchies et le long de la région dorsale antérieure de la cavité corporelle ; (B) Image représentative de la tête du rein chez la daurade, mettant l’accent sur sa coloration plus foncée par rapport aux tissus environnants. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Isolement des leucocytes rénaux de la tête (Figure 2)
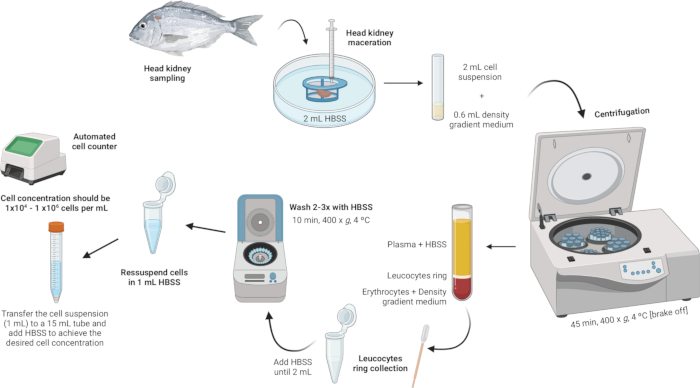
Figure 2 : Description illustrative de l’isolement des leucocytes dans le rein de la tête. Le protocole comporte plusieurs étapes : en commençant par l’homogénéisation du tissu, suivie d’une centrifugation à gradient de densité, d’un prélèvement de l’anneau leucocytaire, d’un lavage de l’anneau leucocytaire, et en terminant par la remise en suspension et l’ajustement de la concentration cellulaire. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Homogénéiser le tissu.
- Placer 2 ml de solution saline équilibrée de Hanks (HBSS) dans une boîte de Pétri stérile.
- Assurez-vous que le treillis de la crépine cellulaire (maille en nylon de 100 μm) est en contact avec le HBSS mais qu’il n’est pas complètement immergé.
- Faites macérer le rein de la tête sur la crépine cellulaire à l’aide du piston d’une seringue. Appliquez une légère pression pour forcer les fragments d’organe à travers le treillis de nylon, créant ainsi une suspension cellulaire.
REMARQUE : En cas de traitement de plusieurs échantillons, la boîte de Pétri contenant la suspension cellulaire peut être conservée au réfrigérateur à 4 °C pendant quelques minutes jusqu’à l’étape suivante. Cette suspension cellulaire sera utilisée pour l’isolement des leucocytes.
- Effectuer une centrifugation par gradient de densité.
- Préparez une solution de milieu à gradient de densité avec une densité de 1,077 g/mL, une osmolarité de 353 mOsm/kg et un pH de 7,4 (voir le fichier supplémentaire 1).
REMARQUE : L’osmolarité peut varier entre les différentes espèces de poissons, il est donc crucial d’ajuster l’osmolarité de la solution de milieu à gradient de densité pour répondre aux exigences spécifiques de chaque espèce. - Dans des tubes de polystyrène à fond rond de 5 ml, ajouter soigneusement 600 μL de la solution de milieu à gradient de densité.
- Prenez la suspension cellulaire (2 ml) et ajoutez-la lentement dans le tube contenant le milieu à gradient de densité. La première goutte est cruciale - ajoutez-la très doucement pour éviter de déstabiliser la phase moyenne du gradient de densité.
REMARQUE : Cela doit être fait à un rapport de 3:10 (gradient de densité moyen :suspension cellulaire). Utilisez une pipette Pasteur stérile de 1 ml pour un ajout précis et doux. Assurez-vous que la pointe de la pipette touche le côté du tube pour éviter de perturber la couche moyenne du gradient de densité. Évitez de mélanger l’échantillon avec le milieu à gradient de densité. - Centrifuger les tubes à 400 x g pendant 45 min à 4 °C avec le frein desserré. Cela garantit que les couches restent intactes pendant le processus.
REMARQUE : Après la centrifugation, des couches distinctes doivent être visibles. Les leucocytes formeront un anneau à l’interface entre le milieu à gradient de densité et la pastille de débris cellulaires (Figure 3).
- Préparez une solution de milieu à gradient de densité avec une densité de 1,077 g/mL, une osmolarité de 353 mOsm/kg et un pH de 7,4 (voir le fichier supplémentaire 1).

Figure 3 : Anneau leucocytaire à l’interface entre le milieu à gradient de densité et la pastille de débris cellulaires. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Récupérez l’anneau leucocytaire.
- À l’aide d’une pipette Pasteur stérile, aspirez doucement l’anneau leucocytaire (~100 μL) et transférez-le dans un tube de microcentrifugation de 2 mL.
REMARQUE : Veillez à ne pas déranger les couches de manière significative pour éviter la contamination. Si l’anneau leucocytaire semble contenir des débris ou des suspensions sombres, il est conseillé de faire passer la suspension leucocytaire collectée à travers une nouvelle crépine à mini-cellules (100 μm) pour assurer la pureté. Placez la crépine à mini-cellules sur le tube de microcentrifugation de 2 ml et transférez doucement la suspension leucocytaire à travers la crépine.
- À l’aide d’une pipette Pasteur stérile, aspirez doucement l’anneau leucocytaire (~100 μL) et transférez-le dans un tube de microcentrifugation de 2 mL.
- Lavez l’anneau leucocytaire.
- Ajouter HBSS dans les tubes de microcentrifugation contenant l’anneau leucocytaire jusqu’à ce que le volume atteigne 2 mL et remettre doucement les cellules en suspension.
REMARQUE : Conservez les tubes dans un récipient rempli de glace et recouvert de papier d’aluminium pour maintenir l’échantillon à basse température. Assurez-vous que les tubes n’entrent pas en contact direct avec la glace. Maintenez cette configuration de refroidissement tout au long du processus de lavage. - Centrifuger les échantillons à 400 × g pendant 10 min à 4 °C (le frein peut être serré).
- Après la centrifugation, jetez soigneusement le surnageant, en laissant la pastille au fond (qui peut être presque invisible).
- Répétez les étapes de lavage (ajout de HBSS, remise en suspension, centrifugation et élimination du surnageant) jusqu’à ce que la pastille soit exempte d’impuretés.
- Ajouter HBSS dans les tubes de microcentrifugation contenant l’anneau leucocytaire jusqu’à ce que le volume atteigne 2 mL et remettre doucement les cellules en suspension.
- Remettez en suspension et ajustez la concentration des cellules.
- Remettre les cellules en suspension dans 1 mL de HBSS dans les mêmes tubes de microcentrifugation de 2 mL utilisés pour les lavages.
- Atteindre une concentration cellulaire comprise entre 1 × 104 et 1 × 106 cellules par ml. Si la pastille initiale est grosse, il peut être nécessaire d’ajouter des HBSS pour diluer la concentration cellulaire à la plage souhaitée. Transférez la suspension cellulaire dans un tube de 15 mL et ajoutez plus de HBSS au besoin en fonction du nombre de cellules obtenues.
REMARQUE : L’utilisation d’un compteur cellulaire automatisé est recommandée pour faciliter le processus.
4. Coloration et fixation des leucocytes (Figure 4)
REMARQUE : Les kits de coloration à cellules mortes fixables LIVE/DEAD offrent une méthode améliorée pour évaluer la viabilité cellulaire dans les cellules fixées à l’aide de la cytométrie en flux. Ces dosages utilisent un colorant réactif fluorescent qui interagit avec les amines cellulaires. Si les membranes cellulaires sont compromises, le colorant peut pénétrer dans les cellules, réagissant avec des amines libres à l’intérieur et à la surface de la cellule, entraînant une coloration fluorescente intense. À l’inverse, dans les cellules viables, seules les amines de surface cellulaire sont disponibles pour réagir avec le colorant, ce qui entraîne une coloration relativement faible. L’intensité de la coloration est maintenue après la fixation au formaldéhyde, qui préserve également l’échantillon en empêchant la croissance des micro-organismes. Les kits de teinture à cellules mortes fixables LIVE/DEAD sont identiques, à l’exception du colorant fluorescent - disponibles en bleu, violet, aqua, jaune, vert, rouge, rouge lointain ou proche IR (infrarouge). Dans cette étude, nous avons utilisé le colorant réactif fluorescent dans le proche infrarouge. De plus, ce test monochrome permet de tester d’autres paramètres en parallèle dans une expérience multicolore.
- Préparez le colorant.
- Amenez les réactifs à température ambiante (RT) : Laissez un flacon de colorant réactif fluorescent et le flacon de diméthylsulfoxyde anhydre (DMSO) atteindre RT avant de retirer les bouchons.
- Reconstituer le colorant : Ajouter 50 μL de DMSO dans le flacon contenant le colorant réactif. Mélangez soigneusement et assurez-vous que le colorant est complètement dissous.
- Utilisez la solution colorante reconstituée dès que possible, de préférence dans les heures qui suivent.
REMARQUE : Chaque kit comprend cinq flacons individuels de colorant réactif, fournissant suffisamment de matériau pour colorer au moins 40 échantillons de cellules. Cependant, après reconstitution, la solution de DMSO du colorant est relativement instable, en particulier lorsqu’elle est exposée à l’humidité. Les portions non utilisées peuvent être conservées jusqu’à 2 semaines à ≤-20 °C, à l’abri de la lumière et de l’humidité.
- Teindre et fixer les cellules.
REMARQUE : Les tampons adaptés à la coloration cellulaire comprennent la solution saline équilibrée de Hanks (HBSS), la solution saline tamponnée au phosphate (PBS) et le PBS de Dulbecco (D-PBS), à condition qu’ils ne contiennent pas de protéines étrangères telles que l’albumine sérique bovine ou le sérum. Lorsque vous utilisez un colorant amino-réactif, évitez les tampons Tris et les solutions contenant de l’azoture de sodium ou des protéines étrangères pour la remise en suspension et le lavage des cellules. Dans cette étude, nous avons utilisé HBSS en raison de sa composition ionique équilibrée, qui aide à maintenir l’équilibre osmotique et fournit des ions essentiels et du glucose pour soutenir le métabolisme et la viabilité des cellules pendant le processus de coloration. Le HBSS est également exempt de protéines étrangères, ce qui empêche les interférences avec le colorant réactif et garantit une évaluation précise de la viabilité.- Après avoir compté les cellules et ajusté la densité à 1 x 106 cellules par mL avec HBSS, transférez 1 mL de cette suspension cellulaire dans des tubes de microcentrifugation de 2 mL.
- Pour chaque jour, induire la mort cellulaire dans au moins un échantillon à utiliser comme contrôle pour définir le seuil d’intensité de fluorescence entre les cellules vivantes et mortes. Préparez les échantillons dans des tubes de microcentrifugation comme suit :
Tube 1 : Cellules vivantes - non colorées
Tube 2 : Cellules vivantes - colorées
Tube 3 : Cellules mortes - non colorées
Tube 4 : Cellules mortes - colorées
REMARQUE : Ces quatre tubes ne doivent être préparés que pour un seul échantillon dans chaque expérience en tant que témoins. Pour les échantillons restants, seuls deux tubes sont nécessaires (Tube 1 : échantillon non coloré et Tube 2 : échantillon - coloré), car ils fourniront des informations sur les cellules vivantes et celles qui étaient mortes.
- Pour chaque jour, induire la mort cellulaire dans au moins un échantillon à utiliser comme contrôle pour définir le seuil d’intensité de fluorescence entre les cellules vivantes et mortes. Préparez les échantillons dans des tubes de microcentrifugation comme suit :
- Contrôle positif de la mort cellulaire : Placez le tube étiqueté Dead unstained (Tube 3) et Dead-stained (Tube 4) dans un bain-marie à 50 °C pendant 7 min pour induire la mort cellulaire par traitement thermique.
- Coloration des cellules : Ajouter 1 μL du colorant réactif fluorescent reconstitué (de l’étape 4.1.2) à 1 mL de suspension cellulaire dans les tubes 2 et 4 (tubes qui seront colorés) et bien mélanger.
- Incuber à RT pendant 30 min, à l’abri de la lumière.
REMARQUE : Si la fixation n’est pas requise, vous pouvez sauter les étapes 4.2.5-4.2.7 ci-dessous. Au lieu de cela, laver les cellules deux fois avec 1 mL de HBSS avec 1 % d’albumine sérique bovine (voir le fichier supplémentaire 1) et remettre en suspension dans 1 mL de HBSS avec 1 % d’albumine sérique bovine. Effectuer l’analyse sur le cytomètre en flux le plus rapidement possible ; Sinon, la viabilité des cellules peut être compromise car les cellules ne sont pas fixes. - Lavez les cellules deux fois avec 1 mL de HBSS et remettez les cellules en suspension dans 900 μL de HBSS.
- Ajouter 100 μL de formaldéhyde à 37 % (ATTENTION, voir le tableau supplémentaire 2).
- Incuber pendant 15 min à RT.
- Laver deux fois avec 1 mL de HBSS avec 1 % d’albumine sérique bovine (BSA), puis remettre les cellules en suspension dans 1 mL de HBSS avec 1 % de BSA.
- Conservez les échantillons au réfrigérateur à 4 °C. Analysez les cellules dans un délai de 1 mois après la fixation.
- Analysez la suspension cellulaire fixe par cytométrie en flux en utilisant le canal d’excitation et de détection approprié.
REMARQUE : Les canaux d’excitation et de détection corrects peuvent différer en fonction de l’instrument utilisé (voir le tableau supplémentaire 3).
- Après avoir compté les cellules et ajusté la densité à 1 x 106 cellules par mL avec HBSS, transférez 1 mL de cette suspension cellulaire dans des tubes de microcentrifugation de 2 mL.

Figure 4 : Description illustrative de la coloration et de la fixation des leucocytes. Veuillez cliquer ici pour voir une version agrandie de cette figure.
5. Cytométrie en flux
- Acquérir des données.
REMARQUE : Les procédures à suivre sur le cytomètre en flux peuvent varier en fonction du cytomètre spécifique utilisé. Dans cette étude, les données ont été acquises à l’aide du cytomètre en flux Attune NTx.- Exécutez les échantillons.
- Placez le tube d’échantillon dans l’orifice d’échantillonnage.
- Commencez l’acquisition en appuyant sur Démarrer, puis cliquez sur enregistrer une fois que le taux d’événements (événements/seconde) se stabilise.
- Enregistrez un minimum de 10 000 événements pour chaque échantillon dans la porte des singlets pour une analyse fiable.
- Enregistrez toutes les données de chaque échantillon et sauvegardez-les sur des disques externes ou un stockage en nuage.
- Analysez les données.
REMARQUE : Pour l’analyse par cytométrie en flux, plusieurs options logicielles sont disponibles. Dans cette étude, l’analyse des données a été effectuée à l’aide de FlowJo v10.8.119.- Charger les fichiers de données : Lancez le logiciel d’analyse de cytométrie en flux et téléchargez les fichiers .fcs acquis à partir de l’expérience.
- Visualisez les données (Figure 5A) : Tracez la diffusion vers l’avant (FSC-A) (XX) en fonction de la diffusion latérale (SSC-A) (YY) pour évaluer la taille et la granularité des cellules.
REMARQUE : Ce graphique est couramment utilisé pour identifier les populations cellulaires et exclure les débris en fonction de leurs propriétés de diffusion. - Exclusion de la porte de cellule singulet et des multiplets (Figure 5B) : utilisez le graphique de l’aire de diffusion vers l’avant (FSC-A) en fonction de la hauteur de diffusion vers l’avant (FSC-H) pour exclure les multiplets. Dessinez une porte pour inclure tous les événements alignés dans le graphique (cellules simples) et exclure les événements non alignés (multiplets). Si l’échantillon présente des événements avec une FSC très faible, excluez-les en ne les incluant pas sur la porte de la cellule unique, en ne laissant que les cellules singulet.
- Identification des populations de leucocytes (Figure 5C) : Distinguer les 3 populations de leucocytes en fonction du profil FSC-A/SSC-A : FSC-Aélevé/SSC-Aélevé sont les granulocytes, leFSC-A moyen/SSC-A medium sont les monocytes et FSC-Afaible/SSC-Afaible sont les lymphocytes.
- Vérification de la viabilité (Figure 5D) : Définir le seuil de coloration de viabilité sur le canal de fluorescence correspondant (NIR, RL3-A). Les cellules vivantes et mortes sont définies en fonction de l’intensité de la coloration avec la coloration à cellules mortes fixables LIVE/DEAD : les cellules colorées sombres sont définies comme les cellules vivantes, et les cellules fortement colorées sont définies comme les cellules mortes.
- Statistiques de population : examinez les statistiques fournies par le logiciel, y compris le nombre total d’événements (cellules) dans chaque porte et les pourcentages de cellules totales et fermées.
- Exporter les données : Exportez les données vers une feuille de calcul et utilisez un logiciel statistique approprié (GraphPad, Prism ou R) pour une analyse statistique plus approfondie.
REMARQUE : Le choix des méthodes d’analyse dépendra des objectifs de la recherche.

Figure 5 : Stratégie de contrôle de la cytométrie en flux pour l’évaluation de la viabilité dans les cellules rénales de la tête : (A) Représente le profil FSC-A/SSC-A de tous les événements collectés. (B) Représente l’exclusion des multiplets basée sur la définition de la région des singlets basée sur la linéarité sur le graphique de diffusion directe (FSC-A)/diffusion directe (FSC-H). (C) Représente les 3 principales populations qui ont été définies sur la base de FSC-A/SSC-A, après exclusion des multiplets. (D) Représente un histogramme montrant la coloration des colorants de viabilité vivante ou morte. Pour mettre en place le seuil permettant de distinguer les cellules vivantes des cellules mortes, les leucocytes ont été soumis à un léger choc thermique (50 °C, 7 min) puis colorés avec un colorant de viabilité. Les cellules positives à haute intensité de coloration (++) sont les cellules mortes, et les cellules positives à faible coloration (+-) sont les cellules vivantes. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
La figure 6 présente des données représentatives de cytométrie en flux montrant les populations de leucocytes isolées du rein de la tête de dorade royale juvénile (Sparus aurata) et leur viabilité cellulaire en utilisant le protocole décrit dans cette étude. La figure compare deux échantillons : l’un avec une viabilité cellulaire élevée, où les poissons ont été exposés à des conditions optimales (figure 6A), et un autre avec une faible viabilité cellulaire, où les cellules ont été exposées à un stress thermique (figure 6B).
Dans les deux échantillons, la présente méthode a permis d’identifier efficacement trois principales populations de leucocytes : les lymphocytes (LY), les monocytes (MO) et les granulocytes (GR). Ces populations ont été distinguées en fonction des différences de taille et de complexité des cellules, comme l’indiquent les graphiques de diffusion directe (FSC-A) et de diffusion latérale (SSC-A). La diffusion vers l’avant (FSC-A) indique la taille relative des cellules, tandis que la diffusion latérale (SSC-A) reflète la complexité interne ou la granularité des cellules, permettant une séparation claire des populations. Dans des conditions optimales (figure 6A), les populations de leucocytes étaient réparties comme suit : LY à 31,0 %, MO à 38,0 % et GR à 31,0 %. Cependant, dans l’échantillon exposé à un stress thermique (figure 6B), un changement dans la répartition de ces populations a été observé, avec une diminution de l’AL à 21,3 %, une augmentation de l’OM à 45,6 % et une stabilité relative du RG à 33,1 %.
Une analyse plus poussée de la viabilité cellulaire, détaillée dans les figures 6A1-A3 et 6B1-B3, révèle un contraste significatif entre les deux échantillons. Comme on peut l’observer, l’échantillon exposé à des conditions optimales (Figure 6A) présentait une viabilité plus élevée, avec une prédominance de cellules vivantes (représentées en bleu) dans toutes les populations de leucocytes. En revanche, l’échantillon soumis à un stress thermique (figure 6B) a montré une augmentation significative de la mort cellulaire (coloration plus intense indiquée en rouge), avec LY montrant 50,7 % de mort cellulaire, MO 83,7 % et GR 84,5 %.
Dans l’ensemble, les résultats démontrent clairement l’efficacité du protocole pour isoler et analyser les populations de leucocytes et évaluer la viabilité cellulaire. De plus, les données fournissent des informations précieuses sur la façon dont les conditions stressantes, telles que l’exposition thermique, influencent la dynamique des populations de leucocytes et la viabilité cellulaire. Les changements observés dans la distribution et la viabilité des cellules en cas de stress suggèrent que l’exposition thermique perturbe non seulement l’équilibre des populations de leucocytes, mais compromet également la santé des cellules. Ces changements peuvent indiquer une réponse immunitaire au stress, indiquant un mécanisme de défense actif déclenché par des facteurs de stress environnementaux.

Figure 6 : Graphiques représentatifs de cytométrie en flux illustrant l’identification et la viabilité de différentes populations de leucocytes à partir du rein de tête de dorade royale (Sparus aurata) : (A) Échantillon à haute viabilité cellulaire, exposé à des conditions optimales : Le panneau de gauche montre le contrôle des populations de leucocytes sur la base de FSC-A/SSC-A, en identifiant les lymphocytes (LY), les monocytes (MO) et les granulocytes (GR) ; Viabilité des LY (A.1), des MO (A.2) et des RG (A.3). (B) Échantillon à faible viabilité cellulaire, soumis à un stress thermique : Le panneau de gauche montre le contrôle des populations de leucocytes sur la base de FSC-A/SSC-A, identifiant les lymphocytes (LY), les monocytes (MO) et les granulocytes (GR) ; Viabilité des LY (B.1), des MO (B.2) et des RG (B.3). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure supplémentaire 1 : Image représentative d’un bassin de quarantaine d’une capacité totale de 660 L. Veuillez cliquer ici pour télécharger cette figure.
Figure supplémentaire 2 : Image de la configuration d’un système RAS. (1) Profilux ; (2) Luminaires ; (3) Aquariums/réservoirs ; (4) Réfrigérateur ; (5) Robinets d’entrée d’eau dans les aquariums ; (6) Siphon bleu pour les sorties d’eau d’aquarium ; (7) Puisard ; (8) Écumeur de protéines ; (9) Filtre mécanique (sac filtrant) ; (10) Filtre mécanique (éponge bleue + laine de verre) ; (11) Filtre biologique (biobilles) ; (12) Thermostat ; (13) Pompe principale ; (14) stérilisateur UV ; (15) capteur de température ; (A) Filtre mécanique (éponge bleue) ; (B) Filtre mécanique (laine de verre). Veuillez cliquer ici pour télécharger cette figure.
Tableau supplémentaire 1 : Composition des ingrédients ( %) et analyse immédiate ( % MS) du régime expérimental utilisé dans l’étude. Veuillez cliquer ici pour télécharger ce tableau.
Tableau supplémentaire 2 : Réactifs utilisés dans le protocole : dangers pour la santé, mentions de danger, conseils de prudence et mesures de premiers secours. Veuillez cliquer ici pour télécharger ce tableau.
Tableau supplémentaire 3 : Canaux d’excitation et de détection appropriés à utiliser avec les colorants à cellules mortes fixables LIVE/DEAD réactifs aux amines. Veuillez cliquer ici pour télécharger ce tableau.
Fichier supplémentaire 1 : Calculs pour la préparation des solutions. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
La méthode mise au point dans le cadre de cette étude représente une avancée significative dans la recherche en immunologie des poissons et promet d’améliorer la compréhension des réponses immunitaires des poissons et de la durabilité des ressources marines. S. aurata est une espèce de poisson marin précieuse de la famille des Sparidae servant d’organisme modèle idéal pour plusieurs raisons, notamment sa pertinence écologique et économique, ainsi que sa polyvalence dans la recherche en laboratoire dans plusieurs domaines d’étude tels que la physiologie, l’immunologie, la toxicologie et l’aquaculture20. L’un des principaux avantages de S. aurata est sa facilité de manipulation et d’élevage en laboratoire, avec des protocoles d’élevage bien établis qui garantissent des conditions expérimentales cohérentes et reproductibles21. De plus, sa capacité d’adaptation à l’environnement (c’est-à-dire sa grande tolérance à un large éventail de conditions environnementales, telles que les fluctuations de température et de salinité) en fait un candidat idéal pour les études visant à améliorer les techniques d’élevage et à évaluer les impacts environnementaux sur les organismes marins22. S. aurata, avec son système immunitaire bien caractérisé et la disponibilité de données génomiques, permet de débloquer les réponses immunitaires des poissons, la résistance aux agents pathogènes, l’efficacité des vaccins et la santé globale20. Compte tenu de son importance dans l’aquaculture, ainsi que dans les habitudes alimentaires des populations d’Europe du Sud, la recherche sur cette espèce peut avoir un impact direct sur les pratiques agricoles, en améliorant sa production et sa durabilité tout en relevant les défis environnementaux au sein de l’industrie20.
En ce sens, ce protocole offre plusieurs avantages et applications potentielles dans divers domaines de recherche, tels que : (i) Immunologie des poissons : Fournit une analyse précise et détaillée des cellules immunitaires du rein de tête de S. aurata, permettant l’identification et la caractérisation de différentes populations de leucocytes, ainsi que des évaluations robustes de leur viabilité cellulaire par cytométrie en flux ; ii) Recherche aquacole : essentielle à l’étude des techniques d’élevage, de la nutrition et de la gestion des maladies, elle soutient les recherches futures visant à réduire la dépendance aux antibiotiques et aux traitements chimiques, favorisant ainsi des pratiques aquacoles plus durables ; iii) Écotoxicologie : Précieuse pour l’évaluation des effets des polluants et d’autres facteurs de stress environnementaux sur la santé immunitaire des poissons, en fournissant des données pour l’évaluation des risques environnementaux et la formulation de réglementations de protection des écosystèmes aquatiques ; (iv) Physiologie comparée : Permet aux chercheurs de suivre les adaptations évolutives des systèmes immunitaires à divers défis environnementaux, en fournissant une compréhension plus approfondie des bases génétiques et physiologiques de la fonction immunitaire ; v) Biologie et écologie marines : Améliorer la compréhension des rôles et des interactions écologiques de S. aurata, en fournissant des informations sur la répartition des espèces, les préférences en matière d’habitat et l’impact des changements environnementaux sur la biodiversité marine ; (vi) Recherche biomédicale : Les poissons sont de plus en plus souvent utilisés comme organismes modèles dans la recherche biomédicale. L’isolement et l’analyse des cellules immunitaires peuvent aider à comprendre les aspects cellulaires et moléculaires essentiels à la découverte de médicaments et même à la médecine.
Pendant de nombreuses années, la quantification et l’identification des leucocytes chez les poissons reposaient sur des techniques hématologiques traditionnelles, telles que le comptage manuel avec des hémocytomètres Bürker, Neubauer ou Thoma, ainsi que sur des frottis sanguins colorés10,12. La viabilité cellulaire a également été évaluée à l’aide du test d’exclusion du bleu de trypan, suivi d’un comptage au microscopede 15, 22, 23, 24, 25, 26, 27, 28. Bien que ces méthodes aient contribué à notre compréhension de l’immunologie des poissons, elles ont plusieurs limites. Le comptage manuel des leucocytes était à la fois chronophage et laborieux, et la précision de ces techniques était souvent compromise par la variabilité de l’opérateur et l’erreur humaine, affectant considérablement la cohérence des résultats10.
En 1994, Esteban et al. ont révolutionné l’analyse des leucocytes chez les poissons en introduisant une technique permettant d’évaluer le mécanisme de défense phagocytaire chez le bar (Dicentrarchus labrax)23. Dans leur étude, les leucocytes ont été isolés à partir du sang périphérique, de la tête, des reins et des exsudats péritonéaux à l’aide de la centrifugation à gradient de densité Percoll23. Cette avancée méthodologique a marqué un bond en avant significatif, améliorant la précision et la fiabilité de l’analyse des leucocytes. À la suite des travaux pionniers d’Esteban et al., des études ultérieures ont visé à affiner et à optimiser les techniques de cytométrie en flux pour l’analyse des leucocytes, en se concentrant sur divers aspects tels que le profilage de la population cellulaire 6,15,16,28,29, la viabilité cellulaire 3,6,27,28 et l’activité phagocytaire 6,23, 24,27,28. Les progrès réalisés dans les procédures d’isolement, y compris l’utilisation de différents milieux à gradient (par exemple, Ficoll vs Percoll) et les protocoles de centrifugation optimisés, ont amélioré la pureté et le rendement des leucocytes isolés 1,8,14,26. Le développement de techniques de coloration avancées et l’utilisation de colorants fluorescents, tels que l’iodure de propidium (PI) et l’iodure de 3,3'-dihexyloxacarbocyanine (DiOC6(3)) ont permis une discrimination plus précise entre les cellules viables et non viables, ainsi qu’une caractérisation détaillée des populations de leucocytes, respectivement16,30. L’un des avantages majeurs de cette technique est sa capacité à distinguer simultanément différentes populations de leucocytes (lymphocytes, monocytes et granulocytes) et à évaluer la viabilité cellulaire de chaque population. Cela permet aux chercheurs d’identifier les populations les plus touchées dans des conditions spécifiques, ce qui permet de mieux comprendre la réponse immunitaire et de révéler les sous-ensembles de leucocytes les plus vulnérables. Cependant, malgré ces améliorations, les méthodes actuelles se heurtent encore à des limites. La plupart des recherches se sont concentrées sur les poissons adultes, laissant une lacune dans l’étude des stades juvéniles. Les poissons juvéniles présentent des défis uniques pour l’extraction des leucocytes en raison de leur petite taille et de la difficulté d’obtenir des échantillons de haute qualité à partir de leurs organes immunitaires proportionnellement plus petits17. L’étude décrite ici aborde spécifiquement ces questions en optimisant le protocole pour les poissons juvéniles, en ajustant le rapport de suspension cellulaire et la solution Percoll pour améliorer la qualité de l’extraction des leucocytes. De plus, les méthodes existantes sont souvent limitées par le nombre d’échantillons ou de répétitions qui peuvent être traités en même temps en raison du besoin immédiat d’évaluation de la viabilité des leucocytes. Tout retard dans la manipulation des échantillons peut nuire à la viabilité des cellules, compliquer le processus d’échantillonnage et compromettre les résultats. Pour surmonter cette limitation, cette étude introduit l’utilisation d’une nouvelle technique de coloration qui permet la fixation et l’analyse des cellules jusqu’à 1 mois après la fixation. Cette innovation offre une plus grande flexibilité dans les calendriers d’échantillonnage, permettant aux chercheurs de traiter et d’analyser les échantillons à leur convenance, améliorant ainsi considérablement le flux de travail et la fiabilité des évaluations par cytométrie en flux.
Le succès de ce protocole repose sur plusieurs étapes critiques, chacune nécessitant une exécution minutieuse pour garantir l’intégrité et la viabilité des leucocytes, qui sont ensuite analysés par cytométrie en flux. La préparation correcte de la solution d’euthanasie et l’ajustement du pH sont essentiels pour une euthanasie efficace. Des solutions mal préparées peuvent entraîner une euthanasie incomplète ou un stress supplémentaire pour le poisson18. Une dissection précise et minutieuse du rein de la tête est essentielle pour éviter la contamination. Le maintien de la stérilité et de l’intégrité des tissus est crucial pour obtenir des échantillons de leucocytes de haute qualité. La densité, l’osmolarité et le pH de la solution Percoll doivent être correctement ajustés pour une séparation efficace des leucocytes. Il est essentiel d’aspirer doucement l’anneau leucocytaire à l’aide d’une pipette stérile pour éviter la contamination et la perturbation des couches de gradient. Un lavage efficace des cellules après la collecte est essentiel pour éliminer les résidus de Percoll et autres impuretés. La répétition du processus de lavage garantit une granule de cellule propre prête à être fixée. Le colorant réactif doit être préparé immédiatement avant utilisation pour garantir son efficacité, car une mauvaise manipulation peut compromettre sa stabilité. L’ajout de colorant et le temps d’incubation sont essentiels pour distinguer avec précision les cellules vivantes des cellules mortes. La fixation des cellules avec 3,7 % de formaldéhyde est une étape essentielle pour préserver la morphologie cellulaire et assurer une identification précise des cellules mortes. La concentration de formaldéhyde doit être précise et les temps d’incubation doivent être strictement suivis pour éviter des résultats inexacts. Il est important de laver les cellules après la fixation pour éliminer tout excès de colorant et de formaldéhyde, qui pourraient interférer avec l’analyse ultérieure. Le stockage adéquat des échantillons fixes et leur analyse en temps opportun sont nécessaires pour maintenir l’exactitude des données. Il est essentiel d’ajuster les canaux d’excitation et de détection pour qu’ils correspondent au colorant spécifique utilisé pour obtenir des résultats précis de cytométrie en flux.
Malgré ses nombreux avantages, cette méthode présente certaines limites qui doivent être prises en compte. L’une des principales limites est sa nature spécifique à l’espèce, car le protocole est optimisé pour la dorade royale juvénile (S. aurata), un poisson marin. Cela signifie que son efficacité peut varier lorsqu’il est appliqué à d’autres espèces de poissons, en particulier les poissons d’eau douce. Les différences de bilan osmotique entre les espèces marines et d’eau douce peuvent nécessiter des ajustements aux zones tampons utilisées dans le protocole, car les solutions adaptées aux conditions salines peuvent ne pas convenir aux espèces d’eau douce. De plus, les différences dans la structure des tissus, la densité cellulaire et les réponses physiologiques peuvent nécessiter des ajustements au protocole, ce qui peut affecter la reproductibilité et l’uniformité entre les différentes espèces.
Un autre facteur important est l’entretien des poissons avant le prélèvement des échantillons. Chaque espèce a des conditions d’eau optimales spécifiques cruciales pour maintenir la santé des poissons et assurer la qualité des résultats expérimentaux20. Les variations de paramètres tels que la température, la salinité et le pH peuvent affecter la viabilité cellulaire et la qualité des données, car des conditions sous-optimales peuvent induire un stress physiologique qui compromet l’intégrité cellulaire. Pour garantir des résultats expérimentaux cohérents, il est important de conserver toutes les répétitions dans les mêmes conditions contrôlées, qu’elles soient optimales ou intentionnellement sous-optimales (selon les objectifs de l’étude).
La variabilité des techniques de manipulation et de dissection peut également avoir un impact sur la qualité et la quantité de leucocytes rénaux de la tête, ce qui fait de la compétence et de l’expérience de l’opérateur un facteur critique pour le succès du protocole. De plus, le maintien de la viabilité cellulaire tout au long du processus d’isolement peut être un défi, car tout délai entre l’euthanasie et la fixation cellulaire peut entraîner une diminution de la viabilité et des résultats biaisés. Le traitement immédiat des tissus et des cellules est essentiel pour maintenir une viabilité cellulaire élevée, mais cette exigence peut être difficile à atteindre de manière constante, en particulier lorsque l’on travaille avec un grand nombre d’échantillons.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts financier, personnel ou professionnel qui aurait pu influencer la recherche, l’analyse, l’interprétation des données, la rédaction ou la décision de soumettre le manuscrit pour publication.
Remerciements
Ce travail a été soutenu par la Fundação Portuguesa para a Ciência e Tecnologia (FCT I.P.), dans le cadre du projet Aqua-CLIMADAPT (PTDC/CTA-AMB/0592/2021, https://doi-org.remotexs.ntu.edu.sg/10.54499/PTDC/CTA-AMB/0592/2021). Nous saluons le BioLab soutenu par l’Unité de biosciences moléculaires appliquées (UCIBIO) et l’Unité de recherche du Laboratoire associé de chimie verte – LAQV, qui sont financés par des fonds nationaux de FCT/MCTES (UIDB/04378/2020 et UIDB/50006/2020, respectivement), ainsi que par le Laboratoire associé Institute for Health and Bioeconomy – i4HB (LA/P/0140/2020). Ce travail a également été soutenu par la Commission européenne par le biais du projet GLYCOTwinning (accord de subvention n° 101079417) et FCT par le biais d’InnoGlyco (2022.04607.PTDC). Isa Marmelo remercie également FCT I.P. pour la bourse de doctorat (2020.04413.BD, https://doi-org.remotexs.ntu.edu.sg/10.54499/2020.04413.BD).
matériels
| Name | Company | Catalog Number | Comments |
| Air Stones | N/A | N/A | |
| Aquafeed | SPAROS, Lda., Portugal | N/A | High-quality diet |
| Automatic Cell Counting Equipment | NanoEnteK, Korea | N/A | EVE automatic cell counter (NanoEnteK) |
| Automatic Water Refrigeration Systems | Foshan Weinuo Refrigeration Equipment Co., Ltd, China | N/A | |
| Bio balls 1.5" Aquarium Pond Filter | TMC Iberia, Portugal | N/A | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich, Germany | A7906 | |
| Bucket (3 L) | N/A | N/A | To prepare and carry out euthanasia |
| Buckets (5 L) | N/A | N/A | To transport the animals |
| Cell Strainers | Jetbiofil, China | CSS-013-100 | Cell Strainer, 100 μm nylon mesh, Sterile, Yellow |
| Centrifugue | Fisher Scientific, Germany | N/A | accuSpin Micro 17 R |
| Colorimetric Test Kit for Ammonia (NH4+/NH3) | Tropic Marin, USA | N/A | |
| Colorimetric Test Kit for Nitrate (NO3-) | Tropic Marin, USA | N/A | |
| Colorimetric Test Kit for Nitrite (NO2-) | Tropic Marin, USA | N/A | |
| Computer | N/A | N/A | To acquire and analyse the data obtained from the flow cytometer |
| Computerized Control System (Profilux) | GHL, Germany | N/A | ProfiLux 3 Outdoor |
| Deionized water | N/A | N/A | To clean the Flow Cytometer |
| Density Gradient Medium: Percoll | Cytiva, Sigma-Aldrich, Germany | 17-0891-01 | |
| Digital scale | KERN & Sohn GmbH, Germany | N/A | KERN EMS 300-3 |
| Ethanol 70% | Millipore, Supelco, Portugal | EX0281 | To keep the workspace clean |
| EVE Cell Counting Slides | NanoEnteK, Korea | N/A | |
| Falcon Tubes (15 mL) | pluriSelect Life Science, Germany | 05-00002-01 | Sterile |
| Filter bag | TMC Iberia, Portugal | N/A | 400 micron |
| Filter Sponge | N/A | N/A | |
| Flow Cytometer | ThermoFisher Scientific, USA | N/A | Attune flow cytometer |
| FlowJo v10.8.1 Software | BD Life Sciences | N/A | |
| Formaldehyde 37% | Sigma-Aldrich, Germany | 8.18708 | |
| Glass Wool | N/A | N/A | |
| Hanks' Balanced Salt Solution | Merck Life Science S.L, Portugal | H6648 | Modified, with sodium bicarbonate, without phenol red, calcium chloride and magnesium sulfate, liquid, sterile-filtered, suitable for cell culture |
| LIVE/DEAD Fixable Dead Cell Stain Kits | Life Technologies Europe, Netherlands | L10119 | Near-IR fluorescent reactive dye + DMSO |
| Main Water Pumps | EHEIM, Germany | Universal 1200 | |
| Microcentrifuge Tubes (2 mL) | BRAND, Merck, Germany | Z628034 | Sterile |
| Micropipette Tips | Sartorius, Germany | 790010, 790200, 791000 | Compatible with Sartorius, 1-10 µL, 2-20 µL, 20-200 µL, 100-1000 µL |
| Micropipettes | Sartorius, Germany | 728020, 728030, 728060, 728070 | Sartorius ProlinePlus 1-10 µL, 2-20 µL, 20-200 µL, 100-1000 µL |
| Mini Cell Strainers | pluriSelect Life Science Global Headoffice, Germany | 43-10100-50 | PluriStrainer 100 µm nylon mesh, Sterile |
| Multi-Parameter Measuring Instrument | WTW, Germany | Multi 3420 SET G + IDS digital conductivity cell (TetraCon 925) + Optical IDS DO sensor (FDO 925) + IDS pH-electrode (SenTix 940) | |
| Pasteur Pipettes (1 mL, 5 mL) | Humeau Expert du laboratoire, France | 248295 | Sterile |
| Petri dishes | Sarstedt, Germany | 82.1194.500 | 60 x 15 mm, Polystyrene, Sterile |
| pH Meter | Hanna Instruments Inc., Romania | HANNA HI2211 | |
| Polystyrene round-bottom Falcon tubes (5 mL) | Fisher Scientific, Germany | 14-959-2A | Sterile |
| Portable Precision Thermometer | Ebro Electronic, Germany | N/A | TFX 430 |
| Protein Skimmers | Mantis | N/A | Tornado 120 |
| Quality control beads/Performance test beads | Thermofisher Scientific, USA | N/A | |
| Quarantine Tanks | N/A | N/A | Tanks with 660 L total volume |
| Rectangular Glass Tanks/Aquariums | N/A | N/A | Tanks with 200 L total volume |
| Refrigerator | N/A | N/A | To store the samples at 4 °C |
| Ruler 30 cm | N/A | N/A | To measure the fish's length |
| Sodium bicarbonate | Honeywell Fluka, Germany | 31437 | Sodium hydrogen carbonate (NaHCO3) |
| Sodium chloride | Sigma-Aldrich, Germany | S9888 | |
| Sterile Dissection Tools | N/A | N/A | (e.g. scalpel, scissors, fine-tipped forceps, dissecting tray/board) |
| Submerged Digital Heaters | TMC Iberia, Portugal | 300 W, V2Therm Digital Heaters | |
| Syringes 1 mL | IVFSTORE, USA | 8300014579-MEA | Sterile, HSW Soft-Ject Syringes to macerate head-kidney |
| Temperature Sensors | GHL, Germany | PT 1000 | |
| Tricaine (MS-222) | ThermoFisher Scientific, Germany | 118000500 | Ethyl 3-aminobenzoate, methanesulfonic acid salt, 98% (C10H15NO5S) |
| Ultraviolet Water Sterilizer | EHEIM, Germany | 5305010 | ClearUVC-36 |
| Water Bath | Fisher Scientific, Germany | N/A | Fisherbrand IsotempTM (P/N U01318) |
| Water-resistant Luminaires | N/A | N/A |
Références
- Samaï, H.C. et al. Procedures for leukocytes isolation from lymphoid tissues and consequences on immune endpoints used to evaluate fish immune status: A case study on roach (Rutilus rutilus). Fish Shellfish Immunol. 74, 190-204 (2018).
- Mokhtar, D. M., Zaccone, G., Alesci, A., Kuciel, M., Hussein, M. T., Sayed, R. K. A. Main components of fish immunity: An overview of the fish immune system. Fishes. 8 (2), 93 (2023).
- Lulijwa, R. et al. Characterisation of Chinook salmon (Oncorhynchus tshawytscha) blood and validation of flow cytometry cell count and viability assay kit. Fish Shellfish Immunol. 88, 179-188 (2019).
- Uribe, C., Folch, H., Enriquez, R., Moran, G. Innate and adaptive immunity in teleost fish: a review. Vet Med. 56 (10), 486-503 (2011).
- Bjørgen, H., Koppang, E. O. Anatomy of teleost fish immune structures and organs. Immunogenetics. 73 (1), 53-63 (2021).
- Santos, R. A. et al. In vitro modulation of gilthead seabream (Sparus aurata L.) leukocytes by Bacillus spp. extracellular molecules upon bacterial challenge. Fish Shellfish Immunol. 121, 285-294 (2022).
- Witeska, M., Kondera, E., Ługowska, K., Bojarski, B. Hematological methods in fish - Not only for beginners. Aquaculture. 547, 737498 (2022).
- Titus, J. et al. Development and validation of a flow cytometry method to examine circulating leukocyte subpopulations in barramundi (Lates calcarifer). Comp Immunol Rep. 6, 200142 (2024).
- Marmelo, I. et al. Eco-innovative aquafeeds biofortified with Asparagopsis taxiformis to improve the resilience of farmed white seabream (Diplodus sargus) to marine heatwave events. Heliyon. 10 (15), e35135 (2024).
- Seibel, H., Baßmann, B., Rebl, A. Blood Will Tell: What Hematological Analyses Can Reveal About Fish Welfare. Front Vet Sci. 8, 616955 (2021).
- Franke, A., Beemelmanns, A., Miest, J. J. Are fish immunocompetent enough to face climate change? Biol Lett. 20 (2), 20230346 (2024).
- Fazio, F. Fish hematology analysis as an important tool of aquaculture: A review. Aquaculture. 500, 237-242 (2019).
- Fazio, F., Saoca, C., Costa, G., Zumbo, A., Piccione, G., Parrino, V. Flow cytometry and automatic blood cell analysis in striped bass Morone saxatilis (Walbaum, 1792): A new hematological approach. Aquaculture. 513, 734398 (2019).
- Lulijwa, R., Alfaro, A. C., Merien, F., Meyer, J., Young, T. Advances in salmonid fish immunology: A review of methods and techniques for lymphoid tissue and peripheral blood leucocyte isolation and application. Fish Shellfish Immunol. 95, 44-80 (2019).
- Esteban, M. Á., Muñoz, J., Meseguer, J. Blood cells of sea bass (Dicentrarchus labrax l.). Flow cytometric and microscopic studies. Anat Rec. 258 (1), 80-89 (2000).
- Inoue, T., Moritomo, T., Tamura, Y., Mamiya, S., Fujino, H., Nakanishi, T. A new method for fish leucocyte counting and partial differentiation by flow cytometry. Fish Shellfish Immunol. 13 (5), 379-390 (2002).
- Ye, R. R. et al. Immune competence assessment in marine medaka (Orzyias melastigma)-a holistic approach for immunotoxicology. Environ Sci Pollut Res. 24 (36), 27687-27701 (2017).
- American Veterinary Medical Association. AVMA Guidelines for the Euthanasia of Animals: 2020 Edition. American Veterinary Medical Association, Schaumburg, IL (2020).
- FlowJoTM Software (for Windows). Version v10.8.1 (BD Life Sciences). At < https://www.bdbiosciences.com/en-us/products/software/flowjo-v10-software> (2023).
- Mhalhel, K. et al. Review on Gilthead Seabream (Sparus aurata) aquaculture: Life cycle, growth, aquaculture practices and challenges. J Mar Sci Eng. 11 (10), 2008 (2023).
- Toni, M., Manciocco, A., Angiulli, E., Alleva, E., Cioni, C., Malavasi, S. Review: Assessing fish welfare in research and aquaculture, with a focus on European directives. Animal. 13 (1), 161-170 (2018).
- Kır, M. Thermal tolerance and standard metabolic rate of juvenile gilthead seabream (Sparus aurata) acclimated to four temperatures. J Therm Biol. 93, 102739 (2020).
- Esteban, M. Á, Meseguer, J. Phagocytic defence mechanism in sea bass (Dicentrarchus labrax L.): An ultrastructural study. Anat Rec. 240 (4), 589-597 (1994).
- Esteban, M. Á., Mulero, V., Muñoz, J., Meseguer, J. Methodological aspects of assessing phagocytosis of Vibrio anguillarum by leucocytes of gilthead seabream (Sparus aurata L.) by flow cytometry and electron microscopy. Cell Tissue Res. 293 (1), 133-141 (1998).
- Rodríguez, A., Esteban, M. Á., Meseguer, J. Phagocytosis and peroxidase release by seabream (Sparus aurata L.) leucocytes in response to yeast cells. Anat Rec A Discov Mol Cell Evol Biol. 272 (1), 415-423 (2002).
- Hamoutene, D., Payne, J. F., Volkoff, H. Effects of tebufenozide on some aspects of lake trout (Salvelinus namaycush) immune response. Ecotoxicol Environ Saf. 69 (2), 173-179 (2007).
- Pierrard, M.-A., Roland, K., Kestemont, P., Dieu, M., Raes, M., Silvestre, F. Fish peripheral blood mononuclear cells preparation for future monitoring applications. Anal Biochem. 426 (2), 153-165 (2012).
- Guardiola, F. A., Logothetis, P., Meseguer, J., Esteban, M. Á. Evaluation of silver nanospheres on viability and innate cellular parameters of gilthead seabream (Sparus aurata L.) head-kidney leucocytes. Fish Shellfish Immunol. 69, 99-107 (2017).
- Campos-Sánchez, J. C., Guardiola, F. A., Esteban, M. Á. In vitro effects of cantharidin on gilthead seabream (Sparus aurata) head-kidney leucocytes. Fish Shellfish Immunol. 123, 20-35 (2022).
- Korytář, T., Dang Thi, H., Takizawa, F., Köllner, B. A multicolour flow cytometry identifying defined leukocyte subsets of rainbow trout (Oncorhynchus mykiss). Fish Shellfish Immunol. 35 (6), 2017-2019 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon