Method Article
フローサイトメトリーによる幼若魚イタドリ頭部腎臓白血球の単離、固定および特性評価
要約
この原稿では、金箔鯛の頭部腎臓から抽出した白血球の単離と固定、およびフローサイトメトリーによる生存率の評価について説明しています。この研究は、プロトコルの標準化に貢献し、サンプルの品質を損なうことなくより多くのサンプルの処理を活用し、魚の免疫学知識の進歩を促進します。
要約
免疫は生物の生理学的調節に不可欠であり、病原体や環境ストレス要因に対する主要な防御として機能します。免疫細胞の単離と解析は、外部からの圧力に対する免疫応答に関する重要な洞察を提供します。しかし、海産魚など、あまり研究されていない種については、調和のとれたプロトコルがないため、技術的および分析的な課題が生じ、データの解釈や種特異的な免疫応答の完全な理解が妨げられることがよくあります。この研究は、金箔の鯛の稚魚(Sparus aurata)の頭部腎臓(魚類の主要な造血器官)から採取された白血球の生存率を特徴付け、決定するための最適化されたフローサイトメトリーベースの分析手順を設定することを目的としていました。この手順は、Hanksの平衡塩溶液を使用した均質化プロセスによる白血球の単離から始まり、その後、最適化されたPercoll密度勾配遠心分離法により、その後の効率的なフローサイトメトリー分析に必要な赤血球汚染を最小限に抑えながら白血球の高い回収率を確保しました。さらに、細胞反応性色素を用いた新しい技術(LIVE/DEAD Fixable Dead Cell Stain Kit)を採用し、蛍光染色パターンに基づいて生存細胞と死細胞を区別しました。3.7%のホルムアルデヒドで固定を行い、細胞の形態、生存率、および染色効率を維持しました。フローサイトメトリー解析により、リンパ球、単球、顆粒球の3つの主要な白血球集団を同定することに成功しました。この方法により、生存率試験だけでなく、細胞タイプの正確な分化も可能になりました。フローサイトメトリープロトコルの改善は、免疫細胞解析の精度と効率を向上させることにより、魚類免疫学における一歩前進を表しています。さらに、このプロトコルは、後の解析のために細胞を固定することができるため、免疫評価に必要な時間と労力を大幅に削減し、研究だけでなく、さまざまな研究分野での実用化にも貴重なツールとなります。
概要
免疫は、生物の生理学的調節において中心的な役割を果たし、さまざまな病原体や環境ストレス要因に対する主要な防御として機能します1。他の脊椎動物と同様に、魚類は、全体的な健康と幸福に不可欠な、複雑で動的で協調的な免疫システムを持っています1。
魚類は自然免疫系と適応免疫系の両方を持っており、これらは同時に機能し、有害な侵入者を検出し、反応し、中和します2。自然免疫系は防御の最前線として機能し、病原体に対して即時かつ非特異的な反応を示します2、一方、適応免疫系は時間の経過とともに発達し、魚が特定の病原体を認識し、免疫学的記憶を確立することを可能にするより特殊な応答を提供します3。魚類の免疫系は、特殊な一次リンパ器官(胸腺および頭部腎臓)および二次リンパ器官(脾臓および粘膜関連リンパ組織(MALT)など)に依存して、免疫防御をサポートし、全体的な健康を維持します4。頭部腎臓は、魚類の主要な造血器官であり、白血球5を含む免疫細胞の発生と成熟に重要な役割を果たしている。
近年、いくつかの魚種の免疫応答の研究は大きな進歩を遂げています2。焦点を当てている重要な分野の1つは、白血球の集団とその活動を理解することです。白血球は、白血球とも呼ばれ、一般に単球、リンパ球、顆粒球に分類され、魚の免疫防御に重要な役割を果たしています。それらは食細胞を持っており、病原体を飲み込んで破壊し、殺菌活性酸素種を放出する役割を担っており、侵入する微生物の排除に貢献しています6。白血球は炎症過程にも関与しており、組織の修復を促進しながら感染を分離および根絶するのに役立ちます6。白血球集団の存在量と活性は、動物の健康と病気における免疫状態の重要な指標です7,8。
いくつかの研究では、悪環境条件などのストレス要因が赤血球の数と形態、および循環白血球の組成を変化させる可能性があることが実証されています9,10。例えば、Franke et al. (2024) がレビューしたように、環境ストレス要因は魚の免疫を損ない、病気の感受性を高め、特定の病原体の感染力を高め、最終的に病気の進行を加速させる可能性があるため、気候変動シナリオにおける魚の免疫系を研究することが重要です11。また、魚類の免疫力を理解することは、基礎生物学研究を進めるだけでなく、養殖業など社会のさまざまな分野を支えるためにも不可欠です。養殖が世界的に拡大し続ける中、養殖魚種の健康と福祉を確保することはますます重要になっています。しかし、魚の福祉は依然として比較的新しい研究分野であり、養殖魚の免疫応答には依然として徹底的かつ標準化された評価が必要です。免疫応答研究を優先することは最も重要であり、得られた情報は、養殖動物の福祉と回復力を向上させる効果的でカスタマイズされたアプローチを通じて、水産養殖の持続可能性と生産性を向上させることができます。
白血球の定量と同定は、通常、ビュルカー、ノイバウアー、またはトーマ血球計算盤による手動カウントや、染色された血液塗抹標本7,10などの血液学的方法を使用して行われます。血液細胞の可視化と分化を支援するために、Wright、May-Grünwald-Giemsa、Hemacolorなどの染色キットがよく採用されます7,12。しかし、これらの手動による細胞カウント技術は面倒で時間がかかり、人為的ミスが発生しやすい8,10。エラーの一般的な原因には、血液の不適切な混合または希釈、染色の問題、血球計算盤チャンバーの不適切なローディングなどがあり、これらはすべて不正確な細胞数につながる可能性があります12。さらに、手動の血液学的分析では、結果の信頼性と再現性を確保するために、高度な専門知識と経験が必要です7。正確で効率的な診断ツールへの需要が高まる中、魚の個体群の免疫状態を深く理解する革新的な方法の開発は、この分野を前進させる上でますます重要なステップとなっています。
フローサイトメトリーは、この文脈における強力なツールとして浮上しており、白血球集団と細胞生存率8を解析するためのハイスループットで定量的なアプローチを提供しています。この最新の診断技術により、混合集団の個々の細胞の迅速な検出、カウント、および特性評価が驚くべき精度で可能になります13。さらに、フローサイトメトリーでは、表現型と機能的特性の両方について、マルチパラメトリックな同時測定が可能です。人間の臨床現場や獣医学で広く使用されていますが、魚の白血球の研究におけるその応用は非常に限られています8。さまざまな魚種1,6,8,13,14,15,16,17についていくつかの研究が行われてきましたが、いくつかの重要な課題に対処する必要があります。これらの解析における大きな課題の1つは、末梢血や頭部腎臓などのリンパ組織から抽出した生きた白血球の懸濁液を得る必要があることである1。白血球の単離は、魚類の独特な特性、すなわち有核赤血球の存在のためにしばしば困難である。赤血球による意図しない汚染は、そのサイズ、卵形、および核の存在により、白血球の分析を妨げる可能性があります1。したがって、白血球懸濁液から赤血球を除去して高い純度を達成し、フローサイトメトリー分析によって白血球の表現型および機能特性を研究することが不可欠です。哺乳動物では、白血球の単離には通常、赤血球の浸透圧溶解またはFicollまたはPercoll1による密度勾配分離が含まれます。しかし、浸透圧溶解は、赤血球が有核化しているため、海産魚にも淡水魚にも効果がなく、適切に溶解することはできません1。代わりに、密度勾配分離は、細胞の安定性を経時的に効果的に維持するため、魚類に適しています1。いくつかの研究では、稚魚から白血球を単離することに成功していますが、多くの研究はまだ主に成魚の集団に焦点を当てています17。それにもかかわらず、初期の段階は病気の発生に対してより脆弱であるだけでなく、サイズも小さいため、サンプリングプロセスがより複雑で困難になります。また、現在の分析法では、白血球の生存率を評価するには即時の処理が必要なため、一度にサンプル数や反復数が限られていることが多いという制限もあります。サンプル処理の遅延は、細胞の生存率に悪影響を及ぼし、サンプリングプロセスにさらなる複雑さをもたらし、研究全体を危険にさらす可能性があります。
私たちの知る限りでは、発表された方法のいずれも、フローサイトメトリーによるその後の生存率解析のために白血球細胞をうまく固定していません。本研究は、南欧諸国で養殖されている主要な魚種である金箔鯛(Sparus aurata)の頭部腎臓から白血球をPercoll密度勾配分離法を用いて効率的に単離する方法を確立した先駆的な研究です。また、フローサイトメトリーを通じて主要な白血球集団(リンパ球、単球、および顆粒球)を同定しながら、生細胞と死細胞を区別する改良された染色ベースの技術も紹介します。改良されたプロトコールには細胞固定が伴い、処置後1ヶ月までの生存細胞解析が可能になります。このフローサイトメトリープロトコルの実装は、免疫評価に通常必要な時間と労力を大幅に削減する可能性を秘めており、水産養殖セクター内の研究とより実用的なアプリケーションの両方にとって貴重な技術となります。この方法論の適用は、多数のサンプルを分析し、細胞を保存し、フローサイトメトリーによる遅延分析を可能にするという利点を提供します。したがって、魚の免疫メカニズムや、細胞の生存能力がさまざまな環境条件や実験条件によってどのように影響を受けるかについて、貴重な洞察を得ることは非常に役立つかもしれません。さらに、この生存率アッセイは、特定の免疫細胞集団のマルチパラメトリック表現型および機能特性評価と統合することができます。このアプローチにより、いくつかの免疫学的パラメータのより包括的な解析が可能になり、それらを対応する細胞タイプに直接リンクし、免疫応答をより明確に理解することができます。これらの知見は、水産養殖における疾病管理のアプローチの改善など、より効果的な戦略の開発に貢献する可能性がある。
プロトコル
このプロトコルは、動物実験の認定を受けた研究者(EU機能AおよびB)によって実施されなければなりません。動物の取り扱いとサンプル収集に関連するすべての手順は、ARRIVEガイドライン(Animal Research: in vivo Experimentsの報告)に準拠し、欧州実験動物科学協会連盟(FELASA)の推奨事項に従って、動物の世話と使用に関する倫理基準を遵守しなければなりません。本研究は、これらすべての基準と、実験動物科学に関するポルトガルの法律(EU指令2010/63;政令-法律第113/2013号)。この研究は、IPMAの動物福祉・倫理機関(ORBEA, LABVIVOS-002-AquaClimAdapt)によって承認され、国立生物動物使用局(National Authority for the Use of Live Animals)の監督下にある食品獣医学総局(DGAV)によって、倫理クリアランス番号20596/25-Sで承認されました。
1. 研究モデルと生物のメンテナンス
注:この研究は、平均体重が30.0±5.0 g、全長が12.0 ± 2.0 cmの幼魚である金箔鯛(Sparus aurata)のために特別に設計されました。この方法は、他の魚種に直接適用できない場合があります。これは、異なる種が白血球の分離、細胞固定、および生存率の評価に影響を与える可能性のある独自の生理学的および免疫学的特性を持っているためです。他の種については、プロトコルへの適応が必要になる場合があり、各対象種に対して条件を最適化するための予備的な研究が推奨される。
- 魚の順応(検疫期間)
- 魚を大容量の水槽に均等に分配します(たとえば、それぞれ合計容量が660 Lの2つの水槽- 補足図1を参照)。
注:使用するタンクは、効率的な水の使用と水質の管理の改善を可能にする再循環養殖システム(RAS)の一部である場合があります。RASでは、水はシステム内で継続的にリサイクルおよび処理され、魚に安定した制御された環境を提供します。この設定は、魚の健康と成長に最適な条件を維持し、均一な分布を確保し、研究中のストレスを最小限に抑えるのに役立ちます。 - 最適な非生物的条件を維持します。
- 魚を自然の生息地を模倣した条件下で3週間隔離します。
温度:20.0 ± 0.5°C;
溶存酸素:7.2 ± 0.2 mg / L;
塩分濃度:35.0 ± 0.5 ‰;
pH:8.0±0.1単位;
日長:14時間明るい/10時間暗い。
注意: 理想的なメンテナンス条件は、魚種によって異なる場合があります。他の種には異なる要件がある場合があるため、生物の健康と福祉を確保するために、これらの条件を対象種の特定のニーズに適合させることが重要です。また、海水温や日長は季節によって変化するため、実験室で自然条件を再現する際には季節変動を考慮する必要があります。
- 魚を自然の生息地を模倣した条件下で3週間隔離します。
- 魚を大容量の水槽に均等に分配します(たとえば、それぞれ合計容量が660 Lの2つの水槽- 補足図1を参照)。
- 実験的研究を開始します。
- 各ケーススタディの実験セットアップデザインに基づいて、必要な水槽と魚の数を定義します。
- 検疫期間後、魚を独立したRASに移します( 補足図2を参照)。
- 各システムにプロテインスキマーを装備して、水から過剰な有機化合物を除去します。物理的ろ過(フィルターバッグ[400μm]、フィルタースポンジ、グラスウール);生物学的ろ過(バイオボール[1.5インチ]、紫外線水滅菌器、水中エアストーン)。自動海水冷凍システムと水中デジタルヒーターは、どちらも温度センサーを備えたコンピューター制御システム(ProfiLux)に接続され、各タンクの温度を調整します。溶存酸素を制御するために、各タンクにエアストーンを沈めます。
- 実験を進める前に、魚を新しいシステムに2週間順応させます。
- 日常のメンテナンスを行う
- 各インキュベーションタンクから魚の糞を取り除き、25%の海水の更新を行います。
- ポータブル精密温度計を使用して温度を測定します。
- マルチパラメータ測定器を使用して、他の海水非生物的パラメータ(塩分、溶存酸素、pH)を監視します。
- 必要に応じて海水の非生物的パラメータを調整し、実験全体の安定性を確保します。
注:実験システムの非生物的条件は、各ケーススタディの特定の要件によって異なります。例えば、この研究が季節変化や海洋熱波のシミュレーションを目的としている場合、気温と日長は、自然の季節変動を模倣するようにそれに応じて調整する必要があります。同様に、研究が低酸素状態または海洋酸性化のシミュレーションに焦点を当てている場合は、海水の酸素レベルとpHを調整する必要があります。これにより、実験条件が可能な限り現実的で関連性のあるものになり、研究結果の妥当性と適用性が向上します。 - 魚の健康と幸福を評価し、ステップ1.2.4.6-1.2.4.8で説明されているように、ストレスや病気の兆候を特定して管理します。
- 不規則な水泳、食欲不振、無気力、攻撃性、孤立などの異常な行動を探します。
- 病変、潰瘍、変色、ひれの締め付け、過度の粘液、急速な鰓の動きなど、病気の兆候がないか確認してください。
- すべての観察を記録し、日付と実行したアクションを記録します。
- 毎週水質検査を実施します。
- 比色試験を使用して、アンモニア(NH3 / NH4)、亜硝酸塩(NO2-)、および硝酸塩(NO3-)のレベルを測定します。
注:これらのパラメータがすべて検出可能なレベルを下回っていることを確認してください。レベルが制限を超える場合は、追加の水交換を実行するか、曝気を増やすか、ろ過を調整します。
- 比色試験を使用して、アンモニア(NH3 / NH4)、亜硝酸塩(NO2-)、および硝酸塩(NO3-)のレベルを測定します。
- 魚の栄養を給餌し、監視します。
- 稚魚の特定の栄養要件を満たす高品質の食事を提供します(食事の詳細な組成の例については、 補足表1 を参照してください)。
注:アクアフィードペレットのサイズ(2〜3 mm)が幼魚に適していることを確認し、摂取と消化を容易にします。 - 魚の1日の平均体重の2%に対応するように飼料量を調整します。
- 魚に1日2回、午前と午後に1回、手動で魚に餌をやります(安定した給餌ルーチンを維持するために特定の時間を設定します)。
- 稚魚の特定の栄養要件を満たす高品質の食事を提供します(食事の詳細な組成の例については、 補足表1 を参照してください)。
2.魚のサンプリング、安楽死、解剖、および頭部腎臓の収集
- 水槽から魚を試食します。
- サンプリングバイアスを避けるために、水槽からランダムに魚を選択します。
- ネットを使用して、魚をタンクの水で満たされた一時的な保管容器にそっと移します。
注意: ストレスを軽減するために、取り扱い時間を最小限に抑えてください。
- 安楽死溶液を準備します。
- 魚を保持するのに適した適切な容器(例:3Lバケツ)を使用してください。
- 適量のトリカイン(MS-222)を海水に溶解して、最終濃度200〜300 mg / L18を達成します(注意:補足表2および補足ファイル1を参照)。
- 重炭酸ナトリウムを含む溶液を7.2〜7.5のpHに緩衝します。
- 安楽死解決策を投与します。
- 魚を少なくとも10分間、または手術運動の停止と反射の喪失が観察されるまで安楽死溶液に入れます(外部刺激に反応しないことを確認して安楽死を確認します)。
- 魚の体重(g)と全長(cm)を記録します。
- 魚の解剖を行います。
注:最適なサンプル品質と細胞生存率を確保するために、解剖プロセスはできるだけ早く、理想的には安楽死後5分以内に完了する必要があります。- サンプリングおよび処理中の変動を最小限に抑えるために、エアコンを使用してラボの温度が19°Cに保たれていることを確認してください。
- 解剖ツール(できれば可能な限りオートクレーブ金属器具)を滅菌し、70%エタノールで清潔なワークスペースを設定します(注意、 補足表2を参照)。
- 安楽死させた魚を横にして、頭を利き手でない方に向けた滅菌解剖トレイに置きます。
- メスを使用して、通気口(肛門)から鰓に向かって魚の腹側正中線に沿って慎重に切開します。
注意: 内臓を傷つけないように、深く切りすぎないように注意してください。 - 解剖ハサミを慎重に使用して切開部を伸ばし、内臓を露出させます。体壁のフラップをそっと持ち上げて、内部の解剖学的構造をはっきりと表示します。
- 頭部腎臓の位置を特定する:頭部腎臓は、鰓のすぐ後ろ、体腔の前背部近くに位置し、体腔の上側に沿って脊柱の下に伸びています。
注:頭部腎臓は通常、周囲の組織に比べて色が濃いです(図1)。 - 脂肪や結合組織などの周囲の組織を慎重に取り除き、頭部の腎臓をよりよく視覚化します。
注:このステップでは、頭部の腎臓の損傷を避けるために、繊細な取り扱いが必要です。 - 先端の細い鉗子とハサミを使用して、頭の腎臓を慎重に持ち上げ、周囲の組織から解放するためにその周りを正確に切り込みます。
注意: 損傷を防ぐために、ティッシュを優しく取り扱ってください。体重約30gの魚では、頭の腎臓の重さは約20〜30mgと予想されます。 - 切除した臓器を直ちに滅菌ペトリ皿内のセルストレーナー(100μmナイロンメッシュ)に入れて、無菌性を確保し、その後の処理ステップを容易にします。
注:この時点から、細胞の生存率を維持するために、すべてのステップをできるだけ早く(5分以内に)実行する必要があります。サンプルを冷たく保つために、氷で満たされた容器にペトリ皿を置き、アルミホイルで覆った状態で次の手順を実行します。

図1:頭部腎臓の位置: (A)鰓の後ろと体腔の前背部に沿った頭部腎臓の典型的な位置を示すイラスト。(B)鯛の頭部腎臓の代表的な画像で、周囲の組織に比べて暗い色を強調しています。 この図の拡大版を表示するには、ここをクリックしてください。
3. 頭部腎白血球の単離(図2)
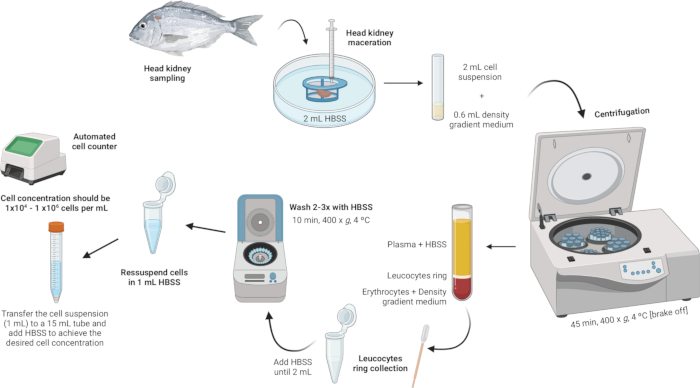
図2: 頭部腎臓からの白血球分離の実例説明。このプロトコールには、組織の均質化から始まり、密度勾配遠心分離、白血球リングの収集、白血球リングの洗浄、細胞濃度の再懸濁と調整で終わるいくつかのステップが含まれます。 この図の拡大版を表示するには、ここをクリックしてください。
- 組織を均質化します。
- 2 mLのハンクス平衡塩溶液(HBSS)を滅菌ペトリ皿に入れます。.
- セルストレーナのメッシュ(100μmナイロンメッシュ)がHBSSに接触しているが、完全に水没していないことを確認します。
- 注射器のプランジャーを使用して、細胞ストレーナーで頭部腎臓を浸軟させます。穏やかな圧力を加えて臓器の断片をナイロンメッシュに押し込み、細胞懸濁液を作成します。
注:複数のサンプルを処理する場合、細胞懸濁液を含むシャーレは、次のステップまで数分間、4°Cの冷蔵庫に保存できます。この細胞懸濁液は、白血球の単離に使用されます。
- 密度勾配遠心分離を行います。
- 密度1.077 g/mL、浸透圧353 mOsm/kg、pH 7.4の密度グラジエント培地溶液を調製します( 補足ファイル1を参照)。
注:浸透圧は魚種によって異なる場合があるため、密度勾配培地溶液の浸透圧を各種の特定の要件を満たすように調整することが重要です。 - 5 mLのポリスチレン丸底チューブに、600 μLの密度勾配培地溶液を慎重に加えます。
- 細胞懸濁液(2 mL)を取り、密度勾配培地を含むチューブにゆっくりと加えます。最初の一滴は非常に重要です - 密度勾配中相を不安定にしないように、非常に穏やかに追加します。
注:これは3:10の比率で行う必要があります(密度勾配培地:細胞懸濁液)。滅菌済みの1 mLパスツールピペットを使用して、正確かつ穏やかに添加します。ピペットの先端がチューブの側面に接触していることを確認してください。サンプルを密度勾配媒体と混合することは避けてください。 - ブレーキをオフにした状態で、チューブを400 x g で45分間、4°Cで遠心分離します。これにより、プロセス中にレイヤーがそのまま残ります。
注:遠心分離後、明確な層が見えるはずです。白血球は、密度勾配培地と細胞破片ペレットとの間の界面にリングを形成します(図3)。
- 密度1.077 g/mL、浸透圧353 mOsm/kg、pH 7.4の密度グラジエント培地溶液を調製します( 補足ファイル1を参照)。

図3: 白血球は、密度勾配培地と細胞デブリペレットとの間の界面で環状に形成されます。 この図の拡大版を表示するには、ここをクリックしてください。
- 白血球リングを収集します。
- 滅菌パスツールピペットを使用して、白血球リング(~100 μL)を穏やかに吸引し、2 mLの微量遠心チューブに移します。
注意: 汚染を避けるために、層を大きく乱さないように注意してください。白血球リングに破片や暗い懸濁液が含まれているように見える場合は、採取した白血球懸濁液を新しいミニセルストレーナー(100μm)に通して純度を確保することをお勧めします。ミニセルストレーナーを2mLの微量遠心チューブの上に置き、白血球懸濁液をストレーナーを通して穏やかに移します。
- 滅菌パスツールピペットを使用して、白血球リング(~100 μL)を穏やかに吸引し、2 mLの微量遠心チューブに移します。
- 白血球リングを洗浄します。
- 白血球リングを含む微量遠心チューブにHBSSを容量が2 mLに達するまで加え、細胞を穏やかに再懸濁します。
注:チューブを氷で満たされた容器に保管し、アルミホイルで覆って、サンプルを低温に保ちます。チューブが氷に直接接触しないようにしてください。この冷却設定は、洗浄プロセス全体を通して維持します。 - サンプルを400 × g で4°Cで10分間遠心分離します(ブレーキをオンにすることができます)。
- 遠心分離後、上清を慎重に捨て、ペレットを底に残します(ほとんど見えない場合があります)。
- ペレットに不純物がなくなるまで、洗浄手順(HBSSの添加、再懸濁、遠心分離、上清の廃棄)を繰り返します。
- 白血球リングを含む微量遠心チューブにHBSSを容量が2 mLに達するまで加え、細胞を穏やかに再懸濁します。
- 再懸濁して細胞濃度を調整します。
- 洗浄に使用したのと同じ2 mL微量遠心チューブ内のHBSS1 mLに細胞を再懸濁します。
- 1 mLあたり1 × 104 4 から 1 × 106 細胞の細胞濃度を達成します。最初のペレットが大きい場合、細胞濃度を所望の範囲に希釈するために追加のHBSSが必要になることがあります。細胞懸濁液を15mLチューブに移し、得られた細胞数に基づいて必要に応じてHBSSを追加します。
注:プロセスを容易にするために、自動セルカウンターの使用をお勧めします。
4. 白血球の染色と固定(図4)
注:LIVE/DEAD Fixable Dead Cell Stain Kitsは、フローサイトメトリーを使用して固定細胞の細胞生存率を評価するための改良された方法を提供します。これらのアッセイは、細胞アミンと相互作用する蛍光反応性色素を利用します。細胞膜が損なわれると、色素は細胞に浸透し、細胞内部と細胞表面の両方で遊離アミンと反応し、強い蛍光染色を引き起こす可能性があります。逆に、生細胞では、細胞表面のアミンのみが色素と反応するため、染色が比較的暗くなります。ホルムアルデヒドで固定した後も染色強度が維持され、微生物の増殖を防ぐことでサンプルが保存されます。LIVE/DEAD Fixable Dead Cell Stain Kitsは、蛍光色素以外は同一で、青色、紫色、水色、黄色、緑色、赤色、遠赤色、または近赤外(赤外線)からお選びいただけます。本研究では、Near-IR蛍光反応性色素を使用しました。さらに、この単色アッセイにより、マルチカラー実験で他のパラメータを並行して試験することができます。
- 染料を準備します。
- 試薬を室温(RT)にしてください:キャップを取り外す前に、蛍光反応性色素のバイアル1つと無水ジメチルスルホキシド(DMSO)のバイアルをRTに到達させます。
- 色素を再構成する:反応性色素を含むバイアルに50μLのDMSOを加えます。よく混ぜて、染料が完全に溶けたことを確認します。
- 再構成した色素溶液は、できるだけ早く、できれば数時間以内に使用してください。
注:各キットには反応性色素のバイアルが5本含まれており、少なくとも40個の細胞サンプルを染色するのに十分な材料を提供します。しかし、再溶解後、染料のDMSO溶液は、特に湿気にさらされると比較的不安定になります。未使用の部分は、光や湿気から保護され、≤〜20°Cで最大2週間保存できます。
- 細胞を染色して固定します。
注:細胞染色に適したバッファーには、ハンクス平衡塩溶液(HBSS)、リン酸緩衝生理食塩水(PBS)、およびダルベッコPBS(D-PBS)が含まれますが、ウシ血清アルブミンや血清などの無関係なタンパク質を含んでいない限り、これらの抗体は軟化しています。アミノ反応性色素を使用する場合は、細胞の再懸濁および洗浄のために、トリスバッファーおよびアジ化ナトリウムまたは無関係タンパク質を含む溶液は避けてください。本研究では、浸透圧バランスの維持に役立ち、染色過程で細胞の代謝と生存能力をサポートする必須イオンとグルコースを提供するバランスの取れたイオン組成を持つHBSSを使用しました。また、HBSSには外来タンパク質が含まれていないため、反応性色素との干渉を防ぎ、正確な生存率評価を保証します。- 細胞をカウントし、HBSSで密度を1 x 106 細胞/mLに調整した後、この細胞懸濁液1 mLを2 mLの微量遠心チューブに移します。
- 毎日、少なくとも1つのサンプルで細胞死を誘導し、生細胞と死細胞の間の蛍光強度閾値を設定するためのコントロールとして使用します。次のように、微量遠心チューブにサンプルを調製します。
チューブ1:生細胞 - 未染色
チューブ 2:生細胞 - 染色済み
チューブ3:死細胞 - 未染色
チューブ4:死細胞 - 染色済み
注:これらの4つのチューブは、コントロールとして各実験の1つのサンプルに対してのみ準備する必要があります。残りのサンプルについては、生きていた細胞と死んでいた細胞に関する情報が得られるため、必要なチューブは2本(チューブ1:サンプル-未染色とチューブ2:サンプル-染色)のみです。
- 毎日、少なくとも1つのサンプルで細胞死を誘導し、生細胞と死細胞の間の蛍光強度閾値を設定するためのコントロールとして使用します。次のように、微量遠心チューブにサンプルを調製します。
- 細胞死のポジティブコントロール:標識したチューブ「Dead unstained」(チューブ3)と「Dead-stained」(チューブ4)を50°Cの水浴に7分間入れ、熱処理により細胞死を誘導します。
- 細胞の染色:チューブ2および4(染色するチューブ)中の細胞懸濁液1 mLに、再構成した蛍光反応性色素(ステップ4.1.2)1 μLを加え、よく混合します。
- 光から保護して、室温で30分間インキュベートします。
注:固定が不要な場合は、以下の手順4.2.5〜4.2.7をスキップできます。代わりに、1%ウシ血清アルブミンを含むHBSS1 mLで細胞を2回洗浄し( 補足ファイル1を参照)、1%ウシ血清アルブミンを含むHBSS1 mLに再懸濁します。フローサイトメーターでできるだけ早く解析を実施します。そうしないと、細胞が固定されていないため、細胞の生存率が損なわれる可能性があります。 - 1 mLのHBSSで細胞を2回洗浄し、900 μLのHBSSで細胞を再懸濁します。
- 37%ホルムアルデヒドを100μL加えます(注意、 補足表2を参照)。
- 室温で15分間インキュベートします。
- 1 mLのHBSSと1%ウシ血清アルブミン(BSA)で2回洗浄し、1 mLのHBSSと1%BSAで細胞を再懸濁します。
- サンプルは4°Cの冷蔵庫で保存します。 固定後1ヶ月以内に細胞を解析してください。
- 適切な励起および検出チャネルを用いたフローサイトメトリーにより、固定細胞懸濁液を解析します。
注意: 正しい励起チャンネルと検出チャンネルは、使用する機器によって異なる場合があります( 補足表3を参照)。
- 細胞をカウントし、HBSSで密度を1 x 106 細胞/mLに調整した後、この細胞懸濁液1 mLを2 mLの微量遠心チューブに移します。

図4: 白血球の染色と固定の実例。 この図の拡大版を表示するには、ここをクリックしてください。
5. フローサイトメトリー
- データを取得します。
注:フローサイトメーターで従うべき手順は、使用するサイトメーターによって異なる場合があります。この研究では、Attune NTxフローサイトメーターを使用してデータを取得しました。- サンプルを実行します。
- サンプルチューブをサンプルポートに入れます。
- startを押して取得を開始し、イベントレート(イベント/秒)が安定したらrecordをクリックします。
- 信頼性の高い分析のために、シングレットゲートの各サンプルに対して最低10,000のイベントを記録します。
- 各サンプルのすべてのデータを保存し、外付けドライブまたはクラウドストレージにバックアップします。
- データを分析します。
注:フローサイトメトリー解析には、いくつかのソフトウェアオプションが利用可能です。本研究では、FlowJo v10.8.119を用いてデータ解析を行いました。- データファイルのロード:フローサイトメトリー解析ソフトウェアを起動し、実験から取得した.fcsファイルをアップロードします。
- データを視覚化します(図5A):前方散乱光(FSC-A)(XX)と側方散乱光(SSC-A)(YY)をプロットして、セルのサイズと粒度を評価します。
注:このプロットは、細胞集団を特定し、その散乱特性に基づいて破片を除外するために一般的に使用されます。 - 一重項セルゲーティングとマルチプレットの除外(図5B):前方散布図領域(FSC-A)と前方散布図高さ(FSC-H)のプロットを使用して、マルチプレットを除外します。ゲートを描画して、グラフに整列されたすべてのイベントを含め (単一セル)、整列されていないイベントを除外します (マルチプレット)。サンプルにFSCが非常に低いイベントがある場合は、それらをシングルセルのゲートに含めず、一重項セルのみを残して除外します。
- 白血球集団の同定(図5C):FSC-A / SSC-Aプロファイルに基づいて3つの白血球集団を区別します:FSC-A高/ SSC-A高 は顆粒球、FSC-A中/ SSC-A中等 部は単球、FSC-A低/ SSC-A低 はリンパ球です。
- 生存率ゲーティング(図5D):対応する蛍光チャネル(NIR、RL3-A)での生存率色素染色の閾値を設定します。生細胞と死細胞は、LIVE/DEAD Fixable Dead Cell Stainによる染色強度に基づいて定義されます:薄暗い染色細胞を生細胞と定義し、強く染色した細胞を死細胞と定義します。
- ポピュレーション統計:各ゲートの合計イベント(セル)や、合計セルとゲートセルの割合など、ソフトウェアによって提供される統計を確認します。
- データのエクスポート:データをスプレッドシートにエクスポートし、適切な統計ソフトウェア(GraphPad PrismまたはR)を使用してさらに統計分析を行います。
注:分析方法の選択は、研究の目的によって異なります。

図5:頭部腎細胞の生存率評価のためのフローサイトメトリーゲーティング戦略: (A)収集されたすべてのイベントのFSC-A/SSC-Aプロファイルを表します。(B)フォワードスキャッター(FSC-A)/フォワードスキャッター(FSC-H)グラフの線形性に基づくシングレット領域の定義に基づくマルチプレット除外を表します。(C) FSC-A/SSC-A に基づいて定義された 3 つの主要な母集団を表し、マルチプレット除外後。(D)Live/Dead Viability色素染色を示すヒストグラムを表します。生細胞と死細胞を区別できる閾値を設定するために、白血球を軽度の熱ショック(50°C、7分)にさらした後、生存率色素で染色しました。高染色強度の陽性細胞(++)は死細胞であり、低染色陽性細胞(+-)は生細胞です。 この図の拡大版を表示するには、ここをクリックしてください。
結果
図6は、幼魚の頭の腎臓から単離された白血球集団と、この研究で説明したプロトコルを使用したそれらの細胞生存率を示す代表的なフローサイトメトリーデータを示しています。この図は、魚が最適な条件にさらされた細胞生存率の高いサンプル(図6A)と、細胞が熱ストレスにさらされた細胞生存率の低いサンプル(図6B)の2つのサンプルを比較したものです。
両方のサンプルにおいて、本法は、リンパ球(LY)、単球(MO)、および顆粒球(GR)の3つの主要な白血球集団を効果的に同定した。これらの集団は、前方散乱図(FSC-A)と側方散乱図(SSC-A)プロットで示されるように、細胞サイズと複雑さの違いに基づいて区別されました。前方散乱(FSC-A)は相対的な細胞サイズを示し、側方散乱(SSC-A)は細胞の内部の複雑さまたは粒度を反映し、集団の明確な分離を可能にします。最適な条件(図6A)では、白血球の個体群は次のように分布しました:LYは31.0%、MOは38.0%、GRは31.0%でした。しかし、熱ストレスにさらされたサンプル(図6B)では、これらの集団の分布に変化が見られ、LYは21.3%に減少し、MOは45.6%に増加し、GRは33.1%と比較的安定しています。
図6A1-A3および図6B1-B3に詳述されている細胞生存率のさらなる分析により、2つのサンプル間に有意なコントラストが明らかになります。観察できるように、最適な条件にばく露されたサンプル(図6A)は、より高い生存率を示し、すべての白血球集団で生細胞(青色で表される)が優勢でした。対照的に、熱ストレスを受けたサンプル(図6B)では、細胞死の有意な増加が示され(赤で示されているより強い染色)、LYは50.7%、MOは83.7%、GRは84.5%を示しました。
全体として、この結果は、白血球集団の単離と解析、および細胞生存率の評価の両方におけるプロトコールの有効性を明確に示しています。さらに、このデータは、熱曝露などのストレスの多い条件が白血球の個体群動態や細胞生存率にどのように影響するかについての貴重な洞察を提供します。ストレス下での細胞分布と生存率の観察された変化は、熱曝露が白血球集団のバランスを乱すだけでなく、細胞の健康を損なうことを示唆しています。これらの変化は、ストレスに対する免疫反応を示している可能性があり、環境ストレス要因によって引き起こされる積極的な防御メカニズムを示しています。

図6:金鯛(Sparus aurata)の頭部腎臓からのさまざまな白血球集団の同定と生存率を示す代表的なフローサイトメトリープロット:(A)最適な条件にさらされた高い細胞生存率のサンプル:左のパネルは、FSC-A / SSC-Aに基づく白血球集団のゲーティングを示し、リンパ球(LY)、単球(MO)、および顆粒球(GR)を同定します。LY(A.1)、MO(A.2)、およびGR(A.3)の実行可能性。(B)熱ストレスにさらされた細胞生存率の低いサンプル:左のパネルは、FSC-A / SSC-Aに基づく白血球集団のゲーティングを示しており、リンパ球(LY)、単球(MO)、および顆粒球(GR)を特定します。LY(B.1)、MO(B.2)、およびGR(B.3)の生存率。この図の拡大版を表示するには、ここをクリックしてください。
補足図1:総容量660Lの検疫タンクの代表画像。 この図をダウンロードするには、ここをクリックしてください。
補足図2:RASシステムセットアップのイメージ。(1)プロフィルックス;(2)照明器具;(3)水族館/タンク;(4)冷蔵庫;(5)水族館の給水栓。(6)水族館の水出口用の青いサイフォン。(7)サンプ;(8)プロテインスキマー;(9)メカニカルフィルター(フィルターバッグ)。(10)メカニカルフィルター(ブルースポンジ+グラスウール);(11)生物学的フィルター(バイオボール);(12)サーモスタット;(13)メインポンプ;(14)UV滅菌器;(15)温度センサー;(A)メカニカルフィルター(青いスポンジ);(B)メカニカルフィルター(グラスウール)。この図をダウンロードするには、ここをクリックしてください。
補足表1:研究で使用された実験食の成分組成(%)と近似分析(%DM)。 この表をダウンロードするには、ここをクリックしてください。
補足表2:プロトコルで使用される試薬:健康被害、危険有害性、予防的声明、および応急処置。 この表をダウンロードするには、ここをクリックしてください。
補足表3:アミン反応性LIVE/DEAD固定可能な死細胞染色剤で使用する適切な励起および検出チャネル。 この表をダウンロードするには、ここをクリックしてください。
補足ファイル1:溶液調製のための計算。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
この研究で開発された方法は、魚類免疫学研究の大幅な進歩を表しており、魚類の免疫応答の理解と海洋資源の持続可能性を向上させることが期待されています。 S. aurata は、スプラダエ科の貴重な海産魚種であり、その生態学的および経済的関連性、生理学、免疫学、毒物学、水産養殖などのいくつかの研究分野での実験室研究における多様性など、いくつかの理由で理想的なモデル生物として機能しています20。 S. aurata の主な利点の1つは、実験室での取り扱いと飼育の容易さであり、一貫性と再現性のある実験条件21を保証する確立された飼育プロトコルを備えています。さらに、その環境適応性(すなわち、温度や塩分濃度の変動など、広範囲の環境条件に対する高い耐性)は、農業技術の向上や海洋生物への環境影響の評価を目的とした研究の理想的な候補となっている22。 S. aurataは、その十分に特徴付けられた免疫システムとゲノムデータの利用可能性により、魚の免疫応答、病原体耐性、ワクチンの有効性、および全体的な健康の解き放つことを可能にします20。水産養殖や南ヨーロッパの人々の食生活におけるその重要性を考えると、この種の研究は養殖慣行に直接影響を与え、その生産と持続可能性を強化しながら、業界内の環境問題に対処することができます20。
この意味で、このプロトコルは、さまざまな研究分野でいくつかの利点と潜在的なアプリケーションを提供します:(i)魚の免疫学: S. aurataの頭部腎臓からの免疫細胞の正確かつ詳細な分析を提供し、異なる白血球集団の同定と特性評価を可能にするだけでなく、フローサイトメトリーによるそれらの細胞生存率の堅牢な評価を可能にします。(ii)水産養殖研究:養殖技術、栄養学、疾病管理の研究に不可欠であり、抗生物質や化学処理への依存を減らし、それによりより持続可能な水産養殖の実践を促進することを目的とした将来の研究を支援します。(iii)生態毒性学:汚染物質やその他の環境ストレス要因が魚の免疫健康に及ぼす影響の評価において価値があり、環境リスク評価のためのデータを提供し、水生生態系の保護規制を策定します。(iv)比較生理学:研究者がさまざまな環境課題に対する免疫系の進化的適応を追跡調査できるようにし、免疫機能の遺伝的および生理学的基盤をより深く理解することができます。(v)海洋生物学と生態学: S. aurataの生態学的役割と相互作用の理解を深め、種の分布、生息地の好み、および環境変化が海洋生物多様性に与える影響についての洞察を提供します。(vi)生物医学研究:魚は生物医学研究のモデル生物としてますます頻繁に使用されています。免疫細胞の単離と解析は、創薬や医療に不可欠な細胞や分子の側面を理解するのに役立ちます。
長年にわたり、魚の白血球の定量と同定は、ビュルカー、ノイバウアー、またはトーマ血球計算盤による手動カウントや、染色された血液塗抹標本10,12などの従来の血液学的技術に依存していました。細胞生存率は、トリパンブルー排除試験を用いても評価され、続いて顕微鏡で15、22、23、24、25、26、27、28をカウントしました。これらの方法は魚の免疫学の理解に貢献してきましたが、いくつかの制限があります。手動による白血球計数は、時間と労力を要し、これらの技術の精度は、オペレーターのばらつきや人為的ミスによってしばしば損なわれ、結果の一貫性に大きな影響を与えました10。
1994年、Estebanらは、シーバス(Dicentrarchus labrax)の食細胞防御機構を評価する技術を導入することにより、魚の白血球分析に革命をもたらしました23。彼らの研究では、白血球を末梢血、頭部腎臓、および腹膜滲出液からPercoll密度勾配遠心分離法を用いて単離した23。この方法論の進歩は大きな飛躍を遂げ、白血球分析の精度と信頼性を向上させました。Estebanらの先駆的な研究に続いて、その後の研究は、細胞集団プロファイリング6,15,16,28,29、細胞生存率3,6,27,28、食作用活性6,23などのさまざまな側面に焦点を当てて、白血球分析のためのフローサイトメトリー技術の改良と最適化を目指してきました。24、27、28。さまざまなグラジエント培地(Ficoll vs. Percollなど)の使用や最適化された遠心分離プロトコルなど、単離手順の進歩により、単離された白血球の純度と収量が向上しました1,8,14,26。高度な染色技術の開発と、ヨウ化プロピジウム(PI)や3,3'-ジヘキシロキサカルボシアニンヨウ化物(DiOC6(3))などの蛍光色素の使用により、生存細胞と非生存細胞をより正確に識別することが可能になっただけでなく、白血球集団の詳細な特性評価も可能になりました16,30。.この手法の主な利点の1つは、異なる白血球集団(リンパ球、単球、顆粒球)を同時に区別し、各集団の細胞生存率を評価できることです。これにより、研究者は特定の条件下で最も影響を受ける集団を特定でき、免疫応答についてより深い洞察を得るとともに、最も脆弱な白血球サブセットを明らかにすることができます。しかし、これらの改善にもかかわらず、現在の方法にはまだ限界があります。ほとんどの研究は成魚に焦点を当てており、幼魚期の研究にはギャップが残っています。幼魚は、サイズが小さく、比例して小さい免疫器官から高品質のサンプルを得るのが難しいため、白血球抽出に独自の課題があります17。ここで説明する研究では、稚魚のプロトコールを最適化し、細胞懸濁比を調整し、白血球抽出の品質を向上させるためのPercoll溶液を使用することで、これらの問題に具体的に対処しています。さらに、既存の分析法では、白血球の生存率評価がすぐに必要になるため、一度に処理できるサンプルや反復の数に制限されることがよくあります。サンプルの取り扱いが遅れると、細胞の生存率に悪影響を及ぼし、サンプリングプロセスが複雑になり、結果が損なわれる可能性があります。この制限を克服するために、この研究では、固定後1か月までの細胞固定と分析を可能にする新しい染色技術の使用を紹介します。このイノベーションにより、サンプリングスケジュールの柔軟性が向上し、研究者は都合の良いときにサンプルを処理および分析できるようになり、フローサイトメトリー評価のワークフローと信頼性が大幅に向上します。
このプロトコールの成功は、いくつかの重要なステップにかかっており、それぞれが白血球の完全性と生存率を確保するために慎重な実行を必要とし、その後、フローサイトメトリーによって分析されます。安楽死溶液の正しい調製とpH調整は、効果的な安楽死にとって重要です。不適切に調製された溶液は、不完全な安楽死または魚への追加のストレスをもたらす可能性がある18。頭部腎臓の正確かつ慎重な解剖は、汚染を避けるために不可欠です。無菌性と組織の完全性を維持することは、高品質の白血球サンプルを得るために非常に重要です。Percoll溶液の密度、浸透圧、pHは、白血球を効率的に分離するために正しく調整する必要があります。滅菌ピペットで白血球リングを穏やかに吸引することは、グラジエント層の汚染や乱れを避けるために重要です。採取後の細胞の効果的な洗浄は、Percollの残留物やその他の不純物を除去するために不可欠です。洗浄プロセスを繰り返すことで、固定の準備ができているきれいなセルペレットが保証されます。反応性染料は、不適切な取り扱いが安定性を損なう可能性があるため、その有効性を確保するために使用直前に調製する必要があります。適切な色素添加とインキュベーション時間は、生細胞と死細胞を正確に区別するために重要です。3.7%ホルムアルデヒドで細胞を固定することは、細胞の形態を維持し、死んだ細胞を正確に同定するための重要なステップです。ホルムアルデヒド濃度は正確である必要があり、不正確な結果を避けるためにインキュベーション時間を厳守する必要があります。固定後の細胞の洗浄は、その後の分析に支障をきたす可能性のある余分な色素やホルムアルデヒドを除去するために重要です。データの正確性を維持するためには、固定サンプルの適切な保管とタイムリーな分析が必要です。使用する特定の色素に合わせて励起チャネルと検出チャネルを調整することは、正確なフローサイトメトリーの結果を得るために不可欠です。
その多くの利点にもかかわらず、この方法には考慮しなければならないいくつかの制限があります。重要な制限の1つは、プロトコルが海産魚である金箔鯛(S. aurata)の稚魚に最適化されているため、その種固有の性質です。これは、他の魚種、特に淡水魚に適用すると、その有効性が異なる可能性があることを意味します。海洋生物種と淡水生物種の間の浸透圧バランスの違いは、塩水条件に適した溶液が淡水生物種には適切でない可能性があるため、プロトコルで使用されるバッファーの調整が必要になる場合があります。さらに、組織構造、細胞密度、および生理学的応答の違いにより、プロトコールの調整が必要になる場合があり、異なる種間での再現性と一貫性に影響を与える可能性があります。
もう一つの重要な要素は、サンプル収集前の魚のメンテナンスです。それぞれの種には、魚の健康を維持し、実験結果の質を確保するために不可欠な特定の最適な水条件があります20。温度、塩分濃度、pHなどのパラメータの変動は、最適でない条件が細胞の完全性を損なう生理学的ストレスを誘発する可能性があるため、細胞の生存率とデータ品質に影響を与える可能性があります。一貫した実験結果を確保するためには、すべての反復を、最適または意図的に最適でないか(研究の目的によって異なります)にかかわらず、同じ制御条件下で維持することが重要です。
取り扱いと解剖技術のばらつきも、頭部腎白血球の質と量に影響を与える可能性があり、オペレーターのスキルと経験がプロトコルの成功にとって重要な要素になります。さらに、安楽死と細胞固定の間の遅延は生存率の低下と偏った結果につながる可能性があるため、単離プロセス全体を通じて細胞生存率を維持することは困難になる可能性があります。組織や細胞の即時処理は、高い細胞生存率を維持するために不可欠ですが、特に多数のサンプルを扱う場合、この要件を一貫して達成することは困難です。
開示事項
著者らは、研究、分析、データ解釈、執筆、または出版のための原稿の提出決定に影響を与えた可能性のある金銭的、個人的、または職業上の利益相反を宣言しません。
謝辞
この研究は、Aqua-CLIMADAPT(PTDC/CTA-AMB/0592/2021, https://doi-org.remotexs.ntu.edu.sg/10.54499/PTDC/CTA-AMB/0592/2021)の枠組みの下、Fundação Portuguesa para a Ciência e Tecnologia(FCT I.P.)の支援を受けました。私たちは、FCT/MCTES(UIDB/04378/2020およびUIDB/50006/2020)からの国家資金によって資金提供されているApplied Molecular Biosciences Unit(UCIBIO)およびAssociated Laboratory for Green Chemistry Research Unit(LAQV)およびAssociate Laboratory Institute for Health and Bioeconomy – i4HB(LA/P/0140/2020)によって支援されているBioLabに感謝します。この研究は、GLYCOTwinningプロジェクト(助成金契約第101079417号)を通じて欧州委員会から、InnoGlyco(2022.04607.PTDC)を通じてFCTからも支援を受けました。Isa Marmeloは、博士号の助成金(2020.04413.BD、https://doi-org.remotexs.ntu.edu.sg/10.54499/2020.04413.BD)のFCT I.P.も認めています。
資料
| Name | Company | Catalog Number | Comments |
| Air Stones | N/A | N/A | |
| Aquafeed | SPAROS, Lda., Portugal | N/A | High-quality diet |
| Automatic Cell Counting Equipment | NanoEnteK, Korea | N/A | EVE automatic cell counter (NanoEnteK) |
| Automatic Water Refrigeration Systems | Foshan Weinuo Refrigeration Equipment Co., Ltd, China | N/A | |
| Bio balls 1.5" Aquarium Pond Filter | TMC Iberia, Portugal | N/A | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich, Germany | A7906 | |
| Bucket (3 L) | N/A | N/A | To prepare and carry out euthanasia |
| Buckets (5 L) | N/A | N/A | To transport the animals |
| Cell Strainers | Jetbiofil, China | CSS-013-100 | Cell Strainer, 100 μm nylon mesh, Sterile, Yellow |
| Centrifugue | Fisher Scientific, Germany | N/A | accuSpin Micro 17 R |
| Colorimetric Test Kit for Ammonia (NH4+/NH3) | Tropic Marin, USA | N/A | |
| Colorimetric Test Kit for Nitrate (NO3-) | Tropic Marin, USA | N/A | |
| Colorimetric Test Kit for Nitrite (NO2-) | Tropic Marin, USA | N/A | |
| Computer | N/A | N/A | To acquire and analyse the data obtained from the flow cytometer |
| Computerized Control System (Profilux) | GHL, Germany | N/A | ProfiLux 3 Outdoor |
| Deionized water | N/A | N/A | To clean the Flow Cytometer |
| Density Gradient Medium: Percoll | Cytiva, Sigma-Aldrich, Germany | 17-0891-01 | |
| Digital scale | KERN & Sohn GmbH, Germany | N/A | KERN EMS 300-3 |
| Ethanol 70% | Millipore, Supelco, Portugal | EX0281 | To keep the workspace clean |
| EVE Cell Counting Slides | NanoEnteK, Korea | N/A | |
| Falcon Tubes (15 mL) | pluriSelect Life Science, Germany | 05-00002-01 | Sterile |
| Filter bag | TMC Iberia, Portugal | N/A | 400 micron |
| Filter Sponge | N/A | N/A | |
| Flow Cytometer | ThermoFisher Scientific, USA | N/A | Attune flow cytometer |
| FlowJo v10.8.1 Software | BD Life Sciences | N/A | |
| Formaldehyde 37% | Sigma-Aldrich, Germany | 8.18708 | |
| Glass Wool | N/A | N/A | |
| Hanks' Balanced Salt Solution | Merck Life Science S.L, Portugal | H6648 | Modified, with sodium bicarbonate, without phenol red, calcium chloride and magnesium sulfate, liquid, sterile-filtered, suitable for cell culture |
| LIVE/DEAD Fixable Dead Cell Stain Kits | Life Technologies Europe, Netherlands | L10119 | Near-IR fluorescent reactive dye + DMSO |
| Main Water Pumps | EHEIM, Germany | Universal 1200 | |
| Microcentrifuge Tubes (2 mL) | BRAND, Merck, Germany | Z628034 | Sterile |
| Micropipette Tips | Sartorius, Germany | 790010, 790200, 791000 | Compatible with Sartorius, 1-10 µL, 2-20 µL, 20-200 µL, 100-1000 µL |
| Micropipettes | Sartorius, Germany | 728020, 728030, 728060, 728070 | Sartorius ProlinePlus 1-10 µL, 2-20 µL, 20-200 µL, 100-1000 µL |
| Mini Cell Strainers | pluriSelect Life Science Global Headoffice, Germany | 43-10100-50 | PluriStrainer 100 µm nylon mesh, Sterile |
| Multi-Parameter Measuring Instrument | WTW, Germany | Multi 3420 SET G + IDS digital conductivity cell (TetraCon 925) + Optical IDS DO sensor (FDO 925) + IDS pH-electrode (SenTix 940) | |
| Pasteur Pipettes (1 mL, 5 mL) | Humeau Expert du laboratoire, France | 248295 | Sterile |
| Petri dishes | Sarstedt, Germany | 82.1194.500 | 60 x 15 mm, Polystyrene, Sterile |
| pH Meter | Hanna Instruments Inc., Romania | HANNA HI2211 | |
| Polystyrene round-bottom Falcon tubes (5 mL) | Fisher Scientific, Germany | 14-959-2A | Sterile |
| Portable Precision Thermometer | Ebro Electronic, Germany | N/A | TFX 430 |
| Protein Skimmers | Mantis | N/A | Tornado 120 |
| Quality control beads/Performance test beads | Thermofisher Scientific, USA | N/A | |
| Quarantine Tanks | N/A | N/A | Tanks with 660 L total volume |
| Rectangular Glass Tanks/Aquariums | N/A | N/A | Tanks with 200 L total volume |
| Refrigerator | N/A | N/A | To store the samples at 4 °C |
| Ruler 30 cm | N/A | N/A | To measure the fish's length |
| Sodium bicarbonate | Honeywell Fluka, Germany | 31437 | Sodium hydrogen carbonate (NaHCO3) |
| Sodium chloride | Sigma-Aldrich, Germany | S9888 | |
| Sterile Dissection Tools | N/A | N/A | (e.g. scalpel, scissors, fine-tipped forceps, dissecting tray/board) |
| Submerged Digital Heaters | TMC Iberia, Portugal | 300 W, V2Therm Digital Heaters | |
| Syringes 1 mL | IVFSTORE, USA | 8300014579-MEA | Sterile, HSW Soft-Ject Syringes to macerate head-kidney |
| Temperature Sensors | GHL, Germany | PT 1000 | |
| Tricaine (MS-222) | ThermoFisher Scientific, Germany | 118000500 | Ethyl 3-aminobenzoate, methanesulfonic acid salt, 98% (C10H15NO5S) |
| Ultraviolet Water Sterilizer | EHEIM, Germany | 5305010 | ClearUVC-36 |
| Water Bath | Fisher Scientific, Germany | N/A | Fisherbrand IsotempTM (P/N U01318) |
| Water-resistant Luminaires | N/A | N/A |
参考文献
- Samaï, H.C. et al. Procedures for leukocytes isolation from lymphoid tissues and consequences on immune endpoints used to evaluate fish immune status: A case study on roach (Rutilus rutilus). Fish Shellfish Immunol. 74, 190-204 (2018).
- Mokhtar, D. M., Zaccone, G., Alesci, A., Kuciel, M., Hussein, M. T., Sayed, R. K. A. Main components of fish immunity: An overview of the fish immune system. Fishes. 8 (2), 93 (2023).
- Lulijwa, R. et al. Characterisation of Chinook salmon (Oncorhynchus tshawytscha) blood and validation of flow cytometry cell count and viability assay kit. Fish Shellfish Immunol. 88, 179-188 (2019).
- Uribe, C., Folch, H., Enriquez, R., Moran, G. Innate and adaptive immunity in teleost fish: a review. Vet Med. 56 (10), 486-503 (2011).
- Bjørgen, H., Koppang, E. O. Anatomy of teleost fish immune structures and organs. Immunogenetics. 73 (1), 53-63 (2021).
- Santos, R. A. et al. In vitro modulation of gilthead seabream (Sparus aurata L.) leukocytes by Bacillus spp. extracellular molecules upon bacterial challenge. Fish Shellfish Immunol. 121, 285-294 (2022).
- Witeska, M., Kondera, E., Ługowska, K., Bojarski, B. Hematological methods in fish - Not only for beginners. Aquaculture. 547, 737498 (2022).
- Titus, J. et al. Development and validation of a flow cytometry method to examine circulating leukocyte subpopulations in barramundi (Lates calcarifer). Comp Immunol Rep. 6, 200142 (2024).
- Marmelo, I. et al. Eco-innovative aquafeeds biofortified with Asparagopsis taxiformis to improve the resilience of farmed white seabream (Diplodus sargus) to marine heatwave events. Heliyon. 10 (15), e35135 (2024).
- Seibel, H., Baßmann, B., Rebl, A. Blood Will Tell: What Hematological Analyses Can Reveal About Fish Welfare. Front Vet Sci. 8, 616955 (2021).
- Franke, A., Beemelmanns, A., Miest, J. J. Are fish immunocompetent enough to face climate change? Biol Lett. 20 (2), 20230346 (2024).
- Fazio, F. Fish hematology analysis as an important tool of aquaculture: A review. Aquaculture. 500, 237-242 (2019).
- Fazio, F., Saoca, C., Costa, G., Zumbo, A., Piccione, G., Parrino, V. Flow cytometry and automatic blood cell analysis in striped bass Morone saxatilis (Walbaum, 1792): A new hematological approach. Aquaculture. 513, 734398 (2019).
- Lulijwa, R., Alfaro, A. C., Merien, F., Meyer, J., Young, T. Advances in salmonid fish immunology: A review of methods and techniques for lymphoid tissue and peripheral blood leucocyte isolation and application. Fish Shellfish Immunol. 95, 44-80 (2019).
- Esteban, M. Á., Muñoz, J., Meseguer, J. Blood cells of sea bass (Dicentrarchus labrax l.). Flow cytometric and microscopic studies. Anat Rec. 258 (1), 80-89 (2000).
- Inoue, T., Moritomo, T., Tamura, Y., Mamiya, S., Fujino, H., Nakanishi, T. A new method for fish leucocyte counting and partial differentiation by flow cytometry. Fish Shellfish Immunol. 13 (5), 379-390 (2002).
- Ye, R. R. et al. Immune competence assessment in marine medaka (Orzyias melastigma)-a holistic approach for immunotoxicology. Environ Sci Pollut Res. 24 (36), 27687-27701 (2017).
- American Veterinary Medical Association. AVMA Guidelines for the Euthanasia of Animals: 2020 Edition. American Veterinary Medical Association, Schaumburg, IL (2020).
- FlowJoTM Software (for Windows). Version v10.8.1 (BD Life Sciences). At < https://www.bdbiosciences.com/en-us/products/software/flowjo-v10-software> (2023).
- Mhalhel, K. et al. Review on Gilthead Seabream (Sparus aurata) aquaculture: Life cycle, growth, aquaculture practices and challenges. J Mar Sci Eng. 11 (10), 2008 (2023).
- Toni, M., Manciocco, A., Angiulli, E., Alleva, E., Cioni, C., Malavasi, S. Review: Assessing fish welfare in research and aquaculture, with a focus on European directives. Animal. 13 (1), 161-170 (2018).
- Kır, M. Thermal tolerance and standard metabolic rate of juvenile gilthead seabream (Sparus aurata) acclimated to four temperatures. J Therm Biol. 93, 102739 (2020).
- Esteban, M. Á, Meseguer, J. Phagocytic defence mechanism in sea bass (Dicentrarchus labrax L.): An ultrastructural study. Anat Rec. 240 (4), 589-597 (1994).
- Esteban, M. Á., Mulero, V., Muñoz, J., Meseguer, J. Methodological aspects of assessing phagocytosis of Vibrio anguillarum by leucocytes of gilthead seabream (Sparus aurata L.) by flow cytometry and electron microscopy. Cell Tissue Res. 293 (1), 133-141 (1998).
- Rodríguez, A., Esteban, M. Á., Meseguer, J. Phagocytosis and peroxidase release by seabream (Sparus aurata L.) leucocytes in response to yeast cells. Anat Rec A Discov Mol Cell Evol Biol. 272 (1), 415-423 (2002).
- Hamoutene, D., Payne, J. F., Volkoff, H. Effects of tebufenozide on some aspects of lake trout (Salvelinus namaycush) immune response. Ecotoxicol Environ Saf. 69 (2), 173-179 (2007).
- Pierrard, M.-A., Roland, K., Kestemont, P., Dieu, M., Raes, M., Silvestre, F. Fish peripheral blood mononuclear cells preparation for future monitoring applications. Anal Biochem. 426 (2), 153-165 (2012).
- Guardiola, F. A., Logothetis, P., Meseguer, J., Esteban, M. Á. Evaluation of silver nanospheres on viability and innate cellular parameters of gilthead seabream (Sparus aurata L.) head-kidney leucocytes. Fish Shellfish Immunol. 69, 99-107 (2017).
- Campos-Sánchez, J. C., Guardiola, F. A., Esteban, M. Á. In vitro effects of cantharidin on gilthead seabream (Sparus aurata) head-kidney leucocytes. Fish Shellfish Immunol. 123, 20-35 (2022).
- Korytář, T., Dang Thi, H., Takizawa, F., Köllner, B. A multicolour flow cytometry identifying defined leukocyte subsets of rainbow trout (Oncorhynchus mykiss). Fish Shellfish Immunol. 35 (6), 2017-2019 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved