Method Article
通过流式细胞术分离、固定和表征幼年 Gilthead 海鲷头肾白细胞
摘要
这份手稿描述了从金头鲷头肾中提取的白细胞的分离和固定,以及通过流式细胞术评估它们的活力。这项工作有助于方案的标准化,并在不影响样品质量的情况下处理更多样品,促进鱼类免疫学知识的进步。
摘要
免疫力对于生物体的生理调节至关重要,是抵御病原体和环境压力源的主要防御措施。免疫细胞的分离和分析为免疫对外部压力的反应提供了关键见解。然而,对于研究较少的物种(如海洋鱼类),缺乏统一的方案,往往会导致技术和分析挑战,阻碍数据解释和对物种特异性免疫反应的透彻理解。本研究旨在建立一种基于流式细胞术的优化分析程序,以表征和确定幼年金头鲷 (Sparus aurata) 头肾(硬骨鱼的主要造血器官)白细胞的活力。该程序首先使用 Hanks 平衡盐溶液通过均质化过程分离白细胞,然后采用优化的 Percoll 密度梯度离心方法,以确保白细胞的高回收率,同时将高效后续流式细胞术分析所需的红细胞污染降至最低。此外,采用了一种使用细胞反应性染料的新技术 (LIVE/DEAD Fixable Dead Cell Stain Kit) 根据荧光染色模式区分活细胞和死细胞。用 3.7% 甲醛实现固定,保留细胞形态、活力和染色效率。流式细胞术分析成功鉴定了三个主要的白细胞群:淋巴细胞、单核细胞和粒细胞。这种方法不仅可以进行活力测试,还可以准确区分细胞类型。流式细胞术方案的改进通过提高免疫细胞分析的准确性和效率,代表了鱼类免疫学向前迈进了一步。此外,通过允许固定细胞以供以后分析,该方案显着减少了免疫评估所需的时间和精力,使其成为各个研究领域的研究和实际应用的宝贵工具。
引言
免疫力在生物体的生理调节中起着核心作用,是抵御各种病原体和环境压力源的主要防御措施1。与其他脊椎动物一样,鱼类具有复杂、动态和协调的免疫系统,这对它们的整体健康和福祉至关重要1。
硬骨鱼具有先天免疫系统和适应性免疫系统,它们同时发挥作用以检测、响应和中和有害入侵者2。先天免疫系统充当第一道防线,对病原体提供即时和非特异性反应2,而适应性免疫系统随着时间的推移而发展,提供更专业的反应,使鱼类能够识别特定病原体并建立免疫记忆3。鱼类免疫系统依靠专门的原代淋巴器官(即胸腺和头肾)和次级淋巴器官(例如脾脏和粘膜相关淋巴组织 (MALT))来支持免疫防御并维持整体健康4。头肾是硬骨鱼的主要造血器官,在免疫细胞(包括白细胞)的发育和成熟中起着至关重要的作用5。
近年来,在研究几种鱼类的免疫反应方面取得了重大进展2。一个重点领域是了解白细胞群及其活性。白细胞,也称为白细胞,通常分为单核细胞、淋巴细胞和粒细胞,在鱼类的免疫防御中起着至关重要的作用。它们具有吞噬细胞,负责吞噬和破坏病原体并释放杀菌活性氧,有助于消除入侵的微生物6。白细胞还参与炎症过程,有助于隔离和根除感染,同时促进组织修复6。白细胞群的丰度和活性是动物健康和疾病中免疫状态的重要指标 7,8。
一些研究表明,应激因素(如不利的环境条件)可以改变红细胞的数量和形态以及循环白细胞的组成 9,10。例如,正如 Franke 等人(2024 年)所回顾的那样,在气候变化情景下研究鱼类的免疫系统至关重要,因为环境压力源会损害鱼类的免疫力,增加疾病易感性,并增强某些病原体的传染性,最终加速疾病进展11。此外,了解鱼类的免疫力不仅对于推进基础生物学研究至关重要,而且对于支持社会各个部门(例如水产养殖业)也至关重要。随着水产养殖在全球范围内的不断发展,确保养殖鱼类的健康和福利变得越来越重要。然而,鱼类福利仍然是一个相对较新的研究领域,养殖鱼类的免疫反应仍然需要彻底和标准化的评估。优先考虑免疫反应研究至关重要,因为获得的信息可以通过有效和量身定制的方法提高水产养殖的可持续性和生产力,从而提高养殖动物的福利和复原力。
白细胞定量和鉴定通常使用血液学方法进行,例如使用 Bürker、Neubauer 或 Thoma 血细胞计数器进行手动计数,以及染色的血涂片 7,10。为了帮助血细胞的可视化和分化,通常使用 Wright、May-Grünwald-Giemsa 和 Hemacolor 等染色试剂盒 7,12。然而,这些手动细胞计数技术繁琐、耗时且容易出现人为错误 8,10。常见的错误来源包括血液混合或稀释不足、染色问题以及血细胞计数器室加载不正确,所有这些都可能导致细胞计数不准确12。此外,手动血液学分析需要高水平的专业知识和经验,以确保结果的可靠性和可重复性7。随着对精确和高效诊断工具的需求增加,开发深入了解鱼类种群免疫状态的创新方法成为推进该领域越来越重要的一步。
在这种情况式细胞术已成为一种强大的工具,它提供了一种高通量、定量的方法来分析白细胞群和细胞活力8。这种现代诊断技术能够以极高的精度对混合细胞群中的单个细胞进行快速检测、计数和表征13。此外,流式细胞术允许同时进行表型和功能表征的多参数测量。尽管广泛用于人类临床环境和兽医学,但它在鱼白细胞研究中的应用仍然非常有限8。虽然已经对不同的鱼类物种进行了一些研究 1,6,8,13,14,15,16,17,但仍需要解决一些关键挑战。这些分析中的一个主要挑战是必须获得从外周血或淋巴组织(如头肾)中提取的活白细胞的悬浮液1。由于硬骨鱼的一个独特特征:有核红细胞的存在,白细胞的分离通常很困难。由于红细胞的大小、卵形和细胞核的存在,红细胞的意外污染会干扰白细胞分析1。因此,必须从白细胞悬液中去除红细胞以获得高白细胞纯度,并通过流式细胞术分析研究白细胞的表型和功能特征。在哺乳动物中,白细胞分离通常涉及红细胞渗透裂解或用 Ficoll 或 Percoll1 进行密度梯度分离。然而,渗透裂解对海水鱼和淡水鱼都是无效的,因为它们的有核红细胞不能被正确裂解1。相反,密度梯度分离是鱼类的首选,因为它可以有效地保持细胞随时间的稳定性1。尽管一些研究已经成功地从幼鱼中分离出白细胞,但许多研究仍然主要集中在成年鱼群上 17。尽管如此,早期阶段不仅更容易受到疾病爆发的影响,而且规模也较小,这使得采样过程更加复杂和具有挑战性。另一个限制是当前方法通常仅限于一次有限数量的样品或重复,因为评估白细胞活力需要立即处理。样品处理的延迟会对细胞活力产生不利影响,从而给样品过程带来进一步的复杂性,并可能危及整个工作。
据我们所知,已发表的方法均未成功固定白细胞以进行随后的流式细胞术活力分析。本研究具有开创性,因为它建立了一种有效的方法,用于使用 Percoll 密度梯度分离方法从南欧国家养殖的主要鱼类幼鱼金头鲷 (Sparus aurata) 的头肾中分离白细胞。我们还提出了一种改进的基于染色的技术,该技术可以区分活细胞和死细胞,同时通过流式细胞术识别主要的白细胞群(淋巴细胞、单核细胞和粒细胞)。改进的方案需要细胞固定,这使得术后长达 1 个月的活细胞分析成为可能。这种流式细胞术方案的实施有可能显着减少免疫评估通常需要的时间和精力,使其成为水产养殖部门研究和更实际应用的宝贵技术。该方法的应用为分析大量样品、保存细胞以及允许通过流式细胞术进行延迟分析提供了优势。因此,对鱼类免疫机制以及不同环境或实验条件如何影响细胞活力产生有价值的见解可能非常有帮助。此外,该活力测定可以与特定免疫细胞群的多参数表型和功能表征相结合。这种方法能够对几个免疫学参数进行更全面的分析,将它们直接与相应的细胞类型联系起来,并提供更清晰的免疫反应信息。这些发现可能有助于制定更有效的策略,包括改进水产养殖中疾病管理的方法。
研究方案
该协议必须由获得动物实验认证的研究人员(欧盟功能 A 和 B)执行。与动物处理和样本采集相关的所有程序必须符合 ARRIVE 指南(动物研究: 体内 实验报告),并遵守根据欧洲实验动物科学协会联合会 (FELASA) 的建议照顾和使用动物的道德标准。本研究遵循所有这些标准以及葡萄牙实验动物科学立法(欧盟指令 2010/63;第 113/2013 号法令)。该研究获得了 IPMA 动物福利和伦理机构 (ORBEA, LABVIVOS-002-AquaClimAdapt) 的批准,该机构由国家活体动物使用管理局监督,即食品和兽医总局 (DGAV),伦理许可编号为 20596/25-S。
1. 研究模型和生物体的维护
注:本研究专为幼年金头鲷 (Sparus aurata) 设计,平均体重为 30.0 ± 5.0 g,总长度为 12.0 ± 2.0 cm。这种方法可能不直接适用于其他鱼类,因为不同的物种具有独特的生理和免疫学特征,可能会影响白细胞分离、细胞固定和活力评估。其他物种可能需要适应该方案,建议进行初步研究以优化每个目标物种的条件。
- 让鱼适应(检疫期)
- 将鱼均匀分布在大容量的水箱中(例如,两个水箱,每个水箱的总容量为 660 升 - 见 补充图 1)。
注意:要使用的水箱可能是循环水产养殖系统 (RAS) 的一部分,该系统可以有效地使用水并改善对水质的控制。在 RAS 中,水在系统内不断循环和处理,为鱼类提供稳定和受控的环境。这种设置有助于维持鱼类健康和生长的最佳条件,确保均匀分布并最大限度地减少研究期间的压力。 - 保持最佳的非生物条件。
- 在模拟其自然栖息地的条件下将鱼隔离 3 周:
温度:20.0 ± 0.5 °C;
溶解氧:7.2 ± 0.2 mg/L;
盐度:35.0 ± 0.5 ‰;
pH 值:8.0 ± 0.1 单位;
光周期:光照 14 小时/黑暗 10 小时。
注意:理想的维护条件可能因不同的鱼种而异。其他物种可能有不同的要求,因此根据目标物种的特定需求调整这些条件以确保生物体的健康和福利非常重要。此外,海水温度和光周期会随季节变化,因此在实验室中复制自然条件时应考虑季节性变化。
- 在模拟其自然栖息地的条件下将鱼隔离 3 周:
- 将鱼均匀分布在大容量的水箱中(例如,两个水箱,每个水箱的总容量为 660 升 - 见 补充图 1)。
- 启动实验研究。
- 根据每个案例研究的实验设置设计定义所需的水箱和鱼的数量。
- 检疫期过后,将鱼转移到独立的 RAS 中(见 补充图 2)。
- 为每个系统配备蛋白质分离器,以去除水中过量的有机化合物;物理过滤(滤袋 [400 μm]、过滤海绵和玻璃棉);生物过滤(生物球 [1.5“]、紫外线水消毒器和浸没式空气石);自动海水制冷系统和浸没式数字加热器,两者都连接到带有温度传感器的计算机控制系统 (ProfiLux) 以调节每个水箱中的温度;每个水箱中浸没空气石以控制溶解氧。
- 在进行实验之前,将鱼在新系统中适应 2 周。
- 执行日常维护
- 从每个孵化池中清除鱼粪,并进行 25% 的海水更新。
- 使用便携式精密温度计测量温度。
- 使用多参数测量仪器监测其他海水非生物参数(盐度、溶解氧和 pH 值)。
- 根据需要调整海水非生物参数,以确保整个实验的稳定性。
注:实验系统中的非生物条件可以根据每个案例研究的具体要求而变化。例如,如果该研究旨在模拟季节性变化或海洋热浪,则应相应地调整温度和光周期以模拟自然季节性变化。同样,如果研究的重点是模拟缺氧条件或海洋酸化,则应调整海水的氧气水平和 pH 值。这确保了实验条件尽可能真实和相关,从而提高了研究结果的有效性和适用性。 - 评估鱼的健康状况,识别和管理压力或疾病的迹象,如步骤 1.2.4.6-1.2.4.8 所述。
- 寻找异常行为,例如游泳不稳定、食欲不振、嗜睡、攻击性或孤立。
- 检查是否有疾病体征,包括病变、溃疡、变色、鳍夹住、粘液过多或鳃快速移动。
- 记录所有观察结果,记下日期和采取的行动。
- 每周进行水质测试。
- 使用比色法测量氨 (NH3/NH4)、亚硝酸盐 (NO2-) 和硝酸盐 (NO3-) 水平。
注意:确保所有这些参数都低于可检测水平。如果水位超过限值,请进行额外的换水、增加曝气或调整过滤。
- 使用比色法测量氨 (NH3/NH4)、亚硝酸盐 (NO2-) 和硝酸盐 (NO3-) 水平。
- 喂养和监测鱼类营养。
- 提供满足幼鱼特定营养需求的优质饮食(有关饮食详细成分的示例,请参见 补充表 1 )。
注意:确保水产饲料颗粒的大小 (2-3 mm) 适合幼鱼,便于摄入和消化。 - 调整饲料量,使其对应于鱼每天平均体重的 2%。
- 每天手动喂鱼两次 - 早上一次,下午一次(设定特定时间以保持稳定的喂食程序)。
- 提供满足幼鱼特定营养需求的优质饮食(有关饮食详细成分的示例,请参见 补充表 1 )。
2. 鱼类取样、安乐死、解剖和头肾采集
- 从水箱中品尝鱼。
- 从鱼缸中随机选择鱼,以避免采样偏差。
- 用网轻轻地将鱼转移到装满水箱水的临时容器中。
注意: 尽量减少处理时间以减轻压力。
- 准备安乐死溶液。
- 使用适合盛放鱼的适当容器(例如 3 升桶)。
- 将适量的三卡因 (MS-222) 溶解在海水中,以达到 200-300 mg/L的最终浓度 18(注意:参见补充表 2 和补充文件 1)。
- 用碳酸氢钠将溶液缓冲至 pH 值 7.2-7.5。
- 管理安乐死解决方案。
- 将鱼放入安乐死溶液中至少 10 分钟或直到观察到鳃盖运动停止和反射丧失(通过检查对外部刺激没有反应来确认安乐死)。
- 记录鱼的体重 (g) 和总长度 (cm)。
- 进行鱼类解剖。
注意:为确保最佳样品质量和细胞活力,应尽快完成解剖过程,最好在安乐死后 5 分钟内完成。- 使用空调确保实验室温度保持在 19 °C,以尽量减少采样和处理过程中的波动。
- 对解剖工具进行消毒(最好尽可能使用高压灭菌金属器械)并用 70% 乙醇建立一个干净的工作空间(注意,参见 补充表 2)。
- 将安乐死的鱼侧放放在无菌解剖盘上,头部指向非惯用手。
- 使用手术刀,沿着鱼的腹侧中线从通风口(肛门)向鳃小心切开。
注意:小心不要切得太深,以免损坏内脏。 - 小心地使用解剖剪刀延长切口并露出内部器官。轻轻提起体壁皮瓣,以便清楚地看到内部解剖结构。
- 找到头肾:头肾位于鳃的正后方,靠近体腔的前背区,并沿着体腔的顶部延伸,在脊柱下方。
注意:与周围组织相比,头肾的颜色通常较深(图 1)。 - 小心清除任何周围的组织,例如脂肪和结缔组织,以更好地观察头肾。
注意:此步骤需要小心处理,以免损坏头肾。 - 使用细尖镊子和剪刀,小心地提起头肾并在其周围进行精确切割,使其从周围组织中分离出来。
注意:请轻柔处理纸巾,以防止损坏。在一条重约 30 克的鱼中,头肾预计重约 20-30 毫克。 - 立即将切除的器官放入无菌培养皿内的细胞过滤器(100 μm 尼龙网)中,以确保无菌并促进后续处理步骤。
注:从此时起,应尽快(在 5 分钟内)执行所有步骤,以保持细胞活力。为了保持样品冷却,将培养皿放在装满冰块并覆盖有铝箔的容器上,执行以下步骤。

图 1:头肾的位置: (A) 描绘头肾在鳃后面和体腔前背侧区域的典型位置的插图;(B) 鲷鱼头肾的代表性图像,强调与周围组织相比,其颜色较深。 请单击此处查看此图的较大版本。
3. 分离头部肾白细胞(图 2)
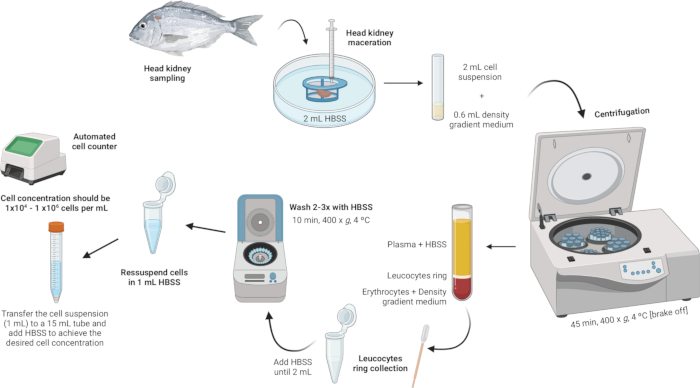
图 2: 从头肾分离白细胞的说明性描述。该方案涉及几个步骤:从组织匀浆开始,然后是密度梯度离心,收集白细胞环,洗涤白细胞环,最后以重悬和调整细胞浓度结束。 请单击此处查看此图的较大版本。
- 匀浆组织。
- 将 2 mL Hanks 平衡盐溶液 (HBSS) 放入无菌培养皿中。
- 确保细胞过滤器的网(100 μm 尼龙网)与 HBSS 接触,但未完全浸没。
- 使用注射器的柱塞在细胞过滤器上浸渍头肾。轻轻按压,迫使器官碎片穿过尼龙网,形成细胞悬液。
注:如果处理多个样品,则含有细胞悬液的培养皿可以在 4 °C 的冰箱中储存几分钟,直到下一步。该细胞悬液将用于白细胞分离。
- 进行密度梯度离心。
- 制备密度梯度培养基溶液,密度为 1.077 g/mL,渗透压为 353 mOsm/kg,pH 值为 7.4(参见 补充文件 1)。
注:不同鱼类的渗透压可能有所不同,因此调整密度梯度介质溶液的渗透压以满足每个物种的特定要求至关重要。 - 在 5 mL 聚苯乙烯圆底管中,小心加入 600 μL 密度梯度培养基溶液。
- 取细胞悬液 (2 mL) 并将其缓慢加入含有密度梯度培养基的试管中。第一滴至关重要 - 添加得非常轻柔,以避免破坏密度梯度介质相的稳定性。
注意:这应该以 3:10 的比例进行(密度梯度培养基:细胞悬液)。使用无菌 1 mL 巴斯德移液器进行精确和温和的添加。确保移液器的尖端接触试管的侧面,以防止干扰密度梯度介质层。避免将样品与密度梯度介质混合。 - 将试管在 4 °C 下以 400 x g 离心 45 分钟,同时关闭制动器。这确保了各层在此过程中保持完整。
注:离心后,应可以看到不同的层。白细胞将在密度梯度培养基和细胞碎片沉淀之间的界面处形成一个环(图 3)。
- 制备密度梯度培养基溶液,密度为 1.077 g/mL,渗透压为 353 mOsm/kg,pH 值为 7.4(参见 补充文件 1)。

图 3: 白细胞在密度梯度培养基和细胞碎片沉淀之间的界面处环状。 请单击此处查看此图的较大版本。
- 收集白细胞环。
- 使用无菌巴斯德移液器,轻轻吸出白细胞环 (~100 μL) 并将其转移到 2 mL 微量离心管中。
注意: 注意不要明显干扰各层,以避免污染。如果白细胞环似乎包含碎片或深色悬浮液,建议将收集的白细胞悬浮液通过新的微型细胞过滤器 (100 μm) 以确保纯度。将微型细胞过滤器放在 2 mL 微量离心管上,然后轻轻地将白细胞悬液通过过滤器转移。
- 使用无菌巴斯德移液器,轻轻吸出白细胞环 (~100 μL) 并将其转移到 2 mL 微量离心管中。
- 清洗白细胞环。
- 将 HBSS 添加到含有白细胞环的微量离心管中,直至体积达到 2 mL,然后轻轻重悬细胞。
注:将试管放在装满冰块的容器中,并用铝箔覆盖,以保持样品处于低温。确保管子不与冰直接接触。在整个洗涤过程中保持这种冷却设置。 - 将样品在 4 °C 下以 400 × g 离心 10 分钟(可以打开制动器)。
- 离心后,小心丢弃上清液,将沉淀留在底部(可能几乎看不见)。
- 重复洗涤步骤(添加 HBSS、重悬、离心和丢弃上清液),直到沉淀无杂质。
- 将 HBSS 添加到含有白细胞环的微量离心管中,直至体积达到 2 mL,然后轻轻重悬细胞。
- 重悬并调整细胞浓度。
- 将细胞重悬于用于洗涤的相同 2 mL 微量离心管内的 1 mL HBSS 中。
- 使细胞浓度介于 1 × 10 ×4 和 1 106 个细胞/mL 之间。如果初始沉淀较大,则可能需要额外的 HBSS 以将细胞浓度稀释到所需范围。将细胞悬液转移至 15 mL 试管中,并根据获得的细胞计数根据需要添加更多 HBSS。
注:建议使用自动细胞计数仪以促进该过程。
4. 白细胞的染色和固定(图 4)
注:LIVE/DEAD 可固定死细胞染色试剂盒提供了一种使用流式细胞术评估固定细胞活力的改进方法。这些检测利用与细胞胺相互作用的荧光反应性染料。如果细胞膜受损,染料可以穿透细胞,与细胞内部和细胞表面的游离胺发生反应,导致强烈的荧光染色。相反,在活细胞中,只有细胞表面的胺可以与染料反应,导致染色相对较暗。用甲醛固定后,染色强度得以保持,甲醛还可以通过防止微生物生长来保护样品。LIVE/DEAD 可固定死细胞染色试剂盒除荧光染料外完全相同 - 有蓝色、紫色、浅绿色、黄色、绿色、红色、远红或近红外(红外)可供选择。在这项研究中,我们使用了 Near-IR 荧光反应性染料。此外,这种单色检测允许在多色实验中并行测试其他参数。
- 准备染料。
- 将试剂置于室温 (RT):在取下瓶盖之前,让一小瓶荧光反应性染料和一小瓶无水二甲基亚砜 (DMSO) 达到 RT。
- 重构染料:向含有活性染料的小瓶中加入 50 μL DMSO。充分混合并确保染料已完全溶解。
- 尽快使用复溶的染料溶液,最好在几个小时内使用。
注:每个试剂盒包括 5 个单独的反应性染料小瓶,提供足够的材料来对至少 40 个细胞样品进行染色。然而,重构后,染料的 DMSO 溶液相对不稳定,尤其是在暴露于湿气时。任何未使用的部分可以在 ≤-20 °C 下储存长达 2 周,避光和防潮。
- 染色并固定细胞。
注:适用于细胞染色的缓冲液包括 Hanks 平衡盐溶液 (HBSS)、磷酸盐缓冲盐水 (PBS) 和 Dulbecco PBS (D-PBS),只要它们不含外来蛋白质,如牛血清白蛋白或血清。使用氨基反应性染料时,避免使用含有叠氮化钠或外来蛋白的 Tris 缓冲液和溶液进行细胞重悬和洗涤。在这项研究中,我们使用 HBSS,因为它的离子组成平衡,有助于维持渗透平衡,并提供必需的离子和葡萄糖,以支持染色过程中的细胞代谢和活力。HBSS 也不含外来蛋白质,可防止干扰活性染料并确保准确的活力评估。- 对细胞进行计数并用 HBSS 将密度调节至 1 x 106 个细胞/mL 后,将 1 mL 该细胞悬液转移到 2 mL 微量离心管中。
- 每天,在至少一个样品中诱导细胞死亡,用作对照,以设置活细胞和死细胞之间的荧光强度阈值。按如下方式在微量离心管中制备样品:
试管 1:活细胞 - 未染色
试管 2:活细胞 - 染色
管 3:死细胞 - 未染色
试管 4:死细胞 - 染色
注意:这四个试管只需要为每个实验中的单个样品作为对照准备。对于其余样品,只需要两管(试管 1:样品 - 未染色和试管 2:样品 - 染色),因为它将提供有关活细胞和死细胞的信息。
- 每天,在至少一个样品中诱导细胞死亡,用作对照,以设置活细胞和死细胞之间的荧光强度阈值。按如下方式在微量离心管中制备样品:
- 细胞死亡阳性对照:将标记的未染色 Dead (Tube 3) 和 Dead-stained (Tube 4) 试管置于 50 °C 的水浴中 7 分钟,以通过热处理诱导细胞死亡。
- 细胞染色:将 1 μL 重构的荧光反应性染料(来自步骤 4.1.2)加入到管 2 和 4(将要染色的管)中的 1 mL 细胞悬液中并充分混合。
- 在 RT 下避光孵育 30 分钟。
注意:如果不需要固定,则可以跳过下面的步骤 4.2.5-4.2.7。相反,用 1 mL 含 1% 牛血清白蛋白的 HBSS 洗涤细胞两次(参见 补充文件 1),并在 1 mL 含 1% 牛血清白蛋白的 HBSS 中重悬。尽快在流式细胞仪上进行分析;否则,由于细胞未固定,细胞活力可能会受到影响。 - 用 1 mL HBSS 洗涤细胞两次,并将细胞重悬于 900 μL HBSS 中。
- 加入 100 μL 37% 甲醛(注意,参见 补充表 2)。
- 在 RT 孵育 15 分钟。
- 用 1 mL 含 1% 牛血清白蛋白 (BSA) 的 HBSS 洗涤两次,然后将细胞重悬于 1 mL 含 1% BSA 的 HBSS 中。
- 将样品储存在 4 °C 的冰箱中。 固定后 1 个月内分析细胞。
- 使用适当的激发和检测通道通过流式细胞术分析固定的细胞悬液。
注:正确的激发和检测通道可能因所使用的仪器而异(参见 补充表 3)。
- 对细胞进行计数并用 HBSS 将密度调节至 1 x 106 个细胞/mL 后,将 1 mL 该细胞悬液转移到 2 mL 微量离心管中。

图 4: 白细胞染色和固定的说明性描述。 请单击此处查看此图的较大版本。
5. 流式细胞术
- 获取数据。
注:流式细胞仪上要遵循的程序可能因所使用的特定流式细胞仪而异。在本研究中,使用 Attune NTx 流式细胞仪采集数据。- 运行示例。
- 将样品管放入样品端口。
- 按 start 开始采集,然后在事件速率(事件/秒)稳定后单击 Record 。
- 在 singlelets 门中为每个样品记录至少 10,000 个事件,以进行可靠的分析。
- 保存每个样品的所有数据,并将其备份到外部驱动器或云存储中。
- 分析数据。
注:对于流式细胞术分析,有多种软件选项可供选择。在本研究中,使用 FlowJo v10.8.119 进行数据分析。- 加载数据文件:启动流式细胞术分析软件并上传从实验中获取的 .fcs 文件。
- 可视化数据(图 5A):绘制前向散射 (FSC-A) (XX) 与侧向散射 (SSC-A) (YY) 以评估细胞大小和粒度。
注:此图通常用于识别细胞群并根据其散射特性排除碎片。 - 单重态细胞门控和多重体排除(图 5B):使用前向散射面积 (FSC-A) 与前向散射高度 (FSC-H) 图来排除多重体。绘制一个门以包括图中对齐的所有事件(单个单元格)并排除未对齐的事件(多重)。如果样品具有 FSC 非常低的事件,则通过不将它们包含在单个细胞的门上来排除这些事件,只保留单细胞。
- 识别白细胞群(图 5C):根据 FSC-A/SSC-A 概况区分 3 个白细胞群:FSC-A高/SSC-A高 是粒细胞,FSC-A培养基/SSC-A培养基 是单核细胞,FSC-A低/SSC-A低 是淋巴细胞。
- 活力门控(图 5D):在相应的荧光通道(NIR,RL3-A)上设置活力染料染色的阈值。根据 LIVE/DEAD 可固定死细胞染色剂的染色强度定义活细胞与死细胞:暗淡染色的细胞定义为活细胞,强染色细胞定义为死细胞。
- 种群统计:查看软件提供的统计数据,包括每个门中的事件总数(细胞)以及总细胞和门控细胞的百分比。
- 导出数据:将数据导出到电子表格,并使用适当的统计软件(GraphPad Prism 或 R)进行进一步的统计分析。
注意:分析方法的选择将取决于研究的目标。

图 5:用于头肾细胞活力评估的流式细胞术门控策略: (A) 表示所有收集事件的 FSC-A/SSC-A 概况。(B) 表示基于前向散射 (FSC-A)/前向散射 (FSC-H) 图上线性的单峰区域定义的多重态排除。(C) 表示在排除多重后基于 FSC-A/SSC-A 定义的 3 个主要群体。(D) 表示显示 Live/Dead Viability 染料染色的直方图。为了设置允许区分活细胞和死细胞的阈值,将白细胞置于轻度热休克 (50 °C, 7 min) 中,然后用活力染料染色。高染色强度阳性细胞 (++) 是死细胞,低染色阳性细胞 (+-) 是活细胞。 请单击此处查看此图的较大版本。
结果
图 6 显示了代表性流式细胞术数据,显示了使用本研究中描述的方案从幼鱼金头鲷 (Sparus aurata) 的头肾中分离的白细胞群及其细胞活力。该图比较了两个样品:一个具有高细胞活力,其中鱼暴露于最佳条件下(图 6A),另一个细胞活力低,细胞暴露于热应激(图 6B)。
在这两个样本中,该方法有效地鉴定了三个主要的白细胞群:淋巴细胞 (LY) 、单核细胞 (MO) 和粒细胞 (GR)。这些群体根据细胞大小和复杂性的差异进行区分,如前向散射 (FSC-A) 和侧向散射 (SSC-A) 图所示。前向散射 (FSC-A) 表示相对细胞大小,而侧向散射 (SSC-A) 反映细胞的内部复杂性或粒度,从而可以清楚地分离细胞群。在最佳条件下(图 6A),白细胞群分布如下:LY 为 31.0%,MO 为 38.0%,GR 为 31.0%。然而,在暴露于热应激的样品中(图 6B),观察到这些群体的分布发生了变化,LY 下降到 21.3%,MO 增加到 45.6%,GR 保持相对稳定在 33.1%。
图 6A1-A3 和图 6B1-B3 中详述的细胞活力进一步分析揭示了两个样品之间的显着差异。可以观察到,暴露于最佳条件的样品(图 6A)表现出更高的活力,在所有白细胞群中以活细胞(以蓝色表示)为主。相比之下,热应激样品(图 6B)显示细胞死亡显着增加(更强烈的染色以红色显示),LY 显示 50.7% 的细胞死亡,MO 显示 83.7% 和 GR 84.5%。
总体而言,结果清楚地证明了该方案在分离和分析白细胞群以及评估细胞活力方面的有效性。此外,这些数据为压力条件(如热暴露)如何影响白细胞群动态和细胞活力提供了有价值的见解。在应激下观察到的细胞分布和活力变化表明,热暴露不仅会破坏白细胞群的平衡,还会损害细胞健康。这些变化可能表明对压力的免疫反应,表明环境压力源触发了主动防御机制。

图 6:代表性流式细胞术图说明了金头鲷 (Sparus aurata) 头肾中不同白细胞群的鉴定和活力:(A) 暴露于最佳条件下的高细胞活力样品:左图显示了基于 FSC-A/SSC-A 的白细胞群设门,识别淋巴细胞 (LY)、单核细胞 (MO) 和粒细胞 (GR);LY (A.1)、MO (A.2) 和 GR (A.3) 的活力。(B) 受热应激的低细胞活力样品:左图显示了基于 FSC-A/SSC-A 的白细胞群门控,识别淋巴细胞 (LY)、单核细胞 (MO) 和粒细胞 (GR);LY (B.1)、MO (B.2) 和 GR (B.3) 的活力。请单击此处查看此图的较大版本。
补充图 1:总容量为 660 L 的检疫罐的代表性图像。 请点击此处下载此图表。
补充图 2:RAS 系统设置的图像。(1) Profilux;(2) 灯具;(3) 水族馆/水箱;(4) 冰箱;(5) 水族箱的进水口水龙头;(6) 用于水族箱出水口的蓝色虹吸管;(7) 集水坑;(8) 蛋白质分离器;(9) 机械过滤器(滤袋);(10) 机械过滤器(蓝色海绵 + 玻璃棉);(11) 生物过滤器(生物球);(12) 恒温器;(13) 主泵;(14) 紫外线消毒器;(15) 温度传感器;(A) 机械过滤器(蓝色海绵);(B) 机械过滤器(玻璃棉)。请点击此处下载此图表。
补充表 1:研究中使用的实验饮食的成分组成 (%) 和近似分析 (%DM)。 请点击此处下载此表格。
补充表 2:方案中使用的试剂:健康危害、危险声明、预防措施和急救措施。 请点击此处下载此表格。
补充表 3:与胺反应性 LIVE/DEAD 可固定死细胞染料一起使用的适当激发和检测通道。 请点击此处下载此表格。
补充文件 1:溶液制备的计算。 请点击此处下载此文件。
讨论
本研究开发的方法代表了鱼类免疫学研究的重大进步,有望提高对鱼类免疫反应和海洋资源可持续性的理解。 S. aurata 是 Sparidae 科的一种有价值的海洋鱼类,由于多种原因,包括其生态和经济相关性,以及它在生理学、免疫学、毒理学和水产养殖等多个研究领域的实验室研究中的广泛性20。 金链球菌 的主要优点之一是易于在实验室中处理和饲养,具有完善的饲养方案,可确保一致和可重复的实验条件21。此外,其环境适应性(即对各种环境条件(如温度和盐度波动)的高度耐受性)使其成为旨在改进养殖技术和评估环境对海洋生物影响的研究的理想选择22。 S. aurata 具有特征明确的免疫系统和基因组数据的可用性,可以解锁鱼类的免疫反应、病原体抵抗力、疫苗功效和整体健康状况20。鉴于它在水产养殖以及南欧人口饮食习惯中的重要性,对该物种的研究可以直接影响农业实践,提高其产量和可持续性,同时解决行业内的环境挑战20。
从这个意义上说,该方案在各个研究领域提供了多种优势和潜在应用,例如:(i) 鱼类免疫学:提供对金黄色葡萄球 菌头肾免疫细胞的精确和详细分析,允许识别和表征不同的白细胞群,以及通过流式细胞术对其细胞活力进行稳健评估;(ii) 水产养殖研究:对养殖技术、营养和疾病管理的研究至关重要,支持旨在减少对抗生素和化学处理的依赖的未来研究,从而促进更可持续的水产养殖做法;(iii) 生态毒理学:在评估污染物和其他环境压力因素对鱼类免疫健康的影响、为环境风险评估和制定水生生态系统保护条例方面具有重要价值;(iv) 比较生理学:使研究人员能够跟踪免疫系统对各种环境挑战的进化适应,从而更深入地了解免疫功能的遗传和生理基础;(v) 海洋生物学和生态学:提高对 金黄色葡萄球菌的生态作用和相互作用的理解,提供对物种分布、栖息地偏好和环境变化对海洋生物多样性影响的见解;(vi) 生物医学研究:鱼类越来越多地被用作生物医学研究的模式生物。免疫细胞分离和分析有助于了解对药物发现甚至医学至关重要的细胞和分子方面。
多年来,鱼类白细胞的定量和鉴定依赖于传统的血液学技术,例如使用 Bürker、Neubauer 或 Thoma 血细胞计数器进行手动计数,以及染色的血涂片10,12。还使用台盼蓝排除试验评估细胞活力,然后进行显微镜计数15、22、23、24、25、26、27、28。虽然这些方法有助于我们理解鱼类免疫学,但它们也有一些局限性。手动白细胞计数既耗时又费力,而且这些技术的准确性经常受到作员可变性和人为错误的影响,严重影响结果的一致性10。
1994 年,Esteban 等人引入了一种技术来评估鲈鱼 (Dicentrarchus labrax)23 的吞噬细胞防御机制,从而彻底改变了鱼类白细胞分析。在他们的研究中,使用 Percoll 密度梯度离心法从外周血、头肾和腹膜渗出物中分离白细胞23。这种方法的进步标志着一个重大的飞跃,提高了白细胞分析的准确性和可靠性。继 Esteban 等人的开创性工作之后,随后的研究旨在改进和优化用于白细胞分析的流式细胞术技术,重点关注各个方面,例如细胞群分析 6,15,16,28,29、细胞活力3、6、27、28 和吞噬活性 6,23, 24,27,28。分离程序的进步,包括使用不同梯度培养基(例如,Ficoll 与 Percoll)和优化的离心方案,提高了分离白细胞的纯度和产量 1,8,14,26。先进染色技术的发展和荧光染料的使用,如碘化丙啶 (PI) 和 3,3'-二己氧碳羰菁碘 (DiOC6(3)),能够更准确地区分活细胞和非活细胞,以及分别详细表征白细胞群16,30.该技术的主要优点之一是它能够同时区分不同的白细胞群(淋巴细胞、单核细胞和粒细胞)并评估每个细胞群的细胞活力。这使研究人员能够确定哪些人群在特定条件下受影响最大,从而更深入地了解免疫反应并揭示最脆弱的白细胞亚群。然而,尽管有这些改进,目前的方法仍然面临局限性。大多数研究都集中在成年鱼上,在幼鱼阶段的研究中留下了空白。幼鱼的体型较小,并且难以从其比例较小的免疫器官中获得高质量的样本,因此对白细胞提取提出了独特的挑战17。此处描述的研究通过优化幼鱼的方案、调整细胞悬液比例和 Percoll 溶液来提高白细胞提取的质量,专门解决了这些问题。此外,由于迫切需要进行白细胞活力评估,现有方法通常受到一次可处理的样品或重复数量的限制。样品处理的任何延迟都会对细胞活力产生不利影响,使采样过程复杂化,并可能影响结果。为了克服这一限制,本研究引入了一种新型染色技术,该技术允许在固定后长达 1 个月内进行细胞固定和分析。这项创新为采样计划提供了更大的灵活性,使研究人员能够方便地处理和分析样品,从而显著改善了流式细胞术评估的工作流程和可靠性。
该方案的成功取决于几个关键步骤,每个步骤都需要仔细执行以确保白细胞的完整性和活力,随后通过流式细胞术进行分析。正确制备安乐死溶液和 pH 值调节对于有效安乐死至关重要。准备不当的解决方案可能会导致安乐死不完全或对鱼造成额外压力18.准确、仔细地解剖头肾对于避免污染至关重要。保持无菌和组织完整性对于获得高质量的白细胞样品至关重要。必须正确调整 Percoll 溶液的密度、渗透压和 pH 值,以实现高效的白细胞分离。用无菌移液器轻轻吸出白细胞环对于避免污染和干扰梯度层至关重要。采集后有效洗涤细胞对于去除 Percoll 残基和其他杂质至关重要。重复洗涤过程可确保干净的细胞沉淀准备好固定。活性染料应在使用前立即制备以确保其有效性,因为处理不当会损害其稳定性。适当的染料添加和孵育时间对于准确区分活细胞和死细胞至关重要。用 3.7% 甲醛固定细胞是保持细胞形态和确保准确鉴定死细胞的关键步骤。甲醛浓度必须精确,并且必须严格遵守孵育时间,以避免结果不准确。固定后清洗细胞对于去除任何多余的染料和甲醛很重要,这可能会干扰后续分析。正确储存固定样品并及时分析对于保持数据准确性是必要的。调整激发和检测通道以匹配所使用的特定染料对于准确的流式细胞术结果至关重要。
尽管该方法具有许多优点,但必须考虑一些局限性。一个关键的限制是其物种特异性,因为该方案针对海鱼幼年金头鲷 (S. aurata) 进行了优化。这意味着当应用于其他鱼类,尤其是淡水鱼时,其有效性可能会有所不同。海洋和淡水物种之间渗透平衡的差异可能需要调整方案中使用的缓冲液,因为适用于盐水条件的解决方案可能不适用于淡水物种。此外,组织结构、细胞密度和生理反应的差异可能需要调整方案,这可能会影响不同物种的可重复性和一致性。
另一个重要因素是样本采集前的鱼类维护。每个物种都有特定的最佳水条件,这对于维持鱼类健康和确保实验结果的质量至关重要20.温度、盐度和 pH 值等参数的变化会影响细胞活力和数据质量,因为次优条件可能会诱发生理应激,从而损害细胞完整性。为确保实验结果的一致性,重要的是将所有重复保持在相同的受控条件下,无论是最佳还是有意次优(取决于研究目标)。
处理和解剖技术的可变性也会影响头部肾白细胞的质量和数量,使作者的技能和经验成为方案成功的关键因素。此外,在整个分离过程中保持细胞活力可能是一项挑战,因为安乐死和细胞固定之间的任何延迟都可能导致活力降低和结果偏倚。立即处理组织和细胞对于保持高细胞活力至关重要,但这一要求可能难以始终如一地实现,尤其是在处理大量样品时。
披露声明
作者声明不存在可能影响研究、分析、数据解释、写作或提交手稿发表决定的财务、个人或专业利益冲突。
致谢
这项工作得到了 Fundação Portuguesa para a Ciência e Tecnologia (FCT I.P.) 的支持,在 Aqua-CLIMADAPT (PTDC/CTA-AMB/0592/2021, https://doi-org.remotexs.ntu.edu.sg/10.54499/PTDC/CTA-AMB/0592/2021) 项目的框架下。我们感谢由应用分子生物科学部门 (UCIBIO) 和绿色化学研究部门联合实验室 – LAQV 支持的生物实验室,这些实验室由 FCT/MCTES 的国家资金资助(分别为 UIDB/04378/2020 和 UIDB/50006/2020),以及健康与生物经济联合实验室研究所 – i4HB (LA/P/0140/2020)。这项工作还得到了欧盟委员会通过 GLYCOTwinning 项目(赠款协议第 101079417 号)和 FCT 通过 InnoGlyco (2022.04607.PTDC) 的支持。Isa Marmelo 还感谢 FCT I.P. 的博士资助(2020.04413.BD 年,https://doi-org.remotexs.ntu.edu.sg/10.54499/2020.04413.BD 年)。
材料
| Name | Company | Catalog Number | Comments |
| Air Stones | N/A | N/A | |
| Aquafeed | SPAROS, Lda., Portugal | N/A | High-quality diet |
| Automatic Cell Counting Equipment | NanoEnteK, Korea | N/A | EVE automatic cell counter (NanoEnteK) |
| Automatic Water Refrigeration Systems | Foshan Weinuo Refrigeration Equipment Co., Ltd, China | N/A | |
| Bio balls 1.5" Aquarium Pond Filter | TMC Iberia, Portugal | N/A | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich, Germany | A7906 | |
| Bucket (3 L) | N/A | N/A | To prepare and carry out euthanasia |
| Buckets (5 L) | N/A | N/A | To transport the animals |
| Cell Strainers | Jetbiofil, China | CSS-013-100 | Cell Strainer, 100 μm nylon mesh, Sterile, Yellow |
| Centrifugue | Fisher Scientific, Germany | N/A | accuSpin Micro 17 R |
| Colorimetric Test Kit for Ammonia (NH4+/NH3) | Tropic Marin, USA | N/A | |
| Colorimetric Test Kit for Nitrate (NO3-) | Tropic Marin, USA | N/A | |
| Colorimetric Test Kit for Nitrite (NO2-) | Tropic Marin, USA | N/A | |
| Computer | N/A | N/A | To acquire and analyse the data obtained from the flow cytometer |
| Computerized Control System (Profilux) | GHL, Germany | N/A | ProfiLux 3 Outdoor |
| Deionized water | N/A | N/A | To clean the Flow Cytometer |
| Density Gradient Medium: Percoll | Cytiva, Sigma-Aldrich, Germany | 17-0891-01 | |
| Digital scale | KERN & Sohn GmbH, Germany | N/A | KERN EMS 300-3 |
| Ethanol 70% | Millipore, Supelco, Portugal | EX0281 | To keep the workspace clean |
| EVE Cell Counting Slides | NanoEnteK, Korea | N/A | |
| Falcon Tubes (15 mL) | pluriSelect Life Science, Germany | 05-00002-01 | Sterile |
| Filter bag | TMC Iberia, Portugal | N/A | 400 micron |
| Filter Sponge | N/A | N/A | |
| Flow Cytometer | ThermoFisher Scientific, USA | N/A | Attune flow cytometer |
| FlowJo v10.8.1 Software | BD Life Sciences | N/A | |
| Formaldehyde 37% | Sigma-Aldrich, Germany | 8.18708 | |
| Glass Wool | N/A | N/A | |
| Hanks' Balanced Salt Solution | Merck Life Science S.L, Portugal | H6648 | Modified, with sodium bicarbonate, without phenol red, calcium chloride and magnesium sulfate, liquid, sterile-filtered, suitable for cell culture |
| LIVE/DEAD Fixable Dead Cell Stain Kits | Life Technologies Europe, Netherlands | L10119 | Near-IR fluorescent reactive dye + DMSO |
| Main Water Pumps | EHEIM, Germany | Universal 1200 | |
| Microcentrifuge Tubes (2 mL) | BRAND, Merck, Germany | Z628034 | Sterile |
| Micropipette Tips | Sartorius, Germany | 790010, 790200, 791000 | Compatible with Sartorius, 1-10 µL, 2-20 µL, 20-200 µL, 100-1000 µL |
| Micropipettes | Sartorius, Germany | 728020, 728030, 728060, 728070 | Sartorius ProlinePlus 1-10 µL, 2-20 µL, 20-200 µL, 100-1000 µL |
| Mini Cell Strainers | pluriSelect Life Science Global Headoffice, Germany | 43-10100-50 | PluriStrainer 100 µm nylon mesh, Sterile |
| Multi-Parameter Measuring Instrument | WTW, Germany | Multi 3420 SET G + IDS digital conductivity cell (TetraCon 925) + Optical IDS DO sensor (FDO 925) + IDS pH-electrode (SenTix 940) | |
| Pasteur Pipettes (1 mL, 5 mL) | Humeau Expert du laboratoire, France | 248295 | Sterile |
| Petri dishes | Sarstedt, Germany | 82.1194.500 | 60 x 15 mm, Polystyrene, Sterile |
| pH Meter | Hanna Instruments Inc., Romania | HANNA HI2211 | |
| Polystyrene round-bottom Falcon tubes (5 mL) | Fisher Scientific, Germany | 14-959-2A | Sterile |
| Portable Precision Thermometer | Ebro Electronic, Germany | N/A | TFX 430 |
| Protein Skimmers | Mantis | N/A | Tornado 120 |
| Quality control beads/Performance test beads | Thermofisher Scientific, USA | N/A | |
| Quarantine Tanks | N/A | N/A | Tanks with 660 L total volume |
| Rectangular Glass Tanks/Aquariums | N/A | N/A | Tanks with 200 L total volume |
| Refrigerator | N/A | N/A | To store the samples at 4 °C |
| Ruler 30 cm | N/A | N/A | To measure the fish's length |
| Sodium bicarbonate | Honeywell Fluka, Germany | 31437 | Sodium hydrogen carbonate (NaHCO3) |
| Sodium chloride | Sigma-Aldrich, Germany | S9888 | |
| Sterile Dissection Tools | N/A | N/A | (e.g. scalpel, scissors, fine-tipped forceps, dissecting tray/board) |
| Submerged Digital Heaters | TMC Iberia, Portugal | 300 W, V2Therm Digital Heaters | |
| Syringes 1 mL | IVFSTORE, USA | 8300014579-MEA | Sterile, HSW Soft-Ject Syringes to macerate head-kidney |
| Temperature Sensors | GHL, Germany | PT 1000 | |
| Tricaine (MS-222) | ThermoFisher Scientific, Germany | 118000500 | Ethyl 3-aminobenzoate, methanesulfonic acid salt, 98% (C10H15NO5S) |
| Ultraviolet Water Sterilizer | EHEIM, Germany | 5305010 | ClearUVC-36 |
| Water Bath | Fisher Scientific, Germany | N/A | Fisherbrand IsotempTM (P/N U01318) |
| Water-resistant Luminaires | N/A | N/A |
参考文献
- Samaï, H.C. et al. Procedures for leukocytes isolation from lymphoid tissues and consequences on immune endpoints used to evaluate fish immune status: A case study on roach (Rutilus rutilus). Fish Shellfish Immunol. 74, 190-204 (2018).
- Mokhtar, D. M., Zaccone, G., Alesci, A., Kuciel, M., Hussein, M. T., Sayed, R. K. A. Main components of fish immunity: An overview of the fish immune system. Fishes. 8 (2), 93 (2023).
- Lulijwa, R. et al. Characterisation of Chinook salmon (Oncorhynchus tshawytscha) blood and validation of flow cytometry cell count and viability assay kit. Fish Shellfish Immunol. 88, 179-188 (2019).
- Uribe, C., Folch, H., Enriquez, R., Moran, G. Innate and adaptive immunity in teleost fish: a review. Vet Med. 56 (10), 486-503 (2011).
- Bjørgen, H., Koppang, E. O. Anatomy of teleost fish immune structures and organs. Immunogenetics. 73 (1), 53-63 (2021).
- Santos, R. A. et al. In vitro modulation of gilthead seabream (Sparus aurata L.) leukocytes by Bacillus spp. extracellular molecules upon bacterial challenge. Fish Shellfish Immunol. 121, 285-294 (2022).
- Witeska, M., Kondera, E., Ługowska, K., Bojarski, B. Hematological methods in fish - Not only for beginners. Aquaculture. 547, 737498 (2022).
- Titus, J. et al. Development and validation of a flow cytometry method to examine circulating leukocyte subpopulations in barramundi (Lates calcarifer). Comp Immunol Rep. 6, 200142 (2024).
- Marmelo, I. et al. Eco-innovative aquafeeds biofortified with Asparagopsis taxiformis to improve the resilience of farmed white seabream (Diplodus sargus) to marine heatwave events. Heliyon. 10 (15), e35135 (2024).
- Seibel, H., Baßmann, B., Rebl, A. Blood Will Tell: What Hematological Analyses Can Reveal About Fish Welfare. Front Vet Sci. 8, 616955 (2021).
- Franke, A., Beemelmanns, A., Miest, J. J. Are fish immunocompetent enough to face climate change? Biol Lett. 20 (2), 20230346 (2024).
- Fazio, F. Fish hematology analysis as an important tool of aquaculture: A review. Aquaculture. 500, 237-242 (2019).
- Fazio, F., Saoca, C., Costa, G., Zumbo, A., Piccione, G., Parrino, V. Flow cytometry and automatic blood cell analysis in striped bass Morone saxatilis (Walbaum, 1792): A new hematological approach. Aquaculture. 513, 734398 (2019).
- Lulijwa, R., Alfaro, A. C., Merien, F., Meyer, J., Young, T. Advances in salmonid fish immunology: A review of methods and techniques for lymphoid tissue and peripheral blood leucocyte isolation and application. Fish Shellfish Immunol. 95, 44-80 (2019).
- Esteban, M. Á., Muñoz, J., Meseguer, J. Blood cells of sea bass (Dicentrarchus labrax l.). Flow cytometric and microscopic studies. Anat Rec. 258 (1), 80-89 (2000).
- Inoue, T., Moritomo, T., Tamura, Y., Mamiya, S., Fujino, H., Nakanishi, T. A new method for fish leucocyte counting and partial differentiation by flow cytometry. Fish Shellfish Immunol. 13 (5), 379-390 (2002).
- Ye, R. R. et al. Immune competence assessment in marine medaka (Orzyias melastigma)-a holistic approach for immunotoxicology. Environ Sci Pollut Res. 24 (36), 27687-27701 (2017).
- American Veterinary Medical Association. AVMA Guidelines for the Euthanasia of Animals: 2020 Edition. American Veterinary Medical Association, Schaumburg, IL (2020).
- FlowJoTM Software (for Windows). Version v10.8.1 (BD Life Sciences). At < https://www.bdbiosciences.com/en-us/products/software/flowjo-v10-software> (2023).
- Mhalhel, K. et al. Review on Gilthead Seabream (Sparus aurata) aquaculture: Life cycle, growth, aquaculture practices and challenges. J Mar Sci Eng. 11 (10), 2008 (2023).
- Toni, M., Manciocco, A., Angiulli, E., Alleva, E., Cioni, C., Malavasi, S. Review: Assessing fish welfare in research and aquaculture, with a focus on European directives. Animal. 13 (1), 161-170 (2018).
- Kır, M. Thermal tolerance and standard metabolic rate of juvenile gilthead seabream (Sparus aurata) acclimated to four temperatures. J Therm Biol. 93, 102739 (2020).
- Esteban, M. Á, Meseguer, J. Phagocytic defence mechanism in sea bass (Dicentrarchus labrax L.): An ultrastructural study. Anat Rec. 240 (4), 589-597 (1994).
- Esteban, M. Á., Mulero, V., Muñoz, J., Meseguer, J. Methodological aspects of assessing phagocytosis of Vibrio anguillarum by leucocytes of gilthead seabream (Sparus aurata L.) by flow cytometry and electron microscopy. Cell Tissue Res. 293 (1), 133-141 (1998).
- Rodríguez, A., Esteban, M. Á., Meseguer, J. Phagocytosis and peroxidase release by seabream (Sparus aurata L.) leucocytes in response to yeast cells. Anat Rec A Discov Mol Cell Evol Biol. 272 (1), 415-423 (2002).
- Hamoutene, D., Payne, J. F., Volkoff, H. Effects of tebufenozide on some aspects of lake trout (Salvelinus namaycush) immune response. Ecotoxicol Environ Saf. 69 (2), 173-179 (2007).
- Pierrard, M.-A., Roland, K., Kestemont, P., Dieu, M., Raes, M., Silvestre, F. Fish peripheral blood mononuclear cells preparation for future monitoring applications. Anal Biochem. 426 (2), 153-165 (2012).
- Guardiola, F. A., Logothetis, P., Meseguer, J., Esteban, M. Á. Evaluation of silver nanospheres on viability and innate cellular parameters of gilthead seabream (Sparus aurata L.) head-kidney leucocytes. Fish Shellfish Immunol. 69, 99-107 (2017).
- Campos-Sánchez, J. C., Guardiola, F. A., Esteban, M. Á. In vitro effects of cantharidin on gilthead seabream (Sparus aurata) head-kidney leucocytes. Fish Shellfish Immunol. 123, 20-35 (2022).
- Korytář, T., Dang Thi, H., Takizawa, F., Köllner, B. A multicolour flow cytometry identifying defined leukocyte subsets of rainbow trout (Oncorhynchus mykiss). Fish Shellfish Immunol. 35 (6), 2017-2019 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。