Method Article
Isolamento, fissazione e caratterizzazione di leucociti renali giovanili di orata mediante citometria a flusso
In questo articolo
Riepilogo
Questo manoscritto descrive l'isolamento e la fissazione di leucociti estratti dalla testa-rene dell'orata e la valutazione della loro vitalità mediante citometria a flusso. Questo lavoro contribuisce alla standardizzazione dei protocolli e sfrutta l'elaborazione di un numero maggiore di campioni senza compromettere la qualità dei campioni, promuovendo i progressi nelle conoscenze sull'immunologia dei pesci.
Abstract
L'immunità è fondamentale per la regolazione fisiologica degli organismi, fungendo da difesa primaria contro gli agenti patogeni e i fattori di stress ambientale. L'isolamento e l'analisi delle cellule immunitarie forniscono informazioni chiave sulle risposte immunitarie alle pressioni esterne. Tuttavia, la mancanza di protocolli armonizzati per le specie meno studiate, come i pesci marini, porta spesso a sfide tecniche e analitiche che ostacolano l'interpretazione dei dati e una comprensione approfondita delle risposte immunitarie specie-specifiche. Questo studio mirava a mettere a punto una procedura analitica ottimizzata basata sulla citometria a flusso per caratterizzare e determinare la vitalità dei leucociti dal rene della testa (il principale organo ematopoietico nei pesci teleostei) del novellame di orata (Sparus aurata). La procedura è iniziata con l'isolamento dei leucociti attraverso un processo di omogeneizzazione utilizzando la soluzione salina bilanciata di Hanks, seguita da un metodo di centrifugazione a gradiente di densità Percoll ottimizzato per garantire alti tassi di recupero dei leucociti con una contaminazione eritrocitaria minima necessaria per un'efficiente successiva analisi di citometria a flusso. Inoltre, è stata impiegata una nuova tecnica che utilizza un colorante reattivo alle cellule (LIVE/DEAD Fixable Dead Cell Stain Kit) per distinguere le cellule vitali da quelle morte in base ai loro modelli di colorazione fluorescente. La fissazione è stata ottenuta con il 3,7% di formaldeide, preservando la morfologia cellulare, la vitalità e l'efficienza di colorazione. L'analisi della citometria a flusso ha identificato con successo tre popolazioni di leucociti predominanti: linfociti, monociti e granulociti. Questo metodo non solo ha permesso test di vitalità, ma anche l'accurata differenziazione dei tipi di cellule. Il miglioramento dei protocolli di citometria a flusso rappresenta un passo avanti nell'immunologia dei pesci aumentando l'accuratezza e l'efficienza dell'analisi delle cellule immunitarie. Inoltre, consentendo la fissazione delle cellule per analisi successive, questo protocollo riduce significativamente il tempo e lo sforzo necessari per le valutazioni immunitarie, rendendolo uno strumento prezioso sia per la ricerca che per le applicazioni pratiche in vari campi di ricerca.
Introduzione
L'immunità svolge un ruolo centrale nella regolazione fisiologica degli organismi, agendo come difesa primaria contro un'ampia gamma di agenti patogeni e fattori di stress ambientale1. Come altri vertebrati, i pesci hanno un sistema immunitario complesso, dinamico e coordinato, essenziale per la loro salutee il loro benessere generale.
I pesci teleostei possiedono un sistema immunitario sia innato che adattativo, che funziona contemporaneamente per rilevare, rispondere e neutralizzare gli invasori dannosi2. Il sistema immunitario innato agisce come prima linea di difesa, fornendo risposte immediate e non specifiche ai patogeni2, mentre il sistema immunitario adattativo si sviluppa nel tempo, offrendo una risposta più specializzata che consente ai pesci di riconoscere patogeni specifici e stabilire la memoria immunologica3. Il sistema immunitario dei pesci si basa su organi linfoidi primari specializzati (ad esempio, timo e rene della testa) e organi linfoidi secondari (ad esempio, milza e tessuti linfoidi associati alla mucosa (MALT)) per supportare la difesa immunitaria e mantenere la salute generale4. Il rene della testa è l'organo ematopoietico primario nei pesci teleostei e svolge un ruolo cruciale nello sviluppo e nella maturazione delle cellule immunitarie, compresi i leucociti5.
Negli ultimi anni sono stati compiuti progressi significativi nello studio delle risposte immunitarie di diverse specie ittiche2. Un'area chiave di interesse è stata la comprensione delle popolazioni di leucociti e della loro attività. I leucociti, noti anche come globuli bianchi, sono generalmente classificati in monociti, linfociti e granulociti e svolgono un ruolo cruciale nella difesa immunitaria dei pesci. Hanno cellule fagocitarie, che sono responsabili dell'inghiottimento e della distruzione degli agenti patogeni e rilasciano specie battericide reattive dell'ossigeno, contribuendo all'eliminazione dei microrganismi invasori6. I leucociti sono anche coinvolti nel processo infiammatorio, aiutando a isolare e sradicare le infezioni e promuovendo la riparazione dei tessuti6. L'abbondanza e l'attività delle popolazioni leucocitarie sono indicatori importanti dello stato immunitario nella salute e nella malattia degli animali 7,8.
Alcuni studi hanno dimostrato che i fattori di stress, come le condizioni ambientali avverse, possono alterare il numero e la morfologia degli eritrociti e la composizione dei leucociti circolanti 9,10. Ad esempio, come esaminato da Franke et al. (2024), è fondamentale studiare il sistema immunitario dei pesci negli scenari di cambiamento climatico, poiché i fattori di stress ambientale possono compromettere l'immunità dei pesci, aumentare la suscettibilità alle malattie e migliorare l'infettività di alcuni agenti patogeni, accelerando in ultima analisi la progressione della malattia11. Inoltre, comprendere l'immunità dei pesci è essenziale non solo per far progredire la ricerca biologica fondamentale, ma anche per sostenere vari settori della società, come l'industria dell'acquacoltura. Con la continua espansione dell'acquacoltura a livello globale, garantire la salute e il benessere delle specie ittiche d'allevamento sta diventando sempre più importante. Tuttavia, il benessere dei pesci rimane un'area di ricerca relativamente nuova e le risposte immunitarie dei pesci d'allevamento richiedono ancora valutazioni approfondite e standardizzate. Dare priorità agli studi sulla risposta immunitaria è della massima importanza, poiché le informazioni acquisite possono migliorare la sostenibilità e la produttività dell'acquacoltura attraverso approcci efficaci e su misura che migliorano il benessere e la resilienza degli animali allevati.
La quantificazione e l'identificazione dei leucociti vengono solitamente eseguite utilizzando metodi ematologici, come il conteggio manuale con emocitometri Bürker, Neubauer o Thoma, nonché strisci di sangue colorati 7,10. Per aiutare nella visualizzazione e nella differenziazione delle cellule del sangue, vengonospesso utilizzati kit di colorazione, come Wright, May-Grünwald-Giemsa e Hemacolor. Tuttavia, queste tecniche di conteggio manuale delle cellule sono noiose, dispendiose in termini di tempo e soggette a errori umani 8,10. Le fonti di errore più comuni includono una miscelazione o una diluizione inadeguata del sangue, problemi di colorazione e un caricamento errato della camera dell'emocitometro, che possono portare a una conta cellulare imprecisa12. Inoltre, l'analisi ematologica manuale richiede un alto livello di competenza ed esperienza per garantire l'affidabilità e la riproducibilità dei risultati7. Con l'aumento della domanda di strumenti diagnostici precisi ed efficienti, lo sviluppo di metodi innovativi che forniscano una comprensione approfondita dello stato immunitario delle popolazioni ittiche diventa un passo sempre più importante per far progredire questo campo.
La citometria a flusso è emersa come uno strumento potente in questo contesto, offrendo un approccio quantitativo ad alto rendimento per analizzare le popolazioni di leucociti e la vitalità cellulare8. Questa moderna tecnologia diagnostica consente di rilevare, contare e caratterizzare rapidamente le singole cellule in popolazioni miste con notevole precisione13. Inoltre, la citometria a flusso consente misure multiparametriche simultanee sia per la caratterizzazione fenotipica che funzionale. Sebbene ampiamente utilizzato in contesti clinici umani e in medicina veterinaria, la sua applicazione nello studio dei leucociti dei pesci rimane molto limitata8. Sebbene siano state condotte alcune ricerche su diverse specie ittiche 1,6,8,13,14,15,16,17, devono ancora essere affrontate diverse sfide critiche. Una delle principali sfide in queste analisi è la necessità di ottenere sospensioni di leucociti vivi estratti dal sangue periferico o da tessuti linfoidi, come il rene della testa1. L'isolamento dei leucociti è spesso difficile a causa di una caratteristica unica dei pesci teleostei: la presenza di eritrociti nucleati. La contaminazione involontaria con eritrociti può interferire con l'analisi dei leucociti a causa delle loro dimensioni, della forma ovoidale e della presenza di un nucleo1. È quindi imperativo eliminare gli eritrociti dalle sospensioni leucocitarie per ottenere un'elevata purezza leucocitaria e studiare le caratteristiche fenotipiche e funzionali dei leucociti mediante analisi di citometria a flusso. Nei mammiferi, l'isolamento dei leucociti comporta tipicamente la lisi osmotica degli eritrociti o la separazione in gradiente di densità con Ficoll o Percoll1. Tuttavia, la lisi osmotica è inefficace sia per i pesci marini che per quelli d'acqua dolce a causa dei loro eritrociti nucleati, che non possono esserelisati correttamente. Invece, la separazione in gradiente di densità è preferita per i pesci in quanto preserva efficacemente la stabilità cellulare nel tempo1. Sebbene alcuni studi abbiano isolato con successo i leucociti dai pesci giovani, molte ricerche si concentrano ancora principalmente sulle popolazioni adulte17. Tuttavia, le prime fasi della vita non sono solo più vulnerabili alle epidemie, ma anche di dimensioni ridotte, rendendo il processo di campionamento più complesso e impegnativo. Un'altra limitazione è che i metodi attuali sono spesso limitati a un numero limitato di campioni o repliche alla volta, poiché la valutazione della vitalità dei leucociti richiede un'elaborazione immediata. I ritardi nell'elaborazione dei campioni possono influire negativamente sulla vitalità cellulare, introducendo così ulteriori complicazioni nel processo di campionamento e potenzialmente mettendo a rischio l'intero lavoro.
Per quanto ne sappiamo, nessuno dei metodi pubblicati ha fissato con successo le cellule leucocitarie per la successiva analisi della vitalità mediante citometria a flusso. Il presente studio è pionieristico, in quanto stabilisce un metodo efficiente per isolare i leucociti dal rene della testa del giovane orata (Sparus aurata), la principale specie ittica allevata nei paesi dell'Europa meridionale, utilizzando una metodologia di separazione in gradiente di densità Percoll. Presentiamo anche una tecnica migliorata basata sulla colorazione che discrimina le cellule vive da quelle morte identificando le principali popolazioni di leucociti (linfociti, monociti e granulociti) attraverso la citometria a flusso. Il protocollo migliorato prevede la fissazione cellulare, che consente un'analisi cellulare vitale fino a 1 mese dopo la procedura. L'implementazione di questo protocollo di citometria a flusso ha il potenziale per ridurre significativamente il tempo e lo sforzo tipicamente necessari per le valutazioni immunitarie, rendendola una tecnica preziosa sia per la ricerca che per applicazioni più pratiche nel settore dell'acquacoltura. L'applicazione di questa metodologia offre vantaggi per l'analisi di un gran numero di campioni, la conservazione delle cellule e la possibilità di ritardare l'analisi mediante citometria a flusso. Pertanto, potrebbe essere molto utile produrre preziose informazioni sui meccanismi immunitari dei pesci e su come la vitalità cellulare sia influenzata da diverse condizioni ambientali o sperimentali. Inoltre, questo test di vitalità può essere integrato con la caratterizzazione fenotipica e funzionale multiparametrica di specifiche popolazioni di cellule immunitarie. Questo approccio consente un'analisi più completa di diversi parametri immunologici, collegandoli direttamente ai tipi di cellule corrispondenti e fornendo una comprensione più chiara delle risposte immunitarie. Questi risultati potrebbero contribuire allo sviluppo di strategie più efficaci, compresi approcci migliori per la gestione delle malattie in acquacoltura.
Protocollo
Questo protocollo deve essere eseguito da ricercatori certificati in sperimentazione animale (funzioni UE A e B). Tutte le procedure relative alla manipolazione degli animali e alla raccolta dei campioni devono essere conformi alle linee guida ARRIVE (Animal Research: Reporting of in vivo Experiments) e aderire a standard etici per la cura e l'uso degli animali in conformità con le raccomandazioni della Federation of European Laboratory Animal Science Associations (FELASA). Il presente studio ha seguito tutti questi standard, nonché la legislazione portoghese per la scienza degli animali da laboratorio (Direttiva UE 2010/63; D.L. n. 113/2013). La ricerca è stata approvata dall'Ente per il benessere e l'etica degli animali dell'IPMA (ORBEA, LABVIVOS-002-AquaClimAdapt), supervisionato dall'Autorità nazionale per l'uso di animali vivi, nota come Direzione generale per l'alimentazione e la veterinaria (DGAV), con il numero di autorizzazione etica 20596/25-S.
1. Studio del modello e mantenimento degli organismi
NOTA: Questo studio è stato specificamente progettato per il novellame di orata (Sparus aurata), con un peso medio di 30,0 ± 5,0 g e una lunghezza totale di 12,0 ± 2,0 cm. Questo metodo potrebbe non essere direttamente applicabile ad altre specie ittiche, poiché specie diverse hanno caratteristiche fisiologiche e immunologiche uniche che possono influenzare l'isolamento dei leucociti, la fissazione cellulare e la valutazione della vitalità. Potrebbero essere necessari adattamenti al protocollo per altre specie e si raccomandano studi preliminari per ottimizzare le condizioni per ciascuna specie bersaglio.
- Acclimatare i pesci (Periodo di Quarantena)
- Distribuire i pesci in modo uniforme in vasche di grande capacità (ad esempio, due vasche con una capacità totale di 660 L ciascuna - vedere la Figura 1 supplementare).
NOTA: Le vasche da utilizzare possono far parte di un sistema di acquacoltura a ricircolo (RAS), che consente un uso efficiente dell'acqua e un migliore controllo sulla qualità dell'acqua. In un RAS, l'acqua viene continuamente riciclata e trattata all'interno del sistema, fornendo un ambiente stabile e controllato per i pesci. Questa configurazione aiuta a mantenere le condizioni ottimali per la salute e la crescita dei pesci, garantendo una distribuzione uniforme e riducendo al minimo lo stress durante lo studio. - Mantenere condizioni abiotiche ottimali.
- Tenere i pesci in quarantena per 3 settimane in condizioni che imitano il loro habitat naturale:
temperatura: 20,0 ± 0,5 °C;
ossigeno disciolto: 7,2 ± 0,2 mg/L;
salinità: 35,0 ± 0,5 ‰;
pH: 8,0 ± 0,1 unità;
Fotoperiodo: 14 ore di luce/10 ore di buio.
NOTA: Le condizioni ideali di manutenzione possono variare tra le diverse specie ittiche. Altre specie possono avere esigenze diverse, quindi è importante adattare queste condizioni alle esigenze specifiche delle specie bersaglio per garantire la salute e il benessere degli organismi. Inoltre, la temperatura dell'acqua di mare e il fotoperiodo possono cambiare con le stagioni, quindi le variazioni stagionali dovrebbero essere prese in considerazione quando si replicano le condizioni naturali in laboratorio.
- Tenere i pesci in quarantena per 3 settimane in condizioni che imitano il loro habitat naturale:
- Distribuire i pesci in modo uniforme in vasche di grande capacità (ad esempio, due vasche con una capacità totale di 660 L ciascuna - vedere la Figura 1 supplementare).
- Avviare lo studio sperimentale.
- Definisci il numero di vasche e pesci necessari in base al progetto di configurazione sperimentale di ciascun caso di studio.
- Dopo il periodo di quarantena, trasferire il pesce in RAS indipendente (cfr. figura supplementare 2).
- Dotare ogni sistema di schiumatoi di proteine per rimuovere i composti organici in eccesso dall'acqua; filtrazione fisica (sacco filtrante [400 μm], spugna filtrante e lana di vetro); filtrazione biologica (bio ball [1,5"], sterilizzatore d'acqua a raggi ultravioletti e pietre porose sommerse); sistemi automatici di refrigerazione dell'acqua di mare e riscaldatori digitali sommersi, entrambi collegati ad un sistema di controllo computerizzato (ProfiLux) con sensori di temperatura per regolare la temperatura in ogni vasca; pietre porose sommerse in ogni serbatoio per controllare l'ossigeno disciolto.
- Acclimatare i pesci per 2 settimane nei nuovi sistemi prima di procedere con l'esperimento.
- Eseguire la manutenzione quotidiana
- Rimuovere le feci di pesce da ogni vasca di incubazione ed eseguire un rinnovo dell'acqua di mare del 25%.
- Misura la temperatura utilizzando un termometro di precisione portatile.
- Monitora altri parametri abiotici dell'acqua di mare (salinità, ossigeno disciolto e pH) utilizzando uno strumento di misura multiparametrico.
- Regolare i parametri abiotici dell'acqua di mare, se necessario, per garantire la stabilità durante l'esperimento.
NOTA: Le condizioni abiotiche nei sistemi sperimentali possono variare a seconda dei requisiti specifici di ciascun caso di studio. Ad esempio, se lo studio mira a simulare i cambiamenti stagionali o le ondate di calore marine, la temperatura e il fotoperiodo devono essere regolati di conseguenza per imitare le variazioni stagionali naturali. Allo stesso modo, se lo studio si concentra sulla simulazione di condizioni di ipossia o acidificazione degli oceani, è necessario apportare modifiche ai livelli di ossigeno e al pH dell'acqua di mare. Ciò garantisce che le condizioni sperimentali siano il più realistiche e pertinenti possibile, migliorando la validità e l'applicabilità dei risultati dello studio. - Valutare la salute e il benessere dei pesci, identificando e gestendo i segni di stress o malattia come descritto nei passaggi 1.2.4.6-1.2.4.8.
- Cerca comportamenti anormali come nuoto irregolare, perdita di appetito, letargia, aggressività o isolamento.
- Verificare la presenza di segni di malattia, tra cui lesioni, ulcere, scolorimento, pinne serrate, muco eccessivo o rapido movimento delle branchie.
- Registrare tutte le osservazioni, annotando la data e le azioni intraprese.
- Condurre test settimanali sulla qualità dell'acqua.
- Misurare i livelli di ammoniaca (NH3/NH4), nitriti (NO2-) e nitrati (NO3-) utilizzando test colorimetrici.
NOTA: Assicurarsi che tutti questi parametri siano al di sotto dei livelli rilevabili. Se i livelli superano i limiti, eseguire un ulteriore cambio dell'acqua, aumentare l'aerazione o regolare la filtrazione.
- Misurare i livelli di ammoniaca (NH3/NH4), nitriti (NO2-) e nitrati (NO3-) utilizzando test colorimetrici.
- Nutrire e monitorare l'alimentazione dei pesci.
- Fornire una dieta di alta qualità che soddisfi le esigenze nutrizionali specifiche del novellame (vedere la Tabella supplementare 1 per un esempio della composizione dettagliata della dieta).
NOTA: Assicurarsi che la dimensione dei pellet di aquafeed (2-3 mm) sia adatta ai giovani, facilitando l'ingestione e la digestione. - Regolare la quantità di mangime in modo che corrisponda al 2% del peso corporeo medio del pesce al giorno.
- Nutrire i pesci manualmente due volte al giorno: una al mattino e una al pomeriggio (impostare un orario specifico per mantenere una routine di alimentazione stabile).
- Fornire una dieta di alta qualità che soddisfi le esigenze nutrizionali specifiche del novellame (vedere la Tabella supplementare 1 per un esempio della composizione dettagliata della dieta).
2. Campionamento dei pesci, eutanasia, dissezione e raccolta del rene della testa
- Assaggia i pesci dalle vasche.
- Seleziona i pesci in modo casuale dalle vasche per evitare distorsioni di campionamento.
- Usa una rete per trasferire delicatamente il pesce in un contenitore temporaneo riempito con acqua dell'acquario.
NOTA: Ridurre al minimo il tempo di manipolazione per ridurre lo stress.
- Prepara la soluzione per l'eutanasia.
- Utilizzare un contenitore appropriato (ad es. un secchio da 3 L) adatto a contenere il pesce.
- Sciogliere la quantità appropriata di Tricaina (MS-222) nell'acqua di mare per raggiungere una concentrazione finale di 200-300 mg/L18 (ATTENZIONE: vedere la Tabella 2 supplementare e il file 1 supplementare).
- Tamponare la soluzione con bicarbonato di sodio a un pH di 7,2-7,5.
- Somministrare la soluzione per l'eutanasia.
- Mettere il pesce nella soluzione per l'eutanasia per almeno 10 minuti o fino a quando non si osserva la cessazione del movimento opercolare e la perdita dei riflessi (confermare l'eutanasia controllando l'assenza di risposta agli stimoli esterni).
- Registrare il peso corporeo (g) e la lunghezza totale (cm) del pesce.
- Eseguire la dissezione dei pesci.
NOTA: Per garantire una qualità ottimale del campione e la vitalità cellulare, il processo di dissezione deve essere completato il più rapidamente possibile, idealmente entro 5 minuti dall'eutanasia.- Assicurarsi che la temperatura del laboratorio sia mantenuta a 19 °C utilizzando l'aria condizionata per ridurre al minimo le fluttuazioni durante il campionamento e l'elaborazione.
- Sterilizzare gli strumenti di dissezione (preferibilmente strumenti metallici in autoclave quando possibile) e allestire uno spazio di lavoro pulito con etanolo al 70% (ATTENZIONE, vedere la Tabella 2 supplementare).
- Posizionare il pesce soppresso su un lato su un vassoio di dissezione sterile con la testa rivolta verso la mano non dominante.
- Usando un bisturi, fai un'attenta incisione lungo la linea mediana ventrale del pesce dallo sfiato (ano) fino alle branchie.
NOTA: Fare attenzione a non tagliare troppo in profondità per evitare di danneggiare gli organi interni. - Utilizzare con cautela le forbici da dissezione per estendere l'incisione ed esporre gli organi interni. Sollevare delicatamente i lembi della parete del corpo per fornire una visione chiara dell'anatomia interna.
- Localizzare il rene della testa: il rene della testa è posizionato appena dietro le branchie, vicino alla regione dorsale anteriore della cavità corporea, e si estende lungo il lato superiore della cavità corporea, sotto la colonna vertebrale.
NOTA: Il rene della testa è in genere di colore più scuro rispetto ai tessuti circostanti (Figura 1). - Elimina con cura tutti i tessuti circostanti, come il grasso e il tessuto connettivo, per visualizzare meglio il rene della testa.
NOTA: Questo passaggio richiede una manipolazione delicata per evitare di danneggiare il rene della testa. - Usando una pinza e forbici a punta fine, solleva con cautela il rene della testa e fai dei tagli precisi attorno ad esso per liberarlo dai tessuti circostanti.
NOTA: Maneggiare delicatamente il fazzoletto per evitare danni. In un pesce che pesa circa 30 g, il rene della testa dovrebbe pesare circa 20-30 mg. - Posizionare immediatamente l'organo asportato in un colino cellulare (rete di nylon da 100 μm) all'interno di una piastra di Petri sterile per garantire la sterilità e facilitare le successive fasi di lavorazione.
NOTA: Da questo punto in poi, tutti i passaggi devono essere eseguiti il più rapidamente possibile (entro 5 minuti) per mantenere la vitalità cellulare. Per mantenere il campione fresco, eseguire i passaggi seguenti con la capsula di Petri posta su un contenitore riempito di ghiaccio e coperto con un foglio di alluminio.

Figura 1: Posizione del rene della testa: (A) Illustrazione che raffigura la posizione tipica del rene della testa dietro le branchie e lungo la regione dorsale anteriore della cavità corporea; (B) Immagine rappresentativa del rene della testa nell'orata, sottolineando la sua colorazione più scura rispetto ai tessuti circostanti. Clicca qui per visualizzare una versione più grande di questa figura.
3. Isolamento dei leucociti renali della testa (Figura 2)
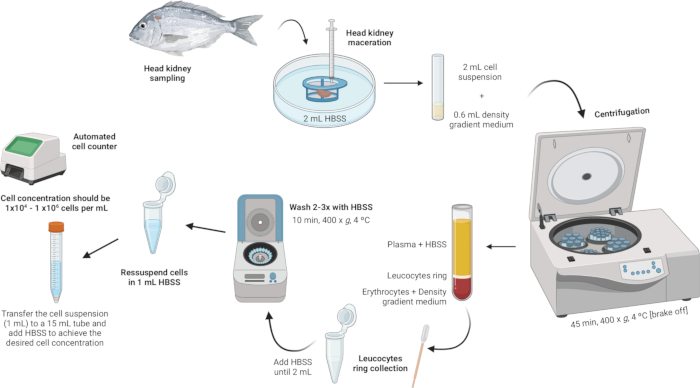
Figura 2: Descrizione illustrativa dell'isolamento dei leucociti dal rene testa. Il protocollo prevede diverse fasi: a partire dall'omogeneizzazione del tessuto, seguita dalla centrifugazione in gradiente di densità, dalla raccolta dell'anello leucocitario, dal lavaggio dell'anello leucocitario e concludendo con la risospensione e l'aggiustamento della concentrazione cellulare. Clicca qui per visualizzare una versione più grande di questa figura.
- Omogeneizzare il tessuto.
- Mettere 2 ml di soluzione salina bilanciata di Hanks (HBSS) in una capsula di Petri sterile.
- Assicurarsi che la maglia del filtro cellulare (rete di nylon da 100 μm) sia a contatto con l'HBSS ma non completamente sommersa.
- Macerare il rene di testa sul colino cellulare utilizzando lo stantuffo di una siringa. Applicare una leggera pressione per forzare i frammenti dell'organo attraverso la rete di nylon, creando una sospensione cellulare.
NOTA: Se si elaborano più campioni, la piastra di Petri contenente la sospensione cellulare può essere conservata in frigorifero a 4 °C per alcuni minuti fino al passaggio successivo. Questa sospensione cellulare verrà utilizzata per l'isolamento dei leucociti.
- Eseguire la centrifugazione in gradiente di densità.
- Preparare una soluzione di terreno a gradiente di densità con una densità di 1,077 g/mL, un'osmolarità di 353 mOsm/kg e un pH di 7,4 (vedere il file supplementare 1).
NOTA: L'osmolarità può variare tra le diverse specie ittiche, quindi è fondamentale regolare l'osmolarità della soluzione del mezzo di gradiente di densità per soddisfare le esigenze specifiche di ciascuna specie. - In provette di polistirene a fondo tondo da 5 mL, aggiungere con cautela 600 μL della soluzione del terreno a gradiente di densità.
- Prendere la sospensione cellulare (2 mL) e aggiungerla lentamente alla provetta contenente il mezzo di gradiente di densità. La prima goccia è fondamentale: aggiungerla molto delicatamente per evitare di destabilizzare la fase media del gradiente di densità.
NOTA: Questo dovrebbe essere fatto con un rapporto 3:10 (Gradiente di densità medio: Sospensione cellulare). Utilizzare una pipetta Pasteur sterile da 1 ml per un'aggiunta precisa e delicata. Assicurarsi che la punta della pipetta tocchi il lato della provetta per evitare di disturbare lo strato medio del gradiente di densità. Evitare di mescolare il campione con il mezzo del gradiente di densità. - Centrifugare le provette a 400 x g per 45 min a 4 °C con il freno disinserito. Ciò garantisce che gli strati rimangano intatti durante il processo.
NOTA: Dopo la centrifugazione, dovrebbero essere visibili strati distinti. I leucociti formeranno un anello all'interfaccia tra il mezzo del gradiente di densità e il pellet di detriti cellulari (Figura 3).
- Preparare una soluzione di terreno a gradiente di densità con una densità di 1,077 g/mL, un'osmolarità di 353 mOsm/kg e un pH di 7,4 (vedere il file supplementare 1).

Figura 3: I leucociti si riuniscono all'interfaccia tra il mezzo del gradiente di densità e il pellet di detriti cellulari. Clicca qui per visualizzare una versione più grande di questa figura.
- Raccogli l'anello dei leucociti.
- Utilizzando una pipetta sterile Pasteur, aspirare delicatamente l'anello leucocitario (~100 μL) e trasferirlo in una provetta da microcentrifuga da 2 mL.
NOTA: Fare attenzione a non disturbare gli strati in modo significativo per evitare contaminazioni. Se l'anello leucocitario sembra contenere detriti o sospensioni scure, è consigliabile far passare la sospensione leucocitaria raccolta attraverso un nuovo filtro a mini cellule (100 μm) per garantirne la purezza. Posizionare il colino per mini cellule sulla provetta da microcentrifuga da 2 ml e trasferire delicatamente la sospensione leucocitaria attraverso il colino.
- Utilizzando una pipetta sterile Pasteur, aspirare delicatamente l'anello leucocitario (~100 μL) e trasferirlo in una provetta da microcentrifuga da 2 mL.
- Lavare l'anello leucocitario.
- Aggiungere HBSS alle provette da microcentrifuga contenenti l'anello leucocitario fino a quando il volume raggiunge i 2 mL e risospendere delicatamente le cellule.
NOTA: Conservare le provette in un contenitore pieno di ghiaccio e coperto con un foglio di alluminio per mantenere il campione a bassa temperatura. Assicurarsi che i tubi non entrino in contatto diretto con il ghiaccio. Mantenere questa configurazione di raffreddamento durante tutto il processo di lavaggio. - Centrifugare i campioni a 400 × g per 10 minuti a 4 °C (il freno può essere inserito).
- Dopo la centrifugazione, scartare con cura il surnatante, lasciando il pellet sul fondo (che può essere quasi invisibile).
- Ripetere le fasi di lavaggio (aggiunta di HBSS, risospensione, centrifugazione e scarto del surnatante) fino a quando il pellet non è privo di impurità.
- Aggiungere HBSS alle provette da microcentrifuga contenenti l'anello leucocitario fino a quando il volume raggiunge i 2 mL e risospendere delicatamente le cellule.
- Risospendere e regolare la concentrazione cellulare.
- Risospendere le cellule in 1 mL di HBSS all'interno delle stesse provette da microcentrifuga da 2 mL utilizzate per i lavaggi.
- Raggiungere una concentrazione cellulare compresa tra 1 × 104 e 1 × 106 cellule per ml. Se il pellet iniziale è di grandi dimensioni, potrebbe essere necessario un ulteriore HBSS per diluire la concentrazione della cella all'intervallo desiderato. Trasferire la sospensione cellulare in una provetta da 15 mL e aggiungere altro HBSS secondo necessità in base alla conta cellulare ottenuta.
NOTA: Si consiglia l'uso di un contatore di celle automatizzato per facilitare il processo.
4. Colorazione e fissazione dei leucociti (Figura 4)
NOTA: I kit di colorazione per cellule morte fissabili LIVE/DEAD forniscono un metodo migliorato per valutare la vitalità cellulare nelle cellule fissate utilizzando la citometria a flusso. Questi saggi utilizzano un colorante reattivo fluorescente che interagisce con le ammine cellulari. Se le membrane cellulari sono compromesse, il colorante può penetrare nelle cellule, reagendo con le ammine libere sia all'interno che sulla superficie cellulare, determinando un'intensa colorazione fluorescente. Al contrario, nelle cellule vitali, solo le ammine della superficie cellulare sono disponibili per reagire con il colorante, portando a una colorazione relativamente debole. L'intensità di colorazione viene mantenuta dopo la fissazione con formaldeide, che preserva anche il campione impedendo la crescita di microrganismi. I kit di colorazione per cellule morte fissabili LIVE/DEAD sono identici tranne che per il colorante fluorescente: disponibile in blu, viola, acqua, giallo, verde, rosso, rosso lontano o vicino all'infrarosso (infrarosso). In questo studio, abbiamo utilizzato il colorante reattivo fluorescente nel vicino infrarosso. Inoltre, questo saggio a colore singolo consente di testare altri parametri in parallelo in un esperimento multicolore.
- Prepara la tintura.
- Portare i reagenti a temperatura ambiente (RT): Lasciare che una fiala del colorante reattivo fluorescente e la fiala di dimetilsolfossido anidro (DMSO) raggiungano la RT prima di rimuovere i tappi.
- Ricostituire il colorante: Aggiungere 50 μl di DMSO alla fiala contenente il colorante reattivo. Mescolare accuratamente e assicurarsi che il colorante si sia completamente sciolto.
- Utilizzare la soluzione colorante ricostituita il prima possibile, preferibilmente entro poche ore.
NOTA: Ogni kit include cinque fiale individuali di colorante reattivo, che forniscono materiale sufficiente per colorare almeno 40 campioni di cellule. Tuttavia, dopo la ricostituzione, la soluzione di DMSO del colorante è relativamente instabile, in particolare se esposta all'umidità. Le porzioni non utilizzate possono essere conservate fino a 2 settimane a ≤-20 °C, al riparo dalla luce e dall'umidità.
- Colora e fissa le cellule.
NOTA: I tamponi adatti per la colorazione cellulare includono la soluzione salina bilanciata di Hanks (HBSS), la soluzione salina tamponata con fosfato (PBS) e la PBS di Dulbecco (D-PBS), purché non contengano proteine estranee come l'albumina sierica bovina o il siero. Quando si utilizza un colorante ammino-reattivo, evitare i tamponi Tris e le soluzioni con azoturo di sodio o proteine estranee per la risospensione e il lavaggio cellulare. In questo studio, abbiamo utilizzato l'HBSS per la sua composizione ionica bilanciata, che aiuta a mantenere l'equilibrio osmotico e fornisce ioni essenziali e glucosio per supportare il metabolismo cellulare e la vitalità durante il processo di colorazione. L'HBSS è inoltre privo di proteine estranee, prevenendo l'interferenza con il colorante reattivo e garantendo un'accurata valutazione della vitalità.- Dopo aver contato le cellule e regolato la densità a 1 x 106 cellule per mL con HBSS, trasferire 1 mL di questa sospensione cellulare in provette da microcentrifuga da 2 mL.
- Per ogni giorno, indurre la morte cellulare in almeno un campione da utilizzare come controllo per impostare la soglia di intensità della fluorescenza tra cellule vive e morte. Preparare i campioni in provette per microcentrifuga come segue:
Provetta 1: Cellule vive - non colorate
Provetta 2: Cellule vive - colorate
Provetta 3: Cellule morte - non colorate
Provetta 4: Cellule morte - colorate
NOTA: Queste quattro provette devono essere preparate solo per un singolo campione in ogni esperimento come controlli. Per i campioni rimanenti, sono necessarie solo due provette (Tubo 1: campione - non colorato e Tubo 2: campione - colorato), in quanto fornirà informazioni sulle cellule che erano vive e quelle che erano morte.
- Per ogni giorno, indurre la morte cellulare in almeno un campione da utilizzare come controllo per impostare la soglia di intensità della fluorescenza tra cellule vive e morte. Preparare i campioni in provette per microcentrifuga come segue:
- Controllo positivo per la morte cellulare: Porre la provetta etichettata Dead unstained (Tube 3) e Dead-stained (Tube 4) in un bagno d'acqua a 50 °C per 7 minuti per indurre la morte cellulare mediante trattamento termico.
- Colorazione delle cellule: Aggiungere 1 μl di colorante reattivo fluorescente ricostituito (dal passaggio 4.1.2) a 1 mL di sospensione cellulare nelle provette 2 e 4 (provette che verranno colorate) e mescolare bene.
- Incubare a RT per 30 minuti, al riparo dalla luce.
NOTA: Se il fissaggio non è richiesto, è possibile saltare i passaggi 4.2.5-4.2.7 di seguito. Invece, lavare le cellule due volte con 1 mL di HBSS con albumina sierica bovina all'1% (vedere File supplementare 1) e risospendere in 1 mL di HBSS con albumina sierica bovina all'1%. Eseguire l'analisi sul citometro a flusso il più rapidamente possibile; In caso contrario, la vitalità cellulare potrebbe essere compromessa poiché le cellule non sono fissate. - Lavare le cellule due volte con 1 mL di HBSS e risospendere le cellule in 900 μL di HBSS.
- Aggiungere 100 μl di formaldeide al 37% (ATTENZIONE, vedere la Tabella supplementare 2).
- Incubare per 15 minuti a RT.
- Lavare due volte con 1 mL di HBSS con albumina sierica bovina (BSA) all'1%, quindi risospendere le cellule in 1 mL di HBSS con BSA all'1%.
- Conservare i campioni in frigorifero a 4 °C. Analizzare le cellule entro 1 mese dalla fissazione.
- Analizzare la sospensione cellulare fissa mediante citometria a flusso utilizzando il canale di eccitazione e rilevamento appropriato.
NOTA: I canali di eccitazione e rilevamento corretti possono variare in base allo strumento utilizzato (vedere la Tabella supplementare 3).
- Dopo aver contato le cellule e regolato la densità a 1 x 106 cellule per mL con HBSS, trasferire 1 mL di questa sospensione cellulare in provette da microcentrifuga da 2 mL.

Figura 4: Descrizione illustrativa della colorazione e della fissazione dei leucociti. Clicca qui per visualizzare una versione più grande di questa figura.
5. Citometria a flusso
- Acquisisci dati.
NOTA: Le procedure da seguire sul citometro a flusso possono variare a seconda del citometro specifico utilizzato. In questo studio, i dati sono stati acquisiti utilizzando il citometro a flusso Attune NTx.- Eseguire gli esempi.
- Posizionare il tubo del campione nella porta del campione.
- Iniziare l'acquisizione premendo start e quindi fare clic su registra una volta che il tasso di eventi (eventi/secondo) si stabilizza.
- Registra un minimo di 10.000 eventi per ogni campione nel cancello singoletto per un'analisi affidabile.
- Salva tutti i dati per ogni campione ed esegui il backup su unità esterne o cloud storage.
- Analizza i dati.
NOTA: Per l'analisi della citometria a flusso, sono disponibili diverse opzioni software. In questo studio, l'analisi dei dati è stata eseguita utilizzando FlowJo v10.8.119.- Carica i file di dati: avvia il software di analisi della citometria a flusso e carica i file .fcs acquisiti dall'esperimento.
- Visualizzare i dati (Figura 5A): Tracciare la dispersione diretta (FSC-A) (XX) rispetto alla dispersione laterale (SSC-A) (YY) per valutare le dimensioni e la granularità delle celle.
NOTA: Questo grafico è comunemente usato per identificare le popolazioni cellulari ed escludere i detriti in base alle loro proprietà di dispersione. - Gating delle celle singoletto ed esclusione dei multipletti (Figura 5B): utilizzare il grafico dell'area di dispersione diretta (FSC-A) rispetto all'altezza di dispersione diretta (FSC-H) per escludere i multipletti. Disegna un gate per includere tutti gli eventi allineati nel grafico (celle singole) ed escludere quelli non allineati (multipletti). Se il campione presenta eventi con FSC molto basso, escluderli non includendoli sul gate della singola cella, rimanendo solo cellule singoletto.
- Identificazione delle popolazioni leucocitarie (Figura 5C): Distinguere le 3 popolazioni leucocitarie in base al profilo FSC-A/SSC-A: FSC-Aalto/SSC-Aalto sono i granulociti, FSC-Amedio/SSC-Amedio sono i monociti e FSC-Abasso/SSC-Abasso sono i linfociti.
- Viability gating (Figura 5D): Impostare la soglia per la colorazione del colorante di vitalità sul canale di fluorescenza corrispondente (NIR, RL3-A). Le cellule vive rispetto a quelle morte sono definite in base all'intensità di colorazione con LIVE/DEAD Fixable Dead Cell Stain: le cellule colorate in dim sono definite come cellule vive e le cellule fortemente colorate sono definite come cellule morte.
- Statistiche sulla popolazione: guarda le statistiche fornite dal software, inclusi gli eventi totali (celle) in ogni porta e le percentuali delle celle totali e gated.
- Esporta dati: esporta i dati in un foglio di calcolo e utilizza un software statistico appropriato (GraphPad Prism o R) per ulteriori analisi statistiche.
NOTA: La scelta dei metodi di analisi dipenderà dagli obiettivi della ricerca.

Figura 5: Strategia di gating della citometria a flusso per la valutazione della vitalità nelle cellule renali della testa: (A) Rappresenta il profilo FSC-A/SSC-A di tutti gli eventi raccolti. (B) Rappresenta l'esclusione dei multipletti in base alla definizione della regione dei singoletti in base alla linearità sul grafico Forward Scatter (FSC-A)/Forward Scatter (FSC-H). (C) Rappresenta le 3 principali popolazioni che sono state definite in base a FSC-A/SSC-A, dopo l'esclusione dei multipletti. (D) Rappresenta un istogramma che mostra la colorazione del colorante di vitalità viva/morta. Per impostare la soglia che permette di distinguere le cellule vive da quelle morte, i leucociti sono stati sottoposti a lieve shock termico (50 °C, 7 min) e poi colorati con colorante vitale. Le cellule positive ad alta intensità di colorazione (++) sono le cellule morte, mentre le cellule positive a bassa colorazione (+-) sono le cellule vive. Clicca qui per visualizzare una versione più grande di questa figura.
Risultati
La Figura 6 presenta dati rappresentativi di citometria a flusso che mostrano le popolazioni leucocitarie isolate dal rene della testa di orata giovane (Sparus aurata) e la loro vitalità cellulare utilizzando il protocollo descritto in questo studio. La figura mette a confronto due campioni: uno con alta vitalità cellulare, in cui i pesci sono stati esposti a condizioni ottimali (Figura 6A), e un altro con bassa vitalità cellulare, in cui le cellule sono state esposte a stress termico (Figura 6B).
In entrambi i campioni, il presente metodo ha identificato efficacemente tre principali popolazioni leucocitarie: linfociti (LY), monociti (MO) e granulociti (GR). Queste popolazioni sono state distinte in base alle differenze nelle dimensioni e nella complessità delle cellule, come indicato dai grafici di dispersione diretta (FSC-A) e di dispersione laterale (SSC-A). La dispersione diretta (FSC-A) indica la dimensione relativa delle cellule, mentre la dispersione laterale (SSC-A) riflette la complessità interna o la granularità delle cellule, consentendo una chiara separazione delle popolazioni. In condizioni ottimali (Figura 6A), le popolazioni leucocitarie sono state distribuite come segue: LY al 31,0%, MO al 38,0% e GR al 31,0%. Tuttavia, nel campione esposto a stress termico (Figura 6B), è stato osservato un cambiamento nella distribuzione di queste popolazioni, con LY in calo al 21,3%, MO in aumento al 45,6% e GR che rimane relativamente stabile al 33,1%.
Un'ulteriore analisi della vitalità cellulare, dettagliata nella Figura 6A1-A3 e nella Figura 6B1-B3, rivela un contrasto significativo tra i due campioni. Come si può osservare, il campione esposto a condizioni ottimali (Figura 6A) ha mostrato una maggiore vitalità, con una predominanza di cellule vive (rappresentate in blu) in tutte le popolazioni leucocitarie. Al contrario, il campione termicamente stressato (Figura 6B) ha mostrato un aumento significativo della morte cellulare (colorazione più intensa mostrata in rosso), con LY che ha mostrato una morte cellulare del 50,7%, MO 83,7% e GR 84,5%.
Nel complesso, i risultati dimostrano chiaramente l'efficacia del protocollo sia nell'isolamento che nell'analisi delle popolazioni leucocitarie e nella valutazione della vitalità cellulare. Inoltre, i dati forniscono preziose informazioni su come le condizioni di stress, come l'esposizione termica, influenzino le dinamiche della popolazione leucocitaria e la vitalità cellulare. I cambiamenti osservati nella distribuzione cellulare e nella vitalità sotto stress suggeriscono che l'esposizione termica non solo interrompe l'equilibrio delle popolazioni leucocitarie, ma compromette anche la salute delle cellule. Questi cambiamenti possono indicare una risposta immunitaria allo stress, indicando un meccanismo di difesa attivo innescato da fattori di stress ambientale.

Figura 6: Grafici rappresentativi di citometria a flusso che illustrano l'identificazione e la vitalità di diverse popolazioni leucocitarie dal rene capo dell'orata (Sparus aurata): (A) Campione con elevata vitalità cellulare, esposto a condizioni ottimali: il pannello di sinistra mostra il gating delle popolazioni leucocitarie in base a FSC-A/SSC-A, identificando linfociti (LY), monociti (MO) e granulociti (GR); Vitalità di LY (A.1), MO (A.2) e GR (A.3). (B) Campione con bassa vitalità cellulare, sottoposto a stress termico: il pannello di sinistra mostra il gating delle popolazioni leucocitarie in base a FSC-A/SSC-A, identificando linfociti (LY), monociti (MO) e granulociti (GR); Vitalità di LY (B.1), MO (B.2) e GR (B.3). Clicca qui per visualizzare una versione più grande di questa figura.
Figura supplementare 1: Immagine rappresentativa di una vasca di quarantena con una capacità totale di 660 L. Clicca qui per scaricare questa figura.
Figura 2 supplementare: Immagine di una configurazione del sistema RAS. (1) Profilux; (2) Apparecchi di illuminazione; (3) Acquari/Serbatoi; (4) Frigorifero; (5) Rubinetti di ingresso dell'acqua negli acquari; (6) Sifone blu per uscite acqua acquario; (7) Pozzetto; (8) Schiumatoio di proteine; (9) Filtro meccanico (sacco filtrante); (10) Filtro meccanico (spugna blu + lana di vetro); (11) Filtro biologico (bioballs); (12) Termostato; (13) Pompa principale; (14) sterilizzatore UV; (15) Sensore di temperatura; (A) Filtro meccanico (spugna blu); (B) Filtro meccanico (lana di vetro). Clicca qui per scaricare questa figura.
Tabella supplementare 1: Composizione degli ingredienti (%) e analisi prossima (% SS) della dieta sperimentale utilizzata nello studio. Clicca qui per scaricare questa tabella.
Tabella supplementare 2: Reagenti utilizzati nel protocollo: pericoli per la salute, indicazioni di pericolo, consigli di prudenza e misure di primo soccorso. Clicca qui per scaricare questa tabella.
Tabella supplementare 3: Canali di eccitazione e rilevamento appropriati da utilizzare con le colorazioni di cellule morte fissabili LIVE/DEAD reattive all'ammina. Clicca qui per scaricare questa tabella.
File supplementare 1: Calcoli per la preparazione delle soluzioni. Clicca qui per scaricare questo file.
Discussione
Il metodo sviluppato in questo studio rappresenta un progresso significativo nella ricerca sull'immunologia dei pesci e promette di migliorare la comprensione delle risposte immunitarie dei pesci e la sostenibilità delle risorse marine. S. aurata è una preziosa specie ittica marina della famiglia degli Sparidae che funge da organismo modello ideale per diversi motivi, tra cui la sua rilevanza ecologica ed economica, nonché la sua versatilità nella ricerca di laboratorio in diversi campi di studio come la fisiologia, l'immunologia, la tossicologia e l'acquacoltura20. Uno dei principali vantaggi di S. aurata è la sua facilità di manipolazione e allevamento in laboratorio, con protocolli di allevamento consolidati che garantiscono condizioni sperimentali coerenti e riproducibili21. Inoltre, la sua adattabilità ambientale (cioè l'elevata tolleranza a un'ampia gamma di condizioni ambientali, come le fluttuazioni di temperatura e salinità) lo rende un candidato ideale per studi volti a migliorare le tecniche di allevamento e a valutare gli impatti ambientali sugli organismi marini22. S. aurata, con il suo sistema immunitario ben caratterizzato e la disponibilità di dati genomici, consente di sbloccare le risposte immunitarie dei pesci, la resistenza ai patogeni, l'efficacia dei vaccini e la salute generale20. Data la sua importanza nell'acquacoltura e nelle abitudini alimentari delle popolazioni dell'Europa meridionale, la ricerca su questa specie può avere un impatto diretto sulle pratiche agricole, migliorandone la produzione e la sostenibilità e affrontando al contempo le sfide ambientali all'interno del settore20.
In questo senso, questo protocollo offre diversi vantaggi e potenziali applicazioni in diverse aree di ricerca, come ad esempio: (i) Immunologia dei pesci: Fornisce un'analisi precisa e dettagliata delle cellule immunitarie del rene della testa di S. aurata, consentendo l'identificazione e la caratterizzazione di diverse popolazioni leucocitarie, nonché valutazioni robuste della loro vitalità cellulare mediante citometria a flusso; ii) ricerca in acquacoltura: essenziale per lo studio delle tecniche di allevamento, della nutrizione e della gestione delle malattie, a sostegno della ricerca futura volta a ridurre la dipendenza da antibiotici e trattamenti chimici, promuovendo in tal modo pratiche di acquacoltura più sostenibili; (iii) Ecotossicologia: Prezioso nella valutazione degli effetti indotti dagli inquinanti e da altri fattori di stress ambientale sulla salute immunitaria dei pesci, fornendo dati per la valutazione del rischio ambientale e la formulazione di regolamenti di protezione per gli ecosistemi acquatici; (iv) Fisiologia comparata: consente ai ricercatori di seguire gli adattamenti evolutivi del sistema immunitario a varie sfide ambientali, fornendo una comprensione più profonda delle basi genetiche e fisiologiche della funzione immunitaria; (v) Biologia ed ecologia marina: migliorare la comprensione dei ruoli ecologici e delle interazioni di S. aurata, fornendo informazioni sulla distribuzione delle specie, sulle preferenze degli habitat e sull'impatto dei cambiamenti ambientali sulla biodiversità marina; (vi) Ricerca biomedica: i pesci sono sempre più spesso utilizzati come organismi modello nella ricerca biomedica. L'isolamento e l'analisi delle cellule immunitarie possono aiutare a comprendere gli aspetti cellulari e molecolari critici per la scoperta di farmaci e persino per la medicina.
Per molti anni, la quantificazione e l'identificazione dei leucociti nei pesci si sono basate su tecniche ematologiche tradizionali, come il conteggio manuale con emocitometri Bürker, Neubauer o Thoma, nonché strisci di sangue colorati10,12. La vitalità cellulare è stata valutata anche utilizzando il test di esclusione del blu di tripano, seguito dal conteggio al microscopio di 15,22,23,24,25,26,27,28. Sebbene questi metodi abbiano contribuito alla nostra comprensione dell'immunologia dei pesci, presentano diverse limitazioni. La conta manuale dei leucociti richiedeva molto tempo e lavoro e l'accuratezza di queste tecniche era spesso compromessa dalla variabilità dell'operatore e dall'errore umano, influenzando in modo significativo la coerenza dei risultati10.
Nel 1994, Esteban et al. hanno rivoluzionato l'analisi dei leucociti dei pesci introducendo una tecnica per valutare il meccanismo di difesa fagocitaria nella spigola (Dicentrarchus labrax)23. Nel loro studio, i leucociti sono stati isolati dal sangue periferico, dal rene della testa e dagli essudati peritoneali utilizzando la centrifugazione a gradiente di densità Percoll23. Questo progresso metodologico ha segnato un significativo balzo in avanti, migliorando l'accuratezza e l'affidabilità dell'analisi dei leucociti. A seguito del lavoro pionieristico di Esteban et al., studi successivi hanno mirato a perfezionare e ottimizzare le tecniche di citometria a flusso per l'analisi dei leucociti, concentrandosi su vari aspetti come il profilo della popolazione cellulare 6,15,16,28,29, la vitalità cellulare 3,6,27,28 e l'attività fagocitaria 6,23. 24,27,28. I progressi nelle procedure di isolamento, tra cui l'uso di diversi terreni a gradiente (ad esempio, Ficoll vs. Percoll) e protocolli di centrifugazione ottimizzati, hanno migliorato la purezza e la resa dei leucociti isolati 1,8,14,26. Lo sviluppo di tecniche di colorazione avanzate e l'uso di coloranti fluorescenti, come lo ioduro di propidio (PI) e lo ioduro di 3,3'-diexilossacarbocianina (DiOC6(3)) hanno permesso una discriminazione più accurata tra cellule vitali e non vitali, nonché una caratterizzazione dettagliata delle popolazioni leucocitarie rispettivamente16,30. Uno dei principali vantaggi di questa tecnica è la sua capacità di distinguere simultaneamente tra diverse popolazioni di leucociti (linfociti, monociti e granulociti) e di valutare la vitalità cellulare di ciascuna popolazione. Ciò consente ai ricercatori di identificare quali popolazioni sono più colpite in condizioni specifiche, fornendo informazioni più approfondite sulla risposta immunitaria e rivelando i sottogruppi di leucociti più vulnerabili. Tuttavia, nonostante questi miglioramenti, i metodi attuali devono ancora affrontare dei limiti. La maggior parte della ricerca si è concentrata sui pesci adulti, lasciando un vuoto nello studio degli stadi giovanili. I pesci giovani presentano sfide uniche per l'estrazione dei leucociti a causa delle loro dimensioni ridotte e della difficoltà di ottenere campioni di alta qualità dai loro organi immunitari proporzionalmente più piccoli17. Lo studio qui descritto affronta specificamente questi problemi ottimizzando il protocollo per i pesci giovani, regolando il rapporto di sospensione cellulare e la soluzione di Percoll per migliorare la qualità dell'estrazione dei leucociti. Inoltre, i metodi esistenti sono spesso limitati dal numero di campioni o repliche che possono essere elaborati contemporaneamente a causa dell'immediata necessità di una valutazione della vitalità dei leucociti. Qualsiasi ritardo nella manipolazione del campione può influire negativamente sulla vitalità cellulare, complicando il processo di campionamento e compromettendo potenzialmente i risultati. Per superare questa limitazione, questo studio introduce l'uso di una nuova tecnica di colorazione che consente la fissazione e l'analisi cellulare fino a 1 mese dopo la fissazione. Questa innovazione offre una maggiore flessibilità nei programmi di campionamento, consentendo ai ricercatori di elaborare e analizzare i campioni a loro piacimento, migliorando significativamente il flusso di lavoro e l'affidabilità delle valutazioni della citometria a flusso.
Il successo di questo protocollo si basa su diversi passaggi critici, ognuno dei quali richiede un'attenta esecuzione per garantire l'integrità e la vitalità dei leucociti, che vengono successivamente analizzati mediante citometria a flusso. La corretta preparazione della soluzione per l'eutanasia e la regolazione del pH sono fondamentali per un'eutanasia efficace. Soluzioni preparate in modo improprio possono causare un'eutanasia incompleta o ulteriore stress per i pesci18. Una dissezione accurata e attenta del rene della testa è fondamentale per evitare la contaminazione. Mantenere la sterilità e l'integrità dei tessuti è fondamentale per ottenere campioni di leucociti di alta qualità. La densità, l'osmolarità e il pH della soluzione di Percoll devono essere regolati correttamente per un'efficiente separazione dei leucociti. L'aspirazione delicata dell'anello leucocitario con una pipetta sterile è fondamentale per evitare la contaminazione e il disturbo degli strati di gradiente. Un efficace lavaggio delle cellule dopo la raccolta è essenziale per rimuovere i residui di Percoll e altre impurità. La ripetizione del processo di lavaggio garantisce un pellet a celle pulite e pronto per il fissaggio. Il colorante reattivo deve essere preparato immediatamente prima dell'uso per garantirne l'efficacia, poiché una manipolazione impropria può comprometterne la stabilità. L'aggiunta corretta del colorante e il tempo di incubazione sono fondamentali per distinguere con precisione tra cellule vive e morte. Il fissaggio delle cellule con il 3,7% di formaldeide è un passaggio fondamentale per preservare la morfologia cellulare e garantire un'identificazione accurata delle cellule morte. La concentrazione di formaldeide deve essere precisa e i tempi di incubazione devono essere rigorosamente rispettati per evitare risultati imprecisi. Il lavaggio delle cellule dopo la fissazione è importante per rimuovere l'eventuale eccesso di colorante e formaldeide, che potrebbe interferire con le analisi successive. La corretta conservazione dei campioni fissati e la loro analisi tempestiva sono necessari per mantenere l'accuratezza dei dati. La regolazione dei canali di eccitazione e rilevamento in modo che corrispondano al colorante specifico utilizzato è essenziale per ottenere risultati accurati della citometria a flusso.
Nonostante i suoi numerosi vantaggi, questo metodo presenta alcune limitazioni che devono essere considerate. Una limitazione chiave è la sua natura specie-specifica, in quanto il protocollo è ottimizzato per il novellame di orata (S. aurata), un pesce marino. Ciò significa che la sua efficacia può variare se applicata ad altre specie ittiche, in particolare ai pesci d'acqua dolce. Le differenze nell'equilibrio osmotico tra le specie marine e quelle d'acqua dolce possono richiedere aggiustamenti ai tamponi utilizzati nel protocollo, poiché le soluzioni adatte alle condizioni saline potrebbero non essere appropriate per le specie d'acqua dolce. Inoltre, le differenze nella struttura dei tessuti, nella densità cellulare e nelle risposte fisiologiche possono richiedere aggiustamenti al protocollo, influenzando potenzialmente la riproducibilità e la coerenza tra le diverse specie.
Un altro fattore importante è la manutenzione del pesce prima della raccolta del campione. Ogni specie ha specifiche condizioni ottimali dell'acqua, cruciali per mantenere la salute dei pesci e garantire la qualità dei risultati sperimentali20. Le variazioni di parametri come la temperatura, la salinità e il pH possono influenzare la vitalità cellulare e la qualità dei dati, poiché condizioni non ottimali possono indurre stress fisiologico che compromette l'integrità cellulare. Per garantire risultati sperimentali coerenti, è importante mantenere tutte le repliche nelle stesse condizioni controllate, ottimali o intenzionalmente subottimali (a seconda degli obiettivi dello studio).
La variabilità nelle tecniche di manipolazione e dissezione può anche influire sulla qualità e sulla quantità dei leucociti renali della testa, rendendo la competenza e l'esperienza dell'operatore un fattore critico per il successo del protocollo. Inoltre, mantenere la vitalità cellulare durante tutto il processo di isolamento può essere una sfida, poiché eventuali ritardi tra l'eutanasia e la fissazione cellulare possono comportare una diminuzione della vitalità e risultati distorti. Il trattamento immediato di tessuti e cellule è essenziale per mantenere un'elevata vitalità cellulare, ma questo requisito può essere difficile da soddisfare in modo coerente, soprattutto quando si lavora con un numero elevato di campioni.
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse finanziari, personali o professionali che possano aver influenzato la ricerca, l'analisi, l'interpretazione dei dati, la scrittura o la decisione di inviare il manoscritto per la pubblicazione.
Riconoscimenti
Questo lavoro è stato sostenuto dalla Fundação Portuguesa para a Ciência e Tecnologia (FCT I.P.), nell'ambito del progetto Aqua-CLIMADAPT (PTDC/CTA-AMB/0592/2021, https://doi-org.remotexs.ntu.edu.sg/10.54499/PTDC/CTA-AMB/0592/2021). Ringraziamo il BioLab sostenuto dall'Unità di Bioscienze Molecolari Applicate (UCIBIO) e dall'Unità di Ricerca del Laboratorio Associato di Chimica Verde – LAQV, che sono finanziati da fondi nazionali da FCT/MCTES (UIDB/04378/2020 e UIDB/50006/2020, rispettivamente), nonché dall'Istituto di Laboratorio Associato per la Salute e la Bioeconomia – i4HB (LA/P/0140/2020). Questo lavoro è stato sostenuto anche dalla Commissione Europea attraverso il progetto GLYCOTwinning (Grant Agreement No. 101079417) e FCT attraverso InnoGlyco (2022.04607.PTDC). Isa Marmelo riconosce anche FCT I.P. per la borsa di dottorato (2020.04413.BD, https://doi-org.remotexs.ntu.edu.sg/10.54499/2020.04413.BD).
Materiali
| Name | Company | Catalog Number | Comments |
| Air Stones | N/A | N/A | |
| Aquafeed | SPAROS, Lda., Portugal | N/A | High-quality diet |
| Automatic Cell Counting Equipment | NanoEnteK, Korea | N/A | EVE automatic cell counter (NanoEnteK) |
| Automatic Water Refrigeration Systems | Foshan Weinuo Refrigeration Equipment Co., Ltd, China | N/A | |
| Bio balls 1.5" Aquarium Pond Filter | TMC Iberia, Portugal | N/A | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich, Germany | A7906 | |
| Bucket (3 L) | N/A | N/A | To prepare and carry out euthanasia |
| Buckets (5 L) | N/A | N/A | To transport the animals |
| Cell Strainers | Jetbiofil, China | CSS-013-100 | Cell Strainer, 100 μm nylon mesh, Sterile, Yellow |
| Centrifugue | Fisher Scientific, Germany | N/A | accuSpin Micro 17 R |
| Colorimetric Test Kit for Ammonia (NH4+/NH3) | Tropic Marin, USA | N/A | |
| Colorimetric Test Kit for Nitrate (NO3-) | Tropic Marin, USA | N/A | |
| Colorimetric Test Kit for Nitrite (NO2-) | Tropic Marin, USA | N/A | |
| Computer | N/A | N/A | To acquire and analyse the data obtained from the flow cytometer |
| Computerized Control System (Profilux) | GHL, Germany | N/A | ProfiLux 3 Outdoor |
| Deionized water | N/A | N/A | To clean the Flow Cytometer |
| Density Gradient Medium: Percoll | Cytiva, Sigma-Aldrich, Germany | 17-0891-01 | |
| Digital scale | KERN & Sohn GmbH, Germany | N/A | KERN EMS 300-3 |
| Ethanol 70% | Millipore, Supelco, Portugal | EX0281 | To keep the workspace clean |
| EVE Cell Counting Slides | NanoEnteK, Korea | N/A | |
| Falcon Tubes (15 mL) | pluriSelect Life Science, Germany | 05-00002-01 | Sterile |
| Filter bag | TMC Iberia, Portugal | N/A | 400 micron |
| Filter Sponge | N/A | N/A | |
| Flow Cytometer | ThermoFisher Scientific, USA | N/A | Attune flow cytometer |
| FlowJo v10.8.1 Software | BD Life Sciences | N/A | |
| Formaldehyde 37% | Sigma-Aldrich, Germany | 8.18708 | |
| Glass Wool | N/A | N/A | |
| Hanks' Balanced Salt Solution | Merck Life Science S.L, Portugal | H6648 | Modified, with sodium bicarbonate, without phenol red, calcium chloride and magnesium sulfate, liquid, sterile-filtered, suitable for cell culture |
| LIVE/DEAD Fixable Dead Cell Stain Kits | Life Technologies Europe, Netherlands | L10119 | Near-IR fluorescent reactive dye + DMSO |
| Main Water Pumps | EHEIM, Germany | Universal 1200 | |
| Microcentrifuge Tubes (2 mL) | BRAND, Merck, Germany | Z628034 | Sterile |
| Micropipette Tips | Sartorius, Germany | 790010, 790200, 791000 | Compatible with Sartorius, 1-10 µL, 2-20 µL, 20-200 µL, 100-1000 µL |
| Micropipettes | Sartorius, Germany | 728020, 728030, 728060, 728070 | Sartorius ProlinePlus 1-10 µL, 2-20 µL, 20-200 µL, 100-1000 µL |
| Mini Cell Strainers | pluriSelect Life Science Global Headoffice, Germany | 43-10100-50 | PluriStrainer 100 µm nylon mesh, Sterile |
| Multi-Parameter Measuring Instrument | WTW, Germany | Multi 3420 SET G + IDS digital conductivity cell (TetraCon 925) + Optical IDS DO sensor (FDO 925) + IDS pH-electrode (SenTix 940) | |
| Pasteur Pipettes (1 mL, 5 mL) | Humeau Expert du laboratoire, France | 248295 | Sterile |
| Petri dishes | Sarstedt, Germany | 82.1194.500 | 60 x 15 mm, Polystyrene, Sterile |
| pH Meter | Hanna Instruments Inc., Romania | HANNA HI2211 | |
| Polystyrene round-bottom Falcon tubes (5 mL) | Fisher Scientific, Germany | 14-959-2A | Sterile |
| Portable Precision Thermometer | Ebro Electronic, Germany | N/A | TFX 430 |
| Protein Skimmers | Mantis | N/A | Tornado 120 |
| Quality control beads/Performance test beads | Thermofisher Scientific, USA | N/A | |
| Quarantine Tanks | N/A | N/A | Tanks with 660 L total volume |
| Rectangular Glass Tanks/Aquariums | N/A | N/A | Tanks with 200 L total volume |
| Refrigerator | N/A | N/A | To store the samples at 4 °C |
| Ruler 30 cm | N/A | N/A | To measure the fish's length |
| Sodium bicarbonate | Honeywell Fluka, Germany | 31437 | Sodium hydrogen carbonate (NaHCO3) |
| Sodium chloride | Sigma-Aldrich, Germany | S9888 | |
| Sterile Dissection Tools | N/A | N/A | (e.g. scalpel, scissors, fine-tipped forceps, dissecting tray/board) |
| Submerged Digital Heaters | TMC Iberia, Portugal | 300 W, V2Therm Digital Heaters | |
| Syringes 1 mL | IVFSTORE, USA | 8300014579-MEA | Sterile, HSW Soft-Ject Syringes to macerate head-kidney |
| Temperature Sensors | GHL, Germany | PT 1000 | |
| Tricaine (MS-222) | ThermoFisher Scientific, Germany | 118000500 | Ethyl 3-aminobenzoate, methanesulfonic acid salt, 98% (C10H15NO5S) |
| Ultraviolet Water Sterilizer | EHEIM, Germany | 5305010 | ClearUVC-36 |
| Water Bath | Fisher Scientific, Germany | N/A | Fisherbrand IsotempTM (P/N U01318) |
| Water-resistant Luminaires | N/A | N/A |
Riferimenti
- Samaï, H.C. et al. Procedures for leukocytes isolation from lymphoid tissues and consequences on immune endpoints used to evaluate fish immune status: A case study on roach (Rutilus rutilus). Fish Shellfish Immunol. 74, 190-204 (2018).
- Mokhtar, D. M., Zaccone, G., Alesci, A., Kuciel, M., Hussein, M. T., Sayed, R. K. A. Main components of fish immunity: An overview of the fish immune system. Fishes. 8 (2), 93 (2023).
- Lulijwa, R. et al. Characterisation of Chinook salmon (Oncorhynchus tshawytscha) blood and validation of flow cytometry cell count and viability assay kit. Fish Shellfish Immunol. 88, 179-188 (2019).
- Uribe, C., Folch, H., Enriquez, R., Moran, G. Innate and adaptive immunity in teleost fish: a review. Vet Med. 56 (10), 486-503 (2011).
- Bjørgen, H., Koppang, E. O. Anatomy of teleost fish immune structures and organs. Immunogenetics. 73 (1), 53-63 (2021).
- Santos, R. A. et al. In vitro modulation of gilthead seabream (Sparus aurata L.) leukocytes by Bacillus spp. extracellular molecules upon bacterial challenge. Fish Shellfish Immunol. 121, 285-294 (2022).
- Witeska, M., Kondera, E., Ługowska, K., Bojarski, B. Hematological methods in fish - Not only for beginners. Aquaculture. 547, 737498 (2022).
- Titus, J. et al. Development and validation of a flow cytometry method to examine circulating leukocyte subpopulations in barramundi (Lates calcarifer). Comp Immunol Rep. 6, 200142 (2024).
- Marmelo, I. et al. Eco-innovative aquafeeds biofortified with Asparagopsis taxiformis to improve the resilience of farmed white seabream (Diplodus sargus) to marine heatwave events. Heliyon. 10 (15), e35135 (2024).
- Seibel, H., Baßmann, B., Rebl, A. Blood Will Tell: What Hematological Analyses Can Reveal About Fish Welfare. Front Vet Sci. 8, 616955 (2021).
- Franke, A., Beemelmanns, A., Miest, J. J. Are fish immunocompetent enough to face climate change? Biol Lett. 20 (2), 20230346 (2024).
- Fazio, F. Fish hematology analysis as an important tool of aquaculture: A review. Aquaculture. 500, 237-242 (2019).
- Fazio, F., Saoca, C., Costa, G., Zumbo, A., Piccione, G., Parrino, V. Flow cytometry and automatic blood cell analysis in striped bass Morone saxatilis (Walbaum, 1792): A new hematological approach. Aquaculture. 513, 734398 (2019).
- Lulijwa, R., Alfaro, A. C., Merien, F., Meyer, J., Young, T. Advances in salmonid fish immunology: A review of methods and techniques for lymphoid tissue and peripheral blood leucocyte isolation and application. Fish Shellfish Immunol. 95, 44-80 (2019).
- Esteban, M. Á., Muñoz, J., Meseguer, J. Blood cells of sea bass (Dicentrarchus labrax l.). Flow cytometric and microscopic studies. Anat Rec. 258 (1), 80-89 (2000).
- Inoue, T., Moritomo, T., Tamura, Y., Mamiya, S., Fujino, H., Nakanishi, T. A new method for fish leucocyte counting and partial differentiation by flow cytometry. Fish Shellfish Immunol. 13 (5), 379-390 (2002).
- Ye, R. R. et al. Immune competence assessment in marine medaka (Orzyias melastigma)-a holistic approach for immunotoxicology. Environ Sci Pollut Res. 24 (36), 27687-27701 (2017).
- American Veterinary Medical Association. AVMA Guidelines for the Euthanasia of Animals: 2020 Edition. American Veterinary Medical Association, Schaumburg, IL (2020).
- FlowJoTM Software (for Windows). Version v10.8.1 (BD Life Sciences). At < https://www.bdbiosciences.com/en-us/products/software/flowjo-v10-software> (2023).
- Mhalhel, K. et al. Review on Gilthead Seabream (Sparus aurata) aquaculture: Life cycle, growth, aquaculture practices and challenges. J Mar Sci Eng. 11 (10), 2008 (2023).
- Toni, M., Manciocco, A., Angiulli, E., Alleva, E., Cioni, C., Malavasi, S. Review: Assessing fish welfare in research and aquaculture, with a focus on European directives. Animal. 13 (1), 161-170 (2018).
- Kır, M. Thermal tolerance and standard metabolic rate of juvenile gilthead seabream (Sparus aurata) acclimated to four temperatures. J Therm Biol. 93, 102739 (2020).
- Esteban, M. Á, Meseguer, J. Phagocytic defence mechanism in sea bass (Dicentrarchus labrax L.): An ultrastructural study. Anat Rec. 240 (4), 589-597 (1994).
- Esteban, M. Á., Mulero, V., Muñoz, J., Meseguer, J. Methodological aspects of assessing phagocytosis of Vibrio anguillarum by leucocytes of gilthead seabream (Sparus aurata L.) by flow cytometry and electron microscopy. Cell Tissue Res. 293 (1), 133-141 (1998).
- Rodríguez, A., Esteban, M. Á., Meseguer, J. Phagocytosis and peroxidase release by seabream (Sparus aurata L.) leucocytes in response to yeast cells. Anat Rec A Discov Mol Cell Evol Biol. 272 (1), 415-423 (2002).
- Hamoutene, D., Payne, J. F., Volkoff, H. Effects of tebufenozide on some aspects of lake trout (Salvelinus namaycush) immune response. Ecotoxicol Environ Saf. 69 (2), 173-179 (2007).
- Pierrard, M.-A., Roland, K., Kestemont, P., Dieu, M., Raes, M., Silvestre, F. Fish peripheral blood mononuclear cells preparation for future monitoring applications. Anal Biochem. 426 (2), 153-165 (2012).
- Guardiola, F. A., Logothetis, P., Meseguer, J., Esteban, M. Á. Evaluation of silver nanospheres on viability and innate cellular parameters of gilthead seabream (Sparus aurata L.) head-kidney leucocytes. Fish Shellfish Immunol. 69, 99-107 (2017).
- Campos-Sánchez, J. C., Guardiola, F. A., Esteban, M. Á. In vitro effects of cantharidin on gilthead seabream (Sparus aurata) head-kidney leucocytes. Fish Shellfish Immunol. 123, 20-35 (2022).
- Korytář, T., Dang Thi, H., Takizawa, F., Köllner, B. A multicolour flow cytometry identifying defined leukocyte subsets of rainbow trout (Oncorhynchus mykiss). Fish Shellfish Immunol. 35 (6), 2017-2019 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon