Method Article
체외 분석, 풀다운 및 샤프롱 분석을 사용한 히스톤 샤페론의 특성 분석
* 이 저자들은 동등하게 기여했습니다
요약
이 프로토콜은 히스톤 샤페론 올리고머화 및 안정성을 연구하기 위한 분석 크기 배제 크로마토그래피, 히스톤 샤페론-히스톤 상호작용을 밝히기 위한 풀다운 분석, 단백질 복합체의 화학량론을 분석하기 위한 AUC, 추정 히스톤 샤페론을 시험 관 내에서 기능적으로 특성화하기 위한 히스톤 샤페로닝 분석을 포함하는 일련의 방법을 설명합니다.
초록
히스톤 단백질은 DNA와 결합하여 진핵 염색질을 형성합니다. 염색질의 기본 단위는 DNA로 둘러싸인 핵심 히스톤 H2A, H2B, H3 및 H4의 두 사본으로 구성된 히스톤 옥타머로 구성된 뉴 클레오 솜입니다. 옥타머는 H2A/H2B 이량체의 두 사본과 H3/H4 사량체의 단일 사본으로 구성됩니다. 고도로 충전 된 코어 히스톤은 세포질 및 핵의 여러 단백질과 비특이적 상호 작용을하는 경향이 있습니다. 히스톤 샤페론은 다양한 종류의 단백질을 형성하여 히스톤을 세포질에서 핵으로 셔틀하고 DNA로의 침착을 도와 뉴 클레오 솜 조립 과정을 돕습니다. 일부 히스톤 샤페론은 H2A/H2B 또는 H3/H4에 특이적이며 일부는 둘 다에 대한 샤페론으로 기능합니다. 이 프로토콜은 풀다운 분석, 분석 크기 배제 크로마토그래피, 분석 초원심분리 및 히스톤 샤프롱 분석과 같은 시험관 내 실험실 기술을 함께 사용하여 주어진 단백질이 히스톤 샤페론으로 기능하는지 여부를 확인하는 방법을 설명합니다.
서문
DNA와 히스톤 단백질로 구성된 뉴 클레오 솜은 염색질의 구조 단위를 형성하고 몇 가지 중요한 세포 사건을 조절합니다. 뉴클레오솜은 복제, 전사 및 번역 1,2와 같은 다양한 프로세스에 DNA에 접근할 수 있도록 동적으로 재배치되고 리모델링됩니다. 매우 염기성인 히스톤은 세포 환경에서 산성 단백질과 상호 작용하거나 응집되는 경향이 있어 다양한세포 결함을 유발합니다3,4,5. 히스톤 샤페론이라고 하는 전용 단백질 그룹은 세포질에서 핵으로의 히스톤 수송을 돕고 비정상적인 히스톤-DNA응집 사건을 방지합니다6,7. 근본적으로, 대부분의 히스톤 샤페론은 생리적 이온 강도로 히스톤을 저장하고 DNA에 전달하여 뉴 클레오 솜 8,9의 형성을 돕습니다. 일부 히스톤 샤페론은 히스톤 올리고머 H2A/H2B 또는 H3/H410에 대해 확실한 선호도를 갖는다.
히스톤 샤페론은 DNA 합성11에 의존적이거나 독립적 인 뉴 클레오 솜을 조립하는 능력에 따라 특징 지어집니다. 예를 들어, 염색질 조립 인자 -1 (CAF-1)은 의존적 인 반면 히스톤 조절자 A (HIRA)는 DNA 합성12,13과 독립적입니다. 유사하게, 히스톤 샤페론의 뉴 클레오 플라스 민 패밀리는 정자 염색질 축합 및 뉴 클레오 솜 어셈블리14에 관여합니다. 뉴 클레오 솜 어셈블리 단백질 (NAP) 패밀리 구성원은 시험관 내에서 뉴 클레오 솜 유사 구조의 형성을 촉진하고 세포질과 핵15 사이의 히스톤 왕복에 관여합니다. 뉴클레오플라스민과 NAP 계열 단백질은 모두 기능성 히스톤 샤페론이지만 구조적 특징을 공유하지 않습니다. 본질적으로, 단백질을 히스톤 샤페론(16)으로 분류할 수 있는 단일 구조적 특징은 없다. 구조 연구와 함께 기능적 및 생물 물리학 적 분석의 사용은 히스톤 샤페론을 특성화하는 데 가장 효과적입니다.
이 연구는 단백질을 뉴 클레오 솜 조립을 돕는 히스톤 샤페론으로 특성화하는 생화학 적 및 생물 물리학 적 방법을 설명합니다. 먼저, 히스톤 샤페론의 올리고머 상태 및 안정성을 분석하기 위해 분석 크기 배제 크로마토 그래피를 수행하였다. 다음으로, 히스톤 샤페론-히스톤 상호작용의 원동력과 경쟁적 특성을 결정하기 위해 풀다운 분석을 수행하였다. 그러나 이러한 상호 작용의 유체역학적 파라미터는 단백질의 모양과 컬럼을 통한 이동에 영향을 미치는 복합체 때문에 분석 크기 배제 크로마토그래피를 사용하여 정확하게 계산할 수 없었습니다. 따라서 정확한 분자량, 상호 작용의 화학량론 및 생물학적 분자의 모양을 포함하는 용액 내 거대분자 특성을 제공하는 분석적 초원심분리가 사용되었습니다. 과거 연구는 yScS11617, DmACF 18, ScRTT106p19, HsNPM120과 같은 히스톤 샤페론을 기능적으로 특성화하기 위해 시험관 내 히스톤 샤페론 분석을 광범위하게 사용했습니다. 히스톤 샤페론 분석은 또한 단백질을 히스톤 샤페론으로 기능적으로 특성화하기 위해 사용되었습니다.
프로토콜
1. 히스톤 샤페론의 올리고머 상태 및 안정성을 설명하기 위한 분석 크기 배제 크로마토그래피
- 히스톤 샤페론의 올리고머 상태 분석
- 4°C에서 24mL 분석 크기 배제 크로마토그래피(SEC) 컬럼을 1.2컬럼 부피(CV), 즉 28.8mL의 탈기된 SEC 완충액[20mM의 트리스-HCl(pH 7.5), 300mM NaCl 및 1mM의 β-메르캅토에탄올(β-ME)]과 평형화합니다( 재료 표 참조).
참고: 컬럼 유형, 완충액 조성 및 완충액 pH는 관심 단백질에 따라 선택할 수 있습니다. 시료 주입량은 24mL 컬럼의 경우 500μL를 초과해서는 안 됩니다. 또한 컬럼 압력을 5MPa 미만으로 유지해야 합니다. - 고농도 단백질 원액에서 탈기된 SEC 버퍼에 0.5mg/mL 단백질 샘플 500μL를 준비하고 500μL 주입 루프를 사용하여 사전 평형화된 컬럼에 주입합니다. 크로마토그래피 실행이 4°C에서 SEC 버퍼를 사용하여 0.2-0.3mL/min의 등용매 유속으로 진행되도록 합니다.
- 280nm의 파장에서 흡광도를 측정하여 단백질의 용리 프로파일을 모니터링합니다. 방향족 잔기가 없는 단백질을 처리할 때는 214nm에서 흡광도를 측정합니다.
- 단백질의 용리 부피를 사용하여 표준 검량선21을 사용하여 kDa 단위의 대략적인 분자량을 계산합니다.
참고: 검량선은 동일한 컬럼을 사용하여 용리된 각각의 분자량(log Mr)의 로그에 대해 알려진 분자량 단백질의 머무름 부피를 플로팅하여 준비됩니다.
- 4°C에서 24mL 분석 크기 배제 크로마토그래피(SEC) 컬럼을 1.2컬럼 부피(CV), 즉 28.8mL의 탈기된 SEC 완충액[20mM의 트리스-HCl(pH 7.5), 300mM NaCl 및 1mM의 β-메르캅토에탄올(β-ME)]과 평형화합니다( 재료 표 참조).
- 히스톤 샤페론의 열 안정성 분석
- 개별 미세 원심분리 튜브에서 탈기된 SEC 완충액(1.1.1에서 사용된 것과 동일)에서 준비된 단백질 샘플 0.5mg/mL 500μL를 취하여 각 튜브를 20°C에서 90°C(20°C, 40°C, 60°C 및 90°C) 범위의 특정 온도로 수조에서 10분 동안 가열합니다.
- 이어서, 열처리된 샘플을 4°C에서 10분 동안 16,200 x g 에서 원심분리하고, 마이크로피펫으로 상청액을 수집하고, 500μL 주입 루프를 사용하여 각 샘플을 4°C에서 SEC 버퍼로 사전 평형화된 분석 컬럼에 개별적으로 주입합니다.
- 크로마토그래피 실행이 4°C에서 SEC 버퍼를 사용하여 0.2-0.3mL/min의 등용매 유속으로 진행되도록 합니다.
- 용리 피크의 위치와 높이를 관찰하고 다른 샘플에 대한 추가 피크의 모양을 찾습니다.
- 히스톤 샤페론의 화학적 안정성 분석
- 히스톤 샤페론의 염 안정성을 검사하려면 트리스 완충액[20mM의 Tris-HCl(pH 7.5) 및 1mM의 β-ME]에서 준비된 0.5mg/mL 단백질 샘플 500μL를 별도의 미세 원심분리 튜브에 넣고 별도의 미세 원심분리 튜브에 4°C에서 30분 동안 배양합니다. 샘플을 16,200 x g 에서 4°C에서 10분 동안 원심분리하고 상청액을 유지합니다.
- 다음으로, 500μL 주입 루프를 사용하여 4°C에서 증가된 NaCl 농도를 포함하는 각각의 완충액의 1.2CV(28.8mL)로 미리 평형화된 분석 컬럼에 상이한 NaCl 농도의 단백질 샘플을 개별적으로 로딩합니다.
- 크로마토그래피 실행이 4°C에서 각 완충액 1CV(24mL)를 사용하여 0.2-0.3mL/분의 등용매 유속으로 진행되도록 합니다.
- 용리 피크의 위치와 높이를 관찰하고 다른 샘플에 대한 추가 피크의 모양을 찾습니다.
- 유사하게, 요소 안정성 분석을 위해, 트리스 완충액[20mM의 Tris-HCl(pH 7.5) 및 1mM의 β-ME]에서 제조된 0.5mg/mL 단백질 샘플 500μL를 별도의 미세 원심분리 튜브에서 실온에서 16시간 동안 배양합니다. 샘플을 실온에서 10분 동안 16,200 x g 로 원심분리하고 상청액을 유지합니다.
- 다음으로, 500μL 주입 루프를 사용하여 요소 처리된 단백질 샘플을 실온에서 다양한 요소 농도를 포함하는 해당 완충액의 1.2CV(28.8mL)로 사전 평형화된 분석 컬럼에 개별적으로 로드합니다.
- 크로마토그래피 실행이 실온에서 각 완충액 1CV(24mL)를 사용하여 0.2-0.3mL/분의 등용매 유속으로 진행되도록 합니다.
주의 : 요소가 결정화되어 컬럼을 손상시키는 경향이 있으므로 낮은 온도에서 요소를 포함하는 완충액으로 실험을 수행하지 마십시오. - 용리 피크의 위치와 높이를 관찰하고 다른 샘플에 대한 추가 피크의 모양을 찾습니다.
2. 히스톤 올리고머와 히스톤 샤페론 사이의 복잡한 형성에 기여하는 상호 작용의 유형을 이해하기 위한 염 구배 기반 풀다운 분석
- 풀다운 분석의 각 반응에 대해 Ni-NTA 수지 40μL를 스핀 컬럼에 피펫팅하고 멸균 이중 증류수로 세척합니다. 이어서, 수지를 100CV (4mL)의 평형 완충액 [20mM의 트리스-HCl (pH 7.5), 300mM의 NaCl, 10mM의 이미다졸, 10μg/mL의 BSA, 및 1mM의 β-ME]로 평형화시킨다( 재료 표 참조).
알림: 풀다운은 1.5mL 마이크로 원심분리 튜브에서도 수행할 수 있습니다. - 5μM의 His-태그된 히스톤 샤페론을 평형 완충액에서 20μM의 히스톤 H2A/H2B 이량체 또는 H3/H4 사량체와 혼합하여 샘플을 준비합니다. 샘플을 얼음 위에서 1시간 동안 배양합니다.
참고: H2A/H2B 이량체 및 H3/H4 사량체는 재조합 인간 히스톤21로부터 제조되며, 올리고머의 무결성은 분석적 초원심분리(AUC)에 의해 추정된 분자 질량에 기초하여 확인된다. 동일한 히스톤 올리고머가 아래에 언급된 모든 실험에 사용되었습니다. - 샘플을 각각 특정 염 농도에 대해 라벨링된 단계 2.1의 Ni-NTA 수지가 있는 별도의 사전 평형화된 스핀 컬럼에 로드하고 컬럼을 4°C에서 30분 동안 유지합니다. 컬럼을 1000 x g 에서 1분 동안 원심분리합니다.
- 다음에, 컬럼을 100 CV (4 mL)의 세척 완충액[20 mM의 트리스-HCl(pH 7.5), 50 mM의 이미다졸, 0.2%의 트윈-20, 및 1 mM의 β-ME]을 함유하는 상이한 염 농도(즉, 300 mM, 500 mM, 600 mM, 700 mM, 800 mM, 900 mM 및 1 M NaCl)로 세척한다. 특정 염 농도를 갖는 완충액으로 각 컬럼을 세척한다.
- 염 세척 단계 후, 100 μL의 용리 완충액[20 mM의 트리스-HCl (pH 7.5), 300 mM의 NaCl, 300 mM의 이미다졸, 및 1 mM의 β-ME]을 사용하여 상이한 컬럼으로부터 단백질을 용리시킨다.
- 이어서, 용리된 샘플을 18% SDS-PAGE22 에 적용하고, 쿠마시 브릴리언트 블루 R250으로 염색한 후 겔을 시각화한다( 재료 표 참조). 대안적으로, Ni-NTA 수지로부터 결합된 단백질을 용리하는 대신 SDS-PAGE 겔 상에 수지를 직접 로딩할 수 있다.
참고: 평형화, 세척 및 용출 완충액 조성물 및 pH는 관심 단백질에 따라 변형될 수 있습니다.
3. H2A/H2B 또는 H3/H4에 대한 히스톤 샤페론의 선호도를 식별하기 위한 경쟁력 있는 풀다운 분석
- 2.1단계에 설명된 대로 스핀 컬럼 준비
- 5μM의 히스톤 샤페론을 300μL의 평형 완충액(단계 2.1에서 제조됨)의 300μL에 20μM의 H2A/H2B 이량체와 함께 얼음 위에서 30분 동안 배양합니다.
참고: 반응에서 히스톤 올리고머 대 히스톤 샤페론의 비율은 알려진 결합 화학량론 데이터를 기반으로 선택할 수 있습니다. 정보가 없는 경우 5배 초과 히스톤을 사용하십시오. - 히스톤 샤페론-H2A/H2B 복합체를 16,200 x g 에서 4°C에서 5분 동안 원심분리하여 침전물을 제거합니다. 다음으로, 평형 완충액(단계 2.1에서 제조됨)으로 미리 평형화된 스핀 컬럼에 샘플을 로딩하고 4°C에서 30분 동안 인큐베이션합니다.
- 100CV(4mL)의 세척 완충액[20mM의 트리스-HCl(pH 7.5), 300mM의 NaCl, 50mM의 이미다졸, 0.2%의 트윈-20 및 1mM의 β-ME]로 컬럼을 세척하여 과량의 H2A/H2B 이량체를 제거합니다. 다음으로, 히스톤 샤페론-H2A/H2B 복합체를 20-60μM의 H3/H4 사량체와 혼합하고 얼음 위에서 30분 동안 배양합니다.
- 컬럼을 100CV(4mL)의 세척 완충액(3.4단계에서 준비)으로 재세척하여 결합되지 않은 H3/H4 사량체를 제거하고 용리 완충액(단계 2.5에서 준비)을 사용하여 샘플을 용리합니다. 용리된 샘플을 18% SDS-PAGE에 적용하고 쿠마시 브릴리언트 블루 R250으로 염색한 후 시각화합니다.
참고 : 먼저 H3 / H4 사량 체를 샤페론과 혼합 할 수 있고, 복합체가 Ni-NTA 비드에 결합 할 수 있고, 복합체가 다양한 농도의 H2A / H2B 이량 체로 배양 될 수있는 분석이 역전 될 수 있습니다.
4. 히스톤 샤페론과 히스톤 사이의 결합 화학량론을 분석하기 위한 분석적 초원심분리 - 침강 속도(AUC-SV) 실험
- AUC를 위한 샘플 준비
- 재구성된 히스톤 H2A/H2B 이량체, H3/H4 사량체 및 히스톤 샤페론을 7kDa 차단 투석 튜브(23)를 통해 투석 완충액[20mM의 트리스(pH 7.5), 300mM의 NaCl 및 1mM의 β-ME]에 대해 개별적으로 투석합니다( 재료 표 참조). 완충액 불일치로 인한 배경 오류를 최소화하기 위해, 투석 완충액에 대해 광범위하게, 바람직하게는 24h의 기간에 걸쳐 3회 투석을 수행한다.
참고: 단백질 샘플의 초기 OD280은 0.3-0.5의 최종OD280을 달성하기 위해 2 내지 3배 더 높은 값을 가져야 한다. 이것은 본질적으로 희석의 효과를 무효화하기 위해 수행됩니다. - 분석 크기 배제 크로마토그래피(1단계에서 언급됨)를 사용하여 투석 완충액으로 H2A/H2B 이량체, H3/H4 사량체 및 히스톤 샤페론을 개별적으로 정제합니다. 나중에 추가 희석을 준비하고 AUC 셀에서 참조로 사용하기 위해 실행에서 버퍼를 저장합니다.
- 재구성된 히스톤 H2A/H2B 이량체, H3/H4 사량체 및 히스톤 샤페론을 7kDa 차단 투석 튜브(23)를 통해 투석 완충액[20mM의 트리스(pH 7.5), 300mM의 NaCl 및 1mM의 β-ME]에 대해 개별적으로 투석합니다( 재료 표 참조). 완충액 불일치로 인한 배경 오류를 최소화하기 위해, 투석 완충액에 대해 광범위하게, 바람직하게는 24h의 기간에 걸쳐 3회 투석을 수행한다.
- AUC를 위한 샘플 로딩
- 단계 4.1.1로부터의 투석 완충액을 사용하여 450 μL의 최종 부피로 정제된 단백질을 혼합하여 0.3-0.6의OD280 에 도달한다. 히스톤 샤페론을 H2A/H2B 이량체 또는 H3/H4 사량체와 혼합하여 별도의 반응 튜브에서 복합체를 형성합니다. 단백질 혼합물을 2-3 시간 동안 배양하십시오.
알림: 또는 침강 데이터는 분석 초원심분리기의 간섭 광학 스캐닝 시스템으로 수집할 수 있습니다. 별도로, 정제 된 단백질을 혼합하기 위해, 히스톤 샤페론 농도를 고정하고 히스톤 올리고머의 농도를 증가시켜 배양하여 정확한 화학 양 론을 얻는다. - 도24에서 상세히 설명한 바와 같이 분석적 초원심분리기의 흡광도 검출기를 사용하여 AUC-SV 실험을 위해 이중 섹터 센터피스 및 석영 윈도우로 셀을 조립한다.
- 400μL의 샘플 용액과 420μL의 투석 완충액을 셀의 두 섹터(각각 샘플 및 참조 섹터)에 채웁니다.
참고: 참조 섹터에서 더 많은 양의 버퍼가 사용되어 참조 메니스커스를 샘플의 메니스커스 위로 유지합니다. 그러나 광학 간섭 시스템을 사용하는 동안 두 섹터를 동일한 볼륨으로 채 웁니다. - 셀의 무게를 측정하고 정확하게 균형을 잡고 4 자리 티타늄 로터에로드하십시오 ( 재료 표 참조). 셀과 로터의 하단에 제공된 표시를 사용하여 셀을 정렬합니다. 로터를 원심 분리기에 넣고 뚜껑을 닫은 다음 압력이 15 미크론 Hg 미만으로 떨어지고 로터 온도가 20 ° C로 안정화 될 때까지 진공을 발생시킵니다 (보통 2-2.5 시간 소요).
알림: AUC 작동 매개변수에는 실험 온도, 로터 속도, 스캔 간격 및 수집할 스캔 수가 포함됩니다. SV 실험의 경우 스캔 간격은 단백질의 분자량에 따라 주어집니다. 단백질이 작을수록 스캔 사이에 더 큰 시간 간격이 필요합니다. 로터 속도도 단백질의 예상 분자량에 따라 설정되며 실험은 20 ° C에서 수행됩니다. 흡광도 데이터는 280 nm에서 모니터링됩니다. - 정확한 화학량론을 얻으려면 히스톤 샤페론 농도를 일정하게 유지하고 히스톤 올리고머의 농도를 증가시켜 포화를 달성하면서 배양하십시오.
- 단계 4.1.1로부터의 투석 완충액을 사용하여 450 μL의 최종 부피로 정제된 단백질을 혼합하여 0.3-0.6의OD280 에 도달한다. 히스톤 샤페론을 H2A/H2B 이량체 또는 H3/H4 사량체와 혼합하여 별도의 반응 튜브에서 복합체를 형성합니다. 단백질 혼합물을 2-3 시간 동안 배양하십시오.
- AUC 데이터 분석
- 앞서 설명한 바와 같이 데이터 분석을 수행한다25. 간단히 말해서 SEDNTERP26 프로그램을 사용하여 버퍼 성분의 밀도와 점도를 계산하십시오 ( 재료 표 참조). 유사하게, SEDNTERP를 사용하여 아미노산 조성을 기반으로 단백질의 부분 비부피를 계산하십시오.
- AUC 머신의 데이터를 SEDFIT27 프로그램으로 로드하고 메니스커스(빨간색 선), 셀 하단(파란색 선) 및 데이터 분석 경계(녹색 선)를 정의합니다. 계량형 C(s) 분포를 모델로 선택합니다.
- 다음으로 최대 해상도를 100으로 설정합니다. 세트 침강 계수 (S), s 최소 : 0 및 S 최대 : 10-15; 처음에 마찰비를 1.2로 설정하고 부동 소동을 선택하여 데이터에서 비율을 도출합니다. 1 시그마 정규화에 대해 신뢰 수준 (F- 비율, 정규화의 크기를 결정)을 0.68로 설정합니다. SEDNTERP에서 얻은 부분 특정 부피, 버퍼 밀도 및 버퍼 점도 값을 설정합니다.
- RUN을 눌러 소프트웨어가 Lamm 방정식27을 풀도록 합니다. 중요한 데이터 불일치가 있는 경우 매개 변수를 조정합니다. 매개변수를 조정한 후 FIT를 눌러 모든 매개변수를 구체화합니다. 0.01 신호 단위보다 작아야 하는 RMSD(평균 제곱근 편차) 값을 기반으로 적합 품질을 평가합니다.
- 옵션을 선택하여 피크의 분자 질량을 추정하십시오 : 분자 / 복합체의 's'에 대한 정보를 제공하는 기본 도구 모음의 표시 기능에 피크 "Mw in c (s)"를 표시합니다.
5. 히스톤 보호자 기능을 확인하기 위한 플라스미드 슈퍼코일링 분석
- 뉴 클레오 솜 조립 반응
- 2 μM의 H3/H4 사량체와 4 μM의 H2A/H2B 이량체를 조립 완충액[20mM의 트리스 HCl(pH 7.5), 1mM의 DTT, 1mM의 MgCl2, 0.1mg/mL의 BSA 및 100mM의 NaCl]에서 히스톤 샤페론(1-6μM)의 농도를 증가시켜 최종 부피 50μL까지 혼합합니다. 혼합물을 4°C에서 30분 동안 배양한다.
- 동시에, 별도의 반응에서, 500 μL의 최종 부피로 조립 완충액에서 1 μg의 토포이소머라제 I 효소( 재료 표 참조)로 500ng의 음성 슈퍼코일 pUC19 플라스미드를 전처리하고 30°C에서 30분 동안 배양합니다.
참고: 토포이소머라제 I은 단일 가닥 닉을 생성하여 슈퍼코일 이중 가닥 플라스미드 DNA를 이완시킵니다. 진핵생물 기원의 토포이소머라제 I 효소, 예컨대 시판되는 밀 배아 토포이소머라제 I 또는 재조합 발현된 초파리 멜라노가스터 토포이소머라제 I이 사용될 수 있었다. - 다음으로, H3/H4 사량체, H2A/H2B 이량체, 히스톤 샤페론 혼합물(단계 5.1.1로부터), 이완된 플라스미드 DNA 반응 혼합물(단계 5.1.2에서)을 결합하고, 30°C에서 90분 동안 추가로 배양한다.
알림: 분석에 대해 두 가지 제어 반응을 설정합니다. 하나는 히스톤 샤페론과 이완된 플라스미드 DNA(히스톤은 아님)를 가지고 있고 다른 하나는 히스톤 올리고머와 이완된 플라스미드 DNA(히스톤 샤페론은 아님)를 가지고 있습니다. - 100μL의 2x 정지 완충액(40mM의 EDTA, 2%의 SDS 및 0.4mg/mL의 프로테이나제 K)을 추가하여 조립 반응을 중지하고 37°C에서 30분 동안 배양합니다.
참고: 정지 완충액은 결합된 히스톤의 변성 및 단백질 분해에 의해 플라스미드 DNA를 탈단백질화합니다.
- 페놀-클로로포름 추출 및 에탄올 침전
- 단계 5.1.4의 반응 혼합물을 포함하는 튜브에 동일한 부피의 트리스-포화 페놀을 첨가하고 잘 혼합한 다음, 실온에서 10분 동안 16,200 x g 에서 원심분리한다.
- 플라스미드 DNA를 갖는 상부 수성상을 마이크로피펫으로 부드럽게 수집하고 동일한 부피의 클로로포름과 혼합한다. 혼합물을 와동시키고 실온에서 10분 동안 16,200 x g 에서 원심분리합니다.
참고: 수성 상과 유기상 사이의 퍼지 계면을 피하기 위해 이 단계에서 이소아밀 알코올을 포함할 수 있습니다. - 다음으로, 상부 수성 상을 수집하고, 3M 아세트산 나트륨 (pH 5.5)의 1/10 부피와 얼음처럼 차가운 에탄올 2.5 부피를 첨가한다 ( 재료 표 참조). 튜브를 3-4배 뒤집어 용액을 잘 혼합하고 플라스미드 DNA의 완전한 침전을 위해 혼합물을 -20°C 냉동고에 30분 동안 보관합니다.
- 단계 5.2.3으로부터의 샘플을 16200 x g 에서 10분 동안 원심분리하고 상청액을 부드럽게 버린다. 미량의 에탄올이 증발 할 때까지 튜브를 실온에서 열어 두어 침전 된 플라스미드 DNA를 튜브에 남겨 둡니다.
- 플라스미드 슈퍼코일링 효과를 관찰하기 위해 아가로스 겔 전기영동을 수행하였다.
- 단계 5.2.4에서 침전된 플라스미드 DNA를 멸균 이중 증류수에 용해시킨다.
- 샘플을 1x 트리스-아세테이트-EDTA (TAE) 완충액 (40 mM의 트리스, 20 mM의 아세트산, 및 1 mM의 EDTA) 중 1% 아가로스 겔 상에서 분해한다( 재료 표 참조).
- 0.2-0.5 μg/mL 농도의 에티듐 브로마이드로 젤을 염색하고 UV 하에서 관찰하여 젤의 DNA 밴드를 시각화합니다.
결과
애기장대 탈리아나로부터의 단백질 FKBP53의 재조합 N-말단 뉴클레오플라스민 도메인을 SEC에 분석하였다. 용리 피크 부피는 표준 곡선에 대해 플롯팅되어 올리고머 상태를 식별했습니다. 분석 SEC 결과는 도메인이 용액에서 펜타머로 존재하며 대략 분자량이 58kDa임을 보여주었습니다(그림 1A,B). 또한, 뉴클레오플라스민 도메인은 분석 SEC와 함께 열적 및 화학적 안정성에 대해 분석되었다. 90 ° C까지 열처리 된 뉴 클레오 플라스 민 샘플은 20 ° C에서 유지 된 샘플과 비교하여 용리 부피와 피크 높이의 명백한 변화를 나타내지 않았으며, 이는 도메인이 매우 열 안정성임을 시사합니다 (그림 1C). 마찬가지로, 뉴 클레오 플라스 민 도메인은 최대 2M의 NaCl (그림 1D)의 염 안정성과 최대 4M의 요소 안정성 (그림 1E)을 나타 냈습니다. 그러나 뉴 클레오 플라스 민 펜타 머는 더 높은 요소 농도에서 해리되기 시작했습니다.
그래디언트 염 세척을 사용하여 히스톤 샤페론(AtFKBP53의 뉴클레오플라스민 도메인)과 히스톤 올리고머 H2A/H2B 이량체 및 H3/H4 사량체 사이의 복합체 형성에 기여하는 상호 작용의 유형을 결정하기 위해 풀다운 분석을 수행했습니다. 뉴 클레오 플라스 민 도메인과 H2A / H2B 이량 체의 상호 작용은 0.4M NaCl의 염 농도까지 안정적이었습니다 (그림 2A). 이에 비해 H3/H4와의 연관성은 0.7M NaCl까지 상당히 안정적이었습니다(그림 2B). 높은 염 농도를 견딜 수있는 샤페론-히스톤 복합체의 능력은 복합체를 안정화시키는 소수성 상호 작용의 역할을 시사합니다. H3 / H4가 높은 염 농도에서도 안정한 샤페론 복합체는 복합체 형성에서 소수성 상호 작용의 주된 역할을 시사합니다. 높은 염 농도에서 H2A / H2B- 샤페론 복합체의 낮은 안정성은 복합체 형성에서 정전기 상호 작용에 중요한 역할을한다는 것을 나타냅니다. 다른 실험에서, 풀다운 분석은 샤페론이 H2A/H2B 이량체 또는 H3/H4 사량체를 선호하는지 여부를 조사하기 위해 사용되었다. 결과는 샤페론이 샤페론에 첨가되는 순서에 관계없이 H2A / H2B 이량 체와 H3 / H4 사량 체에 동시에 결합하는 것으로 나타났습니다 (그림 2C, D). 이것은 샤페론이 히스톤 올리고머와의 상호 작용을 위해 별도의 부위를 가지고 있음을 나타냅니다.
AUC-SV 실험 (그림 3)은 히스톤 올리고머와 샤페론 사이의 상호 작용의 화학 양 론을 연구하기 위해 수행되었습니다. AUC-SV 데이터 분석은 104kDa의 분자량에 해당하는 H2A/H2B와 복합체의 AtFKBP53 뉴클레오플라스민 도메인에 대해 5.40S의 침강 계수(들) 값을 제공했습니다. 뉴 클레오 플라스 민 도메인과 H3 / H4의 복합체는 129kDa에 해당하는 7.35S의 침강 계수 값을 주었다. 복합체의 추정된 분자량은 펜타머 뉴클레오플라스민이 1:1 화학량론에서 H2A/H2B 이량체 및 H3/H4 사량체 모두와 복합체를 형성한다는 것을 보여줍니다.
단백질이 히스톤 올리고머를 DNA에 침착시켜 히스톤 샤페론임을 확인할 수 있음을 보여주는 것이 중요합니다. 이를 위해 플라스미드 슈퍼코일링 분석법이 채택되었습니다(그림 4). 이완된 원형 플라스미드를 히스톤 올리고머 H2A/H2B 및 H3/H4와 함께 NAP 패밀리의 재조합 식물 히스톤 샤페론인 AtNRP1 및 AtNRP228과 함께 인큐베이션하였다. 샤페론의 존재는 슈퍼코일 플라스미드의 양을 증가시켜 DNA에 히스톤을 침착시켜 뉴클레오솜을 형성하여 DNA 슈퍼코일링을 유발할 수 있음을 시사합니다.

그림 1: AtFBP53의 뉴클레오플라스민 도메인의 올리고머 상태 및 안정성. (A) AtFKBP53 뉴클레오플라스민 도메인의 분석 크기-배제 크로마토그래피 프로파일. (B) 알려진 분자량의 구형 단백질을 사용하여 얻은 검량선. 파란색 점은 알려진 단백질의 분자량을 나타내고 빨간색 점은 AtFKBP53 뉴 클레오 플라스 민 도메인을 나타냅니다. (440 kDa - 페리틴, 158 kDa- 알 돌라 제, 75 kDa- 콘 알부민, 44 kDa- 오브 알부민, 6.5 kDa- 아프로 티닌). (C) 20 ° C (녹색), 40 ° C (주황색), 60 ° C (검은 색), 90 ° C (하늘색)의 다른 온도에서 열처리 된 0.5 mg / mL AtFKBP53 뉴 클레오 플라스 민 도메인의 500 μL의 분석 크기 배제 크로마토 그램. (D) 상이한 NaCl 농도를 함유하는 완충액에서 0.5 mg / mL AtFKBP53 뉴 클레오 플라스 민 도메인의 500 μL의 분석 크기 배제 크로마토 그램 : 0.3 M (보라색), 0.6 M (빨간색), 1.0 M (하늘색), 1.5 M (녹색), 2.0 M (검은 색). (E) 요소 농도가 다른 완충액에서 AtFKBP53 뉴 클레오 플라스 민 도메인의 분석 크기 배제 크로마토 그램 : 0M (대조군, 하늘색), 1.0M (분홍색), 2.0M (검은 색), 3.0M (진한 파란색), 4.0M (녹색), 5.0M (갈색). 뉴 클레오 플라스 민 펜타 머는 열 및 화학적 스트레스 조건에 대해 높은 안정성을 나타냅니다. 이 그림은 참고자료21에서 발췌한 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
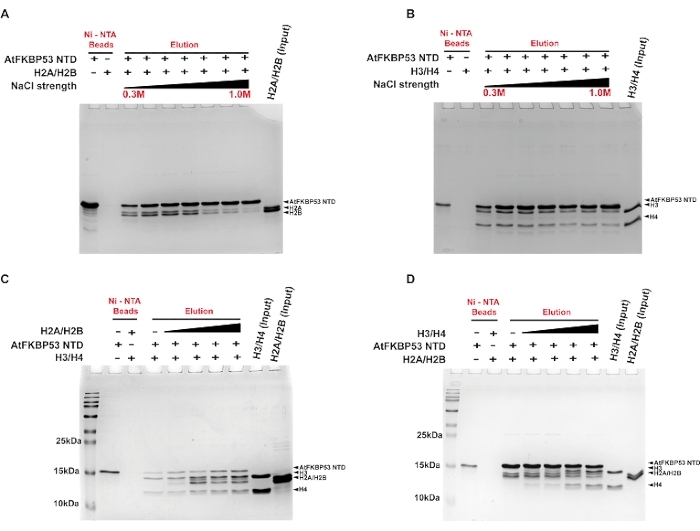
그림 2: AtFKBP53의 뉴클레오플라스민 도메인과 히스톤 올리고머의 상호작용에 대한 풀다운 분석. 분석으로부터의 용리 분획의 18% SDS-PAGE 이미지가 여기에 제시된다. 0.3 M, 0.5 M, 0.6 M, 0.7 M, 0.8 M, 0.9 M 및 1.0 M 범위의 NaCl 농도 증가에서 5 μM AtFKBP53 뉴 클레오 플라스 민 도메인을 갖는 (A) 20 μM H2A / H2B 이량 체 및 (B) 20 μM H3 / H4 사량 체에 대한 풀다운 분석. 5 μM AtFKBP53 FKBD를 여기에서 음성 대조군으로 사용하였다. 경쟁적 결합 실험을 위해, ( C ) 20-60 μM H2A/H2B 이량체 범위와 함께 배양된 5 μM AtFKBP53 뉴클레오플라스민 도메인 및 20 μM H3/H4 사량체의 혼합물 및 (D) 20-60 μM H3/H4 사량체 범위로 인큐베이션된 5 μM AtFKBP53 뉴클레오플라스민 도메인 및 20 μM H2A/H2B 이량체의 혼합물이 사용되었습니다. 표지 AtFKBP53은 AtFKBP53의 뉴클레오플라스민 도메인에 상응한다. 용리 분획은 두 히스톤 올리고머가 뉴클레오플라스민에 동시에 결합하는 것을 보여줍니다. 이 그림은 참고자료21에서 발췌한 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 히스톤 올리고머, AtFKBP53의 뉴클레오플라스민 도메인 및 그 복합체의 분석적 초원심분리 - 침강 속도(AUC-SV) 실험. AUC 거리 분포 대 침강 계수 (S) 플롯. 수득된 침강 계수(들) 값 및 분자 질량이 또한 제공된다. 표지 AtFKBP53은 AtFKBP53의 뉴클레오플라스민 도메인에 상응한다. 추정된 분자 질량은 히스톤 올리고머 H2A/H2B 이량체 및 H3/H4 사량체를 갖는 AtFKBP53 뉴클레오플라스민 도메인에 대한 1:1 화학량론을 나타냅니다. 0.3-0.5의OD280 을 갖는 모든 단백질 샘플 450 μL를 AUC-SV 실험에 사용하였다. 이 그림은 참고자료21에서 발췌한 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 플라스미드 슈퍼코일링 분석. 히스톤 샤페론 AtNRP1 및 AtNRP2에 대한 플라스미드 슈퍼코일링 분석. 500ng의 pUC19 플라스미드 DNA를 실험을 위해 1μg의 토포이소머라제 I로 전처리하였다. 4 μM AtNRP1, 4 μM AtNRP2, 및 4 μM H2A/H2B 이량체 및 2 μM H3/H4 사량체의 혼합물은 전처리된 pUC19 DNA와 함께 인큐베이션했을 때 슈퍼코일링 활성을 나타내지 않는 대조군이었다. 4μM H2A/H2B의 이량체와 2μM H3/H4의 사량체 및 각각 4μM의 AtNRP1 및 AtNRP2의 혼합물이 있는 레인은 전처리된 pUC19 DNA와의 배양 시 슈퍼코일 DNA의 형성을 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 작업은 추정되는 히스톤 샤페론의 생화학적 및 생물물리학적 특성화를 위한 포괄적인 프로토콜 세트를 보여주고 검증합니다. 본원에서, 재조합 발현 및 정제된 NAP 패밀리 단백질, AtNRP1 및 AtNRP2, 및 AtFKBP53의 N-말단 뉴클레오플라스민 도메인을 사용하여 프로토콜을 입증하였다. 동일한 실험 세트가 이전에 특성화되지 않은 히스톤 샤페론의 기능적 특성을 모든 유기체에서 설명하는 데 매우 잘 사용될 수 있습니다.
프로토콜 섹션의 첫 번째 부분은 히스톤 샤페론의 올리고머 상태와 안정성을 조사하는 것입니다. 여러 보고서에 따르면 히스톤 샤페론은 올리고머 상태에서 상당한 다양성을 나타냅니다. 예를 들어, 인간 CAF-1은 단량체29로서 존재한다. NAP 패밀리 구성원은 이량 체 또는 사량 체 29,30,31로 존재합니다. 뉴 클레오 플라스 민은 펜타 머 및 종종 데카 메라 올리고머 상태32,33을 나타냅니다. 분석 SEC 실험은 히스톤 샤페론의 올리고머 상태를 결정할 수 있으며 AUC-SV 실험은 이를 확인할 수 있습니다. 히스톤 샤페론의 몇몇은 다양한 열 및 화학적 스트레스 조건 (33,34) 하에서 매우 안정한 것으로 알려져 있다. 히스톤 샤페론의 열 및 화학적 안정성 특성은 분석 SEC와 함께 조사 할 수도 있습니다. 또한, 원형 이색성 분광법은 화학 물질의 온도 상승 또는 더 높은 농도에 노출 될 때 샤페론의 2 차 구조의 변화에 대한 심층 분석에 효과적으로 사용될 수 있습니다.
프로토콜 섹션의 두 번째 부분에서는 샤페론의 히스톤 올리고머 선호도를 식별하기 위해 염 구배 접근법과 경쟁적 풀다운 분석을 사용하여 히스톤 올리고머와 샤페론의 연관성을 돕는 기본적인 상호 작용을 조사할 수 있는 풀다운 분석을 다룹니다. 복합체가 염 농도의 약간의 증가로 분해되면 복합체를 안정화시키는 데 정전기 상호 작용이 크게 기여할 수 있음을 시사합니다. 고염에서의 온전한 복합체는 복합체35를 안정화시키는데 있어서 소수성에 대해 중요한 역할을 할 것임을 시사한다. 경쟁적 풀다운 분석은 특정 히스톤 올리고머 클래스에 대한 히스톤 샤페론의 특이성 또는 선호도를 결정하기 위해 쉽게 사용될 수 있습니다. 히스톤 올리고머에 대한 선호도에 따라 히스톤 샤페론은 H2A/H2B 샤페론, H3/H4 샤페론 및 H2A/H2B-H3/H4 샤페론10,36과 같은 세 가지 범주로 분류할 수 있습니다. 또한 필요한 경우 등온 적정 열량계 (ITC)를 사용하여 주어진 샤페론의 히스톤 올리고머 특이성과 상호 작용의 열역학적 특성을 이해할 수 있습니다.
프로토콜 섹션의 세 번째 부분은 히스톤 샤페론과 히스톤 올리고머 사이의 상호 작용 화학량론에 대한 조사를 다룹니다. 일반적으로, 히스톤 샤페론의 상이한 패밀리는 H2A/H2B 또는/및 H3/H4 21,28,37,38과의 연관성의 화학량론에 대해 상당히 다르다. AUC-SV 실험은 단백질 또는 그 복합체의 침강 계수 및 분자량을 얻는 데 도움이되며, 이는 복합체 형성에서 화학 양 론을 정확하게 추정하는 데 매우 유용합니다. 또는 ITC를 사용하여 화학량론을 검사할 수도 있습니다.
프로토콜 섹션의 네 번째 부분은 히스톤 샤페론의 뉴 클레오 솜 조립 기능을 조사하는 데 중점을 둡니다. 히스톤 샤페론은 복제, 전사 및 DNA 복구와 같은 중요한 세포 과정을 조절하는 뉴 클레오 솜 조립에 중요한 역할을합니다39. 히스톤 샤페론의 히스톤 샤페로닝 활성의 시험관내 평가에 전형적으로 사용되는 플라스미드 슈퍼코일링 분석이 이 섹션에서 자세히 설명됩니다.
모든 히스톤 보호자가 완전히 구조화 된 것은 아닙니다. 본질적으로 무질서한 영역40,41을 가진 것으로 알려진 사람은 거의 없습니다. 따라서, 열 및 화학적 안정성 분석은 이러한 단백질에 적합하지 않을 수 있다. 또한, 다른 유기체의 히스톤 샤페론은 다른 올리고머 상태와 히스톤에 결합하는 차별적 인 능력을 가지고 있습니다. 따라서 이 프로토콜은 좋은 출발점이 될 수 있지만 필요에 따라 수정해야 합니다.
공개
이해 상충이 선언되지 않았습니다.
감사의 말
인도 정부 과학 및 공학 연구 위원회[CRG/2018/000695/PS]와 인도 정부 과학기술부 생명공학부[BT/INF/22/SP33046/2019]의 Dileep Vasudevan에 대한 교외 보조금과 부바네스와르 생명 과학 연구소의 교내 지원은 크게 인정받고 있습니다. 히스톤 준비에 도움을 주신 Sudeshna Sen 씨와 Annapurna Sahoo 씨에게 감사드립니다. 동료 Chinmayee Mohapatra 박사, Manas Kumar Jagdev 및 Shaikh Nausad Hossain 박사와의 토론도 인정됩니다.
자료
| Name | Company | Catalog Number | Comments |
| Acetic acid (glacial) | Sigma | A6283 | |
| Acrylamide | MP Biomedicals | 814326 | |
| Agarose | MP Biomedicals | 193983 | |
| AKTA Pure 25M FPLC | Cytiva | 29018226 | Instrument for protein purification |
| Ammonium persulfate (APS) | Sigma | A3678 | |
| An-60Ti rotor | Beckman Coulter | 361964 | Rotor for analytical ultracentrifugation |
| Bovine serum albumin (BSA) | Sigma | A7030 | |
| Chloroform | Sigma | C2432 | |
| Coomassie brilliant blue R 250 | Sigma | 1.15444 | |
| Dialysis tubing (7 kDa cut-off) | Thermo Fisher | 68700 | For dialysing protein samples |
| Dithiothreitol (DTT) | MP Biomedicals | 100597 | |
| DNA Loading Dye | New England Biolabs | B7025S | |
| EDTA disodium salt | MP Biomedicals | 194822 | |
| Electronic balance | Shimadzu | ATX224R | |
| Ethanol | Sigma | E7023 | |
| Ethidium bromide (EtBr) | Sigma | E8751 | |
| Gel Doc System | Bio-Rad | 12009077 | For imaging gels after staining |
| Horizontal gel electrophoresis apparatus | Bio-Rad | 1704405 | Instrument for agarose gel electrophoresis |
| Hydrochloric acid (HCl) | Sigma | 320331 | |
| Imidazole | MP Biomedicals | 102033 | |
| Magnesium chloride (MgCl2) | Sigma | M8266 | |
| Micropipettes | Eppendorf | Z683779 | For pipetting of micro-volumes |
| Mini-PROTEAN electrophoresis system | Bio-Rad | 1658000 | Instrument for SDS-PAGE |
| N,N-methylene-bis-acrylamide | MP Biomedicals | 800172 | |
| Nano drop | Thermo Fisher | ND-2000 | For measurement of protein and DNA concentrations |
| Ni-NTA agarose | Invitrogen | R901-15 | Resin beads for pull-down assay |
| Optima AUC analytical ultracentrifuge | Beckman Coulter | B86437 | Instrument for analytical ultracentrifugation |
| pH Meter | Mettler Toledo | MT30130863 | |
| Phenol | Sigma | P4557 | |
| Plasmid isolation kit | Qiagen | 27104 | |
| Proteinase K | Sigma-Aldrich | 1.07393 | |
| pUC19 | Thermo Fisher | SD0061 | Plasmid for supercoiling assay |
| Refrigerated high-speed centrifuge | Thermo Fisher | 75002402 | |
| SDS-PAGE protein marker | Bio-Rad | 1610317 | |
| SEDFIT | Free software program for analytical ultracentrifugation data analysis | ||
| SEDNTERP | Free software program to estimate viscosity and density of buffer and partial specific volume of a protein | ||
| SigmaPrep Spin Columns | Sigma | SC1000 | For pull-down assay |
| Sodium acetate | Sigma | S2889 | |
| Sodium chloride (NaCl) | Merck | S9888 | |
| Sodium dodecyl sulfate (SDS) | MP Biomedicals | 102918 | |
| Superdex 200 Increase 10/300 GL | Cytiva | 28990944 | Column for analytical size-exclusion chromatography |
| Superdex 75 Increase 10/300 GL | Cytiva | 29148721 | Column for analytical size-exclusion chromatography |
| TEMED | Sigma | 1.10732 | |
| Topoisomerase I | Inspiralis | WGT102 | Enzyme used in plasmid supercoiling assay |
| Tris base | Merck | T1503 | |
| Tween-20 | Sigma | P1379 | |
| Urea | MP Biomedicals | 191450 | |
| Water bath | Nüve | NB 5 | For heat treatment of protein samples |
| β-mercaptoethanol (β-ME) | Sigma | M6250 |
참고문헌
- Hübner, M. R., Eckersley-Maslin, M. A., Spector, D. L. Chromatin organization and transcriptional regulation. Current Opinion in Genetics and Development. 23 (2), 89-95 (2013).
- Lai, W. K. M., Pugh, B. F. Understanding nucleosome dynamics and their links to gene expression and DNA replication. Nature Reviews Molecular Cell Biology. 18 (9), 548-562 (2017).
- Kim, U. J., Han, M., Kayne, P., Grunstein, M. Effects of histone H4 depletion on the cell cycle and transcription of Saccharomyces cerevisiae. EMBO Journal. 7 (7), 2211-2219 (1988).
- Prado, F., Aguilera, A. Partial depletion of histone H4 increases homologous recombination-mediated genetic instability. Molecular and Cellular Biology. 25 (4), 1526-1536 (2005).
- Meeks-Wagner, D., Hartwell, L. H. Normal stoichiometry of histone dimer sets is necessary for high fidelity of mitotic chromosome transmission. Cell. 44 (1), 43-52 (1986).
- Groth, A., et al. Human Asf1 regulates the flow of S phase histones during replicational stress. Molecular Cell. 17 (2), 301-311 (2005).
- Laskey, R. A., Honda, B. M., Mills, A. D., Finch, J. T. Nucleosomes are assembled by an acidic protein which binds histones and transfers them to DNA. Nature. 275 (5679), 416-420 (1978).
- Das, C., Tyler, J. K., Churchill, M. E. A. The histone shuffle: histone chaperones in an energetic dance. Trends in Biochemical Sciences. 35 (9), 476-489 (2010).
- Akey, C. W., Luger, K. Histone chaperones and nucleosome assembly. Current Opinion in Structural Biology. 13 (1), 6-14 (2003).
- De Koning, L., Corpet, A., Haber, J. E., Almouzni, G. Histone chaperones: An escort network regulating histone traffic. Nature Structural and Molecular Biology. 14 (11), 997-1007 (2007).
- Eitoku, M., Sato, L., Senda, T., Horikoshi, M. Histone chaperones: 30 years from isolation to elucidation of the mechanisms of nucleosome assembly and disassembly. Cellular and Molecular Life Sciences. 65 (3), 414-444 (2008).
- Quivy, J. P., Grandi, P., Almouzni, G. Dimerization of the largest subunit of chromatin assembly factor 1: importance in vitro and during Xenopus early development. EMBO Journal. 20 (8), 2015-2027 (2001).
- Ray-Gallet, D., et al. HIRA is critical for a nucleosome assembly pathway independent of DNA synthesis. Molecular Cell. 9 (5), 1091-1100 (2002).
- Frehlick, L. J., Eirín-López, J. M., Ausió, J. New insights into the nucleophosmin/nucleoplasmin family of nuclear chaperones. Bioessays. 29 (1), 49-59 (2007).
- Ito, T., Bulger, M., Kobayashi, R., Kadonaga, J. T. Drosophila NAP-1 is a core histone chaperone that functions in ATP-facilitated assembly of regularly spaced nucleosomal arrays. Molecular and Cellular Biology. 16 (6), 3112-3124 (1996).
- Elsässer, S. J., D'Arcy, S. Towards a mechanism for histone chaperones. Biochimica et Biophysica Acta. 1819 (3-4), 211-221 (2013).
- Rodríguez-Campos, A., Koop, R., Faraudo, S., Beato, M. Transcriptionally competent chromatin assembled with exogenous histones in a yeast whole cell extract. Nucleic Acids Research. 32 (13), 111(2004).
- Levenstein, M. E., Kadonaga, J. T. Biochemical analysis of chromatin containing recombinant Drosophila core histones. Journal of Biological Chemistry. 277 (10), 8749-8754 (2002).
- Huang, S., et al. Rtt106p is a histone chaperone involved in heterochromatin-mediated silencing. Proceedings of the National Academy of Sciences of the United States of America. 102 (38), 13410-13415 (2005).
- Swaminathan, V., Kishore, A. H., Febitha, K. K., Kundu, T. K. Human histone chaperone nucleophosmin enhances acetylation-dependent chromatin transcription. Molecular and Cellular Biology. 25 (17), 7534-7545 (2005).
- Singh, A. K., Datta, A., Jobichen, C., Luan, S., Vasudevan, D. AtFKBP53: A chimeric histone chaperone with functional nucleoplasmin and PPIase domains. Nucleic Acids Research. 48 (3), 1531-1550 (2020).
- Scofield, B. T. K. H. Protein Electrophoresis. , (2012).
- Andrew, S. M., Titus, J. A., Zumstein, L. Dialysis and concentration of protein solutions. Current Protocols in Toxicology, Appendix 3. , 1-5 (2002).
- Balbo, A., Zhao, H., Brown, P. H., Schuck, P. Assembly, loading, and alignment of an analytical ultracentrifuge sample cell. Journal of Visualized Experiments. (33), e1530(2009).
- Padavannil, A., Brautigam, C. A., Chook, Y. M. Molecular size analysis of recombinant importin-histone complexes using analytical ultracentrifugation. Bio-protocol. 10 (10), 3625(2019).
- Zhao, H., Brautigam, C. A., Ghirlando, R., Schuck, P. Overview of current methods in sedimentation velocity and sedimentation equilibrium analytical ultracentrifugation. Current Protocols in Protein Science. , Chapter 20, Unit20.12 (2013).
- Schuck, P. Size-distribution analysis of macromolecules by sedimentation velocity ultracentrifugation and Lamm equation modelling. Biophysical Journal. 78 (3), 1606-1619 (2000).
- Kumar, A., Kumar Singh, A., Chandrakant Bob de, R., Vasudevan, D. Structural characterization of Arabidopsis thaliana NAP1-related protein 2 (AtNRP2) and comparison with its homolog AtNRP1. Molecules. 24 (12), 2258(2019).
- Liu, W. H., Roemer, S. C., Port, A. M., Churchill, M. E. A. CAF-1-induced oligomerization of histones H3/H4 and mutually exclusive interactions with Asf1 guide H3/H4 transitions among histone chaperones and DNA. Nucleic Acids Research. 45 (16), 9809(2017).
- Bowman, A., et al. The histone chaperones Vps75 and Nap1 form ring-like, tetrameric structures in solution. Nucleic Acids Research. 42 (9), 6038-6051 (2014).
- Newman, E. R., et al. Large multimeric assemblies of nucleosome assembly protein and histones revealed by small-angle X-ray scattering and electron microscopy. Journal of Biological Chemistry. 287 (32), 26657-26665 (2012).
- Edlich-Muth, C., et al. The pentameric nucleoplasmin fold is present in Drosophila FKBP39 and a large number of chromatin-related proteins. Journal of Molecular Biology. 427 (10), 1949-1963 (2015).
- Franco, A., et al. Structural insights into the ability of nucleoplasmin to assemble and chaperone histone octamers for DNA deposition. Scientific Reports. 9 (1), 9487(2019).
- Xiao, H., Jackson, V., Lei, M. The FK506-binding protein, Fpr4, is an acidic histone chaperone. FEBS Letters. 580 (18), 4357-4364 (2006).
- Graziano, G. Role of hydrophobic effect in the salt-induced dimerization of bovine beta-lactoglobulin at pH 3. Biopolymers. 91 (12), 1182-1188 (2009).
- Burgess, R. J., Zhang, Z. Histone chaperones in nucleosome assembly and human disease. Nature Structural and Molecular Biology. 20 (1), 14-22 (2013).
- Donham, D. C., Scorgie, J. K., Churchill, M. E. The activity of the histone chaperone yeast Asf1 in the assembly and disassembly of histone H3/H4-DNA complexes. Nucleic Acids Research. 39 (13), 5449-5458 (2011).
- Avvakumov, N., Nourani, A., Côté, J. Histone chaperones: Modulators of chromatin marks. Molecular Cell. 41 (5), 502-514 (2011).
- Ransom, M., Dennehey, B. K., Tyler, J. K. Chaperoning histones during DNA replication and repair. Cell. 140 (2), 183-195 (2010).
- Chu, X., et al. Importance of electrostatic interactions in the association of intrinsically disordered histone chaperone Chz1 and histone H2A.Z-H2B. PLoS Computational Biology. 8 (7), 1002608(2012).
- Heidarsson, P. O., et al. Disordered proteins enable histone chaperoning on the nucleosome. bioRxiv. , (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유