Method Article
배아 개발에서 퇴화까지 의 상호 디스크의 광학 단면 및 시각화
요약
우리는 광학 단면 법을 사용하여 추간판의 골문 섬유증에서 공간 연골 세포 조직을 조사하는 방법을 제시한다.
초록
무척추 동물 디스크 (IVD) 변성은 요통의 주요 원인이며 영향을받는 개인을위한 높은 수준의 손상을 수반합니다. 디스크 퇴행성을 해독하고 재생 접근법을 개발할 수 있도록 IVD의 세포 생물학에 대한 철저한 이해가 필수적이다. 아직도 대답되지 않는 남아 있는 이 생물학의 한 양상은 세포가 생리적인 상태 및 변성 도중 공간적으로 배열되는 방법의 질문입니다. IVD의 생물학적 특성과 가용성은 이 조직을 분석하기 어렵게 만듭니다. 본 연구는 초기 배아 발달에서 말기 변성까지 골문 섬유증에 있는 공간 연골세포 조직을 조사합니다. 광학 단면방법(Apotome)은 척추 수술을 받은 환자로부터 얻은 동물 모델 및 인간 디스크 조직으로서 소 배아 조직을 이용한 고해상도 염색 분석을 수행하기 위해 적용된다. 초기 배아 소 디스크에서 매우 높은 연골 세포 밀도에서, 세포의 수는 임신, 성장 및 성숙 도중 감소합니다. 인간 디스크에서, 세포 밀도의 증가는 조직 퇴화의 진행을 동반. 이미 관절 연골에서 입증 된 바와 같이, 클러스터 형성은 고급 디스크 변성의 특징을 나타냅니다.
서문
무척추 디스크(IVD)는 생화학적으로 세포 건축과 관련하여, 첫눈에, 여러 가지 면에서 관절 연골1과유사한 연골 계 구조이다. 실제로, 관절 연골의 IVD 변성 및 골관절염(OA)은 연골 마모, 부전성 낭종 및 골관절염 형성, 및 아전철 경화증2,3로인한 관절 공간 협종화를 특징으로 한다. 이러한 유사성에도 불구하고 두 조직의 아키텍처와 기능적 역할이 다릅니다. 관절 연골의 매트릭스는 주로 아케이드 형성 콜라겐 형 II 네트워크로 형성되는 동안, IVD는 조직의 세 가지 유형으로 구성되어 있습니다 : 중앙에 콜라겐 유형 II 풍부한 핵 pulposus는 축부하를 차지하고 축부하를 소요하고 축섬유라고 조밀하게 포장 된 원형 콜라겐 유형 I 섬유의 포괄 링으로 전송. 이들의 기능은 장방향 섬유 강도로 프로테오글리칸 및 물이 풍부한 핵에 의해 수신된 번역된 축 압력을 흡수하는 것이다. 각 핵및 항문의 위쪽과 하단에서 hyaline 카르틸라기나기드 엔드플레이트는 인접한 척추4(도 1)에접합을 형성한다.
관절 연골에서, 네 개의 뚜렷한 공간 연골 패턴을 찾을 수 있습니다 : 쌍, 문자열, 이중 문자열, 작은 각각 큰 클러스터5,6,7 (그림 2). 이 패턴의 변화는 OA 발병 및 진행8,9와관련이 있습니다. 공간 연골세포 조직은 또한 연골의 직접적인 기능적 특성, 즉 강성, 이러한 이미지 기반 정지접근법(10,11)의기능적 관련성을 밑줄이 있다. 이러한 패턴은 이미 존재하는 임상 용기술(12)으로추가로 식별할 수 있다. IVD와 관절 연골 사이의 유사성으로 인해, IVD에 특징적인 연골세포 패턴도 존재한다는 가설이 될 수 있다. 클러스터 형성은 또한 퇴화IVD(13,14)에서관찰되는 현상이다.
IVD에서 공간 세포 조직을 분석하려고 할 때, 관절 연골을 조사 할 때 존재하지 않는 몇 가지 기술적 어려움을 극복 할 필요가있다 :
첫째, 조직 자체의 처리는 주로 콜라겐 유형 II로 구성된 균일 한 hyaline 연골보다 훨씬 더 도전적이다. IVD의 주요 섬유 성분은 콜라겐 타입 I로 얇은 히스토닉 섹션을 생성하기가 훨씬 더 어려워집니다. hyaline 관절 연골에서도 두꺼운 단면도 조직의 "유리와 같은"특성으로 인해 쉽게 분석 할 수 있지만, IVD의 콜라겐 타입 I 네트워크는 광학적으로 뚫을 수 없습니다. 이러한 이유로, 강한 배경 잡음은 IVD의 히스토로지에서 일반적인 문제입니다. 이 광학적으로 조밀 한 조직을 관통하는 빠르고 저렴한 방법은 예를 들어, 아포토메를 통해 광학 단면 장치의 사용입니다. 이러한 종말에서, 그리드는 기존의 형광 현미경의 조명 경로에 삽입된다. 그리드 앞에 평면 병렬 유리 판이 배치됩니다. 이렇게 하면 이미지의 그리드를 세 가지 다른 위치로 투영합니다. 각 z 위치에 대해 투영된 그리드가 있는 세 개의 원시 이미지가 만들어지고 중첩됩니다. 특수 소프트웨어를 통해 초점 표시등을 계산할 수 있습니다. 기본 원칙은 그리드가 보이면 해당 정보가 초점이 맞추어져 있지 않으면 초점이 맞춰져 있지 않다는 것입니다. 이 기술을 사용하면 집중력이 잘 되고 고해상도 이미지를 합리적인 시간 으로 획득할 수 있습니다.
둘째, 조직은 인간 기증자에게서 오기 어렵습니다. 총 무릎 교체를 할 때, 관절의 전체 표면은 수술 중 추가 분석을 위해 얻을 수있다. 이질관절의 골관절염은 전체 관절의 질병이기도 하지만, 그럼에도 불구하고 관절의 일부 영역이 여전히 손상되지 않은 연골의 질에 강한 초점 차이가 있다, 예를 들어 그 지역에 있는 감소 된 적재로 인해. 이 상황은 IVD에서 다르며, 수술은 일반적으로 디스크가 전 세계적으로 파괴 될 때만 수행됩니다. 수술실에서 인간 기증자로부터 조직을 획득할 때, 조직은 또한 고도로 단편화되고 추가 분석을 수행하기 전에 IVD의 3개의 연골 유형 중 하나에 조직을 정확하게 할당할 필요가 있다. 또한 더 큰 조직 섹션의 더 상세한 분석을 허용하고 IVD의 배아 발달을 조사하기 위해 동물 모델 유기체의 선택은, 따라서, 필요하다.
이러한 모델 유기체를 선택할 때 해부학 및 치수, 기계적 적재, 현재 세포 인구 및 조직 구성에 대해 인간 디스크와 유사한 시스템을 갖는 것이 중요합니다. 여기에 제시 된 기술의 목적을 위해 우리는 소 요추 디스크 조직의 사용을 제안 : 낮은 재생 잠재력의 결과로 인간 디스크의 중요한 속성은 핵에서 성숙하는 동안 노토 코드 세포의 손실입니다. 그러나, 수많은 모형 유기체에서 notochordal 세포는 그들의 일생 내내 오래 검출될 수 있습니다. 양, 염소 또는 연골 디스트로피개와 같은 노토코드 세포를 잃는 소수의 동물대부분은 인간의 디스크보다 훨씬 작은 IVD를 가지고 있습니다. 인간 IVDs15의것과 비교 가능한 처진 디스크 직경을 가진 요추 소 디스크만 존재한다.
초기 디스크 변성으로 이어지는 핵심 요소는 과도한 기계적 적재입니다. 요추 척추에 서있는 소의 무분별한 압력은 척추가 수평으로 정렬 된 약 0.8 MPa입니다. 놀랍게도 이러한 압력은 발립 인간 척추 (0.5 MPa)15,16에대해보고 된 요추 내 내 압력에 필적한다. 또한 소 디스크의 물과 프로테오글리칸의 양은 젊은인간(17)의IVD와 비슷하다. 따라서, 모션 세그먼트의 실제 이동 패턴은 바이페달 인간으로부터 쿼드러페달 동물에서 다를 수 있지만, 총 적재 및 디스크 특성에 대하여, 소는 양과 개와 같은 IVD에 대한 다른 확립된 동물 모델보다 인간 생물학에 훨씬 더 가깝습니다.
이 프로토콜에서 우리는 초기 배아 발달에서 종말 단계 변성까지 공간 연골세포 조직의 관점에서 IVD의 변화를 분석하는 방법을 기술을 제시한다.
프로토콜
배아 발달 및 성숙의 분석을 위해 소 디스크가 사용되었습니다. IVD의 변성을 평가하기 위해 인간 샘플을 분석하였다.
인간 IVD 조직은 정형 외과의 학과에서 요추 디스크 변성, 디스크 탈출, 또는 척추 외상을 위한 수술을 받은 환자에서 얻어졌습니다, 튀빙겐 대학 병원 및 BG 외상 센터 Tübingen. 전체 윤리위원회의 승인은 연구 개시 전에 얻어졌습니다 (프로젝트 번호 244/2013BO2). 서면 통보 된 동의는 참여하기 전에 모든 환자로부터 수신되었습니다. 이 방법은 승인된 지침에 따라 수행되었습니다.
소 조직은 보건 및 식품 안전 /Oberschleißheim에 대한 바이에른 주 사무소와 바르샤바 (독일)에있는 렌더링 공장에서 얻어졌다. 현지 및 수의학 당국의 승인은 죽은 동물로부터 조직에 대한 수신되었다.
1. 샘플 수확
- 인간 IVD 조직: 수술 중 에서 얻은 IVD 샘플을 DMEM(DMEM)에 즉시 배치하여 페니실린 연쇄절제술의 2%(v/v)와 추가 처리전까지 4°C에 저장합니다. 48 시간 이내에 조직을 처리합니다. 또는 조직을 -20°C에서 몇 주 동안 저장합니다.
- 소 IVD 조직 : 죽음 후 24 시간 이내에 동물에서 조직을 수확해야합니다.
죽은 동물 en-bloc에서 주변 척추로 소 디스크를 절제합니다. 냉동 조직을 드라이 아이스에 운반하고 추가 처리될 때까지 -20°C에 보관하십시오.
참고: 형광 분석만 의도되고 ELISA 또는 PCR과 같은 더 이상의 생화확적 정량화 방법이 계획되지 않은 경우, 아래에 설명된 바와 같이 조직 고정을 수행하십시오. 이것은 처리될 필요가 있기 전에 저장에 있는 조직을 더 오래 유지할 수 있습니다. 조직 매트릭스의 악화를 방지하기 위해, 조직이 직접 동결되지 않는 한 수확 후 48 시간 이내에 고정을 수행합니다.
2. 샘플 준비
- 실온에서 냉동 조직을 해동합니다. 조직의 디지털 부드러운 압축시 더 이상 얼음 결정을 느낄 수 없는 즉시 조직을 처리합니다.
참고 : 페트리 접시에 DMEM에서 조직의 준비를 수행합니다. - 콜라겐 밀도 및 방향과 같은 거시적 특성에 기초하여 인간 IVD 조직(항문 섬유증, 중간 영역, 핵 펄포소 또는 카르티라기 엔드플레이트)의 기원을 식별합니다.
- 두 개의 인접한 척추를 가진 소 IVD 디스크로 구성된 모션 세그먼트를 취하고 수술 블레이드(blade number 15)를 사용하여 부전건조증 뼈로부터 디스크 전체를 해부한다.
- 두 개의 해부학 적 집게를 사용하여 디스크를 뒤집어 더 중심영역에 도달합니다. 해부를 수행합니다. 핵 펄포서스는 항문보다 훨씬 얇고 찢어지기 쉽기 때문에 마지막으로 핵을 절제하고 쉽게 정의 된 방식으로 벗겨지지 않도록하십시오.
- 연골의 다른 영역을 식별합니다.
- 수술 블레이드(블레이드 번호 20 또는 22)를 사용하여 전체 디스크에서 관심 영역을 잘라냅니다. 또는 극저온 블레이드를 사용하십시오.
참고 : 소 디스크가 척추의 일부로 en-bloc에 올 때 디스크는 토토에서 준비 될 수 있습니다. 이렇게 하면 다양한 유형의 연골을 훨씬 쉽게 식별할 수 있습니다. 위에서 설명한 방식으로 디스크를 해부할 때, 카르티라기누스 엔드플레이트는 척추에 남아 있습니다. 이 지역을 조사해야 하는 경우, 약간 구부러진 접선 방향으로 작동하는 끌로 기본 뼈를 떼어 내는 것이 가장 좋습니다.
- 배아가 20cm 미만의 크라운 럼프 길이인 경우, IVD의 조직 아키텍처를 보존하기 위해 배아를 토토로 처리해야 합니다. 이러한 경우 척추의 해부를 수행하지 마십시오.
- 디스크가 토토에서 다정해지면 연골의 다른 영역을 식별합니다.
- 실온에서 에틸렌디아민테트라아세트산(EDTA)(EDTA)(20%(w/v); pH = 7.4)에서 탈하을 수행한다. 샘플 크기에 따라 볼륨을 선택 - 전체 조직은 EDTA로 잘 덮여 있어야합니다.
- 조직의 크기에 따라 최대 5 일 동안 갈 수있는 탈화 용액을 매일 변경합니다.
- 탈석화가 주목할만한 저항없이 척추를 관통하는 20 게이지 바늘로 성공했는지 확인하십시오.
참고: 탈석화 용액의 일상적인 변화는 반응 효과성을 유지하기 위해 포화에서 chelate 바인더 EDTA를 방지하는 것이 중요합니다. 그것은 또한 세균성 식민지를 방지.
3. 샘플 연령, 무결성 및 퇴행성 의 채점
- 인간 디스크 조직을 X선 및 자기 공명영상(도 3)뿐만아니라 임상 정보의 도움으로 5가지 범주 중 하나로 분류한다.
참고 : 카테고리 I : 급성 척추 외상에서 파생 된 IVD 변성의 방사선 징후없이 거의 건강한 샘플로 사용하십시오.
카테고리 II: 4주 미만의 임상 증상을 가진 환자로부터 중간 영역에서 퇴화를 시작으로 급성 염증의 상황을 설명한다.
카테고리 III: 염증 반응이 이미 조직과 세포에 영향을 미칠 시간이 있었다 상황을 설명하기 위해 핵 탈출을 위해 작동되었지만 4 주를 초과하는 증상 기간으로 조직복용 환자로부터 조직을 취합니다.
카테고리 IV: 중등디스크 퇴행성선택 항문분석기의 경우, 3 또는 4의 Pfirrmann 점수와 퇴행성 디스크 질환에 대한 신체 간 융합수술로부터 얻은 항문분석기(19).
카테고리 V: Pfirrmann 점수 가 5인 퇴행성 디스크 질환에 대한 신체 간 융합을 통해 수술에서 얻은 말기 퇴화 공정 용 항문. - 동물의 발달 단계/나이에 기초하여 소 조직을 표 1에표시된 대로 8가지 범주 중 하나로 분류한다.
- 켈러가 제안한 공식에 따라 배아의 크라운 럼프 길이에 임신 연령을 계산합니다.
몇 달 의 임신 연령 =
참고 : 임신 의 첫 4 주 동안 의 동물은 0.8-2.2cm20의크라운 럼프 길이와 함께 존재한다.
- 켈러가 제안한 공식에 따라 배아의 크라운 럼프 길이에 임신 연령을 계산합니다.
4. 조직 고정
- 시료를 10배(w/v) 포름알데히드 용액의 시료를 4°C에서 야간에 인산염 완충식식염(PBS)으로 고정한다.
참고: 포름알데히드 용액은 각 방향에서 약 1mm/시간의 속도로 조직에 침투합니다. 매우 작거나 매우 큰 샘플의 경우 노출 시간을 조정해야 할 수 있습니다. - 추가 처리될 때까지 PBS에 조직을 4°C로 저장합니다.
5. 히토로지학적 단면
- 극저온 손잡이에 수용성 포함 매체에 샘플을 포함.
- 축 평면이 생성되거나 콜라겐 유형 I lamellae 수직(예: 중앙분리대 절개 평면)을 절단하는 평면이 발생하도록 노브에 조직을 배치합니다.
참고: 조직은 내장 매체에 의해 완전히 가려져야 합니다.
- 축 평면이 생성되거나 콜라겐 유형 I lamellae 수직(예: 중앙분리대 절개 평면)을 절단하는 평면이 발생하도록 노브에 조직을 배치합니다.
- 표준 극저온을 사용하여 인간 샘플에서 70 μm 의 두께와 소 샘플에서 40 μm의 두께로 임베디드 조직을 섹션.
참고: 단면 두께의 차이는 손상되지 않은 소 디스크와 매우 퇴화된 인간 조직 사이의 조직 무결성의 차이 때문입니다. - 유리 슬라이드의 섹션을 수집합니다.
- 소수성 펜으로 조직 섹션을 둘러싸습니다.
- 인산염 완충식식염수(PBS)로 3번 헹구어 수용성 포함 매체를 제거한다.
6. 형광 염색
- PBS에서 1% (v/v) DAPI (Exmax 358 nm, Emmax 461 nm)의 60 μL과 PBS의 액틴 트래킹 스테인팅 (Exmax 540 nm, Emmax 565 nm)의 1 % (v / v)를 추가하고 실온에서 5 분 동안 인큐베이트하십시오.
참고: 여기서 설명된 염색 프로토콜은 액틴 트래킹 스테인(red)을 사용하여 DAPI 핵 염색(blue) 및 세포질을 사용하여 핵을 시각화하는 것이다. IVD는 녹색 채널의 콜라겐 섬유로 인해 강한 자동 형광을 가지고 있습니다. 이 프로토콜의 섹션에 추가된 유체의 양은 약 5mm x 5mm 크기의 섹션을 위한 것입니다. 더 큰 섹션의 경우 이 금액을 그에 따라 늘려야 합니다. 직사광선 노출 없이 방의 모든 작품을 수행하고 염료표백을 방지하기 위해 희미한 조명으로 수행합니다. - 피펫으로 염색 유체를 제거하고 매번 PBS의 60 μL로 세 번 세척하십시오.
- 적절한 마운팅 매체를 추가하고 커버 슬립으로 섹션을 덮습니다.
참고: 커버 슬립을 추가할 때 포기가 묶여 있지 않은지 확인합니다. 이것은 한 테두리에 슬라이드와 슬립의 접촉을 시작하고 미끄러질 천천히 내려 놓는 것이 가장 좋습니다.
7. 현미경 이미징 및 처리
- 현미경의 샘플 홀더에 스테인드 섹션이 있는 슬라이드를 놓습니다.
참고: IVD의 조밀한 콜라겐 타입 I 네트워크로 인해, 산란된 빛은 기존의 형광 현미경 을 사용하여 조직을 시각화하기 어렵게 만든다. 이 문제를 해결하는 한 가지 방법은 구조화 된 조명을 사용하여 광학 단면을 수행하는 것입니다. 또한 두 채널(파란색과 빨간색)에서 전체 시편의 3차원 프로젝션을 렌더링할 수 있습니다. 이는 구조화된 조명 설정과 10배율 배율 목표 렌즈를 사용한 모자이크 모드를 사용하여 샘플의 개요와 개별 패턴의 3D 재구성을 얻는 것이 가장 좋습니다. - 구조화 된 조명 장치를 시작합니다.
- 적합한 형광 현미경, 형광 필터 및 적절한 조명으로 단일 시야 이미징을 수행하십시오.
참고: 이미징 수집을 표준화하기 위해 사용되는 모든 필터의 노출 시간을 조정합니다. 더 높은 해상도의 이미지에서 시편의 정확한 표현을 얻으려면 배율이 높은 섹션(예: 20배 목표). - 형광 현미경과 호환되는 이미지 최적화 소프트웨어를 사용하여 강도와 밝기를 최적화하여 사진을 후처리합니다.
- 적합한 형광 현미경, 형광 필터 및 적절한 조명으로 단일 시야 이미징을 수행하십시오.
- 전체적으로 섹션을 시각화하려면 모자이크 이미징 기술을 사용
- 도구 모음 패널에서 획득 설정(6D-수집을 누릅니다)을 엽니다.
- 모자이크 설정(MosaiX Register)을조정하고 나중에 하나의 개요 이미지로 병합해야 하는 뷰 필드 이미지의 열 수와 행을 정의합니다.
- 설정을 누르고 개별 타일의 초점 보정을 조정합니다.
참고: 큰 조직 섹션이 단일 초점 평면에 전체 조직 표면을 갖는 것은 거의 불가능합니다. 다양한 초점 레벨의 이미지 타일은 '모사이X 인수'로 촬영할 수 있습니다. - 이미지 타일의 수집을 시작하려면 시작하십시오.
- 소프트웨어에 20%의 중복이 통합된스티치 기능(스티치 버튼)을 사용하여 이미지 타일을 스티치합니다.
- 형광 현미경과 호환되는 이미지 최적화 소프트웨어를 사용하여 강도와 밝기를 최적화하여 사진을 후처리합니다.
- 공간 연골 세포 조직을 분석하려면 소프트웨어에 통합된 3D 기능을 사용합니다.
- z 스택 설정을 조정합니다. 스캔 매개 변수 정의: 시작/중지 버튼을 활성화하여 z축의 시작 및 중지 위치와 슬라이스 거리를 정의합니다.
참고: 소프트웨어는 슬라이스 수를 자동으로 계산합니다. - 이미지 z 스택의 수집을 시작하려면 시작(Start)을누릅니다.
- 형광 현미경과 호환되는 이미지 최적화 소프트웨어를 사용하여 강도와 밝기를 최적화하여 사진을 후처리합니다.
- z 스택 설정을 조정합니다. 스캔 매개 변수 정의: 시작/중지 버튼을 활성화하여 z축의 시작 및 중지 위치와 슬라이스 거리를 정의합니다.
- 이미지 처리 소프트웨어와 호환되는 파일 형식으로 사진을 내보냅니다.
참고: 3D 재구성을 개별 이미지 또는/및 대화형 3D 모델 또는 비디오 형식으로 내보냅니다.
8. 셀룰러 패턴 식별 및 밀도 평가
- 적절한 이미지 처리 프로그램에서 전체 조직 섹션의 수출 모자이크 사진을 엽니다.
- 사진에서 500 μm x 500 μm의 관심 영역을 정의하여 세포 밀도 평가를 받는 영역을 정의합니다.
참고: 적절한 이미지 품질이 없는 모든 타일은 분석에서 제외됩니다. - 개별 셀룰러 패턴을 식별합니다.
참고: 단일 셀은 개별 셀로 정의됩니다 - 인접 한 행렬 내에서 완전히 캡슐화됩니다. 쌍은 가까운 근접 (<25 μm)에서 두 개의 인접 세포로 정의되며, 이에 따라 세포는 행렬을 통해 상호 연결됩니다 (그림 2참조). 현악 형성은 적어도 3개의 연골세포가 선로 정렬된다(핵<25 μm의 중간에서). 이러한 세포는 그대로 행렬에 의해 포위되고 매트릭스 상호 연결은 각 셀 사이에 볼 수 있다. 클러스터는 서로 직접 근접(<25 μm)에 위치하고 매트릭스가 없는 대형 라쿠나에 캡슐화된 다중 셀을 나타냅니다. - 셀룰러 패턴의 정량적 분석을 위해 셀 카운트 플러그인을 사용합니다.
참고: 세포질 염색은 다양한 공간 패턴을 식별하는 검증 방법을 나타냅니다. - 계산된 셀을 선택한 관심 영역의 크기로 나누어 세포 밀도를 계산합니다.
결과
모자이크 이미지를 사용하여, 항문 및 부드러운 핵에 조밀 한 콜라겐 섬유 네트워크를 가진 IVD의 아키텍처는 명확하게 인식 될 수있다(도 4). 세포 밀도의 지속적인 감소는 배아 발달 중에 관찰될 수있다(도 5). IVD의 초기 단계에서는 소 항문 섬유증에서 11,435 세포/mm²의 세포 밀도를 발견할 수 있지만 소 핵 펄포서스의 세포/mm²는 발견될 수 있지만, 이 숫자는 1,011세포/mm²(소 항성섬유서스)와 488개의 세포(모공포스)까지 급격히 감소한다. 성인 가축에서 71 세포/mm² (항문 섬유증) 수고. 106 세포/mm² (핵 펄포푸스)가 보입니다(도 6 A-B). 아포토메와 함께 이중 채널 이미징을 사용하면 공간 패턴의 3D 아키텍처를 시각화할 수있습니다(그림 7).
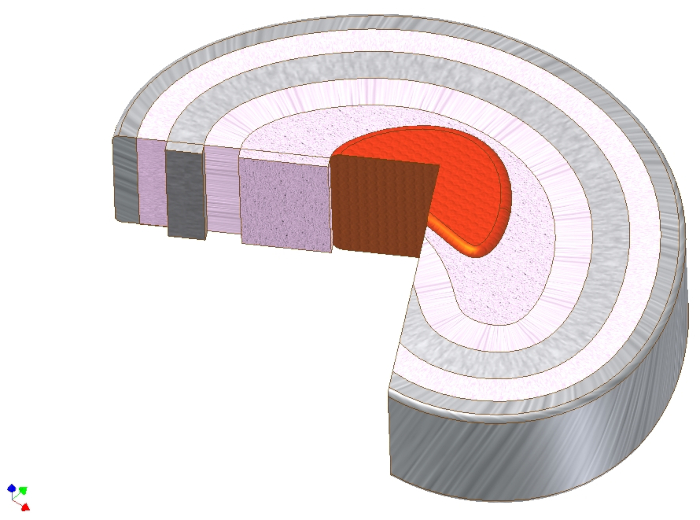
그림 1. 무척추 디스크의 매크로 해부학. 핵 펄포서스 (빨간색)를 보여주는 추간판의 회로도 도면, 바로 그 주위에 중간 영역 (분홍색), 그리고 그 주위에 원형 층에서 항문 섬유. 항문 섬유증내의 콜라겐 타입 I 섬유의 합각 방향을 유의한다. 핵에 축 부하는 따라서 콜라겐 섬유의 축 인장력으로 변환될 수 있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
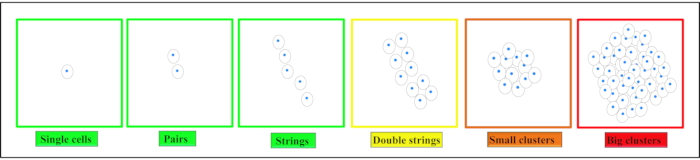
그림 2. 연골세포의 다양한 공간 조직 패턴의 회로도 그림. 조직에 따라 연골 세포는 건강한 연골에서 단일 세포, 쌍 또는 문자열로 발견됩니다. 시작 변성으로 이러한 패턴은 이중 문자열, 작은 클러스터 및 끝 단계 변성에서 큰 클러스터를 형성하도록 변경됩니다. 이 수치는 다나락체, M. 외21에서수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
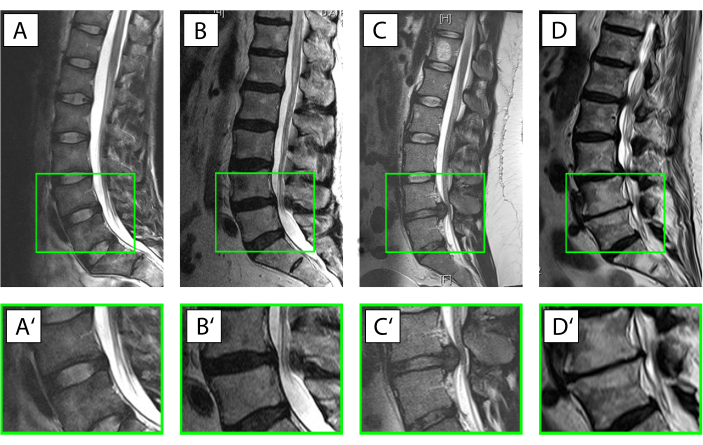
그림 3. 추간판(IVD)의 상이한 조건. (A-D') 궁극 T2 가중 자기 공명 화상 진찰 인간 요추 척추(A-D),확대 된 모션 세그먼트 L4/L5(A'-D'). 환자의 복부 면은 왼쪽에 직면, 등쪽 측면은 뇌척수액에 대한 흰색 신호와 척추 운하와 오른쪽으로 직면. (A,A') 상량성 IVD는 상한콜라겐 타입 I 함량및 핵으로 인해 저심탄성(black) 신호로 표시된 무온IVD는 수결합 프로테오글리칸(Pfirrmann grade19 I)의 함량이 높기 때문에 훨씬 더 밝아진(hyperintense)을 나타냈다. (B,B') 핵 펄포서스로부터 의 수신호의 손실과 항문과 핵 사이의 구별이 손실되는 경우(Pfirrmann 등급19 IV)를 상실하여 IVD 변성을 시작한다. (C,C') 핵 의 영역에서 여전히 눈에 띄는 물 신호와 급성 핵 탈출 그렇지 않으면 그대로 IVD와 척추 운하로 돌출 디스크 조직에 대한 표시. (D,D') V. Pfirrmann 등급19에 대응하는 척추의 디스크, 복부 및 등쪽 척추 형성 및 아전통 경화증 내의 물 신호의 완전한 손실과 함께 크게 파괴 된 IVD를 가진 고급 디스크 변성은이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
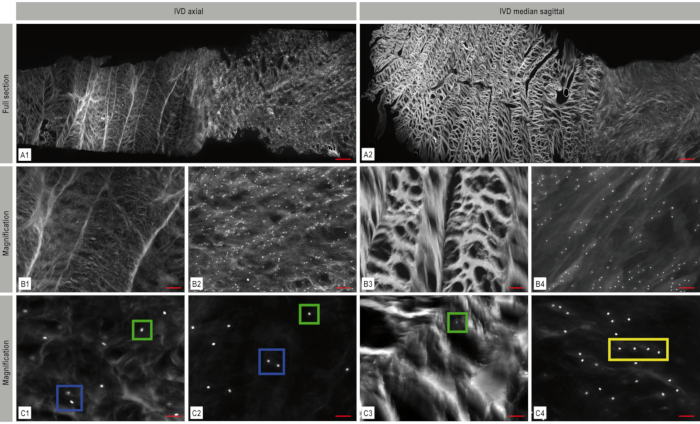
그림 4. 추간판(IVD)의 모자이크 형광 이미징. 항문 섬유증 및 부드러운 핵에 있는 그것의 조밀한 콜라겐 섬유 네트워크를 가진 IVD의 건축은 명확하게 인식될 수 있습니다. 축(A1)및 처탈(A2) 평면에서 DAPI-핵 염색(white)은 IVD 내의 세포 분포 및 배열을 나타낸다. 이 경우 단일 셀(녹색 상자), 쌍(파란색 상자) 및 문자열(노란색 상자)을 보여주는 B1-B4 및 C1-C4에 확대된 대표 영역이 표시됩니다. A: 스케일 바 1,000 μm, B1-B4: 스케일 바 200 μm, C1-C4: 스케일 바 : 50 μm. 이 수치는 보네르, F.C. 외22에서수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5. 소 항문 섬유증 및 인간 퇴행성 항문 섬유증의 다른 발달 및 성숙 단계. DAPI 핵 염색. 모자이크 이미지는 축 단면(A1)에서 전체 초기배아 디스크를 나타내고 배아 발달, 성숙 및 시작 변성(A2-A8)에서소 항문 항문의 대표적인 이미지를 보여준다. (B1-B3) 인간 IVDs로부터 항문항은 수술 불능으로 얻어졌다. 배아 디스크 개발 중에 세포 밀도가 지속적으로 감소하는 것을 관찰할 수 있다. 더 높은 공간 조직 세포 패턴은 출생의 주위에 특히 존재하는 것처럼 보입니다. 변성 중 성인 인간 디스크에서, 세포 밀도가 다시 증가하고 클러스터 형성을 증가 관찰할 수 있다. 스케일 바 100 μm. Wog: 임신 몇 주. 이 수치는 보네르, F.C. 외22에서수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6. 소 추간판의 발달과 성숙을 통해 세포 밀도의 감소. mm² 당 평균(표준 편차) 세포 수는 소 항문섬유증(A)및 소 핵 펄포서스(B)에대한 바 다이어그램에 의해 도시된다. 세포 밀도의 명확한 감소는 디스크의 전체 성숙까지 적어도 적은 정도로 계속되는 배아 기간 동안 특히 관찰될 수 있다 (n=72). Wog: 임신 몇 주. 이 수치는 보네르, F.C. 외22에서수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
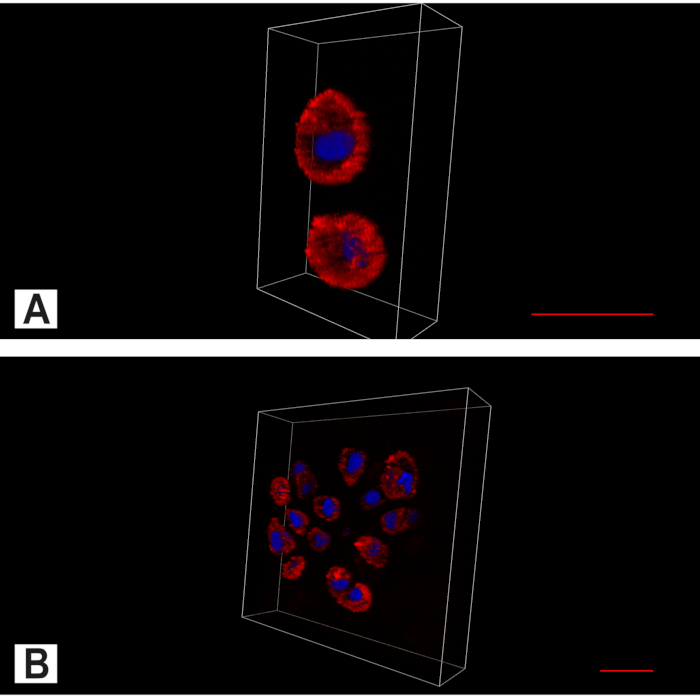
그림 7. 추간판(IVD)의 심근 이미징. 세포질(빨강, 액틴 염색) 및 핵(파란색, DAPI 핵 염색)을 보여주는 바이채널 이미지. (A)그대로 IVD에서 단일 연골세포의 지배적인 공간 패턴 외에도 쌍도 발견된다. (B)퇴화된 항문 세포 군집을 찾을 수 있다. 스케일 바 20 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
비디오 1. 3D 모델로 추간판(IVD)에서 쌍의 종말 이미징. 쌍의 세포질(빨강, 액틴 염색) 및 핵(파란색, DAPI 핵 염색)을 보여주는 이중 채널 이미지. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
비디오 2. 3D 모델로 추간판(IVD)에 있는 클러스터의 종말 영상. 클러스터의 세포질(빨강, 액틴 염색) 및 핵(파란색, DAPI 핵 염색)을 보여주는 바이채널 이미지. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
표 1: 소 배아 발달, 성숙 및 출생 후 의 다른 이정표와 함께 성장. Wog - 임신 의 주. 임신 기간 ca. 283 일, 자연 평균 수명 20-25 년20,23, 24. 이 테이블을 다운로드하려면 여기를 클릭하십시오.
토론
모자이크 이미징 및 광학 단면에 의해 증강된 형광 현미경법을 사용하여, 개발, 성숙 및 변성을 통해 요추 IVD의 항문에서 연골 세포의 공간 배열을 평가했습니다. 퇴행성 조직은 디스크 퇴화를 위한 척추 수술을 받은 환자로부터 수확될 수 있지만, 배아 기간 및 성숙 단계의 분석은 모형 유기체(소)의 사용을 요구하였다. 높은 세포 밀도는 초기 배아 발달 도중 항문에서 주의되었습니다. 개발의 추가 과정에서, 산후 성장 및 성숙 세포 밀도에 있는 뚜렷한 감소를 관찰할 수 있었습니다. 진보된 디스크 변성을 가진 인간 조직에서, 우리는 그 때 항문 섬유증에 있는 세포 밀도에 있는 증가를 정량화할 수 있었습니다.
적극적으로 분할 및 생합성 활성 노토코드 세포와 결합된 조직 부피의 급속한 증가는배아(25)에서관찰되는 세포 밀도의 변화에 대한 가능성이 있다. 그러나 변성으로 세포 밀도가 다시 증가하는 메커니즘은 여전히 불분명합니다. 항문의 퇴행성 공정은 조직 내발성 및 염증 증가, 매트릭스 분해 효소 및 성장 인자 생산의 상향 조절, 세포성26,27,28의변화 등 일련의 병리학적 변화로 이어진다.
관절 연골7에서알려진 패턴을 기반으로 세포 공간 조직의 기능으로 세포 존재를 고려할 때7,9 우리는 세포가 조밀하게 포장되는 것처럼 보이며 단일 세포(22)로존재하는 것으로 간주 초기 배아 디스크에서 인식 할 수있는 공간 조직을 발견하지 못했다. 이 발견은 배아 관절 연골7의결과와 일치한다. 건강한 성숙한 항문에서, 단하나 세포는 우세한 공간패턴(22)을나타낸다. 그러나 쌍및 문자열 형성은22를관찰할 수도 있습니다. 인간 디스크에서 조직을 더 퇴화시킬수록클러스터(22)에서찾을 수 있는 세포의 비율이 높다. 관절 연골7,9,29에서 Rolauffs에 의해 제안된 생리병리학 모형은 우리의 사실 인정에 흥미로운 유사성을 보여줍니다. IVD 변성에 대한 이전 연구는 이미 디스크 변성의 특징으로 클러스터 형성을 설명했다14,30,31,32, 33. 이러한 클러스터는 대부분 고분해성 조직에서 발견될 수 있기 때문에 클러스터 형성은 퇴행성손상(34)을복구하기 위한 조직의 실패한 시도를 나타낼 수 있다. 국소 우세한 연골세포 패턴과 조직 탄성 사이의 강한 상관관계를 확립하고, 이러한 패턴의 높은 기능적 관련성은 관절연골(10,11)에서입증될 수 있다. 이러한 기능적 관련성도 IVD의 공간 연골세포 조직에도 적용된다고 추측할 수 있다.
형광 조직학적 분석은 조직에 대한 형태학적 변화를 분석하는 매력적인 수단이 될 수 있습니다. IVD를 조직학적으로 분석하려고 할 때, 극복해야 할 뚜렷한 기술적 어려움이 있습니다: 첫째, 인간 조직의 제한된 가용성은 인간의 샘플을 얻을 수 없는 곳에 질병의 그 양상을 연구할 수 있는 적당한 동물 모형 유기체를 선택하는 것이 중요합니다. 이 연구에서 해결 된 연구 질문에 대 한, 우리는 소 동물 모델을 선택.
둘째, 콜라겐 타입 I-rich IVD의 처리는 대부분의 그밖 인간 조직에 보다는 훨씬 더 도전적입니다. 조밀한 콜라겐 타입 I-섬유 네트워크는 형광을 강하게 분산시켜 높은 배경 잡음 신호를 생성합니다. 이 문제는 이러한 배경 신호를 빼거나 제거 할 수있는 기술을 사용하여 가장 잘 해결됩니다. 이렇게 하는 잘 알려진 방법은 공초점 현미경 검사법입니다. 공초점 취득 레이저 이미지의 이미지 품질은 일반적으로 우수하지만, 이 기술의 단점은 상대적으로 시간이 많이 소요되고 따라서 모자이크 이미징을 통해 더 큰 조직 영역의 분석을 허용하지 않는다는 것입니다. 둘째로 공초점 현미경은 상대적으로 비싸고 어디서나 사용할 수 없습니다. 배경 노이즈를 필터링하는 훨씬 빠르고 저렴한 방법은 Apotome을 통해 광학 단면을 수행하는 것입니다.
사실 인정을 정확하게 해석할 수 있기 위하여는, 또한 IVD에 있는 그것의 기원으로 분석될 조직을 정확하게 할당하는 것이 필수적입니다. 이 작업은 전체 소 디스크에서 선택할 때 상대적으로 간단하지만 수술 극장에서 인간의 조직을받을 때 매우 어려울 수 있습니다. 골문 섬유증의 특징은 매우 조밀한 콜라겐 타입 I 가 각-ply 섬유 방향으로 네트워크된다. 반면 핵은 더 높은 콜라겐 아키텍처가 육안으로 볼 수 없는 비정질 젤라틴 구조입니다. 중간 영역은 그 두 극자 사이에 자리 잡고 또한 명확한 콜라겐 섬유 아키텍처를 소유하지만, 그것은 훨씬 부드럽고 항문 섬유증보다 덜 조밀하다. 카르틸라기 종판은 히알린 연골로 구성되어 있으며, 육안으로 인식할 수 있는 콜라겐 아키텍처가 존재하지 않지만 "hyaline"이라는 용어가 암시하는 것처럼 오히려 "유리와 같은"입니다. 핵 과는 달리, 그러나, 또한 매우 뻣뻣하고 변형 될 수 없으며, 종종 조직의 검사에 의해 여전히 인식 될 수있는 아천장 골에 위치한다.
조직 기원이 올바르게 확인되면, 조직은 여전히 적절한 질적 및 정량적 판독을 허용하는 표준화 된 이미지를 얻기 위해 단면에 대해 올바르게 지향해야합니다. 자기 공명 화상 진찰과 같은 그밖 화상 진찰 기술에 방향에서 우리는 2개의 표준 분석 평면을 건의합니다: 1개의 중앙위부 부와 축 평면에 하나. 이 두 비행기는 또한 항문의 콜라겐 형 I-섬유 네트워크의 아키텍처에 대한 좋은 인상을 제공합니다. F-actin 염색으로부터 얻은 연구 결과를 해석할 때 조직 샘플의 동결은 사이토스켈레탈 구조 변경을 일으킬 수 있음을 명심해야 하지만, 공간 연골세포 조직에는 영향을 미치지 않아야 한다.
IVD의 세포 생물학을 완전히 이해하기 위해 디스크 변성 및 재생36에대한 우리의 이해에 여전히 열려있는 도전 중 하나입니다. 때때로 건강한 조직에 있는 세포의 생리적 배열 또는 변성 도중 세포 재구성의 질문과 같이 사소한 것처럼 보이는 질문은, 현재까지, 대답되지 않은 남아 있습니다. 획득된 지식은 우리가 조직 질을 평가하고, 클러스터 형성의 가역성을 조사하고, 따라서 퇴행성 프로세스가 여전히 성공적으로 표적으로 할 수 있는 치료 창을 정의하기 위하여 이 심상 기지를 둔 변성 마커를 사용할 수 있게 할 수 있습니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
우리는 그들의 도움과 지원에 대한 원래 출판물에서 우리의 공동 저자에게 감사드립니다. 우리는 종말 이미지를 취득하는 데 도움 샬롯 엠마 밤버거 감사합니다.
자료
| Name | Company | Catalog Number | Comments |
| Amphotericin B | Merck KGaA, Germany | A2942 | |
| Adhesion Microscope Slides SuperFrost Plus | R. Langenbrinck, Germany | 03-0060 | |
| ApoTome | Carl Zeiss MicroImaging GmbH, Germany | 462000115 | |
| AxioVision Rel. 4.8 with Modul MosaiX | Carl Zeiss MicroImaging GmbH, Germany | ||
| CellMask Actin Tracking Stain | Thermo Fischer Scientific, US | A57249 | |
| Cryostat | Leica Biosystems, US | CM3050S | |
| DAPI | Thermo Fischer Scientific, US | D1306 | |
| Dulbecco's modified Eagle's medium (DMEM) | Gibco, Life Technologies, Germany | 41966052 | |
| Ethylenediaminetetraacetic acid | Sigma-Aldrich, US | 60004 | |
| Fluorescence Miscoscope - Axio Observer Z1 with Axio Cam MR3 and Colibri | Carl Zeiss MicroImaging GmbH, Germany | 3834000604 | |
| Formaldehyde | Merck KGaA, Germany | 104002 | |
| Image J 1.53a, with Cell counter plugin | National Insittute of Health (NIH), US | ||
| Invitrogen Alexa Fluor 568 Phalloidin | Thermo Fischer Scientific, US | A12380 | |
| Microscopic Cover Glasses | R. Langenbrinck, Germany | 01-1818/1 | |
| PAP Pen Liquid Blocker | Science Sevices GmbH, Germany | N71310 | |
| Penicillin-Streptomycin | Sigma-Aldrich, US | P4333 | |
| Phosphate buffered saline | Sigma-Aldrich,US | P5119 | |
| Scalpel | pf medical AG, Germany | 2023-01 | |
| Tissue-tek O.C.T. Compound | Sakura Finetek, Netherlands | SA6255012 |
참고문헌
- Urban, J. P. G., Roberts, S. Degeneration of the intervertebral disc. Arthritis Research and Therapy. 5 (3), 120-130 (2003).
- Gupta, K. B., Duryea, J., Weissman, B. N. Radiographic evaluation of osteoarthritis. Radiologic Clinics of North America. 42 (1), 11-41 (2004).
- Pye, S. R., et al. Lumbar disc degeneration: association between osteophytes, end-plate sclerosis and disc space narrowing. Annals of the Rheumatic Diseases. 66 (3), 330-333 (2007).
- Humzah, M. D., Soames, R. W. Human intervertebral disc: structure and function. The Anatomical Record. 220 (4), 337-356 (1988).
- Schumacher, B. L., Su, J. L., Lindley, K. M., Kuettner, K. E., Cole, A. A. Horizontally oriented clusters of multiple chondrons in the superficial zone of ankle, but not knee articular cartilage. The Anatomical Record. 266 (4), 241-248 (2002).
- Rolauffs, B., Williams, J. M., Grodzinsky, A. J., Kuettner, K. E., Cole, A. A. Distinct horizontal patterns in the spatial organization of superficial zone chondrocytes of human joints. Journal of Structural Biology. 162 (2), 335-344 (2008).
- Felka, T., et al. Loss of spatial organization and destruction of the pericellular matrix in early osteoarthritis in vivo and in a novel in vitro methodology. Osteoarthritis and Cartilage. 24 (7), 1200-1209 (2016).
- Rolauffs, B., et al. Onset of preclinical osteoarthritis: the angular spatial organization permits early diagnosis. Arthritis and Rheumatism. 63 (6), 1637-1647 (2011).
- Aicher, W. K., Rolauffs, B. The spatial organization of joint surface chondrocytes: review of its potential roles in tissue functioning, disease and early, preclinical diagnosis of osteoarthritis. Annals of the Rheumatic Diseases. 73 (4), 645-653 (2014).
- Danalache, M., Jacobi, L. F., Schwitalle, M., Hofmann, U. K. Assessment of biomechanical properties of the extracellular and pericellular matrix and their interconnection throughout the course of osteoarthritis. Journal of Biomechanics. 97, 109409(2019).
- Danalache, M., et al. Changes in stiffness and biochemical composition of the pericellular matrix as a function of spatial chondrocyte organization in osteoarthritic cartilage. Osteoarthritis and Cartilage. 27 (5), 823-832 (2019).
- Tschaikowsky, M., et al. Proof-of-concept for the detection of early osteoarthritis pathology by clinically applicable endomicroscopy and quantitative AI-supported optical biopsy. Osteoarthritis and Cartilage. 29 (2), 269-279 (2021).
- Ciapetti, G., et al. Ex vivo observation of human intervertebral disc tissue and cells isolated from degenerated intervertebral discs. European Spine Journal: Official Publication of the European Spine Society, the European Spinal Deformity Society and the European Section of the Cervical Spine Research Society. 21, Suppl 1 10(2012).
- Johnson, W. E., Eisenstein, S. M., Roberts, S. Cell cluster formation in degenerate lumbar intervertebral discs is associated with increased disc cell proliferation. Connective Tissue Research. 42 (3), 197-207 (2001).
- Buttermann, G. R., Beaubien, B. P., Saeger, L. C. Mature runt cow lumbar intradiscal pressures and motion segment biomechanics. The Spine Journal: Official Journal of the North American Spine Society. 9 (2), 105-114 (2009).
- Wilke, H. J., Neef, P., Caimi, M., Hoogland, T., Claes, L. E. New in vivo measurements of pressures in the intervertebral disc in daily life. Spine. 24 (8), Phila Pa. 755-762 (1999).
- Demers, C. N., Antoniou, J., Mwale, F. Value and limitations of using the bovine tail as a model for the human lumbar spine. Spine. 29 (24), Phila Pa. 2793-2799 (2004).
- Hofmann, U. K., et al. Chondrocyte death after mechanically overloading degenerated human intervertebral disk explants is associated with a structurally impaired pericellular matrix. Journal of Tissue Engineering and Regenerative Medicine. 12 (9), 2000-2010 (2018).
- Pfirrmann, C. W., Metzdorf, A., Zanetti, M., Hodler, J., Boos, N. Magnetic resonance classification of lumbar intervertebral disc degeneration. Spine. 26 (17), Phila Pa. 1873-1878 (2001).
- Habermehl, K. H. Die Altersbestimmung bei Haus- und Labortieren. , Paul Parey. Berlin, Hamburg. (1975).
- Danalache, M., Erler, A. L., Wolfgart, J. M., Schwitalle, M., Hofmann, U. K. Biochemical changes of the pericellular matrix and spatial chondrocyte organization-Two highly interconnected hallmarks of osteoarthritis. Journal of Orthopaedic Research: Official Publication of the Orthopaedic Research Society. 38 (10), 2170-2180 (2020).
- Bonnaire, F. C., et al. The intervertebral disc from embryonic development to disc degeneration: insights into spatial cellular organization. The Spine Journal: Official Journal of the North American Spine Society. (21), 00198(2021).
- Vieira-Neto, A., Galvao, K. N., Thatcher, W. W., Santos, J. E. P. Association among gestation length and health, production, and reproduction in Holstein cows and implications for their offspring. Journal of Dairy Science. 100 (4), 3166-3181 (2017).
- Ott, A. Die Entwicklung des schwarzbunten Niederungsrindes von der Geburt bis zum 5. Lebensjahr mit variationsstatistischen Untersuchungen einer Population solcher Rinder von der Geburt bis zum 3. Lebensjahr. Zeitschrift für Tierzüchtung und Züchtungsbiologie. 45 (3), 259-308 (1940).
- Urban, J. P. G., Roberts, S., Ralphs, J. R. The Nucleus of the Intervertebral Disc from Development to Degeneration1. American Zoologist. 40 (1), 53-61 (2000).
- Risbud, M. V., Shapiro, I. M. Role of cytokines in intervertebral disc degeneration: pain and disc content. Nature Reviews. Rheumatology. 10 (1), 44-56 (2014).
- Iatridis, J. C., Michalek, A. J., Purmessur, D., Korecki, C. L. Localized intervertebral disc injury leads to organ level changes in structure, cellularity, and biosynthesis. Cell and Molecular Bioengineering. 2 (3), 437-447 (2009).
- Torre, O. M., Mroz, V., Bartelstein, M. K., Huang, A. H., Iatridis, J. C. Annulus fibrosus cell phenotypes in homeostasis and injury: implications for regenerative strategies. Annals of the New York Academy of Sciences. 1442 (1), 61-78 (2019).
- Rolauffs, B., et al. Proliferative remodeling of the spatial organization of human superficial chondrocytes distant from focal early osteoarthritis. Arthritis and Rheumatism. 62 (2), 489-498 (2010).
- Johnson, W. E., Roberts, S. Rumours of my death may have been greatly exaggerated': a brief review of cell death in human intervertebral disc disease and implications for cell transplantation therapy. Biochemical Society Transactions. 35, Pt 4 680-682 (2007).
- Roberts, S. Disc morphology in health and disease. Biochemical Society Transactions. 30, Pt 6 864-869 (2002).
- Lama, P., Kulkarni, J., Tamang, B. The role of cell clusters in intervertebral disc degeneration and its relevance behind repair. Spine Research. 03, 15(2017).
- Sharp, C. A., Roberts, S., Evans, H., Brown, S. J. Disc cell clusters in pathological human intervertebral discs are associated with increased stress protein immunostaining. European Spine Journal: Official Publication of the European Spine Society, the European Spinal Deformity Society and the European Section of the Cervical Spine Research Society. 18 (11), 1587-1594 (2009).
- Freemont, A. J. The cellular pathobiology of the degenerate intervertebral disc and discogenic back pain. Rheumatology. 48 (1), Oxford. 5-10 (2009).
- Müllers, Y., et al. Quantitative analysis of F-actin alterations in adherent human mesenchymal stem cells: Influence of slow-freezing and vitrification-based cryopreservation. PLoS One. 14 (1), 0211382(2019).
- McCann, M. R., Séguin, C. A. Notochord cells in intervertebral disc development and degeneration. Journal of Developmental Biology. 4 (1), 3(2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유