Method Article
Optische Schnittung und Visualisierung der Bandscheibe von der Embryonalentwicklung bis zur Degeneration
In diesem Artikel
Zusammenfassung
Wir stellen eine Methode vor, um die räumliche Chondrozytenorganisation im Anulus fibrosus der Bandscheibe mit einer optischen Schnittmethode zu untersuchen.
Zusammenfassung
Die Degeneration der Bandscheibe (IVD) ist eine der Hauptursachen für Rückenschmerzen und bringt für die Betroffenen eine hohe Beeinträchtigung mit sich. Um die Bandscheibendegeneration zu entschlüsseln und regenerative Ansätze entwickeln zu können, ist ein gründliches Verständnis der Zellbiologie der IVD unerlässlich. Ein Noch unbeantworteter Aspekt dieser Biologie ist die Frage, wie Zellen in einem physiologischen Zustand und während der Degeneration räumlich angeordnet sind. Die biologischen Eigenschaften der IVD und ihre Verfügbarkeit erschweren die Analyse dieses Gewebes. Die vorliegende Studie untersucht die räumliche Chondrozytenorganisation im Anulus fibrosus von der frühen Embryonalentwicklung bis zur Degeneration im Endstadium. Eine optische Schnittmethode (Apotom) wird angewendet, um hochauflösende Färbeanalysen unter Verwendung von embryonalem Rindergewebe als Tiermodell und menschlichem Bandscheibengewebe von Patienten durchzuführen, die sich einer Wirbelsäulenoperation unterziehen. Von einer sehr hohen Chondrozytendichte in der frühen embryonalen Rinderscheibe nimmt die Anzahl der Zellen während der Schwangerschaft, des Wachstums und der Reifung ab. Bei menschlichen Bandscheiben begleitete eine Zunahme der Zelldichte das Fortschreiten der Gewebedegeneration. Wie bereits im Gelenkknorpel gezeigt wurde, stellt die Clusterbildung ein charakteristisches Merkmal der fortgeschrittenen Bandscheibendegeneration dar.
Einleitung
Die Bandscheibe (IVD) ist eine knorpelbasierte Struktur, die biochemisch und in Bezug auf die Zellarchitektur auf den ersten Blick in vielerlei Hinsicht dem Gelenkknorpel1ähnelt. Tatsächlich sind sowohl die IVD-Degeneration als auch die Osteoarthritis (OA) des Gelenkknorpels durch Gelenkraumverengung aufgrund von Knorpelverschleiß, subchondraler Zysten- und Osteophytenbildung und subchondraler Sklerose gekennzeichnet2,3. Trotz dieser scheinbaren Ähnlichkeiten unterscheiden sich Architektur und funktionelle Rolle beider Gewebe. Während die Matrix des Gelenkknorpels hauptsächlich aus einem arkadenbildenden Kollagen-Typ-II-Netzwerk besteht, besteht die IVD aus drei verschiedenen Gewebetypen: Der Kollagen-Typ-II-reiche Nucleus pulposus in der Mitte nimmt axiale Lasten auf und überträgt sie auf einen umfassenden Ring aus dicht gepackten kreisförmigen Kollagen-Typ-I-Fasern, der als Anulus fibrosus bezeichnet wird. Ihre Funktion besteht darin, die übersetzten axialen Drücke zu absorbieren, die der proteoglykanische und wasserreiche Kern mit ihrer Zug-Längsfaserfestigkeit erhält. An der Ober- und Unterseite jedes Kerns und Anulus bildet eine hyaline knorpelige Endplatte die Verbindung zu den benachbartenWirbeln 4 (Abbildung 1).
Im Gelenkknorpel finden sich vier unterschiedliche räumliche Chondrozytenmuster: Paare, Saiten, Doppelsaiten, kleine bzw. große Cluster5,6,7 ( Abbildung2). Veränderungen in diesem Muster sind mit dem Beginn und der Progressionvon OAassoziiert 8,9. Die räumliche Chondrozytenorganisation ist auch ein Indikator für eine direkte funktionelle Eigenschaft des Knorpels, nämlich seine Steifigkeit, was die funktionelle Relevanz dieses bildbasierten Grading-Ansatzesunterstreicht 10,11. Diese Muster können zusätzlich mit bereits vorhandener klinisch verfügbarer Technologie identifiziert werden12. Aufgrund der Ähnlichkeiten zwischen der IVD und dem Gelenkknorpel kann die Hypothese aufgestellt werden, dass charakteristische Chondrozytenmuster auch in der IVD vorhanden sind. Clusterbildung ist ein Phänomen, das auch bei der degenerierten IVD beobachtet wird13,14.
Bei dem Versuch, die räumliche Zellorganisation in der IVD zu analysieren, ist es notwendig, mehrere technische Schwierigkeiten zu überwinden, die bei der Untersuchung des Gelenkknorpels nicht vorhanden sind:
Erstens ist die Verarbeitung des Gewebes selbst viel schwieriger als bei dem homogenen hyalinen Knorpel, der größtenteils aus Kollagen Typ II besteht. Die Hauptfaserkomponente des IVD ist Kollagen Typ I, was es viel schwieriger macht, dünne histologische Abschnitte zu erzeugen. Während im hyalinen Gelenkknorpel aufgrund der "glasartigen" Beschaffenheit des Gewebes auch dicke Schnitte leicht analysiert werden können, ist das Kollagen-Typ-I-Netzwerk der IVD optisch hochundurchdringlich. Aus diesem Grund ist ein starkes Hintergrundrauschen ein häufiges Problem in der Histologie der IVD. Eine schnelle und kostengünstige Möglichkeit, dieses optisch dichte Gewebe zu durchdringen, ist die Verwendung eines optischen Schnittgeräts, z.B. mittels eines Apotoms. In einem solchen Apotom wird ein Gitter in den Beleuchtungsweg eines herkömmlichen Fluoreszenzmikroskops eingefügt. Vor dem Gitter wird eine ebeneparallele Glasplatte platziert. Dieser neigt sich hin und her und projiziert so das Raster im Bild in drei verschiedenen Positionen. Für jede Z-Position werden drei Rohbilder mit dem projizierten Raster erstellt und überlagert. Mittels spezieller Software kann das unscharfe Licht berechnet werden. Das zugrunde liegende Prinzip ist, dass, wenn das Raster sichtbar ist, diese Information im Fokus ist, wenn nicht, sie als unscharf angesehen wird. Mit dieser Technik können gut fokussierte und hochauflösende Bilder in angemessener Zeit aufgenommen werden.
Zweitens ist das Gewebe von menschlichen Spendern schwer zu bekommen. Beim totalen Knieersatz kann die gesamte Oberfläche des Gelenks für die weitere Analyse während der Operation erhalten werden. Obwohl die Arthrose eines Diarthrodialgelenks auch eine Erkrankung des gesamten Gelenks ist, gibt es dennoch starke fokale Unterschiede in der Qualität des Knorpels, wobei in der Regel einige Bereiche des Gelenks noch intakt sind, zum Beispiel aufgrund einer verminderten Belastung in diesem Bereich. Anders verhält es sich bei der IVD, wo eine Operation in der Regel erst dann durchgeführt wird, wenn die Bandscheibe global zerstört ist. Bei der Gewinnung von Gewebe von menschlichen Spendern aus dem Operationssaal ist das Gewebe auch stark fragmentiert und es ist notwendig, das Gewebe vor weiteren Analysen korrekt einem der drei Knorpeltypen der IVD zuzuordnen. Um detailliertere Analysen auch größerer Gewebeschnitte zu ermöglichen und die Embryonalentwicklung der IVD zu untersuchen, ist daher die Wahl eines tierischen Modellorganismus notwendig.
Bei der Auswahl eines solchen Modellorganismus ist es wichtig, ein System zu haben, das hinsichtlich seiner Anatomie und Abmessungen, seiner mechanischen Belastung, der vorliegenden Zellpopulation sowie seiner Gewebezusammensetzung mit der menschlichen Bandscheibe vergleichbar ist. Für die Zwecke der hier vorgestellten Technik empfehlen wir die Verwendung von bovinem lumbalem Bandscheibengewebe: Eine kritische Eigenschaft der menschlichen Bandscheibe, die zu ihrem geringen regenerativen Potenzial führt, ist der Verlust von Notochordalzellen während der Reifung im Zellkern. In zahlreichen Modellorganismen können notochordale Zellen jedoch ihr gesamtes Leben lang nachgewiesen werden. Die meisten der wenigen Tiere, die ihre Notochordalzellen verlieren, wie Schafe, Ziegen oder Chondrodystrophig-Hunde, haben eine IVD, die viel kleiner ist als menschliche Bandscheiben. Nur Lendenwirbelscheiben sind mit einem vergleichbaren Sagittalscheibendurchmesser wie menschliche IVDs vorhanden15.
Ein Schlüsselfaktor, der zu einer frühen Bandscheibendegeneration führt, ist eine übermäßige mechanische Belastung. Der intradiskale Druck einer stehenden Kuh in der Lendenwirbelsäule beträgt etwa 0,8 MPa, wobei die Wirbelsäule horizontal ausgerichtet ist. Überraschenderweise sind diese Drücke vergleichbar mit den lumbalen intradiskalen Drücken, die für die aufrechte menschliche Wirbelsäule (0,5 MPa) berichtetwurden 15,16. Auch die Menge an Wasser und Proteoglykanen in Rinderscheiben ist vergleichbar mit der der IVD von jungen Menschen17. Obwohl sich das tatsächliche Bewegungsmuster der Bewegungssegmente bei vierbeinigen Tieren vom zweibeinigen Menschen unterscheiden kann, ist die Kuh in Bezug auf die Gesamtbelastung und die Bandscheibeneigenschaften der menschlichen Biologie viel näher als andere etablierte Tiermodelle für die IVD wie Schafe und Hunde.
In diesem Protokoll stellen wir eine Technik vor, wie Veränderungen in der IVD aus der Sicht der räumlichen Chondrozytenorganisation von der frühen Embryonalentwicklung bis zur Degeneration im Endstadium analysiert werden können.
Protokoll
Für die Analyse der Embryonalentwicklung und -reifung wurden Rinderscheiben verwendet. Um die Degeneration der IVD zu bewerten, wurden menschliche Proben analysiert.
Menschliches IVD-Gewebe wurde von Patienten gewonnen, die in der Klinik für Orthopädische Chirurgie, universitätsklinikum Tübingen und im BG Traumazentrum Tübingen wegen Bandscheibendegeneration, Bandscheibenvorfall oder Wirbelsäulentrauma operiert wurden. Die volle Zustimmung der Ethikkommission wurde vor Beginn der Studie eingeholt (Projektnummer 244/2013BO2). Vor der Teilnahme wurde von allen Patienten eine schriftliche Einverständniserklärung eingeholt. Die Methoden wurden in Übereinstimmung mit den genehmigten Richtlinien durchgeführt.
Rindergewebe wurde vom Bayerischen Landesamt für Gesundheit und Lebensmittelsicherheit/Oberschleißheim und von einer Tierkörperbeseitigungsanlage in Warthausen (Deutschland) gewonnen. Für Gewebe von toten Tieren wurde die Genehmigung der örtlichen und veterinärmedizinischen Behörden erteilt.
1. Probenernte
- Menschliches IVD-Gewebe: Intraoperativ gewonnene IVD-Proben werden sofort in Dulbeccos Modified Eagle Medium (DMEM) mit 2% (v/v) Penicillin-Streptomycin und 1,2% (v/v) Amphotericin B. Bis zur weiteren Verarbeitung bei 4 °C lagern. Verarbeiten Sie das Gewebe innerhalb von 48 h. Alternativ lagern Sie das Gewebe bei -20 °C für mehrere Wochen.
- Bovines IVD-Gewebe: Stellen Sie sicher, dass das Gewebe innerhalb von 24 Stunden nach dem Tod von den Tieren geerntet wird.
Resezieren Sie die Rinderscheiben mit den umgebenden Wirbeln von den toten Tieren en-bloc. Das gefrorene Gewebe auf Trockeneis transportieren und bis zur Weiterverarbeitung bei -20 °C lagern.
HINWEIS: Wenn nur Fluoreszenzanalysen vorgesehen sind und keine weiteren biochemischen Quantifizierungsmethoden wie ELISA oder PCR geplant sind, führen Sie die Gewebefixierung wie unten erläutert durch. Dies ermöglicht es, das Gewebe länger im Lager zu halten, bevor es verarbeitet werden muss. Um eine Verschlechterung der Gewebematrix zu verhindern, führen Sie die Fixierung innerhalb von 48 h nach der Ernte durch, es sei denn, das Gewebe wird direkt eingefroren.
2. Probenvorbereitung
- Tauen Sie das gefrorene Gewebe bei Raumtemperatur auf. Verarbeiten Sie das Gewebe, sobald bei digitaler sanfter Kompression des Gewebes keine Eiskristalle mehr zu spüren sind.
HINWEIS: Führen Sie die Vorbereitung des Gewebes in DMEM in einer Petrischale durch. - Identifizieren Sie den Ursprung des menschlichen IVD-Gewebes (Anulus fibrosus, Zwischenzone, Nucleus pulposus oder knorpelige Endplatte) anhand makroskopischer Eigenschaften wie Kollagendichte und -orientierung.
- Nehmen Sie das Bewegungssegment, bestehend aus der BOVIN-IVD-Bandscheibe mit ihren beiden benachbarten Wirbeln, und sezieren Sie die Bandscheibe als Ganzes vom subchondralen Knochen mit einer chirurgischen Klinge (Klingennummer 15).
- Verwenden Sie zwei anatomische Pinzetten, um die Scheibe umzudrehen, um Bereiche zu erreichen, die zentrierter sind. Führen Sie die Sezierung durch. Stellen Sie sicher, dass Sie den Nucleus pulposus zuletzt resezieren, da er viel dünner ist als der Anulus, anfällig für Reißen ist und sich nicht leicht in einer definierten Weise löst.
- Identifizieren Sie die verschiedenen Bereiche des Knorpels.
- Schneiden Sie den interessierenden Bereich mit einer chirurgischen Klinge (Klingennummer 20 oder 22) aus der gesamten Bandscheibe aus. Alternativ können Sie eine Kryotomklinge verwenden.
HINWEIS: Da Rinderscheiben en-bloc als Teil der Wirbelsäule kommen, können die Bandscheiben in-toto vorbereitet werden. Dies erleichtert die korrekte Identifizierung der verschiedenen Knorpelarten erheblich. Beim Sezieren der Bandscheibe in der oben beschriebenen Weise verbleibt die knorpelige Endplatte auf den Wirbeln. Wenn dieser Bereich untersucht werden soll, wird er am besten mit einem Meißel, der in leicht gebogener Tangentialrichtung arbeitet, vom darunter liegenden Knochen abgenommen.
- Falls Embryonen eine Kronen-Rumpf-Länge von weniger als 20 cm haben, stellen Sie sicher, dass die Embryonen in toto verarbeitet werden, um die Gewebearchitektur der IVD zu erhalten. Führen Sie in diesen Fällen keine Dissektion der Wirbel durch.
- Sobald die Bandscheibe in Toto reseziert wurde, identifizieren Sie die verschiedenen Bereiche des Knorpels.
- Führen Sie die Entkalkung in Ethylendiamintetraessigsäure (EDTA) (20% (w/v); pH = 7,4) bei Raumtemperatur durch. Wählen Sie das Volumen in Abhängigkeit von der Probengröße - das gesamte Gewebe muss gut mit EDTA bedeckt sein.
- Wechseln Sie die Entkalkungslösung täglich, die je nach Größe des Gewebes bis zu 5 Tage dauern kann.
- Überprüfen Sie, ob die Entkalkung erfolgreich ist, mit einer 20 Gauge Nadel, die ohne nennenswerten Widerstand in die Wirbel eindringt.
HINWEIS: Der tägliche Wechsel der Entkalkungslösung ist wichtig, um die Sättigung des Chelatbindemittels EDTA zu verhindern und die Reaktionseffektivität aufrechtzuerhalten. Es verhindert auch die bakterielle Besiedlung.
3. Einstufung von Stichprobenalter, Integrität und Degeneration
- Klassifizieren Sie das menschliche Bandscheibengewebe mit Hilfe klinischer Informationen sowie Röntgen- und Magnetresonanztomographie in eine der fünf folgenden Kategorien18 (Abbildung 3).
HINWEIS: Kategorie I: Um als nahezu gesunde Probe zu dienen, verwenden Sie Anulus ohne radiologische Anzeichen einer IVD-Degeneration, die auf ein akutes Wirbelsäulentrauma zurückzuführen ist.
Kategorie II: Zur Veranschaulichung einer akuten Entzündung mit beginnender Degeneration verwenden Sie Gewebe aus der Zwischenzone von Patienten mit klinischen Symptomen mit einer Dauer von weniger als 4 Wochen.
Kategorie III: Um eine Situation zu beschreiben, in der die Entzündungsreaktion bereits Zeit hatte, das Gewebe und die Zellen zu beeinflussen, entnehmen Sie Gewebe von Patienten, die wegen eines Kernprolapses operiert wurden, aber mit einer Symptomdauer von mehr als 4 Wochen.
Kategorie IV: Für moderate Bandscheibendegeneration wählen Sie anulus aus einer Operation mit Interbody-Fusion für degenerative Bandscheibenerkrankungen mit einem Pfirrmann-Score von 3 oder 4 in der Magnetresonanztomographie19.
Kategorie V: Für den Degenerationsprozess im Endstadium erhaltener Anulus aus einer Operation mit Interbody-Fusion bei degenerativer Bandscheibenerkrankung mit einem Pfirrmann-Score von 5. - Klassifizieren Sie das Rindergewebe anhand des Entwicklungsstadiums/Alters des Tieres in eine der acht Kategorien, wie in Tabelle 1 dargestellt.
- Berechnen Sie das Tragalter auf der Kronen-Rumpf-Länge der Embryonen basierend auf der von Keller vorgeschlagenen Formel:
Tragalter in Monaten =
HINWEIS: Tiere in den ersten 4 Schwangerschaftswochen mit einer Kronen-Rumpf-Länge von 0,8-2,2 cm20.
- Berechnen Sie das Tragalter auf der Kronen-Rumpf-Länge der Embryonen basierend auf der von Keller vorgeschlagenen Formel:
4. Gewebefixierung
- Fixieren Sie die Proben im 10-fachen Volumen der Probe von 4% (w/v) Formaldehydlösung in phosphatgepufferter Kochsalzlösung (PBS) über Nacht bei 4 °C.
HINWEIS: Die Formaldehydlösung dringt mit einer Geschwindigkeit von etwa 1 mm / Stunde aus jeder Richtung in das Gewebe ein. Bei sehr kleinen oder sehr großen Proben kann eine Anpassung der Belichtungszeit notwendig sein. - Lagern Sie das Gewebe in PBS bei 4 °C bis zur weiteren Verarbeitung.
5. Histologische Schnitte
- Die Proben in wasserlösliches Einbettmedium am Kryotomknopf einbetten.
- Legen Sie das Gewebe so auf den Knopf, dass entweder eine axiale Ebene erzeugt wird oder eine Ebene, die die Kollagen-Typ-I-Lamellen senkrecht schneidet (z. B. eine mediane sagittale Schnittebene).
HINWEIS: Das Gewebe muss vollständig vom Einbettungsmedium bedeckt sein.
- Legen Sie das Gewebe so auf den Knopf, dass entweder eine axiale Ebene erzeugt wird oder eine Ebene, die die Kollagen-Typ-I-Lamellen senkrecht schneidet (z. B. eine mediane sagittale Schnittebene).
- Schneiden Sie das eingebettete Gewebe mit einer Dicke von 70 μm in menschlichen Proben und 40 μm in Rinderproben mit einem Standard-Kryotom.
HINWEIS: Der Unterschied in der Abschnittsdicke ist auf den Unterschied in der Gewebeintegrität zwischen der intakten Rinderscheibe und dem stark degenerierten menschlichen Gewebe zurückzuführen. - Sammeln Sie die Abschnitte auf einem Glasobjektträger.
- Umschließen Sie die Gewebeschnitte mit einem hydrophoben Pen.
- Spülen Sie die Abschnitte 3 Mal mit phosphatgepufferter Kochsalzlösung (PBS) ab, um das wasserlösliche Einbettungsmedium zu entfernen.
6. Fluoreszenzfärbung
- 60 μL 1% (v/v) DAPI (Exmax 358 nm, Emmax 461 nm) sowie 1% (v/v) Actin Tracking Färbung (Exmax 540 nm, Emmax 565 nm) in PBS geben und 5 min bei Raumtemperatur inkubieren.
HINWEIS: Das hier beschriebene Färbeprotokoll besteht darin, den Kern mit DAPI-Kernfärbung (blau) und das Zytoplasma mit Actin Tracking Stain (rot) sichtbar zu machen. Die IVD hat eine starke Autofluoreszenz aufgrund der Kollagenfasern im grünen Kanal. Die Flüssigkeitsmenge, die den Abschnitten in diesem Protokoll zugesetzt wird, ist für Abschnitte mit einer Größe von etwa 5 mm x 5 mm vorgesehen. Bei größeren Abschnitten muss dieser Betrag entsprechend erhöht werden. Führen Sie alle Arbeiten in Räumen ohne direkte Sonneneinstrahlung und mit gedimmtem Licht durch, um ein Bleichen des Farbstoffs zu verhindern. - Entfernen Sie die Färbeflüssigkeit mit einer Pipette und waschen Sie sie dreimal mit jeweils 60 μL PBS.
- Fügen Sie ein geeignetes Montagemedium hinzu und bedecken Sie die Abschnitte mit einem Abdeckzettel.
HINWEIS: Stellen Sie sicher, dass beim Hinzufügen des Abdeckscheins keine Luftblasen eingeschlossen sind. Dies geschieht am besten, indem man den Kontakt des Slips mit dem Schlitten auf einer Felge beginnt und dann den Slip langsam herunterkommen lässt.
7. Mikroskopische Bildgebung und Verarbeitung
- Legen Sie einen Objektträger mit einem gefärbten Schnitt auf den Probenhalter des Mikroskops.
HINWEIS: Aufgrund des dichten Kollagen-Typ-I-Netzwerks der IVD erschwert das Streulicht die Visualisierung des Gewebes mit herkömmlicher Fluoreszenzmikroskopie. Eine Möglichkeit, dieses Problem zu lösen, besteht darin, optische Schnitte mit strukturierter Beleuchtung durchzuführen. Dies ermöglicht auch eine dreidimensionale Projektion der gesamten Probe in beiden Kanälen (blau und rot). Dies geschieht am besten über die strukturierte Beleuchtungseinstellung und den Mosaik-Modus mit einem 10-fachen Vergrößerungsobjektiv, um einen Überblick über die Probe sowie 3D-Rekonstruktionen einzelner Muster zu erhalten. - Starten Sie das strukturierte Beleuchtungsgerät.
- Führen Sie eine Einzelfeldbildgebung mit einem geeigneten Fluoreszenzmikroskop, Fluoreszenzfiltern und ausreichender Beleuchtung durch.
HINWEIS: Passen Sie die Belichtungszeit für alle verwendeten Filter an, um die Bilderfassung zu standardisieren. Um eine genaue Darstellung der Probe bei einem Bild mit höherer Auflösung zu erhalten, werden die Abschnitte mit einer höheren Vergrößerung (z. B. 20-faches Objektiv) angezeigt. - Nachbearbeitung der Bilder durch Optimierung der Intensität und Helligkeit mit einer mit dem Fluoreszenzmikroskop kompatiblen Bildoptimierungssoftware.
- Führen Sie eine Einzelfeldbildgebung mit einem geeigneten Fluoreszenzmikroskop, Fluoreszenzfiltern und ausreichender Beleuchtung durch.
- Um den Abschnitt als Ganzes zu visualisieren, verwenden Sie die Mosaikbildgebungstechnik
- Öffnen Sie die Erfassungseinstellungen (drücken Sie auf 6D-Erfassung) in der Symbolleiste.
- Passen Sie die Mosaikeinstellungen an (im MosaiXRegister ) und definieren Sie die Anzahl der Spalten und Zeilen von Sichtfeldbildern, die später zu einem Übersichtsbild zusammengeführt werden sollen.
- Drücken Sie Setup und passen Sie die Fokuskorrektur einzelner Kacheln an.
HINWEIS: Es ist fast unmöglich, dass ein großer Gewebeschnitt die gesamte Gewebeoberfläche in einer einzigen Fokusebene hat. Bildkacheln mit unterschiedlichen Brennweiten können mit 'MosaiX Acquisition' aufgenommen werden. - Um die Erfassung der Bildkacheln zu starten, drücken Sie Start.
- Kombinieren Sie die abgebildeten Kacheln mithilfe der Stitching-Funktion(Stitching-Taste) mit 20% Überlappung, die in die Software integriert ist.
- Nachbearbeitung der Bilder durch Optimierung der Intensität und Helligkeit mit einer mit dem Fluoreszenzmikroskop kompatiblen Bildoptimierungssoftware.
- Um die räumliche Chondrozytenorganisation zu analysieren, verwenden Sie die in der Software integrierte 3D-Funktion.
- Passen Sie die Z-Stack-Einstellungen an. Definieren Sie die Scanparameter: Definieren Sie die Start- und Stopppositionen in der z-Achse und den Slice-Abstand durch Aktivieren der Start/Stop-Taste.
HINWEIS: Die Software berechnet automatisch die Anzahl der Slices. - Um die Erfassung der Bild-Z-Stacks zu starten, drücken Sie Start.
- Nachbearbeitung der Bilder durch Optimierung der Intensität und Helligkeit mit einer mit dem Fluoreszenzmikroskop kompatiblen Bildoptimierungssoftware.
- Passen Sie die Z-Stack-Einstellungen an. Definieren Sie die Scanparameter: Definieren Sie die Start- und Stopppositionen in der z-Achse und den Slice-Abstand durch Aktivieren der Start/Stop-Taste.
- Exportieren Sie die Bilder in einem Dateiformat, das mit der Bildverarbeitungssoftware kompatibel ist.
HINWEIS: Exportieren Sie die 3D-Rekonstruktionen als Einzelbilder oder/oder als interaktives 3D-Modell oder in einem Videoformat.
8. Identifizierung zellulärer Muster und Dichtebewertung
- Öffnen Sie die exportierten Mosaikbilder des gesamten Gewebeabschnitts in einem entsprechenden Bildverarbeitungsprogramm.
- Definieren Sie die Bereiche, die der Zelldichtebewertung unterzogen werden, indem Sie in den Bildern interessante Bereiche von 500 μm x 500 μm definieren.
HINWEIS: Alle Kacheln, die keine ausreichende Bildqualität aufweisen, sind von der Analyse ausgeschlossen. - Identifizieren Sie individuelle Zelluläre Muster.
HINWEIS: Einzelne Zellen sind als einzelne Zellen definiert - vollständig eingekapselt innerhalb der benachbarten Matrix. Paare sind definiert als zwei benachbarte Zellen in unmittelbarer Nähe (<25 μm), wobei die Zellen durch ihre Matrizen miteinander verbunden sind (siehe Abbildung 2). String-Formationen sind mindestens drei Chondrozyten, die in einer Linie ausgerichtet sind (von der Mitte der Kerne <25 μm). Diese Zellen sind von einer intakten Matrix umgeben und Matrixverbindungen sind zwischen jeder Zelle zu sehen. Cluster stellen mehrere Zellen dar, die sich in direkter Nähe zueinander befinden (<25 μm) und in einer großen Matrixlücke ohne Matrix eingekapselt sind. - Verwenden Sie ein Zellzähl-Plug-in für die quantitative Analyse der zellulären Muster.
HINWEIS: Die Zytoplasmafärbung stellt eine Verifizierungsmethode dar, um die verschiedenen räumlichen Muster zu identifizieren. - Berechnen Sie die Zelldichte, indem Sie die gezählten Zellen durch die Größe des ausgewählten interessierenden Bereichs dividieren.
Ergebnisse
Anhand von Mosaikbildern ist die Architektur des IVD mit seinem dichten Kollagenfasernetzwerk im Anulus und dem weicheren Kern deutlich zu erkennen (Abbildung 4). Eine kontinuierliche Abnahme der Zelldichte kann während der Embryonalentwicklung beobachtet werden (Abbildung 5). Während in den frühen Stadien der IVD-Entwicklung eine Zelldichte von 11.435 Zellen/mm² im Rinderanuulus fibrosus und 17.426 Zellen/mm² im Rinderkern pulposus zu finden ist, nehmen diese Zahlen bis zur Geburt schnell auf 1.011 Zellen/mm² (Bovine Anulus fibrosus) und 488 Zellen/mm² (Rinderkern pulposus) ab. Bei den erwachsenen Rindern sind 71 Zellen/mm² (Anulus fibrosus) bzw. 106 Zellen/mm² (Nucleus pulposus) zu sehen (Abbildung 6 A-B). Die Verwendung von Bi-Channel-Imaging mit dem Apotome ermöglicht es, die 3D-Architektur der räumlichen Muster zu visualisieren (Abbildung 7).
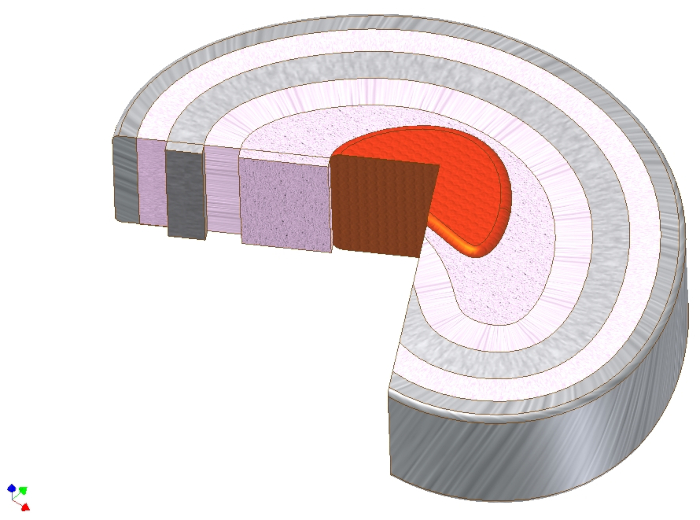
Abbildung 1. Makroskopische Anatomie der Bandscheibe. Schematische Darstellung der Bandscheibe, die den Nucleus pulposus (rot), direkt um ihn herum die Zwischenzone (rosa) und dann in kreisförmigen Schichten um ihn herum den Anulus fibrosus zeigt. Beachten Sie die Lagenwinkelrichtung der Kollagenfasern vom Typ I im Anulus fibrosus. Die axiale Belastung des Kerns kann somit in axiale Zugkräfte der Kollagenfasern übersetzt werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
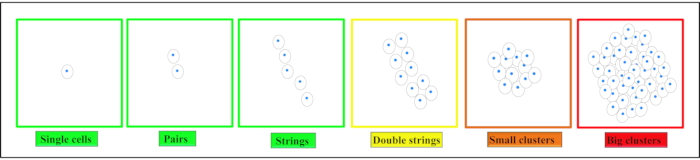
Abbildung 2. Schematische Darstellung verschiedener räumlicher Organisationsmuster von Chondrozyten. Je nach Gewebe finden sich Chondrozyten als Einzelzellen, Paare oder Fäden im gesunden Knorpel. Mit Beginn der Degeneration ändern sich diese Muster zu doppelten Strings, kleinen Clustern und dann großen Clustern in der Endphasendegeneration. Diese Zahl wurde von Danalache, M. et al.21modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
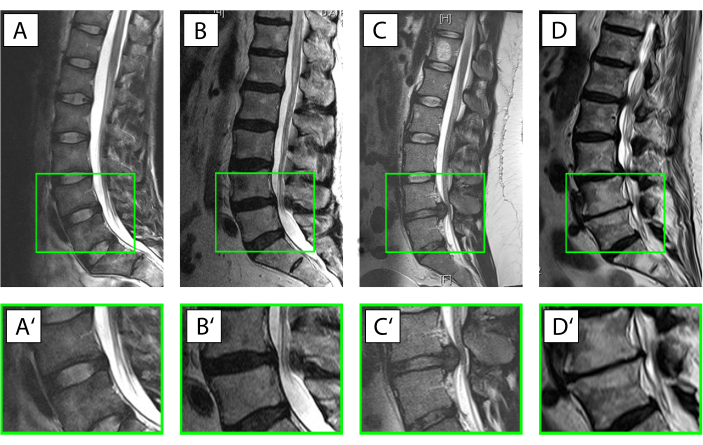
Abbildung 3. Unterschiedliche Zustände der Bandscheibe (IVD). (A-D') Sagittale T2-gewichtete Magnetresonanztomographie der menschlichen Lendenwirbelsäule (A-D), mit dem vergrößerten Bewegungssegment L4/L5 (A'-D'). Die ventrale Seite des Patienten zeigt nach links, die dorsale Seite nach rechts mit dem Spinalkanal mit seinem weißen Signal für die Zerebrospinalflüssigkeit. (A, A ') Intakte IVD mit dem Anulus, der aufgrund des hohen Kollagentyp-I-Gehalts mit einem Hypointense-Signal (schwarz) und dem Zellkern aufgrund des hohen Gehalts an wasserbindenden Proteoglykanen (Pfirrmann Grad19 I) viel heller (hyperintense) dargestellt wird. (B,B') Beginn der IVD-Degeneration mit einem Verlust des Wassersignals aus dem Nucleus pulposus und wo die Unterscheidung zwischen Anulus und Kern verloren geht (Pfirrmann Grad19 IV). (C,C') Akuter Kernprolaps mit noch einem markanten Wassersignal im Bereich des Kerns, der auf eine ansonsten intakte IVD und das dorsal in den Wirbelkanal hineinragende Bandscheibengewebe hinweist. (D,D') Fortgeschrittene Bandscheibendegeneration mit einer weitgehend zerstörten IVD mit vollständigem Verlust des Wassersignals innerhalb der Bandscheibe, ventraler und dorsaler Spondylophytenbildung und subchondraler Sklerose der Wirbel entsprechend einem Pfirrmann-Grad19 von V. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
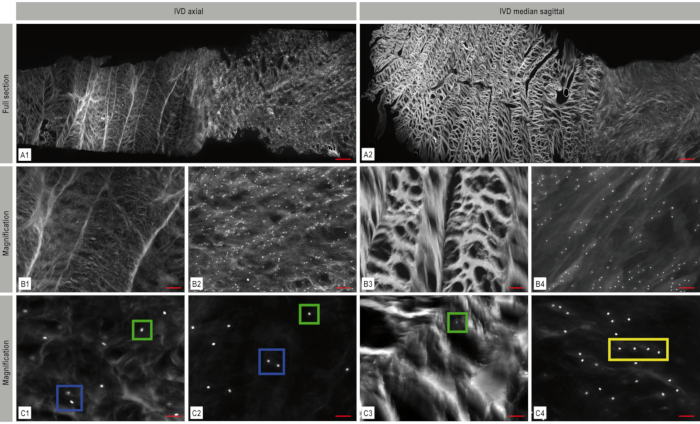
Abbildung 4. Mosaikfluoreszenzbildgebung der Bandscheibe (IVD). Die Architektur des IVD mit seinem dichten Kollagenfasernetzwerk im Anulus fibrosus und dem weicheren Kern ist deutlich zu erkennen. Die DAPI-Kernfärbung (weiß) in der axialen (A1) und sagittalen (A2) Ebene zeigt die Zellverteilung und -anordnung innerhalb der IVD. Vergrößerte repräsentative Bereiche aus diesen Mosaikbildern werden in B1-B4 und C1-C4 dargestellt und veranschaulichen die räumliche Chondrozytenorganisation - in diesem Fall einzelne Zellen (grüner Kasten), Paare (blauer Kasten) und Strings (gelber Kasten). A: Maßstabsbalken 1.000 μm, B1-B4: Maßstabsbalken 200 μm, C1-C4: Maßstabsbalken: 50 μm. Diese Zahl wurde von Bonnaire, F.C. et al.22modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5. Unterschiedliche Entwicklungs- und Reifestadien des bovinen Anulus fibrosus und des menschlichen degenerierenden Anulus fibrosus. DAPI-Kernfärbung. Die Mosaikbilder zeigen eine ganze frühe embryonale Scheibe in einem axialen Schnitt (A1) und repräsentative Bilder des Rinderannals während der Embryonalentwicklung, Reifung und beginnenden Degeneration (A2-A8). (B1-B3) Anulus aus humanen IVDs wurde intraoperativ gewonnen. Eine kontinuierliche Abnahme der Zelldichte kann während der embryonalen Bandscheibenentwicklung beobachtet werden. Ein zelluläres Muster mit höherer räumlicher Organisation scheint vor allem um die Geburt herum vorhanden zu sein. Bei der erwachsenen menschlichen Bandscheibe nimmt bei der Degeneration die Zelldichte wieder zu und es kann eine zunehmende Clusterbildung beobachtet werden. Maßstabsleiste 100 μm. Wog: Schwangerschaftswochen. Diese Zahl wurde von Bonnaire, F.C. et al.22modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6. Verringerung der Zelldichte während der Entwicklung und Reifung der Rinderwirbelscheibe. Die mittlere (Standardabweichung) Zellzahl pro mm² wird durch Balkendiagramme für den Rinderanulus fibrosus (A) und den Rinderkern pulposus (B) veranschaulicht. Eine deutliche Verringerung der Zelldichte ist vor allem während der Embryonalperiode zu beobachten, die sich in geringerem Maße mindestens bis zur vollständigen Reifung der Bandscheibe fortsetzt (n=72). Wog: Schwangerschaftswochen. Diese Zahl wurde von Bonnaire, F.C. et al.22modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
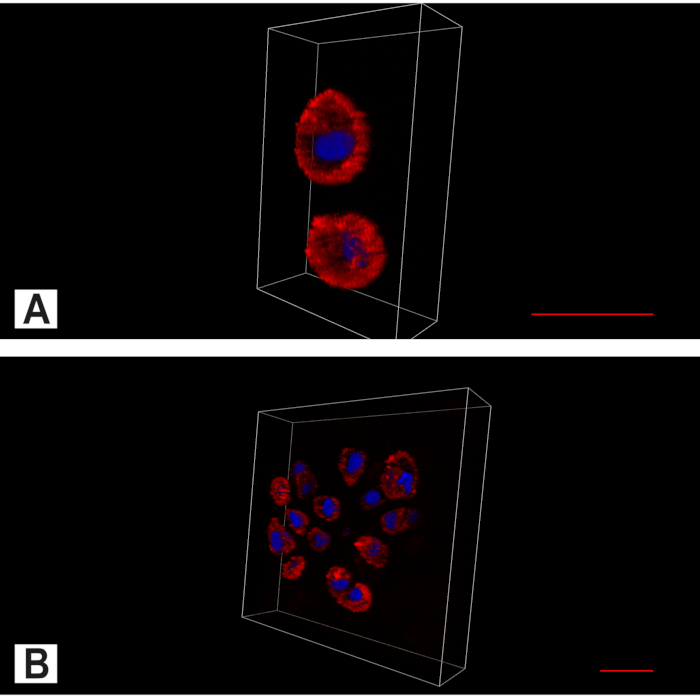
Abbildung 7. Apotombildgebung der Bandscheibe (IVD). Bi-Kanal-Bild, das das Zytoplasma (rot, Aktinfärbung) und den Kern (blau, DAPI-Kernfärbung) zeigt. (A) In der intakten IVD werden neben dem vorherrschenden räumlichen Muster einzelner Chondrozyten auch Paare gefunden. (B) In entarteten Anuluszellclustern finden sich. Maßstabsleiste 20 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Video 1. Apotombildgebung eines Paares in der Bandscheibe (IVD) als 3D-Modell. Zweikanalbilder, die das Zytoplasma (rot, Aktinfärbung) und den Zellkern (blau, DAPI-Kernfärbung) eines Paares zeigen. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Video 2. Apotombildgebung eines Clusters in der Bandscheibe (IVD) als 3D-Modell. Bi-Kanal-Bilder, die das Zytoplasma (rot, Aktinfärbung) und den Kern (blau, DAPI-Kernfärbung) eines Clusters zeigen. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Tabelle 1: Embryonalentwicklung, Reifung und Wachstum der Rinder nach der Geburt mit ihren verschiedenen Meilensteinen. Wog - Schwangerschaftswochen. Tragzeit ca. 283 Tage, natürliche Lebenserwartung 20-25 Jahre20,23,24. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Mit Hilfe der Fluoreszenzmikroskopie, die durch Mosaikbildgebung und optische Schnitte ergänzt wurde, untersuchten wir die räumliche Anordnung der Chondrozyten im Anulus der lendentalen IVD während der gesamten Entwicklung, Reifung und Degeneration. Während degeneratives Gewebe von Patienten entnommen werden konnte, die eine Wirbelsäulenoperation wegen Bandscheibendegeneration erhielten, erforderte die Analyse der Embryonalperiode und der Reifephase die Verwendung eines Modellorganismus (Rind). Hohe Zelldichten wurden im Anulus während der frühen Embryonalentwicklung festgestellt. Im weiteren Verlauf der Entwicklung, des postnatalen Wachstums und der Reifung konnte eine ausgeprägte Abnahme der Zelldichte beobachtet werden. In menschlichem Gewebe mit fortgeschrittener Bandscheibendegeneration konnten wir dann eine Zunahme der Zelldichte im Anulus fibrosus quantifizieren.
Die rasche Zunahme des Gewebevolumens in Verbindung mit sich aktiv teilenden und biosynthetisch aktiven Notochordalzellen sind wahrscheinliche Gründe für die im Embryo beobachteten Veränderungen der Zelldichte25. Die Mechanismen, durch die die Zelldichte mit der Degeneration wieder zunimmt, bleiben jedoch noch unklar. Degenerative Prozesse des Anulus führen zu einer Reihe von pathologischen Veränderungen, einschließlich erhöhter Gewebeinnervation und -entzündung, Hochregulierung von matrixabbauenden Enzymen und Wachstumsfaktorproduktion sowie Veränderungen der Zellularität26,27,28.
Bei der Betrachtung der Zellpräsenz als Funktion der zellulären räumlichen Organisation auf der Grundlage von Mustern, die aus dem Gelenkknorpel7,9 bekanntsind,fanden wir keine erkennbare räumliche Organisation in frühen embryonalen Bandscheiben, in denen die Zellen dicht gepackt zu sein scheinen und die wir als einzelne Zellen betrachteten22. Dieser Befund stimmt mit den Ergebnissen des embryonalen Gelenkknorpelsüberein 7. Im gesunden reifen Anulus stellen einzelne Zellen das vorherrschende räumliche Muster dar22. Paare und String-Formationen können aber auch beobachtet werden22. Je mehr das Gewebe in menschlichen Bandscheiben degeneriert, desto höher ist der Anteil der Zellen, die in Clustern gefunden werdenkönnen 22. Das von Rolauffs vorgeschlagene physiopathologische Modell in Gelenkknorpel7,9,29 zeigt eine faszinierende Ähnlichkeit mit unseren Ergebnissen. Frühere Studien zur IVD-Degeneration hatten auch bereits die Clusterbildung als Kennzeichen der Bandscheibendegeneration14,30,31,32,33. Da diese Cluster meist in stark degenerierten Geweben zu finden sind, könnte die Clusterbildung auf einen fehlgeschlagenen Versuch des Gewebes hinweisen, den degenerativen Schaden zu reparieren34. Durch die Herstellung einer starken Korrelation zwischen dem lokal vorherrschenden Chondrozytenmuster und der Gewebeelastizität konnte eine hohe funktionelle Relevanz dieser Muster in Gelenkknorpel10,11nachgewiesen werden. Es kann spekuliert werden, dass eine solche funktionale Relevanz auch für die räumliche Chondrozytenorganisation im IVD gilt.
Fluoreszenzhistologische Analysen sind ein leicht zu bekommendes und attraktives Mittel, um morphologische Veränderungen an Geweben zu analysieren. Bei der histologischen Analyse der IVD gibt es deutliche technische Schwierigkeiten, die überwunden werden müssen: Erstens ist es aufgrund der begrenzten Verfügbarkeit von menschlichem Gewebe wichtig, einen adäquaten Tiermodellorganismus zu wählen, mit dem jene Aspekte der Krankheit untersucht werden können, mit denen menschliche Proben nicht gewonnen werden können. Für die in dieser Studie behandelte Forschungsfrage haben wir ein Rindertiermodell gewählt.
Zweitens ist die Verarbeitung des Kollagen-Typ-I-reichen IVD viel schwieriger als für die meisten anderen menschlichen Gewebe. Das dichte Kollagen-Typ-I-Fasernetzwerk streut das fluoreszierende Licht stark und erzeugt ein hohes Hintergrundrauschsignal. Dieses Problem lässt sich am besten mit einer Technik lösen, die die Subtraktion oder Eliminierung eines solchen Hintergrundsignals ermöglicht. Eine bekannte Methode dazu ist die konfokale Mikroskopie. Während die Bildqualität von konfokal aufgenommenen LASER-Bildern in der Regel hervorragend ist, sind die Nachteile dieser Technik, dass sie relativ zeitaufwendig ist und somit die Analyse größerer Gewebebereiche mittels Mosaikbildgebung nicht erlaubt. Zweitens sind konfokale Mikroskope relativ teuer und nicht überall erhältlich. Eine viel schnellere und kostengünstigere Möglichkeit, Hintergrundgeräusche herauszufiltern, besteht darin, optische Schnitte z. B. mittels eines Apotoms durchzuführen.
Um die Befunde richtig interpretieren zu können, ist es unerlässlich, das zu analysierende Gewebe auch seiner Herkunft in der IVD richtig zuzuordnen. Während diese Aufgabe relativ einfach ist, wenn eine ganze Rinderscheibe zur Auswahl steht, kann sie bei der Aufnahme von menschlichem Gewebe aus dem Operationssaal sehr schwierig sein. Das charakteristische Merkmal des Anulus fibrosus ist sein sehr dichtes Kollagen-Typ-I-Netzwerk in einer winkelförmigen Faserorientierung. Der Kern hingegen ist eine amorphe gallertartige Struktur, bei der mit bloßem Auge keine höhere Kollagenarchitektur sichtbar ist. Die Zwischenzone liegt zwischen diesen beiden Extrema und besitzt ebenfalls eine klare Kollagenfaserarchitektur, die jedoch viel weicher und weniger dicht ist als der Anulus fibrosus. Die knorpelige Endplatte besteht aus hyalinem Knorpel, präsentiert sich nicht mit einer mit bloßem Auge erkennbaren Kollagenarchitektur, sondern ist eher "glasartig", wie der Begriff "hyalin" vermuten lässt. Im Gegensatz zum Nucleus pulposus ist er jedoch auch sehr steif, kann nicht verformt werden und befindet sich auf dem subchondralen Knochen, der oft noch durch Inspektion des Gewebes erkannt werden kann.
Sobald der Gewebeursprung korrekt identifiziert wurde, muss das Gewebe noch korrekt für den Schnitt ausgerichtet werden, um standardisierte Bilder zu erhalten, die auch eine ordnungsgemäße qualitative und quantitative Auslesung ermöglichen. In Anlehnung an andere bildgebende Verfahren wie die Magnetresonanztomographie schlagen wir zwei Standard-Analyseebenen vor: einen median-sagittalen Schnitt und einen in der axialen Ebene. Diese beiden Ebenen werden auch einen guten Eindruck von der Architektur des Kollagen-Typ-I-Fasernetzwerks des Anulus vermitteln. Bei der Interpretation der Ergebnisse der F-Aktin-Färbung ist zu berücksichtigen, dass das Einfrieren der Gewebeproben zu Veränderungen der Zytoskelettstruktur35 führen kann, die jedoch die räumliche Chondrozytenorganisation nicht beeinträchtigen sollten.
Die Zellbiologie der IVD vollständig zu verstehen, ist eine der noch offenen Herausforderungen in unserem Verständnis von Bandscheibendegeneration und Regeneration36. Mitunter trivial erscheinende Fragen wie die physiologische Anordnung von Zellen im gesunden Gewebe oder die Frage der zellulären Reorganisation bei der Degeneration, bleiben bis heute unbeantwortet. Die gewonnenen Erkenntnisse können es uns ermöglichen, mit diesem bildbasierten Degenerationsmarker die Gewebequalität zu bewerten, die Reversibilität der Clusterbildung zu untersuchen und damit möglicherweise ein therapeutisches Fenster zu definieren, in dem die degenerierenden Prozesse noch erfolgreich anvisiert werden können.
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
Wir danken unseren Co-Autoren aus den Originalpublikationen für ihre Hilfe und Unterstützung. Wir danken Charlotte Emma Bamberger für die Hilfe bei der Anschaffung der Apotombilder.
Materialien
| Name | Company | Catalog Number | Comments |
| Amphotericin B | Merck KGaA, Germany | A2942 | |
| Adhesion Microscope Slides SuperFrost Plus | R. Langenbrinck, Germany | 03-0060 | |
| ApoTome | Carl Zeiss MicroImaging GmbH, Germany | 462000115 | |
| AxioVision Rel. 4.8 with Modul MosaiX | Carl Zeiss MicroImaging GmbH, Germany | ||
| CellMask Actin Tracking Stain | Thermo Fischer Scientific, US | A57249 | |
| Cryostat | Leica Biosystems, US | CM3050S | |
| DAPI | Thermo Fischer Scientific, US | D1306 | |
| Dulbecco's modified Eagle's medium (DMEM) | Gibco, Life Technologies, Germany | 41966052 | |
| Ethylenediaminetetraacetic acid | Sigma-Aldrich, US | 60004 | |
| Fluorescence Miscoscope - Axio Observer Z1 with Axio Cam MR3 and Colibri | Carl Zeiss MicroImaging GmbH, Germany | 3834000604 | |
| Formaldehyde | Merck KGaA, Germany | 104002 | |
| Image J 1.53a, with Cell counter plugin | National Insittute of Health (NIH), US | ||
| Invitrogen Alexa Fluor 568 Phalloidin | Thermo Fischer Scientific, US | A12380 | |
| Microscopic Cover Glasses | R. Langenbrinck, Germany | 01-1818/1 | |
| PAP Pen Liquid Blocker | Science Sevices GmbH, Germany | N71310 | |
| Penicillin-Streptomycin | Sigma-Aldrich, US | P4333 | |
| Phosphate buffered saline | Sigma-Aldrich,US | P5119 | |
| Scalpel | pf medical AG, Germany | 2023-01 | |
| Tissue-tek O.C.T. Compound | Sakura Finetek, Netherlands | SA6255012 |
Referenzen
- Urban, J. P. G., Roberts, S. Degeneration of the intervertebral disc. Arthritis Research and Therapy. 5 (3), 120-130 (2003).
- Gupta, K. B., Duryea, J., Weissman, B. N. Radiographic evaluation of osteoarthritis. Radiologic Clinics of North America. 42 (1), 11-41 (2004).
- Pye, S. R., et al. Lumbar disc degeneration: association between osteophytes, end-plate sclerosis and disc space narrowing. Annals of the Rheumatic Diseases. 66 (3), 330-333 (2007).
- Humzah, M. D., Soames, R. W. Human intervertebral disc: structure and function. The Anatomical Record. 220 (4), 337-356 (1988).
- Schumacher, B. L., Su, J. L., Lindley, K. M., Kuettner, K. E., Cole, A. A. Horizontally oriented clusters of multiple chondrons in the superficial zone of ankle, but not knee articular cartilage. The Anatomical Record. 266 (4), 241-248 (2002).
- Rolauffs, B., Williams, J. M., Grodzinsky, A. J., Kuettner, K. E., Cole, A. A. Distinct horizontal patterns in the spatial organization of superficial zone chondrocytes of human joints. Journal of Structural Biology. 162 (2), 335-344 (2008).
- Felka, T., et al. Loss of spatial organization and destruction of the pericellular matrix in early osteoarthritis in vivo and in a novel in vitro methodology. Osteoarthritis and Cartilage. 24 (7), 1200-1209 (2016).
- Rolauffs, B., et al. Onset of preclinical osteoarthritis: the angular spatial organization permits early diagnosis. Arthritis and Rheumatism. 63 (6), 1637-1647 (2011).
- Aicher, W. K., Rolauffs, B. The spatial organization of joint surface chondrocytes: review of its potential roles in tissue functioning, disease and early, preclinical diagnosis of osteoarthritis. Annals of the Rheumatic Diseases. 73 (4), 645-653 (2014).
- Danalache, M., Jacobi, L. F., Schwitalle, M., Hofmann, U. K. Assessment of biomechanical properties of the extracellular and pericellular matrix and their interconnection throughout the course of osteoarthritis. Journal of Biomechanics. 97, 109409(2019).
- Danalache, M., et al. Changes in stiffness and biochemical composition of the pericellular matrix as a function of spatial chondrocyte organization in osteoarthritic cartilage. Osteoarthritis and Cartilage. 27 (5), 823-832 (2019).
- Tschaikowsky, M., et al. Proof-of-concept for the detection of early osteoarthritis pathology by clinically applicable endomicroscopy and quantitative AI-supported optical biopsy. Osteoarthritis and Cartilage. 29 (2), 269-279 (2021).
- Ciapetti, G., et al. Ex vivo observation of human intervertebral disc tissue and cells isolated from degenerated intervertebral discs. European Spine Journal: Official Publication of the European Spine Society, the European Spinal Deformity Society and the European Section of the Cervical Spine Research Society. 21, Suppl 1 10(2012).
- Johnson, W. E., Eisenstein, S. M., Roberts, S. Cell cluster formation in degenerate lumbar intervertebral discs is associated with increased disc cell proliferation. Connective Tissue Research. 42 (3), 197-207 (2001).
- Buttermann, G. R., Beaubien, B. P., Saeger, L. C. Mature runt cow lumbar intradiscal pressures and motion segment biomechanics. The Spine Journal: Official Journal of the North American Spine Society. 9 (2), 105-114 (2009).
- Wilke, H. J., Neef, P., Caimi, M., Hoogland, T., Claes, L. E. New in vivo measurements of pressures in the intervertebral disc in daily life. Spine. 24 (8), Phila Pa. 755-762 (1999).
- Demers, C. N., Antoniou, J., Mwale, F. Value and limitations of using the bovine tail as a model for the human lumbar spine. Spine. 29 (24), Phila Pa. 2793-2799 (2004).
- Hofmann, U. K., et al. Chondrocyte death after mechanically overloading degenerated human intervertebral disk explants is associated with a structurally impaired pericellular matrix. Journal of Tissue Engineering and Regenerative Medicine. 12 (9), 2000-2010 (2018).
- Pfirrmann, C. W., Metzdorf, A., Zanetti, M., Hodler, J., Boos, N. Magnetic resonance classification of lumbar intervertebral disc degeneration. Spine. 26 (17), Phila Pa. 1873-1878 (2001).
- Habermehl, K. H. Die Altersbestimmung bei Haus- und Labortieren. , Paul Parey. Berlin, Hamburg. (1975).
- Danalache, M., Erler, A. L., Wolfgart, J. M., Schwitalle, M., Hofmann, U. K. Biochemical changes of the pericellular matrix and spatial chondrocyte organization-Two highly interconnected hallmarks of osteoarthritis. Journal of Orthopaedic Research: Official Publication of the Orthopaedic Research Society. 38 (10), 2170-2180 (2020).
- Bonnaire, F. C., et al. The intervertebral disc from embryonic development to disc degeneration: insights into spatial cellular organization. The Spine Journal: Official Journal of the North American Spine Society. (21), 00198(2021).
- Vieira-Neto, A., Galvao, K. N., Thatcher, W. W., Santos, J. E. P. Association among gestation length and health, production, and reproduction in Holstein cows and implications for their offspring. Journal of Dairy Science. 100 (4), 3166-3181 (2017).
- Ott, A. Die Entwicklung des schwarzbunten Niederungsrindes von der Geburt bis zum 5. Lebensjahr mit variationsstatistischen Untersuchungen einer Population solcher Rinder von der Geburt bis zum 3. Lebensjahr. Zeitschrift für Tierzüchtung und Züchtungsbiologie. 45 (3), 259-308 (1940).
- Urban, J. P. G., Roberts, S., Ralphs, J. R. The Nucleus of the Intervertebral Disc from Development to Degeneration1. American Zoologist. 40 (1), 53-61 (2000).
- Risbud, M. V., Shapiro, I. M. Role of cytokines in intervertebral disc degeneration: pain and disc content. Nature Reviews. Rheumatology. 10 (1), 44-56 (2014).
- Iatridis, J. C., Michalek, A. J., Purmessur, D., Korecki, C. L. Localized intervertebral disc injury leads to organ level changes in structure, cellularity, and biosynthesis. Cell and Molecular Bioengineering. 2 (3), 437-447 (2009).
- Torre, O. M., Mroz, V., Bartelstein, M. K., Huang, A. H., Iatridis, J. C. Annulus fibrosus cell phenotypes in homeostasis and injury: implications for regenerative strategies. Annals of the New York Academy of Sciences. 1442 (1), 61-78 (2019).
- Rolauffs, B., et al. Proliferative remodeling of the spatial organization of human superficial chondrocytes distant from focal early osteoarthritis. Arthritis and Rheumatism. 62 (2), 489-498 (2010).
- Johnson, W. E., Roberts, S. Rumours of my death may have been greatly exaggerated': a brief review of cell death in human intervertebral disc disease and implications for cell transplantation therapy. Biochemical Society Transactions. 35, Pt 4 680-682 (2007).
- Roberts, S. Disc morphology in health and disease. Biochemical Society Transactions. 30, Pt 6 864-869 (2002).
- Lama, P., Kulkarni, J., Tamang, B. The role of cell clusters in intervertebral disc degeneration and its relevance behind repair. Spine Research. 03, 15(2017).
- Sharp, C. A., Roberts, S., Evans, H., Brown, S. J. Disc cell clusters in pathological human intervertebral discs are associated with increased stress protein immunostaining. European Spine Journal: Official Publication of the European Spine Society, the European Spinal Deformity Society and the European Section of the Cervical Spine Research Society. 18 (11), 1587-1594 (2009).
- Freemont, A. J. The cellular pathobiology of the degenerate intervertebral disc and discogenic back pain. Rheumatology. 48 (1), Oxford. 5-10 (2009).
- Müllers, Y., et al. Quantitative analysis of F-actin alterations in adherent human mesenchymal stem cells: Influence of slow-freezing and vitrification-based cryopreservation. PLoS One. 14 (1), 0211382(2019).
- McCann, M. R., Séguin, C. A. Notochord cells in intervertebral disc development and degeneration. Journal of Developmental Biology. 4 (1), 3(2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten