Method Article
Sezionamento ottico e visualizzazione del disco intervertebrale dallo sviluppo embrionale alla degenerazione
In questo articolo
Riepilogo
Presentiamo un metodo per studiare l'organizzazione spaziale dei condrociti nell'anulus fibrosus del disco intervertebrale utilizzando un metodo di sezionamento ottico.
Abstract
La degenerazione del disco intervertebrale (IVD) è una delle principali cause di lombalgia e comporta un alto grado di compromissione per gli individui colpiti. Per decodificare la degenerazione del disco e per essere in grado di sviluppare approcci rigenerativi è essenziale una conoscenza approfondita della biologia cellulare dell'IVD. Un aspetto di questa biologia che rimane ancora senza risposta è la domanda su come le cellule sono disposte spazialmente in uno stato fisiologico e durante la degenerazione. Le proprietà biologiche dell'IVD e la sua disponibilità rendono questo tessuto difficile da analizzare. Il presente studio indaga l'organizzazione spaziale dei condrociti nell'anulus fibroso dallo sviluppo embrionale precoce alla degenerazione allo stadio terminale. Un metodo di sezionamento ottico (Apotome) viene applicato per eseguire analisi di colorazione ad alta risoluzione utilizzando tessuto embrionale bovino come modello animale e tessuto del disco umano ottenuto da pazienti sottoposti a chirurgia della colonna vertebrale. Da una densità di condrociti molto elevata nel disco bovino embrionale precoce, il numero di cellule diminuisce durante la gestazione, la crescita e la maturazione. Nei dischi umani, un aumento della densità cellulare ha accompagnato la progressione della degenerazione tissutale. Come era già stato dimostrato nella cartilagine articolare, la formazione di cluster rappresenta una caratteristica della degenerazione avanzata del disco.
Introduzione
Il disco intervertebrale (IVD) è una struttura a base di cartilagine che biochimicamente e rispetto all'architettura cellulare, a prima vista, assomiglia per molti versi alla cartilaginearticolare 1. Infatti, sia la degenerazione IVD che l'osteoartrite (OA) della cartilagine articolare sono caratterizzate da restringimento dello spazio articolare a causa dell'usura della cartilagine, della cisti subcondrale e della formazione di osteofiti e della sclerosi subcondrale2,3. Nonostante queste apparenti somiglianze, l'architettura e il ruolo funzionale di entrambi i tessuti differiscono. Mentre la matrice della cartilagine articolare è formata principalmente da una rete di collagene di tipo II che forma arcade, l'IVD è costituito da tre diversi tipi di tessuto: il nucleo polposo ricco di collagene di tipo II al centro assorbe carichi assiali e li trasmette a un anello comprensivo di fibre circolari di collagene di tipo I densamente imballate che è chiamato anulus fibrosus. La loro funzione è quella di assorbire le pressioni assiali tradotte ricevute dal nucleo ricco di proteoglicani e acqua con la loro resistenza longitudinale a trazione delle fibre. Nella parte superiore e inferiore di ciascun nucleo e anulus una piastra terminale cartilaginea ialina forma la giunzione alle vertebre adiacenti4 (Figura 1).
Nella cartilagine articolare si possono trovare quattro distinti modelli spaziali di condrociti: coppie, stringhe, doppie corde, piccoli gruppi rispettivamente grandi5,6,7 (Figura 2). I cambiamenti in questo modello sono associati all'insorgenza e alla progressione dell'OA8,9. L'organizzazione spaziale dei condrociti è anche indicativa di una proprietà funzionale diretta della cartilagine, vale a dire la sua rigidità, sottolineando la rilevanza funzionale di questo approccio di classificazione basato su immagini10,11. Questi modelli possono inoltre essere identificati con la tecnologia clinicamente disponibile già esistente12. A causa delle somiglianze tra l'IVD e la cartilagine articolare, si può ipotizzare che nell'IVD siano presenti anche modelli caratteristici di condrociti. La formazione di cluster è un fenomeno osservato anche nella IVDdegenerata 13,14.
Quando si tenta di analizzare l'organizzazione cellulare spaziale nell'IVD, è necessario superare diverse difficoltà tecniche che non sono presenti quando si studia la cartilagine articolare:
In primo luogo, l'elaborazione del tessuto stesso è molto più impegnativa rispetto alla cartilagine ialina omogenea che è in gran parte composta da collagene di tipo II. Il principale componente della fibra dell'IVD è il collagene di tipo I, il che rende molto più difficile generare sezioni istologiche sottili. Mentre nella cartilagine articolare ialina anche le sezioni spesse possono essere facilmente analizzate a causa della natura "vetrosa" del tessuto, la rete di collagene di tipo I dell'IVD è otticamente altamente impenetrabile. Per questo motivo, un forte rumore di fondo è un problema comune nell'istologia dell'IVD. Un modo rapido ed economico per penetrare questo tessuto otticamente denso è l'uso di un dispositivo di sezionamento ottico, ad esempio per mezzo di un apotome. In un tale Apotome, una griglia viene inserita nel percorso di illuminazione di un microscopio a fluorescenza convenzionale. Di fronte alla griglia è posizionata una lastra di vetro parallela al piano. Questo si inclina avanti e indietro proiettando così la griglia nell'immagine in tre diverse posizioni. Per ogni posizione z, vengono create e sovrapposte tre immagini raw con la griglia proiettata. Tramite un software speciale, è possibile calcolare la luce fuori fuoco. Il principio di base è che, se la griglia è visibile, quell'informazione è a fuoco, se non è considerata sfocata. Con questa tecnica, immagini ben focalizzate e ad alta risoluzione possono essere acquisite in un ragionevole lasso di tempo.
In secondo luogo, il tessuto è difficile da reperire da donatori umani. Quando si esegue la sostituzione totale del ginocchio, è possibile ottenere l'intera superficie dell'articolazione per ulteriori analisi durante l'intervento chirurgico. Sebbene l'artrosi di un'articolazione diartrodiale sia anche una malattia dell'intera articolazione, ci sono tuttavia forti differenze focali nella qualità della cartilagine con di solito alcune aree dell'articolazione ancora intatte, ad esempio a causa del carico ridotto in quell'area. Questa situazione è diversa nell'IVD, dove la chirurgia viene solitamente eseguita solo quando il disco viene distrutto globalmente. Quando si ottiene tessuto da donatori umani dalla sala operatoria, il tessuto è anche altamente frammentato ed è necessario allocare correttamente il tessuto a uno dei tre tipi di cartilagine dell'IVD prima di effettuare ulteriori analisi. Per consentire analisi più dettagliate anche di sezioni tissutali più grandi e per esaminare lo sviluppo embrionale dell'IVD è quindi necessaria la scelta di un organismo modello animale.
Quando si sceglie un tale organismo modello è importante avere un sistema che sia paragonabile al disco umano per quanto riguarda la sua anatomia e le sue dimensioni, il suo carico meccanico, l'attuale popolazione cellulare e la sua composizione tissutale. Ai fini della tecnica qui presentata suggeriamo l'uso del tessuto del disco lombare bovino: Una proprietà critica del disco umano con conseguente suo basso potenziale rigenerativo è la perdita di cellule notocordali durante la maturazione nel nucleo. Tuttavia, in numerosi organismi modello le cellule notocordali possono essere rilevate per tutta la loro vita. La maggior parte dei pochi animali che perdono le loro cellule notocordali come pecore, capre o cani condrodistrofi hanno un IVD che è molto più piccolo dei dischi umani. Solo i dischi bovini lombari presentano un diametro del disco sagittale paragonabile a quelli degli IVD umani15.
Un fattore chiave che porta alla degenerazione precoce del disco è l'eccessivo carico meccanico. Le pressioni intradiscali di una mucca in piedi nella colonna lombare sono di circa 0,8 MPa con la colonna vertebrale allineata orizzontalmente. Sorprendentemente queste pressioni sono paragonabili alle pressioni intradiscali lombari riportate per la colonna vertebrale umana eretta (0,5 MPa)15,16. Anche la quantità di acqua e proteoglicani nei dischi bovini è paragonabile a quella dell'IVD dei giovaniumani 17. Pertanto, sebbene il modello di movimento effettivo dei segmenti di movimento possa differire negli animali quadrupedi dall'uomo bipede, per quanto riguarda il carico totale e le caratteristiche del disco, la mucca è molto più vicina alla biologia umana rispetto ad altri modelli animali stabiliti per l'IVD come pecore e cani.
In questo protocollo presentiamo una tecnica come analizzare i cambiamenti nell'IVD dal punto di vista dell'organizzazione spaziale dei condrociti dallo sviluppo embrionale precoce alla degenerazione dello stadio terminale.
Protocollo
Per l'analisi dello sviluppo e della maturazione embrionale sono stati utilizzati dischi bovini. Per valutare la degenerazione dell'IVD, sono stati analizzati campioni umani.
Il tessuto IVD umano è stato ottenuto da pazienti sottoposti a intervento chirurgico per degenerazione del disco lombare, prolasso del disco o trauma spinale nel Dipartimento di Chirurgia Ortopedica, nell'Ospedale Universitario di Tubinga e nel BG Trauma Centre Tübingen. La piena approvazione del comitato etico è stata ottenuta prima dell'inizio dello studio (numero di progetto 244/2013BO2). Il consenso informato scritto è stato ricevuto da tutti i pazienti prima della partecipazione. I metodi sono stati eseguiti in conformità con le linee guida approvate.
Il tessuto bovino è stato ottenuto dall'Ufficio di Stato bavarese per la salute e la sicurezza alimentare/Oberschleißheim e da un impianto di rendering a Warthausen (Germania). L'approvazione delle autorità locali e veterinarie è stata ricevuta per i tessuti di animali morti.
1. Raccolta del campione
- Tessuto IVD umano: posizionare immediatamente campioni ivD ottenuti per via intraoperatoria nel modified Eagle Medium (DMEM) di Dulbecco con il 2% (v/v) di penicillina-streptomicina e l'1,2% di (v/v) amfotericina B. Conservare a 4 °C fino a un'ulteriore lavorazione. Elaborare il tessuto entro 48 ore. In alternativa, conservare i tessuti a -20 °C per diverse settimane.
- Tessuto IVD bovino: assicurarsi di raccogliere il tessuto dagli animali entro 24 ore dalla morte.
Resecare i dischi bovini con le vertebre circostanti dagli animali morti in blocco. Trasportare il tessuto congelato su ghiaccio secco e conservare a -20 °C fino a ulteriore lavorazione.
NOTA: se sono previste solo analisi di fluorescenza e non sono previsti ulteriori metodi di quantificazione biochimica come ELISA o PCR, eseguire la fissazione del tessuto come spiegato di seguito. Ciò consente di mantenere il tessuto più a lungo in deposito prima che debba essere elaborato. Per prevenire il deterioramento della matrice tissutale, eseguire la fissazione entro 48 ore dalla raccolta, a meno che il tessuto non sia congelato direttamente.
2. Preparazione del campione
- Scongelare il tessuto congelato a temperatura ambiente. Elaborare il tessuto non appena non si sentono più cristalli di ghiaccio dopo una delicata compressione digitale del tessuto.
NOTA: Eseguire la preparazione del tessuto in DMEM in una capsula di Petri. - Identificare l'origine del tessuto IVD umano (anulus fibrosus, zona intermedia, nucleo polposo o piastra terminale cartilaginea) in base alle proprietà macroscopiche come la densità e l'orientamento del collagene.
- Prendi il segmento di movimento costituito dal disco IVD bovino con le sue due vertebre adiacenti e seziona il disco nel suo insieme dall'osso subcondrale usando una lama chirurgica (lama numero 15).
- Utilizzare due pinze anatomiche per capovolgere il disco per raggiungere le aree più centrate. Eseguire la dissezione. Assicurati di resecare il nucleo polposo per ultimo in quanto è molto più sottile dell'anulus, incline a strapparsi, e non si stacca facilmente in modo definito.
- Identificare le diverse aree della cartilagine.
- Ritagliare l'area di interesse dall'intero disco utilizzando una lama chirurgica (lama numero 20 o 22). In alternativa, utilizzare una lama criotomica.
NOTA: Poiché i dischi bovini vengono inseriti in blocco come parte della colonna vertebrale, i dischi possono essere preparati in toto. Ciò rende molto più facile la corretta identificazione dei diversi tipi di cartilagine. Quando si seziona il disco nel modo sopra descritto, la piastra terminale cartilaginea rimane sulle vertebre. Se quest'area deve essere studiata, è meglio toglierla dall'osso sottostante con uno scalpello che lavora in una direzione tangenziale leggermente piegata.
- Nel caso in cui gli embrioni abbiano una lunghezza della groppa della corona inferiore a 20 cm, assicurarsi di elaborare gli embrioni in toto per preservare l'architettura tissutale dell'IVD. Non eseguire alcuna dissezione delle vertebre in questi casi.
- Una volta che il disco è stato resecato in toto, identificare le diverse aree della cartilagine.
- Eseguire la decalcificazione in acido etilendiamminotetraacetico (EDTA) (20% (p/v); pH = 7,4) a temperatura ambiente. Scegli il volume in base alla dimensione del campione: l'intero tessuto deve essere ben coperto con EDTA.
- Cambiare la soluzione di decalcificazione ogni giorno che può durare fino a 5 giorni a seconda delle dimensioni del tessuto.
- Verificare che la decalcificazione abbia successo con un ago calibro 20 che penetra nelle vertebre senza una notevole resistenza.
NOTA: Il cambio giornaliero della soluzione di decalcificazione è importante per evitare che il legante chelato EDTA si saturi per mantenere l'effettività della reazione. Previene anche la colonizzazione batterica.
3. Classificazione dell'età, dell'integrità e della degenerazione del campione
- Classificare il tessuto del disco umano in una delle cinque seguenti categorie con l'aiuto di informazioni cliniche e di raggi X e risonanza magnetica18 (Figura 3).
NOTA: Categoria I: Per servire come campione quasi sano utilizzare anulus senza alcun segno radiologico di degenerazione IVD derivata da trauma spinale acuto.
Categoria II: Per illustrare una situazione di infiammazione acuta con degenerazione iniziale utilizzare tessuto della zona intermedia da pazienti con sintomi clinici con una durata inferiore a 4 settimane.
Categoria III: Descrivere una situazione in cui la reazione infiammatoria aveva già avuto il tempo di influenzare il tessuto e le cellule prelevano tessuto da pazienti che sono stati operati per un prolasso nucleare ma con una durata dei sintomi superiore a 4 settimane.
Categoria IV: Per la degenerazione del disco moderata selezionare l'anulus ottenuto dalla chirurgia con fusione intercorporea per la malattia degenerativa del disco con un punteggio pfirrmann di 3 o 4 nella risonanza magnetica19.
Categoria V: Per l'anulus del processo di degenerazione allo stadio terminale ottenuto da un intervento chirurgico con fusione intercorporea per malattia degenerativa del disco con un punteggio di Pfirrmann di 5. - Classificare il tessuto bovino in base allo stadio di sviluppo/età dell'animale in una delle otto categorie, come indicato nella tabella 1.
- Calcola l'età di gestazione sulla lunghezza della corona degli embrioni in base alla formula suggerita da Keller:
Età di gestazione in mesi =
NOTA: Gli animali nelle prime 4 settimane di gestazione presentano una lunghezza corona-groppa di 0,8-2,2 cm20.
- Calcola l'età di gestazione sulla lunghezza della corona degli embrioni in base alla formula suggerita da Keller:
4. Fissazione dei tessuti
- Fissare i campioni in 10 volte il volume del campione di soluzione di formaldeide al 4% (p/v) in soluzione salina tamponata con fosfato (PBS) durante la notte a 4 °C.
NOTA: La soluzione di formaldeide penetra nei tessuti ad una velocità di circa 1 mm/ora da ciascuna direzione. Per campioni molto piccoli o molto grandi potrebbe essere necessario un aggiustamento del tempo di esposizione. - Conservare il tessuto in PBS a 4 °C fino a un'ulteriore lavorazione.
5. Sezionamento istologico
- Incorporare i campioni in un mezzo di incorporamento solubile in acqua sulla manopola del criotomo.
- Posizionare il tessuto sulla manopola in modo tale che venga generato un piano assiale o un piano che taglia le lamelle di collagene di tipo I perpendicolari (ad esempio, un piano di sezionamento sagittale mediano).
NOTA: Il tessuto deve essere completamente coperto dal mezzo di incorporamento.
- Posizionare il tessuto sulla manopola in modo tale che venga generato un piano assiale o un piano che taglia le lamelle di collagene di tipo I perpendicolari (ad esempio, un piano di sezionamento sagittale mediano).
- Sezionare il tessuto incorporato ad uno spessore di 70 μm in campioni umani e 40 μm in campioni bovini utilizzando un criotomo standard.
NOTA: La differenza di spessore della sezione è dovuta alla differenza di integrità del tessuto tra il disco bovino intatto e il tessuto umano altamente degenerato. - Raccogli le sezioni su una diapositiva di vetro.
- Circondare le sezioni di tessuto con una penna idrofoba.
- Risciacquare le sezioni 3 volte con soluzione salina tamponata con fosfato (PBS) per rimuovere il mezzo incorporante solubile in acqua.
6. Colorazione a fluorescenza
- Aggiungere 60 μL dell'1% (v/v) di DAPI (Exmax 358 nm, Emmax 461 nm) e l'1% (v/v) di colorazione Actin Tracking (Exmax 540 nm, Emmax 565 nm) in PBS e incubare per 5 minuti a temperatura ambiente.
NOTA: Il protocollo di colorazione qui descritto è quello di visualizzare il nucleo utilizzando la colorazione nucleare DAPI (blu) e il citoplasma utilizzando Actin Tracking Stain (rosso). L'IVD ha una forte autofluorescenza dovuta alle fibre di collagene nel canale verde. La quantità di fluido aggiunto alle sezioni in questo protocollo è destinata a sezioni di dimensioni di circa 5 mm x 5 mm. Per le sezioni più grandi, questo importo deve essere aumentato di conseguenza. Eseguire tutti i lavori in ambienti senza esposizione diretta alla luce solare e con luci soffuse per evitare lo sbiancamento del colorante. - Rimuovere il fluido colorante con una pipetta e lavare tre volte con 60 μL di PBS ogni volta.
- Aggiungere un mezzo di montaggio adatto e coprire le sezioni con uno slittamento di copertura.
NOTA: assicurarsi che non vi siano bolle d'aria intrappolate quando si aggiunge lo slittamento del coperchio. Questo è meglio farlo iniziando il contatto dello slip con la diapositiva su un cerchio e quindi lasciando che lo slip scenda lentamente.
7. Imaging ed elaborazione microscopica
- Posizionare un vetrino con una sezione macchiata sul portacampioni del microscopio.
NOTA: A causa della fitta rete di collagene di tipo I dell'IVD, la luce diffusa rende il tessuto difficile da visualizzare utilizzando la microscopia a fluorescenza convenzionale. Un modo per risolvere questo problema consiste nell'eseguire il sezionamento ottico utilizzando l'illuminazione strutturata. Ciò consente anche di eseguire il rendering di una proiezione tridimensionale dell'intero campione in entrambi i canali (blu e rosso). Questo viene fatto meglio utilizzando l'impostazione di illuminazione strutturata e la modalità Mosaico con un obiettivo di ingrandimento 10x per ottenere una panoramica del campione e ricostruzioni 3D di singoli modelli. - Avviare il dispositivo di illuminazione strutturata.
- Eseguire l'imaging a campo visivo singolo con un microscopio a fluorescenza adatto, filtri a fluorescenza e un'illuminazione adeguata.
NOTA: regolare il tempo di esposizione per tutti i filtri utilizzati per standardizzare l'acquisizione dell'immagine. Per ottenere una rappresentazione accurata del campione ad una risoluzione più alta, le sezioni con un ingrandimento più elevato (ad esempio, obiettivo 20x). - Post-elaborare le immagini ottimizzando l'intensità e la luminosità utilizzando un software di ottimizzazione delle immagini compatibile con il microscopio a fluorescenza.
- Eseguire l'imaging a campo visivo singolo con un microscopio a fluorescenza adatto, filtri a fluorescenza e un'illuminazione adeguata.
- Per visualizzare la sezione nel suo complesso utilizzare la tecnica di imaging a mosaico
- Apri le impostazioni di acquisizione (premi su 6D- Acquisizione)dal pannello della barra degli strumenti.
- Regolare le impostazioni del mosaico (in MosaiX Register) e definire il numero di colonne e righe di immagini del campo visivo che verranno successivamente unite in un'unica immagine panoramica.
- Premere Imposta e regolare la correzione dello stato attivo dei singoli riquadri.
NOTA: è quasi impossibile per una grande sezione di tessuto avere l'intera superficie del tessuto in un unico piano di messa a fuoco. I riquadri immagine a diversi livelli focali possono essere acquisiti da "MosaiX Acquisition". - Per avviare l'acquisizione dei riquadri immagine, premere Start.
- Cucire le tessere fotografate utilizzando la funzione di cucitura ( pulsanteStitching) con il 20% di sovrapposizione incorporata nel software.
- Post-elaborare le immagini ottimizzando l'intensità e la luminosità utilizzando un software di ottimizzazione delle immagini compatibile con il microscopio a fluorescenza.
- Per analizzare l'organizzazione spaziale dei condrociti, utilizzare la funzione 3D incorporata nel software.
- Regolare le impostazioni z-stack. Definire i parametri di scansione: definire le posizioni di avvio e arresto nell'asse z e la distanza della sezione attivando il pulsante Start/Stop.
NOTA: il software calcola automaticamente il numero di sezioni. - Per avviare l'acquisizione delle immagini z-stacks, premere Start.
- Post-elaborare le immagini ottimizzando l'intensità e la luminosità utilizzando un software di ottimizzazione delle immagini compatibile con il microscopio a fluorescenza.
- Regolare le impostazioni z-stack. Definire i parametri di scansione: definire le posizioni di avvio e arresto nell'asse z e la distanza della sezione attivando il pulsante Start/Stop.
- Esporta le immagini con un formato di file compatibile con il software di elaborazione delle immagini.
NOTA: Esportare le ricostruzioni 3D come singole immagini e/o come modello 3D interattivo o in formato video.
8. Identificazione del modello cellulare e valutazione della densità
- Aprire le immagini del mosaico esportate dell'intera sezione del tessuto in un programma di elaborazione delle immagini appropriato.
- Definire le aree sottoposte alla valutazione della densità cellulare definendo le regioni di interesse di 500 μm x 500 μm nelle immagini.
NOTA: tutti i riquadri che non hanno una qualità dell'immagine adeguata sono esclusi dall'analisi. - Identificare i singoli modelli cellulari.
NOTA: le celle singole sono definite come singole celle, completamente incapsulate all'interno della matrice adiacente. Le coppie sono definite come due celle adiacenti in prossimità (<25 μm) per cui le celle sono interconnesse attraverso le loro matrici (vedi Figura 2). Le formazioni di stringhe sono almeno tre condrociti allineati in linea (dal centro dei nuclei <25 μm). Queste celle sono racchiuse da una matrice intatta e le interconnessioni matriciali possono essere viste tra ogni cellula. I cluster rappresentano più celle che si trovano in prossimità diretta l'una dell'altra (<25 μm) e sono incapsulate in una grande lacuna priva di matrice. - Utilizzare un plug-in di conteggio delle cellule per l'analisi quantitativa dei modelli cellulari.
NOTA: La colorazione del citoplasma rappresenta un metodo di verifica per identificare i diversi modelli spaziali. - Calcola la densità delle celle dividendo le celle contate per la dimensione della regione di interesse scelta.
Risultati
Utilizzando immagini a mosaico, l'architettura dell'IVD con la sua fitta rete di fibre di collagene nell'anolo e il nucleo più morbido può essere chiaramente riconosciuta (Figura 4). Una continua diminuzione della densità cellulare può essere osservata durante lo sviluppo embrionale (Figura 5). Mentre nelle prime fasi dello sviluppo dell'IVD si può trovare una densità cellulare di 11.435 cellule/mm² nell'anulus fibrosus bovino e 17.426 cellule/mm² nel nucleo polposo bovino, questi numeri diminuiscono rapidamente a 1.011 cellule/mm² (anulus fibroso bovino) e 488 cellule/mm² (nucleo polposo bovino) fino alla nascita. Nei bovini adulti si osservano 71 cellule/mm² (anulus fibrosus) risp. 106 cellule/mm² (nucleo polposo) (Figura 6 A-B). L'utilizzo dell'imaging bicanale con l'Apotome permette di visualizzare l'architettura 3D dei pattern spaziali (Figura 7).
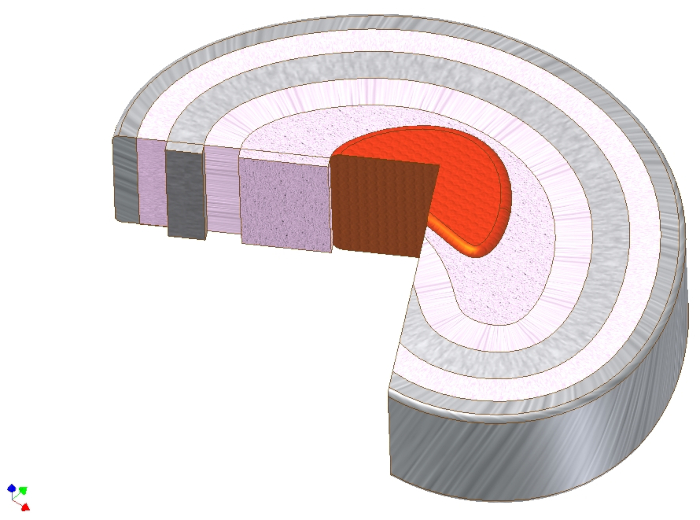
Figura 1. Anatomia macroscopica del disco intervertebrale. Disegno schematico del disco intervertebrale che mostra il nucleo polposo (rosso), direttamente intorno ad esso la zona intermedia (rosa), e poi in strati circolari intorno ad esso l'anulus fibrosus. Si noti la direzione dell'angolo di compensato delle fibre di collagene di tipo I nell'anulus fibroso. Il carico assiale al nucleo può quindi essere tradotto in forze di trazione assiale delle fibre di collagene. Fare clic qui per visualizzare una versione più grande di questa figura.
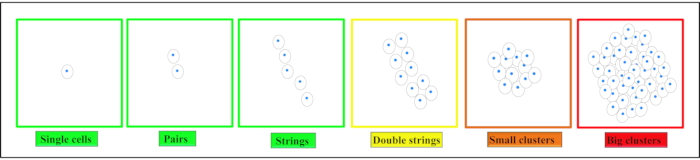
Figura 2. Illustrazione schematica di diversi modelli organizzativi spaziali di condrociti. A seconda del tessuto, i condrociti si trovano come singole cellule, coppie o stringhe nella cartilagine sana. Con l'inizio della degenerazione questi modelli cambiano per formare doppie stringhe, piccoli cluster e poi grandi cluster nella degenerazione dello stadio finale. Questa figura è stata modificata da Danalache, M. et al.21. Fare clic qui per visualizzare una versione più grande di questa figura.
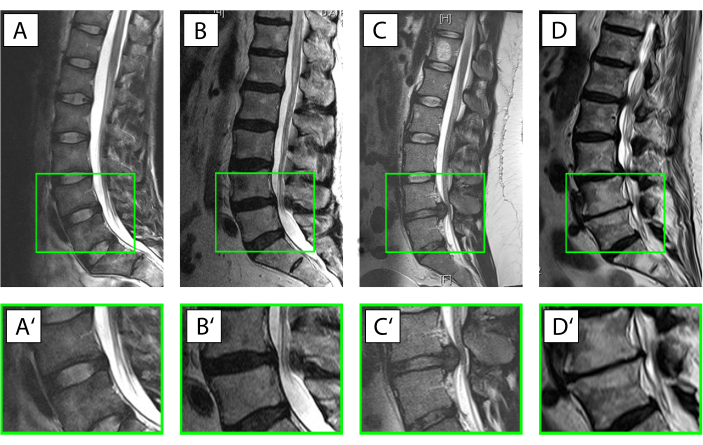
Figura 3. Diverse condizioni del disco intervertebrale (IVD). (A-D') Risonanza magnetica pesata sagittale T2 della colonna lombare umana (A-D), con il segmento di moto ingrandito L4/L5 (A'-D'). Il lato ventrale del paziente è rivolto a sinistra, il lato dorsale è rivolto a destra con il canale spinale con il suo segnale bianco per il liquido cerebrospinale. (A,A') IVD intatto con l'anulus visualizzato con un segnale ipointense (nero) a causa dell'alto contenuto di collagene di tipo I e il nucleo visualizzato molto più luminoso (iperintense) a causa dell'alto contenuto di proteoglicani leganti l'acqua (Pfirrmann grado19 I). (B, B') Inizio della degenerazione IVD con una perdita del segnale d'acqua dal nucleo polposo e dove si perde la distinzione tra ano e nucleo (Pfirrmann grado19 IV). (C, C') Prolasso nucleare acuto con ancora un segnale d'acqua prominente nell'area del nucleo indicativo di un IVD altrimenti intatto e il tessuto del disco che sporge dorsalmente nel canale spinale. (D,D') Degenerazione avanzata del disco con un IVD in gran parte distrutto con una completa perdita del segnale d'acqua all'interno del disco, formazione di spondilofite ventrali e dorsali e sclerosi subcondrale delle vertebre corrispondente a un grado Pfirrmann19 di V. Fare clic qui per visualizzare una versione più grande di questa figura.
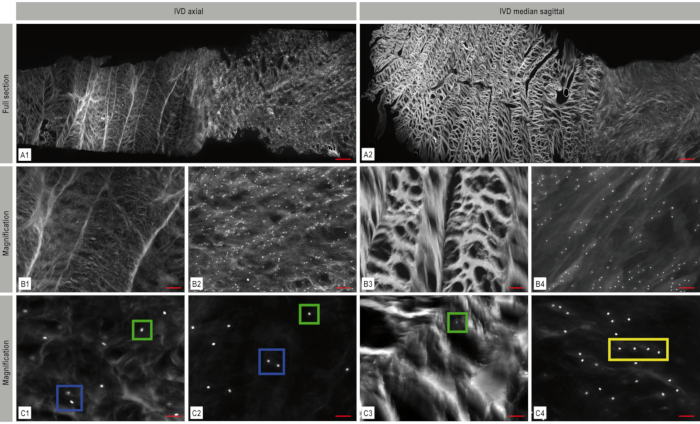
Figura 4. Imaging a fluorescenza a mosaico del disco intervertebrale (IVD). L'architettura dell'IVD con la sua fitta rete di fibre di collagene nell'anulus fibroso e il nucleo più morbido può essere chiaramente riconosciuta. La colorazione DAPI-nucleare (bianca) nel piano assiale (A1) e sagittale (A2) mostra la distribuzione e la disposizione cellulare all'interno dell'IVD. Le aree rappresentative ingrandite di queste immagini a mosaico sono visualizzate in B1-B4 e C1-C4 che illustrano l'organizzazione spaziale dei condrociti - in questo caso singole cellule (scatola verde), coppie (scatola blu) e stringhe (scatola gialla). A: barra di scala 1.000 μm, B1-B4: barra di scala 200 μm, C1-C4: barra di scala: 50 μm. Questa cifra è stata modificata da Bonnaire, F.C. et al.22. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5. Diversi stadi di sviluppo e maturazione dell'anulus fibrosus bovino e dell'anulus fibrosus degenerante umano. Colorazione nucleare DAPI. Le immagini del mosaico mostrano un intero disco embrionale precoce in una sezione assiale (A1) e immagini rappresentative dell'anulus bovino durante lo sviluppo embrionale, la maturazione e l'inizio della degenerazione (A2-A8). (B1-B3) Anulus da IVD umani è stato ottenuto intraoperatoriamente. Una continua diminuzione della densità cellulare può essere osservata durante lo sviluppo del disco embrionale. Un modello cellulare di organizzazione spaziale più elevato sembra essere presente soprattutto intorno alla nascita. Nel disco umano adulto durante la degenerazione, la densità cellulare aumenta di nuovo e si può osservare una crescente formazione di cluster. Scala bar 100 μm. Wog: settimane di gestazione. Questa cifra è stata modificata da Bonnaire, F.C. et al.22. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 6. Riduzione della densità cellulare durante lo sviluppo e la maturazione del disco intervertebrale bovino. La conta cellulare media (deviazione standard) per mm² è illustrata da diagrammi a barre per l'anulus fibrosus bovino (A) e il nucleo polposo bovino (B). Una chiara riduzione della densità cellulare può essere osservata soprattutto durante il periodo embrionale che continua in misura minore almeno fino alla piena maturazione del disco (n=72). Wog: settimane di gestazione. Questa cifra è stata modificata da Bonnaire, F.C. et al.22. Fare clic qui per visualizzare una versione più grande di questa figura.
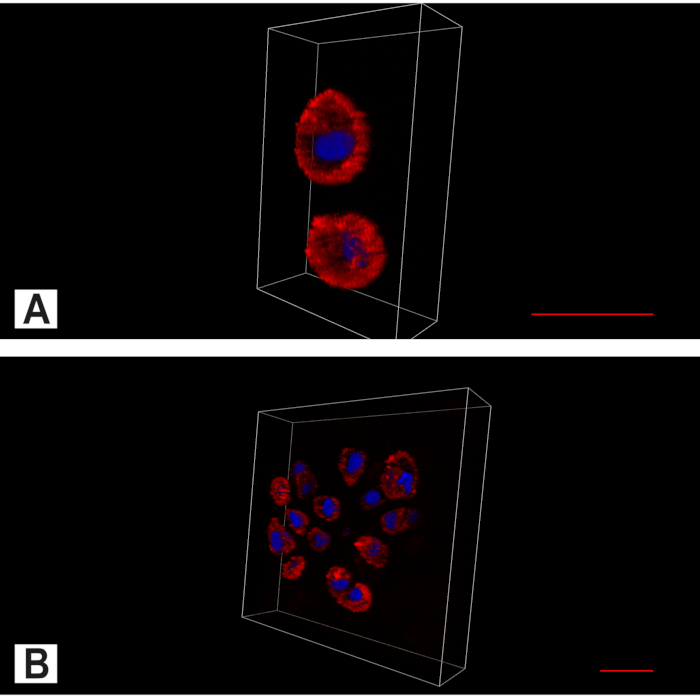
Figura 7. Imaging apotome del disco intervertebrale (IVD). Immagine bicanale che mostra il citoplasma (rosso, colorazione dell'actina) e il nucleo (blu, colorazione nucleare DAPI). (A) Nell'IVD intatto, oltre al modello spaziale predominante dei singoli condrociti, si trovano anche coppie. (B) In gruppi di cellule anulus degenerate si possono trovare cluster di cellule. Barra della scala 20 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Video 1. Imaging apotome di una coppia nel disco intervertebrale (IVD) come modello 3D. Immagini bicanale che mostrano il citoplasma (rosso, colorazione di actina) e il nucleo (blu, colorazione nucleare DAPI) di una coppia. Clicca qui per scaricare questo video.
Video 2. Imaging apotoma di un cluster nel disco intervertebrale (IVD) come modello 3D. Immagini bicanale che mostrano il citoplasma (rosso, colorazione di actina) e il nucleo (blu, colorazione nucleare DAPI) di un cluster. Clicca qui per scaricare questo video.
Tabella 1: Sviluppo embrionale bovino, maturazione e crescita dopo la nascita con le sue diverse pietre miliari. Wog - settimane di gestazione. Periodo di gestazione circa 283 giorni, aspettativa di vita naturale 20-25 anni20,23,24. Fare clic qui per scaricare questa tabella.
Discussione
Utilizzando la microscopia a fluorescenza aumentata dall'imaging a mosaico e dal sezionamento ottico, abbiamo valutato la disposizione spaziale dei condrociti nell'anoulus dell'IVD lombare durante lo sviluppo, la maturazione e la degenerazione. Mentre il tessuto degenerativo poteva essere raccolto da pazienti sottoposti a chirurgia della colonna vertebrale per la degenerazione del disco, l'analisi del periodo embrionale e della fase di maturazione richiedeva l'uso di un organismo modello (bovino). Alte densità cellulari sono state notate nell'anolo durante lo sviluppo embrionale precoce. Nell'ulteriore corso dello sviluppo, si potrebbe osservare la crescita e la maturazione postnatale una pronunciata diminuzione della densità cellulare. Nel tessuto umano con degenerazione del disco avanzata, potremmo quindi quantificare un aumento della densità cellulare nell'anulus fibrosus.
Il rapido aumento del volume tissutale combinato con cellule notocordali attivamente in divisione e biosinteticamente attive sono probabili ragioni per i cambiamenti nella densità cellulare osservati nell'embrione25. I meccanismi con cui la densità cellulare aumenta di nuovo con la degenerazione rimangono, tuttavia, ancora poco chiari. I processi degenerativi dell'anulus portano a una serie di cambiamenti patologici tra cui l'aumento dell'innervazione e dell'infiammazione dei tessuti, l'upregulation degli enzimi che degradano la matrice e la produzione di fattori di crescita, e anche cambiamenti nella cellularità26,27,28.
Quando si considera la presenza cellulare in funzione dell'organizzazione spaziale cellulare basata su modelli noti dalla cartilaginearticolare 7,9 non abbiamo trovato alcuna organizzazione spaziale riconoscibile nei primi dischi embrionali in cui le cellule sembrano essere densamente imballate e che abbiamo considerato presenti come singole cellule22. Questo risultato è coerente con i risultati della cartilagine articolare embrionale7. Nell'anulus maturo sano, le singole cellule rappresentano il modello spaziale predominante22. Coppie e formazioni di corde possono, tuttavia, essere osservate anche22. Più il tessuto è degenerato nei dischi umani, maggiore è la proporzione di cellule che si possono trovare nei cluster22. Il modello fisiopatologico suggerito da Rolauffs nella cartilaginearticolare 7,9,29 mostra un'intrigante somiglianza con i nostri risultati. Precedenti studi sulla degenerazione IVD avevano anche già delineato la formazione di cluster come un segno distintivo della degenerazione del disco14,30,31,32,33. Poiché questi cluster possono essere trovati principalmente in tessuti altamente degenerati, la formazione di cluster potrebbe indicare un tentativo fallito del tessuto di riparare il danno degenerativo34. Stabilendo una forte correlazione tra il pattern condrocitario localmente predominante e l'elasticità tissutale, un'elevata rilevanza funzionale di questi pattern potrebbe essere dimostrata nella cartilaginearticolare 10,11. Si può ipotizzare che una tale rilevanza funzionale si applichi anche all'organizzazione spaziale dei condrociti nell'IVD.
Le analisi istologiche a fluorescenza sono un mezzo facile da trovare e attraente per analizzare i cambiamenti morfologici dei tessuti. Quando si cerca di analizzare istologicamente l'IVD, ci sono distinte difficoltà tecniche che devono essere superate: in primo luogo, la limitata disponibilità di tessuto umano rende importante scegliere un organismo modello animale adeguato con cui quegli aspetti della malattia possono essere studiati dove non è possibile ottenere campioni umani. Per la domanda di ricerca affrontata in questo studio, abbiamo scelto un modello di animale bovino.
In secondo luogo, l'elaborazione dell'IVD ricco di collagene di tipo I è molto più impegnativa rispetto alla maggior parte degli altri tessuti umani. La fitta rete di fibre di collagene di tipo I disperde fortemente la luce fluorescente creando un segnale di rumore di fondo elevato. Questo problema viene affrontato al meglio utilizzando una tecnica che consenta la sottrazione o l'eliminazione di tale segnale di fondo. Un metodo ben noto per farlo è la microscopia confocale. Mentre la qualità dell'immagine delle immagini LASER acquisite confocali è solitamente eccellente, gli svantaggi di questa tecnica sono che richiede relativamente tempo e come tale non consente l'analisi di aree tissutali più grandi mediante l'imaging a mosaico. In secondo luogo, i microscopi confocali sono relativamente costosi e non disponibili ovunque. Un modo molto più rapido ed economico per filtrare il rumore di fondo è quello di eseguire il sezionamento ottico, ad esempio, per mezzo di un Apotome.
Per essere in grado di interpretare correttamente i risultati, è essenziale anche allocare correttamente il tessuto che deve essere analizzato alla sua origine nell'IVD. Mentre questo compito è relativamente semplice quando si ha un intero disco bovino tra cui scegliere, può essere molto impegnativo quando si riceve tessuto umano dalla sala operatoria. La caratteristica dell'anulus fibrosus è la sua rete di collagene di tipo I molto densa in un orientamento a fibra angolare. Il nucleo, al contrario, è una struttura gelatinosa amorfa in cui nessuna architettura di collagene superiore è visibile ad occhio nudo. La zona intermedia si trova tra questi due estremi e possiede anche una chiara architettura di fibre di collagene, ma è molto più morbida e meno densa dell'anulus fibrosus. La piastra terminale cartilaginea è costituita da cartilagine ialina, non si presenta con un'architettura di collagene riconoscibile ad occhio nudo ma è piuttosto "vetrosa" come suggerisce il termine "ialino". A differenza del nucleo polposo è però anche molto rigido, non può essere deformato, ed è situato sull'osso subcondrale che spesso può ancora essere riconosciuto dall'ispezione del tessuto.
Una volta identificata correttamente l'origine del tessuto, il tessuto deve ancora essere correttamente orientato per il sezionamento per ottenere immagini standardizzate che consentano anche una corretta lettura qualitativa e quantitativa. Nell'orientamento ad altre tecniche di imaging come la risonanza magnetica suggeriamo due piani di analisi standard: una sezione mediana-sagittale e una nel piano assiale. Questi due piani forniranno anche una buona impressione dell'architettura della rete di fibre di collagene di tipo I dell'anulus. Nell'interpretare i risultati ottenuti dalla colorazione F-actina bisogna tenere presente che il congelamento dei campioni di tessuto può causare alterazioni della struttura citoscheletrica35 che non dovrebbero, tuttavia, influenzare l'organizzazione spaziale dei condrociti.
Comprendere appieno la biologia cellulare dell'IVD è una delle sfide ancora aperte nella nostra comprensione della degenerazione e della rigenerazione del disco36. Domande che a volte sembrano banali, come la disposizione fisiologica delle cellule nei tessuti sani o la questione della riorganizzazione cellulare durante la degenerazione, rimangono, ad oggi, senza risposta. Le conoscenze ottenute possono permetterci di utilizzare questo marcatore di degenerazione basato su immagini per valutare la qualità dei tessuti, indagare la reversibilità della formazione di cluster e quindi eventualmente definire una finestra terapeutica in cui i processi degenerativi possono ancora essere presi di mira con successo.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo i nostri co-autori delle pubblicazioni originali per il loro aiuto e supporto. Ringraziamo Charlotte Emma Bamberger per aver contribuito ad acquisire le immagini dell'apotoma.
Materiali
| Name | Company | Catalog Number | Comments |
| Amphotericin B | Merck KGaA, Germany | A2942 | |
| Adhesion Microscope Slides SuperFrost Plus | R. Langenbrinck, Germany | 03-0060 | |
| ApoTome | Carl Zeiss MicroImaging GmbH, Germany | 462000115 | |
| AxioVision Rel. 4.8 with Modul MosaiX | Carl Zeiss MicroImaging GmbH, Germany | ||
| CellMask Actin Tracking Stain | Thermo Fischer Scientific, US | A57249 | |
| Cryostat | Leica Biosystems, US | CM3050S | |
| DAPI | Thermo Fischer Scientific, US | D1306 | |
| Dulbecco's modified Eagle's medium (DMEM) | Gibco, Life Technologies, Germany | 41966052 | |
| Ethylenediaminetetraacetic acid | Sigma-Aldrich, US | 60004 | |
| Fluorescence Miscoscope - Axio Observer Z1 with Axio Cam MR3 and Colibri | Carl Zeiss MicroImaging GmbH, Germany | 3834000604 | |
| Formaldehyde | Merck KGaA, Germany | 104002 | |
| Image J 1.53a, with Cell counter plugin | National Insittute of Health (NIH), US | ||
| Invitrogen Alexa Fluor 568 Phalloidin | Thermo Fischer Scientific, US | A12380 | |
| Microscopic Cover Glasses | R. Langenbrinck, Germany | 01-1818/1 | |
| PAP Pen Liquid Blocker | Science Sevices GmbH, Germany | N71310 | |
| Penicillin-Streptomycin | Sigma-Aldrich, US | P4333 | |
| Phosphate buffered saline | Sigma-Aldrich,US | P5119 | |
| Scalpel | pf medical AG, Germany | 2023-01 | |
| Tissue-tek O.C.T. Compound | Sakura Finetek, Netherlands | SA6255012 |
Riferimenti
- Urban, J. P. G., Roberts, S. Degeneration of the intervertebral disc. Arthritis Research and Therapy. 5 (3), 120-130 (2003).
- Gupta, K. B., Duryea, J., Weissman, B. N. Radiographic evaluation of osteoarthritis. Radiologic Clinics of North America. 42 (1), 11-41 (2004).
- Pye, S. R., et al. Lumbar disc degeneration: association between osteophytes, end-plate sclerosis and disc space narrowing. Annals of the Rheumatic Diseases. 66 (3), 330-333 (2007).
- Humzah, M. D., Soames, R. W. Human intervertebral disc: structure and function. The Anatomical Record. 220 (4), 337-356 (1988).
- Schumacher, B. L., Su, J. L., Lindley, K. M., Kuettner, K. E., Cole, A. A. Horizontally oriented clusters of multiple chondrons in the superficial zone of ankle, but not knee articular cartilage. The Anatomical Record. 266 (4), 241-248 (2002).
- Rolauffs, B., Williams, J. M., Grodzinsky, A. J., Kuettner, K. E., Cole, A. A. Distinct horizontal patterns in the spatial organization of superficial zone chondrocytes of human joints. Journal of Structural Biology. 162 (2), 335-344 (2008).
- Felka, T., et al. Loss of spatial organization and destruction of the pericellular matrix in early osteoarthritis in vivo and in a novel in vitro methodology. Osteoarthritis and Cartilage. 24 (7), 1200-1209 (2016).
- Rolauffs, B., et al. Onset of preclinical osteoarthritis: the angular spatial organization permits early diagnosis. Arthritis and Rheumatism. 63 (6), 1637-1647 (2011).
- Aicher, W. K., Rolauffs, B. The spatial organization of joint surface chondrocytes: review of its potential roles in tissue functioning, disease and early, preclinical diagnosis of osteoarthritis. Annals of the Rheumatic Diseases. 73 (4), 645-653 (2014).
- Danalache, M., Jacobi, L. F., Schwitalle, M., Hofmann, U. K. Assessment of biomechanical properties of the extracellular and pericellular matrix and their interconnection throughout the course of osteoarthritis. Journal of Biomechanics. 97, 109409(2019).
- Danalache, M., et al. Changes in stiffness and biochemical composition of the pericellular matrix as a function of spatial chondrocyte organization in osteoarthritic cartilage. Osteoarthritis and Cartilage. 27 (5), 823-832 (2019).
- Tschaikowsky, M., et al. Proof-of-concept for the detection of early osteoarthritis pathology by clinically applicable endomicroscopy and quantitative AI-supported optical biopsy. Osteoarthritis and Cartilage. 29 (2), 269-279 (2021).
- Ciapetti, G., et al. Ex vivo observation of human intervertebral disc tissue and cells isolated from degenerated intervertebral discs. European Spine Journal: Official Publication of the European Spine Society, the European Spinal Deformity Society and the European Section of the Cervical Spine Research Society. 21, Suppl 1 10(2012).
- Johnson, W. E., Eisenstein, S. M., Roberts, S. Cell cluster formation in degenerate lumbar intervertebral discs is associated with increased disc cell proliferation. Connective Tissue Research. 42 (3), 197-207 (2001).
- Buttermann, G. R., Beaubien, B. P., Saeger, L. C. Mature runt cow lumbar intradiscal pressures and motion segment biomechanics. The Spine Journal: Official Journal of the North American Spine Society. 9 (2), 105-114 (2009).
- Wilke, H. J., Neef, P., Caimi, M., Hoogland, T., Claes, L. E. New in vivo measurements of pressures in the intervertebral disc in daily life. Spine. 24 (8), Phila Pa. 755-762 (1999).
- Demers, C. N., Antoniou, J., Mwale, F. Value and limitations of using the bovine tail as a model for the human lumbar spine. Spine. 29 (24), Phila Pa. 2793-2799 (2004).
- Hofmann, U. K., et al. Chondrocyte death after mechanically overloading degenerated human intervertebral disk explants is associated with a structurally impaired pericellular matrix. Journal of Tissue Engineering and Regenerative Medicine. 12 (9), 2000-2010 (2018).
- Pfirrmann, C. W., Metzdorf, A., Zanetti, M., Hodler, J., Boos, N. Magnetic resonance classification of lumbar intervertebral disc degeneration. Spine. 26 (17), Phila Pa. 1873-1878 (2001).
- Habermehl, K. H. Die Altersbestimmung bei Haus- und Labortieren. , Paul Parey. Berlin, Hamburg. (1975).
- Danalache, M., Erler, A. L., Wolfgart, J. M., Schwitalle, M., Hofmann, U. K. Biochemical changes of the pericellular matrix and spatial chondrocyte organization-Two highly interconnected hallmarks of osteoarthritis. Journal of Orthopaedic Research: Official Publication of the Orthopaedic Research Society. 38 (10), 2170-2180 (2020).
- Bonnaire, F. C., et al. The intervertebral disc from embryonic development to disc degeneration: insights into spatial cellular organization. The Spine Journal: Official Journal of the North American Spine Society. (21), 00198(2021).
- Vieira-Neto, A., Galvao, K. N., Thatcher, W. W., Santos, J. E. P. Association among gestation length and health, production, and reproduction in Holstein cows and implications for their offspring. Journal of Dairy Science. 100 (4), 3166-3181 (2017).
- Ott, A. Die Entwicklung des schwarzbunten Niederungsrindes von der Geburt bis zum 5. Lebensjahr mit variationsstatistischen Untersuchungen einer Population solcher Rinder von der Geburt bis zum 3. Lebensjahr. Zeitschrift für Tierzüchtung und Züchtungsbiologie. 45 (3), 259-308 (1940).
- Urban, J. P. G., Roberts, S., Ralphs, J. R. The Nucleus of the Intervertebral Disc from Development to Degeneration1. American Zoologist. 40 (1), 53-61 (2000).
- Risbud, M. V., Shapiro, I. M. Role of cytokines in intervertebral disc degeneration: pain and disc content. Nature Reviews. Rheumatology. 10 (1), 44-56 (2014).
- Iatridis, J. C., Michalek, A. J., Purmessur, D., Korecki, C. L. Localized intervertebral disc injury leads to organ level changes in structure, cellularity, and biosynthesis. Cell and Molecular Bioengineering. 2 (3), 437-447 (2009).
- Torre, O. M., Mroz, V., Bartelstein, M. K., Huang, A. H., Iatridis, J. C. Annulus fibrosus cell phenotypes in homeostasis and injury: implications for regenerative strategies. Annals of the New York Academy of Sciences. 1442 (1), 61-78 (2019).
- Rolauffs, B., et al. Proliferative remodeling of the spatial organization of human superficial chondrocytes distant from focal early osteoarthritis. Arthritis and Rheumatism. 62 (2), 489-498 (2010).
- Johnson, W. E., Roberts, S. Rumours of my death may have been greatly exaggerated': a brief review of cell death in human intervertebral disc disease and implications for cell transplantation therapy. Biochemical Society Transactions. 35, Pt 4 680-682 (2007).
- Roberts, S. Disc morphology in health and disease. Biochemical Society Transactions. 30, Pt 6 864-869 (2002).
- Lama, P., Kulkarni, J., Tamang, B. The role of cell clusters in intervertebral disc degeneration and its relevance behind repair. Spine Research. 03, 15(2017).
- Sharp, C. A., Roberts, S., Evans, H., Brown, S. J. Disc cell clusters in pathological human intervertebral discs are associated with increased stress protein immunostaining. European Spine Journal: Official Publication of the European Spine Society, the European Spinal Deformity Society and the European Section of the Cervical Spine Research Society. 18 (11), 1587-1594 (2009).
- Freemont, A. J. The cellular pathobiology of the degenerate intervertebral disc and discogenic back pain. Rheumatology. 48 (1), Oxford. 5-10 (2009).
- Müllers, Y., et al. Quantitative analysis of F-actin alterations in adherent human mesenchymal stem cells: Influence of slow-freezing and vitrification-based cryopreservation. PLoS One. 14 (1), 0211382(2019).
- McCann, M. R., Séguin, C. A. Notochord cells in intervertebral disc development and degeneration. Journal of Developmental Biology. 4 (1), 3(2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon