Method Article
Sectionnement optique et visualisation du disque intervertébral du développement embryonnaire à la dégénérescence
Dans cet article
Résumé
Nous présentons une méthode pour étudier l’organisation spatiale des chondrocytes dans l’anulus fibrose du disque intervertébral en utilisant une méthode de sectionnement optique.
Résumé
La dégénérescence du disque intervertébral (DIV) est l’une des principales causes de lombalgie et entraîne un degré élevé de déficience pour les personnes touchées. Pour décoder la dégénérescence discale et pouvoir développer des approches régénératives, une compréhension approfondie de la biologie cellulaire de l’IVD est essentielle. Un aspect de cette biologie qui reste encore sans réponse est la question de savoir comment les cellules sont disposées spatialement dans un état physiologique et pendant la dégénérescence. Les propriétés biologiques du DIV et sa disponibilité rendent ce tissu difficile à analyser. La présente étude étudie l’organisation spatiale des chondrocytes dans l’anulus fibreux depuis le début du développement embryonnaire jusqu’à la dégénérescence terminale. Une méthode de sectionnement optique (Apotome) est appliquée pour effectuer des analyses de coloration à haute résolution en utilisant du tissu embryonnaire bovin comme modèle animal et du tissu discale humain obtenu à partir de patients subissant une chirurgie de la colonne vertébrale. À partir d’une densité de chondrocytes très élevée dans le disque bovin embryonnaire précoce, le nombre de cellules diminue pendant la gestation, la croissance et la maturation. Dans les disques humains, une augmentation de la densité cellulaire a accompagné la progression de la dégénérescence tissulaire. Comme cela avait déjà été démontré dans le cartilage articulaire, la formation de grappes représente une caractéristique de la dégénérescence discale avancée.
Introduction
Le disque intervertébral (DIV) est une structure à base de cartilage qui, biochimiquement et par rapport à l’architecture cellulaire, à première vue, ressemble à bien des égards au cartilage articulaire1. En effet, la dégénérescence DIV et l’arthrose (OA) du cartilage articulaire sont caractérisées par un rétrécissement de l’espace articulaire dû à l’usure du cartilage, à la formation de kystes sous-chondriques et d’ostéophytes, et à la sclérose sous-chondrale2,3. Malgré ces similitudes apparentes, l’architecture et le rôle fonctionnel des deux tissus diffèrent. Alors que la matrice du cartilage articulaire est principalement formée d’un réseau de collagène de type II formant des arcades, le DIV se compose de trois types de tissus différents: le noyau pulpeux riche en collagène de type II au centre prend des charges axiales et les transmet à un anneau englobant de fibres de collagène circulaires de type I densément emballées appelées anulus fibrosus. Leur fonction est d’absorber les pressions axiales traduites reçues par le noyau riche en protéoglycanes et en eau avec leur résistance à la fibre longitudinale à la traction. En haut et en bas de chaque noyau et anulus, une plaque d’extrémité cartilagineuse hyaline forme la jonction avec les vertèbresadjacentes 4 (Figure 1).
Dans le cartilage articulaire, quatre modèles de chondrocytes spatiaux distincts peuvent être trouvés: paires, cordes, cordes doubles, petits ou grands amas5,6,7 ( Figure2). Les changements dans ce schéma sont associés à l’apparition et à la progression del’arthrose 8,9. L’organisation spatiale des chondrocytes est également révélatrice d’une propriété fonctionnelle directe du cartilage, à savoir sa rigidité, soulignant la pertinence fonctionnelle de cette approche de classement basée sur l’image10,11. Ces modèles peuvent en outre être identifiés avec la technologie cliniquement disponible déjà existante12. En raison des similitudes entre le DIV et le cartilage articulaire, on peut émettre l’hypothèse que des modèles chondrocytes caractéristiques sont également présents dans le DIV. La formation d’amas est un phénomène également observé dans l’IVDdégénérée 13,14.
Lorsque vous essayez d’analyser l’organisation cellulaire spatiale dans le DIV, il est nécessaire de surmonter plusieurs difficultés techniques qui ne sont pas présentes lors de l’étude du cartilage articulaire:
Tout d’abord, le traitement du tissu lui-même est beaucoup plus difficile qu’avec le cartilage hyalin homogène qui est en grande partie composé de collagène de type II. Le principal composant fibreux de l’IVD est le collagène de type I, ce qui rend beaucoup plus difficile la génération de fines sections histologiques. Alors que dans le cartilage articulaire hyalin, même les sections épaisses peuvent facilement être analysées en raison de la nature « vitreuse » du tissu, le réseau de collagène de type I du DIV est optiquement très impénétrable. Pour cette raison, un fort bruit de fond est un problème courant dans l’histologie de l’IVD. Un moyen rapide et peu coûteux de pénétrer dans ce tissu optiquement dense est l’utilisation d’un dispositif de sectionnement optique, par exemple au moyen d’un apotome. Dans un tel Apotome, une grille est insérée dans la voie d’éclairage d’un microscope à fluorescence conventionnel. Devant la grille, une plaque de verre plane-parallèle est placée. Cela s’incline d’avant en arrière, projetant ainsi la grille dans l’image dans trois positions différentes. Pour chaque position z, trois images brutes avec la grille projetée sont créées et superposées. Au moyen d’un logiciel spécial, la lumière floue peut être calculée. Le principe sous-jacent est que, si la grille est visible, cette information est au centre de l’attention, sinon elle est considérée comme floue. Avec cette technique, des images bien focalisées et haute résolution peuvent être acquises dans un délai raisonnable.
Deuxièmement, le tissu est difficile à trouver à partir de donneurs humains. Lors d’une arthroplastie totale du genou, toute la surface de l’articulation peut être obtenue pour une analyse plus approfondie pendant la chirurgie. Bien que l’arthrose d’une articulation diarthroïale soit également une maladie de l’articulation entière, il existe néanmoins de fortes différences focales dans la qualité du cartilage, généralement certaines zones de l’articulation étant encore intactes, par exemple en raison d’une charge réduite dans cette zone. Cette situation est différente dans le DIV, où la chirurgie n’est généralement effectuée que lorsque le disque est globalement détruit. Lors de l’obtention de tissus de donneurs humains dans la salle d’opération, le tissu est également très fragmenté et il est nécessaire d’attribuer correctement le tissu à l’un des trois types de cartilage du DIV avant de procéder à d’autres analyses. Pour permettre des analyses plus détaillées de coupes de tissus également plus grandes et pour examiner le développement embryonnaire de l’IVD, le choix d’un organisme modèle animal est donc nécessaire.
Lors du choix d’un tel organisme modèle, il est important d’avoir un système comparable au disque humain en ce qui concerne son anatomie et ses dimensions, sa charge mécanique, la population cellulaire actuelle ainsi que sa composition tissulaire. Aux fins de la technique présentée ici, nous suggérons l’utilisation de tissu discale lombaire bovin: Une propriété critique du disque humain entraînant son faible potentiel de régénération est la perte de cellules notochordales pendant la maturation dans le noyau. Cependant, dans de nombreux organismes modèles, les cellules notochordales peuvent être détectées toute leur durée de vie. La plupart des rares animaux qui perdent leurs cellules notochordales tels que les moutons, les chèvres ou les chiens chondrodystrophig ont un DIV beaucoup plus petit que les disques humains. Seuls les disques bovins lombaires présents ont un diamètre de disque sagittal comparable à celui des DIV humains15.
Un facteur clé conduisant à la dégénérescence précoce du disque est la charge mécanique excessive. Les pressions intradiscales d’une vache debout dans la colonne lombaire sont d’environ 0,8 MPa avec la colonne vertébrale alignée horizontalement. Étonnamment, ces pressions sont comparables aux pressions intradiscales lombaires rapportées pour la colonne vertébrale humaine en érection (0,5 MPa)15,16. De plus, la quantité d’eau et de protéoglycanes dans les disques bovins est comparable à celle de l’IVD des jeunes humains17. Par conséquent, bien que le schéma de mouvement réel des segments de mouvement puisse différer chez les animaux quadrupèdes de l’humain bipède, en ce qui concerne la charge totale et les caractéristiques du disque, la vache est beaucoup plus proche de la biologie humaine que d’autres modèles animaux établis pour l’IVD tels que les moutons et les chiens.
Dans ce protocole, nous présentons une technique permettant d’analyser les changements dans le DIV du point de vue de l’organisation spatiale des chondrocytes, du développement embryonnaire précoce à la dégénérescence terminale.
Protocole
Pour l’analyse du développement et de la maturation embryonnaires, des disques bovins ont été utilisés. Pour évaluer la dégénérescence de l’IDIV, des échantillons humains ont été analysés.
Le tissu DIV humain a été obtenu chez des patients subissant une intervention chirurgicale pour une dégénérescence discale lombaire, un prolapsus discale ou un traumatisme de la colonne vertébrale dans le département de chirurgie orthopédique de l’hôpital universitaire de Tübingen et le centre de traumatologie BG de Tübingen. L’approbation complète du comité d’éthique a été obtenue avant le début de l’étude (numéro de projet 244/2013BO2). Le consentement éclairé écrit a été reçu de tous les patients avant leur participation. Les méthodes ont été réalisées conformément aux directives approuvées.
Le tissu bovin a été obtenu auprès de l’Office bavarois de la santé et de la sécurité alimentaire/Oberschleißheim et d’une usine d’équarrissage à Warthausen (Allemagne). L’approbation des autorités locales et vétérinaires a été reçue pour les tissus d’animaux morts.
1. Récolte d’échantillons
- Tissu DIV humain : Placer immédiatement les échantillons de DIV obtenus en peropératoire dans le milieu Eagle modifié (DMEM) de Dulbecco avec 2 % (v/v) de pénicilline-streptomycine et 1,2 % (v/v) d’amphotéricine B. Conserver à 4 °C jusqu’à la suite du traitement. Traiter le tissu dans les 48 heures. Alternativement, conservez les tissus à -20 °C pendant plusieurs semaines.
- Tissu DIV bovin : Assurez-vous de prélever le tissu sur les animaux dans les 24 heures suivant la mort.
Réséquez les disques bovins avec les vertèbres environnantes des animaux morts en bloc. Transporter les tissus congelés sur de la glace carbonique et les conserver à -20 °C jusqu’à la suite du traitement.
REMARQUE: Si seules des analyses de fluorescence sont prévues et qu’aucune autre méthode de quantification biochimique telle que ELISA ou PCR n’est prévue, effectuez la fixation tissulaire comme expliqué ci-dessous. Cela permet de conserver le tissu plus longtemps dans le stockage avant qu’il n’ait besoin d’être traité. Pour éviter la détérioration de la matrice tissulaire, effectuez la fixation dans les 48 heures suivant la récolte, sauf si le tissu est congelé directement.
2. Préparation de l’échantillon
- Décongeler les tissus congelés à température ambiante. Traitez le tissu dès qu’aucun cristal de glace ne peut plus être ressenti lors de la compression numérique douce du tissu.
REMARQUE: Effectuer la préparation du tissu dans le DMEM dans une boîte de Pétri. - Identifier l’origine du tissu DIV humain (anulus fibreux, zone intermédiaire, noyau pulpeux ou plaque terminale cartilagineuse) en fonction des propriétés macroscopiques telles que la densité et l’orientation du collagène.
- Prenez le segment de mouvement constitué du disque DIV bovin avec ses deux vertèbres adjacentes et disséquez le disque dans son ensemble de l’os sous-chondral à l’aide d’une lame chirurgicale (lame numéro 15).
- Utilisez deux pinces anatomiques pour retourner le disque afin d’atteindre des zones plus centrées. Effectuez la dissection. Assurez-vous de réséquer le noyau pulpeux en dernier car il est beaucoup plus mince que l’anulus, sujet à la déchirure, et il ne se détache pas facilement d’une manière définie.
- Identifier les différentes zones du cartilage.
- Découpez la zone d’intérêt de l’ensemble du disque à l’aide d’une lame chirurgicale (lame numéro 20 ou 22). Vous pouvez également utiliser une lame de cryotome.
REMARQUE: Comme les disques bovins viennent en bloc comme une partie de la colonne vertébrale, les disques peuvent être préparés in-toto. Cela rend l’identification correcte des différents types de cartilage beaucoup plus facile. Lors de la dissection du disque de la manière décrite ci-dessus, la plaque d’extrémité cartilagineuse reste sur les vertèbres. Si cette zone doit être étudiée, il est préférable de la retirer de l’os sous-jacent à l’aide d’un ciseau fonctionnant dans une direction tangentielle légèrement courbée.
- Dans le cas où les embryons sont d’une longueur couronne-croupe inférieure à 20 cm, assurez-vous de traiter les embryons en toto pour préserver l’architecture tissulaire du DIV. N’effectuez aucune dissection des vertèbres dans ces cas.
- Une fois le disque réséqué in-toto, identifiez les différentes zones du cartilage.
- Effectuer la décalcification dans l’acide éthylènediaminetétraacétique (EDTA) (20% (p/v); pH = 7,4) à température ambiante. Choisissez le volume en fonction de la taille de l’échantillon - l’ensemble du tissu doit être bien recouvert d’EDTA.
- Changez la solution de décalcification quotidiennement, ce qui peut durer jusqu’à 5 jours en fonction de la taille du tissu.
- Vérifiez que la décalcification est réussie avec une aiguille de calibre 20 qui pénètre dans les vertèbres sans résistance notable.
REMARQUE: Le changement quotidien de la solution de décalcification est important pour empêcher le liant chélate EDTA de saturation pour maintenir l’efficacité de la réaction. Il empêche également la colonisation bactérienne.
3. Classement de l’âge, de l’intégrité et de la dégénérescence de l’échantillon
- Classez le tissu discale humain dans l’une des cinq catégories suivantes à l’aide d’informations cliniques ainsi que d’imagerie par rayons X et par résonance magnétique18 (Figure 3).
REMARQUE: Catégorie I: Pour servir d’échantillon presque sain, utilisez anulus sans aucun signe radiologique de dégénérescence DIV dérivée d’un traumatisme aigu de la colonne vertébrale.
Catégorie II: Pour illustrer une situation d’inflammation aiguë avec début de dégénérescence, utilisez du tissu de la zone intermédiaire de patients présentant des symptômes cliniques d’une durée inférieure à 4 semaines.
Catégorie III: Décrire une situation où la réaction inflammatoire avait déjà eu le temps d’affecter les tissus et les cellules prélèvent des tissus de patients opérés pour un prolapsus nucléaire mais avec une durée de symptôme supérieure à 4 semaines.
Catégorie IV: Pour la dégénérescence discale modérée, sélectionnez l’anulus obtenu par chirurgie avec fusion intercorporelle pour la discopathie dégénérative avec un score de Pfirrmann de 3 ou 4 en imagerie par résonance magnétique19.
Catégorie V: Pour le processus de dégénérescence en phase terminale anulus obtenu par chirurgie avec fusion intercorporelle pour la discopathie dégénérative avec un score de Pfirrmann de 5. - Classer le tissu bovin en fonction du stade de développement ou de l’âge de l’animal dans l’une des huit catégories, comme le montre le tableau 1.
- Calculez l’âge de gestation sur la longueur couronne-croupe des embryons en fonction de la formule suggérée par Keller:
Âge de gestation en mois =
NOTE: Les animaux dans les 4 premières semaines de gestation présentent une longueur couronne-croupion de 0,8-2,2 cm20.
- Calculez l’âge de gestation sur la longueur couronne-croupe des embryons en fonction de la formule suggérée par Keller:
4. Fixation des tissus
- Fixer les échantillons dans 10x le volume de l’échantillon de solution de formaldéhyde à 4% (p/v) dans une solution saline tamponnée au phosphate (PBS) pendant la nuit à 4 °C.
REMARQUE: La solution de formaldéhyde pénètre dans les tissus à une vitesse d’environ 1 mm / heure de chaque direction. Pour les très petits ou très gros échantillons, un ajustement du temps d’exposition pourrait être nécessaire. - Conserver le tissu dans du PBS à 4 °C jusqu’à la suite du traitement.
5. Sectionnement histologique
- Incorporer les échantillons dans un milieu d’incorporation soluble dans l’eau sur le bouton du cryotome.
- Placez le tissu sur le bouton de manière à ce qu’un plan axial soit généré, soit un plan qui coupe les lamelles de collagène de type I perpendiculairement (par exemple, un plan de section sagittal médian).
REMARQUE: Le tissu doit être entièrement recouvert par le support d’encastrement.
- Placez le tissu sur le bouton de manière à ce qu’un plan axial soit généré, soit un plan qui coupe les lamelles de collagène de type I perpendiculairement (par exemple, un plan de section sagittal médian).
- Découper le tissu incorporé à une épaisseur de 70 μm dans des échantillons humains et de 40 μm dans des échantillons de bovins à l’aide d’un cryotome standard.
REMARQUE: La différence d’épaisseur de section est due à la différence d’intégrité tissulaire entre le disque bovin intact et le tissu humain hautement dégénéré. - Rassemblez les sections sur une lame de verre.
- Entourez les sections de tissus avec un stylo hydrophobe.
- Rincez les sections 3 fois avec une solution saline tamponnée au phosphate (PBS) pour éliminer le milieu d’incorporation soluble dans l’eau.
6. Coloration par fluorescence
- Ajouter 60 μL de 1 % (v/v) de DAPI (Exmax 358 nm, Emmax 461 nm) ainsi que 1 % (v/v) de coloration Actin Tracking (Exmax 540 nm, Emmax 565 nm) dans PBS et incuber pendant 5 min à température ambiante.
REMARQUE: Le protocole de coloration décrit ici consiste à visualiser le noyau à l’aide d’une coloration nucléaire DAPI (bleu) et le cytoplasme à l’aide d’Actin Tracking Stain (rouge). Le DIV a une forte autofluorescence due aux fibres de collagène dans le canal vert. La quantité de fluide ajoutée aux sections dans ce protocole est destinée aux sections d’une taille d’environ 5 mm x 5 mm. Pour les sections plus grandes, ce montant doit être augmenté en conséquence. Effectuez tous les travaux dans des pièces sans exposition directe au soleil et avec des lumières tamisées pour éviter le blanchiment du colorant. - Retirez le liquide de coloration avec une pipette et lavez trois fois avec 60 μL de PBS à chaque fois.
- Ajoutez un support de montage approprié et couvrez les sections avec un couvercle.
REMARQUE: Assurez-vous qu’il n’y a pas de bulles d’air piégées lors de l’ajout du couvercle. Pour ce faire, il est préférable de commencer le contact du glissement avec la glissière sur une jante, puis de laisser le glissement descendre lentement.
7. Imagerie et traitement microscopiques
- Placez une lame avec une section colorée sur le porte-échantillon du microscope.
REMARQUE: En raison du réseau dense de collagène de type I de l’IVD, la lumière diffusée rend le tissu difficile à visualiser à l’aide de la microscopie à fluorescence conventionnelle. Une façon de résoudre ce problème consiste à effectuer un sectionnement optique à l’aide d’un éclairage structuré. Cela permet également de rendre une projection tridimensionnelle de l’échantillon entier dans les deux canaux (bleu et rouge). Il est préférable d’utiliser le réglage d’éclairage structuré et le mode Mosaïque avec un objectif de grossissement 10x pour obtenir une vue d’ensemble de l’échantillon ainsi que des reconstructions 3D de motifs individuels. - Démarrez le dispositif d’éclairage structuré.
- Effectuez une imagerie à champ de vision unique avec un microscope à fluorescence approprié, des filtres à fluorescence et un éclairage adéquat.
REMARQUE: Ajustez le temps d’exposition pour tous les filtres utilisés afin de normaliser l’acquisition d’imagerie. Pour obtenir une représentation précise de l’échantillon à une image de résolution plus élevée, les sections avec un grossissement plus élevé (par exemple, objectif 20x). - Post-traitez les images en optimisant l’intensité et la luminosité à l’aide d’un logiciel d’optimisation d’image compatible avec le microscope à fluorescence.
- Effectuez une imagerie à champ de vision unique avec un microscope à fluorescence approprié, des filtres à fluorescence et un éclairage adéquat.
- Pour visualiser la section dans son ensemble, utilisez la technique d’imagerie en mosaïque
- Ouvrez les paramètres d’acquisition (appuyez sur 6D- Acquisition) dans le panneau de la barre d’outils.
- Ajustez les paramètres de mosaïque (dans MosaiX Register)et définissez le nombre de colonnes et de lignes d’images de champ de vision qui seront ensuite fusionnées en une seule image de vue d’ensemble.
- Appuyez sur Configuration et réglez la correction de mise au point de chaque vignette.
REMARQUE: Il est presque impossible pour une grande section de tissu d’avoir toute la surface du tissu dans un seul plan de mise au point. Les tuiles d’image à différents niveaux focaux peuvent être prises par 'MosaiX Acquisition'. - Pour démarrer l’acquisition des vignettes d’image, appuyezsur Démarrer .
- Assemblez les tuiles imagées à l’aide de la fonction d’assemblage (boutonCouture) avec un chevauchement de 20% incorporé dans le logiciel.
- Post-traitez les images en optimisant l’intensité et la luminosité à l’aide d’un logiciel d’optimisation d’image compatible avec le microscope à fluorescence.
- Pour analyser l’organisation spatiale des chondrocytes, utilisez la fonction 3D incorporée dans le logiciel.
- Ajustez les paramètres z-stack. Définissez les paramètres de numérisation : définissez les positions de départ et d’arrêt sur l’axe z et la distance de la tranche en activant le bouton Démarrer/Arrêter.
REMARQUE: Le logiciel calcule automatiquement le nombre de tranches. - Pour lancer l’acquisition des z-stacks d’images, appuyezsur Démarrer .
- Post-traitez les images en optimisant l’intensité et la luminosité à l’aide d’un logiciel d’optimisation d’image compatible avec le microscope à fluorescence.
- Ajustez les paramètres z-stack. Définissez les paramètres de numérisation : définissez les positions de départ et d’arrêt sur l’axe z et la distance de la tranche en activant le bouton Démarrer/Arrêter.
- Exportez les images avec un format de fichier compatible avec le logiciel de traitement d’image.
REMARQUE: Exportez les reconstructions 3D sous forme d’images individuelles et / et en tant que modèle 3D interactif ou dans un format vidéo.
8. Identification du profil cellulaire et évaluation de la densité
- Ouvrez les images en mosaïque exportées de toute la section de tissu dans un programme de traitement d’image approprié.
- Définissez les zones soumises à l’évaluation de la densité cellulaire en définissant des régions d’intérêt de 500 μm x 500 μm dans les images.
REMARQUE : Toutes les tuiles qui n’ont pas une qualité d’image adéquate sont exclues de l’analyse. - Identifiez les modèles cellulaires individuels.
REMARQUE: Les cellules individuelles sont définies comme des cellules individuelles - entièrement encapsulées dans la matrice adjacente. Les paires sont définies comme deux cellules adjacentes à proximité (<25 μm) où les cellules sont interconnectées à travers leurs matrices (voir figure 2). Les formations de cordes sont au moins trois chondrocytes alignés en ligne (à partir du milieu des noyaux <25 μm). Ces cellules sont entourées d’une matrice intacte et des interconnexions matricielles peuvent être vues entre chaque cellule. Les amas représentent plusieurs cellules situées à proximité directe les unes des autres (<25 μm) et sont encapsulées dans une grande lacune dépourvue de matrice. - Utilisez un plug-in de comptage cellulaire pour l’analyse quantitative des modèles cellulaires.
REMARQUE: La coloration du cytoplasme représente une méthode de vérification pour identifier les différents modèles spatiaux. - Calculez la densité cellulaire en divisant les cellules comptées par la taille de la région d’intérêt choisie.
Résultats
En utilisant des images en mosaïque, l’architecture de l’IVD avec son réseau dense de fibres de collagène dans l’anulus et le noyau plus mou peut être clairement reconnue (Figure 4). Une diminution continue de la densité cellulaire peut être observée au cours du développement embryonnaire (Figure 5). Alors qu’aux premiers stades du développement de l’IDIV, on peut trouver une densité cellulaire de 11 435 cellules/mm² dans l’anulus fibreux bovin et de 17 426 cellules/mm² dans le noyau pulpeux bovin, ces nombres diminuent rapidement à 1 011 cellules/mm² (anulus fibreux bovin) et 488 cellules/mm² (noyau pulpeux bovin) jusqu’à la naissance. Chez les bovins adultes, on voit 71 cellules/mm² (anulus fibrosus) resp. 106 cellules/mm² (nucleus pulposus)(Figure 6 A-B). L’utilisation de l’imagerie bicanal avec l’Apotome permet de visualiser l’architecture 3D des motifs spatiaux (Figure 7).
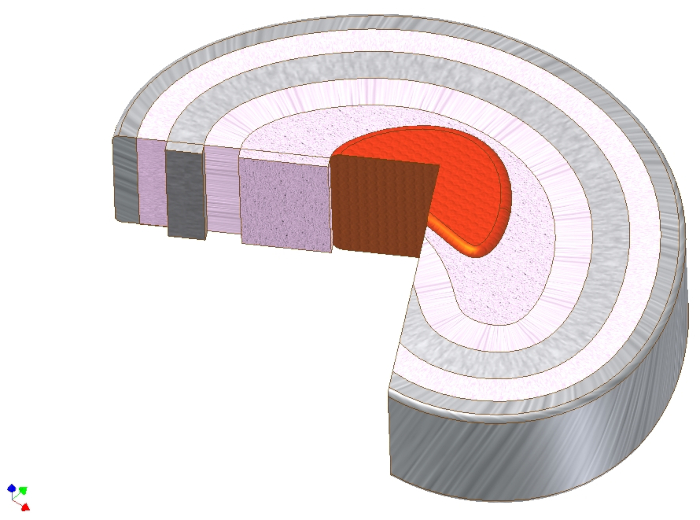
Graphique 1. Anatomie macroscopique du disque intervertébral. Dessin schématique du disque intervertébral montrant le noyau pulpeux (rouge), directement autour de lui la zone intermédiaire (rose), puis en couches circulaires autour de lui l’anulus fibrosus. Notez la direction de l’angle de pli des fibres de collagène de type I dans l’anulus fibreux. La charge axiale vers le noyau peut ainsi être traduite en forces de traction axiales des fibres de collagène. Veuillez cliquer ici pour voir une version agrandie de cette figure.
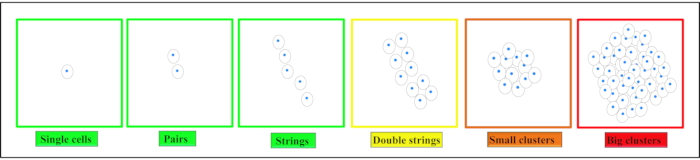
Graphique 2. Illustration schématique de différents modèles d’organisation spatiale des chondrocytes. Selon le tissu, les chondrocytes se trouvent sous forme de cellules individuelles, de paires ou de cordes dans le cartilage sain. Avec le début de la dégénérescence, ces modèles changent pour former des chaînes doubles, de petits clusters, puis de grands clusters en fin de dégénérescence. Ce chiffre a été modifié à partir de Danalache, M. et al.21. Veuillez cliquer ici pour voir une version agrandie de cette figure.
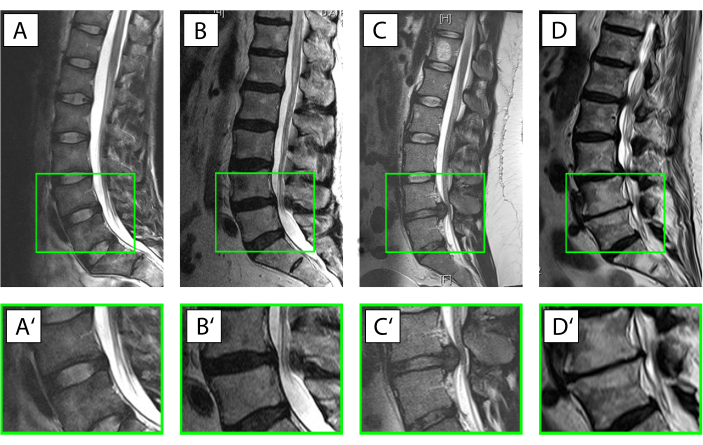
Graphique 3. Différentes conditions du disque intervertébral (DIV). (A-D') Imagerie par résonance magnétique sagittale pondérée T2 de la colonne lombaire humaine (A-D), avec le segment de mouvement agrandi L4 / L5 (A'-D'). La face ventrale du patient fait face à gauche, la face dorsale fait face à droite avec le canal rachidien avec son signal blanc pour le liquide céphalo-rachidien. (A,A') DIV intact avec l’anulus affiché avec un signal hypointense (noir) en raison de la teneur élevée en collagène de type I et le noyau affiché beaucoup plus lumineux (hyperintense) en raison de la teneur élevée en protéoglycanes liant l’eau (Pfirrmann grade19 I). (B,B') Début de la dégénérescence DIV avec une perte du signal d’eau du noyau pulpeux et où la distinction entre l’anulus et le noyau est perdue (Pfirrmann grade19 IV). (C,C') Prolapsus nucléaire aigu avec encore un signal d’eau proéminent dans la région du noyau indiquant un DIV autrement intact et le tissu discale dépassant dorsalement dans le canal rachidien. (D,D') Dégénérescence discale avancée avec un DIV en grande partie détruit avec une perte complète du signal d’eau dans le disque, formation de spondylophytes ventraux et dorsaux et sclérose sous-chondrale des vertèbres correspondant à un grade De Pfirrmann19 de V. Veuillez cliquer ici pour voir une version plus grande de cette figure.
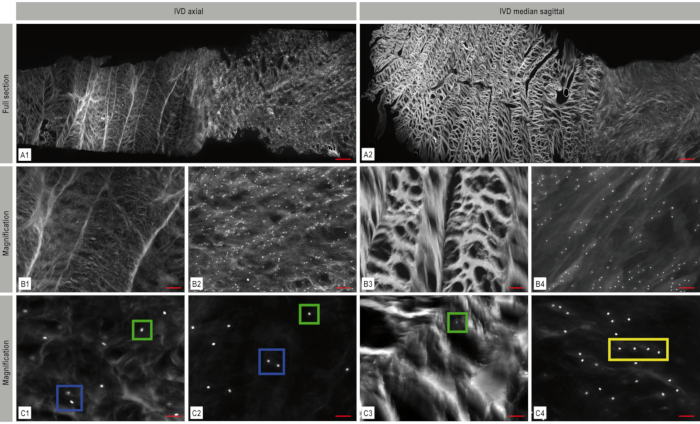
Graphique 4. Imagerie par fluorescence mosaïque du disque intervertébral (DIV). L’architecture de l’IVD avec son réseau dense de fibres de collagène dans l’anulus fibreux et le noyau plus mou peut être clairement reconnue. La coloration nucléaire DAPI (blanc) dans le plan axial(A1)et sagittal(A2)montre la distribution et la disposition des cellules dans le DIV. Les zones représentatives agrandies de ces images en mosaïque sont affichées en B1-B4 et C1-C4 illustrant l’organisation spatiale des chondrocytes - dans ce cas, des cellules uniques (boîte verte), des paires (boîte bleue) et des chaînes (boîte jaune). A: barre d’échelle 1 000 μm, B1-B4: barre d’échelle 200 μm, C1-C4: barre d’échelle : 50 μm. Cette figure a été modifiée à partir de Bonnaire, F.C. et al.22. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Graphique 5. Différents stades de développement et de maturation de l’anulus fibrose bovin et de l’anulus fibreux dégénéré humain. Coloration nucléaire DAPI. Les images en mosaïque montrent tout un disque embryonnaire précoce dans une section axiale (A1) et des images représentatives de l’anulus bovin pendant le développement embryonnaire, la maturation et le début de la dégénérescence (A2-A8). (B1-B3) Anulus à partir de DIV humains a été obtenu en peropératoire. Une diminution continue de la densité cellulaire peut être observée pendant le développement du disque embryonnaire. Un modèle cellulaire d’organisation spatiale plus élevé semble être présent, en particulier autour de la naissance. Dans le disque humain adulte pendant la dégénérescence, la densité cellulaire augmente à nouveau et une formation croissante d’amas peut être observée. Barre d’échelle 100 μm. Wog: semaines de gestation. Cette figure a été modifiée à partir de Bonnaire, F.C. et al.22. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Graphique 6. Réduction de la densité cellulaire tout au long du développement et de la maturation du disque intervertébral bovin. Le nombre moyen (écart-type) de cellules par mm² est illustré par des diagrammes à barres pour l’anulus fibreux bovin (A) et le noyau pulpeux bovin (B). Une nette réduction de la densité cellulaire peut être observée en particulier pendant la période embryonnaire qui se poursuit dans une moindre mesure au moins jusqu’à la maturation complète du disque (n = 72). Wog: semaines de gestation. Cette figure a été modifiée à partir de Bonnaire, F.C. et al.22. Veuillez cliquer ici pour voir une version agrandie de cette figure.
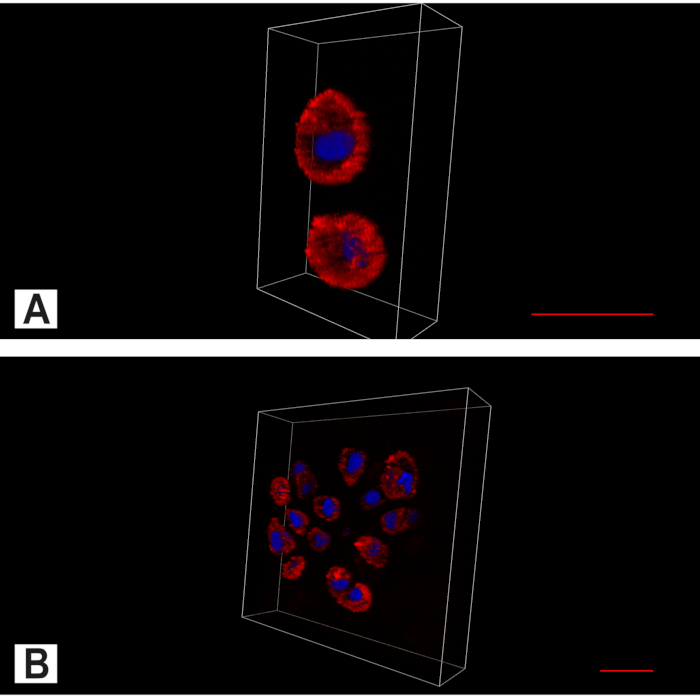
Graphique 7. Imagerie apotome du disque intervertébral (DIV). Image bicanal montrant le cytoplasme (rouge, coloration à l’actine) et le noyau (bleu, coloration nucléaire DAPI). (A) Dans le DIV intact, en plus du modèle spatial prédominant de chondrocytes simples, des paires sont également trouvées. (B) On peut trouver des amas de cellules anulus dégénérées. Barre d’échelle 20 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Vidéo 1. Imagerie apotome d’une paire dans le disque intervertébral (DIV) en tant que modèle 3D. Images bicanaux montrant le cytoplasme (rouge, coloration à l’actine) et le noyau (bleu, coloration nucléaire DAPI) d’une paire. Veuillez cliquer ici pour télécharger cette vidéo.
Vidéo 2. Imagerie apotome d’un amas dans le disque intervertébral (DIV) en tant que modèle 3D. Images bicanaux montrant le cytoplasme (rouge, coloration à l’actine) et le noyau (bleu, coloration nucléaire DAPI) d’un amas. Veuillez cliquer ici pour télécharger cette vidéo.
Tableau 1 : Développement, maturation et croissance de l’embryon bovin après la naissance avec ses différents jalons. Wog - semaines de gestation. Période de gestation env. 283 jours, espérance de vie naturelle 20-25 ans20,23,24. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
En utilisant la microscopie à fluorescence augmentée par l’imagerie en mosaïque et la section optique, nous avons évalué la disposition spatiale des chondrocytes dans l’anulus du DIV lombaire tout au long du développement, de la maturation et de la dégénérescence. Alors que le tissu dégénératif pouvait être prélevé sur des patients recevant une chirurgie de la colonne vertébrale pour une dégénérescence discale, l’analyse de la période embryonnaire et de la phase de maturation nécessitait l’utilisation d’un organisme modèle (bovin). Des densités cellulaires élevées ont été notées dans l’anulus au début du développement embryonnaire. Au cours du développement ultérieur, la croissance et la maturation postnatales ont pu être observées, une diminution prononcée de la densité cellulaire. Dans les tissus humains présentant une dégénérescence discale avancée, nous avons ensuite pu quantifier une augmentation de la densité cellulaire dans l’anulus fibreux.
L’augmentation rapide du volume tissulaire combinée à la division active et aux cellules notochordales biosynthétiquement actives sont des raisons probables des changements de densité cellulaire observés chez l’embryon25. Les mécanismes par lesquels la densité cellulaire augmente à nouveau avec la dégénérescence restent cependant encore incertains. Les processus dégénératifs de l’anulus entraînent une série de changements pathologiques, notamment une augmentation de l’innervation et de l’inflammation des tissus, une régulation à la hausse des enzymes dégradant la matrice et de la production de facteur de croissance, ainsi que des modifications de la cellularité26,27,28.
En considérant la présence cellulaire en fonction de l’organisation spatiale cellulaire basée sur des modèles connus du cartilage articulaire7,9, nous n’avons trouvé aucune organisation spatiale reconnaissable dans les disques embryonnaires précoces où les cellules semblent être densément emballées et que nous considérions comme présentes comme des cellules uniques22. Ce résultat est cohérent avec les résultats du cartilage articulaire embryonnaire7. Dans l’anulus mature sain, les cellules individuelles représentent le modèle spatial prédominant22. Des paires et des formations de cordes peuvent cependant également être observées22. Plus le tissu dans les disques humains est dégénéré, plus la proportion de cellules que l’on peut trouver dans les grappes22est élevée. Le modèle physiopathologique suggéré par Rolauffs dans le cartilage articulaire7,9,29 montre une similitude intrigante avec nos résultats. Des études antérieures sur la dégénérescence divivienne avaient également déjà décrit la formation d’amas comme une caractéristique de la dégénérescence discale14,30, 31,32,33. Étant donné que ces grappes peuvent principalement être trouvées dans des tissus très dégénérés, la formation de grappes pourrait indiquer une tentative infructueuse du tissu de réparer les dommages dégénératifs34. En établissant une forte corrélation entre le modèle de chondrocytes localement prédominant et l’élasticité des tissus, une grande pertinence fonctionnelle de ces modèles a pu être démontrée dans le cartilage articulaire10,11. On peut supposer qu’une telle pertinence fonctionnelle s’applique également à l’organisation spatiale des chondrocytes dans le DIV.
Les analyses histologiques par fluorescence sont un moyen facile à trouver et attrayant pour analyser les changements morphologiques des tissus. Lorsque l’on essaie d’analyser histologiquement le DIV, il y a des difficultés techniques distinctes qui doivent être surmontées: Premièrement, la disponibilité limitée de tissus humains rend important le choix d’un organisme modèle animal adéquat avec lequel les aspects de la maladie peuvent être étudiés lorsque des échantillons humains ne peuvent pas être obtenus. Pour la question de recherche abordée dans cette étude, nous avons choisi un modèle d’animal bovin.
Deuxièmement, le traitement du DIV riche en collagène de type I est beaucoup plus difficile que pour la plupart des autres tissus humains. Le réseau dense de fibres de collagène de type I diffuse fortement la lumière fluorescente, créant un signal de bruit de fond élevé. Ce problème est mieux résolu en utilisant une technique qui permet la soustraction ou l’élimination de ce signal de fond. Une méthode bien connue pour le faire est la microscopie confocale. Bien que la qualité d’image des images LASER confocales acquises soit généralement excellente, les inconvénients de cette technique sont qu’elle prend relativement du temps et qu’elle ne permet donc pas l’analyse de zones tissulaires plus grandes au moyen de l’imagerie en mosaïque. Deuxièmement, les microscopes confocaux sont relativement chers et ne sont pas disponibles partout. Un moyen beaucoup plus rapide et moins coûteux de filtrer le bruit de fond consiste à effectuer un sectionnement optique, par exemple au moyen d’un Apotome.
Pour pouvoir interpréter correctement les résultats, il est essentiel d’attribuer également correctement le tissu à analyser à son origine dans le DIV. Bien que cette tâche soit relativement simple lorsqu’on a un disque bovin entier à choisir, elle peut être très difficile lors de la réception de tissus humains de la salle d’opération. La caractéristique de l’anulus fibreux est son réseau de collagène de type I très dense dans une orientation de fibre inclinée. Le noyau, en revanche, est une structure gélatineuse amorphe où aucune architecture de collagène supérieure n’est visible à l’œil nu. La zone intermédiaire se trouve entre ces deux extrema et possède également une architecture claire de fibre de collagène, mais elle est beaucoup plus douce et moins dense que l’anulus fibreux. La plaque d’extrémité cartilagineuse est constituée de cartilage hyalin, ne présente pas une architecture de collagène reconnaissable à l’œil nu mais elle est plutôt « vitreuse » comme le terme « hyaline » le suggère. Contrairement au noyau pulpeux, il est cependant également très rigide, ne peut pas être déformé et est situé sur l’os sous-chondral qui peut souvent encore être reconnu par l’inspection du tissu.
Une fois que l’origine du tissu a été correctement identifiée, le tissu doit encore être correctement orienté pour la section afin d’obtenir des images standardisées qui permettent également une lecture qualitative et quantitative appropriée. En orientation vers d’autres techniques d’imagerie telles que l’imagerie par résonance magnétique, nous suggérons deux plans d’analyse standard: une section sagittale médiane et une dans le plan axial. Ces deux plans donneront également une bonne impression de l’architecture du réseau de fibres de collagène de type I de l’anulus. Lors de l’interprétation des résultats obtenus à partir de la coloration F-actine, il faut garder à l’esprit que la congélation des échantillons de tissus peut provoquer des altérations de la structure du cytosquelette35 qui ne devraient toutefois pas affecter l’organisation spatiale des chondrocytes.
Comprendre pleinement la biologie cellulaire de l’IVD est l’un des défis encore ouverts dans notre compréhension de la dégénérescence discale et de la régénération36. Des questions qui semblent parfois triviales, comme l’arrangement physiologique des cellules dans les tissus sains ou la question de la réorganisation cellulaire pendant la dégénérescence, restent, à ce jour, sans réponse. Les connaissances acquises peuvent nous permettre d’utiliser ce marqueur de dégénérescence basé sur l’image pour évaluer la qualité des tissus, étudier la réversibilité de la formation de grappes et ainsi éventuellement définir une fenêtre thérapeutique dans laquelle les processus de dégénérescence peuvent encore être ciblés avec succès.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous remercions nos co-auteurs des publications originales pour leur aide et leur soutien. Nous remercions Charlotte Emma Bamberger d’avoir aidé à acquérir les images d’apotome.
matériels
| Name | Company | Catalog Number | Comments |
| Amphotericin B | Merck KGaA, Germany | A2942 | |
| Adhesion Microscope Slides SuperFrost Plus | R. Langenbrinck, Germany | 03-0060 | |
| ApoTome | Carl Zeiss MicroImaging GmbH, Germany | 462000115 | |
| AxioVision Rel. 4.8 with Modul MosaiX | Carl Zeiss MicroImaging GmbH, Germany | ||
| CellMask Actin Tracking Stain | Thermo Fischer Scientific, US | A57249 | |
| Cryostat | Leica Biosystems, US | CM3050S | |
| DAPI | Thermo Fischer Scientific, US | D1306 | |
| Dulbecco's modified Eagle's medium (DMEM) | Gibco, Life Technologies, Germany | 41966052 | |
| Ethylenediaminetetraacetic acid | Sigma-Aldrich, US | 60004 | |
| Fluorescence Miscoscope - Axio Observer Z1 with Axio Cam MR3 and Colibri | Carl Zeiss MicroImaging GmbH, Germany | 3834000604 | |
| Formaldehyde | Merck KGaA, Germany | 104002 | |
| Image J 1.53a, with Cell counter plugin | National Insittute of Health (NIH), US | ||
| Invitrogen Alexa Fluor 568 Phalloidin | Thermo Fischer Scientific, US | A12380 | |
| Microscopic Cover Glasses | R. Langenbrinck, Germany | 01-1818/1 | |
| PAP Pen Liquid Blocker | Science Sevices GmbH, Germany | N71310 | |
| Penicillin-Streptomycin | Sigma-Aldrich, US | P4333 | |
| Phosphate buffered saline | Sigma-Aldrich,US | P5119 | |
| Scalpel | pf medical AG, Germany | 2023-01 | |
| Tissue-tek O.C.T. Compound | Sakura Finetek, Netherlands | SA6255012 |
Références
- Urban, J. P. G., Roberts, S. Degeneration of the intervertebral disc. Arthritis Research and Therapy. 5 (3), 120-130 (2003).
- Gupta, K. B., Duryea, J., Weissman, B. N. Radiographic evaluation of osteoarthritis. Radiologic Clinics of North America. 42 (1), 11-41 (2004).
- Pye, S. R., et al. Lumbar disc degeneration: association between osteophytes, end-plate sclerosis and disc space narrowing. Annals of the Rheumatic Diseases. 66 (3), 330-333 (2007).
- Humzah, M. D., Soames, R. W. Human intervertebral disc: structure and function. The Anatomical Record. 220 (4), 337-356 (1988).
- Schumacher, B. L., Su, J. L., Lindley, K. M., Kuettner, K. E., Cole, A. A. Horizontally oriented clusters of multiple chondrons in the superficial zone of ankle, but not knee articular cartilage. The Anatomical Record. 266 (4), 241-248 (2002).
- Rolauffs, B., Williams, J. M., Grodzinsky, A. J., Kuettner, K. E., Cole, A. A. Distinct horizontal patterns in the spatial organization of superficial zone chondrocytes of human joints. Journal of Structural Biology. 162 (2), 335-344 (2008).
- Felka, T., et al. Loss of spatial organization and destruction of the pericellular matrix in early osteoarthritis in vivo and in a novel in vitro methodology. Osteoarthritis and Cartilage. 24 (7), 1200-1209 (2016).
- Rolauffs, B., et al. Onset of preclinical osteoarthritis: the angular spatial organization permits early diagnosis. Arthritis and Rheumatism. 63 (6), 1637-1647 (2011).
- Aicher, W. K., Rolauffs, B. The spatial organization of joint surface chondrocytes: review of its potential roles in tissue functioning, disease and early, preclinical diagnosis of osteoarthritis. Annals of the Rheumatic Diseases. 73 (4), 645-653 (2014).
- Danalache, M., Jacobi, L. F., Schwitalle, M., Hofmann, U. K. Assessment of biomechanical properties of the extracellular and pericellular matrix and their interconnection throughout the course of osteoarthritis. Journal of Biomechanics. 97, 109409(2019).
- Danalache, M., et al. Changes in stiffness and biochemical composition of the pericellular matrix as a function of spatial chondrocyte organization in osteoarthritic cartilage. Osteoarthritis and Cartilage. 27 (5), 823-832 (2019).
- Tschaikowsky, M., et al. Proof-of-concept for the detection of early osteoarthritis pathology by clinically applicable endomicroscopy and quantitative AI-supported optical biopsy. Osteoarthritis and Cartilage. 29 (2), 269-279 (2021).
- Ciapetti, G., et al. Ex vivo observation of human intervertebral disc tissue and cells isolated from degenerated intervertebral discs. European Spine Journal: Official Publication of the European Spine Society, the European Spinal Deformity Society and the European Section of the Cervical Spine Research Society. 21, Suppl 1 10(2012).
- Johnson, W. E., Eisenstein, S. M., Roberts, S. Cell cluster formation in degenerate lumbar intervertebral discs is associated with increased disc cell proliferation. Connective Tissue Research. 42 (3), 197-207 (2001).
- Buttermann, G. R., Beaubien, B. P., Saeger, L. C. Mature runt cow lumbar intradiscal pressures and motion segment biomechanics. The Spine Journal: Official Journal of the North American Spine Society. 9 (2), 105-114 (2009).
- Wilke, H. J., Neef, P., Caimi, M., Hoogland, T., Claes, L. E. New in vivo measurements of pressures in the intervertebral disc in daily life. Spine. 24 (8), Phila Pa. 755-762 (1999).
- Demers, C. N., Antoniou, J., Mwale, F. Value and limitations of using the bovine tail as a model for the human lumbar spine. Spine. 29 (24), Phila Pa. 2793-2799 (2004).
- Hofmann, U. K., et al. Chondrocyte death after mechanically overloading degenerated human intervertebral disk explants is associated with a structurally impaired pericellular matrix. Journal of Tissue Engineering and Regenerative Medicine. 12 (9), 2000-2010 (2018).
- Pfirrmann, C. W., Metzdorf, A., Zanetti, M., Hodler, J., Boos, N. Magnetic resonance classification of lumbar intervertebral disc degeneration. Spine. 26 (17), Phila Pa. 1873-1878 (2001).
- Habermehl, K. H. Die Altersbestimmung bei Haus- und Labortieren. , Paul Parey. Berlin, Hamburg. (1975).
- Danalache, M., Erler, A. L., Wolfgart, J. M., Schwitalle, M., Hofmann, U. K. Biochemical changes of the pericellular matrix and spatial chondrocyte organization-Two highly interconnected hallmarks of osteoarthritis. Journal of Orthopaedic Research: Official Publication of the Orthopaedic Research Society. 38 (10), 2170-2180 (2020).
- Bonnaire, F. C., et al. The intervertebral disc from embryonic development to disc degeneration: insights into spatial cellular organization. The Spine Journal: Official Journal of the North American Spine Society. (21), 00198(2021).
- Vieira-Neto, A., Galvao, K. N., Thatcher, W. W., Santos, J. E. P. Association among gestation length and health, production, and reproduction in Holstein cows and implications for their offspring. Journal of Dairy Science. 100 (4), 3166-3181 (2017).
- Ott, A. Die Entwicklung des schwarzbunten Niederungsrindes von der Geburt bis zum 5. Lebensjahr mit variationsstatistischen Untersuchungen einer Population solcher Rinder von der Geburt bis zum 3. Lebensjahr. Zeitschrift für Tierzüchtung und Züchtungsbiologie. 45 (3), 259-308 (1940).
- Urban, J. P. G., Roberts, S., Ralphs, J. R. The Nucleus of the Intervertebral Disc from Development to Degeneration1. American Zoologist. 40 (1), 53-61 (2000).
- Risbud, M. V., Shapiro, I. M. Role of cytokines in intervertebral disc degeneration: pain and disc content. Nature Reviews. Rheumatology. 10 (1), 44-56 (2014).
- Iatridis, J. C., Michalek, A. J., Purmessur, D., Korecki, C. L. Localized intervertebral disc injury leads to organ level changes in structure, cellularity, and biosynthesis. Cell and Molecular Bioengineering. 2 (3), 437-447 (2009).
- Torre, O. M., Mroz, V., Bartelstein, M. K., Huang, A. H., Iatridis, J. C. Annulus fibrosus cell phenotypes in homeostasis and injury: implications for regenerative strategies. Annals of the New York Academy of Sciences. 1442 (1), 61-78 (2019).
- Rolauffs, B., et al. Proliferative remodeling of the spatial organization of human superficial chondrocytes distant from focal early osteoarthritis. Arthritis and Rheumatism. 62 (2), 489-498 (2010).
- Johnson, W. E., Roberts, S. Rumours of my death may have been greatly exaggerated': a brief review of cell death in human intervertebral disc disease and implications for cell transplantation therapy. Biochemical Society Transactions. 35, Pt 4 680-682 (2007).
- Roberts, S. Disc morphology in health and disease. Biochemical Society Transactions. 30, Pt 6 864-869 (2002).
- Lama, P., Kulkarni, J., Tamang, B. The role of cell clusters in intervertebral disc degeneration and its relevance behind repair. Spine Research. 03, 15(2017).
- Sharp, C. A., Roberts, S., Evans, H., Brown, S. J. Disc cell clusters in pathological human intervertebral discs are associated with increased stress protein immunostaining. European Spine Journal: Official Publication of the European Spine Society, the European Spinal Deformity Society and the European Section of the Cervical Spine Research Society. 18 (11), 1587-1594 (2009).
- Freemont, A. J. The cellular pathobiology of the degenerate intervertebral disc and discogenic back pain. Rheumatology. 48 (1), Oxford. 5-10 (2009).
- Müllers, Y., et al. Quantitative analysis of F-actin alterations in adherent human mesenchymal stem cells: Influence of slow-freezing and vitrification-based cryopreservation. PLoS One. 14 (1), 0211382(2019).
- McCann, M. R., Séguin, C. A. Notochord cells in intervertebral disc development and degeneration. Journal of Developmental Biology. 4 (1), 3(2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon