Method Article
조직 샘플의 질량 분광계 기반 산탄총 프로테오믹스의 포괄적인 워크플로우
요약
설명된 프로토콜은 라벨 기반 및 라벨 자유 양수의 두 가지 접근법을 사용하여 조직 샘플의 최적화된 정량 적 프로테오믹스 분석을 제공합니다. 라벨 기반 접근법은 단백질의 보다 정확한 양을 얻을 수 있는 장점이 있으며, 라벨없는 접근법은 비용 효율적이며 코호트의 수백 가지 샘플을 분석하는 데 사용됩니다.
초록
질량 분석의 최근 발전은 강력하고 재현 가능한 데이터 세트의 생성과 함께 깊은 프로테오믹 분석을 초래했습니다. 그러나 상당한 기술적 진보에도 불구하고 환자 혈액, CSF 및 조직과 같은 생체 표본의 샘플 준비는 여전히 상당한 어려움을 겪고 있습니다. 바이오마커를 식별하기 위해 조직 프로테오믹스는 종종 벤치에서 클리닉으로 연구 결과를 번역하는 매력적인 샘플 소스를 제공합니다. 알츠하이머병, 파킨슨병 등과 같은 암 및 신경퇴행성 질환의 조기 진단을 위한 잠재적인 후보바이오마커를 공개할 수 있다. 조직 proteomics는 또한 단백질의 풍부에 근거를 둔 전신 정보의 부를 산출하고 흥미로운 생물학 질문을 해결하는 것을 돕습니다.
정량적 프로테오믹스 분석은 라벨 기반 및 라벨 이없는 접근 방식의 두 가지 광범위한 범주로 그룹화될 수 있습니다. 라벨 기반 접근법에서 단백질 또는 펩타이드는 SILAC(세포 배양에서 아미노산을 가진 안정적인 동위원소 라벨) 또는 ICAT(동위원소 코딩 친화성 태그), TMT(동위원소 코딩 친화성 태그), TMT(동위원소 대칭 대칭 태그) 또는 iTRAQ(상대및 절대수량에 대한 isobaric tag)와 같은 화학 적 태그로 분류됩니다. 라벨 기반 접근법은 단백질의 보다 정확한 양과 동소바릭 라벨을 사용하는 장점이 있으며, 여러 샘플을 단일 실험에서 분석할 수 있다. 라벨없는 접근 방식은 라벨 기반 접근 방식에 대한 비용 효율적인 대안을 제공합니다. 특정 코호트에 속하는 수백 개의 환자 샘플을 분석하고 임상 적 특징에 따라 다른 코호트와 비교할 수 있습니다. 여기서는 생명 과학, 특히 바이오마커 발견 기반 프로젝트에서 중요한 라벨 프리 및 라벨 기반 프로테오메 프로파일링 방법을 사용하여 조직 샘플에 최적화된 정량적 프로테오믹스 워크플로우를 설명했습니다.
서문
프로테오믹스 기술은 질병1의검출 및 예후에 도움을 줄 수 있는 잠재적 후보 마커의 식별 및 정량화를 가능하게 할 가능성이 있다. 질량 분석 분야의 최근 발전은 단백질 수준에서 임상 연구를 가속화했습니다. 연구원은 지금 단백질 식별 및 정량화2를위한 증가한 감도를 제공하는 질량 분광법 기지를 둔 proteomics를 사용하여 몇몇 질병의 복잡한 병리학의 도전을 해결하기 위하여 노력하고 있습니다. 단백질의 정확한 정량적 측정은 건강하고 병들인 개별에 있는 단백질 중 동적 및 공간 협력을 이해하기 위하여 중요합니다3; 그러나, 프로테오메 전체 규모에 대한 이러한 분석은 쉽지 않다.
임상 표본의 프로테오믹 프로파일링의 한 가지 주요 제한사항은 생물학적 샘플의 복잡성입니다. 많은 상이한 유형의 샘플은 세포주, 혈장 및 조직4,5와같은 질병 프로테아움을 연구하기 위해 조사되었다. 세포주 널리 질병 진행의 다른 단계를 모방 하는 체 외 실험에서 모델로 사용 됩니다. 그러나, 세포주를 가진 한 가지 주요 제한은 세포 배양6의과정에서 지노티픽 및 현상 변화를 쉽게 획득한다는 것입니다. 플라즈마와 같은 체액은 바이오마커 발견을 위한 매력적인 공급원이 될 수 있습니다. 그러나, 단백질 농도가 매우 풍부하고 동적 범위 때문에 플라즈마 프로테오믹스는 조금 더 도전적입니다7. 여기서, 가장 풍부한 단백질로부터 유래된 펩타이드는 질량/전하 비율이 동일하더라도 낮은 풍부한 단백질로부터 유래된 단백질을 억제할 수있다. 지난 몇 년 동안 고갈 및 분수 기술의 발전이 있었지만, 좋은 커버리지를 얻는 것은 여전히 플라즈마 proteomics8,9의주요 한계남아있다. 질병 생물학의 proteomic 조사를 위한 조직의 사용은 조직 견본이 질병 사이트에 가장 근위이고 질병 생물학에 더 나은 통찰력을 제공하기 위하여 높은 생리적 및 병리학적인 정보를 제공하기 때문에 바람직하다10,11.
이 원고에서, 우리는 조직 견본의 정량적인 proteomics를 위한 단순화된 프로토콜을 제공했습니다. 우리는 이 완충이 질량 분석 기지를 둔 조사와 호환하기 때문에 조직 용액 준비에 대해 8 M 우레아를 포함하는 완충액을 사용했습니다. 그러나, 질량 분광계에 주입 하기 전에 소금을 제거 하는 펩 티 드를 청소 하는 것이 필수적이다. 기억해야 할 한 가지 중요한 점은 트립신이 8M 우레아 농도에서 낮은 활성을 나타내기 때문에 단백질 소화를 위한 트립신을 첨가하기 전에 우레아 농도를 1M 미만으로 낮추는 것입니다. iTRAQ(상대적이고 절대적인 정량화를 위한 아이소바릭 태그) 및 라벨없는 정량화(LFQ)를 사용하여 정량적 글로벌 프로테오믹스의 두 가지 접근법을 설명했습니다. iTRAQ 기반 정량 프로테오믹스는 주로 생물학적 상태(예: 정상 대 질병 또는 처리된 샘플)에서 다양한 여러 샘플을 비교하는 데 사용됩니다. 이 접근법은펩타이드(12)의N단 1차 아민에 라벨을 붙이기 위해 동소근 시약을 활용한다. iTRAQ 시약에는 펩티드13의N-terminal 1차 아민과 반응하는 N-메틸 피프라진 기자 그룹, 밸러스티어 그룹 및 1개의 N-하이드록시 succinimide 에스테르 군이 포함되어 있다. 각 조건에서 소화 된 펩 티 드 특정 iTRAQ 시약으로 표시 됩니다. 라벨링 에 이어, 반응이 중지되고 상이한 조건에서 펩티드가 단일 튜브로 풀링된다. 이 결합된 견본 혼합물은 식별 및 정량화를 위한 질량 분광계에 의해 분석됩니다. MS/MS 분석 후, 저분자 질량을 가진 리포터 이온 단편이 생성되고 이들 리포터 이온의 이온 강도는 단백질의 정량화에 사용된다.
또 다른 접근법, 라벨없는 정량화는 안정적인 동위원소로 펩티드를 라벨링하지 않고 복잡한 시료에서 단백질의 상대적 수를 결정하는 데 사용됩니다.
프로토콜
이 연구는 기관 검토 위원회와 인도 기술 봄베이 연구소의 윤리위원회 (IITB-IEC/2016/026)에 의해 검토및 승인되었습니다. 환자/참가자는 이 연구에 참여하기 위해 서면 동의를 제공했습니다.
1. 조직 리자테 준비
참고: 얼음에서 다음 단계를 모두 수행하여 프로테아제의 비활성 상태를 유지합니다. 메스와 사용된 모든 튜브가 오염을 피하기 위해 멸균되었는지 확인하십시오.
- 구슬 박동 튜브에 조직의 ~ 30 mg을 가지고, 1 x 인산염 완충식 염수 (PBS)의 200 μL을 추가하고 소용돌이.
참고 : 이 연구에서, 신선한 냉동 인간의 뇌 종양 조직은 lysate 준비를 위해 촬영되었다. 프로토콜은 조직의 모형 (연약한 또는 단단한 조직) 및 조직의 세포 복잡성에 따라서 어떤 변경든지 신선한 동결된 조직에 이용될 수 있습니다. - 그 후, 조직을 정착하고 조심스럽게 파이펫을 사용하여 PBS를 제거하기 위해 튜브를 회전. 조직에 남아있는 혈액의 흔적이 여전히있는 경우 다른 PBS 세척을 수행.
- 제조 업체의 프로토콜에 따라 300 μL 의 요소 용해 버퍼 (8 M urea, 50 mTris pH 8.0, 75 mM NaCl, 1 mM MgCl2)및 프로테아제 억제제 칵테일 (PIC)을 추가합니다.
참고: 용해 버퍼의 부피는 초음파 처리 과정에서 조직을 분쇄하고 추출된 것을 중단하기에 충분해야 합니다. 너무 적은 리시스 버퍼는 비효율적인 조직 리시스를 초래할 수 있으며, 너무 많은 리시스 버퍼는 단백질 리세이트를 희석시킬 것입니다. - 튜브를 얼음 위에 놓고 5s (ON / OFF)의 펄스 사이클로 2.5 분 동안 40 %의 진폭으로 조직을 초음파 처리합니다.
- 지르코늄 구슬을 튜브에 넣고 얼음에 5분 배양된 90s의 비드 비터를 사용하여 조직을 균질화합니다. 이 단계를 두 번 반복합니다.
- 조직이 적절하게 균질화되면 10 분 동안 얼음에 튜브를 배양하십시오.
- 인큐베이션 후, 원심분리시 샘플을 6,018 x g에서 4°C에서 15분 동안 15분 동안 분리하여 셀 이물질을 상체로부터 분리한다.
- 신선한 라벨튜브에서 상체를 수집하고 추가 사용이 될 때까지 -80 °C에 알리쿼시로 보관하십시오.
2. 조직 리스의 단백질 정량화 및 품질 검사
- 보충 파일 1에설명 된 바와 같이 브래드포드의 시약을 사용하여 조직 용액의 단백질 농도를 정량화한다.
- 단백질 정량화에 따라, 12% SDS-PAGE 젤에 10 μg의 조직 용액을 실행하여 용액의 품질을 확인합니다.
참고: 품질 검사를 지우는 lysates에 대해서만 추가 다운스트림 처리를 수행해야 합니다.
3. 단백질의 효소 소화
참고: 효소 소화단계는 도 1a에표시됩니다.
- 소화를 위해 50 μg의 단백질을 섭취하고 ddH2O를추가하여 부피를 20 μL로 구성하십시오.
- 지금, 단백질의 이황화물 결합을 줄이고 60분 동안 37°C에서 시료를 배양하기 위해 주식으로부터 0.8 μL을 단백질 용액에 첨가하여 주식(0.5 M TCEP)으로부터 20mM Tris(2-carboxyethyl) 포스핀(TCEP)을 준비한다.
- ddH2O로 40mM 요오도아세타미드(IAA)를 준비하고 1.6 μL을 추가하여 감소된 시스테인 잔류물을 알킬 수 있습니다. 실온에서 10 분 동안 어둠 속에서 배양하십시오.
- 25m Tris pH 8.0 및 1mM CaCl2를 함유한 희석 버퍼를 1:8 비율로 추가하여 샘플에서 우레아 농도를 1M 미만으로 희석시. 이 시점에서 pH를 확인합니다.
참고: 트립신을 소화 효소로 사용하는 경우, 우레아의 농도가 1M 미만인지 확인하십시오. - 소화를 수행하려면 1:50의 효소/기질 비율로 트립신을 추가합니다. 16시간 동안 흔들리는 건조한 욕조에서 37°C에서 튜브를 배양하여 밤새 소화합니다.
참고: 트립신 효소는 자기 소화에 수반 되는 매우 반응성 프로테아제. 여분의주의를 기울이고 얼음 위에 트립신을 신속하게 추가하십시오. - 16h의 배양 후, 소화된 펩티드를 진공 농축기에서 건조시다.
4. 소화 된 펩티드의 탈염
참고: 펩티드의 탈염을 수행하려면 C18 단계 팁을 사용하십시오.
- 메탄올의 50 μL을 추가하여 C18 단계 팁을 활성화합니다. RT에서 2 분 동안 1,000 x g의 팁을 원심 분리하십시오. 두 번 반복합니다.
- 아세토닐릴 50μL을 0.1% 포믹산에 추가하여 스테이지 팁을 세척합니다. RT에서 2 분 동안 1,000 x g의 튜브원심분리기. 튜브 의 바닥에 수집 된 여과를 버리십시오. 이 단계를 두 번 반복합니다.
- 0.1%(v/v) FA의 50 μL을 추가하여 열을 평형화합니다. 다시 말하지만, RT에서 2 분 동안 1,000 x g에서 원심 분리를 수행하고 여과물을 폐기하십시오.
- 말린 소화 펩티드를 0.1%의 50 μL에서 0.1%의 포믹산으로 재구성한다.
참고: 샘플을 통과하는 동안 스테이지 팁 내부의 기포 형성을 피하십시오. 건조가 펩티드 손실로 이어질 수 있기 때문에 단계 팁은 원심 분리 단계에서 완전히 건조해서는 안됩니다. - 재구성된 펩타이드를 활성화 된 단계 팁에 추가하고 2 분 동안 1,000 x g에서 원심 분리로 단계 끝을 통해 샘플을 전달합니다. 이 단계를 적어도 네 번 반복합니다. 흐름을 4°C로 저장합니다.
- 시료를 세척하려면 0.1%(v/v)의 50μL(v/v)의 포믹산을 추가합니다. 원심분리 단계를 반복하고 여과물을 폐기합니다.
- 펩타이드의 용출을 위해, 0.1% 포믹산(v/v)에 40%(v/v) ACN의 50 μL을 추가하고 원심분리로 단계 끝을 통과한다. 신선한 튜브에 여과물을 수집합니다. 0.1% 포믹산에서 50% 및 60% ACN으로 단계를 반복하고 동일한 신선한 튜브에서 여과물을 수집합니다.
- 진공 농축기로 신선한 튜브에서 수집된 탈염 펩티드를 건조시다.
참고: 건조된 탈염 펩타이드는 주입할 준비가 되어 있거나 6개월 동안 -20°C로 저장할 수 있다. 장기 저장(>6개월)의 경우 펩티드를 -80°C에 보관하십시오.
5. 염무제 펩타이드의 정량화
- 말린 염무제 펩티드를 0.1% FA로 재구성한다.
- 70% 에탄올을 사용하여 보풀 -free 티슈로 포토메트릭 측정 플레이트를 닦아냅니다.
- 0.1% FA의 2 μL을 사용하여 빈 공간을 설정합니다.
- 재구성된 샘플 2μL을 복제된 플레이트에 추가합니다.
- 분광계에 플레이트를 놓고 205 nm 및 280 nm에서 흡광도를 측정합니다.
- 다음 수식을 사용하여 어금니 (ε)를 계산합니다.
ε = 27 / [1 - 3.85 * A280 / A205]
참고: 몰 의 흡수성(ε)은 전자 전이의 확률 또는 종들이 사고되고 있는 방사선의 특정 파장을 얼마나 잘 흡수하는지를 측정합니다. ε 값은 31mL mg-1cm -1cm-1 ~ 33mL mg-1cm -1cm-1의범위에 있어야 한다. 값이 범위에 속하지 않으면 샘플이 제대로 소화되지 않음을 나타냅니다. - 다음 공식을 사용하여 μg/μL의 펩티드 농도를 계산합니다.
펩티드 농도 = 순 OD (205) / 0.051 * ε
6. 소화 된 펩티드의 라벨없는 수량 (LFQ)
참고: 라벨이 없는 수량의 경우 보충 파일 2에언급된 LC 및 MS 매개 변수를 사용합니다. 동일한 유형의 샘플의 3개의 생물학적 복제가 질량 분광계에서 실행되었을 때 높은 커버리지 데이터가 얻어졌다.
- 액체 크로마토그래피 설정
- 탈염 펩티드의 정량화 후, 유리병에 펩티드 2 μg를 가지고 0.1 % FA를 사용하여 10 μL로 부피를 구성합니다. 탈염 펩티드의 농도는 200 ng/μL이 될 것입니다.
- 액체 크로마토그래피 시스템의 자동 샘플러(재료 표 참조)를열고 유리병을 자동 샘플러 내부에 배치합니다.
- 0.1% (v/v) FA를 사용하여 사전 열 및 분석 열을 계평합니다.
- 바이알에서 염무소화 펩타이드 1μg을 사용하여 컬럼에 적재합니다.
- 샘플 복잡성에 따라 LC 그라데이션을 설정합니다. 본 실험에서 LC 그라데이션은 조직 샘플의 라벨 없는 수량에 대해 120분 동안 사용되었습니다.
- MS 설정: 프로테오믹스 분석을 최적화하기 전에, 시스템 적합성을 위한 소프트웨어를 사용하여 소세럼 알부민(BSA)의 일부 펩티드를 모니터링하고 BSA(그림2A,B)의커버리지를 분석하여 계측기의 품질 관리 검사를 수행한다. 인수 매개 변수는 MS 데이터 수집 소프트웨어를 사용하여 계측기로 설정되었습니다(재료 표참조).
- 소프트웨어를 열고, 악기 설정을 두 번 클릭하고 기본 매개 변수와 펩티드 ID에서 템플릿을 선택합니다.
- 보충 파일 2를 사용하여 MS 매개 변수를 설정하고 새 방법으로 저장합니다.
- 이제 샘플 세부 정보를 채우기 위해 소프트웨어를 엽니다. 시퀀스 설정을두 번 클릭하고 샘플 유형, 샘플 이름, 파일 저장 위치, 계측기 방법 파일, 주입 볼륨 및 샘플위치와 같은 세부 정보를 입력합니다.
- 모든 정보가 채워지면 행을 선택하고 실행을시작합니다.
7. 소화 된 펩 티 드의 라벨 기반 수량 (iTRAQ)
참고: iTRAQ 또는 TMT 시약 등과 같은 다른 동소바릭 라벨을 사용하여 라벨 기반 정량화를 수행할 수 있습니다. 여기서, iTRAQ 4-플렉스는 3개의 조직 샘플로부터 소화된 펩티드의 라벨링에 사용되었다. iTRAQ 4-플렉스 라벨링의 절차는 아래에 언급되어 있습니다.
- iTRAQ 시약을 사용하여 소화 된 펩티드의 라벨링.
참고: 이 실험에서는 3개의 조직 샘플에서 펩티드가 사용됩니다. 각 조직 샘플에서 소화 된 펩타이드 80 μg는 iTRAQ 시약 (114, 115, 116 및 117)으로 라벨링을위한 4 개의 튜브에서 채취됩니다 (자세한 실험 매개 변수에 대한 보충 파일 3 참조).- iTRAQ 시약을 사용하기 전에 시약의 각 유리병을 실온(약 5분)으로 가져옵니다. 각 바이알의 하단에 솔루션을 가져오기 위해 약 30s의 짧은 스핀을 제공합니다.
참고: 각 바이알에서 10-15 μL 용액이 있어야 합니다. - iTRAQ 라벨링의 경우 iTRAQ 라벨링 키트에 제공된 용해 버퍼의 20 μL에서 건조 펩티드를 재구성한다.
- 키트에 제공된 유리병에서 70 μL의 에탄올을 추가하여 라벨을 재구성하고 30s용용용액을 혼합하여 10s로 회전합니다.
참고: 모든 단계는 제조업체의 지침에 따라 수행되는 것이 좋습니다. - 균일하게 혼합된 iTRAQ 라벨(114, 115, 116 및 117)을 펩티드 샘플을 포함하는 각 튜브에 추가하고 라벨링 반응이 일어날 수 있도록 한다.
- 각 튜브의 성분을 30초 동안 소용돌이게 한 다음 튜브를 10초 동안 회전시켜 혼합물을 튜브 바닥으로 되돌려 보냅니다.
참고: pH 용지를 사용하여 솔루션의 pH를 확인합니다. pH는 8보다 커야 합니다. 그렇지 않은 경우 용해 버퍼의 최대 10 μL을 추가하여 pH를 조정합니다. - 각 튜브를 실온에서 90분 동안 배양합니다. 반응의 끝에서, MS 등급 물을 추가하여 튜브에 어떤 초과 언바운드 라벨을 담금.
- 실내 온도에서 30분에서 1시간 동안 튜브를 배양합니다.
- 잠복이 끝나면 라벨이 부착된 모든 내용을 단일 튜브로 옮기고 라벨이 부착된 펩티드를 진공 농축기에서 건조시다.
참고: TMT 라벨링에 대해 유사한 라벨링 절차를 따를 수 있습니다.
- iTRAQ 시약을 사용하기 전에 시약의 각 유리병을 실온(약 5분)으로 가져옵니다. 각 바이알의 하단에 솔루션을 가져오기 위해 약 30s의 짧은 스핀을 제공합니다.
- 액체 크로마토그래피 설정
- 0.1% 포믹산으로 샘플을 재구성하고 나노 LC의 자동 샘플러를 열고 자동 샘플러 내부에 샘플을 배치합니다. LC 설정에 대해 보충 파일 2에 언급된 매개 변수를 사용합니다.
- 샘플의 복잡성에 따라 LC 그라데이션을 설정합니다. 180분의 LC 그라데이션은 조직 샘플의 라벨 기반 수량(iTRAQ)을 위한 본 실험에서 사용되었다.
참고: 덜 복잡한 시료의 경우 짧은 그라데이션은 대부분의 펩타이드를 효율적으로 분리할 수 있습니다. 그러나 샘플이 매우 복잡한 경우 펩티드의 더 나은 분리를 위해 더 긴 그라데이션을 사용합니다.
- iTRAQ 기술에 대한 MS 설정
- 라벨 기반 수량에서 MS/MS 조각화에 대해 35%로 설정된 충돌 에너지를 제외한 라벨 기반 수량에 사용되는 것과 동일한 방식으로 라벨 기반 수량에 대한 모든 MS 매개변수를 설정합니다.
8. 데이터 분석
- LC 질량 분광계에서 얻은 원시(MS/MS 스펙트럼) 파일을 시판가능한 분석 소프트웨어(재료 표 참조)를 사용하여 분석합니다.
참고: 71,785개의 단백질 서열을 포함하는 Uniprot(UP000005640)의 인간 참조 프로테오메 데이터베이스는 세퀘스트 HT 및 마스코트(v2.6.0) 검색 엔진을 사용하여 단백질 ID를 획득하는 데 사용되었습니다. 레이블이 없는 수량 및 레이블 기반 수량에 대한 매개 변수는 보충 파일 4에설명되어 있습니다.
결과
우리는 발견 프로테오믹스에 대한 두 가지 접근 방식을 사용했습니다: 라벨이 없는 및 라벨 기반 프로테오믹스 접근법. SDS-PAGE에서 조직 샘플의 단백질 프로파일은 그대로 단백질을 나타내고 프로테오믹분석(도 2A)을고려할 수 있었다. 계측기의 품질 관리 검사는 시스템 적합성 소프트웨어를 통해 모니터링되었으며 계측기 성능(도2B)의일별 변화를 보여 주었다. LC 그라데이션(도2C)의30분에서 BSA 샘플의 91% 시퀀스 커버리지를 관찰했습니다. LC 그라데이션은 상업용 HeLa 세포 다이제스트의 500 ng를 사용하여 최적화되었으며, 1h 그라데이션(도2D)에서1488단백질과 비교하여 2시간 그라데이션에서 2425개의 단백질을 관찰하였다. 우리는 풀 조직 샘플(그림 2E)의세 가지 기술적 복제모두에 걸쳐 평균 2428 단백질을 식별 할 수있었습니다.
최적화된 LC 및 MS 파라미터는 3개의 상이한 생물학적 조직샘플(도 3 및 보충 파일 2)에적용되었다. 크로마토그램은 3개의 다른 생물학 조직 견본 사이 좋은 재현성을 보여주었습니다. 우리는 각각 라벨이 없는 기반 접근법을 사용하여 조직 샘플 1, 2 및 3로부터 2725, 2748 및 2718 정량화 가능한 단백질을 확인했습니다. 우리는 151 단백질이 제 1 및 두 번째 LFQ 실험에서 일반적이었다는 것을 관찰하고, 163 단백질은 두 번째와 세 번째 LFQ 실험 사이에서 공유되었고, 187 단백질은 1차 및 세 번째 실험 사이에서 공유되었다, 동안 2190 단백질은 세 가지 조직 샘플(그림 4A)에서일반적이었다.
우리는 크로마토그램을 검사하고 iTRAQ 라벨을 확인하고 거의 모든 MS / MS 스펙트럼에 존재하는 것으로 나타났습니다. iTRAQ 실험을 위해 세 세트가 실행되었습니다. 각 세트에서 얻은 단백질 수는 각각 2455, 2285 및 2307이었다. 287개의 단백질은 샘플 1 및 샘플 2, 183 단백질 샘플 2 및 샘플 3에서 일반적이었다, 및 195 단백질은 샘플 1 및 샘플 3에서 일반적이었다. 3개의 견본에서 일반적인 단백질의 총 수는 1557(도 4B)이었습니다.
우리는 LFQ 및 iTRAQ실험(그림 4C)에서1% FDR 후에 얻은 총 펩티드 스펙트럼 일치(PSM), 펩티드 군, 총 단백질, 단백질 군 및 단백질 수를 비교하였다.

도 1: 조직 프로테오믹스를 위한 워크플로우. (A)MS 분석을 위한 조직 용액으로부터 샘플을 준비하는 샘플 처리 단계. (B)라벨이 없는 수량에 대한 단계. (C)라벨 기반 수량에 대한 단계. (D)프로테오메 검색기를 이용한 데이터 분석을 위한 단계. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 조직 샘플의 품질 검사 제어 및 계측기의 재현성. (A)조직의 품질 검사는 12% SDS-PAGE(B)파노라마를 사용하여 BSA의 일부 펩티드모니터링에 대한 12% SDS-PAGE(B) 모니터링을 통해 다양한 일 동안 계측기 가변성을 확인한다. (C)3개의 기술 복제에서 BSA의 서열 커버리지. (D)조직 샘플에 대한 LC 파라미터의 최적화. (E)3개의 상이한 생물학적 샘플에서 펩티드 스펙트럼 성냥, 펩티드 및 단백질의 수. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 3: 조직 샘플의 프로테오믹스 분석을 위한 LC 및 MS 파라미터. (A, B)조직 샘플의 라벨 프리 수량(A) 및 라벨 기반 수량(B)을 위해 펩티드를 분리하는 데 사용되는 액체 크로마토그래피 그라데이션. (C)레이블이 없는 수량 및 레이블 기반 수량에 대한 MS 매개 변수입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
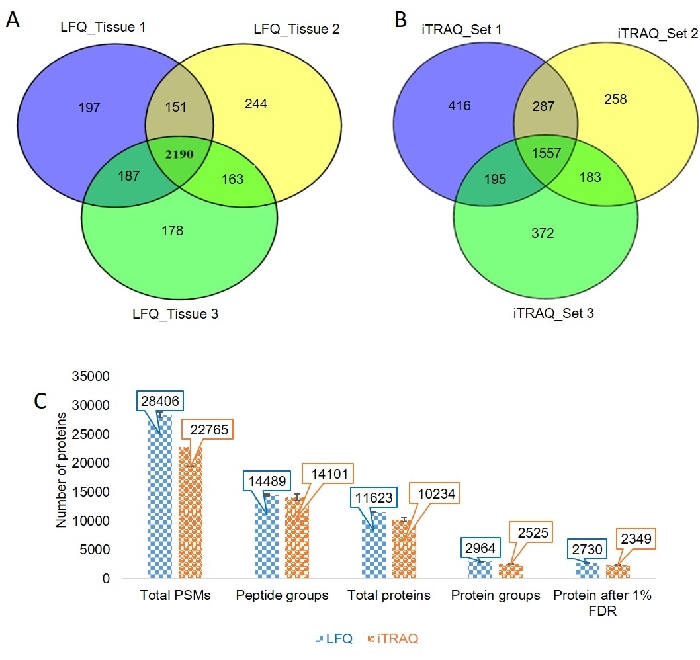
도 4: 조직 샘플의 라벨 프리 및 라벨 기반 수량. (A)벤 다이어그램은 라벨이 없는 실험의 조직 샘플 1, 2 및 3에서 일반적이고 독점적인 단백질을 나타낸다. (B)벤 다이어그램은 라벨 기반 실험의 조직 샘플 1, 2 및 3에서 공통 및 배타적 단백질을 나타낸다. (C)펩티드 스펙트럼 일치(PSMs), 펩타이드 군, 총 단백질, 단백질 군 및 단백질 수의 비교 분석은 라벨 없는 수량(LFQ) 및 라벨 기반 실험(iTRAQ)에서 1% FDR 후. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 파일. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
생물학적 샘플의 조직 프로테오믹스는 질병 진행의 다른 단계와 관련된 새로운 잠재적인 바이오마커를 탐구할 수 있게 해줍니다. 그것은 또한 질병 진행과 관련 되 었던 신호 및 통로의 메커니즘을 설명합니다. 조직 정량 적 프로테오믹스 분석을 위한 기술된 프로토콜은 재현 가능한 양호한 커버리지 데이터를 제공한다. 대부분의 단계는 제조업체의 지침에서 적용되었습니다. 고품질 데이터를 얻기 위해 다음 단계가 가장 중요합니다. 따라서 이러한 단계를 수행하는 동안 추가주의를 기울여야합니다.
단백질의 불완전한 소화 및 각질의 오염은 단백질의 더 적은 엄호를 제공할 수 있습니다 (n < 1000), 따라서 전반적인 실험에 영향을 미치는. 샘플(pH 8)과 샘플(1M 미만)의 요소 농도의 pH는 단백질의 효율적인 소화를 보장합니다. 신선한 버퍼를 사용하고 주의를 기울여 시료를 취급하면 케라틴 오염의 가능성이 줄어듭니다. iTRAQ 시약은 매우 비용이 많이 들며 데이터를 분석하기 위해 MS/MS 및 소프트웨어를 수행하기 위해 정교한 MS 플랫폼이 필요합니다. 프로테오믹스 실험은 염, 펩타이드 정량화 및 iTRAQ/TMT 시약의 라벨링 효율의 오염에 민감합니다. MS/MS 분석 전에 소화된 펩타이드가 제대로 탈염되어 데이터의 배경 잡음이 줄어드는지 확인하십시오. iTRAQ 기술의 경우, 부착된 태그의 단편화는 펩타이드와 단백질을 비교적 정량화하는 데 사용될 수 있는 저분자 질량 리포터 이온을 생성하며, 라벨이 없는 접근법의 경우 곡선 아래 영역은 수량으로 간주됩니다. 단백질의 양에 대한 신뢰를 높이기 위해, 독립적 인 검증 실험은 특히 MRM / PRM을 수행해야합니다.
2개의 양수 방법(라벨프리 및 라벨 계 프로테오믹스)를 이용한 조직 샘플의 분석은 단백질의 양호한 커버리지를 얻기 위하여 기술되었다. 라벨이 없는 정량적 프로테오믹스 접근법은 임상 연구에서 사용하기 위한 몇 가지 이점을 제공합니다. 견본은 독립적으로 실행되고, 질량 분광계를 통해 분석될 견본의 다수가 있기 때문에 환자 집단을 위해 착수되는 연구 결과를 위해 특히 중요합니다. 최적화된 펩타이드 풀과 같은 기술적 복제를 사용하면 샘플이 서로 다른 시점에서 실행되더라도 좋은 재현성을 보장할 수 있습니다. 이 접근법은 많은 국제 사회의 노력인 CPTAC와 같은 대규모 집단 연구에서 사용되었습니다14.
연구에서 나오는 잠재적인 표적은 표적 프로테오믹스 접근법을 사용하여 검증을 위해 고려될 수 있었습니다. 우리는 조직 견본 분석을 기반으로 한 프로젝트가 이 연구에서 제공된 정량적 프로테오믹스의 상세한 워크플로우로부터 크게 유익할 수 있다고 결론을 내렸습니다. 언급 된 단계는 방법을 최적화하고 조직 샘플의 proteome을 매핑하는 데 도움이됩니다. 정량적 프로테오믹 기술의 선택은 샘플 수, MS 플랫폼의 가용성 및 해결될 생물학적 질문에 따라 달라질 수 있습니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
우리는 MHRD-UAY 프로젝트 (UCHHATAR AVISHKAR YOJANA), 생명 공학부 (BT / PR13114 / INF / 22/206/2015)가 지원하는 IIT 봄베이의 SS 및 MASSFIITB 시설에 대한 프로젝트 #34_IITB 모든 MS 관련 실험을 수행하도록 인정합니다.
자료
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Acetonitrile (MS grade) | Fisher Scientific | A/0620/21 | |
| Bovine Serum Albumin | HiMedia | TC194-25G | |
| Calcium chloride | Fischer Scienific | BP510-500 | |
| Formic acid (MS grade) | Fisher Scientific | 147930250 | |
| Iodoacetamide | Sigma | 1149-25G | |
| Isopropanol (MS grade) | Fisher Scientific | Q13827 | |
| Magnesium Chloride | Fischer Scienific | BP214-500 | |
| Methanol (MS grade) | Fisher Scientific | A456-4 | |
| MS grade water | Pierce | 51140 | |
| Phosphate Buffer Saline | HiMedia | TL1006-500ML | |
| Protease inhibitor cocktail | Roche Diagnostics | 11873580001 | |
| Sodium Chloride | Merck | DF6D661300 | |
| TCEP | Sigma | 646547 | |
| Tris Base | Merck | 648310 | |
| Trypsin (MS grade) | Pierce | 90058 | |
| Bradford Reagent | Bio-Rad | 5000205 | |
| Urea | Merck | MB1D691237 | |
| Supplies | |||
| Hypersil Gold C18 column | Thermo | 25002-102130 | |
| Micropipettes | Gilson | F167380 | |
| Stage tips | MilliPore | ZTC18M008 | |
| Zirconia/Silica beads | BioSpec products | 11079110z | |
| Equipment | |||
| Bead beater (Homogeniser) | Bertin Minilys | P000673-MLYS0-A | |
| Microplate reader (spectrophotometer) | Thermo | MultiSkan Go | |
| pH meter | Eutech | CyberScan pH 510 | |
| Probe Sonicator | Sonics Materials, Inc | VCX 130 | |
| Shaking Drybath | Thermo | 88880028 | |
| Orbitrap Fusion mass spectrometer | Thermo | FSN 10452 | |
| Nano LC | Thermo | EASY-nLC1200 | |
| Vacuum concentrator | Thermo | Savant ISS 110 | |
| Software | |||
| Proteome Discoverer | Thrermo | Proteome Discoverer 2.2.0.388 |
참고문헌
- Petricoin, E., Wulfkuhle, J., Espina, V., Liotta, L. A. Clinical proteomics: revolutionizing disease detection and patient tailoring therapy. Journal of Proteome Research. 3 (2), 209-217 (2004).
- Geho, D. H., Petricoin, E. F., Liotta, L. A. Blasting into the microworld of tissue proteomics: a new window on cancer. Clinical Cancer Research: An Official Journal of the American Association for Cancer Research. 10 (3), 825-827 (2004).
- Hashimoto, Y., Greco, T. M., Cristea, I. M. Contribution of mass spectrometry-based proteomics to discoveries in developmental biology. Advances in Experimental Medicine and Biology. 1140, 143-154 (2019).
- Faria, S. S., et al. A timely shift from shotgun to targeted proteomics and how it can be groundbreaking for cancer research. Frontiers in Oncology. 7, 13 (2017).
- Ray, S., et al. Proteomic technologies for the identification of disease biomarkers in serum: advances and challenges ahead. Proteomics. 11 (11), 2139-2161 (2011).
- Chen, E. I., Yates, J. R. Cancer proteomics by quantitative shotgun proteomics. Molecular Oncology. 1 (2), 144-159 (2007).
- Geyer, P. E., Holdt, L. M., Teupser, D., Mann, M. Revisiting biomarker discovery by plasma proteomics. Molecular Systems Biology. 13 (9), 942 (2017).
- Ray, S., et al. Proteomic analysis of Plasmodium falciparum induced alterations in humans from different endemic regions of India to decipher malaria pathogenesis and identify surrogate markers of severity. Journal of Proteomics. 127, 103-113 (2015).
- Ray, S., et al. Clinicopathological analysis and multipronged quantitative proteomics reveal oxidative stress and cytoskeletal proteins as possible markers for severe vivax malaria. Scientific Reports. 6, 24557 (2016).
- Sharma, S., et al. Multipronged quantitative proteomic analyses indicate modulation of various signal transduction pathways in human meningiomas. Proteomics. 15 (2-3), 394-407 (2015).
- Sharma, S., Ray, S., Moiyadi, A., Sridhar, E., Srivastava, S. Quantitative proteomic analysis of meningiomas for the identification of surrogate protein markers. Scientific Reports. 4, 7140 (2014).
- Aslam, B., Basit, M., Nisar, M. A., Khurshid, M., Rasool, M. H. Proteomics: Technologies and their applications. Journal of Chromatographic Science. 55 (2), 182-196 (2017).
- Wiese, S., Reidegeld, K. A., Meyer, H. E., Warscheid, B. Protein labeling by iTRAQ: A new tool for quantitative mass spectrometry in proteome research. Proteomics. 7 (3), 340-350 (2007).
- Rudnick, P. A., et al. A description of the Clinical Proteomic Tumor Analysis Consortium (CPTAC) common data analysis pipeline. Journal of Proteome Research. 15 (3), 1023-1032 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유