Method Article
זרימת עבודה מקיפה של פרוטאומיקת רובה ציד מבוססת ספקטרומטריה של דגימות רקמה
In This Article
Summary
הפרוטוקול המתואר מספק ניתוח פרוטאומי כמותי ממוטב של דגימות רקמה באמצעות שתי גישות: כמות מבוססת תווית וללא תווית. לגישות מבוססות תוויות יש יתרון של כמות מדויקת יותר של חלבונים, בעוד שגישה נטולת תוויות חסכונית יותר ומשמשת לניתוח מאות דגימות של קבוצה.
Abstract
ההתקדמות האחרונה בספקטרומטריית מסה הביאה לניתוח פרוטאומי עמוק יחד עם יצירת ערכות נתונים חזקות ושחזוריות. עם זאת, למרות ההתקדמות הטכנית ניכרת, הכנת מדגם מ biospecimens כגון דם המטופל, CSF, ורקמות עדיין מציב אתגרים ניכרים. לזיהוי סמנים ביולוגיים, פרוטאומיקה של רקמות מספקת לעתים קרובות מקור מדגם אטרקטיבי לתרגום ממצאי המחקר מהספסל למרפאה. זה יכול לחשוף סמנים ביולוגיים מועמד פוטנציאלי לאבחון מוקדם של סרטן ומחלות ניווניות כגון מחלת אלצהיימר, מחלת פרקינסון, וכו '. פרוטאומייקה של רקמות גם מניבה שפע של מידע מערכתי המבוסס על שפע החלבונים ומסייעת לענות על שאלות ביולוגיות מעניינות.
ניתן לקבץ ניתוח פרוטאומיה כמותית לשתי קטגוריות רחבות: גישה מבוססת תוויות וגישה נטולת תוויות. בגישה המבוססת על תוויות, חלבונים או פפטידים מסומנים באמצעות איזוטופים יציבים כגון SILAC (תיוג איזוטופ יציב עם חומצות אמינו בתרבות התאים) או על ידי תגים כימיים כגון ICAT (תגי זיקה מקודדים איזוטופ), TMT (תג מסה דו-מושבי) או iTRAQ (תג איזוברי לכמות יחסית ומוחלטת). גישות מבוססות תוויות יש את היתרון של כמות מדויקת יותר של חלבונים באמצעות תוויות איזובריות, דגימות מרובות ניתן לנתח בניסוי אחד. הגישה נטולת התוויות מספקת חלופה חסכונית לגישות מבוססות תוויות. ניתן לנתח ולהשוות מאות דגימות מטופלים השייכות לקבוצה מסוימת ולהשוותן לקבוצות אחרות המבוססות על תכונות קליניות. כאן, תיארנו זרימת עבודה פרוטאומית כמותית ממוטבת עבור דגימות רקמה באמצעות שיטות פרופיל פרוטאום ללא תוויות ומבוססות תוויות, החיוניות ליישומים במדעי החיים, במיוחד פרויקטים מבוססי גילוי סמנים ביולוגיים.
Introduction
טכנולוגיות פרוטאומיקס יש פוטנציאל לאפשר זיהוי וכימות של סמנים מועמד פוטנציאליים שיכולים לסייע באיתור וחיזוי של המחלה1. ההתקדמות האחרונה בתחום ספקטרומטריית המסה האיצה את המחקר הקליני ברמת החלבון. חוקרים מנסים להתמודד עם האתגר של פתוביולוגיה מסובכת של מספר מחלות באמצעות פרוטאומיקה מבוססת ספקטרומטריה המונית, אשר מציעה כעת רגישות מוגברת לזיהוי וכימות חלבונים2. מדידה כמותית מדויקת של חלבונים חיונית להבנת שיתוף הפעולה הדינמי והמרחבי בין חלבונים אצל אנשים בריאים וחולים3; עם זאת, ניתוח כזה בקנה מידה רחב פרוטאום אינו קל.
מגבלה מרכזית אחת של פרופיל פרוטאומי של דגימות קליניות היא המורכבות של דגימות ביולוגיות. סוגים רבים ושונים של דגימות נחקרו כדי לחקור את פרוטאום המחלה, כגון קווי תאים, פלזמה, ורקמות4,5. קווי תאים נמצאים בשימוש נרחב כמודלים בניסויי במבחנה כדי לחקות שלבים שונים של התקדמות המחלה. עם זאת, מגבלה מרכזית אחת עם קווי תאים היא שהם רוכשים בקלות שינויים גנוטיפיים ופנוטיפיים במהלך התהליך של תרבית התא6. נוזלי גוף כגון פלזמה יכולים להיות מקור אטרקטיבי לגילוי סמן ביולוגי; עם זאת, בשל חלבונים שופעים מאוד ואת הטווח הדינמי של ריכוז חלבון, פרוטאומיקה פלזמה הוא קצת יותר מאתגר7. כאן, פפטידים שמקורם בחלבונים הנפוצים ביותר יכולים לדכא את אלה שמקורם בחלבונים השופעים הנמוכים גם אם יחס המסה /מטען זהה ל-6. למרות שהיו התקדמות בטכנולוגיות דלדול ופירוק בשנים האחרונות, קבלת כיסוי טוב עדיין נותר מגבלה גדולה של פרוטאומיקספלזמה 8,9. השימוש ברקמות לחקירה פרוטאומית של ביולוגיה של המחלה עדיף שכן דגימות רקמה הן הקרובות ביותר לאתרי המחלה ומציעות מידע פיזיולוגי ופתולוגי גבוה כדי לספק תובנות טובות יותר על ביולוגיית המחלה10,11.
בכתב יד זה, סיפקנו פרוטוקול פשוט יותר עבור פרוטאומיקה כמותית של דגימות רקמה. השתמשנו במאגר המכיל 8 M אוריאה להכנת ליסאט רקמה כמו חוצץ זה תואם עם חקירות מבוססות ספקטרומטריית מסה. עם זאת, חובה לנקות את הפפטידים כדי להסיר מלחים לפני הזרקת אותם לתוך ספקטרומטר המסה. נקודה חשובה לזכור היא להפחית את ריכוז אוריאה לפחות מ 1 M לפני הוספת טריפסין לעיכול חלבון כמו טריפסין תערוכות פעילות נמוכה בריכוז 8 M אוריאה. הסברנו שתי גישות של פרוטאומיקה גלובלית כמותית: כימות מבוסס תווית באמצעות iTRAQ (תגים איזובריים לכימות יחסית ומוחלטת) וכימות ללא תוויות (LFQ). הפרוטאומיקה הכמותית המבוססת על iTRAQ משמשת בעיקר להשוואת דגימות מרובות המשתנות במצבן הביולוגי (למשל, נורמלי לעומת מחלה או דגימות מטופלות). הגישה משתמשת ריאגנטים איזובריים כדי לתייג את אמינים ראשיים N-terminal של פפטידים12. ריאגנטים iTRAQ מכילים קבוצת כתבים N-מתיל פיפראזין אחת, קבוצת מאזן, וקבוצת אסתר תמציתית N-הידרוקסית שמגיבה עם אמינים ראשוניים N-terminal של פפטידים13. פפטידים מעוכלים מכל תנאי מסומנים עם ריאגנט iTRAQ מסוים. לאחר התיוג, התגובה נעצרת ו מתויג פפטידים מתנאים שונים מחולקים לתוך צינור אחד. תערובת מדגם משולבת זו מנותחת על ידי ספקטרומטר מסה לזיהוי וכימות. לאחר ניתוח MS / MS, רסיסי יונים עיתונאיים עם מסות מולקולריות נמוכות נוצרים ועוצמות היונים של יונים עיתונאיים אלה משמשות לכימות החלבונים.
גישה נוספת, כימות ללא תוויות משמש כדי לקבוע את המספר היחסי של חלבונים בדגימות מורכבות מבלי לסמן פפטידים עם איזוטופים יציבים.
Protocol
מחקר זה נבדק ואושר על ידי ועדות בדיקה מוסדיות וועדת האתיקה של המכון ההודי לטכנולוגיה בומביי (IITB-IEC/2016/026). המטופלים/המשתתפים סיפקו את הסכמתם בכתב להשתתף במחקר זה.
1. הכנת ליסאט רקמות
הערה: בצע את כל השלבים הבאים על הקרח כדי לשמור על הפרוטאזים לא פעילים. ודא אזמלים וכל הצינורות המשמשים הם סטריליים כדי למנוע כל זיהום צולב.
- קח ~ 30 מ"ג של רקמה בצינור להכות חרוזים, להוסיף 200 μL של 1x תמיסת מלח חוצץ פוספט (PBS) מערבולת זה.
הערה: במחקר זה, רקמות גידול אנושי קפוא טרי נלקחו להכנת lysate. הפרוטוקול יכול לשמש עבור כל רקמה קפואה טרייה עם כמה שינויים בהתאם לסוג של רקמות (רקמות רכות או קשות) ומורכבות הסלולר של הרקמות. - לאחר מכן, לסובב את הצינור כדי ליישב את הרקמה ולהסיר בזהירות את PBS באמצעות pipette. בצע שטיפת PBS נוספת אם עדיין נותרו עקבות של דם ברקמה.
- הוסף 300 μL של חוצץ תמוגה אוריאה (8 M אוריאה, 50 mM טריס pH 8.0, 75 mM NaCl, 1 mM MgCl2) וקוקטייל מעכב פרוטאז (PIC) לפי פרוטוקול היצרן.
הערה: הנפח של מאגר תמה צריך להיות מספיק כדי לטחון את הרקמה במהלך תהליך sonication ולהשעות את מה שחולץ. חיץ תמה קטן מדי עלול לגרום תמה רקמות לא יעיל, בעוד חוצץ תמן יותר מדי ידלל את החלבון lysate. - מניחים את הצינור על קרח sonicate הרקמה ב משרעת של 40% במשך 2.5 דקות עם מחזורי דופק של 5 s (ON/OFF, בהתאמה).
- מוסיפים חרוזי זירקוניום לצינורות ומרגיזים את הרקמה באמצעות מקצף חרוזים במשך 90 s עם 5 דקות דגירה על קרח. חזור על שלב זה פעמיים.
- ברגע שהרקמה הומוגנית כראוי, לדגור על הצינור על קרח במשך 10 דקות.
- לאחר הדגירה, צנטריפוגה הדגימה ב 6,018 x g במשך 15 דקות ב 4 °C (70 °F) כדי להפריד את פסולת התא מן supernatant.
- לאסוף את supernatant בצינור שכותרתו טרי ולאחסן ב -80 °C כמו aliquots עד לשימוש נוסף.
2. כימות חלבונים ובדיקת איכות של ליסאטים של רקמות
- לכמת את ריכוז החלבון ברקמות lysate באמצעות ריאגנט של ברדפורד כמתואר בקובץ המשלים 1.
- לאחר כימות החלבון, הפעל 10 מיקרוגרם של ריסאט רקמות על ג'ל SDS-PAGE 12% כדי לבדוק את איכות lysate.
הערה: עיבוד במורד הזרם חייב להתבצע רק עבור lysates ניקוי בדיקות האיכות.
3. עיכול אנזימטי של חלבונים
הערה: השלבים לעיכול אנזימטי מוצגים באיור 1a.
- לעיכול, לקחת 50 מיקרוגרם של חלבונים ולהוסיף ddH2O כדי לפצות על הנפח ל 20 μL.
- עכשיו, להכין 20 mM טריס (2-carboxyethyl) פוספין (TCEP) מן המניה (0.5 M TCEP) על ידי הוספת 0.8 μL מהמלאי לחלבון ליסאט כדי להפחית את קשרים דיסולפידים בחלבונים ולדגום על המדגם ב 37 °C (60 דקות).
- הכן 40 mM iodoacetamide (IAA) ב ddH2O ולהוסיף 1.6 μL כדי alkylate שאריות ציסטאין מופחת. דגירה בחושך במשך 10 דקות בטמפרטורת החדר.
- הוסף מאגר דילול המכיל 25 mM Tris pH 8.0 ו 1 mM CaCl2 ביחס 1:8 כדי לדלל את ריכוז אוריאה לפחות מ 1 M במדגם. בשלב זה, לבדוק את ה- pH.
הערה: אם משתמשים טריפסין כאנזים עיכול, ודאו שריכוז האוריאה הוא פחות מ-1 מ'. - כדי לבצע עיכול, להוסיף טריפסין ביחס אנזים/מצע של 1:50. לדגור על הצינורות ב 37 °C (50 °F) באמבטיה יבשה רועדת במשך 16 שעות לעיכול לילה.
הערה: אנזים טריפסין הוא פרוטאז תגובתי מאוד נוטה לעיכול עצמי. קח טיפול נוסף ולבצע את התוספת של טריפסין במהירות מעל הקרח. - לאחר 16 שעות של דגירה, יבשו את הפפטידים המעוכלים ברכז ואקום.
4. התפלת פפטידים מעוכלים
הערה: כדי לבצע התפלה של פפטידים, השתמש בעצות שלב C18.
- הפעל את קצה שלב C18 על-ידי הוספת 50 μL של מתנול. צנטריפוגה הקצה ב 1,000 x g במשך 2 דקות ב RT. להשליך את הסינון שנאסף בתחתית הצינור. חזור פעמיים.
- הוסף 50 μL של acetonitrile ב 0.1% חומצה פורמית לשטוף את קצה הבמה. צנטריפוגה הצינור ב 1,000 x g במשך 2 דקות ב RT. להשליך את הסינון שנאסף בתחתית הצינור. חזור על שלב זה פעמיים.
- הוסף 50 μL של 0.1% (v/v) FA כדי לכלול את העמודה. שוב, לבצע את centrifugation ב 1,000 x g במשך 2 דקות ב RT ולהשליך את הסינון.
- ליישב מחדש את הפפטידים המיובשים ב 50 μL של 0.1% חומצה פורמית.
הערה: הימנע היווצרות בועת אוויר בתוך טיפים שלב בעת העברת המדגם. טיפים שלב לא צריך להיות מיובש לחלוטין במהלך שלב centrifugation, כמו ייבוש יכול להוביל לאובדן פפטיד. - מוסיפים את הפפטידים המחודשים לקצה הבמה המופעל ומעבירים את המדגם דרך קצה הבמה על ידי צנטריפוגה ב-1,000 x גרם למשך 2 דקות. חזור על שלב זה לפחות ארבע פעמים. לאחסן את הזרימה דרך ב 4 °C (5 °F).
- כדי לשטוף את המדגם, להוסיף 50 μL של 0.1% (v/v) חומצה פורמית. חזור על שלב צנטריפוגה ובטל את הסינון.
- עבור elution של פפטידים, להוסיף 50 μL של 40% (v/ v) ACN ב 0.1% חומצה פורמית (v/ v) ולהעביר אותו דרך קצה הבמה על ידי צנטריפוגה. לאסוף את הסינון בצינור טרי. חזור על השלב עם 50% ו 60% ACN ב 0.1% חומצה פורמית ולאסוף את הסינון באותו צינור טרי.
- יבשו את הפפטידים המותפלים שנאספו בצינור הטרי באמצעות רכז ואקום.
הערה: הפפטידים המותפלים היבשים מוכנים להזרקה, או שניתן לאחסן אותם ב -20 מעלות צלזיוס למשך 6 חודשים. לאחסון לטווח ארוך (>6 חודשים), יש לאחסן את הפפטידים ב-80 °C (80 °F).
5. כימות פפטידים מותפלים
- תרכיבו מחדש את הפפטידים המותפלים המיובשים ב-FA של 0.1%.
- נגב את לוח המדידה הפוטומטרי עם רקמה נטולת מוך באמצעות 70% אתנול.
- השתמש ב- 2 μL של 0.1% FA כדי להגדיר את הריק.
- הוסף 2 μL של דגימות מחדש על הלוח ב replicates.
- מניחים את הצלחת בספקטרופוטומטר ומודדים את הספיגה ב-205 ננומטר ו-280 ננומטר.
- חשב ספיגת טוחנת (ε) באמצעות הנוסחה הבאה:
ε = 27 / [1 - 3.85 * A280 / A205]
הערה: ספיגת טוחנת (ε) היא מדד להסתברות של המעבר האלקטרוני או עד כמה מין סופג את אורך הגל המסוים של קרינה כי הוא להיות אירוע על זה. הערך של ε צריך להיות בטווח של 31 מ"ל מ"ג-1ס"מ-1 עד 33 מ"ל מ"ג-1ס"מ-1. אם הערך אינו נופל בטווח, הדבר מציין שהדגימות אינן מתעכלות כראוי. - חשב את ריכוז הפפטיד ב- μg/μL באמצעות הנוסחה הבאה:
ריכוז פפטיד = נטו OD (205) / 0.051 * ε
6. כמות ללא תוויות (LFQ) של הפפטידים המעוכלים
הערה: עבור כמות ללא תוויות, השתמש בפרמטרים של LC ו- MS המוזכרים בקובץ המשלים 2. נתוני כיסוי גבוה הושגו כאשר שלושה שכפולים ביולוגיים מאותו סוג של המדגם פורסמו בספקטרומטר המסה.
- הגדרת כרומטוגרפיה נוזלית
- לאחר כימות פפטידים מותפלים, לקחת 2 מיקרוגרם של פפטידים בוויאליה ולהפיק את הנפח ל 10 μL באמצעות 0.1% FA. הריכוז של פפטידים מותפלים יהיה 200 ננוגרם / μL.
- פתח את הדגימה האוטומטית של מערכת הכרומטוגרפיה הנוזלית (ראה טבלה של חומרים) והנח את ה- vial בתוך הדגימה האוטומטית.
- השתמש ב- 0.1% (v/v) FA כדי לכלול את העמודה שלפני העמודה והאנליטית.
- קח 1 מיקרוגרם של פפטיד מעוכל מותפל מהחינתון וטען אותו על העמוד.
- הגדר את מעבר הצבע LC בהתאם למורכבות המדגם. בניסוי זה, שיפוע LC שימש במשך 120 דקות עבור כמות ללא תווית של דגימות הרקמה.
- הגדרת MS: לפני אופטימיזציה של כל בדיקות proteomics, לבצע בדיקת בקרת איכות של המכשיר על ידי ניטור כמה פפטידים של אלבומין סרום בקר (BSA) באמצעות כל תוכנה להתאמת המערכת וניתוח כיסוי של BSA (איור 2A,B). פרמטרי הרכישה הוגדרו במכשיר באמצעות תוכנת רכישת הנתונים של MS (ראה טבלת חומרים).
- פתח את התוכנה, לחץ פעמיים על הגדרת מכשיר ובחר את התבנית מתוך פפטידים-ID עם פרמטרי ברירת מחדל.
- הגדר את הפרמטרים של MS באמצעות קובץ משלים 2 ושמור אותו כשיטה חדשה.
- עכשיו, לפתוח את התוכנה כדי למלא את הפרטים לדוגמה; לחץ פעמיים על הגדרת הרצף, ומלא את הפרטים כגון סוג לדוגמה, שם לדוגמה, מיקום שמירת קובץ, קובץ שיטת מכשיר, עוצמת ההזרקה ומיקום המדגם.
- לאחר מילוי כל המידע, בחר את השורה והתחל את הפעל.
7. כמות מבוססת תווית (iTRAQ) של פפטידים מעוכלים
הערה: כימות מבוסס תווית יכול להתבצע באמצעות תוויות איזובריות שונות כגון iTRAQ או ריאגנטים TMT, וכו '. כאן, iTRAQ 4-plex שימש לתיוג של פפטידים מעוכלים משלוש דגימות רקמה. ההליך של תיוג iTRAQ 4-plex מוזכר להלן.
- תיוג של פפטידים מעוכלים באמצעות ריאגנטים iTRAQ.
הערה: בניסוי זה, פפטידים משלוש דגימות רקמה משמשים. מכל דגימת רקמה, 80 מיקרוגרם של פפטידים מעוכלים נלקחים בארבעה צינורות לתיוג עם ריאגנטים iTRAQ (114, 115, 116, ו 117) (ראה קובץ משלים 3 עבור הפרמטרים הניסיוניים המפורטים).- לפני השימוש ריאגנט iTRAQ, להביא כל מקטורינה של ריאגנט לטמפרטורת החדר (כ 5 דקות). תן ספין קצר של כ 30 s להביא את הפתרון בתחתית כל חתול.
הערה: ודא כי בכל ממתקין, פתרון 10-15 μL צריך להיות נוכח. - לתיוג iTRAQ, יש תגדירו מחדש את הפפטידים היבשים ב-20 מיקרו-אל של מאגר פירוק המסופק בערכת התוויות של iTRAQ.
- ליישב מחדש את התוויות על ידי הוספת 70 μL של אתנול מן המשחקון המסופק בערכה ולערבב את הפתרון עבור 30 s ולסובב אותו עבור 10 s.
הערה: מומלץ כי כל השלבים להתבצע בהתאם להוראות היצרן. - הוסף את תוויות iTRAQ המעורבות באופן הומוגני (114, 115, 116 ו- 117) לצינורות המתאימים שלהם המכילים דגימות פפטיד ולאפשר את תגובת התיוג להתרחש.
- מערבבים את הרכיבים של כל צינור על ידי מערבולת הצינור במשך 30 s, ולאחר מכן לסובב את הצינור במשך 10 s כדי להחזיר את התערובת לתחתית הצינור.
הערה: בדוק את ה- pH של הפתרון באמצעות נייר pH. pH צריך להיות גדול מ 8; אם לא, הוסף עד 10 μL של מאגר הפירוק כדי להתאים את ה- pH. - לדגור על כל צינור בטמפרטורת החדר במשך 90 דקות. בסוף התגובה, להרוות כל תווית לא מאוגדת עודף בצינור על ידי הוספת מים כיתה MS.
- לדגור על הצינורות בטמפרטורת החדר במשך 30 דקות עד 1 שעה.
- לאחר שהדגירה נגמרת, מעבירים את כל התוכן המסומן לצינור אחד ומייבשים את הפפטידים המסומנים ברכז ואקום.
הערה: ניתן לעקוב אחר הליך תיוג דומה עבור תיוג TMT.
- לפני השימוש ריאגנט iTRAQ, להביא כל מקטורינה של ריאגנט לטמפרטורת החדר (כ 5 דקות). תן ספין קצר של כ 30 s להביא את הפתרון בתחתית כל חתול.
- הגדרת כרומטוגרפיה נוזלית
- ליישב מחדש את הדגימות 0.1% חומצה פורמית, לפתוח את הדגימה האוטומטית של ננו LC, ולהניח את הדגימות בתוך דגימת אוטומטית. השתמש בפרמטרים המוזכרים בקובץ המשלים 2 עבור הגדרת LC.
- הגדר את מעבר הצבע LC בהתאם למורכבות המדגם. שיפוע LC של 180 דקות שימש בניסוי זה עבור כמות מבוססת תווית (iTRAQ) של דגימות הרקמה.
הערה: עבור דוגמאות פחות מורכבות, שיפוע קצר יכול להפריד ביעילות את רוב הפפטידים. עם זאת, אם המדגם מורכב מאוד, השתמש בשיפוע ארוך יותר להפרדה טובה יותר של פפטידים.
- הגדרת MS עבור טכניקת iTRAQ
- הגדר את כל הפרמטרים של MS עבור כמות מבוססת תווית באותו אופן המשמש עבור הכמות נטולת התוויות למעט אנרגיית ההתנגשות, שהוגדרה ל- 35% עבור פיצול MS/MS בכמות המבוססת על תווית.
8. ניתוח נתונים
- נתח את הקבצים הגולמיים (ספקטרום MS/MS) שהתקבלו בספקטרומטר מסת LC באמצעות תוכנת ניתוח זמינה מסחרית (ראה טבלת חומרים).
הערה: מסד הנתונים של פרוטאום הייחוס האנושי של Uniprot (UP000005640) הכולל 71,785 רצפי חלבונים שימש להשגת זהויות חלבון באמצעות מנועי החיפוש Sequest HT וקמע (v2.6.0). הפרמטרים עבור כמות ללא תוויות וכמות מבוססת תווית מתוארים בקובץ המשלים 4.
תוצאות
השתמשנו בשתי גישות שונות לגילוי פרוטאומיקס: גישות פרוטאומיות ללא תוויות ומבוססות תוויות. פרופיל החלבון של דגימות רקמות ב-SDS-PAGE הראה את החלבונים השלמים וניתן לשקול אותו לניתוח פרוטאומי(איור 2A). בדיקת בקרת האיכות של המכשיר הייתה מנוטרת באמצעות תוכנת התאמת מערכת והיא הראתה את השונות היומיומית בביצועי המכשירים (איור 2B). ראינו כיסוי רצף של 91% של מדגם BSA ב 30 דקות של שיפוע LC(איור 2C). שיפוע ה-LC עבר אופטימיזציה באמצעות 500 ננוגרם של תקציר תאי HeLa מסחריים וצפינו ב-2425 חלבונים בשיפוע של 2 שעות בהשוואה ל-1488 חלבונים בשיפוע של שעה אחד(איור 2D). הצלחנו לזהות בממוצע 2428 חלבונים בכל שלושת השכפולים הטכניים של דגימת רקמת בריכה(איור 2E).
הפרמטרים הממוטבים של LC ו-MS הוחלו על שלוש דגימות רקמות ביולוגיות שונות (איור 3 וקובץ משלים 2). הכרומטוגרמה הראתה יכולת רבייה טובה בין שלוש דגימות רקמות ביולוגיות שונות. זיהינו 2725, 2748 ו-2718 חלבונים הניתנים לכימות מדגימות רקמה 1, 2 ו-3, בהתאמה, באמצעות גישה מבוססת ללא תוויות. ראינו כי 151 חלבונים היו נפוצים בניסויי LFQ הראשון והשני, 163 חלבונים חולקו בין ניסויי LFQ השני והשלישי, ו-187 חלבונים חולקו בין הניסוי הראשון והשלישי, בעוד ש-2190 חלבונים היו נפוצים בכל שלוש דגימות הרקמות(איור 4A).
בדקנו את הכרומטוגרמה ובדקנו את תוויות iTRAQ ומצאנו שהיא קיימת כמעט בכל ספקטרום הטרשתות MS / MS. שלושת הסטים כבר לרוץ לניסוי iTRAQ. מספר החלבונים שהתקבלו מכל קבוצה היה 2455, 2285 ו-2307, בהתאמה. 287 חלבונים נמצאו נפוצים בדגימה 1 ודגימה 2, 183 חלבונים היו נפוצים בדגימה 2 ודגימה 3, ו-195 חלבונים היו נפוצים בדגימה 1 ובדגימה 3. המספר הכולל של חלבונים הנפוצים בכל שלוש הדגימות היה 1557 (איור 4B).
השווינו בין התאמות ספקטרליות פפטידיות כוללות (PSMs), קבוצות פפטיד, סך חלבונים, קבוצות חלבונים ומספר החלבונים שהושגו לאחר 1% FDR מניסוי LFQ ו- iTRAQ (איור 4C).

איור 1: זרימת עבודה עבור פרוטאומיקת רקמות. (A) שלבי עיבוד המדגם להכנת דגימות מרקמות ליסאט לניתוח MS. (B)שלבים לכמות ללא תוויות. (C)שלבים עבור כמות מבוססת תוויות. (D)שלבים לניתוח נתונים באמצעות מגלה פרוטאום. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: בקרת בדיקת איכות של דגימות רקמות ושחזור של המכשיר. (A)בדיקת איכות של רקמות מתמוססת על 12% SDS-PAGE (B)ניטור של כמה פפטידים של BSA באמצעות פנורמה כדי לבדוק את השתנות המכשירים בימים השונים. (C)כיסוי הרצף של BSA בשלושה העתקים טכניים. (D)אופטימיזציה של פרמטרי LC עבור דגימות רקמה. (ה) מספר הגפרורים הספקטרליים הפפטידים, הפפטידים והחלבונים בשלוש דגימות ביולוגיות שונות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 3: פרמטרים של LC ו- MS לניתוח פרוטאומיקה של דגימת רקמות. (A,B)שיפוע הכרומטוגרפיה הנוזלית המשמש להפרדת הפפטידים לכמות ללא תוויות (A) וכמות מבוססת תווית (B) של דגימת הרקמה. (C)הפרמטרים של MS עבור כמות ללא תוויות וכמות מבוססת תוויות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
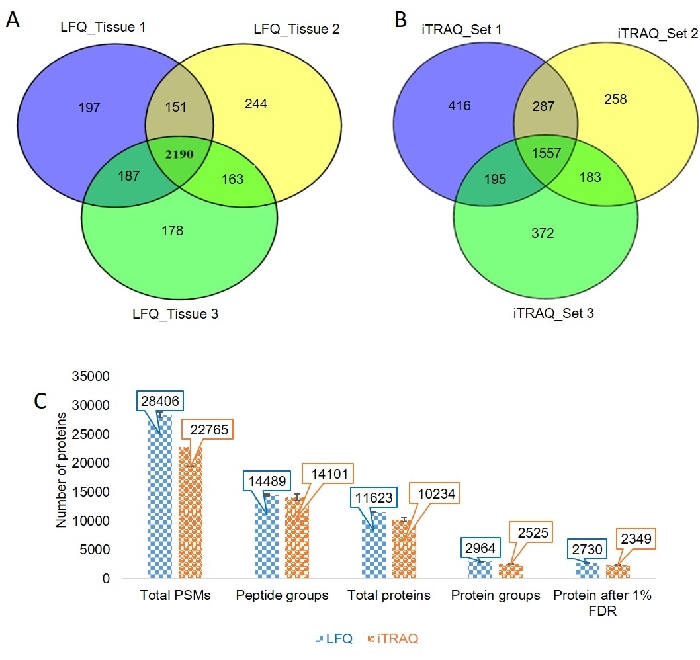
איור 4: כמות נטולת תוויות ומבוססת תוויות של דגימת רקמות. (A)דיאגרמת Venn מייצגת את החלבונים הנפוצים והבלעדיים בדגימות רקמות 1, 2 ו- 3 של הניסוי ללא תוויות. (B)דיאגרמת ון מייצגת את החלבונים הנפוצים והבלעדיים בדגימות רקמות 1, 2 ו- 3 של הניסוי מבוסס התווית. (C)הניתוח ההשוואתי של מספר הגפרורים הספקטרליים פפטיד (PSMs), קבוצות פפטיד, סך חלבונים, קבוצות חלבון, ומספר חלבון לאחר 1% FDR בכמות ללא תוויות (LFQ) וניסוי מבוסס תווית (iTRAQ). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
קבצים משלימים. נא לחץ כאן כדי להוריד קובץ זה.
Discussion
פרוטאומייקה של רקמות של דגימות ביולוגיות מאפשרת לנו לחקור סמנים ביולוגיים פוטנציאליים חדשים הקשורים לשלבים שונים של התקדמות המחלה. זה גם מסביר את מנגנון האיתות והמסלולים הקשורים להתקדמות המחלה. הפרוטוקול המתואר לניתוח פרוטאומי כמותי של רקמות מספק נתוני כיסוי טובים לשחזור. רוב השלבים הותאמו מהוראות היצרן. על מנת לקבל נתונים באיכות גבוהה, השלבים הבאים הם קריטיים ביותר. לפיכך, יש לתת טיפול נוסף בעת ביצוע צעדים אלה.
עיכול חלקי של חלבונים וזיהום של קרטין עשוי לספק פחות כיסוי של חלבונים (n < 1000), ובכך להשפיע על הניסוי הכולל. ה-pH של דגימות (pH 8) וריכוז אוריאה בדגימות (פחות מ-1 מ') יבטיחו עיכול יעיל של חלבונים. השימוש במאגר טרי וטיפול בדגימות בזהירות יפחיתו את הסיכויים לזיהום קרטין. ריאגנטים iTRAQ הם יקרים מאוד וזה דורש פלטפורמת MS מתוחכמת כדי לבצע את MS / MS ותוכנה כדי לנתח את הנתונים. ניסויי הפרוטאומיקה רגישים לזיהום ממלחים, כימות פפטיד ויעילות תיוג של ריאגנטים iTRAQ /TMT. לפני ניתוח MS/MS, ודא שפפטידים מתעכלים מותפלים כראוי כדי להפחית את רעשי הרקע בנתונים. במקרה של טכניקת iTRAQ, פיצול התג המצורף יוצר יון כתב מסת מולקולרית נמוכה שניתן להשתמש בו כדי לכמת יחסית את הפפטידים והחלבונים שמהם הם נוצרו, ואילו לגישה ללא תוויות, האזור שמתחת לעקומה נחשב לכמות. כדי להגביר את הביטחון בכמות החלבונים, ניסויי אימות עצמאיים במיוחד, MRM / PRM צריך להתבצע.
ניתוח של דגימות רקמה באמצעות שתי שיטות כמות (פרוטאומיה ללא תווית ומבוססת תווית) תואר כדי לקבל כיסוי טוב של חלבונים. גישת הפרוטאומיקה הכמותית נטולת התווית מציעה מספר יתרונות לשימוש בה במחקרים קליניים. הדגימות מנוהלות באופן עצמאי, וזה חשוב במיוחד עבור מחקרים המתבצעים עבור קבוצת המטופלים שכן יש מספר רב של דגימות שיש לנתח באמצעות ספקטרומטר מסה. באמצעות שכפול טכני כגון מאגר של פפטידים ממוטבים, ניתן להבטיח שחזור טוב גם אם הדגימות מופעלות בנקודות זמן שונות. גישה זו שימשה במחקרים גדולים כגון CPTAC, שהוא מאמץ של קהילות בינלאומיות רבות14.
היעדים הפוטנציאליים העולים מהמחקר יכולים להיחשב לאימות באמצעות גישות פרוטאומיות ממוקדות. אנו מסיקים כי הפרויקטים המבוססים על ניתוח דגימות רקמות יכולים להיות מופקים במידה רבה מזרימות העבודה המפורטות של פרוטאומיקה כמותית המסופקת במחקר זה. השלבים שהוזכרו יסייעו לייעל את השיטה ולמפות את הפרוטאום של דגימות רקמות. הבחירה בטכניקות פרוטאומיות כמותיות עשויה להיות תלויה במספר הדגימות, בזמינות של פלטפורמות MS ובשאלה הביולוגית שיש לטפל בה.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מכירים בפרויקט MHRD-UAY (UCHHATAR AVISHKAR YOJANA), פרויקט #34_IITB למתקן SS ו- MASSFIITB ב- IIT בומביי הנתמך על ידי המחלקה לביוטכנולוגיה (BT / PR13114/ INF / 22/206/2015) לביצוע כל הניסויים הקשורים ל- MS.
Materials
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Acetonitrile (MS grade) | Fisher Scientific | A/0620/21 | |
| Bovine Serum Albumin | HiMedia | TC194-25G | |
| Calcium chloride | Fischer Scienific | BP510-500 | |
| Formic acid (MS grade) | Fisher Scientific | 147930250 | |
| Iodoacetamide | Sigma | 1149-25G | |
| Isopropanol (MS grade) | Fisher Scientific | Q13827 | |
| Magnesium Chloride | Fischer Scienific | BP214-500 | |
| Methanol (MS grade) | Fisher Scientific | A456-4 | |
| MS grade water | Pierce | 51140 | |
| Phosphate Buffer Saline | HiMedia | TL1006-500ML | |
| Protease inhibitor cocktail | Roche Diagnostics | 11873580001 | |
| Sodium Chloride | Merck | DF6D661300 | |
| TCEP | Sigma | 646547 | |
| Tris Base | Merck | 648310 | |
| Trypsin (MS grade) | Pierce | 90058 | |
| Bradford Reagent | Bio-Rad | 5000205 | |
| Urea | Merck | MB1D691237 | |
| Supplies | |||
| Hypersil Gold C18 column | Thermo | 25002-102130 | |
| Micropipettes | Gilson | F167380 | |
| Stage tips | MilliPore | ZTC18M008 | |
| Zirconia/Silica beads | BioSpec products | 11079110z | |
| Equipment | |||
| Bead beater (Homogeniser) | Bertin Minilys | P000673-MLYS0-A | |
| Microplate reader (spectrophotometer) | Thermo | MultiSkan Go | |
| pH meter | Eutech | CyberScan pH 510 | |
| Probe Sonicator | Sonics Materials, Inc | VCX 130 | |
| Shaking Drybath | Thermo | 88880028 | |
| Orbitrap Fusion mass spectrometer | Thermo | FSN 10452 | |
| Nano LC | Thermo | EASY-nLC1200 | |
| Vacuum concentrator | Thermo | Savant ISS 110 | |
| Software | |||
| Proteome Discoverer | Thrermo | Proteome Discoverer 2.2.0.388 |
References
- Petricoin, E., Wulfkuhle, J., Espina, V., Liotta, L. A. Clinical proteomics: revolutionizing disease detection and patient tailoring therapy. Journal of Proteome Research. 3 (2), 209-217 (2004).
- Geho, D. H., Petricoin, E. F., Liotta, L. A. Blasting into the microworld of tissue proteomics: a new window on cancer. Clinical Cancer Research: An Official Journal of the American Association for Cancer Research. 10 (3), 825-827 (2004).
- Hashimoto, Y., Greco, T. M., Cristea, I. M. Contribution of mass spectrometry-based proteomics to discoveries in developmental biology. Advances in Experimental Medicine and Biology. 1140, 143-154 (2019).
- Faria, S. S., et al. A timely shift from shotgun to targeted proteomics and how it can be groundbreaking for cancer research. Frontiers in Oncology. 7, 13 (2017).
- Ray, S., et al. Proteomic technologies for the identification of disease biomarkers in serum: advances and challenges ahead. Proteomics. 11 (11), 2139-2161 (2011).
- Chen, E. I., Yates, J. R. Cancer proteomics by quantitative shotgun proteomics. Molecular Oncology. 1 (2), 144-159 (2007).
- Geyer, P. E., Holdt, L. M., Teupser, D., Mann, M. Revisiting biomarker discovery by plasma proteomics. Molecular Systems Biology. 13 (9), 942 (2017).
- Ray, S., et al. Proteomic analysis of Plasmodium falciparum induced alterations in humans from different endemic regions of India to decipher malaria pathogenesis and identify surrogate markers of severity. Journal of Proteomics. 127, 103-113 (2015).
- Ray, S., et al. Clinicopathological analysis and multipronged quantitative proteomics reveal oxidative stress and cytoskeletal proteins as possible markers for severe vivax malaria. Scientific Reports. 6, 24557 (2016).
- Sharma, S., et al. Multipronged quantitative proteomic analyses indicate modulation of various signal transduction pathways in human meningiomas. Proteomics. 15 (2-3), 394-407 (2015).
- Sharma, S., Ray, S., Moiyadi, A., Sridhar, E., Srivastava, S. Quantitative proteomic analysis of meningiomas for the identification of surrogate protein markers. Scientific Reports. 4, 7140 (2014).
- Aslam, B., Basit, M., Nisar, M. A., Khurshid, M., Rasool, M. H. Proteomics: Technologies and their applications. Journal of Chromatographic Science. 55 (2), 182-196 (2017).
- Wiese, S., Reidegeld, K. A., Meyer, H. E., Warscheid, B. Protein labeling by iTRAQ: A new tool for quantitative mass spectrometry in proteome research. Proteomics. 7 (3), 340-350 (2007).
- Rudnick, P. A., et al. A description of the Clinical Proteomic Tumor Analysis Consortium (CPTAC) common data analysis pipeline. Journal of Proteome Research. 15 (3), 1023-1032 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved