Method Article
組織サンプルの質量分析ベースのショットガンプロテオミクスの包括的ワークフロー
要約
記載されたプロトコルは、ラベルベースとラベルフリー定量の2つのアプローチを用いて、組織サンプルの最適化された定量プロテオミクス分析を提供します。ラベルベースのアプローチは、より正確なタンパク質定量の利点を有する一方で、ラベルフリーアプローチはより費用対効果が高く、コホートの何百ものサンプルを分析するために使用されます。
要約
質量分析の最近の進歩は、堅牢で再現可能なデータセットの生成と共に深いプロテオミクス分析をもたらしました。しかし、かなりの技術的進歩にもかかわらず、患者の血液、CSF、および組織などの生体検体からのサンプル調製は依然としてかなりの課題を抱えています。バイオマーカーを同定するために、組織プロテオミクスはしばしば、研究結果をベンチから診療所に翻訳する魅力的なサンプル源を提供する。これは、アルツハイマー病、パーキンソン病などの癌や神経変性疾患の早期診断のための潜在的な候補バイオマーカーを明らかにすることができます。組織プロテオミクスはまた、タンパク質の豊富に基づいて全身情報の富を生成し、興味深い生物学的な質問に対処するのに役立ちます。
定量的プロテオミクス解析は、ラベルベースとラベルフリーアプローチの2つの大きなカテゴリに分類できます。標識ベースのアプローチでは、タンパク質またはペプチドは、SILAC(細胞培養中のアミノ酸による安定同位体標識)、ICAT(同位体コード化アフィニティータグ)、TMT(タンデム質量タグ)またはiTRAQ(相対および絶対定量のための同位体タグ)などの安定同位体を使用して標識されます。標識ベースのアプローチは、タンパク質をより正確に定量できるという利点を有し、またアイソバリックラベルを用いて、複数のサンプルを1回の実験で分析することができる。ラベルフリーのアプローチは、ラベルベースのアプローチに代わるコスト効率の高い方法です。特定のコホートに属する数百の患者サンプルを分析し、臨床特徴に基づいて他のコホートと比較することができる。ここでは、ライフサイエンス、特にバイオマーカー発見ベースのプロジェクトでの応用に不可欠な、ラベルフリーおよびラベルベースのプロテオームプロファイリング法を用いた組織サンプルの最適化された定量プロテオミクスワークフローについて説明しました。
概要
プロテオミクス技術は、疾患1の検出および予後に役立つ候補マーカーの同定と定量を可能にする可能性を有する。質量分析の分野における最近の進歩は、タンパク質レベルでの臨床研究を加速しています。研究者たちは、質量分析法ベースのプロテオミクスを用いて、いくつかの疾患の複雑な病態生物学の課題に取り組もうとしており、現在はタンパク質同定と定量化に対する感度の向上を提供している。タンパク質の正確な定量的測定は、健康な個人と病気の個人のタンパク質間の動的および空間的な協調を理解するために重要である3;しかし、このようなプロテオーム規模の分析は容易ではありません。
臨床検体のプロテオミクスプロファイリングの大きな制限の1つは、生物学的サンプルの複雑さである。多くの異なる種類のサンプルが、細胞株、血漿、および組織4、5などのプロテオームの疾患を研究するために調査されてきた。細胞株は、疾患進行の異なる段階を模倣するインビトロ実験のモデルとして広く使用されています。しかしながら、細胞株の1つの大きな制限は、細胞培養6の過程で遺伝子と平解な変化を容易に獲得する点である。プラズマなどの体液は、バイオマーカー発見の魅力的な源となる可能性があります。しかし、タンパク質の豊富さとダイナミックレンジのタンパク質濃度により、血漿プロテオミクスは少し難しい7.ここで、最も豊富なタンパク質から生まれたペプチドは、質量/電荷比が同じ6であっても、低い豊富なタンパク質由来のものを抑制することができる。ここ数年で枯渇と分画技術の進歩がありましたが、良好なカバレッジを得ることは、依然としてプラズマプロテオミクス8、9の大きな限界です。疾患生物学のプロテオーム学的調査のための組織の使用は、組織サンプルが疾患部位に最も近く、疾患生物学10,11に対するより良い洞察を提供するために高い生理学的および病理学的情報を提供するので好ましい。
本稿では、組織試料の定量的プロテオミクスの簡易プロトコルを提供しました。このバッファーは質量分析法に基づく調査と互換性があるため、8 M 尿素を含むバッファーを組織のライセート調製に使用しました。しかし、質量分析計に注入する前に、塩を除去するためにペプチドをきれいにすることが必須です。覚えておかねない重要なポイントの1つは、トリプシンが8M尿素濃度で低い活性を示すため、タンパク質消化のためのトリプシンを添加する前に尿素濃度を1M未満に減らすことです。定量的なグローバルプロテオミクスの2つのアプローチ:iTRAQ(相対および絶対定量のためのアイソバリックタグ)とラベルフリー定量(LFQ)を用いたラベルベースの定量法について説明しました。iTRAQベースの定量プロテオミクスは、主に生物学的状態(例えば、正常と疾患または治療されたサンプル)で変化する複数のサンプルを比較するために使用されます。このアプローチは、ペプチド12のN末端一次アミンを標識する等圧試薬を利用する。iTRAQ試薬は、1つのN-メチルピペラジンレポーターグループ、バランサ基、およびペプチド13のN末端一次アミンと反応する1つのN-ヒドロキシスクッチイミドエステル基を含む。各条件から消化されたペプチドは、特定のiTRAQ試薬で標識される。標識に続いて、反応を停止し、異なる条件からの標識ペプチドを単一のチューブにプールする。この組み合わせサンプル混合物は、同定と定量のために質量分析計によって分析される。MS/MS分析後、低分子質量のレポーターイオン断片が生成され、これらのレポーターイオンのイオン強度がタンパク質の定量化に使用されます。
別のアプローチとして、標識フリー定量法を用いて、安定同位体を有するペプチドを標識することなく、複合体サンプル中のタンパク質の相対数を決定する。
プロトコル
この研究は、インド工科大学ボンベイ校(IITB-IEC/2016/026)の機関審査委員会と倫理委員会によって審査され、承認されました。患者/参加者は、この研究に参加するために書面による同意を提供しました。
1. 組織のライセートの準備
注:氷の上で以下の手順をすべて実行して、プロテアーゼを非アクティブに保ちます。メスと使用されるチューブが無菌であることを確認して、クロスコンタミネーションを避けてください。
- ビーズの鼓動チューブに~30mgの組織を取り、200μLの1xリン酸緩衝液生理塩分(PBS)と渦を加えます。
注:この研究では、新鮮な凍結したヒト脳腫瘍組織を、ライセート調製のために採取した。プロトコルは、組織の種類(軟部または硬い組織)および組織の細胞の複雑さに応じていくつかの変化を伴う任意の新鮮な凍結組織に使用することができる。 - その後、チューブを回転して組織を沈め、ピペットを使用してPBSを慎重に除去します。組織に残っている血液の痕跡がまだある場合は、別のPBS洗浄を行います.
- メーカーのプロトコルに従って、300 μLの尿素分解バッファー(8 M尿素、50 mM Tris pH 8.0、75 mM NaCl、1 mM MgCl2)およびプロテアーゼ阻害剤カクテル(PIC)を加えます。
注:リシスバッファーの体積は、超音波処理プロセス中に組織を粉砕し、抽出されたものを中断するのに十分でなければなりません。あまりにも少ないリシスバッファーは非効率的な組織のリシスを生じ得、あまりにも多くのリシスバッファーは、タンパク質のリゼートを希釈します。 - チューブを氷の上に置き、5 sのパルスサイクル(それぞれON/OFF)で2.5分間40%の振幅で組織を超音波処理します。
- チューブにジルコニウムビーズを加え、氷の上に5分間インキュベーションして90 sのビーズビーターを使用して組織を均質化します。この手順を 2 回繰り返します。
- 組織が適切に均質化されたら、チューブを氷の上で10分間インキュベートします。
- インキュベーション後、サンプルを4°Cで15分間6,018 x g で遠心分離し、上清から細胞デブリを分離します。
- 新鮮なラベル付きチューブに上清を収集し、さらに使用するまでアリコートとして-80°Cで保存します。
2. タンパク質定量と組織ライセートの品質チェック
- 補足ファイル1に記載されているようにブラッドフォードの試薬を使用して、組織ライセート中のタンパク質濃度を定量化する。
- タンパク質定量に続いて、12%SDS-PAGEゲルで10μgの組織ライセートを実行し、ライセートの品質を確認します。
注: さらに下流処理は、ライセートが品質チェックをクリアする場合にのみ実行する必要があります。
3. タンパク質の酵素消化
注: 酵素消化の手順を 図 1aに示します。
- 消化のために、50 μgのタンパク質を取り、ddH2Oを加え、容積を20 μLにします。
- 次に、ストックから20 mM Tris(2-carboxyethyl)ホスフィン(TCEP)を調製し、ストックから0.8μLをタンパク質のリセートに加えてタンパク質中のジスルフィド結合を減少させ、サンプルを37°Cで60分間インキュベートします。
- 40 mM のヨウドアセトアミド (IAA) を ddH2O で調製し、1.6 μL を加えて、減少したシステイン残基をアルキル化します。暗闇の中で室温で10分間インキュベートします。
- 25 mM Tris pH 8.0 および 1 mM CaCl2 を含む希釈バッファーを 1:8 の比率で加え、尿素濃度をサンプル中の 1 M 未満に希釈します。この時点で、pH を確認します。
注:消化酵素としてトリプシンを使用する場合は、尿素の濃度が1M未満であることを確認してください。 - 消化を行うために、1:50の酵素/基質比でトリプシンを加えます。一晩消化のために16時間揺れるドライバスで37°Cでチューブをインキュベートします。
注意:トリプシン酵素は自己消化しやすい反応性の高いプロテアーゼです。余分な注意を払い、氷の上にトリプシンの追加を迅速に実行します。 - 16時間のインキュベーションの後、消化されたペプチドを真空濃縮器で乾燥させます。
4. 消化ペプチドの脱塩
注:ペプチドの脱塩を実行するには、C18ステージのヒントを使用してください。
- 50 μLのメタノールを加えて、C18ステージ先端をアクティブにします。先端を1,000 x g で2分間RTで遠心する。2 回繰り返します。
- 50 μLのアセトニトリルを0.1%のギ酸に加えて、ステージ先端を洗浄します。チューブを1,000 x g で2分間RTで遠心分離します。この手順を 2 回繰り返します。
- 50 μL の 0.1% (v/v) FA を追加して、カラムを平衡化します。再度、RTで2分間1,000 x g で遠心を行い、濾液を捨てます。
- 乾燥した消化したペプチドを0.1%のギ酸の50 μLで再構成する。
注:サンプルを渡している間、ステージの先端の内部に気泡の形成を避けてください。段階の先端は、乾燥がペプチドの損失につながる可能性がありますので、遠心段階の間に完全に乾燥させるべきではありません。 - 活性化ステージ先端に再構成されたペプチドを加え、2分間1,000 x g で遠心分離してサンプルをステージ先端に通します。この手順を少なくとも 4 回繰り返します。フロースルーは4°Cで保存してください。
- サンプルを洗浄するには、50 μLの 0.1%(v/v)のギ酸を加えます。遠心分離のステップを繰り返し、濾液を捨てます。
- ペプチドの溶出のために、0.1%のギ酸(v/v)の40%(v/v)ACNの50 μLを加え、遠心分離によって段階の先端を通過する。新鮮なチューブに濾液を収集します。50%および60%のACNを0.1%のギク酸で繰り返し、同じ新鮮なチューブに濾液を集める。
- 真空濃縮器を使用して、新鮮なチューブに集めた脱塩ペプチドを乾燥させます。
注:乾燥した脱塩ペプチドを注入する準備ができているか、6ヶ月間-20°Cで保存することができます。長期保存(>6ヶ月)の場合は、-80°Cで保存してください。
5. 脱塩ペプチドの定量化
- 乾燥した脱塩ペプチドを0.1%FAに再構成する。
- 70%エタノールを使用して、リントフリー組織でフォトメトリック測定プレートを拭きます。
- 0.1%FAの2 μLを使用してブランクを設定します。
- 2 μLの再構成サンプルを複製でプレートに追加します。
- 分光光度計にプレートを置き、205 nmおよび280 nmで吸光度を測定します。
- 次の式を使用して、モルの吸収率 (ε) を計算します。
ε = 27 / [1 - 3.85 * A280 / A205]
注:モル吸着率(ε)は、電子転移の確率、または種が入射している特定の波長の放射線をどれだけ吸収するかを測定するものです。εの値は、31 mL mg-1cm-1 ~ 33 mL mg-1cm-1の範囲内にする必要があります。値が範囲内に収まらない場合は、サンプルが適切に消化されないことを示します。 - 次の式を使用して、μg/μLでペプチド濃度を計算します。
ペプチドの濃度 = 純OD (205) / 0.051 * ε
6. 消化ペプチドの無ラベル定量(LFQ)
注: ラベルなしの数量には、 補足ファイル 2に記載されている LC パラメータと MS パラメータを使用します。質量分析計で同じタイプのサンプルの3つの生物学的複製を実行したときに、高いカバレッジデータが得られました。
- 液体クロマトグラフィーのセットアップ
- 脱塩ペプチドを定量した後、バイアル内の2μgのペプチドを取り、0.1%FAを使用して体積を10 μLにします。脱塩ペプチドの濃度は200 ng/μLになります。
- 液体クロマトグラフィーシステムのオートサンプラーを開き( 材料表を参照)、バイアルをオートサンプラーの内部に置きます。
- 0.1%(v/v)FAを使用して、事前列と分析列を平衡化します。
- バイアルから脱塩した消化ペプチドを1μg取り出し、カラムにロードします。
- サンプルの複雑さに応じて、LC の勾配を設定します。本実験では、LC勾配を組織試料のラベルフリー定量に120分間使用した。
- MSセットアップ:プロテオミクスアッセイを最適化する前に、システム適合性のためのソフトウェアを使用してウシ血清アルブミン(BSA)のいくつかのペプチドを監視し、BSAのカバレッジを分析することによって、機器の品質管理チェックを行います(図2A、B)。取得パラメータは MS データ取得ソフトウェアを使用して計測器に設定されました (資料一覧を参照)。
- ソフトウェアを開き、 インスツルメントを ダブルクリックし、デフォルトパラメータを持つペプチドIDからテンプレートを選択します。
- 補足ファイル 2を使用して MS パラメータを設定し、新しい方法として保存します。
- 次に、サンプルの詳細を記入するソフトウェアを開きます。 [シーケンスセットアップ] をダブルクリックし、サンプルタイプ、サンプル名、ファイル保存場所、計測器方法ファイル、注入量、サンプル位置などの詳細を入力します。
- すべての情報が入力されたら、行を選択して 、実行を開始します。
7. 消化ペプチドの標識ベース定量(iTRAQ)
メモ:ラベルベースの定量は、iTRAQやTMT試薬などの異なるアイソバリックラベルを使用して行うことができます。ここで、iTRAQ 4-plexは、3つの組織サンプルからの消化されたペプチドの標識化に使用した。iTRAQ 4-plex ラベル付けの手順は、以下に挙げます。
- iTRAQ試薬を用いた消化ペプチドの標識化
注:この実験では、3つの組織サンプルからのペプチドが使用されています。各組織サンプルから、80 μgの消化ペプチドを4つのチューブに取り込み、iTRAQ試薬(114、115、116、および117)で標識します(詳細な実験パラメータについては 補足ファイル3 を参照)。- iTRAQ試薬を使用する前に、試薬の各バイアルを室温(約5分)にしてください。各バイアルの底部に溶液を持って来るために約30 sの短いスピンを与えます。
注:各バイアルに10~15μLの溶液が存在することを確認してください。 - iTRAQ標識の場合、iTRAQ標識キットに用意されている溶解バッファーの20 μLで乾燥したペプチドを再構成します。
- キットに付属のバイアルから70μLのエタノールを加えてラベルを再構成し、30 sの溶液を混合し、10秒回転させます。
注:すべての手順は、製造元の指示に従って実行することをお勧めします。 - 均質に混合されたiTRAQラベル(114、115、116、および117)をペプチドサンプルを含むそれぞれのチューブに加え、標識反応を起こさせます。
- 30 sのチューブをボルテックスして各チューブの成分を混合し、チューブを10 s回転してチューブの底に戻します。
注:pHペーパーを使用して溶液のpHを確認してください。pH は 8 より大きくする必要があります。ない場合は、pHを調整するために溶解バッファーの10 μLまで追加します。 - 各チューブを室温で90分間インキュベートします。反応の最後に、MSグレードの水を加えることによってチューブ内の余分な非結合標識をクエンチする。
- 室温で30分から1時間インキュベートします。
- インキュベーションが終わったら、標識された内容物をすべて1本のチューブに移し、真空濃縮器で標識ペプチドを乾燥させます。
メモ:同様のラベル付け手順に従って、TMTラベル付けすることができます。
- iTRAQ試薬を使用する前に、試薬の各バイアルを室温(約5分)にしてください。各バイアルの底部に溶液を持って来るために約30 sの短いスピンを与えます。
- 液体クロマトグラフィーのセットアップ
- サンプルを0.1%のギ酸で再構成し、ナノLCのオートサンプラーを開き、オートサンプラーの内部に置きます。LC セットアップの 補足ファイル 2 に記載されているパラメータを使用します。
- サンプルの複雑さに応じて、LC の勾配を設定します。この実験では、180 minのLC勾配を組織試料のラベルベース定量(iTRAQ)に使用した。
注: 複雑性の低いサンプルでは、短い勾配でほとんどのペプチドを効率的に分離できます。しかし、サンプルが非常に複雑な場合は、ペプチドのより良い分離のために長い勾配を使用してください。
- ITRAQ テクニックの MS セットアップ
- ラベルベースの定量で MS/MS フラグメンテーションの 35% に設定された衝突エネルギーを除き、ラベルなしの定量に使用されるのと同じ方法でラベルベースの定量のすべての MS パラメータを設定します。
8. データ分析
- LC質量分析装置から得られた生の(MS/MSスペクトル)ファイルを、市販の解析ソフトウェアを使用して解析します( 材料表を参照)。
注:71,785個のタンパク質配列を含むユニプロト(UP000005640)のヒト参照プロテオームデータベースを使用して、セクエストHTとマスコット(v2.6.0)検索エンジンを使用してタンパク質同一性を取得しました。ラベルなしの数量とラベルベースの定量のパラメータについては、 補足ファイル 4を参照してください。
結果
私たちは、発見プロテオミクスには、ラベルフリーとラベルベースのプロテオミクスアプローチの2つの異なるアプローチを使用してきました。SDS-PAGE上の組織サンプルのタンパク質プロファイルは、インタクトなタンパク質を示し、プロテオミクス分析のために考慮することができた(図2A)。装置の品質管理チェックは、システム適合性ソフトウェアを介して監視され、機器性能の日単位の変動を示した(図2B)。BSAサンプルの91%の配列カバレッジをLC勾配の30分で観察した(図2C)。LC勾配は、500ngの市販HeLa細胞消化を用いて最適化され、1時間の勾配で1488タンパク質と比較して2hの勾配で2425タンパク質を観察した(図2D)。プール組織サンプルの3つの技術的複製すべてで平均2428個のタンパク質を同定することができました(図2E)。
最適化されたLCおよびMSパラメータを、3つの異なる生体組織サンプルに適用した(図3および補足ファイル2)。クロマトグラムは、3つの異なる生体組織サンプル間で良好な再現性を示した。我々は、ラベルフリーベースのアプローチを使用して、組織サンプル1、2、および3からそれぞれ2725、2748、および2718定量可能なタンパク質を同定した。我々は、第1および第2のLFQ実験において151個のタンパク質が共通であり、163個のタンパク質が第1および第3の実験の間で共有され、187個のタンパク質が第1および第3の実験の間で共有され、2190タンパク質は3つの組織サンプルすべてにおいて共通である(図4A)。
クロマトグラムを検査し、iTRAQラベルを確認し、ほぼすべてのMS/MSスペクトルに存在することを発見しました。3つのセットは、iTRAQ実験のために実行されています。各セットから得られたタンパク質数はそれぞれ2455、2285、2307であった。サンプル1およびサンプル2では287個のタンパク質が一般的であることが判明し、183個のタンパク質はサンプル2およびサンプル3で共通であり、195タンパク質はサンプル1およびサンプル3で共通であった。3つのサンプルすべてで共通するタンパク質の総数は1557であった(図4B)。
ペプチドスペクトルマッチ(PSM)、ペプチド基、総タンパク質、タンパク質基、およびLFQおよびiTRAQ実験から1%FDR後に得られたタンパク質の数を比較した(図4C)。

図1:組織プロテオミクスのワークフロー( A)サンプル処理手順は、MS分析のために組織のライセートからサンプルを調製する。(B) ラベルなしの数量のステップ。(C) ラベルベースの数量のステップ。(D) プロテオーム発見者を用いたデータ解析のステップ この図の大きなバージョンを表示するには、ここをクリックしてください。

図2:組織サンプルの品質管理と器具の再現性(A)12%SDS-PAGEの組織溶解物の品質チェック(B)パノラマを使用したBSAの一部のペプチドのモニタリングは、異なる日にわたる機器の変動性をチェックする。(C) BSA のシーケンスカバレッジを 3 つの技術的な複製で表す。(D) 組織サンプルのLCパラメータの最適化(E) 3つの異なる生物学的試料におけるペプチドスペクトルマッチ、ペプチド、タンパク質の数。この図の大きなバージョンを表示するには、ここをクリックしてください。

図3:組織試料のプロテオミクス分析のためのLCおよびMSパラメータ( A,B)組織サンプルのラベルフリー定量(A)およびラベルベース定量(B)のためにペプチドを分離するために使用される液体クロマトグラフィー勾配。(C) ラベルなしの数量とラベルベースの定量の MS パラメータ。 この図の大きなバージョンを表示するには、ここをクリックしてください。
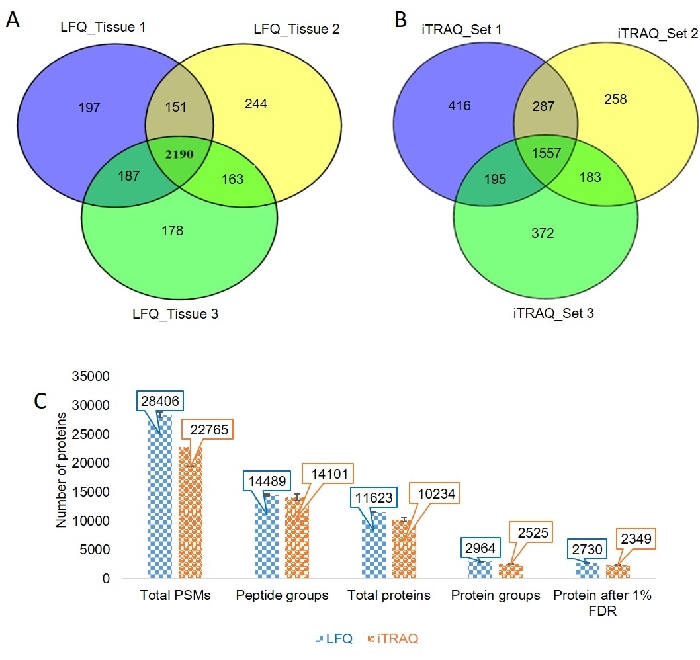
図4:ラベルフリーおよびラベルベースの組織サンプルの定量化(A)ベン図は、ラベルフリー実験の組織サンプル1、2、および3における共通および排他的タンパク質を表す。(B)ベン図は、標識ベースの実験の組織サンプル1、2、および3における共通および排他的なタンパク質を表す。(C)ペプチドスペクトルマッチ(PSM)、ペプチド基、総タンパク質、タンパク質基、および1%FDR後のタンパク質数の比較分析を、標識フリー定量(LFQ)および標識ベース実験(iTRAQ)に含む。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
生物学的サンプルの組織プロテオミクスは、疾患進行の異なる段階に関連する新しい潜在的なバイオマーカーを探求することを可能にする。また、疾患の進行に関連するシグナル伝達および経路のメカニズムについても説明する。組織定量プロテオミクス分析用に記述されたプロトコルは、再現可能な良好なカバレッジデータを提供する。ほとんどの手順は、製造元の指示に従って調整されています。高品質のデータを取得するには、次の手順が最も重要です。したがって、これらの手順を実行する間は、特別な注意が必要です。
タンパク質の不完全な消化およびケラチンの汚染は、タンパク質の被覆率(n<1000)を少なくし、それによって実験全体に影響を与える可能性があります。サンプルのpH(pH8)およびサンプル中の尿素の濃度(1M未満)は、タンパク質の効率的な消化を保証します。新鮮なバッファーの使用と注意してサンプルの取り扱いはケラチン汚染の可能性を減らします。iTRAQ試薬は非常にコストがかかり、MS/MSおよびソフトウェアを実行してデータを分析するには、高度なMSプラットフォームが必要です。プロテオミクス実験は、iTRAQ/TMT試薬の塩からの汚染、ペプチド定量、および標識効率に敏感です。MS/MS分析の前に、消化されたペプチドが適切に脱塩され、データ内のバックグラウンドノイズを低減するようにしてください。iTRAQ技術の場合、付着タグの断片化は、ペプチドおよびそれらが由来するタンパク質を相対的に定量するために使用できる低分子質量レポーターイオンを生成し、一方、ラベルフリーアプローチでは、曲線下の領域を定量化することが考えられる。タンパク質の定量に対する信頼度を高めるために、特にMRM/PRMの独立検証実験を行う必要があります。
2つの定量法(ラベルフリーおよびラベルベースプロテオミクス)を用いた組織サンプルの分析は、タンパク質の良好な被覆率を得るために記載されている。ラベルフリー定量プロテオミクスアプローチは、臨床研究での使用にはいくつかの利点を提供します。サンプルは独立して実行され、質量分析計 を介して 分析されるサンプルが多数あるため、患者コホートのために行われる研究には特に重要です。最適化されたペプチドのプールなどの技術的な複製を使用して、サンプルが異なる時点で実行される場合でも、良好な再現性を保証することができます。このアプローチは、CPTACのような大規模なコホート研究で使用されています, これは、多くの国際社会の努力である14.
研究から生まれた潜在的な標的は、標的プロテオミクスアプローチを用いた検証のために考慮することができる。我々は、組織サンプル分析に基づくプロジェクトは、本研究で提供される定量的プロテオミクスの詳細なワークフローから大きな恩恵を受けることができると結論付ける。上記のステップは、方法を最適化し、組織サンプルのプロテオームをマッピングするのに役立ちます。定量的プロテオミクス技術の選択は、サンプルの数、MSプラットフォームの可用性、および対処する生物学的問題に依存する可能性があります。
開示事項
著者らは開示するものは何もない。
謝辞
我々は、MHRD-UAYプロジェクト(UCHHATAR AVISHKAR YOJANA)、バイオテクノロジー省(BT/PR13114/INF/22/2015)が支援するIITボンベイのSSおよびMASSFIITB施設へのプロジェクト#34_IITBを認め、MS関連の実験をすべて実施します。
資料
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Acetonitrile (MS grade) | Fisher Scientific | A/0620/21 | |
| Bovine Serum Albumin | HiMedia | TC194-25G | |
| Calcium chloride | Fischer Scienific | BP510-500 | |
| Formic acid (MS grade) | Fisher Scientific | 147930250 | |
| Iodoacetamide | Sigma | 1149-25G | |
| Isopropanol (MS grade) | Fisher Scientific | Q13827 | |
| Magnesium Chloride | Fischer Scienific | BP214-500 | |
| Methanol (MS grade) | Fisher Scientific | A456-4 | |
| MS grade water | Pierce | 51140 | |
| Phosphate Buffer Saline | HiMedia | TL1006-500ML | |
| Protease inhibitor cocktail | Roche Diagnostics | 11873580001 | |
| Sodium Chloride | Merck | DF6D661300 | |
| TCEP | Sigma | 646547 | |
| Tris Base | Merck | 648310 | |
| Trypsin (MS grade) | Pierce | 90058 | |
| Bradford Reagent | Bio-Rad | 5000205 | |
| Urea | Merck | MB1D691237 | |
| Supplies | |||
| Hypersil Gold C18 column | Thermo | 25002-102130 | |
| Micropipettes | Gilson | F167380 | |
| Stage tips | MilliPore | ZTC18M008 | |
| Zirconia/Silica beads | BioSpec products | 11079110z | |
| Equipment | |||
| Bead beater (Homogeniser) | Bertin Minilys | P000673-MLYS0-A | |
| Microplate reader (spectrophotometer) | Thermo | MultiSkan Go | |
| pH meter | Eutech | CyberScan pH 510 | |
| Probe Sonicator | Sonics Materials, Inc | VCX 130 | |
| Shaking Drybath | Thermo | 88880028 | |
| Orbitrap Fusion mass spectrometer | Thermo | FSN 10452 | |
| Nano LC | Thermo | EASY-nLC1200 | |
| Vacuum concentrator | Thermo | Savant ISS 110 | |
| Software | |||
| Proteome Discoverer | Thrermo | Proteome Discoverer 2.2.0.388 |
参考文献
- Petricoin, E., Wulfkuhle, J., Espina, V., Liotta, L. A. Clinical proteomics: revolutionizing disease detection and patient tailoring therapy. Journal of Proteome Research. 3 (2), 209-217 (2004).
- Geho, D. H., Petricoin, E. F., Liotta, L. A. Blasting into the microworld of tissue proteomics: a new window on cancer. Clinical Cancer Research: An Official Journal of the American Association for Cancer Research. 10 (3), 825-827 (2004).
- Hashimoto, Y., Greco, T. M., Cristea, I. M. Contribution of mass spectrometry-based proteomics to discoveries in developmental biology. Advances in Experimental Medicine and Biology. 1140, 143-154 (2019).
- Faria, S. S., et al. A timely shift from shotgun to targeted proteomics and how it can be groundbreaking for cancer research. Frontiers in Oncology. 7, 13 (2017).
- Ray, S., et al. Proteomic technologies for the identification of disease biomarkers in serum: advances and challenges ahead. Proteomics. 11 (11), 2139-2161 (2011).
- Chen, E. I., Yates, J. R. Cancer proteomics by quantitative shotgun proteomics. Molecular Oncology. 1 (2), 144-159 (2007).
- Geyer, P. E., Holdt, L. M., Teupser, D., Mann, M. Revisiting biomarker discovery by plasma proteomics. Molecular Systems Biology. 13 (9), 942 (2017).
- Ray, S., et al. Proteomic analysis of Plasmodium falciparum induced alterations in humans from different endemic regions of India to decipher malaria pathogenesis and identify surrogate markers of severity. Journal of Proteomics. 127, 103-113 (2015).
- Ray, S., et al. Clinicopathological analysis and multipronged quantitative proteomics reveal oxidative stress and cytoskeletal proteins as possible markers for severe vivax malaria. Scientific Reports. 6, 24557 (2016).
- Sharma, S., et al. Multipronged quantitative proteomic analyses indicate modulation of various signal transduction pathways in human meningiomas. Proteomics. 15 (2-3), 394-407 (2015).
- Sharma, S., Ray, S., Moiyadi, A., Sridhar, E., Srivastava, S. Quantitative proteomic analysis of meningiomas for the identification of surrogate protein markers. Scientific Reports. 4, 7140 (2014).
- Aslam, B., Basit, M., Nisar, M. A., Khurshid, M., Rasool, M. H. Proteomics: Technologies and their applications. Journal of Chromatographic Science. 55 (2), 182-196 (2017).
- Wiese, S., Reidegeld, K. A., Meyer, H. E., Warscheid, B. Protein labeling by iTRAQ: A new tool for quantitative mass spectrometry in proteome research. Proteomics. 7 (3), 340-350 (2007).
- Rudnick, P. A., et al. A description of the Clinical Proteomic Tumor Analysis Consortium (CPTAC) common data analysis pipeline. Journal of Proteome Research. 15 (3), 1023-1032 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved