Method Article
3 차원 선 동적인 인간 조직 Gingiva 등가물
요약
프로토콜의 목적은 염증 인간의 gingiva 모델 시험관을 구축 하는 것입니다. 이 조직 모델 공동 세 가지 유형의 인간 세포, HaCaT keratinocytes, gingival fibroblasts 및 THP 1 대 식 세포, 3 차원 조건 하에서 양성. 치은 염 및 치 주 염 등 치 주 질환을 조사 하는 것이 모델을 적용할 수 있습니다.
초록
치 주 질환 (치은 염 등 치 주 염)는 성인에서 치아 손실의 주요 원인. Gingiva에 염증 치 주 질환의 근본적인 physiopathology입니다. 치 주 질환의 현재 실험 모델 동물의 다양 한 종류에 설립 되었습니다. 그러나, 동물 모델의 physiopathology는 인간의 세포 및 분자 메커니즘을 분석 하 고 치 주 질환에 대 한 새로운 의약품을 평가 하기가 어렵습니다 다릅니다. 여기, 우리 인간의 염증 성 조직 등가물 gingiva (iGTE) 체 외에서의 재구성에 대 한 자세한 프로토콜 제시. 우리는 먼저 인간의 gingival 섬유 아 세포 (HGF) 등 3 차원 조건 하에서 인간의 피부 상피 keratinocytes (HaCaT), 인간 세포의 두 종류를 이용 하 여 gingiva (GTE)의 인간의 조직에 해당 빌드. 우리는 GTE에 구멍을 펀치 조직 주먹을 사용 하 여 상처 모델을 만듭니다. 다음, 인간의 THP 1 monocytes 콜라겐 젤과 혼합는 GTE에 구멍에 주입 됩니다. 10 ng/mL phorbol myristate 12 13-아세테이트 (PMA) 72 h에 대 한 adimistration에 의해 THP-1 셀 GTE (iGTE)에서 양식 염증 foci 하 대 식 세포로 분화 (IGTE 또한 일 수 있다 stumilated lipopolysaccharides (LPS)의 2 µ g/mL와 염증을 시작 하 48 h에 대 한 ). IGTE 3 차원 구조와 인간 세포를 사용 하 여 염증 gingiva의 첫 번째 시험관에 모델입니다. IGTE 치 주 질환에 주요 학적 변화 (immunocytes activition, fibryoblasts, 상피 세포, monocytes 그리고 대 식 세포 중에서 세포 상호 작용)을 반영 한다. 치 주 질환에 대 한 상처 치유 공부를 다양 한 도구, 조직 재생, 염증, 세포 세포 상호 작용, 및 화면 잠재적인 약으로 GTE, 부상된 GTE, 및 iGTE을 사용할 수 있습니다.
서문
치 주 질환 성인에서 치아 손실의 주요 원인입니다. 치은 염 및 치 주 염 가장 일반적인 치 주 질병이 있습니다. 둘 다 gingiva에 biofilm 중재 급성 또는 만성 염증 성 변화를 제시. 치은 염 치 주 염이 만성 염증으로 일반적으로 선물 하는 반면 급성 염증, 특징 이다. 조직학 수준에 세균성 구성 요소는 대 식 세포, 림프 톨, 플라스마 세포, 돛대 세포1,2등 면역 세포의 활성화를 트리거합니다. 이러한 면역 세포 특히 대 식 세포, 지방 세포 (gingival 상피 세포, 섬유 아 세포, 내 피 세포, 및 osteoblasts 포함)와 상호 작용 결과로 치 주 조직3,4에 염증 성 병 변. 치 주 질환의 실험 모델 동물, 쥐, 등의 다양 한 종류에서 설립 되어 햄스터, 토끼, 흰 족제비, 개, 그리고 대주교. 그러나, 동물 모델의 physiopathology는 인간의 세포 및 분자 메커니즘을 분석 하 고 치 주 질환5의 새로운 의약품을 평가 하기가 어렵습니다 다릅니다. 치 주 박테리아와 단층 인간 구강 상피 세포의 공동 경작은 치 주 감염6의 메커니즘을 조사 하기 위해 사용 되었습니다. 그럼에도 불구 하 고, 구강 세포의 단층 문화 부족 그대로 조직;의 3 차원 (3D) 셀룰러 아키텍처 따라서, 그들은 체 외에 상황을 모방 수 없습니다.
여기, 3D 염증 인간의 조직 등가물 gingiva (iGTE)의 생체 외에서치 주 질환을 대표 설정 됩니다. 치 주 질환의이 3D 모델 단층 세포 배양 및 동물 모델 사이의 중간 위치를 차지 하고있다. 세 가지 유형의 HaCaT keratinocytes, gingival fibroblasts 및 THP-1 세포를 포함 하 여 인간 셀 공동 콜라겐 젤에 재배 있으며 iGTE 구축 염증 초기자에 의해 자극. IGTE는 밀접 하 게 세포 분화, 세포 세포 상호 작용 및 gingiva에 대 식 세포 활성화의 비보에 조건을 시뮬레이션합니다. 이 모델은 마약 검사 및 치 주 질환, 새로운 약리학 접근을 테스트 뿐만 아니라 상처 치유, 염증, 및 조직 재생에 세포질이 고 분자 메커니즘 분석을 위한 많은 가능한 응용.
프로토콜
이 프로토콜은 인간의 gingival 조직 등가물, gingival 상처 모델 및 치은 염 모델을 만들 하도록 설계 되었습니다. 인간의 피부 상피 keratinocytes (HaCaT) 교수 노 버트 E. Fusenig 독일 Krebsforschungszentrum (하이 델 베르크, 독일)7의에서 친절 하 게 제공 되었다. 인간의 gingival 섬유 아 세포 (HGFs)8이전 게시 된 프로토콜 따라 gingival 조직에서 분리 했다. 미리 동의 얻어와 연구 윤리 위원회는 일본 치과 대학 학교 생활 치과의 도쿄에서 설정한 지침에 따라 승인 (승인 번호: NDU-T2012-35). 1-3 단계 프로토콜 셀 문화 후드에서 수행 되어야 합니다.
1. 3D 인체 조직 등가물 Gingiva (GTE) (그림 1A)의 준비
- 10% 혼합 콜라겐 타입-A의 젤 집중 MEM-알파와 10% 재건 버퍼 (2.2 g NaHCO3 및 4.47 g HEPES 100 ml 0.05 N NaOH) pipetting으로 15 mL 무 균 튜브에. 사용 될 때까지 얼음에 혼합된 콜라겐 솔루션을 유지.
- 24 잘 문화 삽입 (기 공 크기 3.0 µ m) 24-잘 접시에 놓습니다.
-
0.25% trypsin EDTA 용액을 사용 하 여 문화 표면에서 HGFs를 제거 합니다. 10 ml 문화 매체 A의 세포를 중단 (MEM-알파 + 20 %FBS + 1 %GlutaMAX). Bürker-터크 셀 카운터로 셀을 계산.
- 셀 (1-5 x105 셀/mL), 원하는 수량을 추출 후 4 분 190 x g에서 원심.
- 혼합된 콜라겐 솔루션에 셀을 일시 중단 합니다. 다음 단계까지 얼음에 혼합물을 유지.
- 모든 거품을 생산 하지 않고 문화 삽입으로 셀 콜라겐 혼합 (0.5-2.5 x 105 셀/잘) 0.5 mL를 추가 합니다. 젤에 혼합물을 응고를 37 ° C에서 5% CO2 습도 분위기에서 10-30 분을 위한 혼합물을 품 어.
참고:의 문화 삽입 되지 않도록 불평등 콜라겐 젤을 중심으로 콜라겐 혼합물을 추가 합니다. - 잘 삽입으로 0.5 mL으로 문화 매체의 1 mL를 추가 합니다. 24 h에 대 한 문화 접시를 품 어 또는 37 ° c.에 5% CO2 습도 분위기에서 하룻밤
- 0.25% trypsin EDTA 용액을 사용 하 여 문화 표면에서 HaCaT 세포를 제거 합니다. 10 ml 매체 B의 셀을 일시 중단 (DMEM + 10 %FBS + 1 %GlutaMAX) 셀을 카운트. 추출 셀 (1-5 x5 셀/10ml) 피 펫, 190 x g.에서 4 분에 대 한 원심 분리기의 필요한 수량 중단 중간 b 세포
- 열망 하 여 HGF 콜라겐 혼합물을 포함 하는 문화 삽입에서 매체를 제거 합니다. HGF 콜라겐 혼합 상단 HaCaT 세포 현 탁 액 (0.5-2.5 x 105 셀/잘) 0.5 mL를 추가 합니다. 24 시간 또는 하룻밤에 대 한 문화를 품 어.
참고:이 시간이 시점에서 문화에 매체 잘 해야 중간 A 문화 삽입에 중간 중간 B. 해야 하는 동안 - KSR 매체 (공동 문화 매체)와 문화 매체를 대체 (메모리 알파 + 15% 녹아웃 혈 청 교체 + 1 %GlutaMAX) + 5 %FBS. 잘 하 고 문화 삽입으로 0.5 mL 문화에 문화 매체의 1 mL를 추가 합니다. 24-48 h에 대 한 문화를 품 어.
- KSR 매체 + 1% 문화 매체를 대체 FBS. 잘 문화에 1 mL 및 문화 삽입으로 0.5 mL를 추가 합니다. 24 시간 또는 하룻밤에 대 한 문화를 품 어.
- 문화에서 문화 매체 0.7-1 잘 바꿉니다 mL KSR 매체. (문화 표면 공기에 노출 한다) 문화 삽입에서 매체를 완전히 제거 합니다. 1-2 주에 대 한 문화를 품 어. 일주일에 2 번 잘 문화에서 매체를 변경 합니다.
참고: (상위 레이어 구성 keratinocytes) 문화 표면 위의 중간 수준 상승을 못하게 합니다. 항상 문화 표면 건조 유지.
2. 부상된 GTE (그림 1B)의 준비
- 1-3 m m 직경 조직 주먹을 준비 합니다. 20 분 동안 121 ° C에 압력솥으로 소독.
- 밀어 조직 주먹 수직 GTE 300 µ m 깊이 대 한 그리고 상처를 시뮬레이션 하기 위해 조직에 구멍을 펀치.
- 이 단계에서 부상된 GTE를 사용 하 여 상처 치유 및 조직 재생을 조사. 또는, GTE 조직학 분석을 수행 하기 위해 10% 포 르 말린 중립 버퍼 솔루션을 사용 하 여 수정 합니다.
3. 염증 GTE (iGTE) (그림 1B)의 준비
- 이전 보고서9에 따르면 THP-1 세포 배양.
- 10% 혼합 콜라겐 타입-A의 젤 집중 RPMI 1640, 10% 재건 버퍼 (2.2 g NaHCO3 및 4.47 g HEPES 100 ml 0.05 N NaOH)과 10 ng/mL PMA. 사용까지 얼음에 혼합된 콜라겐 솔루션을 유지.
- 수 1-2 x 106 THP-1 세포와 190 x g.에서 4 분 동안 원심 분리기 혼합된 콜라겐 솔루션의 1 mL에 셀을 일시 중단 합니다. 다음 단계까지 얼음에 혼합물을 유지.
- GTE의 부상된 지역으로 10-30 µ L THP-1-콜라겐 혼합물을 추가 합니다. 0.7-1 문화 매체를 대체 PMA의 10 ng/mL를 포함 하는 mL KSR 매체.
- 5% CO2 72 h에 대 한 37 ° C에서 습도 분위기에서 혼합물을 품 어.
- 치은 염 이나 치 주 질환 조사에 대 한 모델을 사용 하 여 (예를 들어 추가 잠재적인 항 염증 제 약 cytokine 릴리스10에 그것의 효과 볼 수 iGTE). 또는, 72 h PMA 처리를 생략 2 µ g/mL LPS의 문화에 추가 하 고 조직 5% CO2 48 h11,1237 ° C에서 습도 분위기에서 품 어.
4. 고정 및 전체 마운트 Immunostaining GTE와 iGTE의 문화
-
문화는 고정
- 24-잘 접시에서 문화 매체를 제거 합니다. 워시 버퍼 인산 염 (PBS)와 2 회 조직.
- 문화를 잘 10% 포 르 말린 중립 버퍼 솔루션 삽입 하 고 1 mL의 1 mL를 추가 합니다. 하룻밤 냉장고에서 4 ° C에 24-잘 접시를 남겨 주세요.
- 다음 날 10% 포 르 말린 중립 버퍼 솔루션을 제거 합니다.
- 전체 산 immunostaining에 대 한 고정 후 PBS로 3-4 회 조직을 씻어.
- 되며 오신 (H & E) 얼룩 및 일반 immunostaining, 탈수, 파라핀 포함, 및 단면 진행.
참고: 전체 산 immunostaining에 대 한이 단계를 생략할 수 있습니다.
-
전체 마운트 immunostaining
참고:이 프로토콜 참조 13에서에서 수정 되었습니다.- 3 조직 세척 PBS 0.5-1에서에서 x % 트리톤, 10-30 분 각 시간.
- 블로킹 버퍼에서 30 분 동안 두 번 조직을 품 어 (PBS 1% 트라이 톤 + 10 %BSA), 실내 온도에.
- 블로킹 버퍼, 5-10 분 때마다 조직 2 ×를 씻어.
- 삽입에 필요한 희석/농도에서 1 차적인 항 체 솔루션의 50 µ L를 추가 합니다. 얇은 플라스틱 집착 영화를 사용 하 여 조직에 밖으로 건조 하지 않도록 하려면 삽입 하.
- 4 ° c.에 1 ~ 2 일에 대 한 조직을 품 어
- 씻어 조직 3 번, PBS에서 30 분 1% 트라이 톤 + 10 %BSA. 씻어 PBS에서 5 분, 3 번 다시 1% 트라이 톤.
- 블로킹 버퍼에 이차 항 체의 50 µ L를 추가 (PBS 1% 트라이 톤 + 10 %BSA) 및 각 삽입을 Hoechst 33342 솔루션 (NucBlue 라이브 셀 얼룩)의 5 µ L. 얇은 플라스틱 집착 영화를 사용 하 여 조직에 밖으로 건조 하지 않도록 하려면 삽입 하.
- 4 ° c.에 1 ~ 2 일 동안 품 어 젖은 종이 타월에 24-잘 접시를 포장 하 고 보육 전반에 걸쳐 사용을 비닐 팩에 넣어.
- PBS 1% 트라이 톤에서 10 분 조직 3 번 씻어
- 날카로운 바늘을 사용 하 여 얻을 조직 문화 삽입의 막 잘라. 장소는 슬라이드에 막입니다.
참고: 조직 막에 있어야 한다. - 형광 마운트 매체의 2-3 방울을 추가 합니다. 커버 글라스와 어둠 속에서 4 ° C에서 저장 조직 분석까지 커버.
- Confocal 레이저 스캐닝 현미경 (LSM) 조직 보기
결과
HaCaT 세포 단계 대조 현미경 관찰 (그림 2A)에서 전형적인 keratinocyte 형태 표시. 전자 현미경 (SEM) 이미지 스캐너 HaCaT 세포 표면 많은 microvilli에 의해 덮여 있었다 보였다. HaCaT 세포 사이의 세포 연결 막 프로세스 (그림 2B)에 의해 중재 했다. HaCaT 세포 gingival 상피 마커 K8/1814, HaCaT 세포 적합 gingiva 재건 (그림 2C) 나타내는 표현.
그림 3A GTE의 성공적인 예를 보여 줍니다 그리고 그림 3B GTE의 실패 한 예를 보여 줍니다. 실패 한 재판 (그림 3B)는 문화 삽입의 센터에 추가 되지 콜라겐 젤 혼합물에 의해 발생 합니다. 그림 3C GTE의 상처 모델 조직 주먹으로 조직에 있는 구멍을 펀칭으로 만들 수 있습니다 보였다. H & E 염색 (그림 3D)와 SEM 이미지 (그림 3E) 시연 하는 경작의 19 일, HaCaT 세포 형태 상피, 그리고 콜라겐 젤 포함 HGF 셀 양식 lamina propria의 약 10-20 층. 재건축된 GTE의 lamina propria에 HGF 세포는 섬유 아 세포 (그림 3 층)의 특징적인 형태를 전시 하 고 콜라겐 섬유 (그림 3)의 잘 정의 된 배열에 의해 포위 되었다. 면역 형광 염색 vimentin 및 테-7 (그들 모두 피부 섬유 마커15) (그림 4A 및 4B) GTE의 lamina propria에 표현 됩니다 보여. K19, 특정 마커 염16, 접합 및 포켓 상피를 약하게 표현 (그림 4C), GTE의 상피 이며 iGTE (그림 4D)의 상피에 강력 하 게 표현 된다. 데이터의 lamina propria 염증 성 자극 후 특히 HaCaT 세포 염에 키 상피 세포로 분화 할 수 있다 제안 했다.
치은 염 등 치 주 염, 염증 성 gingival 질환, 림프 톨 및 대 식 세포의 존재에 의해 특징 조직학에서는 고 섬유 증 및 조직 괴 사17,18. 이 프로토콜에서 THP-1 세포는 iGTE에 대 한 염증 세포로 사용 되었다. 그림 5, PMA 자극 없이 THP-1 셀 제시 monocytic 형태 (그림 5A) 매체에 뜬 그들의 대부분. 대조적으로, 72 h에 대 한 PMA 10 ng/mL에 노출 되 고, 후 THP-1 세포의 50% 이상 대 식 세포와 같은 세포로 분화 하 고 문화 표면 (그림 5B)에 준수. HGF와 HaCaT 세포8와 마찬가지로, THP-1 셀 콜라겐 젤 (KSR 매체), 공동 문화 매체에 안으로 잘 성장 하 고 PMA-치료 (그림 5C) 후 대 식 세포와 같은 세포로 분화. Immunostaining 준수 THP-1 셀 CD68 표현 했다 (대 식 세포19의 표식) (그림 5D)와 CD14 (대 식 세포의 다른 마커) (그림 6). IGTE를, THP 1 monocytes 콜라겐 젤에 포함 되었고 상처 (그림 5E)를 시뮬레이션 하는 구멍에 주입. PMA 후 72 h (10 ng/mL)-자극, THP-1 셀 상처를 시뮬레이션 및 표현 CD68 구멍 안에 세포 (그림 5 층)으로 분화 (그림 5G), 부상된 GTE에서 양식 염증 foci 수 있습니다 나타내는.
전체 산 immunohistochemistry (그림 6) 보였다 THP-1 셀 뿐만 아니라 상처를 시뮬레이션 하는 구멍에 CD14 표현 (대 식 세포의 다른 마커)는 구멍의 가장자리에 섬유 아 세포로 서 vimentin 표현 하지만. Vimentin 활성 세포20으로 표현 된다. 데이터는 THP 1 대 식 세포 기능을 확인 했다.

그림 1: 실험적인 디자인. 3D 인체 조직 등가물 gingiva (GTE) (A)의 실험적인 체제 및 염증 GTE (iGTE) (B). 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
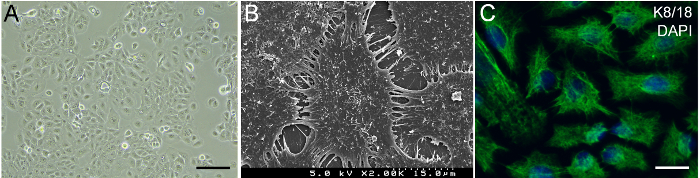
그림 2: HaCaT keratinocytes의. (A) 문화에 HaCaT 세포의 단계 대조 현미경 이미지. 눈금 막대 = 50 µ m. (B) SEM 이미지 HaCaT 세포의. (C) Immunohistochemical gingival 상피 세포 마커 K8/18 HaCaT 세포의 얼룩. 녹색, k 8/18입니다. 블루, DAPI입니다. 눈금 막대 = 10 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
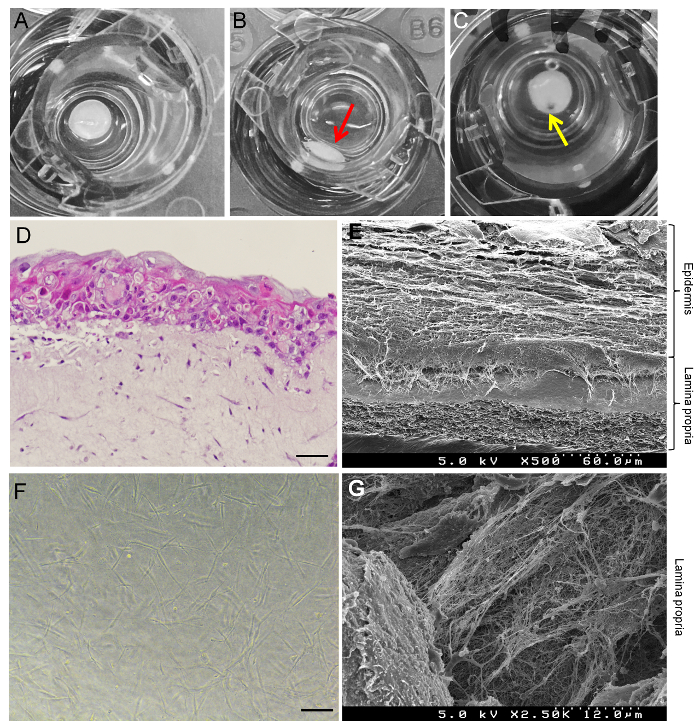
그림 3: gingiva (GTE)의 3 차원 인체 조직 등가물의. 문화에서 성공적인 GTE의 (A) 예. 조직 문화 삽입 한가운데에 이다. 실패 한 GTE의 (B) 예:는 GTE의 일부 조직에서 분리 하 고 벽 (빨간색 화살표) 쪽으로 편견. (C) 부상 GTE: 노란색 화살표 조직 주먹으로 펀치 구멍을 나타냅니다. (D) H & E 19 일 (14 일 공기 노출)에 대 한 재배 GTE의 얼룩. 눈금 막대 50 µ m. (E) SEM 이미지 19 일 동안 재배 하는 GTE의 수직 섹션의 =. (F) 단계 대조 HGF의 미세한 이미지 형성 GTE의 lamina propria 콜라겐 젤 세포. 눈금 막대 25 µ m. (G) SEM 이미지 GTE의 lamina propria에 HGF 셀 주위 대규모 콜라겐 섬유의 =. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 4: vimentin, 테-7과 GTE에서 K19의 식. 면역 형광 검사 lamina propria 마커 vimentin (A 및 B) 및 테-7 (B) GTE, 그리고 표 피 마커 K19 GTE (C) 및 iGTE (D)에 대 한 GTE의 얼룩. 레드, vimentin K19 녹색, 테-7. 블루, DAPI입니다. E, 표 피; LP, lamina propria 눈금 막대 = 50 µ m (A, C 및 D) 20 µ m (B). 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 5: THP-1 셀의. (A) Undifferentiated THP-1 세포 문화. 눈금 막대 = 15 µ m. (B) 분화 THP-1 세포. 눈금 막대 = 15 µ m. (C) THP-1 셀 KSR 매체에 콜라겐 젤에 포함 되었고 24 h. 규모에 대 한 PMA로 치료 = 50 µ m. (D) Immunohistochemical 얼룩 THP 1 대 식 세포 대 식 세포 마커 CD68의 바. 빨강, CD68입니다. 블루, DAPI입니다. 눈금 막대 5 µ m. (E) THP-1-콜라겐 혼합 HGE PMA 치료의 시작 부분에서의 부상된 구멍에. 눈금 막대 = 25 µ m. (F) THP-1 셀 PMA 처리 후 72 h에 대 식 세포 (빨간색 화살표)로 분화. 눈금 막대 25 µ m. (G) THP-1 셀 표현된 macrophage 마커 CD68 =. 노란 점선된 라인 H & e. 스케일 바의 부상된 구멍의 영역을 나타냅니다 = 100 µ m. 레드, CD68. 블루, hoechst 33342입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
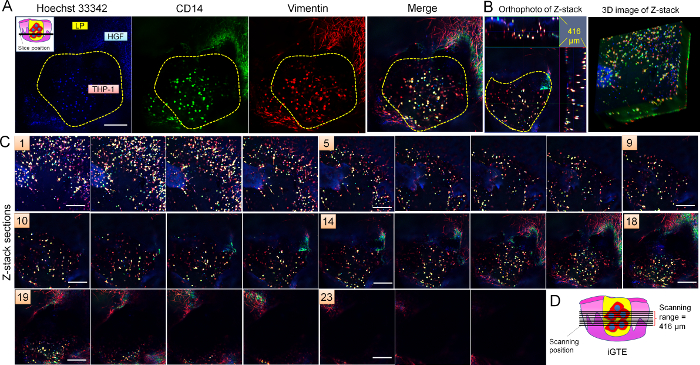
그림 6: iGTE의. CD14 (녹색) 및 vimentin (빨간색)에 대 한 전체 마운트 immunohistochemistry iGTE에서 수행 되었다. 부터 Z-시리즈 이미지 (C) iGTE (총에서 416 µ m 통해 캡처. 패널 1 LSM 스캔, 첫 번째 섹션 이며 패널 25 마지막입니다. 간격 섹션 사이 약 16.64 µ m입니다). 대표 섹션 (A) (Z 시리즈 이미지의 제 17), orthophoto와 Z-스택 (B)의 3D 이미지는 iGTE에 상처를 시뮬레이션 하는 구멍에 CD14-vimentin 긍정적인 THP-1 세포의 3D 분포를 제시 합니다. IGTE에 LSM의 검색 위치 (D)에 표시 되 고 (A) 왼쪽된 상단 구석에. 눈금 막대 = 50 µ m. 황색 점선 iGTE에 상처 구멍의 영역을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
이 프로토콜 gingival 조직 등가물 및 이전 보고서8,,2122에 의해 설명 된 피하 지방 조직 등가물을 만드는 방법을 기반으로 합니다. 이 간단 하 고 쉬운 방법 이지만, 일부 단계 특별 한 주의가 필요 합니다. 예를 들어 콜라겐 혼합 솔루션에서 젤 형성을 피하기 위해 사용 될 때까지 얼음에 유지 되어야 한다. 문화 삽입으로 콜라겐 혼합물을 추가할 때 솔루션 편견된 젤 ( 그림 3B처럼) 형성을 피하기 위해 삽입의 센터에서 주사 확인 하십시오. GTE에 구멍을 펀칭 기술을 걸립니다. 조직 주먹 가끔 조직 너무 젖은 경우는 조직을 선택할 수 없습니다. 조직 생 검 시스템 또는 집게의 쌍 유용할 것; 그러나, 부상된 위치 크기 많이 변경 됩니다. 그것은 또한 날카로운 바늘과 주사기를 사용 하 여 구멍을 펀칭 하지 않고 THP-1 셀 콜라겐 혼합물을 주입 하 수 (젤 바늘을 방해할 하지 않습니다 있는지 확인 하십시오).
이 방법의 한계는 그것이 iGTE 부족 혈관, 신경 세포 및 다른 면역 세포와 염증에 의해 발생 하지 않습니다 때문에 치은 염 및 치 주 염, 복잡 한 생물 학적 현상을 완벽 하 게 나타낼 수는 호스트 biofilm의 상호 그러나, 그것은 유일한 생체 외에서 염 조직 모델 인간의 세포에 의해 부분적으로 염증 gingiva의 병 리를 제시 하. 모델 1로 진짜 치은 염 및 치 주 질환에 더 많은 유사를 수정할 수 있습니다) 공동 호스트 biofilm 상호 작용을 만드는 biofilm와 GTE를 재배 또는 LPS (의 외부 막에 화합물을 사용 하 여 iGTE에 선 동적인 응답을 자극 그램 음성 박테리아 및 강한 염증 초기자 우리 프로토콜에서 제안), 2) 양식 gingiva 치아 단지에 추출 된 치아에 콜라겐 HGF 솔루션 시드 및 관찰 방법을 gingiva에 염증 영향 하드 조직, 그리고 3) 사용 하 여 GTE의 iGTE 표 피를 인간의 gingival 상피 세포.
여기에 제시 된 방법으로 GTE와 iGTE 문화 사용할 수 있습니다 다양 한 도구로 상처 치유, 조직 재생, 염증, 세포 세포 상호 작용을 공부 하 고 화면 잠재적인 의약품에 치은 염 및 치 주 질환에 대 한.
공개
저자는 충돌의 관심을 선언합니다.
감사의 말
이 작품 지원 부분에서 일본 사회에 의해 과학 진흥 (JSP) 선진적인 과학 연구 (26861689 및 17 K 11813) 한다. 저자 나 다니엘 그린 씨 교정 하는 것을 감사 하 고 싶습니다.
자료
| Name | Company | Catalog Number | Comments |
| Collagen type I-A | Nitta Gelatin Inc | For making dermis of GTE | |
| MEM-alpha | Thermo Fisher Scientific | 11900073 | Cell culture medium |
| Cell Culture Insert (for 24-well plate), pore size 3.0 μm | Corning, Inc. | 353096 | For tissue culture |
| GlutaMAX | Thermo Fisher Scientific | 35050061 | Cell culture reagent |
| DMEM | Thermo Fisher Scientific | 31600034 | Cell culture medium |
| KnockOut Serum Replacement | Thermo Fisher Scientific | 10828028 | Cell culture reagent |
| Tissue puncher | Shibata system service co., LTD | SP-703 | For punching holes in GTE |
| RPMI 1640 | Thermo Fisher Scientific | 31800022 | Cell culture medium |
| BSA | Sigma-Aldrich | A3294 | For immunostaining |
| Hoechst 33342 (NucBlue Live Cell stain) | Thermo Fisher Scientific | R37605 | For labeling nuclei |
| Fluorescence mount medium | Dako | For mounting samples after immunostaining | |
| Anti-Cytokeratin 8+18 antibody [5D3] | abcam | ab17139 | For identifying epithelium |
| Scaning electron microscope | Hitachi, Ltd. | HITACHI S-4000 | For observing samples' surface topography and composition |
| Confocal laser scanning microscopy | LSM 700; Carl Zeiss Microscopy Co., Ltd. | LSM 700 | For observing samples' immunofluorescence staining |
| Anti-Cytokeratin 19 antibody | abcam | ab52625 | For identifying epithelium |
| Anti-vimentin antibody | abcam | ab92547 | For identifying fibroblasts and activated macrophages |
| Anti-TE-7 antibody | Millipore | CBL271 | For identifying fibroblasts in the dermis |
| Anti-CD68 antibody | Sigma-Aldrich | SAB2700244 | For identifying macrophages |
| Human CD14 Antibody | R&D Systems | MAB3832-SP | For identifying macrophages |
| Alexa Fluor 594-conjugated secondary goat anti-rabbit antibody | Thermo Fisher Scientific | A11012 | For immunofluorescence staining |
| Alexa Fluor 488-conjugated secondary goat anti-mouse antibody | Thermo Fisher Scientific | A11001 | For immunofluorescence staining |
| EVOS FL Cell Imaging System | Thermo Fisher Scientific | For observing the sample's immunofluorescence staining | |
| THP-1 cells | Riken BRC cell bank | RCB1189 | For making iGTE |
| PMA(Phorbol 12-myristate 13-acetate) | Sigma-Aldrich | P8139 | For differentiatting THP-1 cells |
참고문헌
- Cekici, A., Kantarci, A., Hasturk, H., Van Dyke, T. E. Inflammatory and immune pathways in the pathogenesis of periodontal disease. Periodontology 2000. 64 (1), 57-80 (2014).
- Hasturk, H., Kantarci, A., Van Dyke, T. E. Oral Inflammatory Diseases and Systemic Inflammation: Role of the Macrophage. Frontiers in Immunology. 3, 118 (2012).
- Koh, T. J., DiPietro, L. A. Inflammation and wound healing: The role of the macrophage. Expert reviews in molecular medicine. 13, e23 (2011).
- Mescher, A. L. Macrophages and fibroblasts during inflammation and tissue repair in models of organ regeneration. Regeneration. 4 (2), 39-53 (2017).
- Struillou, X., Boutigny, H., Soueidan, A., Layrolle, P. Experimental Animal Models in Periodontology: A Review. The Open Dentistry Journal. 4, 37-47 (2010).
- Han, Y. W., et al. Interactions between Periodontal Bacteria and Human Oral Epithelial Cells: Fusobacterium nucleatum Adheres to and Invades Epithelial Cells. Infection and Immunity. 68 (6), 3140-3146 (2000).
- Boukamp, P., Petrussevska, R. T., Breitkreutz, D., Hornung, J., Markham, A., Fusenig, N. E. Normal keratinization in a spontaneously immortalized aneuploid human keratinocyte cell line. J Cell Biol. 106 (3), 761-771 (1988).
- Xiao, L., Miwa, N. Hydrogen-rich water achieves cytoprotection from oxidative stress injury in human gingival fibroblasts in culture or 3D-tissue equivalents, and wound-healing promotion, together with ROS-scavenging and relief from glutathione diminishment. Hum Cell. 30 (2), 72-87 (2017).
- Tsuchiya, S., Yamabe, M., Yamaguchi, Y., Kobayashi, Y., Konno, T., Tada, K. Establishment and characterization of a human acute monocytic leukemia cell line (THP-1). Int J Cancer. 26 (2), 171-176 (1980).
- Ara, T., Kurata, K., Hirai, K., Uchihashi, T., Uematsu, T., Imamura, Y., Furusawa, K., Kurihara, S., Wang, P. L. Human gingival fibroblasts are critical in sustaining inflammation in periodontal disease. J Periodontal Res. 44 (1), 21-27 (2009).
- Park, E. K., Jung, H. S., Yang, H. I., Yoo, M. C., Kim, C., Kim, K. S. Optimized THP-1 differentiation is required for the detection of responses to weak stimuli. Inflamm Res. 56 (1), 45-50 (2007).
- Sharif, O., Bolshakov, V. N., Raines, S., Newham, P., Perkins, N. D. Transcriptional profiling of the LPS induced NF-kappaB response in macrophages. BMC Immunol. 8, 1 (2007).
- Shetty, S., Gokul, S. Keratinization and its disorders. Oman Med J. 27 (5), 348-357 (2012).
- Klinge, B., Matsson, L., Attström, R. Histopathology of initial gingivitis in humans. A pilot study. J Clin Periodontol. 10 (4), 364-369 (1983).
- Nagarakanti, S., Ramya, S., Babu, P., Arun, K. V., Sudarsan, S. Differential expression of E-cadherin and cytokeratin 19 and net proliferative rate of gingival keratinocytes in oral epithelium in periodontal health and disease. J Periodontol. 78 (11), 2197-2202 (2007).
- Goodpaster, T., Legesse-Miller, A., Hameed, M. R., Aisner, S. C., Randolph-Habecker, J., Coller, H. A. An immunohistochemical method for identifying fibroblasts in formalin-fixed, paraffin-embedded tissue. J Histochem Cytochem. 56 (4), 347-358 (2008).
- Langeland, K., Rodrigues, H., Dowden, W. Periodontal disease, bacteria, and pulpal histopathology. Oral Surg Oral Med Oral Pathol. 37 (2), 257-270 (1974).
- Holness, C. L., Simmons, D. L. Molecular cloning of CD68, a human macrophage marker related to lysosomal glycoproteins. Blood. 81 (6), 1607-1613 (1993).
- Mor-Vaknin, N., Punturieri, A., Sitwala, K., Markovitz, D. M. Vimentin is secreted by activated macrophages. Nat Cell Biol. 5 (1), 59-63 (2003).
- Xiao, L., Aoshima, H., Saitoh, Y., Miwa, N. The effect of squalane-dissolved on adipogenesis-accompanied oxidative stress and macrophage in a preadipocyte-monocyte co-culture system. Biomaterials. 31 (23), 5976-5985 (2010).
- Xiao, L., Aoshima, H., Saitoh, Y., Miwa, N. Highly hydroxylated fullerene localizes at the cytoskeleton and inhibits oxidative stress in adipocytes and a subcutaneous adipose-tissue equivalent. Free Radic Biol Med. 51 (7), 1376-1389 (2011).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유