Method Article
Equivalenti di tessuto umano infiammatorio tridimensionale del Gingiva
In questo articolo
Riepilogo
L'obiettivo del protocollo è quello di costruire un modello di infiammatorio gengiva umana in vitro. Questo modello di tessuto Co-coltiva tre tipi di cellule umane, keratinocytes di HaCaT, fibroblasti gengivali e macrofagi THP-1, in condizioni tridimensionali. Questo modello può essere applicato a indagare le malattie parodontali, quali gengivite e parodontite.
Abstract
Le malattie parodontali (come gengivite e parodontite) sono le principali cause di perdita dei denti negli adulti. L'infiammazione nella gengiva è fondamentale fisiopatologia delle malattie parodontali. Attuali modelli sperimentali di malattie parodontali sono stati stabiliti in vari tipi di animali. Tuttavia, la fisiopatologia dei modelli animali è diversa da quella degli esseri umani, rendendo difficile per analizzare i meccanismi cellulari e molecolari e valutare nuovi farmaci per malattie parodontali. Qui, presentiamo un protocollo dettagliato per la ricostruzione di equivalenti di tessuto infiammatorio umano della gengiva (iGTE) in vitro. Costruiamo prima equivalenti di tessuto umano della gengiva (GTE) utilizzando due tipi di cellule umane, tra cui fibroblasti gengivali umani (HGF) e cheratinociti epidermici della pelle umana (HaCaT), in condizioni tridimensionali. Creiamo un modello di ferita utilizzando un perforatore di tessuto per fare un buco nel GTE. Prossimi, umani monociti THP-1 mescolati con gel di collagene sono iniettati nel foro il GTE. Da adimistration di 10 ng/mL phorbol 12-myristate 13-acetate (PMA) per 72 h, cellule THP-1 differenziano nei macrofagi di focolai infiammatori forma in GTE (iGTE) (IGTE inoltre può essere stumilated con 2 µ g/mL di lipopolisaccaridi (LPS) per 48 h avviare l'infiammazione ). IGTE è il primo modello in vitro di gengiva infiammatoria utilizzando cellule umane con un'architettura tridimensionale. IGTE riflette le modifiche patologiche principali (activition immunociti, interazioni intracellulari tra fibryoblasts, cellule epiteliali, monociti e macrofagi) a malattie parodontali. GTE, GTE feriti e iGTE utilizzabile come versatile di strumenti per studiare la guarigione della ferita, rigenerazione tissutale, infiammazione, interazione cellula-cellula e potenziali farmaci schermo per malattie parodontali.
Introduzione
Le malattie parodontali sono la principale causa di perdita dei denti negli adulti. Gengivite e parodontite sono le più comuni malattie parodontali. Entrambi presenti alterazioni infiammatorie acute o croniche biofilm-mediata nella gengiva. Gengivite è caratterizzata da infiammazione acuta, considerando che la parodontite si presenta solitamente come l'infiammazione cronica. A livello istologico, componenti batteriche innescano l'attivazione di cellule immunitarie, come i macrofagi, linfociti, plasmacellule e mastociti1,2. Queste cellule immuni, soprattutto macrofagi, interagiscono con le cellule locali (tra cui cellule epiteliali gingival, fibroblasti, cellule endoteliali e osteoblasti) con conseguente lesioni infiammatorie nel tessuto peridentale3,4. Modelli sperimentali di malattie parodontali sono state stabilite in vari tipi di animali, come ratti, criceti, conigli, furetti, canini e primati. Tuttavia, la fisiopatologia dei modelli animali è diversa da quella degli esseri umani, rendendo difficile per analizzare i meccanismi cellulari e molecolari e valutare nuovi farmaci di malattie parodontali5. Co-coltura di batteri parodontali e cellule epiteliali orali umane monostrato è stato utilizzato per studiare il meccanismo di infezioni parodontali6. Tuttavia, colture monostrato di cellule orali mancano l'architettura cellulare di tridimensionale (3D) di tessuto intatto; Pertanto, essi non può simulare la situazione in vitro .
Qui, gli equivalenti 3D infiammatoria del tessuto umano della gengiva (iGTE) sono istituiti per rappresentare malattie parodontali in vitro. Questo modello 3D delle malattie parodontali occupa una posizione intermedia tra colture delle cellule dello strato monomolecolare e modelli animali. Tre tipi di cellule umane, incluse HaCaT cheratinociti e fibroblasti gengivali macrofagi THP-1, sono co-coltivati su gel di collagene e stimolati dagli iniziatori infiammatori di costruire iGTE. IGTE simula molto attentamente le condizioni in vivo del differenziamento cellulare, l'interazione cellula-cellula e l'attivazione del macrofago nel gingiva. Questo modello ha molte possibili applicazioni per droga di screening e test di nuovi approcci farmacologici in malattie parodontali, nonché per l'analisi dei meccanismi cellulari e molecolari nella guarigione della ferita, infiammazione e rigenerazione dei tessuti.
Protocollo
Questo protocollo è progettato per creare equivalenti di tessuto gengivale umano, ferita gengivale modelli e modelli di gengivite. Pelle umana cheratinociti (HaCaT) sono state gentilmente concesse da professore Norbert E. Fusenig di Deutsches Krebsforschungszentrum (Heidelberg, Germania)7. Fibroblasti gengivali umani (HGFs) sono stati isolati dai tessuti gengivali secondo i protocolli precedentemente pubblicati8. Il consenso informato è stato ottenuto in anticipo, e lo studio è stato approvato secondo le linee guida fissano dal comitato etico, la Nippon Dental University School of Life Dentistry presso Tokyo (numero di autorizzazione: NDU-T2012-35). Procedura di protocollo 1 – 3 deve essere eseguita in una cappa di cultura cellulare.
1. preparazione del tessuto umano 3D equivalenti di gengiva (GTE) (Figura 1A)
- Mix del collagene tipo I-A gel con 10% concentrato MEM-alfa e buffer di ricostruzione di 10% (2,2 g di NaHCO3 e 4,47 HEPES in 100 mL di 0.05 N NaOH) in una provetta sterile da 15 mL di pipettaggio. Mantenere la soluzione mista collagene su ghiaccio fino a quando non utilizzato.
- Inserire inserti cultura 24 pozzetti (poro dimensione 3.0 µm) in una piastra a 24 pozzetti.
-
Rimuovere HGFs dalla superficie di cultura utilizzando 0,25% soluzione di tripsina-EDTA. Sospendere le cellule in 10 mL di medium di coltura A (MEM-alfa + 20% FBS + 1% GlutaMAX). Contare le celle di un contatore di cellule Bürker-Türk.
- Estrarre la quantità desiderata di celle (1-5 x105 cellule/mL), quindi centrifugare per 4 min a 190 x g.
- Sospendere le cellule nella soluzione mista del collagene. Mantenere la miscela su ghiaccio fino al passaggio successivo.
- Aggiungere 0,5 mL della miscela delle cellule-collagene (0,5-2,5 x 105 cellule/pozzetto) nell'inserto cultura senza produrre eventuali bolle. Incubare la miscela per 10-30 min in atmosfera umidificata con 5% CO2 a 37 ° C per far coagulare la miscela in un gel.
Nota: Aggiungere il composto di collagene al centro dell'inserto cultura per evitare disparità formazione di gel di collagene. - Aggiungere 1 mL di terreno di coltura nel pozzo e 0,5 mL nell'inserto. Incubare la piastra di coltura per 24 ore o durante la notte in atmosfera umidificata con 5% CO2 a 37 ° C.
- Rimuovere le cellule HaCaT dalla superficie di cultura utilizzando 0,25% soluzione di tripsina-EDTA. Sospendere le cellule in 10 mL di medium B (DMEM 10% FBS + 1% GlutaMAX) e contare le celle. Estratto la quantità necessaria di celle (1 – 5 x 105 cellule/mL) con una pipetta, centrifugare per 4 min x 190 g. sospendere le cellule in media B.
- Rimuovere il supporto dagli inserti di cultura, che contengono la miscela di HGF-collagene, dall'aspirazione. Aggiungere 0,5 mL della sospensione di cellule HaCaT (0,5-2,5 x 105 cellule/pozzetto) nella parte superiore la miscela di HGF-collagene. Incubare le colture per 24 ore o durante la notte.
Nota: A questo punto del tempo, il mezzo nella cultura ben dovrebbe essere A medio, mentre il mezzo nell'inserto cultura dovrebbe essere medio B. - Sostituire il terreno di coltura con il mezzo di KSR (co-coltura) (MEM-alfa + 15% sostituzione di KnockOut del siero + 1% GlutaMAX) + 5% FBS. Aggiungere 1 mL di terreno di coltura nella cultura ben e 0,5 mL nell'inserto cultura. Incubare le colture per 24 – 48 h.
- Sostituire il terreno di coltura con KSR medium + 1% FBS. Aggiungere 1 mL nella cultura ben e 0,5 mL nell'inserto cultura. Incubare le colture per 24 ore o durante la notte.
- Sostituire il terreno di coltura nella cultura bene con 0,7 – 1 mL di terreno di KSR. Rimuovere completamente il mezzo dall'inserto di cultura (la superficie di cultura dovrebbe essere esposto all'aria). Incubare le colture per 1 – 2 settimane. Modificare il mezzo nella cultura ben due volte alla settimana.
Nota: Non lasciare che l'innalzamento del livello medio sopra la superficie di cultura (lo strato superiore è composto da cheratinociti). Tenere sempre asciutta la superficie di cultura.
2. preparazione del GTE feriti (Figura 1B)
- Preparare un perforatore di tessuto del diametro 1 – 3 mm. Sterilizzare con autoclave a 121 ° C per 20 min.
- Spingere il puncher tessuto perpendicolarmente in GTE circa 300 µm profonda e fare un buco nel tessuto per simulare una ferita.
- A questo punto, è possibile utilizzare il GTE feriti per indagare la rigenerazione di tessuto e di guarigione della ferita. In alternativa, Difficoltà GTE utilizzando soluzione tampone neutro di formalina al 10% per eseguire l'analisi istologica.
3. preparazione del GTE infiammatorie (iGTE) (Figura 1B)
- Coltivare le cellule THP-1 secondo la precedente relazione9.
- Mix del collagene tipo I-A gel con 10% concentrato RPMI 1640, buffer di ricostruzione del 10% (2,2 g di NaHCO3 e 4,47 HEPES in 100 mL di 0.05 N NaOH) e 10 ng/mL PMA. Mantenere la soluzione mista collagene su ghiaccio fino all'utilizzo.
- Conteggio 1 – 2 x 106 THP-1 cellule e centrifugare per 4 min x 190 g. sospendere le cellule in 1 mL della soluzione mista di collagene. Mantenere la miscela su ghiaccio fino al passaggio successivo.
- Aggiungere 10 – 30 µ l THP-1-collagene miscela nell'area ferito del GTE. Sostituire il terreno di coltura a 0,7 – 1 mL di terreno di KSR contenente 10 ng/mL di PMA.
- Incubare la miscela in atmosfera umidificata con 5% CO2 a 37 ° C per 72 h.
- Utilizzare il modello per lo studio di gengivite o parodontite (ad esempio, aggiungere potenziale farmaco antinfiammatorio a iGTE per vedere i suoi effetti sul rilascio di citochina10). In alternativa, omettere 72h PMA-trattamento, aggiungere 2 µ g/mL di LPS nella cultura e incubare il tessuto in atmosfera umidificata con 5% CO2 a 37 ° C per 48 h11,12.
4. fissazione e Immunostaining di montare tutta del GTE e iGTE culture
-
Fissazione delle culture.
- Rimuovere il terreno di coltura dalla piastra a 24 pozzetti. Lavare i tessuti 2 volte con tamponato fosfato salino (PBS).
- Aggiungere 1 mL di soluzione di tampone neutro di formalina al 10% per l'inserto e 1 mL alla cultura bene. Lasciare la piastra a 24 pozzetti in frigorifero a 4 ° C durante la notte.
- Rimuovere la soluzione di tampone neutro di formalina 10% il giorno seguente.
- Per l'intero Monte immunocolorazione, lavare i tessuti 3 - 4 volte con PBS dopo la fissazione.
- Per ematossilina ed eosina (H & E) e immunostaining regolari, procedere con disidratazione, inclusione in paraffina e sezionamento.
Nota: Per l'intero Monte immunocolorazione, questo passaggio può essere omesso.
-
Tutta Monte immunostaining
Nota: Questo protocollo è stato modificato da quella di riferimento 13.- Lavare i tessuti 3 x in PBS 0.5 – 1% Triton, 10 – 30 min ogni volta.
- Incubare i tessuti due volte per 30 min in tampone bloccante (PBS 1% Triton + 10% BSA), a temperatura ambiente.
- Lavare i tessuti 2 × in tampone bloccante, 5 – 10 minuti ogni volta.
- Aggiungere 50 µ l di soluzione di anticorpo primario alla diluizione/concentrazione necessaria agli inserti. Utilizzare una sottile pellicola di plastica per avvolgere gli inserti per evitare disidratazione del tessuto.
- Incubare il tessuto per 1 o 2 giorni a 4 ° C.
- Lavare i tessuti 3 volte, per 30 min in PBS 1% Triton + 10% BSA. Lavare nuovamente 3 volte, per 5 min in PBS 1% Triton.
- Aggiungere 50 µ l di anticorpo secondario in tampone bloccante (PBS 1% Triton + 10% BSA) e 5 µ l di soluzione di Hoechst 33342 (macchia di NucBlue Live Cell) per ogni inserimento. Utilizzare una sottile pellicola di plastica per avvolgere gli inserti per evitare disidratazione del tessuto.
- Incubare per 1-2 giorni a 4 ° C. Avvolgere la piastra a 24 pozzetti in un tovagliolo di carta bagnato e poi metterlo in un pacchetto di plastica da utilizzare durante l'incubazione.
- Lavare i tessuti 3 volte, per 10 min in triton 1% PBS
- Usare un ago affilato per tagliare la membrana dell'inserto cultura per ottenere il tessuto. Posizionare la membrana in una diapositiva.
Nota: Il tessuto dovrebbe essere sulla membrana. - Aggiungere 2 – 3 gocce di mezzo di montaggio di fluorescenza. Coprire il tessuto con una copertura in vetro e conservare a 4 ° C al buio fino all'analisi.
- Mostra tessuti con un laser confocale microscopia (LSM).
Risultati
Le cellule HaCaT visualizzato morfologia tipica del keratinocyte sotto osservazione al microscopio di contrasto di fase (Figura 2A). Immagini di scanner elettrone microscopiche (SEM) ha mostrato che le superfici delle cellule HaCaT erano coperti da molti microvilli. Intercellulare connessioni tra le cellule HaCaT sono state mediate da processi a membrana (Figura 2B). Le cellule HaCaT espresso epitelio gingival marcatore K8/1814, che indica che le cellule HaCaT sono adatte per la ricostruzione della gengiva (Figura 2).
Figura 3A viene illustrato un esempio riuscito di GTE, e Figura 3B Mostra un esempio non riuscito del GTE. La prova senza successo (Figura 3B) è causata dalla miscela di gel di collagene non vengono aggiunta al centro dell'inserto cultura. Figura 3 ha mostrato che un modello di ferita del GTE può essere fatta praticando un foro nel tessuto con un perforatore di tessuto. H & E che macchia (Figura 3D) e immagini al SEM (Figura 3E) hanno dimostrato che a 19 giorni di coltivazione, circa 10 – 20 strati di epitelio di forma cellule HaCaT e collagene gel incorporato HGF cellule forma della lamina propria. Nella lamina propria del GTE ricostruito, HGF cellule hanno esibito la morfologia caratteristica dei fibroblasti (Figura 3F) e sono state circondate da ben definite matrici di fibre di collagene (Figura 3). Colorazione di immunofluorescenza ha mostrato che il vimentin e TE-7 (entrambi sono dei fibroblasti dermici marcatori15) sono espresse nella lamina propria del GTE (Figura 4A e 4B). K19, un marcatore specifico all'epitelio giunzionale e tasca in periodontitis16, è debolmente espresso nell'epitelio del GTE (Figura 4) ed è fortemente espresso nell'epitelio di iGTE (Figura 4). I dati hanno suggerito che le cellule HaCaT possono differenziare in cellule epiteliali chiave nella parodontite, soprattutto dopo stimolo infiammatorio della lamina propria.
Malattie gengivale infiammatorie, quali gengivite e parodontite, istologicamente sono caratterizzate dalla presenza di linfociti e macrofagi e provocare la fibrosi ed il tessuto necrosi17,18. In questo protocollo, cellule THP-1 sono state utilizzate come le cellule infiammatorie per iGTE. Come illustrato nella Figura 5, senza PMA-stimolazione, cellule THP-1 presenta una morfologia monocytic e la maggior parte di loro ha galleggiato nel medio (Figura 5A). Al contrario, dopo essere stato esposto a PMA 10 ng/mL per 72 h, oltre il 50% delle cellule THP-1 differenziate in macrofago-come le cellule e aderito sulla superficie di cultura (figura 5B). Simili a cellule HaCaT e HGF8, cellule THP-1 è cresciuto bene all'interno del gel di collagene in co-coltura (medio KSR) e differenziano in cellule macrofago-come dopo PMA-trattamento (Figura 5). Immunostaining ha mostrato che le cellule THP-1 aderite espresso CD68 (un marcatore di macrofagi19) (Figura 5) e CD14 (un altro indicatore di macrofagi) (Figura 6). Per formare iGTE, monociti THP-1 sono stati incorporati nel gel collagene e iniettati nel foro che simula una ferita (Figura 5E). A 72 h dopo PMA (10 ng/mL)-stimolazione, THP-1 cellule differenziate nei macrofagi (Figura 5F) all'interno del foro che simula una ferita ed espresso CD68 (Figura 5), che indica sono in grado di focolai infiammatori forma nel GTE feriti.
Tutta Monte immunohistochemistry (Figura 6) ha mostrato che le cellule THP-1 nel foro che simula una ferita non solo espresso CD14 (un altro indicatore di macrofagi), ma anche espresso il vimentin, come pure i fibroblasti nel bordo del foro. Il vimentin è espresso dai macrofagi attivi20. I dati confermano che i macrofagi THP-1 sono funzionali.

Figura 1: disegni sperimentali. Messa a punto sperimentale di equivalenti di tessuto umano 3D della gengiva (GTE) (A) e infiammatoria GTE (iGTE) (B). Clicca qui per visualizzare una versione più grande di questa figura.
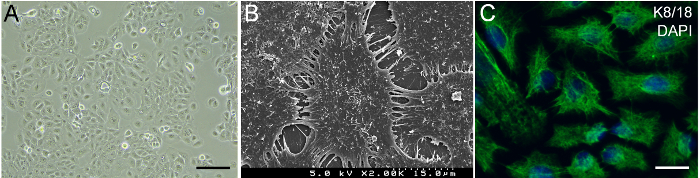
Figura 2: caratterizzazione dei keratinocytes di HaCaT. (A) immagine al microscopio di contrasto di fase delle cellule HaCaT nella cultura. Barra della Scala = immagine di SEM 50 µm. (B) delle cellule di HaCaT. (C) Immunohistochemical macchiatura delle cellule HaCaT per marcatore delle cellule epiteliali gingival K8/18. Verde, K8/18. Blu, DAPI. Barra della scala = 10 µm. Clicca qui per visualizzare una versione più grande di questa figura.
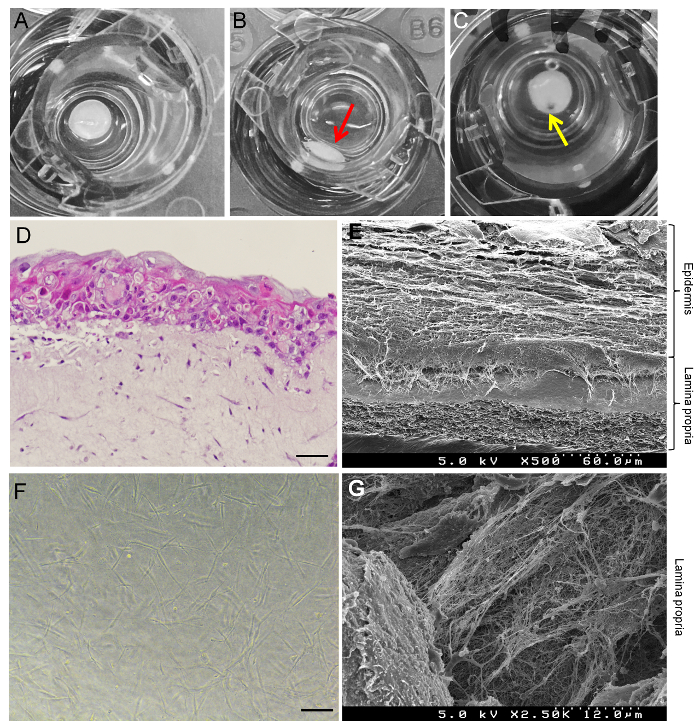
Figura 3: caratterizzazione degli equivalenti di tessuto umano 3D della gengiva (GTE). (A) esempio di un riuscita GTE in cultura. Il tessuto è al centro dell'inserto di cultura. (B) esempio di un GTE non riuscito: parte il GTE è separato dal tessuto e polarizzato verso la parete (freccia rossa). (C) feriti GTE: freccia gialla indica un foro perforato dal puncher di tessuto. (D) H & E colorazione del GTE coltivato per 19 giorni (14 giorni aria esposizione). Barra della scala = 50 µm. (E) immagine di SEM di una sezione verticale del GTE coltivato per 19 giorni. (F) immagine microscopica di HGF cellule in gel di collagene che formano la lamina propria del GTE a contrasto di fase. Barra della scala = 25 µm. (G) SEM immagine massiccia delle fibre di collagene intorno alle cellule HGF nella lamina propria del GTE. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: espressione di vimentina, TE-7 e K19 in GTE. Colorazione di immunofluorescenza del GTE per TE-7 (B) in GTE ed epidermide marcatore K19 in GTE (C) e iGTE (D) e il vimentin di marcatori della lamina propria (A e B). Rosso, il vimentin e K19. Verde, TE-7. Blu, DAPI. E, epidermide; LP, propria di lamina. Barra della scala = 50 µm (A, C e D), 20 µm (B). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: caratterizzazione delle cellule THP-1. (A) indifferenziato THP-1 cellule in cultura. Barra della scala = 15 µm. (B) macrofagi differenziati THP-1. Barra della scala = 15 µm. (C) cellule THP-1 sono state incorporate nel gel di collagene in mezzo KSR e trattate con PMA per 24 h. scala bar = 50 µm. (D) la macchiatura di Immunohistochemical dei macrofagi THP-1 per indicatore del macrofago CD68. Rosso, CD68. Blu, DAPI. Barra della scala = 5 µm. (E) THP-1-collagene miscela nel foro ferito di HGE all'inizio del trattamento di PMA. Barra della scala = 25 µm. (F) THP-1 cellule differenziate nei macrofagi (frecce rosse) a 72 h dopo il trattamento di PMA. Barra della scala = 25 µm. (G) THP-1 cellule del macrofago espressi indicatore CD68. Linea gialla tratteggiata indica l'area del foro ferito nel bar H & E. scala = 100 µm. rosso, CD68. Blu, hoechst 33342. Clicca qui per visualizzare una versione più grande di questa figura.
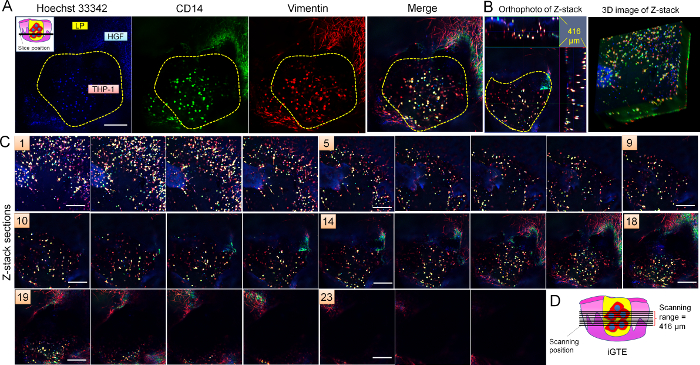
Figura 6: caratterizzazione di iGTE. Tutta Monte immunohistochemistry per CD14 (verde) e il vimentin (rosso) è stato effettuato su iGTE. Immagini di serie Z (C) acquisite attraverso iGTE (416 µm in totale. Pannello 1 è la prima sezione che LSM scansionati e pannello 25 è l'ultimo. L'intervallo è µm circa 16.64 tra sezioni). Rappresentanza sezione (A) (n. 17 delle immagini di serie Z), ortofoto e l'immagine 3D della Z-pila (B) ha presentato la distribuzione 3D dei macrofagi vimentin-positive e di CD14-THP-1 nel foro che simula una ferita nella iGTE. La posizione di scansione di LSM in iGTE è indicata in (D) e l'angolo superiore sinistro (A). Barra della scala = 50 µm. gialle tratteggiate indicano l'area del foro ferito in iGTE. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Questo protocollo è basato su metodi di creazione di tessuto gengivale equivalenti ed equivalenti di tessuto adiposo sottocutanei descritti da precedenti rapporti8,21,22. Anche se si tratta di un metodo semplice e facile, alcuni passaggi richiedono particolare attenzione. Ad esempio, la miscela di collagene dovrebbe essere tenuta su ghiaccio fino all'utilizzo per evitare la formazione di un gel nella soluzione. Quando si aggiunge la miscela di collagene nell'inserto cultura, assicurarsi che la soluzione è stata iniettata nel centro dell'inserto per evitare formando un gel distorto (come in Figura 3B). Praticando un foro in GTE richiede anche abilità. Il puncher tessuto a volte non può ritirare il tessuto se il tessuto è troppo umido. Un sistema di biopsia del tessuto o un paio di pinze sarebbe utile; Tuttavia, le dimensioni della posizione ferita molto cambierà. È anche possibile utilizzare una siringa con ago appuntito per iniettare la miscela di collagene delle cellule THP-1 senza un foro di perforazione (assicurarsi che il gel non intasare l'ago).
La limitazione di questo metodo è che non è in grado di rappresentare perfettamente i complessi fenomeni biologici di gengivite e parodontite, perché iGTE manca di vasi sanguigni, cellule di un neurone e altre cellule del sistema immunitario, e l'infiammazione è causata non dal interazioni ospite-biofilm. Tuttavia, è solo in vitro gengivite modello del tessuto fatto di cellule umane che presenta in parte la patologia infiammatoria dalla gengiva. Il modello può essere modificato per essere più simile a quella reale gengivite e malattia parodontale di 1) co-coltivando GTE con biofilm per creare interazioni host-biofilm o stimolando le risposte infiammatorie in iGTE utilizzando LPS (i composti nella membrana esterna di Batteri gram-negativi e un iniziatore infiammatorio forte come abbiamo suggerito nel protocollo), 2) semina la soluzione di collagene-HGF su denti estratti per formare complessi di gengiva-dente e osservando come l'infiammazione in gengiva influenza dei tessuti duri e 3) utilizzando cellule epiteliali gingival umane per formare l'epidermide di GTE e iGTE.
Con i metodi qui presentati, GTE e iGTE culture possono essere utilizzate come strumenti versatili per studiare la guarigione della ferita, rigenerazione tissutale, infiammazione, interazione cellula-cellula e ai farmaci potenziali schermo per gengivite e parodontite.
Divulgazioni
Gli autori non dichiarano alcun conflitto di interessi.
Riconoscimenti
Questo lavoro è stato supportato in parte dalla Japan Society per la promozione della scienza (JSPS) sovvenzione per la ricerca scientifica (26861689 e 17 K 11813). Gli autori vorrei ringraziare Mr. Nathaniel Green per la correzione di bozze.
Materiali
| Name | Company | Catalog Number | Comments |
| Collagen type I-A | Nitta Gelatin Inc | For making dermis of GTE | |
| MEM-alpha | Thermo Fisher Scientific | 11900073 | Cell culture medium |
| Cell Culture Insert (for 24-well plate), pore size 3.0 μm | Corning, Inc. | 353096 | For tissue culture |
| GlutaMAX | Thermo Fisher Scientific | 35050061 | Cell culture reagent |
| DMEM | Thermo Fisher Scientific | 31600034 | Cell culture medium |
| KnockOut Serum Replacement | Thermo Fisher Scientific | 10828028 | Cell culture reagent |
| Tissue puncher | Shibata system service co., LTD | SP-703 | For punching holes in GTE |
| RPMI 1640 | Thermo Fisher Scientific | 31800022 | Cell culture medium |
| BSA | Sigma-Aldrich | A3294 | For immunostaining |
| Hoechst 33342 (NucBlue Live Cell stain) | Thermo Fisher Scientific | R37605 | For labeling nuclei |
| Fluorescence mount medium | Dako | For mounting samples after immunostaining | |
| Anti-Cytokeratin 8+18 antibody [5D3] | abcam | ab17139 | For identifying epithelium |
| Scaning electron microscope | Hitachi, Ltd. | HITACHI S-4000 | For observing samples' surface topography and composition |
| Confocal laser scanning microscopy | LSM 700; Carl Zeiss Microscopy Co., Ltd. | LSM 700 | For observing samples' immunofluorescence staining |
| Anti-Cytokeratin 19 antibody | abcam | ab52625 | For identifying epithelium |
| Anti-vimentin antibody | abcam | ab92547 | For identifying fibroblasts and activated macrophages |
| Anti-TE-7 antibody | Millipore | CBL271 | For identifying fibroblasts in the dermis |
| Anti-CD68 antibody | Sigma-Aldrich | SAB2700244 | For identifying macrophages |
| Human CD14 Antibody | R&D Systems | MAB3832-SP | For identifying macrophages |
| Alexa Fluor 594-conjugated secondary goat anti-rabbit antibody | Thermo Fisher Scientific | A11012 | For immunofluorescence staining |
| Alexa Fluor 488-conjugated secondary goat anti-mouse antibody | Thermo Fisher Scientific | A11001 | For immunofluorescence staining |
| EVOS FL Cell Imaging System | Thermo Fisher Scientific | For observing the sample's immunofluorescence staining | |
| THP-1 cells | Riken BRC cell bank | RCB1189 | For making iGTE |
| PMA(Phorbol 12-myristate 13-acetate) | Sigma-Aldrich | P8139 | For differentiatting THP-1 cells |
Riferimenti
- Cekici, A., Kantarci, A., Hasturk, H., Van Dyke, T. E. Inflammatory and immune pathways in the pathogenesis of periodontal disease. Periodontology 2000. 64 (1), 57-80 (2014).
- Hasturk, H., Kantarci, A., Van Dyke, T. E. Oral Inflammatory Diseases and Systemic Inflammation: Role of the Macrophage. Frontiers in Immunology. 3, 118 (2012).
- Koh, T. J., DiPietro, L. A. Inflammation and wound healing: The role of the macrophage. Expert reviews in molecular medicine. 13, e23 (2011).
- Mescher, A. L. Macrophages and fibroblasts during inflammation and tissue repair in models of organ regeneration. Regeneration. 4 (2), 39-53 (2017).
- Struillou, X., Boutigny, H., Soueidan, A., Layrolle, P. Experimental Animal Models in Periodontology: A Review. The Open Dentistry Journal. 4, 37-47 (2010).
- Han, Y. W., et al. Interactions between Periodontal Bacteria and Human Oral Epithelial Cells: Fusobacterium nucleatum Adheres to and Invades Epithelial Cells. Infection and Immunity. 68 (6), 3140-3146 (2000).
- Boukamp, P., Petrussevska, R. T., Breitkreutz, D., Hornung, J., Markham, A., Fusenig, N. E. Normal keratinization in a spontaneously immortalized aneuploid human keratinocyte cell line. J Cell Biol. 106 (3), 761-771 (1988).
- Xiao, L., Miwa, N. Hydrogen-rich water achieves cytoprotection from oxidative stress injury in human gingival fibroblasts in culture or 3D-tissue equivalents, and wound-healing promotion, together with ROS-scavenging and relief from glutathione diminishment. Hum Cell. 30 (2), 72-87 (2017).
- Tsuchiya, S., Yamabe, M., Yamaguchi, Y., Kobayashi, Y., Konno, T., Tada, K. Establishment and characterization of a human acute monocytic leukemia cell line (THP-1). Int J Cancer. 26 (2), 171-176 (1980).
- Ara, T., Kurata, K., Hirai, K., Uchihashi, T., Uematsu, T., Imamura, Y., Furusawa, K., Kurihara, S., Wang, P. L. Human gingival fibroblasts are critical in sustaining inflammation in periodontal disease. J Periodontal Res. 44 (1), 21-27 (2009).
- Park, E. K., Jung, H. S., Yang, H. I., Yoo, M. C., Kim, C., Kim, K. S. Optimized THP-1 differentiation is required for the detection of responses to weak stimuli. Inflamm Res. 56 (1), 45-50 (2007).
- Sharif, O., Bolshakov, V. N., Raines, S., Newham, P., Perkins, N. D. Transcriptional profiling of the LPS induced NF-kappaB response in macrophages. BMC Immunol. 8, 1 (2007).
- Shetty, S., Gokul, S. Keratinization and its disorders. Oman Med J. 27 (5), 348-357 (2012).
- Klinge, B., Matsson, L., Attström, R. Histopathology of initial gingivitis in humans. A pilot study. J Clin Periodontol. 10 (4), 364-369 (1983).
- Nagarakanti, S., Ramya, S., Babu, P., Arun, K. V., Sudarsan, S. Differential expression of E-cadherin and cytokeratin 19 and net proliferative rate of gingival keratinocytes in oral epithelium in periodontal health and disease. J Periodontol. 78 (11), 2197-2202 (2007).
- Goodpaster, T., Legesse-Miller, A., Hameed, M. R., Aisner, S. C., Randolph-Habecker, J., Coller, H. A. An immunohistochemical method for identifying fibroblasts in formalin-fixed, paraffin-embedded tissue. J Histochem Cytochem. 56 (4), 347-358 (2008).
- Langeland, K., Rodrigues, H., Dowden, W. Periodontal disease, bacteria, and pulpal histopathology. Oral Surg Oral Med Oral Pathol. 37 (2), 257-270 (1974).
- Holness, C. L., Simmons, D. L. Molecular cloning of CD68, a human macrophage marker related to lysosomal glycoproteins. Blood. 81 (6), 1607-1613 (1993).
- Mor-Vaknin, N., Punturieri, A., Sitwala, K., Markovitz, D. M. Vimentin is secreted by activated macrophages. Nat Cell Biol. 5 (1), 59-63 (2003).
- Xiao, L., Aoshima, H., Saitoh, Y., Miwa, N. The effect of squalane-dissolved on adipogenesis-accompanied oxidative stress and macrophage in a preadipocyte-monocyte co-culture system. Biomaterials. 31 (23), 5976-5985 (2010).
- Xiao, L., Aoshima, H., Saitoh, Y., Miwa, N. Highly hydroxylated fullerene localizes at the cytoskeleton and inhibits oxidative stress in adipocytes and a subcutaneous adipose-tissue equivalent. Free Radic Biol Med. 51 (7), 1376-1389 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon