Method Article
Dreidimensionale entzündliche menschliches Gewebe Äquivalente der Gingiva
In diesem Artikel
Zusammenfassung
Das Ziel des Protokolls ist eine entzündliche menschlichen Gingiva Modell in Vitrozu bauen. Dieses Gewebe Modell pflegt Co drei Arten von menschlichen Zellen, HaCaT Keratinozyten, gingival Fibroblasten und THP-1 Makrophagen, dreidimensionalen Bedingungen. Dieses Modell kann angewendet werden, für die Untersuchung von parodontaler Erkrankungen wie Gingivitis und Parodontitis.
Zusammenfassung
Parodontale Erkrankungen (z.B. Gingivitis, Parodontitis) sind die führenden Ursachen für Zahnverlust bei Erwachsenen. Entzündung im Zahnfleisch ist die grundlegende physiopathologie der Parodontalerkrankungen. Aktuelle experimentelle Modelle der Parodontalerkrankungen entstanden in verschiedenen Arten von Tieren. Die Physiopathologie von Tiermodellen ist jedoch anders als die des Menschen, macht es schwierig, zelluläre und molekulare Mechanismen zu analysieren und bewerten neue Medikamente für parodontale Erkrankungen. Hier präsentieren wir Ihnen ein detailliertes Protokoll zur Rekonstruktion von entzündlichen Gewebe Entsprechungen des Zahnfleisches (iGTE) in Vitro. Wir erstellen zunächst menschliches Gewebe Äquivalente der Gingiva (GTE) durch die Verwendung von zwei Arten von menschlichen Zellen, einschließlich menschliche gingival Fibroblasten (HGF) und menschliche Haut epidermalen Keratinozyten (HaCaT), dreidimensionale Bedingungen. Wir erstellen eine Wunde Modell mithilfe eine Gewebe Puncher, ein Loch in der GTE Punsch. Nächste, menschliche THP-1 Monozyten mit Kollagen Gel gemischt werden in das Loch in der GTE injiziert. Durch Adimistration von 10 ng/mL Phorbol Myristate-12 13-Acetat (PMA) für 72 h, THP-1-Zellen unterschieden in Makrophagen in Form entzündlicher Herde in GTE (iGTE) (IGTE auch kann sein Stumilated mit 2 µg/mL von Lipopolysacchariden (LPS) für 48 h, Entzündung zu initiieren ). IGTE ist das erste in-vitro- Modell der entzündlichen Gingiva mit menschlichen Zellen mit einer dreidimensionalen Architektur. IGTE spiegelt die wichtigsten pathologische Veränderungen (Immunzellen Activition, intrazellulären Interaktionen zwischen Fibryoblasts, Epithelzellen, Monozyten und Makrophagen) in parodontale Erkrankungen. GTE, Verwundeten GTE und iGTE dient als vielseitige Werkzeuge, um die Wundheilung zu studieren, Geweberegeneration, Entzündungen, Zell-Zell-Interaktion und Bildschirm mögliche Medikamente für parodontale Erkrankungen.
Einleitung
Parodontale Erkrankungen sind die häufigste Ursache für Zahnverlust bei Erwachsenen. Gingivitis und Parodontitis sind die häufigsten parodontalen Erkrankungen. Die beiden präsentieren Biofilm-vermittelten akute oder chronische entzündliche Veränderungen im Zahnfleisch. Gingivitis ist geprägt von akuten Entzündungen, während Parodontitis in der Regel als chronische Entzündung präsentiert. Bei der histologischen Ebene ausgelöst bakterielle Komponenten die Aktivierung von Immunzellen, wie Makrophagen, Lymphozyten, Plasmazellen und Mastzellen1,2. Diese Immunzellen, vor allem Makrophagen, interagieren mit lokalen Zellen (einschließlich Zahnfleisch Epithelzellen, Fibroblasten, Endothelzellen und Osteoblasten) wodurch entzündliche Läsionen im parodontalen Gewebe3,4. Experimentelle Modelle der Parodontalerkrankungen wurden in verschiedene Arten von Tieren, wie Ratten, Hamster, Kaninchen, Frettchen, Eckzähne und Primaten. Die Physiopathologie von Tiermodellen ist jedoch anders als die des Menschen, macht es schwierig, zelluläre und molekulare Mechanismen zu analysieren und bewerten neue Medikamente von Parodontalerkrankungen5. Co-Kultur von parodontale Bakterien und menschlichen mündliche Epithelzellen Monolage wurde verwendet, zu untersuchen, den Mechanismus der parodontalen Infektionen6. Dennoch fehlt Monolayer-Kulturen der mündlichen Zellen die dreidimensionale (3D) zelluläre Architektur von intaktem Gewebe; Daher können nicht sie die in-vitro- Situation imitieren.
Hier sind 3D entzündliche menschliches Gewebe Äquivalente der Gingiva (iGTE) gegründet, um parodontale Erkrankungen in Vitrodarstellen. Das 3D-Modell der Parodontalerkrankungen nimmt eine Zwischenstellung zwischen Monolage Zellkulturen und Tiermodellen. Drei Arten von menschlichen Zellen, einschließlich HaCaT Keratinozyten, gingival Fibroblasten und Makrophagen THP-1, sind Co auf Kollagen Gel angebaut und durch entzündliche Initiatoren iGTE bauen stimuliert. IGTE simuliert eng die in-Vivo -Bedingungen der Zelldifferenzierung, Zell-Zell-Interaktion und Makrophagen Aktivierung im Zahnfleisch. Dieses Modell hat viele Einsatzmöglichkeiten für Drug screening und testen neue pharmakologische Ansätze bei parodontalen Erkrankungen sowie zur Analyse von zellulärer und molekularer Mechanismen in der Wundheilung, Entzündung und Regeneration des Gewebes.
Protokoll
Dieses Protokoll soll menschliche Gingiva-Äquivalente, gingival Wunde Modelle und Gingivitis-Modelle zu erstellen. Menschliche Haut epidermalen Keratinozyten (HaCaT) wurden freundlicherweise zur Verfügung gestellt von Professor Norbert E. Fusenig Deutsches Krebsforschungszentrum (Heidelberg, Deutschland)7. Menschliche gingivale Fibroblasten (HGFs) waren von gingival Gewebe gemäß den zuvor veröffentlichten Protokolle8isoliert. Einwilligung war vorher, und die Studie wurde nach den Richtlinien der Ausschuss Ethik, die Nippon Dental University School of Life Dentistry in Tokio zugelassen (Zulassungsnummer: NDU-T2012-35). Protokoll-Schritte 1 – 3 sollte in einer Zelle Kultur Haube durchgeführt werden.
1. Vorbereitung des 3D menschliches Gewebe Äquivalente der Gingiva (GTE) (Abbildung 1A)
- MEM-Alpha und 10 % Wiederaufbau Puffer Mix Kollagen Typ-A-Gel mit 10 % konzentriert (2,2 g Nahco33 und 4,47 g HEPES in 100 mL 0,05 N NaOH) in einem 15 mL steriles Röhrchen durch pipettieren. Halten Sie die gemischten Kollagen-Lösung auf Eis bis verwendet.
- 24-Well-Kultur-Einsätze (Pore Größe 3,0 µm) in einer 24-Well-Platte zu platzieren.
-
HGFs von der Kultur-Oberfläche mit 0,25 % Trypsin-EDTA-Lösung entfernen. Aussetzen der Zellen in 10 mL Kulturmedium A (MEM-Alpha + 20 % FBS + 1 % GlutaMAX). Zählen der Zellen durch einen Bürker-Türk-Zelle-Zähler.
- Extrahieren Sie die gewünschte Menge an Zellen (1-5 X105 Zellen/mL), dann 4 Minuten bei 190 X g zentrifugieren.
- Unterbrechen Sie die Zellen in der gemischten Kollagen-Lösung. Halten Sie die Mischung auf dem Eis erst im nächsten Schritt.
- Fügen Sie 0,5 mL der Zelle-Kollagen-Mischung (0,5 – 2,5 x 105 Zellen/gut) in der Kultur einfügen ohne Bläschen zu produzieren. Inkubieren Sie die Mischung für 10-30 min in eine feuchte Atmosphäre mit 5 % CO2 bei 37 ° C zu gerinnen die Mischung in ein Gel.
Hinweis: Fügen Sie die Kollagen-Mischung in die Mitte der Kultur einfügen ungleiche Bildung von Kollagen Gel zu vermeiden. - Fügen Sie 1 mL Kulturmedium in den Brunnen und 0,5 mL in den Einsatz. Inkubation der Kultur-Platte für 24 h oder über Nacht in eine feuchte Atmosphäre mit 5 % CO2 bei 37 ° C.
- Entfernen Sie HaCaT-Zellen von der Kultur-Oberfläche mit 0,25 % Trypsin-EDTA-Lösung. Die Zellen in 10 mL Medium B auszusetzen (DMEM + 10 % FBS + 1 % GlutaMAX) und die Zellen zu zählen. Extrakt die benötigte Menge von Zellen (1 – 5 x 105 Zellen/mL) mit einer Pipette, Zentrifuge für 4 min bei 190 X g. auszusetzen, die Zellen in der mittleren B.
- Entfernen Sie das Medium aus der Kultur-Einsätzen, die durch Absaugen die HGF-Kollagen-Mischung enthalten. 0,5 mL HaCaT Zellsuspension (0,5 – 2,5 x 105 Zellen/Brunnen) auf der Oberseite der HGF-Kollagen-Mischung zugeben. Inkubation der Kulturen für 24 Stunden oder über Nacht.
Hinweis: Zu diesem Zeitpunkt sollte das Medium in der Kultur gut mittlere A, werden während des Mediums in der Kultur einfügen sollte mittlere B. - Ersetzen Sie das Kulturmedium mit KSR Medium (Co Kulturmedium) (MEM-Alpha + 15 % Ko-Serum Ersatz + 1 % GlutaMAX) + 5 % FBS. Fügen Sie 1 mL Kulturmedium in die Kultur gut und 0,5 mL in der Kultur einfügen. Inkubation der Kulturen für 24 – 48 h.
- Ersetzen Sie das Kulturmedium mit KSR Medium + 1 % FBS. Fügen Sie 1 mL in die Kultur gut und 0,5 mL in der Kultur einfügen. Inkubation der Kulturen für 24 Stunden oder über Nacht.
- Ersetzen Sie das Kulturmedium in der Kultur gut mit 0,7 – 1 mL KSR Medium. Entfernen Sie das Medium vollständig aus dem Kultur einfügen (Kultur-Oberfläche sollte Luft ausgesetzt werden). 1 – 2 Wochen inkubieren Sie der Kulturen. Ändern Sie das Medium in der Kultur auch zwei Mal pro Woche.
Hinweis: Lassen Sie nicht die mittlere Ebene steigen über der Kultur-Oberfläche (die oberste Schicht aus Keratinozyten). Immer halten Sie die Kultur Oberfläche trocken.
2. Vorbereitung des Verwundeten GTE (Abbildung 1 b)
- Bereiten Sie eine 1 – 3 mm Durchmesser Gewebe Puncher. Mit einem Autoklaven bei 121 ° C für 20 min zu sterilisieren.
- Der Gewebe-Puncher senkrecht in GTE über 300 µm Tiefe schieben, und ein Loch in das Gewebe um eine Wunde zu simulieren.
- Verwenden Sie in diesem Schritt die Verwundeten GTE für die Untersuchung von Wunde heilen und Geweberegeneration. Alternativ zu beheben GTE mit 10 % Formalin neutraler Pufferlösung histologische Analysen durchzuführen.
3. Vorbereitung des entzündlichen GTE (iGTE) (Abbildung 1 b)
- THP-1-Zellen nach dem vorherigen Bericht9zu kultivieren.
- Mix Kollagen Typ-A-Gel mit 10 % konzentriert RPMI 1640, 10 % Wiederaufbau Puffer (2,2 g Nahco33 und 4,47 g HEPES in 100 mL 0,05 N NaOH) und 10 ng/mL PMA. Halten Sie die gemischten Kollagen-Lösung auf dem Eis bis zur Verwendung.
- Anzahl 1 – 2 x 106 THP-1 Zellen und Zentrifuge für 4 min bei 190 X g. aussetzen der Zellen in 1 mL der Lösung gemischt Kollagen. Halten Sie die Mischung auf dem Eis erst im nächsten Schritt.
- Fügen Sie 10 – 30 µL THP-1-Kollagen Mischung in den verletzten Bereich der GTE. Ersetzen Sie das Kulturmedium 0,7 – 1 mL KSR 10 ng/mL von PMA-haltigem Medium.
- Inkubieren Sie die Mischung in eine feuchte Atmosphäre mit 5 % CO2 bei 37 ° C für 72 h.
- Verwenden Sie das Modell für die Untersuchung von Gingivitis oder Parodontitis (z. B. hinzufügen potenzielle entzündungshemmendes Medikament iGTE zu sehen, seine Auswirkungen auf die Cytokine Release10). Alternativ lassen Sie 72 h PMA-Behandlung Weg, fügen Sie 2 µg/mL LPs in die Kultur hinzu und inkubieren Sie das Gewebe in eine feuchte Atmosphäre mit 5 % CO2 bei 37 ° C für 48 h11,12.
4. Fixierung und ganze montieren Immunostaining GTE und iGTE Kulturen
-
Fixierung der Kulturen.
- Entfernen Sie das Kulturmedium aus 24-Well-Platte. Waschen Sie das Gewebe 2 Mal mit Phosphat gepufferte Kochsalzlösung (PBS).
- Die Kultur gut 1 mL 10 % Formalin neutraler Pufferlösung, die Einlage und 1 mL hinzufügen. Lassen Sie die 24-Well-Platte über Nacht im Kühlschrank bei 4 ° C.
- Entfernen Sie die 10 % Formalin neutraler Pufferlösung am folgenden Tag.
- Waschen Sie für ganze Berg Immunostaining Gewebe 3-4 Mal mit PBS nach der Fixierung.
- Gehen Sie für Hämatoxylin und Eosin (H & E) Färbung und regelmäßige Immunostaining mit Austrocknung, Paraffin einbetten und schneiden.
Hinweis: Für ganze Berg Immunostaining kann dieser Schritt entfallen.
-
Ganzen Berg immunostaining
Hinweis: Dieses Protokoll wurde von der Referenz 13 geändert.- Waschen Sie das Gewebe 3 X in PBS 0,5 – 1 % Triton, 10-30 min jedes Mal.
- Inkubieren Sie das Gewebe zweimal für 30 min in blocking-Puffer (PBS 1 % Triton + 10 % BSA), bei Raumtemperatur.
- Waschen Sie das Gewebe 2 × in blockierende Puffer, 5 – 10 Minuten jedes Mal.
- Fügen Sie 50 µL Primärantikörper Lösung am erforderlichen Verdünnung/Konzentration auf die Einsätze. Verwenden Sie eine dünne Kunststoff Frischhaltefolie wickeln die Einsätze um Austrocknung des Gewebes zu vermeiden.
- Inkubieren Sie das Gewebe für 1 bis 2 Tage bei 4 ° c
- Waschen Sie das Gewebe 3 Mal für 30 min in PBS 1 % Triton + 10 % BSA. Waschen wieder 3 Mal für 5 min in PBS 1 % Triton.
- Fügen Sie 50 µL Sekundärantikörper in blocking-Puffer (PBS 1 % Triton + 10 % BSA) und 5 µL Hoechst 33342 Lösung (NucBlue Live Cell Fleck) für jeden Einsatz. Verwenden Sie eine dünne Kunststoff Frischhaltefolie wickeln die Einsätze um Austrocknung des Gewebes zu vermeiden.
- 1 bis 2 Tage bei 4 ° c inkubieren Wickeln Sie die 24-Well-Platte in einem feuchten Papiertuch, und steckte sie dann in ein Kunststoff-Pack im gesamten Inkubation verwendet werden.
- Waschen Sie das Gewebe 3 Mal für 10 min in PBS 1 % triton
- Verwenden einer spitzen Nadel, schneiden Sie die Membran von der Kultur einfügen, um das Gewebe zu erhalten. Platzieren Sie die Membran auf einer Folie.
Hinweis: Das Gewebe sollte auf der Membran. - Fügen Sie 2 – 3 Tropfen Fluoreszenz Mount Medium. Decken Sie das Gewebe mit einem Deckglas und Speicher bei 4 ° C im Dunkeln bis zur Analyse.
- Zeigen Sie Gewebe mit einem konfokalen Laser-scanning-Mikroskopie (LSM an).
Ergebnisse
HaCaT-Zellen angezeigt typische Keratinozyten Morphologie unter Phasenkontrast-mikroskopische Beobachtung (Abbildung 2A). Scanner Elektron mikroskopische (SEM) Bilder zeigten, dass viele Mikrovilli HaCaT Zelloberflächen abgedeckt wurden. Interzelluläre Verbindungen zwischen HaCaT-Zellen wurden durch Membranverfahren (Abb. 2 b) vermittelt. HaCaT-Zellen ausgedrückt gingivalen Epithel Marker K8/1814, darauf hinweist, dass HaCaT-Zellen für den Wiederaufbau der Gingiva (Abbildung 2) geeignet sind.
Abbildung 3A zeigt ein gelungenes Beispiel für GTE und Abbildung 3 b zeigt eine fehlgeschlagene Beispiel GTE. Der erfolglose Versuch (Abb. 3 b) verursacht durch die Kollagen-Gel-Mischung nicht in der Mitte der Kultur einfügen hinzugefügt. Abbildung 3 zeigte, dass eine Wunde Modell der GTE durch ein Loch in das Gewebe mit einem Gewebe Puncher gemacht werden kann. H & E Färbung (Abbildung 3D) und SEM Bilder (Abbildung 3E) gezeigt, dass bei 19 Tage des Anbaus, ca. 10 – 20 Schichten von HaCaT-Zellen Form Epithel und Kollagen Gel eingebettet HGF Zellen Form Lamina Propria. In der Lamina Propria des rekonstruierten GTE HGF Zellen charakteristische Morphologie der Fibroblasten (Abbildung 3F) ausgestellt, und waren umgeben von klar definierten Arrays von Kollagenfasern (Abbildung 3). Immunfluoreszenz-Färbung zeigte, dass Vimentin und TE-7 (beide sind dermalen Fibroblasten Marker15) in die Lamina Propria der GTE (Abbildung 4A und 4 b) ausgedrückt werden. K19, eine spezifische Marker, Knoten und Tasche Epithel in Parodontitis16, ist schwach ausgedrückt in das Epithel der GTE (Abbildung 4) und äußert sich stark in das Epithel der iGTE (Abbildung 4). Die Daten vorgeschlagen, dass HaCaT-Zellen in wichtigen Epithelzellen in Parodontitis, vor allem nach entzündlichen Stimulation der Lamina Propria differenzieren können.
Entzündliche gingivale Erkrankungen wie Gingivitis und Parodontitis, sind histologisch gekennzeichnet durch das Vorhandensein von Lymphozyten und Makrophagen und Fibrose und Gewebe Nekrose17,18führen. In diesem Protokoll dienten THP-1-Zellen als die Entzündungszellen iGTE. Wie in Abbildung 5, ohne PMA-Stimulation, präsentiert THP-1-Zellen eine monozytären Morphologie und die meisten von ihnen schwebten in das Medium (Abb. 5A). Im Gegensatz dazu nach PMA 10 ng/mL für 72 h ausgesetzt, mehr als 50 % der THP-1-Zellen in Makrophagen-ähnliche Zellen differenziert und auf die Kultur-Oberfläche (Abb. 5 b) eingehalten. Ähnlich wie bei HaCaT und HGF Zellen8, THP-1-Zellen wuchs auch im Inneren der Kollagen-Gel Kokultur Mittel-(KSR Medium) und differenziert in Makrophagen-ähnliche Zellen nach PMA-Behandlung (Abbildung 5). Immunostaining zeigte, dass die haften THP-1-Zellen CD68 ausgedrückt (ein Marker der Makrophagen19) (Abbildung 5) und CD14 (ein weiteres Zeichen von Makrophagen) (Abbildung 6). IGTE bilden, wurden THP-1 Monozyten in das Kollagen-Gel eingebettet und in das Loch simuliert eine Wunde (Abb. 5E) injiziert. Bei 72 h nach PMA (10 ng/mL)-Stimulation, THP-1-Zellen differenziert in Makrophagen (Abbildung 5F) in der Bohrung simuliert eine Wunde und CD68 ausgedrückt (Abbildung 5), darauf hinweist, sie sind in der Lage, Form entzündlicher Herde in den Verwundeten GTE.
Ganzen Berg Immunohistochemistry (Abbildung 6) zeigte, dass THP-1-Zellen in das Loch eine Wunde nicht nur simulieren CD14 ausgedrückt (ein weiterer Marker von Makrophagen), aber auch ausgedrückt Vimentin als auch der Fibroblasten in der Kante des Lochs. Vimentin wird durch aktive Makrophagen20ausgedrückt. Die Daten bestätigt, dass THP-1 Makrophagen funktionsfähig sind.

Abbildung 1: Versuchspläne. Versuchsaufbau 3D menschliches Gewebe Äquivalente der Gingiva (GTE) (A) und entzündlichen GTE (iGTE) (B). Bitte klicken Sie hier für eine größere Version dieser Figur.
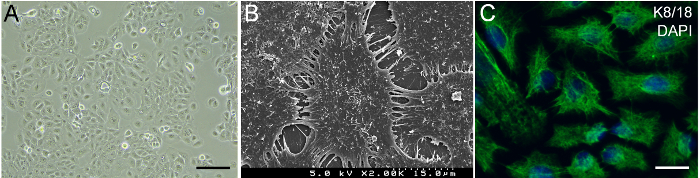
Abbildung 2: Charakterisierung von HaCaT Keratinozyten. (A) Phasenkontrast-mikroskopische Bild von HaCaT-Zellen in Kultur. Maßstabsleiste = 50 µm. (B) SEM Bild von HaCaT-Zellen. (C) immunhistochemische Färbung von HaCaT-Zellen für gingival Epithelzelle Marker K8/18. Grün, K8/18. Blau, DAPI. Maßstabsleiste = 10 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
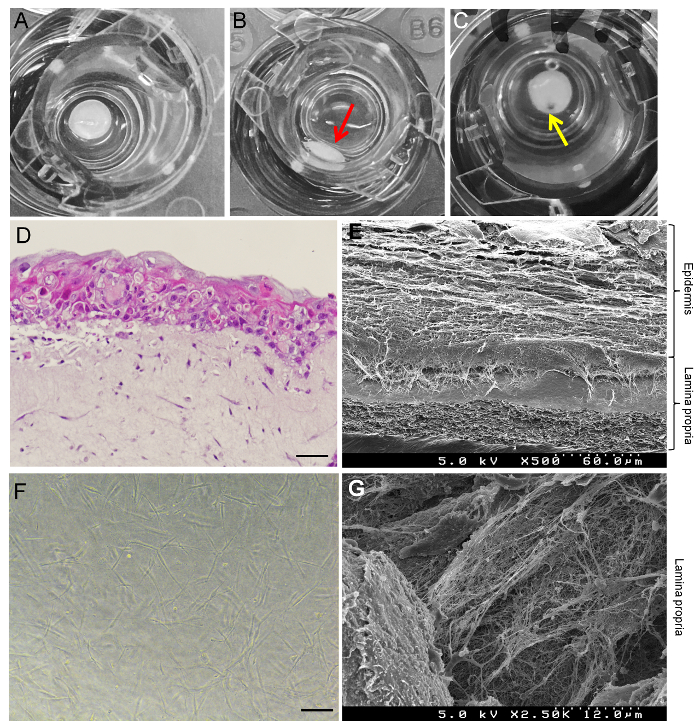
Abbildung 3: Charakterisierung von 3D menschliches Gewebe Äquivalente der Gingiva (GTE). (A) Beispiel für eine erfolgreiche GTE in Kultur. Das Gewebe ist in der Mitte der Kultur einfügen. (B) Beispiel für eine fehlgeschlagene GTE: Teil des GTE ist getrennt vom Gewebe und voreingenommen in Richtung der Wand (roter Pfeil). (C) verwundete GTE: gelber Pfeil zeigt einen gelocht der Gewebe-Puncher. (D) H & E Färbung des GTE seit 19 Tagen (14 Tage Luft Exposition) kultiviert. Maßstabsleiste = 50 µm. (E) SEM Bild von einem vertikalen Schnitt der GTE für 19 Tage kultiviert. (F) Phasenkontrast-mikroskopische Bild der HGF Zellen in Kollagen-Gel, das die Lamina Propria der GTE gebildet. Maßstabsleiste = 25 µm. (G) SEM Bild von massiven Kollagenfasern um HGF-Zellen in der Lamina Propria der GTE. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 4: Expression von Vimentin, TE-7 und K19 in GTE. Immunfluoreszenz Färbung des GTE für Lamina Propria Marker Vimentin (A und B) und TE-7 (B) im GTE und Epidermis Marker K19 in GTE (C) und (D) iGTE. Rot, Vimentin und K19. Grün, TE-7. Blau, DAPI. E, Epidermis; LP, Lamina Propria. Maßstabsleiste = 50 µm (A, C und D), 20 µm (B). Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 5: Charakterisierung von Zellen THP-1. (A) undifferenzierte THP-1 Zellen in Kultur. Maßstabsleiste = 15 µm. (B) differenziert THP-1 Makrophagen. Maßstabsleiste = 15 µm. (C) THP-1-Zellen waren eingebettet in Kollagen Gel KSR Mittel- und behandelt mit PMA für 24 h Skala bar = 50 µm. (D) immunhistochemische Färbung der THP-1 Makrophagen für Makrophagen Marker CD68. Rot, CD68. Blau, DAPI. Maßstabsleiste = 5 µm. (E) THP-1-Kollagen-Gemisch in die Verwundeten Loch der HGE zu Beginn des PMA-Behandlung. Maßstabsleiste = 25 µm. (F) THP-1-Zellen differenziert in Makrophagen (rote Pfeile) bei 72 h nach der PMA Behandlung. Maßstabsleiste = 25 µm. (G) THP-1 Zellen ausgedrückt Makrophagen Marker CD68. Gelbe gestrichelte Linie zeigt den Bereich der Verwundeten Bohrung in H & E. Scale Bar = 100 µm. rot, CD68. Blau, Hoechst 33342. Bitte klicken Sie hier für eine größere Version dieser Figur.
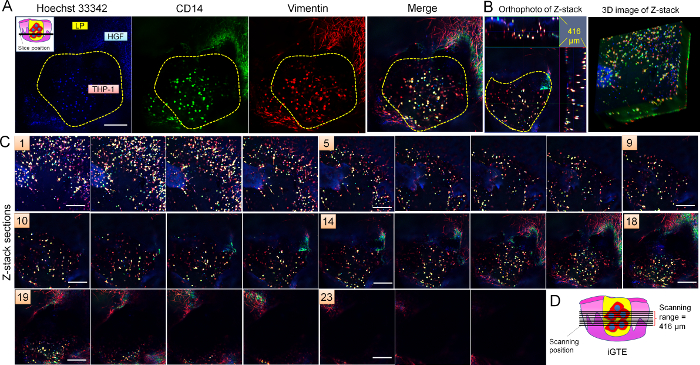
Abbildung 6: Charakterisierung von iGTE. Ganzen Berg Immunohistochemistry für CD14 (grün) und Vimentin (rot) wurde am iGTE durchgeführt. Z-Serie Bilder (C) durch iGTE (416 µm insgesamt. Panel 1 ist der erste Abschnitt, die, den LSM gescannt, und Panel 25 ist das letzte. Das Intervall beträgt ca. 16.64 µm zwischen Abschnitten). Repräsentative Abschnitt (A) (Nr. 17 der Z-Serie Bilder), Orthofoto und 3D-Bild von Z-Stapel (B) präsentiert die 3D Verteilung von CD14 und Vimentin-positiv THP-1 Makrophagen in das Loch eine Wunde in der iGTE zu simulieren. Die Abtastposition LSM in iGTE wird angegeben in (D) und der linken oberen Ecke in (A). Maßstabsleiste = 50 µm. gelb gepunkteten Linien zeigen den Bereich der Verwundeten Bohrung in iGTE. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Dieses Protokoll basiert auf Methoden der Schaffung von Gingiva-äquivalente und Subkutane Fettgewebe Äquivalente von vorherigen Berichte8,21,22beschrieben. Obwohl dies eine einfache und einfache Methode, erfordern einige Schritte besondere Aufmerksamkeit. Beispielsweise sollte die Kollagen-Mischung auf dem Eis bis zur Verwendung, Gelbildung in der Lösung zu vermeiden gehalten werden. Wenn die Kollagen-Mischung in das Kultur einfügen hinzufügen, stellen Sie sicher, dass die Lösung in der Mitte des Einsatzes zu vermeiden, bildet eine voreingenommene Gel (wie in Abb. 3 b) injiziert wurde. Ein Loch in GTE braucht auch Geschick. Der Gewebe-Puncher kann nicht das Gewebe manchmal abholen, wenn das Gewebe zu nass ist. Ein Gewebe-Biopsie-System oder ein paar Zangen wäre hilfreich; Allerdings werden die Dimensionen des Standortes verwundete viel geändert. Es ist auch möglich, eine Spritze mit spitzen Nadel verwenden, um die THP-1-Zelle-Kollagen-Mischung zu injizieren, ohne ein Loch (stellen Sie sicher, das Gel ist nicht die Nadel verstopfen).
Die Einschränkung dieser Methode ist, dass es nicht in der Lage, die komplexen biologischen Phänomene von Gingivitis und Parodontitis, perfekt zu vertreten, weil iGTE, Blutgefäße, Nervenzellen und anderen Immunzellen fehlt, und die Entzündung nicht durch entsteht die Host-Biofilm-Interaktionen. Allerdings ist es das einzige in-vitro- Gingivitis Gewebe Modell von menschlichen Zellen gemacht, die teilweise die Pathologie der entzündlichen Gingiva präsentiert. Das Modell kann geändert werden, um mehr ähnlich wie die echten Gingivitis und Parodontitis werden durch 1) Co kultivieren GTE mit Biofilm Host-Biofilm Interaktionen erstellen oder stimuliert Entzündungsreaktionen in iGTE mithilfe von LPS (die Verbindungen in der äußeren Membran der Gram-negativen Bakterien und eine starke entzündliche Initiator wie wir im Protokoll vorgeschlagen), 2) die Kollagen-HGF-Lösung auf extrahierte Zähne, Zahnfleisch-Zahn-komplexe Form zu säen und beobachten, wie Entzündungen im Zahnfleisch Hartgewebe und 3 beeinflusst) mit menschlichen gingival Epithelzellen die Epidermis von GTE und iGTE bilden.
Mit der hier vorgestellten Methoden können GTE und iGTE Kulturen als vielseitige Werkzeuge, Wundheilung, Geweberegeneration, Entzündung, Zell-Zell-Interaktion zu studieren und zu möglichen Medikamenten Bildschirm für Gingivitis und Parodontitis verwendet werden.
Offenlegungen
Die Autoren erklären keinen Interessenskonflikt.
Danksagungen
Diese Arbeit wurde zum Teil von der Japan Society für die Promotion of Science (JSPS) Beihilfe für wissenschaftliche Forschung (26861689 und 17 K 11813) unterstützt. Die Autoren möchte Herr Nathaniel Green für das Korrekturlesen zu danken.
Materialien
| Name | Company | Catalog Number | Comments |
| Collagen type I-A | Nitta Gelatin Inc | For making dermis of GTE | |
| MEM-alpha | Thermo Fisher Scientific | 11900073 | Cell culture medium |
| Cell Culture Insert (for 24-well plate), pore size 3.0 μm | Corning, Inc. | 353096 | For tissue culture |
| GlutaMAX | Thermo Fisher Scientific | 35050061 | Cell culture reagent |
| DMEM | Thermo Fisher Scientific | 31600034 | Cell culture medium |
| KnockOut Serum Replacement | Thermo Fisher Scientific | 10828028 | Cell culture reagent |
| Tissue puncher | Shibata system service co., LTD | SP-703 | For punching holes in GTE |
| RPMI 1640 | Thermo Fisher Scientific | 31800022 | Cell culture medium |
| BSA | Sigma-Aldrich | A3294 | For immunostaining |
| Hoechst 33342 (NucBlue Live Cell stain) | Thermo Fisher Scientific | R37605 | For labeling nuclei |
| Fluorescence mount medium | Dako | For mounting samples after immunostaining | |
| Anti-Cytokeratin 8+18 antibody [5D3] | abcam | ab17139 | For identifying epithelium |
| Scaning electron microscope | Hitachi, Ltd. | HITACHI S-4000 | For observing samples' surface topography and composition |
| Confocal laser scanning microscopy | LSM 700; Carl Zeiss Microscopy Co., Ltd. | LSM 700 | For observing samples' immunofluorescence staining |
| Anti-Cytokeratin 19 antibody | abcam | ab52625 | For identifying epithelium |
| Anti-vimentin antibody | abcam | ab92547 | For identifying fibroblasts and activated macrophages |
| Anti-TE-7 antibody | Millipore | CBL271 | For identifying fibroblasts in the dermis |
| Anti-CD68 antibody | Sigma-Aldrich | SAB2700244 | For identifying macrophages |
| Human CD14 Antibody | R&D Systems | MAB3832-SP | For identifying macrophages |
| Alexa Fluor 594-conjugated secondary goat anti-rabbit antibody | Thermo Fisher Scientific | A11012 | For immunofluorescence staining |
| Alexa Fluor 488-conjugated secondary goat anti-mouse antibody | Thermo Fisher Scientific | A11001 | For immunofluorescence staining |
| EVOS FL Cell Imaging System | Thermo Fisher Scientific | For observing the sample's immunofluorescence staining | |
| THP-1 cells | Riken BRC cell bank | RCB1189 | For making iGTE |
| PMA(Phorbol 12-myristate 13-acetate) | Sigma-Aldrich | P8139 | For differentiatting THP-1 cells |
Referenzen
- Cekici, A., Kantarci, A., Hasturk, H., Van Dyke, T. E. Inflammatory and immune pathways in the pathogenesis of periodontal disease. Periodontology 2000. 64 (1), 57-80 (2014).
- Hasturk, H., Kantarci, A., Van Dyke, T. E. Oral Inflammatory Diseases and Systemic Inflammation: Role of the Macrophage. Frontiers in Immunology. 3, 118(2012).
- Koh, T. J., DiPietro, L. A. Inflammation and wound healing: The role of the macrophage. Expert reviews in molecular medicine. 13, e23(2011).
- Mescher, A. L. Macrophages and fibroblasts during inflammation and tissue repair in models of organ regeneration. Regeneration. 4 (2), 39-53 (2017).
- Struillou, X., Boutigny, H., Soueidan, A., Layrolle, P. Experimental Animal Models in Periodontology: A Review. The Open Dentistry Journal. 4, 37-47 (2010).
- Han, Y. W., et al. Interactions between Periodontal Bacteria and Human Oral Epithelial Cells: Fusobacterium nucleatum Adheres to and Invades Epithelial Cells. Infection and Immunity. 68 (6), 3140-3146 (2000).
- Boukamp, P., Petrussevska, R. T., Breitkreutz, D., Hornung, J., Markham, A., Fusenig, N. E. Normal keratinization in a spontaneously immortalized aneuploid human keratinocyte cell line. J Cell Biol. 106 (3), 761-771 (1988).
- Xiao, L., Miwa, N. Hydrogen-rich water achieves cytoprotection from oxidative stress injury in human gingival fibroblasts in culture or 3D-tissue equivalents, and wound-healing promotion, together with ROS-scavenging and relief from glutathione diminishment. Hum Cell. 30 (2), 72-87 (2017).
- Tsuchiya, S., Yamabe, M., Yamaguchi, Y., Kobayashi, Y., Konno, T., Tada, K. Establishment and characterization of a human acute monocytic leukemia cell line (THP-1). Int J Cancer. 26 (2), 171-176 (1980).
- Ara, T., Kurata, K., Hirai, K., Uchihashi, T., Uematsu, T., Imamura, Y., Furusawa, K., Kurihara, S., Wang, P. L. Human gingival fibroblasts are critical in sustaining inflammation in periodontal disease. J Periodontal Res. 44 (1), 21-27 (2009).
- Park, E. K., Jung, H. S., Yang, H. I., Yoo, M. C., Kim, C., Kim, K. S. Optimized THP-1 differentiation is required for the detection of responses to weak stimuli. Inflamm Res. 56 (1), 45-50 (2007).
- Sharif, O., Bolshakov, V. N., Raines, S., Newham, P., Perkins, N. D. Transcriptional profiling of the LPS induced NF-kappaB response in macrophages. BMC Immunol. 8, 1(2007).
- Abcam. Whole mount fluorescent immunohistochemistry. , Available from: http://www.abcam.com/ps/pdf/protocols/whole_mount_fluorescent_ihc.pdf (2017).
- Shetty, S., Gokul, S. Keratinization and its disorders. Oman Med J. 27 (5), 348-357 (2012).
- Klinge, B., Matsson, L., Attström, R. Histopathology of initial gingivitis in humans. A pilot study. J Clin Periodontol. 10 (4), 364-369 (1983).
- Nagarakanti, S., Ramya, S., Babu, P., Arun, K. V., Sudarsan, S. Differential expression of E-cadherin and cytokeratin 19 and net proliferative rate of gingival keratinocytes in oral epithelium in periodontal health and disease. J Periodontol. 78 (11), 2197-2202 (2007).
- Goodpaster, T., Legesse-Miller, A., Hameed, M. R., Aisner, S. C., Randolph-Habecker, J., Coller, H. A. An immunohistochemical method for identifying fibroblasts in formalin-fixed, paraffin-embedded tissue. J Histochem Cytochem. 56 (4), 347-358 (2008).
- Langeland, K., Rodrigues, H., Dowden, W. Periodontal disease, bacteria, and pulpal histopathology. Oral Surg Oral Med Oral Pathol. 37 (2), 257-270 (1974).
- Holness, C. L., Simmons, D. L. Molecular cloning of CD68, a human macrophage marker related to lysosomal glycoproteins. Blood. 81 (6), 1607-1613 (1993).
- Mor-Vaknin, N., Punturieri, A., Sitwala, K., Markovitz, D. M. Vimentin is secreted by activated macrophages. Nat Cell Biol. 5 (1), 59-63 (2003).
- Xiao, L., Aoshima, H., Saitoh, Y., Miwa, N. The effect of squalane-dissolved on adipogenesis-accompanied oxidative stress and macrophage in a preadipocyte-monocyte co-culture system. Biomaterials. 31 (23), 5976-5985 (2010).
- Xiao, L., Aoshima, H., Saitoh, Y., Miwa, N. Highly hydroxylated fullerene localizes at the cytoskeleton and inhibits oxidative stress in adipocytes and a subcutaneous adipose-tissue equivalent. Free Radic Biol Med. 51 (7), 1376-1389 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten