Method Article
세포내 루멘 Morphogenesis 그리고 Vivo에서 편광 막 속 단일 셀에 대 한 모델로 선 충 C. Excretory 운하: GFP 융해, RNAi 상호 작용 화면 및 이미징 라벨
요약
C. 선 충 배설 운하 드 노 보 편광 막 속의 시각적 vivo에서 분석에 대 한 고유한 단일 셀 모델입니다. 이 프로토콜 표준 유전 RNAi 및 이미징 접근, 식별 및 분자 단 세포 tubulogenesis, 그리고 꼭대기 막 및 루멘 속 감독의 특성에 대 한 적응의 조합을 설명 합니다.
초록
4 선 충 C. 배설 운하는 좁은 튜브를 거의 동등 하 게 멀리 확장된 세포내 endotubes 구축 하 고 막 및 submembraneous 루멘 안정화와 함께 단일 셀에서 동물의 길이 통해 확장 꼭대기 캐릭터의 골격입니다. 배설 셀 확장의 길이 약 2, 000 번 드 노 보 편광 막 속, 세포내 루멘 morphogenesis vivo에서 평가 대 한 독특한이 모델을 만드는이 운하를 생성 및 단 세포 tubulogenesis입니다. 여기에 제시 된 프로토콜 표준 라벨, 이득 및 손실-의-기능 유전자 또는 RNA 간섭 (RNAi) 결합 하는 방법을 보여줍니다-, 그리고를 사용 하 여이 모델 기능 분자 수준에서이 프로세스를 분석 하 고 시각적으로 해 부 현미경 접근. 표기 방법의 예를 들어, 프로토콜 tubulogenesis의 실시간 분석을 위한 유전자 변형 동물 형광 성 융해 단백질의 생성을 설명합니다. 유전 접근의 예를 들어, 그것은 함수 이득 낭 성 운하 형을 수정 하도록 설계 된 시각적 RNAi 기반 상호 작용 스크린의 핵심 포인트를 강조 표시 합니다. 특정 방법을 설명 하는 방법: 레이블 및 형광 단백질; 표현 하 여 운하를 시각화 타겟된 RNAi 라이브러리를 구성 하 고 전략을 RNAi 운하 morphogenesis;의 분자 분석에 대 한 심사 시각적으로 고기;의 수정 평가 형광 현미경 검사 법;를 해 부하 여 점수 confocal 현미경 검사 법;에 의해 더 높은 해상도에서 subcellular 운하 구성 요소 특징 그리고 시각적 매개 변수를 측정. 방식은 확인 및 intracellular 루멘 phylogenetically 보존된 과정에 참여 하 고 단 세포 유전자에 대 한 선 충 C. 배설 채널의 활용에 관심이 있는 탐정에 대 한 유용 morphogenesis 튜브.
서문
모든 내부 장기의 튜브, 전송 및 가스, 액체 및 영양분의 교환 및 변화 낭비의 배설물 같은 그들의 여러 가지 기능에 대 한 중요 한 구성 됩니다. 그들의 편광된 캐릭터, 독특한 꼭대기와 lumenal 멤브레인과 이러한 특정 기능, 적응 하 고 결함 그들의 엔도-및 플라즈마 멤브레인 시스템의 속에는 인간의 질병1,2의 빈번한 원인이. 튜브는 맥 관 구조와 내부 장기의 대부분은 다세포 이며 intercellularly;는 루멘을 형성 그러나, 침 루멘을 형성, 단 세포 관, 수 예, 나타낼 만큼 인간의 모 세관 침대2의 30-50%. 비록 그들의 microdomains 튜브의 특정 기능 (예를 들어, 꼬마 장 microvilli 대 배설 운하 canaliculi에 따라 다를 수 있습니다 멀티-및 단 세포 튜브의 편광된 막 구성 면에서 유사 하다 선 충; C. 선 충 장 tubulogenesis 종이 동반 참조)3. 편광된 막 속 및 tubulogenesis의 원리는, metazoans 중 보존 하 고 유사한 분자 기계는 그들에 지시1,,24.
C. 선 충 배설 시스템 이루어져 5: 배설 셀 (EC), 덕트 세포 (DC), 셀 (PC)와 두 개의 선 셀 기 공. EC, DC 또는 PC의 절제는 바디 구멍에 한 초기 애벌레 단계5에서 동물 다 액체 축적을 발생합니다. 이 3 단 세포 관 글, 세 가지 방법으로 그들의 루멘을 만들: (EC)를 공동 화; 세포에 의해 셀 포장 결합 autocellular 접합 형성 (PC); 그리고 셀 배치 하 여 결합 autofusion (DC); 다른 메커니즘의 루멘 morphogenesis 모든 phylogenetically 보존된6,7입니다. EC, 후부 인 두 전구의 측면 왼쪽에 있는 밖으로 보내는 두 측면 확장 4 운하 anteriorly 확장 하는 확장에서 그리고 뒤로 (둘 다 오른쪽과 왼쪽 측면) 벌레의 코 및 꼬리의 끝에 각각 (그림 1)5,,68. EC에서에서 확장 약 1 µ m 2 x 1000 µ m, 동물에서 가장 큰 셀을 만들기. Subcellular 수준에 배설 채널 pseudocoelom, 향해 이동 하 고 lumenal 막 (endotube)에 의해 터널링 기저 막에서 생성 된 간단한 튜브입니다. 그것의 유일한 세포 접합;에서 덕트 lumenal 막에 연결 하는 운하 lumenal 막 운하는 그렇지 않으면 그들의 길이 (그림 1)에 따라 junctionless. 배설 운하 lumenal 막 및 그것의 submembraneous 골격 꼭대기 막의 조성과 소장, 같은 다세포 튜브의 submembraneous 골격 유사한 그들의 분자 구성에 의해 정의 된 꼭대기는 그리고 다른 (예를 들어, 평면) epithelia의. 세포질 세포, endosomal 나노미터 및 기타 (예, 골) endomembranes는 운하의 길이 따라 배포를 포함 하 여 또한, 여러 canalicular 소포-중 lumenal 막에 연결 된 상호 또는 절연-운하 세포질7,,89,10 통해 스레드는 . 이 동적 플라즈마 멤브레인/canalicular 연결 추가 채널의 막 시스템을 확장 하 고 모두 루멘 morphogenesis 및 osmoregulation10에 기여. 배설도 따라서 엔도-와 편광된 막 속의 분석 및 엔도-플라즈마 멤브레인 인터페이스의 규제에 대 한 훌륭한 모델을 제공 하는 플라즈마 세포 막의 거의 전적으로 구성 되어 있습니다. 이 단일 셀 시스템-루멘 확장명이 일치에서 운하 morphogenesis-동안 꼭대기 막의 극적인 확장 하실 수 있습니다을 안정 시키고 세포내 lumenal 막 센터는 필요에 의해 발생 하는 건축 문제를 분석 하 . 이 프로토콜에 초점을 맞추고 보다 직접 셀 움직임에서 EC의 위치를 생성 하는 신호 채널 튜브와 루멘의 구조 morphogenesis 및이 프로세스에 필요한 세포내 막 역동성의 분석에는 배설 체계 다른 세포 요소 (6에서검토) 그것의 복잡 한 연결을 구성 하 고.
편광된 막과 세포내 루멘 속의 분석에 대 한 선 충 C. 단일 셀 운하 시스템의 추가 이용은 개발 시간을 통해 그것의 막의 다른 구성 요소의 세대를 분리 하는 기능 그리고 접속점입니다. EC와 복 부 폐쇄의 시간에 태어난 ventro 옆 인 두의 중간 embryogenesis5,6,8, 동안 시간 측면 운하 확장 하 고 분기 발생 동안 침전. 이것은 늦은 embryogenesis, (그림 1) L1 애벌레 단계에 계속 하는 과정 동안 앞쪽 후부 운하 확장에 의해 선행 된다. 새로 부 화 애벌레, 후부 운하 끝에 도달 하면 벌레의 중간 약, 벌레8함께 elongates 완전히 확장 꼬리에 L1 무대의 끝에 어느 시간 후 운하. 그러나 따라서 동물의 성장을의 그것을 초과 하는 속도에서 활성 채널 성장 종료 첫 번째 애벌레 단계에서, 추가 성장 추가 애벌레 단계 (L2-4) 전체 동물의 성장과 동시에 발생 합니다. 이 설정은 드 노 보 편광 막 속의 편광된 세포 분열 또는 마이그레이션 독립의 다른 단계를 분석할 기회를 제공 한다. 또한, 접속점 (에서 발생 하는 루멘 개시 전에 배아);의 어셈블리에서이 프로세스의 분리 허용 막 분극에 그들의 정확한 요구 사항을 여전히 극성 필드에 오픈 질문 이다. 마지막으로, 그것은 고유 하 게 꼭대기 기저 막 확장, 배설 운하10전 앞 후자의 프로세스에서에서 분리 합니다. C. 선 충 배설 채널 모델은 따라서 편광된 막 속의 분석에 대 한 이러한 장점의 번호를 공유 하지만 다세포 설정 (참조 실행 장 모델에 특히 유익한 보완 함께 종이 장 tubulogenesis3에).
야생-타입 운하는이 작은 벌레의 ultrathin tubules, 비록 그들의 루멘 6 수 있습니다.이 투명 한 동물에 Nomarski 광학에 의해 직접 sualized. 사실, 돌연변이 낭 성 운하 형태학 레이블이 없는 동물 해 부 현미경, tubulogenesis11에 관련 된 유전자를 식별 하기 위해 앞으로 유전 스크린에 큰 효과를 사용 하는 낮은 확대를 사용 하 여 특징 수 있습니다. 그러나 향상 된 시각화 운하의 형태와 그들의 편광된 막, cytoskeletal 구성 요소, 다른 세포내 세포 및 다른 subcellular 구조의 구별의, 라벨링 요구 하 고 높은 형광등을 전원 해 고 confocal 현미경 검사 법입니다. 비록 운하 미세 구조 포즈 다양 한 라벨 및 현미경 검사 법에 대 한 어려움, 막 및 subcellular 구성 요소는 각 구획에 고유한 특정 분자를 통해 구별 될 수 있다 및 동물 안전 하 게 장착할 수 현미경에 대 한 경우 특정 아티팩트 ( 프로토콜 및 토론참조) 소개를 피하기 위해 주의. 라벨 immunohistochemistry 고정된 표본에 의해 또는 그들의 자신의 통제 형광 성 융해 단백질을 표현 하는 유전자 변형 벌레를 생성 하 여 수행할 수 있습니다 또는 vivo에서 화상 진 찰에 대 한 배설 운하 관련 발기인. 이 프로토콜 설명는 후자의 라벨 (동반 종이3를 얼룩이 지는 항 체에 대 한 장 tubulogenesis 참조).
결합 손실 또는 이득-의-기능 학문 vivo에서 vivo에서 이미징 단일 셀에서 분석 하는 능력 개발은 전체 선 충 C. 배설 운하는 분자에 대 한 특히 강한 모델 레벨 및 단 세포 tubulogenesis의 세포 분석입니다. 정방향 또는 역방향 유전 스크린 운하 morphogenesis 고기 (예를 들어, cysts)을 식별 하는 야생-타입 또는 레이블이 유전자 변형 동물 시작 수행할 수 있습니다 그리고 그들의 기본 유전자 결함. 또는, 이러한 화면 돌연변이 표현 형 (예, 낭 성 운하)로 시작 하 고 진압 또는 증강이이 형의 유전자 돌연변이 표현 형을 일으키는 기능적으로 상호 작용 하는 유전자를 식별 식별 수 있습니다. 돌연변이 체 표현 형을 일으키는 유전적 결함 (예를들면, 유전자 삭제 통해 ) 손실 또는 이득 일으킬 수 있다 (예를 들어,를 통해 활성화 돌연변이 또는 초과 유전자의 도입을 통해) 조사 기능. 앞으로 mutagenesis 또는 체계적인 RNAi 스크린 유전자 기능에 편견 없이 고 관심의 기능에 관련 된 유전자의 편견된 식별을 허용. 라이브러리를 수 유 하는 게놈 넓은 RNAi의 가용성을 감안할 때 거의 모든 유전자 수 수 쉽게 뜨 RNAi C. 선 충에 의해 그런 관심사의 어떤 단일 유전자 또는 유전자 (예를 들어, 대상된 화면에서)의 어떤 그룹 수 있습니다 또한 신속 하 게 찾는 것 대 한 반전 유전학 접근에 그들의 효과. 접근의 가능한 조합을 보여, 우리 여기 설명 대상된 RNAi 상호 작용 화면 기능 이득 낭 성 배설 운하 돌연변이로 시작 세포질 운하 녹색 형광 단백질 (GFP)으로 표시. 돌연변이 형 음-1, 높은 보존된 C. 선 충 의 overexpression에 의해 생성 된 막 걸 링커 가족 Ezrin-Radixin-Moesin (ERM), 루멘 morphogenesis 및 막에 연루 되어 있는의 ortholog 많은 종12조직입니다. C. 선 충 음 1 배설 운하 등 소장, 내부 장기의 lumenal 막 localizes 및 두13루멘 형성에 대 한 필요 합니다. 음-1 overexpression 초과 말라와 루멘에 플럭스를 증가 하 고 짧은 낭 운하와 두꺼워 말라 undercoat9방해 lumenal 막 생성의 운하 lumenal 막에 소포를 보충 한다. 프로토콜 융합 단백질 (또는 다른 단백질); 운하 표현 배설와 유전자 변형 종자를 생성 하는 방법을 설명 합니다. 타겟된 RNAi 스크린 운하 형;의 한정자를 식별 하기 위해 이러한 긴장 시작을 수행 하는 방법 그리고 시각적으로 형광 해 고 confocal 현미경 검사 법, 유익한 tubulogenesis 고기를 계량 하는 간단한 방법을 포함 하 여 이러한 스크린의 결과 분석 하는 방법. 대체 기술 및 RNAi, 종종 치명적인 tubulogenesis 유전자 조정의 세부 사항 라벨 장 tubulogenesis3에 동반 종이에서 찾을 수 있습니다. 모든 메서드는 채널 tubulogenesis에 다른 질문의 조사에 대 한 다양 한 조합에 사용할 수 있습니다.
프로토콜
1. 형광 성 융해 단백질 14 C. 선 충 Excretory 운하 라벨
참고: 장 tubulogenesis에 함께 종이 참조 3 현장에서 항 체 절차를 배설 운하에 얼룩으로 라벨에 대 한. C. 선 충 배설 운하 엔도-및 플라즈마 막, 발기인 배설도 운전 하는 식의 예제를 보려면 표 2를 시각화 하는 데 유용 하 게 입증 하는 분자의 예제를 보려면 표 1을 참조 하 고 표 3 마커 및 발기인의 더 포괄적인 컬렉션에 대 한 리소스에 대 한 다른 fluorophores의 선택에 대해 참조를 포함 하 여.
- 제한 효소에 의해 조직의 특정 형광 성 감 적 플라스 미드의 건설 기반 복제 15
참고: 건설의 대체 기술에 대 한 토론을 참조 하십시오 형광 성 융해 단백질입니다. - 식별 (transcriptional 융해)에 대 한 발기인의 또는 WormBase 44 (변환 융해)에 대 한 그것의 발기인과 함께 관심의 전체 유전자의 순서
- .
- (변환 융해)에 대 한 모터와 발기인 (transcriptional 융해)에 대 한 전체 유전자의 증폭에 대 한 정방향 및 역방향 뇌관 디자인. 5 제한 효소 링커 추가 ’와 3 ’ 뇌관의 끝.
참고: 벡터 (예, pPD95.79) 플라스 미드 16에 존재 하는 제한 효소를 선택 합니다. 변환 융해, 3에 대 한 ’ 링커 금지 효소 소화는 벡터와 결 찰 후에, 삽입 codon 프레임 fluorophore, 예를 들어, GFP의 codons와 연속 될 것입니다 설계 한다. 하나 일반적인 제한 효소 링커 14; 1 또는 2 더 많은 기지를 추가 해야 할 수도 있습니다. 정지 codon를 만드는 것이 아니라 돌. - 수행 중 합 효소 연쇄 반응 (PCR) 발기인 또는 템플릿 15 라이브 웜 또는 야생-타입 게놈 DNA 또는 cDNA를 사용 하 여 전체 길이 유전자 증폭.
참고: 벌레 서식 파일을 사용할 때 먼저 세포의 용 해 버퍼 (PCR 버퍼 플러스 성분을 K) 17에 벌레를 lyse. 혼합된 단계 벌레 서식 파일로 사용할 수 있습니다. 굶 어 웜 세균성 DNA로 오염 방지를 사용할 수 있습니다. - (1%) 수행 agarose 젤 전기 이동 법 증폭된 제품의 정확한 크기를 확인 하기 위해 PCR 제품에.
참고: 밴드 크기가 올바른 경우 다음 단계로 진행 합니다. 여러 밴드 생성 되는 경우 단일 밴드를 생산 하는 증폭 조건을 향상. 이 작동 하지 않으면, 젤에서 올바른 밴드를 잘라 하 고 표준 방법 15 DNA를 정화 하 고 다음 다음 단계로 진행. - PCR 제품 및 표준 방법 15에 의해 별도 튜브에 fluorophore (예, pPD95.79)를 포함 하는 벡터 플라스 미드에 수행 금지 다이제스트.
- 소화 DNAs 젤 전기 이동 법으로 분리 하 고 PCR 제품을 elute 별도 튜브에 DNA 밴드 벡터.
- 표준 방법 15 젤 조각에서 DNAs를 정화. 분 광 광도 계에 의해 DNA 농도 측정.
- PCR 제품 선 및 표준 방법으로 DNA 벡터 및 유능한 세포에 표준 방법 15에 의해 하는 재조합 DNAs 변환.
- 확산 10 μ, 50 μ, 50 μ g/mL 암 피 실린 보충 하는 3 개의 개별 Luria 국물 (파운드) 접시에 변환 된 셀의 100 μ.
참고: 다른 양의 셀 변환 효율의 스펙트럼에 대 한 다른 접시에 확산. 예를 들어, 너무 조밀 하 게 도금 수 있습니다 허용 하지 식민지의 경우 변환 효율. - 하룻밤 37 ° C에서 접시를 품 어. 다음날 아침, 인큐베이터에서 번호판 꺼내.
참고: 식민지 매우 작은 경우에, 품 어 몇 시간 더. - 준비 플라스 미드 DNAs 표준 방법 15 단일 식민지에서. 서식 파일 DNA 및 뇌관을 혼합 하 고 시퀀싱 (핵심 서비스 센터에서 일반적으로 수행 됩니다) 발송.
- 시퀀스 읽었고 융해 구성의 무결성을 확인.
참고: 중요: 사이 삽입 된 유전자와 형광 마커 진 번역 융해에 대 한 정확한 codon 프레임을 확인. 이상적으로, 아무 돌연변이 PCR 및 결 찰 절차 동안 도입 된 것인지 전체 유전자 시퀀싱. - 생성 더 많은 플라스 미드 DNA (를 사용 하 여 단계 1.1.11) 주입 단계 1.2.
참고: 약 1, 발기인에 대 한 – 3 kilobase (kb)는 대부분 C. 선 충 유전자에 대 한 충분 한. 변환 융해 단백질 또한 배설 운하 특정 발기인에서 관심사의 유전자를 삽입 하 여 건설할 수 있다 (표 2 참조). - (변환 융해)에 대 한 모터와 발기인 (transcriptional 융해)에 대 한 전체 유전자의 증폭에 대 한 정방향 및 역방향 뇌관 디자인. 5 제한 효소 링커 추가 ’와 3 ’ 뇌관의 끝.
- 생식 변환에 대 한 DNA의 microinjection에 의해 유전자 변형 동물의 세대 18
참고: transgenes 도입에 대 한 대체 기술에 대 한 설명을 참조 하십시오. 개요 절차는 유전자 변형 동물 형광 융해 단백질 또는 관심의 다른 단백질을 생성 하기 위해 사용할 수 있습니다. 예를 들어, 외 인 단백질은 새로 도입 된 (예를 들어, 분리 ortholog) 수 또는 생 단백질을 재 (예: 구조 대는 해당 생식 돌연변이) 또는 표현 형 (예를 들어, 사출 생성 하 overexpressed 수 있습니다. 음-1의 사용 되었다 수정에 대 한 대상 역할 overexpression 낭 성 운하 표현 형을 생성 하 RNAi 상호 작용 화면 아래에서 설명).- 믹스 구조 DNA (1 – 50 ng/μ) 마커 플라스 미드 DNA (일반적으로 100 ng/μ), 예를 들어 지배적인 마커 rol-6 (su1006)와 (1.2.3 표식 옵션에 대 한 참조).
참고: 중요: 주입 된 DNA의 농도 때 artefactual 고기 (cysts, 확장 결함, 치 사 율)의 소개를 피하기 위해 실험적으로 결정 되어야 합니다은 특히 배설 운하에서 유전자 표현 transgenes의 표현에 민감 하다. 하나 만들 수 있습니다, 예를 들어, 플라스 미드의 여러 혼합물 1 ng/μ, 10 ng/μ, 50 ng/μ, 100 ng/μ rol-6(su1006)와 100 ng/μ의 농도 가능한 스트레인의 세대에 대 한 농도의 범위를 테스트 하는 원하는 식 또는 표현 형 (높은 농도 비 특히 운하 morphogenesis에 독성이 있을 가능성이 있으며 치명적인 수 있습니다). - 0.22 μ m (마이크로미터) 기 공 크기 스핀-x 원심 분리기 튜브 필터를 통해 DNA 혼합물을 필터링.
참고: 열어 놓지 마십시오 튜브의 뚜껑을 microinjection 바늘을 차단할 수 있는 먼지를 피하기 위해. - 생식 변환에 대 한 표준 방법으로 야생-타입 또는 돌연변이 벌레의 생식으로 재조합 플라스 미드 microinject (절차 세부 사항에 대 한 참조 18 참조).
참고: 표준 마커 플라스 미드는, 예를 들면: rol-6(su1006), dpy 20, unc-119, pha-1. Rol-6(su1006) 같은 지배적인 transgenes는 구출 transgenes는 그들의 각각 돌연변이로 소개 하는 반면 야생 타입 웜에 소개 된다. 표식 plasmids 공동 유전자 변형 라인의 쉬운 유지 보수를 위해 삽입 된 extrachromosomal transgenes는 세포 분열 동안 임의로 손실 이후 (1.2.8 참조). Fluorophore 융해에 대 한 인코딩을 하는 유전자를 주입 때 하나 사용할 수 있습니다 또한 fluorophore, GFP, 표식으로 자체. rol 6 유도 morphogenesis 고기의 평가 대 한 유리한 자주는 주위 롤 웜. - 대장균에 주입 하는 전송 웜 시드 선 충 류 성장 매체 (NGM) 플레이트 (예를 들어, 5 웜/접시) (참조 19 표준 C. 선 충에 대 한 참조 문화 및 유지 보수 절차 및 자료의 테이블).
- 자손 3 약 20 ° C에서 개발 하 고 번호판을 품 어 라.
- 는 Rol (롤링) 벌레 (또는 어떤 다른 특정 주입 마커, 예를 들어, GFP) 해 현미경 F1 자손을 검토 하 고 롤러 t 선택o 개별 번호판.
- F2 동물으로 접시를 선택 하 고 해 형광 현미경으로 형광의 존재를 확인 (일반적으로 모든 롤러 동물은 GFP 긍정적인).
참고: F2 롤러 유전자 변형 라인의 성공적인 세대를 나타냅니다. 개별 줄 수 있습니다, 예를 들어, transgene 전송 속도 관련. 그것은 따라서 유지 하 고 여러 라인을 저장 하는 데 유용. - 마커 양성 동물에 대 한 새로운 번호판을 풍부 하 게 하 여 유전자 변형 라인 유지.
참고: 삽입 된 DNA extrachromosomal 배열에서 생식에 통합 됩니다. Extrachromosomal 배열에 대 한 전송 속도 일반적으로 약 50%만 변수. 긴장을 잃고 하지, 그것은 수동으로 지배적인 마커 (예를 들면, 부정적인 선택에 의해 보안 되지 라인) 라인을 풍부 하 게 하는 중요 한 따라서. - -80 ° C 19에서 장기 저장을 위한 표준 냉동 기술에 의해 유전자 변형 라인 동결.
참고: Transgenes extrachromosomal 배열에도 통합 될 수 있는 생식으로 동질적인 라인 18를 추가 단계에서 UV 방사선에 의해. 예를 들어 음 1 음 1 + [+] 스트레인을 UV 방사선에 의해는 생식에 통합 되었다 fgIs2[erm-1p::erm-1;rol-6p::rol-6(su1006)] 모든 동물 transgene, RNAi 기반에 그것의 사용에 대 한 요구를 전달 하는 곳 상호 작용 화면 아래에서 설명 합니다. 이 긴장 또한 vha-1 p를 포함 하는 스트레인에 교차점을 통해 세포질 배설 운하 GFP에 의해 분류 되었다:: GFP transgene (동일한 절차에 의해 생성 된 위에서 설명한 대로, 기본 유전에 대 한 참조 20 참조 십자가 등 절차) 음-1 [+ +]; 라고 vha-1 p:: GFP 스트레인 아래.
- 믹스 구조 DNA (1 – 50 ng/μ) 마커 플라스 미드 DNA (일반적으로 100 ng/μ), 예를 들어 지배적인 마커 rol-6 (su1006)와 (1.2.3 표식 옵션에 대 한 참조).
2. RNAi 라이브러리 대상 및 운하 형을 수정 하는 RNAi 상호 작용 화면의 디자인
참고: 타겟된 RNAi 기반 유전자 상호 작용 화면 overexpression 낭 성 운하 형을 사용 하 여 설명 배설 작용에 대 한 검색 morphogenesis 유전자 운하. 음-1 + [+] 스트레인 (단계 1.2.9 참조) 예제 9 역할을 합니다. 이 이렇게 배설 운하 루멘 morphogenesis의 유전 분석을 위한 많은 가능한 방법의 한을 선물 한다 (다른 유전 접근에 대 한 소개 및 토론 참조). 함께 종이 장 tubulogenesis 3 및 참조 17 , , 21 22 RNAi, RNAi의 세부 사항에 대 한 배경 참조 절차, RNAi 강도 (종종 치명적인 tubulogenesis 유전자를 조정)의 변조 및 기술적인 문제의 토론 RNAi에 연결. 참조 표준 웜 문화 및 유지 보수, 자료의 테이블에 대 한 참조 19.
- 음-1 (또는 관심의 다른 유전자)에 대 한 검색 데이터베이스와 게시 된 기사에 있는 상호 작용 분자.
참고: 잠재적인 음-1 인터 실험적 기능, 유전자, 또는 물리적으로 어떤 종에서 음 단백질 상호 작용을 표시 했다 또는 어떤 철에, 높은 처리량에서 예측 했다 모든 분자 포함 또는 시스템 생물학 접근 (데이터베이스 및 리소스의 예 표 3 참조). - 모든 유전자의 목록을 생성 하 고 찾을 C. 선 충 homologs 필요한.
참고: 보십시오 유전자 클래스, 관심사의 유전자의 기능을 고려 하 고 인터 식별에 대 한 그물을 넓혀에 확인 된 유전자의 목록을 확장 (예를 들어, 막 걸 링커 음-1에 대 한 모든 actins을 선택 하 고 말라 관련 분자). - 식별 해당 RNAi 모든 유전자에 대 한 상업적으로 사용 가능한 게놈 넓은 세균성 RNAi 라이브러리에서 클론 먹이 세균 (예를 들어, Ahringer 게놈 C. 선 충 RNAi 라이브러리 21 먹이; 자료의 테이블)
- 잘 번호 해당 RNAi 접시와 그들의 모든 유전자에 대 한 스프레드시트를 생성.
- RNAi 클론 50 LB/암 피 실린/항생물질 접시 (항생제의 선택은 라이브러리 구조에 의해 결정 됩니다) 하루에 줄무늬가 있고 RNAi 라이브러리 생성 대상으로 될 때까지 계속 선택.
참고: 라이브러리 크기에 따라 예상된 워크플로, 전체 라이브러리를 생성을 생략 하 고 직접 배치 분석 진행. 플레이트 4 ° C에서, 약 2 주 (필요한 경우, 그 후 새로운 접시에 다시 행진) 보다는 더 이상 저장할 수 없습니다. 반대로, 하나-80에 긴 기간 저장에 대 한 복제 96 잘 또는 384-잘 형태로 큰 냉동된 라이브러리를 생성할 수 있습니다 ° c. - 하룻밤 37 ° C에서 접시를 품 어. 다음날 아침, 4에서 인큐베이터와 저장소에서 번호판을 제거 ° c.
- 선택 RNAi 박테리아 살 균 이쑤시개로 접시에서 혼합 박테리아 600 μ 1.5 mL microtube에 LB/암 피 실린 (50 ng/μ) 국물, 37 ° C에서 튜브를 품 어, 6 헤 대 한 동요
참고:는 microtube의 측면을 따라 선택 (이 쑤 시 게 또는 micropipette 팁)을 문 지르고 하 여 국물에 RNAi 박테리아를 예방. - 씨 70 μ 중복 되거나 triplicate 세트에서 6-잘 RNAi 플레이트의 각 음에 박테리아를 배양. 22 ° C에서 RNAi 접시를 밤새 품 어.
참고: RNAi 접시 표준 절차 (테이블의 자료 및 참조 3 , , 17 21)에 의해 생성 되며, 여기 6 잘 조직에 운하 morphogenesis 접시에 살아있는 동물에서의 미세한 평가 대 한 허용 하는 더 높은 처리량 접근 방식에 대 한 문화 플레이트 형식. - 다음 아침, 선택 3 L4 단계 음-1 [+ +]; vha-1 p:: GFP RNAi 플레이트의 각 음에 벌레.
- 먼저 RNAi 방해 하는 (참조 19 참조) OP50 박테리아와 오염을 피하기 위하여
- 박테리아 없이 NGM 접시에 벌레 씨 고 약 10 분에 대 한 크롤 링 하는 동물. 만 비 굶 어 건강 한 동물을 사용.
- 자손을 생산 하는 동물을 허용 하는 3 d 22 ° C에서 번호판을 품 어.
- F1 자손 해 형광 현미경에서 검사 운하 고기.
3. Vivo에서 C. 선 충 Excretory 운하 형광 해 부 현미경 검사 법 그리고 Tubulogenesis 고기의 점수에 의해 이미징
- 준비 형 채 점 시트 (표 4에 표시 된 예제와 그림 5 ).
- 장소 바로 형광 dissectin 아래 벌레와 함께 한 천 배지g 현미경, 평가, 접시의 오픈 뚜껑 사용 초점을 더 낮은 확대.
참고:이 프로토콜 1.5 X와 10 배 목표와 3.5에서 45 (자료 테이블)의 확대/축소 범위는 범위 사용에 설명 합니다. - 잘 별도로 각각에 초점을 맞추고, 잘 1부터 시작 하 여 동물을 평가 하 고 접시에 아래로 일.
참고: 항상 컨트롤의 평가 함께 시작 합니다. 예를 들어, mock (빈 벡터) 컨트롤 (HT115 RNAi 박테리아 (참조 참조 17 , 21) 없이 또는 비관련된 유전자 삽입) 부정 및 긍정적인 적절 한 제어 하는, 예를 들어에서 이 상호 작용 화면, 음-1 (음-1 + [+] 형 억제) 하는 RNAi 및 sma-1 / spectrin RNAi (음-1 + [+] 운하 형 강화). - 먼저, 검사 일반 고기 밝은 빛 아래에서 볼 수 (예: 하자/치명적인, Clr/지우기, Emb/배아 치명적인, Ste/살 균, Unc/uncoordinated, Dpy/땅 딸 보, 등), 동물 및 수의 총 수를 계산 하 여 표현 형을 계량 표현 형을 가진 동물의 기록 번호 (표 4 참조).
참고: 운하 고기 (예, Emb, Ste)의 평가 영향을 미칠 수 있습니다 결함을 일으키는 유전자의 knockdowns 고려 조건으로 실험을 반복, 게시물 배아 RNAi (참조 절차 3 종이 동반 ). - 둘째, 형광 조명 아래에서 배설 운하 고기 검사, 같지는 고기 (예, 운하의 길이, 루멘, cysts의 폭) 점수, 숫자를 기록 및 채 점 시트에 고기를 설명 (표 4, 참조 하십시오 강력한 클래스 "xfig" = > 그림 5).
참고: 높은 확대 범위 확대와 더 많은 미묘한 운하 고기 평가 하 필요 합니다. 낮은 확대 신중 하 게 평가 하는 운하 사이 앞뒤로 이동 ’ s 길이 폭 및 다른 운하 morphogenesis 표현 형. 부 량 또는 간단한 고기의 반 정량화, 포함 100 동물 (예를 들어이 타겟된 RNAi 스크린에 L4s; 고기: 채널 1/4, 1/2, 3/4의 길이 및 전체 후부 운하의 확장 및 후부 운하의 루멘 직경 작은 cysts (< 동물 폭의 1/3), 큰 cysts (> 동물 폭의 1/3); 표 4 참조). - 현미경에 의해 적어도 3 다른 동물에서 주된 고기의 취득 이미지 탑재 디지털 전 하 결합 소자 (CCD) 카메라와 해당 이미징 소프트웨어 (재료의 표 참조)
- 이미지, 먼저 카메라에, 연결 된 컴퓨터를 켜고, 이미지 캡처 소프트웨어 아이콘 더블 클릭, 낮은 배율에서 수동으로 벌레 플레이트의 영역을 집중 하 고 켜십시오 카메라 셔터.
- 클릭는 “ 실시간 미리 보기 ” 화면에 벌레를 시각화 명확 하 게 클릭을 수동으로 초점을 조정 하는 아이콘의 컴퓨터 화면에 벌레를 시각화 하기 위해 컴퓨터 화면에 이미지 캡처 소프트웨어는 “ 스냅 ” 아이콘, 다음 클릭에 “ 저장 ” 아이콘.
참고: 동물 형광 조명 아래에서 빠르게 이동 됩니다 따라서 계속 한 손으로 컴퓨터 마우스에 준비 접시는 다른 한 손으로 관심의 영역으로 이동 하는 동안. 즉시 클릭 합니다 “ 스냅 ” 아이콘 이미지를 얻으려고. 그것은 일반적으로 몇 가지 시도와 좋은 이미지를 획득 가능. - 적절 한 파일 이름으로 획득된 이미지 저장 (스트레인 이름, RNAi 클론 이름 및 날짜 포함).
참고: 얇고 긴 운하와 함께 빠르게 움직이는 야생-타입 벌레는 돌연변이 보다 이미지를 더 어렵습니다. 낭 성 운하 또는 다른 고기 돌연변이 이미징 촉진 천천히, 가능성이 있다. Rol 같은 플라스 미드 마커 수 이미징에 대 한 동물을 유지 하 여 “ 자리에 ” 보다는 이동 앞으로, 동물 자체에 주위 압 연과 표현 형에 있는 향상 된 보기를 제공할 수 있습니다.
4. C. 선 충 Excretory 운하 Confocal 레이저 스캐닝 현미경으로 높은 해상도 영상
면봉의 끝에 또는의 끝에- 기름 또는 석유 젤리의 작은 금액을 놓고
- 살아있는 동물을 장착 합니다 손가락을 확산의 직경을 가진 ultrathin 원을 생성 하 그리스 ~ 6 – 깨끗 한 유리 슬라이드 중간 8 m m.
- 장소 6 μ 5 %lidocaine 솔루션 (마 취)는 micropipette에 의해 동그라미로.
참고: lidocaine 재고 솔루션 lidocaine 가루 물에 용 해 하 여 만들 수 있습니다. M9 버퍼 19 (자료 테이블) 5%로 희석. 그것은 일반적인 동원 정지 솔루션 (예: 나트륨 아 지 드) 파열 cysts 원인과 그 운하 고기 유도 피하기 위해 배설 채널의 분석에 대 한 중요. - RNAi 접시에서 여러 가지 동물을 선택 하 고 솔루션으로 웜 선택 19 immerging 여 lidocaine 솔루션으로 그들을 배치.
참고: 선호 단계 특정 동물을 균일 한 두께 여도 장착을 용이 하 게 합니다를 선택 합니다. 동물 해 형광 현미경에 미리 선택 되어 있습니다. - 유리 슬라이드에 22 x 22 mm coverslip 장소; 부드럽게 그리스 원에 정착 하자.
참고: coverslip 운하 형태학, 특히 돌연변이 또는 운하와 가능 하 게 다른 고기 취급 RNAi 웜 손상 될 수 있습니다 어떤에 어떤 물리적 압력을 적용 되지 않습니다. 그것을 피하기 위해 두꺼운 그리스 원; 따라서 중요 한은 이상적으로 동물은 부드럽게 사이 끼여 유리 슬라이드와 커버 슬립. - 젖 빛 유리 슬라이드에 샘플의 이름을 작성합니다. 바로 운하 형의 및 이미지 분석을 위한 공초점 현미경 슬라이드를.
참고: 지연 운하 cysts의 손상 될 수 있습니다 또는 운하 루멘 형태학 변화.
- 시스템적 confocal 이미지
- 슬라이드 confocal 현미경의 샘플 단계에, 초점을 낮은 확대율 (10 배)에서 웜. 60 X / 100 X 목표 아래 보기와 선택
- 동물 검사 배설 운하 ’ s 세포 및 subcellular 고기, 예, 루멘 모양 및 직경, 크기와 모양 cysts; 또는 subcellular 구성 요소 분석, 대 한 분류의 예를 들어, 꼭대기/lumenal 막, 기저 막, 세포질, endosomal canalicular 소포 대, 다른 세포 (토론, 그림 2 및 그림 4 참조).
- 관심의 특정 표현 형의 취득 이미지.
참고:이 프로토콜 검사 confocal 현미경 (자료 테이블) 레이저의 사용을 설명 합니다. 얇은 선 충 C. subcellular 구성 요소를 해결 하기 위해 배설 운하, 더 높은 확대 목표 (100 X 60 X)이 필요 합니다. 회전 디스크 confocal 현미경 시간 경과 이미지를 사용할 수 있지만 적은 confocality를 제공 합니다 (내용 참조).- Confocal 이미지를 수집 하는 컴퓨터를 켜고, confocal 현미경 소프트웨어를 두 번 클릭 하 고 특정 레이저 아이콘 클릭 하 여 레이저를 선택.
- 클릭은 “ 스캔 ” 아이콘 컴퓨터 화면에 초점 맞춘된 웜 시각화을 통해 레이저 강도 조정 합니다 소프트웨어, 그리고 다시 클릭 “ 스캔 ” 아이콘 검색을 중지 한 후 클릭을 “ 캡처 ” 아이콘 이미지를 다음에 클릭을 “ 저장 ” 아이콘.
- 적절 한 파일 이름으로 이미지를 저장 하 고 RNAi 복제 이름, 날짜, 스트레인 이름 등.
참고: 이미지는 단일 및 여러 섹션으로 취득 될 수 있다 (예를 들어, 10 – z 축 따라 15 섹션). 단면화 3D 시각화 수 있습니다. 투영 이미지 고 (현미경)에 따라 필요한 경우 별도로 저장 합니다. 최적 해상도 대 한 설정을 사용 하 여 레이저 낮은 이득, 작은 구멍을 너무 많이, 열 없고 여러 이미지 당 평균 추가 (참조에 대 한 일반적인 내용은 confocal 영상 23 , 24 참조). (가급적 사용 수정 되지 않은 이미지) 필요한 경우 이미징 소프트웨어에 의해 수정에 대 한 있도록 채도 수준 아래 밝기에서의 이미지 처리. - 의 더블-이미지 또는 여러 레이저 아이콘을 클릭 하 여 같은 방식으로 레이블된 운하 (예: 녹색, 빨강, 그리고 파랑)를 곱하면 하지만 채널 (공동 지역화 연구에 대 한 중요 한) 사이 도련 통해 피하려고 순차적 검색 사용.
참고: 하나 고려 (이 또한 결과에 해당 사진 표백 증가)를 순차적으로 검색 하는 데 필요한 시간 및 스캐너 설정을 수정 해야 합니다. 채널 형태에 난다 효과 방지 하려면 최대 30 분 이상에 대 한 하나의 슬라이드에서 동물을 검색 하지 않습니다. 더 이상 검색 하는 것이 필요한 경우 새 슬라이드를 탑재. - 취득 해당 미분 간섭 광학 (DIC) Nomarski 이미지, 측정 하는 경우에 특히 운하 길이 루멘 직경 벌레에 관하여 / ’ s 몸 길이 직경. 클릭 하 여 오버레이 형광 및 Nomarski 이미지 “ 오버레이 ” 랜드마크를 보여주는 아이콘 ( 그림 1D 및 그림 4A – D).
- 정량화를 위한 ImageJ 소프트웨어 25 ( 그림 5C) 관심의 표시 구성의 형광 강도 측정.
결과
이 프로토콜에는 시각과 분자로 분석 단 세포 tubulogenesis 및 단일 셀에서 세포내 루멘 morphogenesis C. 선 충 배설 운하를 사용 하는 방법을 설명 합니다. 성인 기 중반 embryogenesis의 시간에서 그들의 확장, 동안 4 개의 배설 운하 그들의 basolateral 및 그들의 canalicular 및 endosomal endomembrane 시스템을 제공 하는 독특한 모델을 함께 꼭대기/lumenal 막 확장 계속 드 노 보 의 비보에 분석 편광 막 속 (그림 1). 꼭대기 막 같은 subcellular 구성 요소, 세포질, 및 endosomal canalicular 소포 대 특정 형광 성 융해 단백질 (프로토콜 섹션 1에서에서 설명), 표현 하 여 구상 될 수 있다 그리고 그들은 서로 의해 구별 될 수 있다 더블 또는 트리플 (그림 2) 단일 유전자 변형 동물에 라벨. 꼭대기 멤브레인 관련 분자 (음-1), overexpressing에 의해 생성 된 고유 배설 운하 형 (그림 3A-B) 꼭대기 막에 작용 하는 유전자를 식별 하는 대상된 RNAi 화면 수행 하는 방법을 보여 주기 위해 사용 하 고 루멘 속; 이이 모델 (프로토콜 섹션 2에서에서 설명)에서 편광된 막 속의 분자 및 시각적 분석의 예를 들어 역할을 합니다. 이 음-1 + [+] 운하 형 형광 현미경 검사 법 (프로토콜 섹션 3에서에서 설명)을 해 부에 의해 시각적으로 평가 하 고 점수 억제 (그림 3C– D) 방법과 향상 (그림 3E-F)을 보여 주기 위해 사용 됩니다. . 음-1 레벨의 변조에 의해 유도 된 운하 고기 (프로토콜 섹션 4에서에서 설명), confocal 현미경 검사 법 (그림 4)에 의해 subcellular 수준에서 결함을 해결 하는 방법 및 간단한 운하 고기 (운하 길이 및 낭종을 계량 하는 방법 제공 크기) 및 꼭대기 막 속 결함 (그림 5).
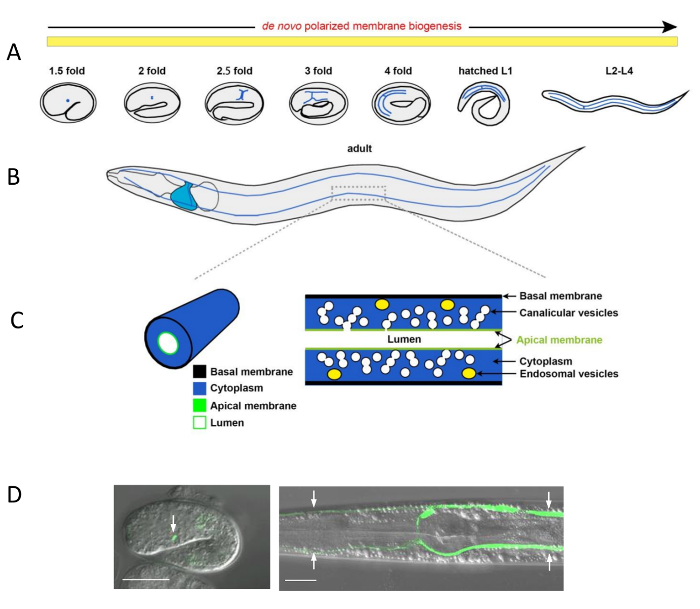
그림 1 : C. 선 충 Excretory 운하 및 Subcellular 운하 구조 morphogenesis
(A) 도식 표현 배설 운하 확장 (블루 라인)의 배아와 유 충의 개발 중입니다. 배설 셀 (표시 되지 않음) 태아의 쉼표 단계에서 인 두 후부 전구의 ventro 옆 왼쪽에 최종 위치에 도달 합니다. 먼저 왼쪽과 오른쪽; 쪽으로 옆으로 두 팔 태아 elongates로 확장 다음 각 팔 앞쪽 및 후부 분기에 분기. 이 앞쪽에 및 사후 가지 추가 확장 4 개의 애벌레 단계 동안 동물의 신장를 통해 먼저 잡고 L2 단계에서 동물의 성장 후 성인 기까지 더 성장, 동반. 드 노 보 편광 막 속 성인 기까지이 확장을 지원 합니다. (B) 성인 동물에서 앞쪽 운하 지점 도달 코 끝 및 후부 분기 꼬리 (블루 라인). 배설 셀 시체 (파란색) 후부 인 두 구 근처에 표시 됩니다. 편광된 막 도메인 성인 기 동안 유지 됩니다. (C) 운하 팔 섹션의 확대. 왼쪽: 운하 쇼의 3 차원 보기: 기저 막 (검정), (파란색), 세포질 lumenal 막 (녹색) 및 (흰색) 루멘. 오른쪽: 내부는 운하와 그것의 세포 막의 보기: 기저 막 (검정), (파란색) 세포질, endosomes (노란색 타원), canalicular 소포 (백색 분야, 각각 다른, 루멘에 연결 또는 분리를 연결 된 단일 vesicles), 꼭대기 막 (녹색) 그리고 (흰색) 루멘입니다. 배아에 배설 셀 및 배설 운하에 의해 분류, 유 충의 (D) Confocal/DIC 오버레이 현미경 세포질 GFP 대 lumenal 각각. 왼쪽된 이미지: 꼭대기 음- 음-1 발기인 아래 1::GFP을 표현 하 여 시각 운하 루멘과 1.5-fold 배아에 배설 셀 (녹색 화살표). 오른쪽 이미지: 배설 4 분기 (녹색 화살표) L3 유 충, 세포질 vha-1 p시각에서 채널:: GFP. 바 규모 = 20 μ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 2 : 이중 라벨 형광 성 융해 단백질 Subcellular 구성 요소 야생-타입 배설 운하 팔 시각화
(A)은 꼭대기 막에서 세포질을 구별. Sulp-5 발기인에서 GFP의 표현을 시각화 운하 세포질 (녹색 위); 그것의 자신의 발기인 아래 음-1::mCherry의 식 시각화 꼭대기 막 (빨강, 중간); 세포질과 것 이다 그렇지 않으면 구별할 수 높은 배율 에서도 단일 라벨 꼭대기 막 구분이 이미지 (아래)를 병합 합니다. 눈금 막대 5 μ m를 =. Endosomal 소포 루멘에의 공간적 관계를 결정 하는 (B) . 꼭대기 멤브레인 관련 GFP 융해 단백질 (의사 빨강, 위쪽 색깔);에 의해 루멘의 시각화 mCherry::RAB-7 (의사 파랑, 중간 색깔);를 표현 하 여 endosomal vesicles의 시각화 이러한 이미지 (아래)를 병합 루멘을 endosomal vesicles의 상대적인 공간 위치를 보여 줍니다. 눈금 막대 5 μ m를 =. (C, D) 다른 배율에서 subcellular 운하 구성 요소 대 해결 운하 튜브 모양. L1 유 충의 세포질 aqp 8 발기인 아래 물 채널 AQP 8::mCherry 표현 하 여 sulp-5 발기인 및 세포질 canalicular 소포에서 GFP를 표현 하 여 표시 됩니다. (C) 이미지 낮은 확대율에서 인수 단계 특정 varicosities (varicosities는 canalicular 소포 및 채널 성장에 필요한 다른 구성 요소에서 풍부한 저수지), 해당 "구슬-에-한-문자열" 패턴을 해결 하지만 세포질 AQP-8 puncta 해결 되지. (D) 높은 확대에 인수 하는 이미지 해결 운하 세포질에서 AQP-8 puncta canalicular 소포에 해당. 스케일 바: 20 μ m c에서와 D.에 5 μ m 모든 패널 표시 10-15 섹션의 confocal 계획. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 3 : 강화 및 억압 점수낭 성 운하 형 (해 부 현미경 검사 법에 의해 ERM-1[++])의 s
(A) 음-1 [+ +]; rol-6(su1006) 배설 운하 vha-1 발기인에서 GFP를 표현 하 여 시각화 됩니다. 외 음부까지 후부 운하 확장 또는 동물의 중간 (화살표; 1/2로 간주) 낮은 배율 (1.5 X 목표와 낮은 확대/축소)에. (B) 높은 확대에 서명 음-1 + [+] 작은 낭 성 방해 운하 해결 될 수, 후부 운하 (작은 화살표로 표시 한 arm)의 끝으로 약간 넘어 또는 외 음부에까지 확장 (산 문; 큰 화살표로 표시 된 채널 패널 D 루멘 여겨질 수 있다 비교에 대 한 야생 유형으로). (C) 억제, 낮은 배율: RNAi에 길쭉한 및 얇은 운하 음-1 + [+] 동물을 취급. (D) 높은 확대, 후부 운하 볼 수 있다 (작은 화살표; 패널 B 에서처럼 부모 동물의 비교); 꼬리를 거의 완벽 하 게 확장 큰 화살표는 외 음부의 위치를 나타냅니다. (E) 향상: RNAi에 큰 cysts로 더 단축된 운하 치료 음-1 + [+] 동물; 낮은 확대, 아니 줌. (F) 더 높은 확대, 후부 운하 확장 미만 1/2 (작은 화살표)으로 결정 하거나 수 산 문 (큰 화살표로 표시 됨) 및 낭종 크기 (표시 부모 동물의 보다 넓은 동물의 폭의 1/3을 초과 하지 확장 에 B). 스케일 바 = 400 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
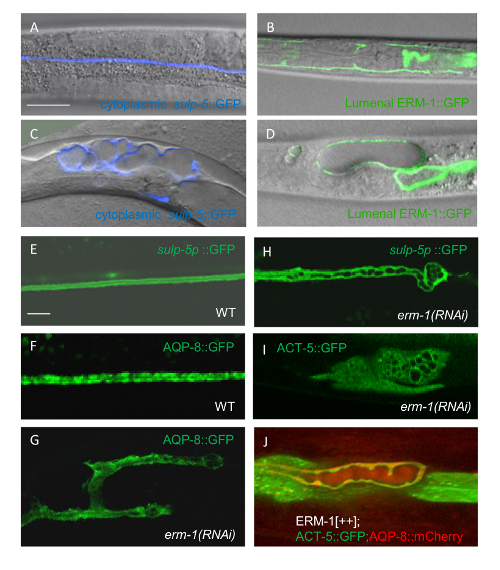
그림 4 : 배설 운하 형태학 및 Subcellular 운하 구성 요소에 Confocal 현미경 검사 법에 의해 돌연변이/RNAi 동물의 시각적 분석
(A-D) 낭 성 운하 형 (confocal/DIC 오버레이 현미경 표시 됩니다)에서 vacuolar 구별. (A) 야생-타입의 세포질 sulp 5 발기인 (의사 색 레이블, 패널 B에 표시 된 녹색 꼭대기 막에서 구별에서 파랑)에서 GFP를 표현 하 여 시각 이다. (B) 야생-타입의 꼭대기 막 음-1::GFP;을 표현 하 여 시각 이다 note 루멘이 확대 표시 되지 않습니다 및 해당 단일 레이블 세포질 막 라벨에서 구별할 수 없다. RNAi에 의해 유도 되는 (C) 배설 채널 형: 세포질 라벨 intralumenal cysts에서 세포질 그들을 구별할 수 없습니다. (D) 배설 운하 형 RNAi에 의해 유도 된: 루멘, 식별 (그림 4I 세포질 그들에 대 한 비교) (세포질) 그들 보다는 (lumenal) cysts 내부 액체 축적을 감지 꼭대기 음-1::GFP 라벨. 눈금 막대 = 40 μ m A-D, subcellular 운하 구성 요소 (단일 채널 무기의 공초점 이미지 표시 됩니다)에 대 한 대답 (E-J) 분석 손실 및 이득-의-기능 효과에 표시에 대 한. (E-G) Canaliculi의 subcellular 지 방화에 erm-1 RNAi의 효과. (E) 야생-타입 운하 세포질; GFP 제외 나타내는 루멘 note (F) 야생-타입 세포질 AQP-8::GFP puncta, canalicular 소포에 해당. (G) Cytoplasmic 고 AQP 8::GFP puncta erm-1(RNAi) 동물에서의 기저 변위. (H) 불연속 루멘 및 erm-1(mildRNAi) 동물에 루멘 팁 병리학 (컬링과 루멘 중심의 손실)의 세부 사항 (참조3 RNAi 강도 변조에 대 한); note는 운하 세포질 확장 루멘, 여기 작은 cysts로 표시의 팁. (I) 세포질 그들에서 운하 확장 없이 배설 운하 본문에 강하게 영향을 erm-1(RNAi) 동물3; 법-5::GFP 하지은 (일부 그들 주위 여러 작은 점 들)을 제외 하 고 루멘을 채용. (J) 채용 초과 행위-5::GFP 및 트리플 유전자 변형 동물 음-1 (법 5::GFP 및 낭 성 루멘 주위 겹치는 AQP 8::mCherry 덩어리의 참고 두꺼운 벨트) overexpressing 루멘에 AQP-8::mCherry. 눈금 막대 E-J, e에서 표시 5 μ m = 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 5 : 해 고 Confocal 현미경 검사 법에 의해 운하 결함의 정량화의 예제
야생 타입 (위 패널) 그리고 돌연변이 낭 성 (낮은 패널)의 (A) 회로도 표현을 배설 운하 운하 길이 낭종 크기의 정량화에 대 한. 후부 운하 길이 0, 1/4, 1/2, 3/4, 및 1로 정량입니다. 채널 길이 '0' 확장자 나타내고 '1' 전체 길이 확장을 나타냅니다. 낭종 크기로 계량 < 1/3 (소형) 및 >의 1/3 (대형) 몸 직경. (B) 제어 및 형광 현미경 검사 법을 해 부하 여 음-1 [+ +](RNAi) 동물에 총 운하 형태학의 정량화. 모의(RNAi) 음-1 + [+] 동물, 후부 운하 길이 약 1/2 95% 동물 (참조 이미지, 그림 3A-B) 확장입니다. 억압 음-1 [+ +](RNAi) 동물, 후부 운하 길이 거의 완벽 하 게 80-90% 동물 (참조 이미지, 그림 3C– D)에 확장 됩니다. 증강 음-1 [+ +](RNAi) 동물, 약 60-70% 운하는 큰 cysts 짧은 길이 (< 1/2) (참조 이미지, 그림 3E-F). 데이터 의미 ± SD (n > 3). (C) 공초점 이미지에서 ImageJ로 꼭대기/lumenal 운하 골격의 형광 강도의 정량화. 채널의 꼭대기 막 법-5::GFP에 의해 표시 됩니다, 그리고 야생-타입 운하 팔 왼쪽된, ERM-1 + [+] 운하 팔, 오른쪽에 표시 됩니다. 왼쪽 패널: 야생 타입 멤브레인 슬리브에서 법-5::GFP의 강도 약 50 (값/막 회색, 검은색과 빨간색 화살표로 표시), 이미지 아래 표시 된 플롯. 패널을 마우스 오른쪽: 음-1 + [+] 법-5::GFP의 강도 100 위 (지 느 러 미 막의 회색 값은 약 110 (검은색 화살표), 그리고 복 부 막의 약 140 (빨간색 화살표)), 이미지 아래 표시 된 플롯. 스케일 바 = 5 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
| 표 1:에 대 한 마커의 예는 C. 선 충 배설 운하 멤브레인 시스템 | ||||
| 단백질 이름 | 하위 | |||
| 표 2: 예 C. 선 충 Excretory 운하 관련 발기인 | ||
| 발기인 | 식 단계 | |
| 음-1 | 쉼표 단계 배아 | |
| sulp-5 | 3 태아 | |
| vha-1 | 2-fold 배아 | |
| vha-5 | 2-fold 배아 | |
| aqp-8 | 2-fold 배아 | |
| glt-3 | 늦은 배아 | |
| 1 예는 표 3에 나열 된 리소스에서 선택 됩니다. | ||
| 표 3: 리소스 | |||||
| C. 선 충 배설 운하 관련 분자, 라벨 시 약/긴장 및 항 체를 식별 하는 리소스 | |||||
| 1. 꼬마 유전학 센터 (CGC)43 사용할 시 약 및 긴장에 대 한 | |||||
| 2. Wormbase44 배설 운하 관련 분자, 긴장 및 항 체에 대 한 내용은 | |||||
| 3. 배설 운하 관련 분자에 대 한 정보: 참조6 참조 | |||||
| 4. Transgeneome 웹사이트45 변환 GFP 융해 구문에 대 한 | |||||
| 5. C.elegans 식 패턴46 transcriptional GFP 융해 구문에 대 한 | |||||
| 6. 국가 유관 프로젝트 (NBRP)::C.elegans47 정보에 선 충 C. 돌연변이 및 발기인에 대 한 | |||||
| 7. Fluorophores: 참조 기준48,49 | |||||
| 타겟된 RNAi 라이브러리에 대 한 분자 조립에 대 한 웹 기반 리소스 | |||||
| 1. GeneMANIA50 | |||||
| 2. AceView51 | |||||
| 3. iHOP52 | |||||
| 4. Wormbase44 | |||||
| 5. saccharomyces 게놈 데이터베이스53 | |||||
| 6. Flybase54 | |||||
| 7. 마우스 게놈 데이터베이스55 | |||||
| 8. 인간 게놈 데이터베이스56 | |||||
| 9. 폭발57 |
| 표 4: 예제 시트를 득점 하는 간단한 표현 형의 | |||||||
| RNAi 도서관 | 스트레인 | 일반 형 (총 %) | 채널 형 | ||||
| 채널 길이 < 1/2 (L4%) | 채널 길이 > 1/2 (L4%) | 다른 채널 형 | 계산 하는 동물의 총 수 | ||||
| 플레이트 없음 | 잘 수 | ||||||
| I-1 | A 1 | 음-1 [+ +]; vha-1 p:: GFP | Clr (30) | 80 | 20 | 100 | |
| X-5 | B12 | 같은 | 없음 | 30 | 70 | 100 | |
| III-10 | C5 | 같은 | Unc (54) | 70 | 30 | 큰 cysts | 100 |
토론
C. 선 충 유전 다양성, 투명성, 간단한 몸 계획, 고정 세포 계보는 우수한 morphogenesis의 분석 모델 만들. 이 프로토콜 표준 유전 조작 및 이미징 결합 하는 방법을 설명 합니다 2 미크론의 활용 연구 얇은 편광된 막과 세포내 루멘 속 단일 셀 튜브에서 연구 선 충 C. 배설 운하.
라벨
C. 선 충 배설 운하 허용 하는 라이브 분석 (여기에 설명 된), 형광 성 융해 단백질의 표정 또는 항 체 또는 화학 얼룩 (참조 창 자 tubulogenesis 항 체 얼룩이 지기에 대 한 종이 동반 표시 될 수 있습니다. 3). 두 개 이상의 다른 fluorophores, 또는 이들의 조합 식 다른 기술, 라벨 수 있습니다 (그림 2) 이러한 얇은 tubules의 고해상도 영상 해 부에 대 한. 운하에 운하 특정 발기인에 의해 지시 하는 형광 성 융해 단백질 배설 운하 그들의 사이에서 여러 가지 이유로 라벨에 대 한 첫 번째 선택은: (1) 낮은 식 많은 운하 단백질 그리고 수준을 쉽게 (2) 채널의 미세 구조 관심사의 단백질 수 있습니다 또한 표현 될 운하 외부 얼룩에 의해 압도. 다른 한편으로, 운하 exogenous 단백질에 민감합니다 고 쉽게 난다 고기 (예를 들어, 확장 결함 및 cysts, 또는 심지어 치)을 개발할 때 이러한 단백질 강하게 표현 됩니다. 이 생성 하는 유전자 변형 동물의 다른 방법으로 선택할 때 결정에 무게 해야 합니다. 원칙적으로, transgenes 소개 될 수 있다 extrachromosomal 배열 (예를 들어, 여기에 설명 된 대로 생식 변환용 생식에 플라스 미드 DNA의 직접 주입 하 여)로 일반적으로 높은 복사 번호 배열 (종종 높은 생성 식), 또는 일반적으로에서 낮은 또는 단일 복사본 (예를 들어, 사격26 또는 Mos1 중재 단일 복사본 삽입 [MosSCI]27를 통해) 게놈으로 통합. 그러나 Extrachromsomal 배열도 (아직도,, 높은 사본 수에) 두 번째 단계에서 게놈에 통합 될 수18. 다른 한편으로, 낮은 농도 (예를 들어, 1-2 ng / µ L DNA, DNA 마커의 높은 농도 함께)에서 생식에 주입 했을 때 낮은 (심지어 단일) 복사본 번호 배열을 쉽게 생성 된28수 있습니다. 이 시나리오는 최고의 식 수준의 찾을 운하 라벨에 대 한 너무 낮은 너무 높은 (독성) 도움이 될 수 있는 DNA 농도 다양 수 있는 이점이 있다. 주입 된 DNA 농도 및 식 수준 간의 관계 (예를 들면, 발기인), 여러 요인에 따라 달라 이며 따라서 실험적으로 결정 되어야 합니다. 또는, 관심사의 유전자 수 직접 표시는 생식에 fluorophore와 클러스터 정기적으로 산재 짧은 구조 반복 (CRISPR) 기반으로 라벨링 절차29,30여. 이 접근의 가장 생리 게놈 컨텍스트로 fluorophore 장소, 하지만 이건 항상 필요한 또는 바람직한 (예를들면, 단백질은 매우 낮은 수준에서 표현 하는 경우). 그러나 그것은 예를 들어 최선의 선택이 될 수 있습니다,, 관심사의 유전자가 매우 큰 경우.
운하 시각화는 fluorophore에 의해 운하 세포질을 강조할 것 이다 운하에 transcriptional 구조를 지시에 의해 수행할 수 있습니다. 반면, 라벨 subcellular 운하 구성 요소 전장 유전자가 유전자 인코딩 fluorophore 프레임에 연결 되어 있는 변환 융합을 필요 합니다. 식 (보다는 유전자의 발기인) 운하 특정 발기인을 사용 하 여 때 그것의 선택 해야 될 기초 발기인의 강도에, 발달 분석에 대 한 그 식의 시간. 채널의 삼투성 기능 중요; 때 애벌레 단계 전에 많은 배설 운하 특정 유전자 표현 하지 않습니다. 활성 확장 단계의 분석을 위해 너무 늦 었 어 (음-1 및 프로-1 은 초기 표현된 유전자)10,13. 예 배설 운하 엔도-및 플라즈마 막의 마커 및 운하 특정 발기인에 대 한 표 1 과 2에 각각, 받는다 고 표 3에 추가적인 운하 특정 분자를 찾는 대 한 리소스. 꼬마 유전학 센터를 통해 사용할 수는 이미 만든 적합 한 형광 성 융해 단백질을 찾기 위해 이러한 리소스를 사용할 수 있습니다 (CGC; 표 1참고). 이러한 단백질 융해의 표현에 대 한 재조합 플라스 미드를 건설, 하나 사용할 수 있는 특정 프로와 죄수 각각 다양 한 복제 방법 (다른 논의14). 기반으로 하는 기존의 제한 효소 포함 됩니다 접근, 여기에 설명 된 복제, 모듈형 "PCR 바느질" 방법14 multisite 게이트웨이 시스템31,32깁슨 어셈블리 또는 기자 진 건설을 사용 하 여 복제 ,33. 이 다른 접근은 생식으로 그들의 소개에 대 한 선택 하는 방법을 그리고/또한 다른 특정 요구 (예를 들어 다양 한 게이트웨이 시스템을 용이 하 게 발기인 및 라벨 접근 하는 큰 규모에 대 한 cDNAs의 더미)에 적용할 수 있습니다. . 케어는 fluorophore (N-대 단백질의 C-말단에 연결), 관심사의 단백질의 기능을 고려에 대 한 올바른 삽입 사이트 선택에 주의가 필요.
유전자 기능 방해
C. 선 충에서 유전자 기능을 교란 하는 많은 가능한 방법의 하나로, 대상된 RNAi의 상호 작용 화면을 overexpressing lumenal 막 구성 요소에 의해 유도 된 낭 성 운하 루멘 형을 수정 하도록 설계 된이 프로토콜에 설명 합니다. 이 특정 경우에 꼭대기/lumenal 막 overexpressing 관련 마커 같은 음-1 직접 원하는 대상에 조회를 지침의 이점이 있다: 세포내 꼭대기/lumenal 막 속의 분석. Overexpression에 의해 생성 된 함수 이득 형 또한 장점이 특정 여기에 설명 된 대로 손실의 기능 (RNAi) 상호 작용 화면과 결합 될 때 (34 손실 및 이득-의-기능 분석의 논의 대 한 참조와 유전 스크린의 디자인)입니다. 또한, 자체 음 1은 잘 조사 "루멘 morphogenesis" 및 꼭대기 막 정체성 분자12. 따라서,이 경우에, 타겟 (보다는 오히려 편견) 화면 직접 유익 루멘 morphogenesis 동안이 과정에서 수반 추가 특성화 음-1의 특정 기능에 대 한 것입니다. 그러나 편견된 아닌 대상 화면 야생 유형 동물, f 유전자 변형 동물 어느 쪽이 든을 시작 하는 것은 비슷한 방식에서 실시 하는 수 있는,luorescently 배설 운하, 표시 또는 어떤 운하 돌연변이. 일반적인 장단점 (예를 들어, mutagenesis 대)에 RNAi의 기능 손실 고기, 그리고 전도의 생성 및 C. 선 충 에서 유전자 스크린의 다양 한 종류의 토론에 대 한 다른 논의 34. 종종 치명적인 tubulogenesis 유전자의 분석을 위해 특정 장점은 고기, 온화한 고기 등의 스펙트럼을 생산 하는 RNAi. 이것은 설명 하 고 동반 종이에 장 tubulogenesis3에 대 한 논의. 이득과 손실의 기능 돌연변이 십자가, 등 클래식 유전 절차를 생성 하는 다른 접근은 상세 하 고 일반 유전학 방법 문학20에서 설명.
현미경 검사 법 그리고 tubulogenesis 고기의 평가
시각적으로 평가 하 고, 여기에 설명 된 대로 (예: 채널 길이 및 루멘 직경), 간단한 득점 매개 변수를 사용 하 여 현미경을 해 부하는 형광에서 잘 정의 된 채널 형의 수정 득점 시간의 짧은 기간에 달성 될 수 있다 동물에는 타겟 또는 체계적인 유전 또는 RNAi 스크린의 더 큰 숫자를 처리 하는 경우에. 반면,는 비슷한 화면 검색 소설 운하 morphogenesis 고기는 스트레인에 대 한 그건 야생-타입 (그것의 운하 라벨 transgene)를 제외 하 고는 동일한 방식으로 수행 수 있습니다, 원칙적으로, 하지만 더 많은 시간이 소요 (우리 같은 실시 한 몇 개월에 게놈 넓은 기초에 스크린). 같은 화면 (여기 표시 되지 않음) 여러 다른 운하 고기 식별 및 따라서 개발 해야 correspondingly 다른 득점 매개 변수, 예를 들면, 질적 분류 ( 9,11, 참조 구성표 35,36,,3738 운하 고기 해 부 현미경으로 점수를 다른 방법으로). 모든 운하 형을 해석할 때 낭종 형성이 얇은 관 구조에 많은 다른 모욕의 불특정 효과가 있을 수 있습니다 그리고 그것은 종종 덜 유익한 터미널 형 염두에 결정적 이다. 낭종의 크기와 위치, 다른 한편으로, 유익, 수 예, 운하 셀 (운하 확장의 시작)에서 가까운 낭종, 채널의 길이 따라 cysts 또는 운하 끝 cysts 결함의 기본 메커니즘에 단서를 제공. (여기 꼭대기/lumenal 막으로 둘러싸인 내부 lumenal 액체가 채워진 spheroids로 정의 되는) 운하 cysts 소포에서 구별 한다 (작은 세포질 막 도약 액체 채워진 spheroids) 또는 그들 (확대 세포질 막 도약 액체 채워진된 spheroids), 하지 모든 모습으로 동일 (그림 4A-D)를 할 수 있는 lumenal 막에 의해 둘러싸여. 세포질 그들 발생할 수 있습니다 마찬가지로 secondarily, 예를 들어, 솔루션 (나트륨 아 지 드) 장착의 독성 효과 통해. 둘 다, 큰 cysts 및 세포질 그들 수 동물의 크기 거의 고 추가 구분할 수는 클래식에서 "취소 (Clr)" 하는 데 필요한 바디 구멍에 있는 액체의 축적으로 인 한 형 카. 마지막으로, 낭 성 운하에 운하 길이 거의 항상 이차 손상 된 따라서 진정한 운하 확장 결함 필요 낭종 무료 설정에서 설명 합니다.
그들의 작은 직경에도 불구 하 고 배설의 subcellular 구성 요소 운하와 같은 기저 막, 세포내 대 꼭대기 endosomal canalicular 소포, 세포내 세포 및 cytoskeletal 구성 요소, 대 구상 될 수 있다 하 여 높은 확대, 예를 들어, confocal 현미경 검사 법 (그림 2, 그림 4). Confocal 영상으로 혼자 GFP 긍정적인 운하 세포질 비 형광 라인 (그림 2A, 그림 4E)을 통해 운하 세포질에서 루멘을 구별 하는 것 충분 하다. 마커의 정체성 확실 한 할당 immunoelectronmicroscopy39필요 합니다 (또한 현저 하 게 다른 크기에서), endosomal 소포에서 canalicular 해결에 기여 한다. 더블, 트리플 라벨의 분자와 서로 (그림 2) subcellular 컴포넌트의 관계의 subcellular 지역화를 확인할 수 있습니다. 단일 레이블된 lumenal 운하 막 세포질 또는 기저 막으로 동일한 더블 라인을 생산 하지만 더블 통해 구별 될 수 있다 또는 라벨 트리플. Confocal 분석에 대 한 적절 한 장착은 중요 한, 주어진 다 운하 구조, 삼투성 변화에 그것의 감도 및 그것의 가장 빈번한 낭 성 표현 형의 취약점의 취약성. Cysts 삼투성 변화 나 물리적 압력으로 쉽게 버스트, 나트륨 아 지 드, 등 독 소 막에 민감한 고 또한 동원 정지 (생성 하는 수 있습니다 또한 세포질 그들) 사용 일부 마 취약에 과민 한. 우리의 손에서 M9 버퍼에서 5 %lidocaine 가장 배설 채널 분석에 대 한 최고의 작품. 설명 된 대로 이미징 절차 및 모든 처리, 부드러운 되어야 합니다. 고기 (예:cysts, 그들)를 모방 하는 아티팩트를 피하기 위해, 즉시 장착 후 이미지를 얻으려고 최상 이다. 만약 불가능 하다, 낭종 이미지 다른 고기를 이미징 하기 전에 먼저, 인수 한다. 이 프로토콜에서는 표준 검사 confocal 현미경 검사 법 회전 하는 디스크는, 대조적으로, phototoxicity를 감소의 동적 변화 분석에 대 한 선택의 현미경 confocal 현미경에 비해 우수한 confocality를 제공 하 시간이 지남에 subcellular 구성 요소입니다. Subcellular 역학에 같은 질문 라벨 변경 색상40사진 전환 fluorophores와 융해 단백질 또는 photobleaching 기술을 사용 하 여 해결할 수 있습니다. 마지막으로, 해상도의 범위 수 더 증가 될 전송 전자 현미경 검사 법 (TEM, 구조 하지만 하지 분자 고해상도 제공), 추가 하 여 슈퍼 해상도 현미경 (나노미터 범위에 분자 해상도 제공 하는); 또는 immunoelectronmicroscopy (두 제공)39,41. 3 차원 단층 가장 직렬 섹션 결합 될 수 있다 하며 배설 운하9,10canalicular 플라즈마 멤브레인 인터페이스의 분석에 대 한 특히 유용 합니다. 이러한 서로 다른 유형의 현미경 그리고 다른 이미징 방법의 조합에 대 한 향상 된 기술 개발을 계속 합니다.
공개
저자 들은 아무 경쟁 금융 관심사 선언 합니다.
감사의 말
우리 엠 부 (캔자스의 대학, 캔사스, 미국), K. Nehrke (로체스터 대학 의료 센터, 로체스터, 뉴욕, 미국), 꼬마 유전학 센터, 건강의 국가 학회, 연구 인프라의 투자 감사 프로그램 (P40 OD010440)입니다. 이 작품은 NIH GM078653, MGH는 224570 V.G.에 SAA 223809 교부 금에 의해 지원 되었다
자료
| Name | Company | Catalog Number | Comments |
| Cloning | |||
| Plasmid pPD95.75 | Addgene | Cat. No. 37464 | |
| PCR Kit | Qiagen | Cat. No. 27106 | |
| Ligation kit | New England Biolabs | Cat. No. E2611L | |
| DNA marker | Thermo Scientific | Cat. No. SM1331 | |
| Agarose DNA grade | Fisher Scientific | Cat. No. BP164-100 | |
| Competent cells | New England Biolabs | Cat. No. C2987H | |
| Tris | Fisher Scientific | Cat. No. BP154-1 | |
| EDTA | Sigma | Cat. No. ED-1KG | |
| Acetic acid | Fisher Scientific | Cat. No. A38S-500 | |
| Ethidium bromide | Fisher Scientific | Cat. No. BP1302-10 | |
| Equipments | |||
| PCR machine | MJ Research | Cat. No. PTG-200 | |
| Centrifuge | Eppendorf | Cat. No. 5415C | |
| Water Bath | Precision Scientific | Cat. No. 666A3 | |
| Gel running instrument | Fisher Scientific | Cat. No. 09-528-165 | |
| Gel running power supply | Fisher Scientific | Cat. No. 45-000-465 | |
| Molecular Imager Gel Doc XR System | Bio-Rad | Cat. No. 1708195EDU | |
| Nanodrop Spectrophotometer | Thermo Scientific | Cat. No. ND1000 | |
| C. elegans related1 | 1see reference19 for standard C. elegans culture and maintenance procedures. | ||
| LB Medium and plates2 | 2see reference19 for protocols. | ||
| Tryptone | Acros Organics | Cat. no. 611845000 | |
| Yeast Extract | BD Biosciences | Cat. no. 212750 | |
| NaCl | Sigma | Cat. no. S7653 | |
| Bacto Agar | BD Biosciences | Cat. no. 214040 | |
| Ampicillin | Sigma | Cat. no. A0116 | |
| Tetracycline | Fisher Scientific | Cat. no. BP912 | |
| M9 Medium2 | 2see reference19 for protocols. | ||
| NaCl | Sigma | Cat. no. S7653 | |
| KH2PO4 | Sigma | Cat. no. P0662 | |
| Na2HPO4 | Sigma | Cat. no. S7907 | |
| MgSO4 | Sigma | Cat. no. M2773 | |
| NGM plates 2 | 2see reference19 for protocols. | ||
| NaCl | Sigma | Cat. no. S7653 | |
| Peptone | BD Biosciences | Cat. no. 211677 | |
| Tryptone | Acros Organics | Cat. no. 611845000 | |
| Bacto Agar | BD Biosciences | Cat. no. 214040 | |
| MgSO4 | Sigma | Cat. no. M2773 | |
| CaCl2 | Sigma | Cat. no. C3881 | |
| Cholesterol | Sigma | Cat. no. C8667 | |
| K2HPO4 | Sigma | Cat. no. P3786 | |
| KH2PO4 | Sigma | Cat. no. P0662 | |
| RNAi plates3 | 3see reference21 for protocols. | ||
| NaCl | Sigma | Cat. no. S7653 | |
| Peptone | BD Biosciences | Cat. no. 211677 | |
| Tryptone | Acros Organics | Cat. no. 611845000 | |
| Bacto Agar | BD Biosciences | Cat. no. 214040 | |
| MgSO4 | Sigma | Cat. no. M2773 | |
| CaCl2 | Sigma | Cat. no. C3881 | |
| Cholesterol | Sigma | Cat. no. C8667 | |
| K2HPO4 | Sigma | Cat. no. P3786 | |
| KH2PO4 | Sigma | Cat. no. P0662 | |
| IPTG | US Biological | Cat. no. I8500 | |
| Carbenicillin | Fisher Scientific | Cat. no. BP2648 | |
| NaOH | Fisher Scientific | Cat. no. SS266-1 | |
| Sodium hypochlorite | Fisher Scientific | Cat. no. 50371500 | |
| Bacteria | |||
| OP50 bacteria | CGC | ||
| HT115 bacteria | CGC | ||
| Genome-wide RNAi libraries | |||
| Ahringer genome-wide RNAi feeding library (ref21,58,59) | Source BioScience | ||
| C. elegans ORF-RNAi feeding library (ref60) | Source BioScience | ||
| Imaging related | |||
| Lidocaine | MP Biomedicals,LLG | Cat. no. 193917 | |
| Materials | |||
| Vacuum Grease Silicone | Beckman | Cat. no. 335148 | |
| Microscope slides | Fisher Scientific | Cat. no. 4448 | |
| Tissue culture plate, 6 well | Corning Inc. | Cat. no. 08-772-33 | |
| Equipment | |||
| SMZ-U dissecting microscope (Nikon) | |||
| SZX12 dissecting microscope (Olympus), equipped with a high-power stereo fluorescence attachment (Kramer Scientific), CCD camera with Q capture software and X-Cite fluorescent lamp (Photonic Solutions). | |||
| TCS SL Laser-scanning confocal microscope (Leica Microsystem) | |||
| C2 laser-scanning confocal mounted on an ECLIPSE Ti-E inverted microscope (Nikon) |
참고문헌
- Lubarsky, B., Krasnow, M. A. Tube morphogenesis: making and shaping biological tubes. Cell. 112 (1), (2003).
- Sundaram, M. V., Cohen, J. D. Time to make the doughnuts: Building and shaping seamless tubes. Semin. Cell Dev. Biol. S1084-9521, 30130-30136 (2016).
- Zhang, N. The C. elegans intestine as a model for intercellular lumen morphogenesis and in vivo polarized membrane biogenesis at the single-cell level. JoVE. , (2017).
- Andrew, D. J., Ewald, A. J. Morphogenesis of epithelial tubes: Insights into tube formation, elongation, and elongation. Dev. Biol. 341 (1), 34-55 (2010).
- Nelson, F. K., Albert, P. S., Riddle, D. L. Fine structure of the Caenorhabditis elegans secretory-excretory system. J. Ultrastruct. Res. 82 (2), 156-171 (1983).
- Sundaram, M. V., Buechner, M. The Caenorhabditis elegans Excretory System: A Model for Tubulogenesis, Cell Fate Specification, and Plasticity. Genetics. 203 (1), 35(2016).
- Altun, Z. F., Hall, D. H. Excretory system. WormAtlas. , (2009).
- Buechner, M. Tubes and the single C. elegans excretory cell. Trends Cell Biol. 12 (10), 479-484 (2002).
- Khan, L. A. Intracellular lumen extension requires ERM-1-dependent apical membrane expansion and AQP-8-mediated flux. Nat. Cell Biol. 15 (2), 143-156 (2013).
- Kolotuev, I., Hyenne, V., Schwab, Y., Rodriguez, D., Labouesse, M. A pathway for unicellular tube extension depending on the lymphatic vessel determinant Prox1 and on osmoregulation. Nat. Cell Biol. 15 (2), 157-168 (2013).
- Buechner, M., Hall, D. H., Bhatt, H., Hedgecock, E. M. Cystic canal mutants in Caenorhabditis elegans are defective in the apical membrane domain of the renal (excretory) cell. Dev. Biol. 214 (1), 227-241 (1999).
- Fehon, R. G., McClatchey, A. I., Bretscher, A. Organizing the cell cortex: the role of ERM proteins. Nat. Rev. Mol. Cell Biol. 11 (4), 276-287 (2010).
- Gobel, V., Barrett, P. L., Hall, D. H., Fleming, J. T. Lumen morphogenesis in C. elegans requires the membrane-cytoskeleton linker erm-1. Dev. Cell. 6 (6), 865-873 (2004).
- Boulin, T., et al. Reporter gene fusions, WormBook. The C. elegans Research Community, WormBook. , April 5, 2006 http://www. wormbook.org (2006).
- Sambrook, J. Molecular cloning: a laboratory manual. Sambrook, J., DW, R. ussell , Cold Spring Harbor Laboratory Press . (2006).
- Fire, A., Harrison, S. W., Dixon, D. A modular set of lacZ fusion vectors for studying gene expression in Caenorhabditis elegans. Gene. 93 (2), 189-198 (1990).
- Ahringer, J. Reverse genetics, WormBook. The C. elegans Research Community, WormBook. 6, April 6, 2006 http://www. wormbook.org (2006).
- Transformation and microinjection, WormBook. The C. elegans Research Community, WormBook. Evans, T. C. , April 6, 2006 http://www.wormbook.org (2006).
- Maintenance of C. elegans, WormBook. The C. elegans Research Community, WormBook. Stiernagle, T. , February 11, 2006 http://www.wormbook.org (2006).
- Genetic mapping and manipulation: Chapter 7-Making compound mutants, WormBook. The C. elegans Research Community, WormBook. Fay, D. , February 17, 2006 http://www.wormbook.org (2006).
- Kamath, R. S., Ahringer, J. Genome-wide RNAi screening in Caenorhabditis elegans. Methods. 30 (4), 313-321 (2003).
- Timmons, L., Court, D. L., Fire, A. Ingestion of bacterially expressed dsRNAs can produce specific and potent genetic interference in Caenorhabditis elegans. Gene. 263 (1-2), 103-112 (2001).
- Pawley, J. B. Handbook of Biological Confocal Microscopy. , Springer. (2006).
- Hibbs, A. R. Confocal Microscopy for Biologists. , Springer. US. (2004).
- Bankhead, P. Analyzing fluorescence microscopy images with ImageJ. , (2014).
- Praitis, V., Casey, E., Collar, D., Austin, J. Creation of low-copy integrated transgenic lines in Caenorhabditis elegans. Genetics. 157 (3), 1217-1226 (2001).
- Frøkjaer-Jensen, C. Single-copy insertion of transgenes in Caenorhabditis elegans. Nat. Genet. 40 (11), 1375-1383 (2008).
- Mello, C. C., Kramer, J. M., Stinchcomb, D., Ambros, V. Efficient gene transfer in C. elegans: extrachromosomal maintenance and integration of transforming sequences. EMBO J. 10 (12), 3959-3970 (1991).
- Barrangou, R. Cas9 Targeting and the CRISPR Revolution. Science. 344 (6185), 707-708 (2014).
- Dickinson, D. J., Goldstein, B. CRISPR-Based Methods for Caenorhabditis elegans Genome Engineering. Genetics. 202 (3), 885-901 (2016).
- Esposito, D., Garvey, L. A., Chakiath, C. S. Gateway cloning for protein expression. Methods Mol. Biol. 498, 31-54 (2009).
- Gibson, D. G. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nat. Methods. 6 (5), 343-345 (2009).
- Hobert, O. PCR fusion-based approach to create reporter gene constructs for expression analysis in transgenic C. elegans. Biotechniques. 32 (4), 728-730 (2002).
- Jorgensen, E. M., Mango, S. E. The art and design of genetic screens: caenorhabditis elegans. Nat. Rev. Genet. 3 (5), 356-369 (2002).
- Berry, K. L., Bulow, H. E., Hall, D. H., Hobert, O. A. C. elegans CLIC-like protein required for intracellular tube formation and maintenance. Science. 302 (5653), 2134-2137 (2003).
- Mattingly, B. C., Buechner, M. The FGD homologue EXC-5 regulates apical trafficking in C. elegans tubules. Dev. Biol. 359 (1), 59-72 (2011).
- Shaye, D. D., Greenwald, I. The disease-associated formin INF2/EXC-6 organizes lumen and cell outgrowth during tubulogenesis by regulating F-actin and microtubule cytoskeletons. Dev. Cell. 32 (6), 743-755 (2015).
- Lant, B. CCM-3/STRIPAK promotes seamless tube extension through endocytic recycling. Nat. Commun. 6 (6), 6449(2015).
- Paupard, M. C., Miller, A., Grant, B., Hirsh, D., Hall, D. H. Immuno-EM localization of GFP-tagged yolk proteins in C. elegans using microwave fixation. J. Histochem. Cytochem. 49 (8), 949-956 (2001).
- Lukyanov, K. A., Chudakov, D. M., Lukyanov, S., Verkhusha, V. V. Photoactivatable fluorescent proteins. Nat. Rev. Mol. Cell Biol. 6 (11), 885-891 (2005).
- Bates, M., Huang, B., Dempsey, G. T., Zhuang, X. Multicolor super-resolution imaging with photo-switchable fluorescent probes. Science. 317 (5845), 1749-1753 (2007).
- Sherman, T. The abts and sulp families of anion transporters from Caenorhabditis elegans. Am. J. Physiol. Cell Physiol. 289 (2), C341-C351 (2005).
- Caenorhabditis Genetics Center (CGC). , http://cbs.umn.edu/cgc/home (2017).
- Wormbase. , http://www.wormbase.org/ (2017).
- Transgeneome website. , https://transgeneome.mpi-cbg.de/transgeneomics/index.html (2017).
- C. elegans expression pattern. , http://gfpworm.org/ (2017).
- National BioResource Project (NBRP)::C. elegans. , https://shigen.nig.ac.jp/c.elegans/ (2017).
- Heppert, J. K. Comparative assessment of fluorescent proteins for in vivo imaging in an animal model system. Mol. Biol. Cell. 27 (22), 3385-3394 (2016).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nat Methods. 2 (12), 905-909 (2005).
- GeneMANIA. , http://genemania.org/ (2017).
- AceView. , http://www.ncbi.nlm.nih.gov/ieb/research/acembly/ (2017).
- iHOP. , http://www.ihop-net.org/UniPub/iHOP / (2017).
- Saccharomyces Genome Database. , http://www.yeastgenome.org (2017).
- Flybase. , http://www.flybase.org (2017).
- Mouse Genome Database. , http://www.informatics.jax.org (2017).
- Human Genome Database. , http://www.gdb.org (2017).
- BLAST. , https://blast.ncbi.nlm.nih.gov/Blast.cgi (2017).
- Kamath, R. S., Martinezcampos, M., Zipperlen, P., Fraser, A. G., Ahringer, J. Effectiveness of specific RNA-mediated interference through ingested double-stranded RNA in Caenorhabditis elegans. Genome Biol. 2 (1), RESEARCH0002(2001).
- Kamath, R. S. Systematic functional analysis of the Caenorhabditis elegans genome using RNAi. Nature. 421 (6920), 231-237 (2003).
- Rual, J. F. Toward improving Caenorhabditis elegans phenome mapping with an ORFeome-based RNAi library. Genome research. 14 (10B), 2162-2168 (2004).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유