Method Article
C. Elegans Excretory Kanal als Modell für die intrazelluläre Lumen Morphogenese und In Vivo polarisiert Membrane Biogenesis in einer einzelnen Zelle: Kennzeichnung von GFP-Fusionen, RNAi Interaktion Bildschirm und Imaging
In diesem Artikel
Zusammenfassung
Der C. Elegans Ausscheidungsorgane Kanal ist ein einzigartiges einzellige Modell für die optische in-Vivo -Analyse der de Novo polarisiert Membran Biogenese. Dieses Protokoll beschreibt eine Kombination aus standard genetische/RNAi und imaging-Ansätze, zur Identifizierung und Charakterisierung von Molekülen Regie einzelligen Tubulogenesis und apikale Membran und Lumen Biogenese anpassungsfähig.
Zusammenfassung
Die vier C. Elegans Ausscheidungsorgane Kanäle sind engen Röhren, die durch die Länge des Tieres aus einer einzigen Zelle mit fast ebenso weit ausgedehnten intrazelluläre Endotubes, die aufbauen und stabilisieren das Lumen mit einer Membran und Submembraneous erweitert Zytoskelett der apikalen Charakter. Die Ausscheidungsorgane Zelle erweitert seine Länge ca. 2.000 Mal, um diese Kanäle, so dass dieses Modell für die in-Vivo -Beurteilung der de Novo polarisiert Membran Biogenese, intrazelluläre Lumen Morphogenese eindeutig zu generieren und einzelligen Tubulogenesis. Die hier vorgestellten Protokoll zeigt, wie Sie Standard Beschriftung, Gewinn - und Verlust-der-Funktion genetische oder RNA-Interferenz (RNAi) kombinieren-, und mikroskopische Ansätze, dieses Modell optisch zu sezieren und funktionell analysiert diese Prozesse auf molekularer Ebene zu verwenden. Als ein Beispiel für eine Kennzeichnung Ansatz beschreibt das Protokoll die Generation von transgenen Tieren mit fluoreszierenden Fusionsproteine für live-Analyse des Tubulogenesis. Als ein Beispiel für eine genetische Ansatz unterstreicht es Eckpunkte eines visuellen RNAi-basierten Interaktion Bildschirm entwickelt, um eine zystische Kanal Gain-of-Function-Phänotyp ändern. Die spezifischen Methoden beschrieben sind wie: beschriften und visualisieren die Kanäle zum Ausdruck bringen, fluoreszierende Proteine; eine gezielte RNAi-Bibliothek zu konstruieren und strategisch RNAi screening für die molekulare Analyse der Kanal Morphogenese; Änderungen der Kanal Phänotypen visuell zu beurteilen; Punkten sie durch sezieren Fluoreszenz-Mikroskopie; subzelluläre Kanal Komponenten mit höherer Auflösung durch konfokale Mikroskopie zu charakterisieren; und Quantifizierung der visuelle Parametern. Der Ansatz eignet sich für den Prüfer, der unter Ausnutzung des C. Elegans Ausscheidungsorgane Kanals für die Identifizierung und Charakterisierung von Genen beteiligt die phylogenetisch konserviert Prozesse der intrazellulären Lumen und einzelligen interessiert ist Rohr-Morphogenese.
Einleitung
Alle inneren Organe bestehen aus Rohren, entscheidend für ihre viele verschiedenen Funktionen, wie z. B. den Transport und Austausch von Gasen, Flüssigkeiten und Nährstoffen und die Ausscheidung von Stoffwechselschlacken. Ihre polarisierten Charakter, mit deutlichen lumenal und apikalen Membranen, ist auf diese spezifische Funktionen angepasst, und Mängel in der Biogenese ihrer Endo und Plasmamembran-Systeme sind eine häufige Ursache von Krankheiten1,2. Die Mehrheit der Rohre des Gefäßsystems und der inneren Organe sind mehrzelligen und bilden ein Lumen intercellularly; jedoch können, einzellige Röhren, die das Lumen intrazellulär bilden, z. B. so viel wie 30 – 50 % der menschlichen Kapillare Betten2darstellen. Die polarisierten Membranen der Multi- und einzelligen Röhren ähneln sich in Zusammensetzung, obwohl ihre Microdomains basierend auf das Rohr bestimmte Funktion (z.B., Ausscheidungsorgane Kanal Canaliculi gegen Darm Mikrovilli in Caenorhabditis unterscheiden können Elegans; siehe Papier auf C. Elegans Darm Tubulogenesis begleiten)3. Die Grundsätze der polarisierten Membran Biogenese und Tubulogenesis sind bei Metazoen konserviert, und eine ähnliche molekulare Maschinerie leitet sie1,2,4.
Die Ausscheidungsorgane C. Elegans besteht aus fünf Zellen: die Ausscheidungsorgane Zelle (EC), Kanal Zellen (DC), pore Zelle (PC) und zwei Drüsenzellen. Ablation der EG, DC oder PC verursacht Flüssigkeitsansammlung in der Körperhöhle und die Tiere sterben an einer frühen Larvenstadium5. Faszinierend, diese drei einzelligen Rohre erstellen ihr Lumen auf drei verschiedene Arten: von Zelle Aushöhlung (EG); Zelle Verpackung gekoppelt mit Autocellular Kreuzung Bildung (PC); und durch die Zelle Umhüllung in Verbindung mit Autofusion (DC); verschiedene Mechanismen der Lumen Morphogenese, die alle phylogenetisch konserviert6,7. Die EG, befindet sich auf der linken lateralen Seite der hinteren Rachenraum Lampe, sendet zwei seitliche Erweiterungen aus, die die vier Kanäle verzweigen sich vorangegangene erweitern und nach hinten (auf der rechten und linken Seite) bis zur Spitze des der Wurm Nose und tail , bzw. (Abbildung 1)5,6,8. Die EG erstreckt sich von etwa 1 µm bis 2 x 1.000 µm, so dass es die größte Zelle im Tier. Auf subzellulärer Ebene ist der Ausscheidungsorgane Kanal ein einfaches Rohr, generiert aus einer Basalmembran auf das Pseudocoelom gerichtet, und durch eine lumenal Membran (Endotube) getunnelt. Die Kanal lumenal Membran verbindet der Kanal lumenal Membran an der nur interzellulären Kreuzung; Ansonsten sind die Kanäle junctionless entlang ihrer Länge (Abbildung 1). Die Ausscheidungsorgane Kanal lumenal Membran und seine Submembraneous Zytoskelett sind apikale, definiert durch ihre molekulare Zusammensetzung, die die Zusammensetzung der apikalen Membran und Submembraneous Zytoskelett mehrzelligen Röhren, wie der Darm ähnelt, und von anderen Epithelien (z.B.Wohnung). Zytoplasmatischen Organellen, einschließlich Endosomal vesikuläre und andere (z.B.Golgi) Endomembranes entlang der Länge des Kanals verteilt sind. Darüber hinaus sind mehrere canalicular Vesikel - verbunden mit der lumenal Membran und/oder miteinander verbunden oder isoliert - durch den Kanal Zytoplasma7,8,9,10 Gewinde . Diese dynamische Plasma-Membran/canalicular Verbindung weiter erweitert den Kanal-Membran-System und trägt zur sowohl Lumen Morphogenese und Muskeltätigkeit10. Die Ausscheidungsorgane Kanal besteht somit fast ausschließlich aus Endo und Plasmamembranen, die ein hervorragendes Modell für die Analyse der polarisierten Membran Biogenese und die Regulierung der Endo-Plasmamembran Schnittstelle. Die drastische Ausweitung der apikalen Membran während Kanal Morphogenese - in diesem einzellige System deckungsgleich mit Lumen Erweiterung – ermöglicht auch die architektonische Probleme, die durch die Notwendigkeit, zu stabilisieren und in der Mitte einer intrazellulären lumenal Membran zu analysieren . Dieses Protokoll konzentriert sich auf die Analyse der Kanal Rohr und Lumen der strukturellen Morphogenese und der intrazellulären Membran Dynamik für diesen Prozess nicht auf die Signale, die die Zelle Bewegungen lenken, die in der Standpunkt der EG zu erzeugen die Ausscheidungsorgane und seiner komplizierten Verbindungen mit anderen zellulären Elementen (rezensiert in6) zu konstruieren.
Ein weiterer Vorteil von C. Elegans einzellige Kanalsystem für die Analyse von polarisierten Membran und intrazellulären Lumen Biogenese ist seine Fähigkeit, durch Entwicklungszeit, die Generation der verschiedenen Komponenten der Membranen zu trennen und Kreuzungen. Die EG entsteht zum Zeitpunkt der ventralen Schließung und siedelt sich Ventro-seitlich des Rachens während Mitte Embryogenese5,6,8, während die Verlängerung der Seitenkanal und Verzweigungen auftreten. Das anterior-posterioren Kanal Erweiterung in der späten Embryogenese, einen Prozess folgt, die weiterhin in der L1-Larvenstadium (Abbildung 1). In einer frisch geschlüpften Larve die hinteren Kanal Spitze erreicht ungefähr in die Mitte des Wurms, voll Verlängerung am Schwanz am Ende der Phase L1, nach welcher Zeit des Kanals zusammen mit dem Wurm8verlängert. Aktiven Kanal Wachstum mit einer Geschwindigkeit über das Wachstum des Tieres so endet im ersten Larvenstadium, allerdings weiter Wachstum tritt gleichzeitig mit dem Wachstum des gesamten Tieres während die weiteren Larvenstadien (L2-4). Diese Einstellung bietet die Möglichkeit, die verschiedene Stufen der de Novo polarisiert Membran Biogenese unabhängig von polarisierten Zellteilung oder Migration zu analysieren. Außerdem ermöglicht es die Trennung dieses Prozesses von der Versammlung der Knotenpunkte (die im Embryo vor Lumen Einleitung auftreten); Ihre genauen Anforderungen in Membran Polarisierung ist immer noch eine offene Frage im Feld Polarität. Schließlich trennt es eindeutig apikalen von Basalmembran Expansion, das letztere Verfahren vor der ehemaligen in der Ausscheidungsorgane Kanäle10. Das C. Elegans Ausscheidungsorgane Kanal Modell ist daher eine besonders informative Ergänzung mit dem Darm Modell, das eine Reihe von diesen Vorteilen für die Analyse von polarisierten Membran Biogenese teilt aber führt ihn in einer mehrzelligen Einstellung (siehe die begleitenden Paper über den Darm Tubulogenesis3).
Obwohl Wildtyp Kanäle ultradünnen Tubuli in diesem winzigen Wurm sind, können ihre Lumen vi sein.Sualized direkt von Nomarski Optik in diesem transparenten Tier. In der Tat können mutierten zystische Kanal Morphologien charakterisiert werden, in unbeschrifteten Tiere mit geringer Vergrößerung sezieren Mikroskopie, die mit großer Wirkung in vorwärts genetischer Bildschirme verwendet wurde, um an Tubulogenesis11beteiligten Gene zu identifizieren. Verbesserte Visualisierung von der Morphologie der Kanäle und Unterscheidung von ihren polarisierten Membranen, Zellskelett Komponenten, verschiedene intrazelluläre Organellen und andere subzellulären Strukturen, jedoch erfordert, Kennzeichnung und höher macht Leuchtstofflampen sezierenden und konfokalen Mikroskopie. Obwohl die Kanäle Feinstruktur eine Reihe von Schwierigkeiten für die Kennzeichnung und Mikroskopie stellt, Membranen und subzelluläre Komponenten unterschieden werden, über die bestimmte Moleküle, die einzigartig für jedes Fach und Tiere können sicher für die Mikroskopie montiert werden, wenn bestimmte Vorsichtsmaßnahmen getroffen werden, zu vermeiden Einführung Artefakten (siehe Protokoll und Diskussion). Kennzeichnung kann erfolgen durch Immunhistochemie in festen Proben oder durch die Erzeugung transgener Würmer mit dem Ausdruck fluoreszierende Fusionsproteine unter die Kontrolle über ihre eigenen oder Ausscheidungsorgane Kanal-spezifische Promotoren für in-Vivo Bildgebung. Dieses Protokoll beschreibt die Kennzeichnung Verfahren (siehe begleitende Papier auf intestinale Tubulogenesis für Antikörper Färbung3).
Die Fähigkeit, in Vivo Verlust oder Gewinn-of-Function-Studien mit in-Vivo imaging-Analyse auf die einzelne Zelle level in der gesamten Entwicklung macht den C. Elegans Ausscheidungsorgane Kanal ein besonders starkes Modell für die molekulare und zelluläre Analyse der einzelligen Tubulogenesis. Vorwärts oder rückwärts genetische Bildschirme können durchgeführt werden, beginnend mit einem Wildtyp oder beschrifteten transgenen Tieres Kanal Morphogenese Phänotypen (z.B. Zysten) zu identifizieren und ihre zugrunde liegenden Gendefekten. Alternativ können solche Bildschirme beginnen mit einem mutierten Phänotyp (z.B. eine zystische Kanal) und Unterdrücker oder Enhancer von diesen Phänotyp zur Identifizierung von Genen, die funktionell interagieren mit dem Gen verursacht des mutierten Phänotyps zu identifizieren. Der Gendefekt verursacht des mutierten Phänotyps kann induzieren einen Verlust (z.B. über gen löschen) oder ein Gewinn (z.B. über eine aktivierende Mutation oder über die Einführung des überschüssigen gen Kopien) der untersuchten Funktion. Vorwärts Mutagenese oder systematische RNAi-Screens sind ohne Vorurteile auf Genfunktion und die unvoreingenommene Identifizierung von Genen, die in der Funktion des Interesses ermöglichen. Angesichts der Verfügbarkeit der genomweiten RNAi Fütterung Bibliotheken kann fast jedes gen leicht durch RNAi in C. Elegans, abgerissen werden, dass jedes einzelne gen des Interesses oder eine Gruppe von Genen (z. B.in gezielte Bildschirme) auch schnell sondiert werden kann für ihre Wirkung in einem reverse Genetik-Ansatz. Um eine mögliche Kombination von Ansätzen zu demonstrieren, beschreiben wir hier einen gezielte RNAi Interaktion Bildschirm, beginnend mit eine zystische Ausscheidungsorgane Kanal Gain-of-Function-Mutante mit zytoplasmatischen Kanal grün fluoreszierenden Proteins (GFP) gekennzeichnet. Die mutierte Phänotyp wurde durch Überexpression des Erm-1, einer hoch konservierten C. Elegans generiert Ortholog der Membran-Aktin Linker Familie Ezrin-Radixin-Moesin (ERM), die in Lumen Morphogenese und Membran verwickelt Organisation in vielen Arten12. C. Elegans ERM-1 lumenal Membranen der inneren Organe, wie z. B. die Ausscheidungsorgane Kanal und des Darms, lokalisiert und ist erforderlich für Lumen Bildung in beiden13. ERM-1 Überexpression Rekruten überschüssige Aktin und Vesikeln der Kanal lumenal Membran, Erhöhung der Fluss in das Lumen und generieren einen kurzen zystische Kanal und einem gekräuselten lumenal Membran mit verdickten Aktin Unterwolle9. Das Protokoll beschreibt, wie Sie transgene Linien mit Ausscheidungsorgane Kanal ausgedrückt erzeugen mit der Bezeichnung Fusion Proteine (oder andere Proteine); Gewusst wie: ausführen eine gezielte RNAi-Screens ausgehend von dieser Stämme, Modifikatoren des Phänotyps Kanal zu identifizieren; und wie Sie visuell analysieren die Ergebnisse solcher Bildschirme von sezierenden und konfokale Fluoreszenzmikroskopie, einschließlich einfache Möglichkeiten, um informative Tubulogenesis Phänotypen zu quantifizieren. Alternative Techniken und die Details der RNAi, abgestimmt auf die oft tödliche Tubulogenesis Gene, Kennzeichnung finden Sie in der begleitenden Zeitung am Darm Tubulogenesis3. Alle Methoden können in verschiedenen Kombinationen für die Untersuchung weiterer Fragen auf Kanal Tubulogenesis verwendet werden.
Protokoll
1. Kennzeichnung der C. Elegans Excretory Kanal durch fluoreszierende Fusionsproteine 14
Hinweis: finden Sie im begleitende Paper am Darm Tubulogenesis 3 für die Kennzeichnung von in Situ Antikörper Färbung Verfahren anpassbar an die Ausscheidungsorgane Kanal. Siehe Tabelle 1 Beispiele für Moleküle bewährt zur Visualisierung von C. Elegans Ausscheidungsorgane Kanal Endo- und Plasmamembranen, Tabelle 2 Beispiele für Promotoren, die Ausdruck der Ausscheidungsorgane Kanal fahren und Tabelle 3 Mittel für umfassende Sammlungen von Markern und Promotoren, einschließlich der Verweise, die Diskussion über die Auswahl der verschiedenen Fluorophore.
- Bau von Gewebe-spezifischen fluoreszierenden Marker-Plasmide von Restriktionsenzym basierte Klonen 15
Hinweis: siehe auch die Diskussion für alternative Techniken für den Bau fluoreszierende Fusionsproteinen.- Identifizieren die Sequenz des Antragstellers (für transkriptionelle Fusionen) oder des gesamten Gens von Interesse mit seinen Promoter (für Translationale Fusionen) in WormBase 44.
Hinweis: für Projektträger, ca. 1 – 3 Kilobase (kb) ist ausreichend für die meisten C. Elegans Gene. Translationale Fusionsproteine können auch durch die Platzierung eines Gens von Interesse im Rahmen einer spezifischen Promotor Ausscheidungsorgane Kanal gebaut werden (siehe Tabelle 2). - Design forward und reverse Primer für die Amplifikation der Veranstalter (für transkriptionelle Fusionen) und/oder ein voller gen mit Promoter (für Translationale Fusionen). Fügen Sie Restriktionsenzym linker im 5 ’ und 3 ’ Enden der Primer.
Hinweis: Wählen Sie Restriktionsenzyme, die in den Vektor Plasmid (z. B. pPD95.79) 16 vorhanden sind. Für Translationale Fusionen, die 3 ’ Linker sollten entworfen werden, so dass nach Beschränkung Enzym Verdauung und Verbindung mit dem Vektor, Codon Einsatzgestell kontinuierlich mit die Codons der Fluorophor, z. B. GFP werden. Man kann die typischen Restriktionsenzym linker 14 1 oder 2 mehr Basen hinzufügen müssen; Achten Sie darauf, kein Stopcodon erstellen. - Perform Polymerase-Kettenreaktion (PCR) verstärken die Promoter oder Full-length-gen mit live Würmer oder Wildtyp genomische DNA oder cDNA als Vorlage 15.
Hinweis: Wenn Sie Würmer als Vorlage verwenden, zunächst lysiert Würmer Lyse Puffer (PCR Puffer plus Proteinase K) 17. Gemischte Bühne Würmer können als Vorlage verwendet werden. Ausgehungert Würmer können verwendet werden, zur Vermeidung von Kontaminationen mit bakterieller DNA. - Perform Agarose (1 %) gel-Elektrophorese auf PCR-Produkte um die richtige Größe der verstärkten Produkt zu identifizieren.
Hinweis: Wenn Bandgröße korrekt ist, fahren Sie mit nächsten Schritt. Wenn mehrere Bänder generiert werden, verbessern Sie Verstärkung, single-Band zu produzieren. Wenn dies nicht funktioniert, die richtige Band aus dem Gel geschnitten und DNA durch Standardmethoden 15 zu reinigen und dann fahren Sie mit nächsten Schritt. - Perform Beschränkungsauswahl auf das PCR-Produkt und dem Vektor-Plasmid, das Fluorophor (z. B. pPD95.79) in separaten Röhren durch Standardmethoden 15 enthält.
- Trennen die verdaute DNAs durch Gelelektrophorese und eluieren das PCR-Produkt und Vektor-DNA-Bänder in getrennten Röhren.
- Reinigen die DNA vom Gel Scheiben durch Standardmethoden 15. DNA-Konzentration durch Spektralphotometer messen.
- Verbinden das PCR-Produkt und Vektor-DNA durch Standardmethoden und verwandeln die rekombinante DNA in kompetente Zellen durch Standardmethoden 15.
- Verbreiten 10 μL, 50 μL und 100 μL der transformierten Zellen auf drei Einzelplatten Luria Brühe (LB) ergänzt mit 50 μg/mL Ampicillin.
Hinweis: Verbreiten Sie unterschiedliche Mengen an Zellen auf verschiedene Platten für ein Spektrum von Transformation Effizienz. Beispielsweise viel zu dicht Beschichtung kann nicht zulassen, die Isolation der Kolonien wenn Transformation effizient ist. - Die Platten bei 37 ° C inkubieren über Nacht. Am nächsten Morgen nehmen Sie die Platten aus dem Inkubator.
Hinweis: Wenn die Kolonien sehr klein sind, brüten für mehrere Stunden mehr. - Vorbereiten Plasmid DNA aus einzelnen Kolonien von Standardmethoden 15. Mischen Sie Vorlage DNA und Primer und versenden für die Sequenzierung (in der Regel in einem Kern-Service-Center durchgeführt).
- Die Sequenzen zu lesen und überprüfen Sie die Integrität des Fusion-Konstrukts.
Hinweis: kritische: bestätigen den richtigen Codon Rahmen zwischen eingefügten Gene und fluoreszierenden Marker-gen für Übersetzung Fusionen. Sequenz im Idealfall das gesamte gen zu bestätigen, dass keine Mutation während PCR und Ligatur Verfahren eingeführt wurde. - Erzeugen mehr Plasmid-DNA (mit Schritt 1.1.11) zur Injektion für Schritt 1.2.
- Identifizieren die Sequenz des Antragstellers (für transkriptionelle Fusionen) oder des gesamten Gens von Interesse mit seinen Promoter (für Translationale Fusionen) in WormBase 44.
- Generation von transgenen Tieren durch Mikroinjektion von DNA für die Transformation der Keimbahn 18
Hinweis: siehe auch die Diskussion für alternative Techniken für die Einführung von transgenen. Die beschriebenen Verfahren können verwendet werden, um transgene Tiere zu erzeugen, die eine Fluoreszenz-Fusionsprotein oder ein anderes Protein des Interesses zu tragen. Zum Beispiel kann eine exogene Protein neu eingeführte (z. B. einer heterologen Ortholog) oder eine endogene Protein kann wieder zugeführt (z. B. die entsprechenden Keimbahn Mutant für Rettung) oder überexprimiert um einen Phänotyp (z. B. Injektion zu generieren Erm - 1 wurde zur Überexpression zystische Kanal Phänotyp zu generieren, der als Ziel für die Änderung dient der RNAi Interaktion Bildschirm unten beschriebenen).- Mix Konstrukt DNA (1 – 50 ng/μl) mit Marker Plasmid DNA (in der Regel 100 ng/μl), zum Beispiel die dominierende Marker Rol-6 (su1006) (siehe 1.2.3 für Marker-Optionen).
Hinweis: kritische: Konzentration der injizierten DNA muss empirisch bestimmt werden, um die Einführung der artifizielle Phänotypen (Zysten, Erweiterung Mängel, Letalität) zu vermeiden, wenn Gene in die Ausscheidungsorgane Kanäle, die besonders zum Ausdruck zu bringen für den Ausdruck von transgenen empfindlich. Kann man, zum Beispiel, machen verschiedene Mischungen von Plasmiden bei Konzentrationen von 1 ng/μl, 10 ng/μl, 50 ng/μl und 100 ng/μl mit 100 ng/μl rol-6(su1006) Testen verschiedener Konzentrationen für die Generierung eines tragfähigen Stamm mit der gewünschten Ausdruck oder Phänotyp (hohe Konzentrationen sind wahrscheinlich unspezifisch toxisch für Kanal Morphogenese und kann tödlich sein). - Filtern das DNA-Gemisch durch einen 0,22-μm (Mikrometer) Pore Größe Spin-X Zentrifuge Kerzenfilter.
Hinweis: Lassen Sie nicht den Deckel des Rohres offen für Staub zu vermeiden, die die Mikroinjektion Nadeln blockieren können. - Microinject rekombinanten Plasmide in die Gonade der Wildtyp oder mutierten Würmer durch Standardmethoden für die Transformation der Keimbahn (siehe Referenz 18 Verfahren Einzelheiten).
Hinweis: Standard-Marker Plasmide sind, zum Beispiel: rol-6(su1006), Dpy-20, Unc-119, pha-1. Dominierende transgene wie rol-6(su1006) werden in Wildtyp-Würmer, eingeführt, während Rettung transgene in ihren jeweiligen Mutanten eingeführt werden. Marker Plasmide sind für einfache Wartung der transgenen Linien Co eingespritzte da extrachromosomale transgene zufällig verloren während der Zellteilung (siehe 1.2.8). Wenn Gene codieren für Fluorophor Fusionen zu injizieren, können eine Fluorophor, GLP, auch selbst als Marker verwenden. Rol-6 induziert Würmer zu wälzen sich die oft vorteilhaft für die Bewertung der Morphogenese Phänotypen. - Transfer injiziert Würmer auf Escherichia coli ausgesät Nematoden Wachstum Medium (NGM) Platten (z. B. 5 Würmer/Platte) (siehe Referenz 19 für standard C. Elegans Kultur und Wartungsverfahren und Tabelle der Werkstoffe).
- Brüten die Platten und lassen Sie Nachkommen entwickeln bei 20 ° C für ca. 3 d.
- Untersuchen die F1-Nachkommen unter dem sezierenden Mikroskop für Rol (rollende) Würmer (oder jede andere spezifische Injektion Marker, z. B. GFP) und wählen Sie Rollen teinzelnen Platten o.
- Platten mit rollenden F2 Tiere wählen und bestätigen Präsenz der Fluoreszenz unter dem sezierenden Fluoreszenzmikroskop (alle Roller-Tiere sind in der Regel positive GFP).
Hinweis: F2 Rollen zeigen die erfolgreiche Generierung einer transgenen Linie. Einzelne Linien können unterschiedlich sein, z.B. in Bezug auf Transgene Übertragungsrate. Es ist daher sinnvoll zu verwalten und speichern Sie mehrere Linien. - Pflegen die transgenen Linien durch die Anreicherung von neuer Platten für Marker-positiven Tieren.
Hinweis: Die injizierte DNA wird in die Keimbahn als extrachromosomale Array integriert. Übertragungsraten für extrachromosomale Arrays sind variabel, aber in der Regel rund ~ 50 %. Um die Belastung nicht zu verlieren, daher ist es wichtig, manuell Zeilen bereichern mit dominanten Marker (z. B. Linien, die nicht durch negative Auslese gesichert). - Einfrieren transgene Linien durch Einfrieren Standardtechniken für langfristige Lagerung bei-80 ° C 19.
Hinweis: Transgene auf extrachromosomale Arrays können auch in die Keimbahn durch UV-Bestrahlung in einem weiteren Schritt zu homogenen Linien 18 integriert werden. Z. B. Erm-1 wurde in die Keimbahn durch UV-Bestrahlung zu ERM-1 [++]-Stamm integriert fgIs2[erm-1p::erm-1;rol-6p::rol-6(su1006)] wo jedes Tier trägt das Transgen, eine Voraussetzung für den Einsatz in der RNAi-basierten Interaktion-Bildschirm unten beschrieben. Diese Sorte wurde zusätzlich mit der Bezeichnung zytoplasmatischen Ausscheidungsorgane Kanal GFP über Kreuzung in eine Belastung mit einem Vha - 1P:: GFP Transgen (erzeugt durch das gleichen Verfahren wie oben beschrieben, siehe Referenz 20 für grundlegende genetische Verfahren wie Kreuze) und gekennzeichnet als ERM-1 [++]; VHA - 1P:: GFP Stamm unten.
- Mix Konstrukt DNA (1 – 50 ng/μl) mit Marker Plasmid DNA (in der Regel 100 ng/μl), zum Beispiel die dominierende Marker Rol-6 (su1006) (siehe 1.2.3 für Marker-Optionen).
2. Bau eines gezielten RNAi Bibliothek und Design eines RNAi-Interaktion-Bildschirms auf einen Kanal Phänotyp ändern
Hinweis: ein gezielte RNAi-basierten genetischen Interaktion Bildschirm wird beschrieben, die eine Überexpression zystische Kanal Phänotyp, verwendet Suche nach interagierenden Ausscheidungsorgane Kanal Morphogenese Genen. Die ERM-1 [++]-Stamm dient (siehe Schritt 1.2.9) als Beispiel 9. Dieser Ansatz stellt nur eine von vielen möglichen Ansätzen für die genetische Analyse der Ausscheidungsorgane Kanal Lumen Morphogenese (siehe Einführung und Diskussion für andere gentechnische Ansätze). Finden Sie im begleitende Paper am Darm Tubulogenesis 3 und Referenzen 17 , 21 , 22 Hintergrundinformationen über RNAi, Details der RNAi Verfahren, Modulation der RNAi-Stärke (eingestellt auf die oft tödliche Tubulogenesis Gene) und Diskussion von technischen Problemen verbunden RNAi. Siehe Referenz 19 für standard Wurm Kultur und Wartung und Tabelle Materialien.
- ERM-1 (oder andere gen des Interesses) suchen interagierende Moleküle in Datenbanken und veröffentlichten Artikeln.
Hinweis: Mögliche ERM-1 Interaktoren wären alle Moleküle, die wurden experimentell gezeigt, funktional, genetisch oder physisch mit ERM Proteine in irgendeiner Sorte zu interagieren und/oder durch irgendwelche in Silico, hohem Durchsatz dazu vorhergesagt wurden oder Systembiologie Ansatz (siehe Tabelle 3 Beispiele für Datenbanken und Ressourcen). - Erzeugt eine Liste aller Gene und C. Elegans homologe zu finden wo erforderlich.
Hinweis: Erweiterung der Liste der identifizierten Gene zu gen-Klassen, die die Funktion des Gens von Interesse berücksichtigt und erweitert das Netz zur Identifizierung von Interaktoren in Erwägung ziehen (z. B. für die Membran-Aktin-Linker ERM-1, wählen Sie alle Actins und im Zusammenhang mit Actin Moleküle). - Die entsprechenden RNAi bakterielle Fütterung Klone in handelsüblichen genomweite bakterielle RNAi-Bibliotheken für alle Gene zu identifizieren (z.B. Ahringer genomische C. Elegans RNAi Fütterung Bibliothek 21; Tabelle der Materialien)
- Erzeugen eine Tabelle für alle Gene und ihre entsprechenden RNAi-Platte und gut Anzahl.
- Wählen und Streifen ~ 50 RNAi-Klone auf LB/Ampicillin/Tetracyclin-Platten (Wahl des Antibiotikums richtet sich nach Bibliotheksbau) pro Tag und weiter bis gezielt RNAi Bibliothek generiert.
Hinweis: Je nach Bibliotheksgröße und projizierte Workflow, lassen Sie Weg, erzeugen eine vollständige Bibliothek und fahren Sie direkt mit Batch Analyse. Platten können bei 4 ° C, nicht länger als ca. 2 Wochen (wenn nötig, wieder auf neue Teller danach Streifen) gelagert werden. Im Gegensatz dazu eine größere gefrorenen Bibliotheken in replizieren 96-Well oder 384-Well-Format für langfristige Lagerung bei-80 erzeugen kann ° c - Die Platten bei 37 ° C inkubieren über Nacht. Am nächsten Morgen entfernen Platten Inkubator und Store bei 4 ° c
- Pick RNAi Bakterien aus einer Platte mit einem sterilen Zahnstocher, Bakterien mit 600 μL LB/Ampicillin (50 ng/μl) Brühe in 1,5 mL Reaktionscup mischen, die Röhrchen bei 37 ° C inkubieren, schütteln für 6 h
Hinweis: Impfen RNAi Bakterien in die Brühe durch Reiben der Pick (Zahnstocher oder einer Mikropipette Tip) entlang der Seite des die Reaktionscup. - Samen 70 μL kultivierten Bakterien in jede Vertiefung des 6-Well RNAi Platten in doppelter oder dreifacher Sets. Die RNAi-Platten bei 22 ° C über Nacht inkubieren.
Hinweis: RNAi Platten sind durch Standardverfahren (Tabelle der Werkstoffe und Referenzen 3 , 17 , 21) erzeugt und verwendet hier in einem 6-Well-Gewebe Kultur-Plattenformat für einen höheren Durchsatz-Ansatz, der noch für die mikroskopische Beurteilung des Kanals Morphogenese mit lebenden Tieren auf den Platten erlaubt. - Nächsten Morgen, Pick 3 L4 Stadium ERM-1 [++]; VHA - 1P:: GFP Würmer auf jede Vertiefung der RNAi-Platten.
- Zur Vermeidung von Kontaminationen mit OP50 Bakterien (siehe Referenz 19), die RNAi zuerst stören Saatgut die Würmer auf einen Teller NGM ohne Bakterien und lassen Sie die Tiere für ca. 10 min zu kriechen. Verwenden Sie nur gesunde Tiere nicht verhungert.
- Inkubieren Sie die Platten bei 22 ° C für 3-d Tiere Nachkommen produzieren können.
- Untersuchen Kanal Phänotypen in F1-Nachkommen unter den sezierenden Fluoreszenzmikroskop.
3. In Vivo Imaging von C. Elegans Excretory Canal durch Fluoreszenzmikroskopie sezieren und Scoring der Tubulogenesis Phänotypen
- bereiten ein Phänotyp Wertungsblatt (Beispiel in Tabelle 4 dargestellte und Abbildung 5 ).
- Legen die Agarplatte mit Würmern direkt unter dem Fluoreszenz-dissecting Mikroskop, geöffnetem Deckel der Platte für die Bewertung, verwenden Sie geringeren Vergrößerung zu konzentrieren.
Hinweis: Dieses Protokoll beschreibt die Verwendung eines Bereichs mit 1.5 X und 10 X Ziele und einen Zoombereich von 3,5 bis 45 (Table of Materials). - Tiere durch Fokussierung auf jeweils auch separat, beginnend mit gut 1 zu bewerten, und arbeiten Sie die Platte.
Hinweis: Beginnen Sie immer mit der Bewertung von Steuerelementen. Zum Beispiel ein Mock (leerer Vektor) negative Kontrolle (HT115 RNAi Bakterien (siehe Referenzen 17 , 21) ohne oder mit einem unabhängigen gen Einsatz) und entsprechende positive steuert, z. B. Diese Interaktion Bildschirm, Erm-1 RNAi (unterdrückt die ERM-1 [++]-Phänotyp) und sma-1 / Spectrin RNAi (erhöht die ERM-1 [++] Kanal Phänotyp). - Zunächst allgemeine Phänotypen unter hellem Licht zu erkennen (z. B.: Let/tödliche, Clr/klar, Emb/embryonale tödlich, Ste/sterile, Unc/unkoordiniert, Dpy/plumpen, etc.), quantifizieren den Phänotyp durch Gesamtzahl der Tiere und Anzahl zählen Tiere mit dem Phänotyp, notieren Sie die Zahlen (siehe Tabelle 4).
Hinweis: Für Niederschlägen von Genen verursacht Fehler, die Bewertung der Kanal Phänotypen (z.B. Emb, Ste), beeinträchtigen können Wiederholung des Experiments mit bedingten betrachten, post embryonalen RNAi (siehe begleitende Papier für Verfahren 3 ). - Zweitens prüfen Ausscheidungsorgane Kanal Phänotypen unter fluoreszierendem Licht, erzielen messbare Phänotypen (z.B. Länge des Kanals, Breite des Lumens, Zysten), notieren Sie die Zahlen und Phänotypen auf ein Wertungsblatt zu beschreiben (siehe Tabelle 4, < starke Klasse = "Xfig" > Abbildung 5).
Hinweis: Höherer Vergrößerung mit Zoombereich ist erforderlich, um weitere subtile Kanal Phänotypen zu bewerten. Hin und her bewegen zwischen niedrigen und hohen Vergrößerung des Kanals sorgfältig bewerten ’ s Länge und Breite und jeder andere Kanal Morphogenese Phänotyp. Für die Quantifizierung oder semi-Quantifizierung der einfachen Phänotypen, zählen 100 Tiere (z. B. L4s in diesem gezielten RNAi; Phänotypen: Kanal 1/4, 1/2, 3/4 Länge und volle Verlängerung der hinteren Kanäle und Lumen Durchmesser der hinteren Kanäle, klein Zysten (< 1/3 der tierischen Breite), große Zysten (> 1/3 der tierischen Breite); siehe Tabelle 4). - Erwerben Bilder von der vorherrschenden Phänotypen aus mindestens 3 verschiedenen Tieren durch ein Mikroskop montiert kostenfrei – Coupled Digitalgerät (CCD) Kamera und entsprechende Software zur Abbilderstellung (siehe Tabelle der Materialien)
- , Bilder, zu erwerben Zuerst schalten Sie Kamera, angeschlossenen Rechner einschalten Doppelklick das Bildsymbol für Capture-Software, einen Fokusbereich der Wurm Platte manuell unter geringer Vergrößerung und der Verschluss der Kamera öffnen.
- Klicken Sie auf die “ live-Vorschau ” Ikone der Bild-Capture-Software auf dem Computer-Bildschirm zu visualisieren, die Würmer auf dem Computerbildschirm stellen Sie den Fokus manuell zu klar visualisieren die Würmer auf dem Bildschirm, und klicken Sie dann die “ fangen ” Symbol, dann Klicken Sie auf die “ speichern ” Symbol.
Hinweis: Tiere bewegt sich schneller unter fluoreszierendem Licht, daher halten Sie einerseits auf Computer-Maus bereit während der Bewegung der Plattenrandes in den Bereich des Interesses mit der anderen Hand. Klicken Sie dann umgehend die “ fangen ”-Symbol, um das Bild zu erwerben. Es ist normalerweise möglich, ein gutes Bild mit mehreren versuchen erwerben. - Speichern die aufgenommenen Bilder mit einem richtigen Dateinamen (enthalten Stamm, RNAi-Klon-Name und Datum).
Hinweis: Schneller bewegenden Wildtyp Würmer mit dünnen und langen Kanälen sind schwieriger als Mutanten Image. Mutanten mit zystische Kanäle und/oder anderen Phänotypen werden voraussichtlich bewegen sich langsam, und erleichtert so die Bildgebung. Marker-Plasmide wie Rol können nützlich sein für Bildgebung durch Tierhaltung “ an Ort und Stelle ” anstatt bewegen vorwärts und können auch einen besseren Überblick auf den Phänotyp mit dem Tier wälzen sich vorsehen.
4. Imaging von C. Elegans Excretory Kanal mit hoher Auflösung durch Scannen konfokale Lasermikroskopie
- Montage lebende Tiere eine winzige Menge Fett oder Vaseline zu platzieren, an der Spitze von einem Wattestäbchen oder an der Spitze der den Zeigefinger und verteilen das Fett zum Generieren eines ultradünnen Kreis mit einem Durchmesser von ~ 6 – 8 mm in der Mitte einen sauberen Objektträger.
- Platz 6 μl 5 % Lidocain-Lösung (Narkose) in den Kreis von einer Mikropipette.
Hinweis: Eine Stammlösung Lidocain kann erfolgen, durch Lidocain-Pulver in Wasser auflösen. Verdünnen Sie auf 5 % mit M9 Puffer 19 (Table of Materials). Es ist von entscheidender Bedeutung für die Analyse der Ausscheidungsorgane Kanal zu vermeiden die gemeinsame Immobilisierung-Lösungen (z. B. Natriumazid) dazu führen, dass Zysten zu Bruch und das induzieren Kanal Phänotypen. - Wählen Sie mehrere Tiere aus einer RNAi-Platte, und legen Sie sie in die Lidocain-Lösung durch den Wurm Pick 19 in die Lösung eintauchen.
Anmerkung: Wählen Sie vorzugsweise Bühne-spezifischen Tiere, die selbst-Montage durch gleichmäßige Dicke erleichtern werden. Tiere können auf dem sezierenden Fluoreszenzmikroskop vorausgewählt werden. - Legen Sie ein 22 x 22 mm-Deckglas auf den Objektträger; lassen Sie es sanft auf den Fett-Kreis niederzulassen.
Hinweis: Gelten Sie keine physischen Druck auf das Deckglas Kanal Morphologie, vor allem in Mutanten oder RNAi behandelt Würmer mit Kanal und möglicherweise anderen Phänotypen beschädigen könnte. Deshalb ist es wichtig, einen dicken fetten Kreis zu vermeiden; Tiere sind im Idealfall sanft zwischen Objektträger und Deckglas eingeklemmt. - Schreiben Sie den Namen der Probe auf die mattierte Seite weist nach der Glas-Folie. Sofort nehmen Sie die Folie an das konfokale Mikroskop für die Analyse des Kanal-Phänotyps und Bilder zu erwerben.
Hinweis: Verzögerungen können Beschädigung der Kanal Zysten oder ändern in Kanal Lumen Morphologie.
- Acquiring konfokale Bilder
- legen Sie die Folie auf der Probe-Bühne des confocal Mikroskop, konzentrieren sich die Würmer bei kleiner Vergrößerung (10 X).
- Ansicht und wählen Sie Tiere unter 60 X und/oder 100 X Ziele prüfen die Ausscheidungsorgane Kanal ’ s zelluläre und subzelluläre Phänotypen, z.B., Lumen Form und Durchmesser, Größe und Form der Zysten; oder die subzellulären Komponenten für Analyse, beschriftet z.B., apikale/lumenal Membran, Basalmembran, Zytoplasma, Endosomal versus canalicular Vesikel, anderen Organellen (siehe Diskussion, Abbildung 2 und Abbildung 4).
- Erwerben Bilder von bestimmten Phänotyp von Interesse.
Hinweis: Dieses Protokoll beschreibt die Verwendung von einem Laser-scanning-confocal Mikroskop (Table of Materials). Zur Behebung subzelluläre Komponenten in den dünnen C. Elegans sind Ausscheidungsorgane Kanäle, höhere Vergrößerung Ziele (60 X 100 X) erforderlich. Eine rotierende Festplatten confocal Mikroskop kann zur Zeit Zeitraffer Bilder erwerben aber weniger Confocality bietet (siehe Diskussion).- Konfokale Bilder zu erwerben, den Computer einschalten, klicken Sie doppelt auf die confocal Mikroskop-Software und wählen Sie den Laser durch eine spezielle Laser-Symbol anklicken.
- Klicken Sie auf das “ Scan ” Symbol den fokussierten Wurm auf dem Computerbildschirm visualisieren Laser Intensität durch die Software, und klicken Sie erneut auf “ scan ” Symbol Suchlauf, dann klicken auf “ erfassen ” Symbol, um ein Bild aufzunehmen, dann klicken auf “ speichern ” Symbol.
- Bilder mit korrekten Dateinamen speichern und RNAi-Klon, Stamm-Name und Datum enthalten.
Hinweis: Bilder können als Einzel- und mehrere Abschnitte erworben werden (z. B. 10 – 15 Abschnitte entlang der z-Achse). -Schnitt ermöglicht 3D Visualisierung. Erwerben Sie Projektion von Bildern zu und speichern Sie separat, ggf. (je nach Mikroskop). Verwenden Sie für optimale Auflösung Lasereinstellungen mit niedrigen Gewinn, nicht Pinhole zuviel zu öffnen, und fügen Sie mehrere durchschnittlich pro Bild (siehe Referenzen 23 , 24 für allgemeine Diskussion der konfokalen Bildgebung). Achten Sie darauf, Bilder bei Helligkeit unter Sättigungsgrad, um Änderung zu ermöglichen, von imaging-Software (vorzugsweise Verwendung unverändert Bilder) ggf. erwerben. - Bilder von Doppel - oder multiplizieren beschrifteten Kanäle (z.B. grün, rot und blau) auf die gleiche Weise, indem du mehrere Laser-Symbole, aber verwenden sequentielle Scannen durchbluten zwischen Kanälen (kritisch für Co Lokalisierungs-Arbeiten) zu vermeiden.
Hinweis: Eine müssen berücksichtigen Sie den Zeitaufwand für das sequentielle scannen (was auch führt zu einer entsprechenden Erhöhung der Foto Bleichen) und Scanner-Einstellungen zu ändern. Scannen Sie Tiere von einer Folie für mehr als 30 min maximal um unspezifische Effekte auf Kanal Morphologie zu vermeiden nicht. Neue Folie zu montieren, wenn länger Scannen erforderlich ist. - Erwerben entsprechenden differential Interferenz Optik (DIC) / Nomarski Bilder, vor allem wenn Quantifizierung canal und Lumen Durchmesser in Bezug auf den Wurm ’ s Körperlänge und Durchmesser. Überlagern von Fluoreszenz und Nomarski Bilder durch Anklicken “ Overlay ” Symbol, um die Sehenswürdigkeiten zu zeigen ( Abbildung 1 und Abbildung 4A – D).
- Für die Quantifizierung, Messen Fluoreszenzintensität einer beschrifteten Komponente des Interesses von ImageJ Software 25 ( Abbildung 5).
Ergebnisse
Dieses Protokoll beschreibt, wie das C. Elegans Ausscheidungsorgane Kanäle verwenden, um visuell und molekular einzelligen Tubulogenesis und intrazellulären Lumen Morphogenese in einer einzelnen Zelle zu analysieren. Während ihre Erweiterung aus der Zeit der Mitte Embryogenese bis zum Erwachsenenalter weiterhin die vier Ausscheidungsorgane Kanäle ihre basolateralen und apikalen/lumenal Membranen zusammen mit ihren canalicular und Endosomal Endomembrane System und bietet ein einzigartiges Modell für erweitern die in Vivo -Analyse der de Novo polarisiert Membran Biogenese (Abbildung 1). Subzelluläre Komponenten wie apikalen Membranen, Zytoplasma und Endosomal versus canalicular Vesikel visualisiert werden, zum Ausdruck bringen, bestimmte fluoreszierende Fusionsproteine (im Protokoll Abschnitt 1 beschrieben), und sie können voneinander unterschieden werden doppelte oder dreifache Beschriftung in einem einzelnen transgenen Tieres (Abbildung 2). Ein einzigartige Ausscheidungsorgane Kanal Phänotyp (Abb. 3A, B) erzeugte überexprimierenden eine apikale Membran verbunden-Molekül (ERM-1), wird verwendet, um einen gezielten RNAi-Bildschirm, um Gene funktionieren in der apikalen Membran zu identifizieren Ausführung zu veranschaulichen und Lumen Biogenese; Dies dient als ein Beispiel für eine molekulare und visuelle Analyse der polarisierten Membran Biogenese in diesem Modell (im Protokoll Abschnitt 2 beschrieben). Diese ERM-1 [++] Kanal Phänotyp wird verwendet, um wie visuell bewertet und Partitur Unterdrückung (Abbildung 3-D) und Verbesserung (Abbildung 3E-F) zeigen durch sezieren Fluoreszenz-Mikroskopie (im Protokoll Abschnitt 3 beschrieben) . Kanal-Phänotypen, die durch die Modulation der ERM-1-Spiegel zu dienen, zu zeigen, wie Defekte auf der subzellulären Ebene durch konfokale Mikroskopie (Abbildung 4) (beschrieben in Abschnitt 4 Protokoll) zu lösen und wie einfache Kanal-Phänotypen (Kanallänge und Zyste zu quantifizieren Größe) und apikale Membran Biogenese Mängel (Abbildung 5).
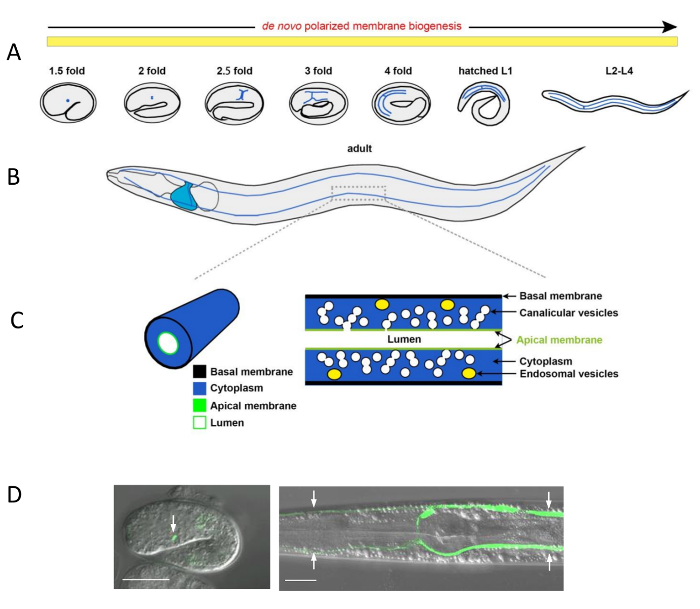
Abbildung 1 : Morphogenese von C. Elegans Excretory Canal und subzellulären Strukturen der Kanal
(A) schematische Darstellung der Ausscheidungsorgane Kanal Erweiterung (blaue Linien) während der Entwicklung des Embryos und Larve. Die Ausscheidungsorgane Zelle erreicht seine endgültigen Speicherort auf der linken Seite der Ventro-Lateral der hinteren Rachenraum Lampe Komma Stadium des Embryos (nicht dargestellt). Wie der Embryo verlängert, reicht es zunächst zwei Arme seitlich nach links und rechts; dann gabelt jeden Arm in einen vorderen und hinteren Zweig. Diese vorderen und hinteren Zweige reichen weiter im gesamten Dehnung des Tieres während vier Larvenstadien, zuerst holt das Tier Wachstum in der L2-Stadium, dann ihr weitere Wachstum bis ins Erwachsenenalter begleitet. De Novo polarisiert Membran Biogenese unterstützt diese Erweiterung bis ins Erwachsenenalter. (B) In das Erwachsene Tier erreichen die vorderen Kanal Zweigen die Nasenspitze und die hinteren Zweige, die Rute (blaue Linien). Die Ausscheidungsorgane Zellkörper ist in der Nähe der hinteren Rachenraum Lampe (blau) dargestellt. Polarisierte Membrandomänen werden im Erwachsenenalter beibehalten. (C) vergrößerte Ansichten von einem Kanalabschnitt Arm. Links: 3D Ansicht der Kanal zeigt: Basalmembran (schwarz), Zytoplasma (blau), lumenal Membran (grün) und das Lumen (weiß). Rechts: Innenansicht des Kanals und der Membranen: Basalmembran (schwarz), Zytoplasma (blau), Endosomen (gelbe ovale), canalicular Vesikeln (weiße Kugeln, verbunden mit jeweils anderen, verbunden mit dem Lumen oder isoliert einzelne Vesikel), apikale Membran (grün) und das Lumen (weiß). (D) Confocal/DIC Overlay Mikrographen der Ausscheidungsorgane Zelle in einem Embryo und die Ausscheidungsorgane Kanäle in eine Larve, gekennzeichnet durch lumenal gegen cytoplasmatische GFP bzw.. Linkes Bild: Ausscheidungsorgane Zelle (grün, Pfeil) in ein 1,5-facher Embryo mit Kanal Lumen visualisiert apikalen ERM-1::GFP unter der Erm-1 -Promoter zum Ausdruck zu bringen. Rechtes Bild: vier Ausscheidungsorgane Kanal Niederlassungen (grün, Pfeil) in L3-Larven, visualisiert durch den zytoplasmatischen Vha - 1P:: GFP. Skalieren von Balken = 20 μm. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2 : Visualisierung subzelluläre Komponenten in Wildtyp Ausscheidungsorgane Canal Armen durch doppelte Kennzeichnung mit fluoreszierenden Fusionsproteine
(A) das Zytoplasma von der apikalen Membran unterscheiden. Ausdruck der GFP unter der Sulp-5 Promoter visualisiert das Kanal Zytoplasma (grün, oben); Ausdruck der ERM-1::mCherry unter seinen eigenen Promotor visualisiert die apikale Membran (rot, Mitte); Zusammenführen von diesen Bildern (unten) unterscheidet zwischen Zytoplasma und die apikale Membran, die sonst nicht zu unterscheiden wäre durch einheitliche Kennzeichnung auch bei hoher Vergrößerung. Maßstabsleiste = 5μm. (B) bestimmen die räumliche Beziehung der Endosomal Vesikel, das Lumen. Visualisierung des Gefäßlumens durch eine apikale membranassoziierten GFP Fusionsprotein (Pseudo-gefärbt rot, oben); Visualisierung von Endosomal Vesikeln zum Ausdruck bringen, mCherry::RAB-7 (Pseudo-gefärbt, blau, Mitte); Verschmelzung dieser Bilder (unten) zeigt die relative räumliche Positionen der Endosomal Vesikel, das Lumen. Maßstabsleiste = 5μm. (C und D) Auflösen von Kanal Rohrformen versus subzelluläre Kanal Komponenten bei verschiedenen Vergrößerungen. Das Zytoplasma der L1-Larven ist beschriftet, GFP unter Sulp-5 Förderer und zytoplasmatischen canalicular Vesikel zum Ausdruck bringen den Wasserkanal AQP-8::mCherry unter der Aqp-8 Veranstalter zum Ausdruck zu bringen. (C) Bilder erworben bei niedriger Vergrößerung beheben eine "Perlen on a String"-Muster, Bühne-spezifische Krampfadern (Krampfadern sind Stauseen reichlich in canalicular Vesikeln und anderen Komponenten für Kanal Wachstum) entspricht, aber tun nicht lösen Sie zytoplasmatischen AQP-8 Puncta. (D) Bilder erworben bei höherer Vergrößerung lösen AQP-8 Puncta im Zytoplasma Kanal entspricht canalicular Vesikel. Maßstabsleisten: C 20 μm und 5 μm in D. Alle Tafeln zeigen konfokale Projektionen von jeweils 10 – 15 Abschnitte. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3 : Scoring-Enhancer und Suppressors eine zystische Canal Phänotyp (ERM-1[++]) durch sezieren Mikroskopie
(A) ERM-1 [++]; Rol-6(su1006) exkretorischen Kanäle werden visualisiert, GFP unter Vha-1 Förderer zum Ausdruck zu bringen. Hinteren Kanäle zu erweitern, bis die Vulva oder Mitte Körper des Tieres (Pfeile; als Verlängerung 1/2) bei geringer Vergrößerung (1,5 X objektiven und niedrigen Zoom). (B) bei höherer Vergrößerung der Signatur ERM-1 [++] kleine zystische gekräuselte Kanal gelöst werden kann, mit der Spitze der hinteren Kanäle (ein Arm wird durch kleine Pfeil) Verlängerung bis nach der Vulva oder etwas weiter (Kanal Vulva wird durch große Pfeil; Lumen im Bedienfeld "D" kann als Wildtyp zum Vergleich betrachtet werden). (C) Unterdrückung, geringer Vergrößerung: länglich und dünne Kanäle in RNAi ERM-1 [++] Tiere behandelt. (D) bei höherer Vergrößerung, hinteren Kanäle sehen Sie fast vollständig ausgefahren, das Heck (kleine Pfeile im Vergleich zu derjenigen der Elterntiere, gezeigt im Bedienfeld "B"); großer Pfeil zeigt die Position der Vulva. (E) Verstärkung: weitere gekürzte Kanäle mit größeren Zysten in RNAi behandelt ERM-1 [++] Tiere; geringer Vergrößerung, kein Zoom. (F) bei höherer Vergrößerung, hinteren Kanal Erweiterung kann bestimmt als weniger als 1/2 (kleiner Pfeil) oder nicht erweitert werden bis hin zur Vulva (durch große Pfeil gekennzeichnet) und Zyste Größe wie von mehr als 1/3 des Tieres Breite (breiter als die des übergeordneten Tieres gezeigt (b). Skalieren von Balken = 400 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
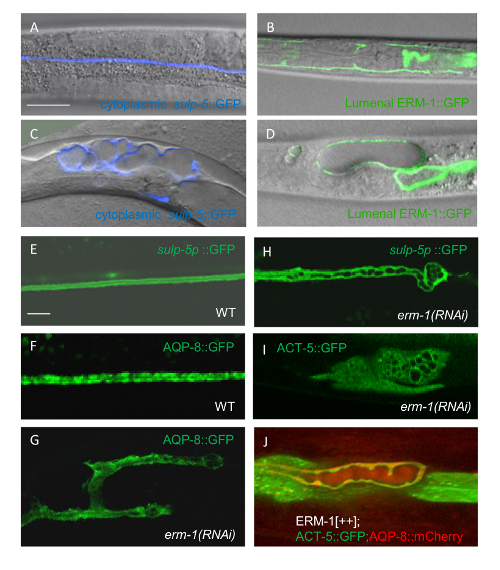
Abbildung 4 : Visuelle Analyse der Ausscheidungsorgane Canal Morphologie und subzelluläre Kanal Komponenten in Mutant/RNAi Tiere durch konfokale Mikroskopie
(A – D) Ein vacuolar von eine zystische Kanal Phänotyp (konfokale/DIC überlagert, die Aufnahmen gezeigt werden) zu unterscheiden. (A) , die das Zytoplasma der Wildtyp Kanal visualisiert wird, zum Ausdruck bringen GFP unter der Sulp-5 Promoter (Pseudo-farbig Blau in der Unterscheidung von apikalen Membran etikettieren, gezeigt im Grün im Bedienfeld "B"). (B) die apikale Membran eines Wildtyp Kanals wird visualisiert, ERM-1::GFP zum Ausdruck zu bringen; Beachten Sie, dass Lumen nicht bei dieser Vergrößerung sichtbar, dass einzelne Kennzeichnung kann nicht von der Membran Etikettierung zytoplasmatischen unterscheiden. (C) Ausscheidungsorgane Kanal Phänotyp induziert durch RNAi: zytoplasmatischen Kennzeichnung nicht zytoplasmatischen Vakuolen von Intralumenal Zysten unterscheiden. (D) Ausscheidungsorgane Kanal Phänotyp induziert durch RNAi: apikale ERM-1::GFP Kennzeichnung erkennt Flüssigkeitsansammlung in das Lumen (lumenal) Zysten statt (zytoplasmatischen) Vakuolen (vergleiche Abbildung 4I für zytoplasmatischen Vakuolen) zu identifizieren. Maßstabsleiste = 40 μm für A – D, gezeigt in A. (E-J) analysieren Verlust und Gewinn-of-Function Auswirkungen auf subzellulärer Kanal Komponenten (konfokale Bilder der einzelnen Kanal Arme werden angezeigt). (E-G) Wirkung der Erm-1 RNAi auf der subzellulären Lokalisierung von Canaliculi. (E) Wildtyp Kanal Zytoplasma; Beachten Sie die GFP Ausgrenzung anzeigt Lumen. (F) Wildtyp cytoplasmatische AQP-8::GFP Puncta, entsprechend canalicular Vesikel. (G) Cytoplasmic und basalen Verschiebung der AQP-8::GFP Puncta erm-1(RNAi) Tier. (H) diskontinuierlich Lumen und Detail der Lumen Spitze Pathologie (Curling und Verlust des Zentrierens Lumen) in erm-1(mildRNAi) Tier siehe (3 für modulierende RNAi Stärke); Beachten Sie, dass die Spitze des Lumens, hier angedeutet durch kleine Zysten, dass Kanal Zytoplasma hinausragt. (I) zytoplasmatischen Vakuolen absondernde Kanal Körper ohne Kanal Erweiterung in stark betroffenen erm-1(RNAi) Tier3; Beachten Sie, dass ACT-5::GFP, das Lumen (mit Ausnahme von einigen kleinen Flecken rund um einige Vakuolen) nicht eingestellt ist. (J) Rekrutierung von überschüssigen ACT-5::GFP und AQP-8::mCherry, das Lumen in dreifach transgenen Tieres überexprimierenden ERM-1 (Hinweis dicken Gürtel von ACT-5::GFP und überlappenden AQP-8::mCherry Klumpen um die zystische Lumen). Maßstabsleiste = 5 μm für E-J, gezeigt in E. Klicken Sie bitte hier, um eine größere Version dieser Figur.

Abbildung 5 : Beispiele für Quantifizierung der Kanal Mängel sezierenden und konfokalen Mikroskopie
(A) schematische Darstellung der Wildtyp (obere Abdeckung) und Mutant zystische (untere Platten) Ausscheidungsorgane Kanäle für die Quantifizierung der Kanal Länge und Zyste Größe. Posterior Kanallänge wird als 0, 1/4, 1/2, 3/4 und 1 quantifiziert. Kanallänge '0' zeigt keine Verlängerung und '1' in voller Länge Verlängerung. Größe der Zyste wird quantifiziert, als < 1/3 (klein) und > 1/3 (groß) der Körperdurchmesser. (B) Quantifizierung der Brutto-Kanal Morphologie in Kontrolle und ERM-1 [++](RNAi) Tiere durch fluoreszierende sezieren Mikroskopie. Bei mock(RNAi) ERM-1 [++] Tieren ist der hintere Kanallänge ca. 1/2 in 95 % Tiere (Referenz-Bild, Bild 3A– B) erweitert. In Suppressor ERM-1 [++](RNAi) Tiere wird der hintere Kanallänge fast vollständig in 80 – 90 % Tiere (Referenz-Bild, Abbildung 3– D) erweitert. In Enhancer ERM-1 [++](RNAi) Tiere, ca. 60-70 % Kanäle haben große Zysten und kürzere Länge (< 1/2) (Referenz-Bild, Abbildung 3E-F). Datendarstellung als ± SD bedeuten (n > 3). (C) Quantifizierung der Fluoreszenzintensität des apikalen/lumenal Kanal Zytoskeletts von ImageJ aus konfokale Bilder. Der Kanal apikale Membran ist gekennzeichnet von ACT-5::GFP, Wildtyp Kanal Arm wird an der linken, ERM-1 [++] Kanal Arm, auf der rechten Seite angezeigt. Links Platten: Intensität der ACT-5::GFP in Wildtyp-Membran-Hülse ist etwa 50 (Wert/Membran grau, mit schwarzen und roten Pfeil angezeigt), Grundstück unter Bild gezeigt. Rechten Platten: Intensität des ACT-5::GFP in ERM-1 [++] ist über 100 (Grauwert des dorsalen Membran beträgt ca. 110 (schwarzer Pfeil) und ventralen Membran beträgt ca. 140 (roter Pfeil)), Grundstück unter Bild gezeigt. Skalieren von Balken = 5 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
| Tabelle 1: Beispiele von Markern für die C. Elegans Ausscheidungsorgane Kanalsystem Membran | ||||
| Proteinnamen | Sub | |||
| Tabelle 2: Beispiele für C. Elegans Excretory Kanal-spezifische Promotoren | ||
| Promotoren | Ausdruck-Bühne | |
| Erm-1 | Komma-Bühne-embryo | |
| SULP-5 | 3-Fold embryo | |
| VHA-1 | 2-Fold embryo | |
| VHA-5 | 2-Fold embryo | |
| AQP-8 | 2-Fold embryo | |
| GLT-3 | späte embryo | |
| 1 Beispiele sind in Tabelle 3 aufgeführten Ressourcen entnommen. | ||
| Tabelle 3: Ressourcen | |||||
| Ressourcen zur Identifizierung von C. Elegans Ausscheidungsorgane Kanal-spezifische Moleküle, Kennzeichnung Reagenzien/Stämme und Antikörper | |||||
| (1) Caenorhabditis Genetik Center (CGC)43 verfügbar Reagenzien und Stämme | |||||
| 2. Wormbase44 für Informationen über die Ausscheidungsorgane Kanal-spezifische Moleküle, Zerrungen und Antikörper | |||||
| 3. Informationen über Ausscheidungsorgane Kanal-spezifische Moleküle: siehe Referenz6 | |||||
| (4) Transgeneome Webseite45 für Translationale GFP Fusion Konstrukte | |||||
| 5. C.elegans Ausdruck Muster46 für transkriptionelle GFP Fusion Konstrukte | |||||
| 6. nationale BioResource Projekt (NBRP)::C.elegans47 für Informationen über C. Elegans Mutanten und Promotoren | |||||
| (7) Fluorophore: siehe Referenz48,49 | |||||
| Web-basierte Ressourcen für die Montage der Moleküle für eine gezielte RNAi-Bibliothek | |||||
| (1) GeneMANIA50 | |||||
| (2) AceView51 | |||||
| (3) iHOP52 | |||||
| 4. Wormbase44 | |||||
| (5) Saccharomyces Genom Datenbank53 | |||||
| 6. Flybase54 | |||||
| 7. Maus Genom Datenbank-55 | |||||
| 8. menschliche Genom Datenbank56 | |||||
| 9. BLAST57 |
| Tabelle 4: Beispiel für einfache Phänotyp Scoring-Blatt | |||||||
| RNAi-Bibliothek | Stamm | Allgemeine Phänotyp (% insgesamt) | Kanal-Phänotyp | ||||
| Kanal Länge < 1/2 (% L4) | Kanal Länge > 1/2 (% L4) | Anderen Kanal-Phänotyp | Gesamtzahl der Tiere gezählt | ||||
| Platte Nr. | Auch Nummer | ||||||
| I-1 | A1 | ERM-1 [++]; VHA - 1P:: GFP | CLR (30) | 80 | 20 | 100 | |
| X-5 | B12 | gleichen | keine | 30 | 70 | 100 | |
| III-10 | C5 | gleichen | UNC (54) | 70 | 30 | große Zysten | 100 |
Diskussion
C. Elegans genetische Flexibilität, Transparenz, einfache Körper Plan und invariante Zelle Abstammung machen es ein hervorragendes Modell für die Analyse der Morphogenese. Dieses Protokoll beschreibt, wie Sie kombinieren standard genetische Manipulationen und Bildgebung Studien nutzen die 2 Mikrometer dünn C. Elegans Ausscheidungsorgane Kanäle um polarisierte Membran und intrazellulären Lumen Biogenese in einer Einzelzelle Röhre zu studieren.
Kennzeichnung
Die C. Elegans Ausscheidungsorgane Kanäle können durch die Expression von fluoreszierenden Fusionsproteine, ermöglicht live-Analyse (hier beschrieben), oder durch Antikörper oder chemische Färbung (siehe begleitende Papier auf intestinale Tubulogenesis für Antikörper Färbung beschriftet werden 3). der Ausdruck von zwei oder mehr verschiedenen Fluorophore oder die Kombination dieser verschiedenen Techniken, Kennzeichnung ermöglicht eine hochauflösende visuelle Zerlegung von diesen dünnen Röhrchen (Abbildung 2). Fluoreszierende Fusionsproteine angewiesen, die Kanäle von einem bestimmten Kanal-Förderer sind die erste Wahl für die Ausscheidungsorgane Kanal Beschriftung aus verschiedenen Gründen, darunter: (1) die geringe Expression Ebenen viele Kanal-Proteine, und (2) den Kanal Feinstruktur, die leicht überwältigt von der Färbung außerhalb der Kanäle, wo das Protein des Interesses auch ausgedrückt werden kann. Auf der anderen Seite Kanäle reagieren empfindlich auf exogene Proteine und unspezifische Phänotypen (z. B.Erweiterung Mängel und Zysten oder sogar Letalität) leicht zu entwickeln als solche Proteine stark zum Ausdruck. Dies sollte in die Entscheidung wiegen, bei der Wahl zwischen verschiedenen Möglichkeiten zur Erzeugung transgener Tiere. Im Prinzip kann transgene als extrachromosomale Arrays (z.B.durch direkte Injektion von Plasmid DNA in die Gonade Keimbahn Transformation, wie hier beschrieben), eingebracht werden erzeugt in der Regel High-Kopie Nummer Arrays (oft mit hohen (Ausdruck), oder integriert in das Genom, in der Regel zu niedrig oder einzelne Kopienzahl (z. B.durch Bombardierung26 oder über einzelne Kopie Mos1-vermittelte Aufnahme [MosSCI]27). Extrachromsomal Arrays können auch integriert das Genom in einem zweiten Schritt (noch, jedoch bei einer hohen Kopienzahl)18. Auf der anderen Seite in die Keimbahn bei niedrigen Konzentration (z. B.1 – 2 ng/µL DNA, kombiniert mit einer höheren Konzentration der Marker-DNA) injiziert, sein niedrig (noch) Exemplar Nummer Arrays einfach generierten28. Dieses Szenario hat den Vorteil, dass DNA-Konzentrationen variiert werden können, die dazu beitragen können, den besten Ausdruck Ebene zum Kanal zu beschriften, weder zu niedrig noch zu hoch (giftig) zu finden. Das Verhältnis zwischen injizierten DNA-Konzentration und Ausdruck Ebene ist abhängig von mehreren Faktoren (z.B. der Projektträger) und muss somit empirisch ermittelt werden. Alternativ kann das gen des Interesses direkt mit einem Fluorophor in der Keimbahn von gruppierten regelmäßig eingestreut kurze palindromische wiederholt (CRISPR) basierte Kennzeichnung Verfahren29,30beschriftet werden. Obwohl dieser Ansatz der Fluorophor in den meisten physiologischen genomische Zusammenhang stellt, ist dies nicht immer notwendig oder sogar wünschenswert (z. B. wenn das Protein auf sehr niedrigem Niveau zum Ausdruck kommt). Kann es jedoch sein, die beste Option, zum Beispiel wenn das gen des Interesses sehr groß ist.
Kanal-Visualisierung kann erreicht werden, durch die Leitung transkriptionelle Konstrukte in den Kanal, der das Kanal Zytoplasma von einer Fluorophor hervorheben. Im Gegensatz dazu erfordert die Kennzeichnung subzelluläre Kanal Komponenten eine translationale Fusion, wo das Full-length-gen im Rahmen der Fluorophor Kodierung gen verbunden ist. Wenn einen Kanal spezifischen Promotor zum Ausdruck (anstatt der Promoter des Gens) verwenden, sollte seiner Wahl des Projektträgers Kraft und für die entwicklungspolitische Analyse, die Zeit ihres Ausdrucks beruhen. Viele Ausscheidungsorgane Kanal spezifischer Gene drücken nicht vor das Larvenstadium wird der Kanal osmotische Funktion kritisch; zu spät für die Analyse von seiner aktiven Ausbauphase (Erm-1 und Profis-1 sind frühe exprimierten Genen)10,13. Für Markierungen der Ausscheidungsorgane Kanal Endo- und Plasmamembranen und Kanal spezifische Promotoren Beispiele in Tabelle 1 und 2, bzw., und Ressourcen für die Suche nach zusätzlichen Kanal-spezifische Moleküle in Tabelle 3. Diese Ressourcen können auch verwendet werden, für die Suche nach einem bereits gemacht geeignet fluoreszierende Fusionsprotein, das möglicherweise durch das Caenorhabditis Genetik Zentrum vorhanden (CGC; siehe auch Tabelle 1). Um rekombinante Plasmide für den Ausdruck von solchen Protein Fusionen zu konstruieren, kann man verschiedenen Klonen Methoden, jeweils mit spezifischen vor- und Nachteile verwenden (an anderer Stelle erläutert14). Dazu gehören konventionelle Restriktionsenzym basierte Ansätze, die hier beschriebenen Klonen, modulare Klonen mit der multisite Gateway System31, Gibson Versammlung32oder Reporter-gen Bau von der "Nähte PCR"-Methode14 ,33. Diese unterschiedlichen Ansätze lässt sich anpassen an die Methode ausgewählt für ihre Einführung in die Keimbahn und/oder an andere Bedürfnisse (z. B. das vielseitige Gateway System erleichtert die Promotoren und cDNAs für größeren Maßstab Kennzeichnung Ansätze mischen) . Darauf zu achten, dass die korrekte Einstichstelle für das Fluorophor (Verknüpfung auf die N-im Vergleich zu C-Terminus des Proteins), unter Berücksichtigung der Funktion des Proteins des Interesses zu wählen.
Interferenzen mit Genfunktion
Als eine von vielen Möglichkeiten, die Genfunktion in C. Eleganszu belästigen beschreibt dieses Protokoll einen gezielte RNAi Interaktion Bildschirm entwickelt, um eine zystische Kanal Lumen Phänotyp, induziert durch überexprimierenden eine lumenal Membran-Komponente zu ändern. In diesem speziellen Fall eine apikale/lumenal Membran überexprimierenden verbundenen Marker wie ERM-1 hat den Vorteil die Untersuchung direkt an das gewünschte Ziel zu lenken: die Analyse der intrazellulären apikalen/lumenal Membran Biogenese. Ein Gain-of-Function-Phänotyp durch Überexpression erzeugt auch bietet gewisse Vorteile, wenn Sie mit einem Verlust der Funktion (RNAi) Interaktion Bildschirm kombiniert, wie hier beschrieben (siehe34 für die Erörterung von Verlust und Gewinn-of-Function-Analysen und die Design der genetischen Bildschirme). ERM-1 selbst ist übrigens ein gut untersuchten "Lumen Morphogenese" und apikale Membran Identität Molekül12. Daher dürfte in diesem Fall ein gezielte (anstatt unvoreingenommener) Bildschirm direkt informativ für Lumen Morphogenese und damit auch weitere kennzeichnende ERM-1 spezifische Funktion in diesem Prozess sein. Allerdings könnte ein unvoreingenommener ungezielte Bildschirm in ähnlicher Weise, entweder mit einem Wildtyp Tier, eines transgenen Tieres mit f ab durchgeführt werdenLuorescently exkretorischen Kanäle, beschriftet oder mit jedem Kanal Mutant. Die allgemeinen vor- und Nachteile von RNAi (z.B.im Vergleich zu Mutagenese) für die Generierung von Verlustfunktion Phänotypen und die Wärmeleitung und Diskussion der verschiedenen Arten von genetischen Bildschirme in C. Elegans werden an anderer Stelle diskutiert 34. RNAi produziert ein Spektrum von Phänotypen, mildere Phänotypen, einschließlich einen besonderen Vorteil für die Analyse der Gene oft tödliche Tubulogenesis. Dies wird beschrieben und diskutiert in den begleitenden Papier auf intestinale Tubulogenesis3. Verschiedene Ansätze, um Gewinn und Verlust der Funktion Mutanten und klassische genetische Verfahren wie Kreuze, generieren sind detailliert und in der Allgemeinen Genetik Methoden Literatur20diskutiert.
Mikroskopie und Auswertung von Tubulogenesis Phänotypen
Visuell auswerten und die Änderung des Phänotyps wohldefinierte Kanal unter einem Mikroskop mit einfachen scoring Parametern (z. B. Kanal und Lumen Durchmesser), sezieren, wie hier beschrieben Leuchtstofflampenlicht scoring können in kurzer Zeit erreicht werden auch bei der Verarbeitung von größeren Anzahl von Tieren gezielt oder systematische genetische oder RNAi-Bildschirm. Im Gegensatz dazu einen ähnlichen Bildschirm auf der Suche nach neuartigen Kanal Morphogenese Phänotypen in einem Stamm, der Wildtyp ist (außer für die Kanal-Kennzeichnung Transgen), wird mehr Zeit in Anspruch, sondern kann im Prinzip auf die gleiche Weise durchgeführt werden (wir haben durchgeführt, so ein Bildschirm auf einer genomweiten Basis in einigen Monaten). Solche Bildschirme werden mehrere verschiedene Kanal-Phänotypen (hier nicht dargestellt) zu identifizieren und deshalb entwickeln müssen entsprechend verschiedene scoring Parameter, z. B., eine qualitative Klassifizierung Schema (siehe 9,11, 35,36,37,38 für verschiedene Möglichkeiten, um Kanal Phänotypen zu erzielen, indem sezieren Mikroskopie). Jeder Kanal Phänotyp zu interpretieren, ist es wichtig zu beachten, dass Zystenbildung kann eine unspezifische Wirkung von vielen verschiedenen Beleidigungen auf diese dünnen röhrenförmigen Struktur, und es oft eine weniger informativ terminal Phänotyp ist. Zyste Größe und Lage, auf der anderen Seite, informativ, möglicherweise z. B., eine Zyste in der Nähe der Kanal-Zelle (zu Beginn des Kanal-Erweiterung), Zysten entlang des Kanals oder Zysten am Kanal Tipps liefern Hinweise auf die zugrunde liegenden Mechanismus der Mängel. Kanal-Zysten (hier definiert als Intra-lumenal Flüssigkeit gefüllten Sphäroide, umgeben von einer apikalen/lumenal Membran) sollte von Vesikeln unterschieden werden (kleine cytoplasmatische Membrane-springen Flüssigkeit gefüllt Sphäroide) oder Vakuolen (erweiterten cytoplasmatische Membrane-springen Flüssigkeit gefüllten Sphäroide), nicht von einer lumenal Membran, die alle Blick oberflächlich identisch (Abb. 4A-D) umgeben. Zytoplasmatischen Vakuolen können auch sekundär, z. B.über toxische Wirkungen von Befestigungslösungen (Natriumazid) entstehen. Sowohl große Zysten und zytoplasmatischen Vakuolen können Sie fast die Größe des Tieres, und müssen weiter vom klassischen unterschieden werden "löschen (Clr)" Kanal Phänotyp, die durch Ansammlung von Flüssigkeit in die Körperhöhle verursacht wird. Zu guter Letzt muss Kanallänge fast immer sekundär in zystische Kanäle beeinträchtigt wird, daher ein wahre Kanal Erweiterung defekt frei inmitten der Zyste nachgewiesen werden.
Trotz ihrer winzigen Durchmessern subzelluläre Komponenten der Ausscheidungsorgane Kanäle, wie z. B. apikalen versus basalen Membranen, intrazelluläre Endosomal versus canalicular Vesikel, intrazellulären Organellen und Zytoskeletts Komponenten visualisiert werden durch höhere Vergrößerung, z.B.konfokalen Mikroskopie (Abbildung 2, Abbildung 4). Durch konfokale Bildgebung ist eine GFP-positiven Kanal Zytoplasma allein ausreicht, um das Lumen von Kanal Zytoplasma über eine nicht-fluoreszierende (Abb. 2A, Abbildung 4E) zu unterscheiden. Die Identität der Markierungen trägt zur Lösung canalicular aus Endosomal Vesikel (auch auffallend unterschiedlicher Größe), obwohl die endgültige Aufteilung Immunoelectronmicroscopy39benötigen. Doppelte und dreifache Beschriftung bestimmen die subzelluläre Lokalisation ein Molekül des Interesses und das Verhältnis von subzelluläre Komponenten zueinander (Abbildung 2). Single beschrifteten lumenal Kanal Membranen produzieren die gleichen Doppellinie als Zytoplasma oder der Basalmembran, aber unterschieden werden über doppelt oder dreifach-Kennzeichnung. Für die konfokale Analyse ordnungsgemäße Montage ist wichtig, angesichts der Fragilität des Kanal-Struktur, seine Sensibilität für osmotische Veränderungen und die Verletzlichkeit seiner häufigsten zystische Phänotyp. Zysten platzen leicht osmotische Veränderungen oder körperlichen Druck, reagieren empfindlich auf Membran Giftstoffe wie Natriumazid und sind auch empfindlich auf einige Anästhetika zur Immobilisierung (das auch zytoplasmatischen Vakuolen produzieren kann). In unseren Händen funktioniert 5 % Lidocain in M9 Puffer am besten für die Ausscheidungsorgane Kanal Assays. Bildgebende Verfahren und alle Handhabung sollte sanft, werden wie beschrieben. Um Artefakte zu vermeiden, die Phänotypen (z.B., Zysten und Vakuolen) zu imitieren, empfiehlt es sich, Bilder sofort nach der Montage zu erwerben. Wenn das nicht möglich ist, sollte zunächst Zyste Bilder erworben werden, vor anderen Phänotypen imaging. Dieses Protokoll beschreibt standard Scan konfokalen Mikroskopie, die bietet überlegene Confocality, verglichen mit spinning Disk konfokalen Mikroskopie, die im Gegensatz dazu reduziert Phototoxizität und die Mikroskopie der Wahl für die Analyse der dynamischen Veränderungen von subzelluläre Komponenten im Laufe der Zeit. Solche Fragen auf subzellulärer Dynamik können auch durch Immunofluoreszenz Techniken oder Kennzeichnung Fusionsproteine mit Foto-schaltbare Fluorophore, die Farbe40ändern behoben werden. Zu guter Letzt das Spektrum der Auflösung kann weiter erhöht werden durch Hinzufügen von Transmissions-Elektronenmikroskopie (TEM, Bereitstellung der höchsten strukturellen aber nicht molekularen Auflösung), super-Auflösung Mikroskopie (Bereitstellung von molekularer Auflösung im Nanometerbereich); oder Immunoelectronmicroscopy (vorausgesetzt beide)39,41. 3D Computertomographie mit TEM Schnittserien kombinierbar und eignet sich besonders für die Analyse der Schnittstelle canalicular Plasmamembran Ausscheidungsorgane Kanäle9,10. Verbesserte Techniken für diese verschiedenen Arten der Mikroskopie und Kombinationen dieser verschiedenen bildgebenden Ansätze weiter entwickelt werden.
Offenlegungen
Die Autoren erklären, dass sie keine finanziellen Interessenkonflikte.
Danksagungen
Wir danken M. Buechner (University of Kansas, Kansas, USA), K. Nehrke (Medical Center der Universität von Rochester, Rochester, New York, USA) und dem Caenorhabditis Genetik Center, gefördert durch die National Institutes of Health, Office of Research Infrastructure Programme (P40 OD010440). Diese Arbeit wurde unterstützt durch Zuschüsse des NIH GM078653, MGH ist 224570 und SAA-223809, V.G.
Materialien
| Name | Company | Catalog Number | Comments |
| Cloning | |||
| Plasmid pPD95.75 | Addgene | Cat. No. 37464 | |
| PCR Kit | Qiagen | Cat. No. 27106 | |
| Ligation kit | New England Biolabs | Cat. No. E2611L | |
| DNA marker | Thermo Scientific | Cat. No. SM1331 | |
| Agarose DNA grade | Fisher Scientific | Cat. No. BP164-100 | |
| Competent cells | New England Biolabs | Cat. No. C2987H | |
| Tris | Fisher Scientific | Cat. No. BP154-1 | |
| EDTA | Sigma | Cat. No. ED-1KG | |
| Acetic acid | Fisher Scientific | Cat. No. A38S-500 | |
| Ethidium bromide | Fisher Scientific | Cat. No. BP1302-10 | |
| Equipments | |||
| PCR machine | MJ Research | Cat. No. PTG-200 | |
| Centrifuge | Eppendorf | Cat. No. 5415C | |
| Water Bath | Precision Scientific | Cat. No. 666A3 | |
| Gel running instrument | Fisher Scientific | Cat. No. 09-528-165 | |
| Gel running power supply | Fisher Scientific | Cat. No. 45-000-465 | |
| Molecular Imager Gel Doc XR System | Bio-Rad | Cat. No. 1708195EDU | |
| Nanodrop Spectrophotometer | Thermo Scientific | Cat. No. ND1000 | |
| C. elegans related1 | 1see reference19 for standard C. elegans culture and maintenance procedures. | ||
| LB Medium and plates2 | 2see reference19 for protocols. | ||
| Tryptone | Acros Organics | Cat. no. 611845000 | |
| Yeast Extract | BD Biosciences | Cat. no. 212750 | |
| NaCl | Sigma | Cat. no. S7653 | |
| Bacto Agar | BD Biosciences | Cat. no. 214040 | |
| Ampicillin | Sigma | Cat. no. A0116 | |
| Tetracycline | Fisher Scientific | Cat. no. BP912 | |
| M9 Medium2 | 2see reference19 for protocols. | ||
| NaCl | Sigma | Cat. no. S7653 | |
| KH2PO4 | Sigma | Cat. no. P0662 | |
| Na2HPO4 | Sigma | Cat. no. S7907 | |
| MgSO4 | Sigma | Cat. no. M2773 | |
| NGM plates 2 | 2see reference19 for protocols. | ||
| NaCl | Sigma | Cat. no. S7653 | |
| Peptone | BD Biosciences | Cat. no. 211677 | |
| Tryptone | Acros Organics | Cat. no. 611845000 | |
| Bacto Agar | BD Biosciences | Cat. no. 214040 | |
| MgSO4 | Sigma | Cat. no. M2773 | |
| CaCl2 | Sigma | Cat. no. C3881 | |
| Cholesterol | Sigma | Cat. no. C8667 | |
| K2HPO4 | Sigma | Cat. no. P3786 | |
| KH2PO4 | Sigma | Cat. no. P0662 | |
| RNAi plates3 | 3see reference21 for protocols. | ||
| NaCl | Sigma | Cat. no. S7653 | |
| Peptone | BD Biosciences | Cat. no. 211677 | |
| Tryptone | Acros Organics | Cat. no. 611845000 | |
| Bacto Agar | BD Biosciences | Cat. no. 214040 | |
| MgSO4 | Sigma | Cat. no. M2773 | |
| CaCl2 | Sigma | Cat. no. C3881 | |
| Cholesterol | Sigma | Cat. no. C8667 | |
| K2HPO4 | Sigma | Cat. no. P3786 | |
| KH2PO4 | Sigma | Cat. no. P0662 | |
| IPTG | US Biological | Cat. no. I8500 | |
| Carbenicillin | Fisher Scientific | Cat. no. BP2648 | |
| NaOH | Fisher Scientific | Cat. no. SS266-1 | |
| Sodium hypochlorite | Fisher Scientific | Cat. no. 50371500 | |
| Bacteria | |||
| OP50 bacteria | CGC | ||
| HT115 bacteria | CGC | ||
| Genome-wide RNAi libraries | |||
| Ahringer genome-wide RNAi feeding library (ref21,58,59) | Source BioScience | ||
| C. elegans ORF-RNAi feeding library (ref60) | Source BioScience | ||
| Imaging related | |||
| Lidocaine | MP Biomedicals,LLG | Cat. no. 193917 | |
| Materials | |||
| Vacuum Grease Silicone | Beckman | Cat. no. 335148 | |
| Microscope slides | Fisher Scientific | Cat. no. 4448 | |
| Tissue culture plate, 6 well | Corning Inc. | Cat. no. 08-772-33 | |
| Equipment | |||
| SMZ-U dissecting microscope (Nikon) | |||
| SZX12 dissecting microscope (Olympus), equipped with a high-power stereo fluorescence attachment (Kramer Scientific), CCD camera with Q capture software and X-Cite fluorescent lamp (Photonic Solutions). | |||
| TCS SL Laser-scanning confocal microscope (Leica Microsystem) | |||
| C2 laser-scanning confocal mounted on an ECLIPSE Ti-E inverted microscope (Nikon) |
Referenzen
- Lubarsky, B., Krasnow, M. A. Tube morphogenesis: making and shaping biological tubes. Cell. 112 (1), (2003).
- Sundaram, M. V., Cohen, J. D. Time to make the doughnuts: Building and shaping seamless tubes. Semin. Cell Dev. Biol. S1084-9521, 30130-30136 (2016).
- Zhang, N. The C. elegans intestine as a model for intercellular lumen morphogenesis and in vivo polarized membrane biogenesis at the single-cell level. JoVE. , (2017).
- Andrew, D. J., Ewald, A. J. Morphogenesis of epithelial tubes: Insights into tube formation, elongation, and elongation. Dev. Biol. 341 (1), 34-55 (2010).
- Nelson, F. K., Albert, P. S., Riddle, D. L. Fine structure of the Caenorhabditis elegans secretory-excretory system. J. Ultrastruct. Res. 82 (2), 156-171 (1983).
- Sundaram, M. V., Buechner, M. The Caenorhabditis elegans Excretory System: A Model for Tubulogenesis, Cell Fate Specification, and Plasticity. Genetics. 203 (1), 35(2016).
- Altun, Z. F., Hall, D. H. Excretory system. WormAtlas. , (2009).
- Buechner, M. Tubes and the single C. elegans excretory cell. Trends Cell Biol. 12 (10), 479-484 (2002).
- Khan, L. A. Intracellular lumen extension requires ERM-1-dependent apical membrane expansion and AQP-8-mediated flux. Nat. Cell Biol. 15 (2), 143-156 (2013).
- Kolotuev, I., Hyenne, V., Schwab, Y., Rodriguez, D., Labouesse, M. A pathway for unicellular tube extension depending on the lymphatic vessel determinant Prox1 and on osmoregulation. Nat. Cell Biol. 15 (2), 157-168 (2013).
- Buechner, M., Hall, D. H., Bhatt, H., Hedgecock, E. M. Cystic canal mutants in Caenorhabditis elegans are defective in the apical membrane domain of the renal (excretory) cell. Dev. Biol. 214 (1), 227-241 (1999).
- Fehon, R. G., McClatchey, A. I., Bretscher, A. Organizing the cell cortex: the role of ERM proteins. Nat. Rev. Mol. Cell Biol. 11 (4), 276-287 (2010).
- Gobel, V., Barrett, P. L., Hall, D. H., Fleming, J. T. Lumen morphogenesis in C. elegans requires the membrane-cytoskeleton linker erm-1. Dev. Cell. 6 (6), 865-873 (2004).
- Boulin, T., et al. Reporter gene fusions, WormBook. The C. elegans Research Community, WormBook. , April 5, 2006 http://www. wormbook.org (2006).
- Sambrook, J. Molecular cloning: a laboratory manual. Sambrook, J., DW, R. ussell , Cold Spring Harbor Laboratory Press . (2006).
- Fire, A., Harrison, S. W., Dixon, D. A modular set of lacZ fusion vectors for studying gene expression in Caenorhabditis elegans. Gene. 93 (2), 189-198 (1990).
- Ahringer, J. Reverse genetics, WormBook. The C. elegans Research Community, WormBook. 6, April 6, 2006 http://www. wormbook.org (2006).
- Transformation and microinjection, WormBook. The C. elegans Research Community, WormBook. Evans, T. C. , April 6, 2006 http://www.wormbook.org (2006).
- Maintenance of C. elegans, WormBook. The C. elegans Research Community, WormBook. Stiernagle, T. , February 11, 2006 http://www.wormbook.org (2006).
- Genetic mapping and manipulation: Chapter 7-Making compound mutants, WormBook. The C. elegans Research Community, WormBook. Fay, D. , February 17, 2006 http://www.wormbook.org (2006).
- Kamath, R. S., Ahringer, J. Genome-wide RNAi screening in Caenorhabditis elegans. Methods. 30 (4), 313-321 (2003).
- Timmons, L., Court, D. L., Fire, A. Ingestion of bacterially expressed dsRNAs can produce specific and potent genetic interference in Caenorhabditis elegans. Gene. 263 (1-2), 103-112 (2001).
- Pawley, J. B. Handbook of Biological Confocal Microscopy. , Springer. (2006).
- Hibbs, A. R. Confocal Microscopy for Biologists. , Springer. US. (2004).
- Bankhead, P. Analyzing fluorescence microscopy images with ImageJ. , (2014).
- Praitis, V., Casey, E., Collar, D., Austin, J. Creation of low-copy integrated transgenic lines in Caenorhabditis elegans. Genetics. 157 (3), 1217-1226 (2001).
- Frøkjaer-Jensen, C. Single-copy insertion of transgenes in Caenorhabditis elegans. Nat. Genet. 40 (11), 1375-1383 (2008).
- Mello, C. C., Kramer, J. M., Stinchcomb, D., Ambros, V. Efficient gene transfer in C. elegans: extrachromosomal maintenance and integration of transforming sequences. EMBO J. 10 (12), 3959-3970 (1991).
- Barrangou, R. Cas9 Targeting and the CRISPR Revolution. Science. 344 (6185), 707-708 (2014).
- Dickinson, D. J., Goldstein, B. CRISPR-Based Methods for Caenorhabditis elegans Genome Engineering. Genetics. 202 (3), 885-901 (2016).
- Esposito, D., Garvey, L. A., Chakiath, C. S. Gateway cloning for protein expression. Methods Mol. Biol. 498, 31-54 (2009).
- Gibson, D. G. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nat. Methods. 6 (5), 343-345 (2009).
- Hobert, O. PCR fusion-based approach to create reporter gene constructs for expression analysis in transgenic C. elegans. Biotechniques. 32 (4), 728-730 (2002).
- Jorgensen, E. M., Mango, S. E. The art and design of genetic screens: caenorhabditis elegans. Nat. Rev. Genet. 3 (5), 356-369 (2002).
- Berry, K. L., Bulow, H. E., Hall, D. H., Hobert, O. A. C. elegans CLIC-like protein required for intracellular tube formation and maintenance. Science. 302 (5653), 2134-2137 (2003).
- Mattingly, B. C., Buechner, M. The FGD homologue EXC-5 regulates apical trafficking in C. elegans tubules. Dev. Biol. 359 (1), 59-72 (2011).
- Shaye, D. D., Greenwald, I. The disease-associated formin INF2/EXC-6 organizes lumen and cell outgrowth during tubulogenesis by regulating F-actin and microtubule cytoskeletons. Dev. Cell. 32 (6), 743-755 (2015).
- Lant, B. CCM-3/STRIPAK promotes seamless tube extension through endocytic recycling. Nat. Commun. 6 (6), 6449(2015).
- Paupard, M. C., Miller, A., Grant, B., Hirsh, D., Hall, D. H. Immuno-EM localization of GFP-tagged yolk proteins in C. elegans using microwave fixation. J. Histochem. Cytochem. 49 (8), 949-956 (2001).
- Lukyanov, K. A., Chudakov, D. M., Lukyanov, S., Verkhusha, V. V. Photoactivatable fluorescent proteins. Nat. Rev. Mol. Cell Biol. 6 (11), 885-891 (2005).
- Bates, M., Huang, B., Dempsey, G. T., Zhuang, X. Multicolor super-resolution imaging with photo-switchable fluorescent probes. Science. 317 (5845), 1749-1753 (2007).
- Sherman, T. The abts and sulp families of anion transporters from Caenorhabditis elegans. Am. J. Physiol. Cell Physiol. 289 (2), C341-C351 (2005).
- Caenorhabditis Genetics Center (CGC). , http://cbs.umn.edu/cgc/home (2017).
- Wormbase. , http://www.wormbase.org/ (2017).
- Transgeneome website. , https://transgeneome.mpi-cbg.de/transgeneomics/index.html (2017).
- C. elegans expression pattern. , http://gfpworm.org/ (2017).
- National BioResource Project (NBRP)::C. elegans. , https://shigen.nig.ac.jp/c.elegans/ (2017).
- Heppert, J. K. Comparative assessment of fluorescent proteins for in vivo imaging in an animal model system. Mol. Biol. Cell. 27 (22), 3385-3394 (2016).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nat Methods. 2 (12), 905-909 (2005).
- GeneMANIA. , http://genemania.org/ (2017).
- AceView. , http://www.ncbi.nlm.nih.gov/ieb/research/acembly/ (2017).
- iHOP. , http://www.ihop-net.org/UniPub/iHOP / (2017).
- Saccharomyces Genome Database. , http://www.yeastgenome.org (2017).
- Flybase. , http://www.flybase.org (2017).
- Mouse Genome Database. , http://www.informatics.jax.org (2017).
- Human Genome Database. , http://www.gdb.org (2017).
- BLAST. , https://blast.ncbi.nlm.nih.gov/Blast.cgi (2017).
- Kamath, R. S., Martinezcampos, M., Zipperlen, P., Fraser, A. G., Ahringer, J. Effectiveness of specific RNA-mediated interference through ingested double-stranded RNA in Caenorhabditis elegans. Genome Biol. 2 (1), RESEARCH0002(2001).
- Kamath, R. S. Systematic functional analysis of the Caenorhabditis elegans genome using RNAi. Nature. 421 (6920), 231-237 (2003).
- Rual, J. F. Toward improving Caenorhabditis elegans phenome mapping with an ORFeome-based RNAi library. Genome research. 14 (10B), 2162-2168 (2004).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten