Method Article
C. 线虫排泄管作为细胞内腔形态发生和体内极化膜生物在单个细胞中的模型: GFP-融合、rna 干扰界面和成像的标记
摘要
C. 线虫排泄管是一种独特的单细胞模型, 用于可视化的体内分析从头生物极化膜。该协议描述了标准的遗传/rna 干扰和成像方法相结合, 适用于定向单细胞 tubulogenesis、顶端膜和腔生物的分子的鉴定和表征。
摘要
四C. 线虫排泄运河是狭窄的管子延伸通过动物的长度从一个单细胞, 与几乎相等地延长的细胞内 endotubes 修造和稳定流明用膜和 submembraneous顶端字符的骨架。排泄细胞扩大其长度约2000倍, 以产生这些运河, 使该模型独特的在体内评估的de 从头极化膜生物, 胞内管腔内形态发生和单细胞tubulogenesis这里介绍的协议显示了如何结合标准标记, 增益和功能的遗传或 rna 干扰, 和微观的方法, 使用这个模型, 视觉解剖和功能分析这些过程的分子水平。作为标记方法的一个示例, 该协议概述了用荧光融合蛋白生成转基因动物, 用于 tubulogenesis 的实时分析。作为一种遗传方法的例子, 它突出了视觉 RNAi-based 交互界面的关键点, 旨在改变功能囊状管的表型。所描述的具体方法是如何: 通过表达荧光蛋白来标记和可视化运河;构建有针对性的 rna 干扰文库, 并制定策略性 rna 筛选方法, 对运河形态发生的分子分析;视觉评估运河表型的改变;通过解剖荧光显微镜对其进行评分;用共焦显微镜对高分辨率亚细胞导管成分进行表征;并量化可视化参数。该方法对于有兴趣利用C. 线虫排泄管的研究人员是有用的, 用于识别和表征细胞内腔和单细胞 phylogenetically 保守过程中涉及的基因。管状形态。
引言
所有的内脏器官都是由管子组成的, 它们的各种功能非常关键, 如气体、液体和养分的运输和交换, 以及代谢废物的排泄。他们的极化特性, 具有独特的顶端和腔膜, 是适应这些特定功能, 和缺陷的生物其内膜和细胞膜系统是一个常见的原因, 人类疾病1,2。血管和内脏的大多数管是多细胞的, 形成流明 intercellularly;然而, 单细胞管, 形成流明细胞, 可以, 例如, 代表多达30-50% 人毛细血管床2。和单细胞管的极化膜在成分上是相似的, 虽然它们的微可能根据管的特定功能而有所不同 (例如, 在线虫中, 排泄管小与小肠微绒毛) 线虫;有关C. 线虫肠道 tubulogenesis)3的附随纸张。极化膜生物和 tubulogenesis 的原理在后生中保存, 而类似的分子机械则指示它们1,2,4。
线虫排泄系统由五细胞组成: 排泄细胞 (EC)、导管细胞 (DC)、孔隙细胞 (PC) 和两个腺体细胞。消融的 EC, DC 或 PC 导致体液积聚在体腔和动物死亡早期幼虫阶段5。有趣的是, 这三单细胞生物用三种不同的方式创造了它们的流明: 细胞空洞化 (EC);细胞包裹结合 autocellular 结形成 (个人计算机);与 autofusion (DC) 相结合的细胞包裹;腔内形态发生的不同机制都是 phylogenetically 保守的6,7。该 EC 位于咽后部的左外侧, 发出两个侧向延伸, 四根运河伸出来将前和向后 (在左右两侧) 延伸到蠕虫的鼻尖和尾部。分别 (图 1)5、6、8。EC 从大约1µm 延伸到 2 x 1000 µm, 使它成为动物中最大的细胞。在亚细胞水平上, 排泄管是一个简单的管, 产生从一个基膜的方向 pseudocoelom, 并通过隧道腔膜 (endotube)。运河腔膜连接到导管腔膜在其唯一的细胞间结;运河是否则 junctionless 沿他们的长度 (图 1)。排泄管腔膜及其 submembraneous 细胞骨架顶端, 其分子组成的定义, 类似的顶端膜的组成和 submembraneous 细胞骨架的多细胞管, 如肠道,和其他 (如, 扁平) 上皮细胞。细胞质细胞器, 包括内涵水泡和其他 (如, 高尔基体) endomembranes 沿运河的长度分布。此外, 多个小囊泡--或者连接到腔膜, 和/或互联, 或隔离--通过运河细胞质7,8,9,10.这种动态的等离子膜/小连接进一步扩大了运河的膜系统, 并有助于流明形态发生和渗透10。因此, 排泄管几乎完全由内膜和细胞膜组成, 为极化膜生物的分析和细胞膜界面的调节提供了良好的模型。在运河 morphogenesis-in 的顶端膜的戏剧性扩展这个单细胞系统与流明扩展一致-也允许分析因需要稳定和中心的细胞内腔膜所引起的建筑问题.本议定书的重点是分析运河管和流明的结构形态发生和细胞内膜动力学所需的这个过程, 而不是信号的细胞运动, 产生 EC 的位置在排泄系统和构造它与其他细胞元素的错综复杂的连接 (在6中进行了回顾)。
C. 线虫单细胞管系统的进一步优势对极化膜和胞内腔的分析生物是它的能力分离, 通过发展时间, 它的细胞膜的不同的组分的世代和路口。EC 出生于腹侧闭合时, 在中期胚胎发育期间腹侧咽,5,6,8, 其间出现侧向管延伸和分支。随后是晚期胚胎发生后的前段后道延长, 这一过程将持续到 L1-larval 阶段 (图 1)。在一个新孵出的幼虫中, 后管尖端达到近似的蠕虫中间, 完全延伸到尾部的 L1 阶段结束, 之后的时间运河拉长与蠕虫8。在第一个幼体阶段, 以高于动物生长速度的活性运河生长结束, 然而, 在其他幼体期 (L2–4) 中, 进一步的生长与整个动物的生长同时发生。此设置提供了一个机会来分析不同的步骤, de 从头极化膜生物独立于极化细胞分裂或迁移。此外, 它允许分离这个过程从接合 (在胚胎发生在流明开始之前);它们在膜极化中的确切要求在极性领域仍然是一个开放的问题。最后, 它唯一的分离顶端从基底膜扩张, 后者的过程前在排泄运河10。因此, C. 线虫排泄管模型是一种特别翔实的肠道模型的补充, 它在极化膜生物的分析中具有许多优点, 但在多细胞环境中执行它 (见肠道 tubulogenesis 的附文3)。
虽然野生型运河是超薄小管在这个微小的蠕虫, 他们的流明可以是 visualized 直接由 Nomarski 光学在这透明动物。实际上, 突变型的胆囊管形态可以用低放大解剖显微镜来描述, 它在前向遗传筛检中的应用对 tubulogenesis11中所涉及的基因有很大的影响。改进的可视化的运河形态学和他们的极化膜, 骨架成分, 不同的细胞器和其他亚结构的区别, 但是, 需要标记和更高的功率荧光解剖和共聚焦显微镜。虽然运河的精细结构带来了许多困难的标签和显微镜, 膜和亚细胞成分可以区分通过特定的分子每个舱室, 和动物可以安全地安装显微镜, 如果采取了某些预防措施以避免引入工件 (请参见协议和讨论)。标记可以通过免疫组织化学在固定标本, 或通过生成转基因蠕虫表达荧光融合蛋白在自己的控制下或排泄管特定促进剂为在体内成像。本协议描述后一种标记技术 (参见有关肠道 tubulogenesis 抗体染色的附文3)。
在整个开发过程中, 将在体内丢失-或功能研究与活体成像分析结合在一起的能力使线虫排泄管成为一个特别强的分子模型和单细胞 tubulogenesis 的细胞分析。向前或反向的遗传屏幕可以执行从野生类型或标记的转基因动物, 以确定运河的形态发生表型 (例如, 囊肿) 及其潜在的基因缺陷。或者, 这样的屏幕可以从突变型 (例如, 囊性管) 开始, 并识别此表型的抑制因子或增强剂, 以确定与导致突变型的基因功能交互的基因。导致突变表型的遗传缺陷可能导致损失 (例如、 via基因缺失) 或增益 (如、通过激活突变或通过引入过量的基因拷贝) 的研究功能。前瞻性突变或系统的 rna 干扰屏幕是没有先入为主的基因功能, 并允许无偏见的基因识别涉及的功能的兴趣。考虑到基因组范围内的 rna 干扰喂养库的可用性, 几乎所有的基因都可以通过在线虫中的 rna 干扰而被轻易地击倒, 这样, 任何一个感兴趣的基因或任何一组基因 (如如, 在目标屏幕中) 也可以快速探测为他们的效果在反向遗传学方法。为了演示一种可能的方法组合, 我们在这里描述一个有针对性的 rna 干扰互动屏幕, 从一个功能囊性排泄管突变体, 标记为细胞质管绿色荧光蛋白 (GFP)。突变型的表现是由过度表达的erm-1, 高度保守的C. 线虫同源的膜-肌动蛋白连接器家族 Ezrin-Radixin-Moesin (erm), 这已牵连到流明形态发生和膜组织在许多种类12。C. 线虫ERM-1 本地化到内脏器官的腔膜, 如排泄管和肠道, 并且在两个13中都需要流明形成。ERM-1 过度肌动蛋白和小泡到运河腔膜, 增加通量到流明和产生短囊管和卷曲腔膜与加厚肌动蛋白底漆9。该协议描述了如何产生具有排泄管表达的融合蛋白 (或其他蛋白质) 的转基因菌株;如何执行有针对性的 rna 干扰屏幕, 从这样的菌株开始, 以确定一个运河表型的修饰剂;以及如何通过荧光解剖和共聚焦显微镜对这些屏幕的结果进行直观的分析, 包括简单的方法来量化信息 tubulogenesis 表型。替代标记技术和 rna 干扰的细节, 调整到经常致命的 tubulogenesis 基因, 可以发现在肠道 tubulogenesis3的陪同文件。所有的方法都可以用于各种组合, 用于调查运河 tubulogenesis 的其他问题。
研究方案
1. 用荧光融合蛋白标记 C. 线虫 排泄管 14
注意: 参见肠道 tubulogenesis 的附文 3 用于标记 原位 抗体染色程序, 适用于排泄管。请参见 表 1 , 以了解用于可视化 C. 线虫 排泄管内膜和细胞膜的分子的示例, 表 2 启动子表达式到排泄管的例子, 和 表 3 用于更全面的标记和发起人集合的资源, 包括讨论不同荧光的选择的参考.
- 基于限制性酶的克隆构建组织特异性荧光标记质粒 15
注意: 请参阅 讨论 以了解其他构造方法荧光融合蛋白。- 标识启动子序列 (用于转录融合) 或与其启动子 (用于平移融合) 在 WormBase 44 中的整个基因.
注: 对于推广者, 大约1和 #8211; 3 kilobase (kb) 对于大多数 C. 线虫 基因都是足够的。平移融合蛋白也可以通过在排泄管特定启动子下放置一个感兴趣的基因来构建 (参见 表 2 ). - 设计向前和反向底漆为促进者的放大 (为转录融合) 和/或一个充分的基因与促进者 (为翻译融合)。添加限制酶连接在5和 #8217; 和3和 #8217; 底漆的末端.
注意: 选择在矢量质粒中存在的限制性酶 ( 例如 , pPD95.79) 16 。对于平移融合, 3 和 #8217; 连接器应设计为在限制酶消化和与载体结扎后, 插入密码子帧将连续与密码的荧光, 例如 , GFP。你可能需要增加1或2更多基地对典型的制约酵素连接 14 ;注意不要创建一个停止密码子. - 执行聚合酶链反应 (PCR), 使用活蠕虫或野生型基因组 DNA 或 cDNA 作为模板来放大启动子或全长基因 15 .
注意: 当使用蠕虫作为模板时, 首先溶解蠕虫在裂解缓冲 (PCR 缓冲加蛋白酶 K) 17 。混合阶段蠕虫可用作模板。饥饿的蠕虫可以用来避免细菌 DNA 的污染. - 在 PCR 产品上进行琼脂糖 (1%) 凝胶电泳, 以确定放大产品的正确尺寸.
注意: 如果带大小正确, 请继续下一步。如果生成多个频带, 则可改善放大条件以产生单波段。如果这不起作用, 切开正确的带从胶凝体和净化脱氧核糖核酸由标准方法 15 然后继续下一步. - 在 PCR 产品上执行限制摘要和包含荧光 ( (如 , pPD95.79) 的矢量质粒), 采用标准方法 15 .
- 用凝胶电泳分离经消化的 dna, 并洗 PCR 产物和不同管中的载体 DNA 带.
- 用标准方法将 dna 从凝胶切片中纯化 15 。用分光光度法测定 DNA 浓度.
- 用标准方法结扎 PCR 产物和载体 DNA, 用标准方法将重组基因转化为合格细胞 15 .
- 传播10和 #956; l, 50 和 #956; l 和100和 #956; 转化细胞在三个体 Luria 肉汤 (LB) 板上补充50和 #956; 氨苄西林.
注意: 将不同数量的细胞分散到不同的板块上, 以提高光谱的转化效率。例如, 电镀过于密集, 可能不允许孤立的殖民地, 如果转化是有效的. - 在37和 #176 上孵育盘子。第二天早上, 从孵化器拿出盘子.
注意: 如果菌落非常小, 孵育几个小时. - 用标准方法从单个菌落中制备质粒 dna 15 。混合模板 DNA 和引物和发送的排序 (通常在核心服务中心执行).
- 读取序列并验证融合构造的完整性.
注意: 临界: 确认插入基因与荧光标记基因之间的正确密码子框架, 用于平移融合。理想的情况下, 序列的整个基因, 以确认在 PCR 和结扎过程中没有引入突变. - 为步骤1.2 生成更多的质粒 DNA (使用步骤 1.1.11).
- 标识启动子序列 (用于转录融合) 或与其启动子 (用于平移融合) 在 WormBase 44 中的整个基因.
- 通过微注射 DNA 为系转化生成转基因动物 18 注: 请参阅关于引入转基因的替代技术的讨论。概述的程序可以用来产生转基因动物携带荧光融合蛋白或任何其他蛋白质的利益。例如, 一个外源蛋白可以被新引入 ( 例如 , 一个异源同源) 或一个内生蛋白可以重新引入 (例如, 到其相应的系突变的救援) 或表达生成表型 (例如, 注射的 erm-1 被用来产生过度表达的囊状管表型, 这是通过下面描述的 rna 干扰界面来进行修改的目标。
- 混合构造 dna (1 和 #8211; 50 ng/和 #956; l) 与标记质粒 dna (通常 100 ng/和 #956; l), 例如占主导地位的标记 rol-6 (su1006) (请参见1.2.3 标记选项).
注意: 临界: 在排泄管中表达基因时, 必须根据经验确定注射 DNA 的浓度, 以避免引入 artefactual 表型 (囊肿、延伸缺陷、致死性), 尤其是对转基因的表达敏感。例如, 可以在浓度为 1 ng/和 #956 的质粒中制造几种混合物; l、10 ng/与 #956; l、50 ng/与 #956; l 和 100 ng/和 #956; l 与 100 ng/和 #956; l "su1006" 以测试某一可行应变的生成范围所需的表达或表型 (高浓度可能是非毒性的运河形态发生, 可能是致命的). - 通过 0.22 #956; m (微米) 孔径旋转 x 离心管过滤器过滤 DNA 混合物.
注意: 不要把管子的盖子开着, 以免灰尘堵塞注射针头.
通过标准的系转换方法, 将重组质粒 Microinject 到野生型或变种蠕虫的性腺中 (参见参考资料 18 中的过程详细信息). - 将注入的蠕虫转移到 大肠杆菌 种子线虫生长培养基 (NGM) 板 (如 , 5 蠕虫/板) (请参见参考资料 19 以了解标准的 C. 线虫文化和维护程序 材料表 ).
- 孵育板, 让后代在20和 #176 发展; C 约 3 d.
- 检查在解剖显微镜下的 F1 子代 (滚动) 蠕虫 (或任何其他特定的注射标记, 如 、GFP) 和拾取辊 to 单个板.
- 选择带有滚动 F2 动物的板, 并在解剖荧光显微镜下确认荧光的存在 (通常所有的滚轮动物都是 GFP 阳性).
注: F2 滚筒表明了转基因线的成功生成。对于转基因传输速率, 单个行可能不同, 例如 。因此, 维护和存储几行是很有用的. - 通过丰富新的标记阳性动物的盘子来维持转基因的线条.
注: 注入的 DNA 被纳入系作为一个外数组。外阵列的传输速率是可变的, 但通常在50% 左右。因此, 为了不丢失应变, 必须手动丰富具有主导标记的线条 ( 例如 , 不通过负选择来保护线条). - 在-80 和 #176 的长期存储中采用标准冻结技术冻结转基因品系; C 19 .
注: 在外阵列上的转基因也可以通过紫外线照射将其集成到系中, 从而在另一个步骤中生成均匀线 18 。例如, 通过紫外线照射将 erm-1 集成到系中, 以获取 erm-1 [++] 应变 fgIs2 [erm-1 p:: erm-1; 6 p:: 6 (su1006)) 每种动物携带转基因, 在 RNAi-based 中使用它的要求交互屏幕如下所述。这种菌株是另外标记的细胞质排泄管 gfp 通过交叉在一个应变, 包含一个 vha-1p :: gfp 转基因 (生成的相同程序如上所述; 见参考 20 的基本遗传过程, 如交叉), 被称为 ERM-1 [++]; vha-1p :: GFP 菌株在下面.
注: 标准标记质粒是, 例如: 6 (su1006), dpy-20, unc-119, pha-1 。主要的转基因像 6 (su1006) 被引入到野生类型蠕虫中, 而营救转基因被引入各自的变种。标记质粒是合作易于维护的转基因线, 因为外转基因在细胞分裂期间随机丢失 (见 1.2.8)。当注射基因编码荧光融合, 你也可以使用荧光, GFP, 本身作为标记。 rol-6 诱导蠕虫在自身周围滚动, 这通常有利于对形态表型的评估. - 混合构造 dna (1 和 #8211; 50 ng/和 #956; l) 与标记质粒 dna (通常 100 ng/和 #956; l), 例如占主导地位的标记 rol-6 (su1006) (请参见1.2.3 标记选项).
2。有针对性的 rna 干扰库的构建与 rna 交互作用屏幕的设计修改运河表型
注意: 有针对性的 RNAi-based 基因交互作用屏幕被描述使用一个过度表达的囊状管表现型寻找相互作用的排泄管形态发生基因。ERM-1 [++] 应变 (参见步骤 1.2.9) 充当示例 9 。这种方法仅为排泄管腔形态发生的遗传分析提供了多种可能的方法之一 (参见 介绍 和 讨论 其他遗传方法)。请参阅肠道 tubulogenesis 的附文 3 和参考资料 17 , 21 , 22 , 了解 rna 干扰的背景, 详细信息程序, 调制的 rna 干扰强度 (调整到往往致命的 tubulogenesis 基因) 和讨论的技术问题连接到 rna 干扰。有关标准蠕虫区域性和维护以及 材料表 , 请参见参考 19 。
- 在数据库和已发布文章中搜索 ERM-1 (或其他感兴趣的基因) 交互分子.
注: 潜在的 ERM-1 团员将包括所有实验证明在功能上、基因上或物理上与任何物种的 ERM 蛋白相互作用的所有分子, 并且/或者被预测为任何 在硅片中 这样做, 高吞吐量或系统生物学方法 (有关数据库和资源的示例, 请参见 表 3 ). - 生成所有基因的列表并查找 C. 线虫 同系物在需要的地方.
注意: 考虑将已识别基因的列表扩展到基因类, 这将考虑到感兴趣基因的功能并扩大用于识别团员的网络 ( 例如 , 对于膜-肌动蛋白链接器 ERM-1, 选择所有动和肌动蛋白相关分子). - 在商业上可用的所有基因的全基因组细菌 rna 干扰库中识别相应的 rna 干扰细菌喂养克隆 (, 如 , Ahringer 基因组 C. 线虫的 rna 干扰喂养文库 21 ; 材料表 )
- 生成所有基因及其对应的 rna 干扰板和井号的电子表格.
- 在 LB/氨苄西林/四环素板上选择和条纹〜 50 rna 干扰克隆 (抗生素的选用由图书馆建设决定), 并继续, 直到生成有目标的干扰 rna 库.
注意: 根据库大小和预计工作流, 省略生成完整库并直接进行批分析。盘子可以储存在4和 #176; C, 不超过约2周 (如果需要, re-streak 到新的板块后)。相反, 在-80 和 #176 的长期存储中, 可以在复制96井或384井格式中生成更大的冻结库; C. - 在37和 #176 上孵育盘子。第二天早上, 从孵化箱中取出盘子, 并在4和 #176 储存; C.
- 用无菌牙签从盘子中提取干扰细菌, 将细菌与600和 #956 混合; 在1.5 毫升微中, 用氨苄西林 (50 ng/和 #956; l) 肉汤, 在37和 #176 上孵育管; C, 摇动 6 h.
注: 在微的一侧, 通过揉搓 (牙签或微尖端), 将微生物的干扰接种到肉汤中. - 种子70和 #956; 将细菌培养成每组6个好的 rna 干扰板, 重复或三份。在一夜之间孵育22和 #176 的 rna 干扰板; C.
注意: rna 干扰板是由标准程序 ( 材料表 和参考资料 3 、 17 、 21 ) 生成的, 这里使用的是6井组织文化板格式为一个更高的吞吐量方法仍然允许微观评估运河形态发生在活动物在板材. - 第二天早上, 选择 3 L4 阶段 ERM-1 [++]; vha-1p :: GFP 蠕虫在 rna 干扰板上的每一个井。
- 为了避免 OP50 细菌的污染 (请参见参考 19 ), 该病毒干扰第一种蠕虫在无细菌的 NGM 板上播种, 并让动物爬行约10分钟。只使用 non-starved 的健康动物.
- 在22和 #176 上孵育板; C 为 3 d 允许动物产生后代.
- 在解剖荧光显微镜下检查 F1 子代的导管表型.
3。 在体内 用荧光解剖显微镜和 Tubulogenesis 表型评分法对 线虫 排泄管进行成像
- 准备一个表单评分表 (示例如 表格 4 和 图5所示).
- 将琼脂板与蠕虫直接置于荧光 dissectin 下显微镜下, 打开盖板进行评估, 使用较低的放大倍数对焦.
注意: 此协议描述了使用具有1.5X 和10X 目标的范围以及从3.5 到45的缩放范围 ( 材料表 ). - 通过分别聚焦于每一个井来评估动物, 从1开始, 然后在盘子里工作.
注意: 总是从控件的计算开始。例如, 模拟 (空矢量) 负控制 (HT115 的 rna 干扰细菌 (参见参考 17 , 21 ) 没有或与不相关的基因插入) 和适当的阳性对照, 例如 , 在此交互屏幕, erm-1 干扰 (抑制 erm-1 [+ +] 表型) 和 sma-1 /收缩 rna 干涉 (提高了 erm-1 [+ +] 渠道表型). - 首先, 检查明亮光下的一般表型 (例如: 让/致命, Clr/清除, 教统局/胚胎致命, Dpy/无菌, Unc/不协调, 矮胖, 等 ), 通过计数动物总数和数量来量化表现动物的表型, 记录数字 (请参见 表 4 ).
注: 对于导致可能影响运河表型评价的缺陷的基因的 knockdowns ( 例如 , 教统局,), 考虑重复实验与有条件的, 后胚胎 rna 干扰 (见附文为过程 3 ). - 第二, 在荧光光下检查排泄管表型, 评分可量化表型 (如: , 运河的长度, 流明的宽度, 囊肿), 记录数字, 并在计分单上描述表现型 (参见 表格 4 ,强类 = "xfig" > 图 5 ).
注: 更高的放大率与变焦范围是需要评估更微妙的运河表型。在低和高放大率之间来回移动, 仔细评估运河和 #8217 的长度和宽度以及任何其他的运河形态发生表型。对于简单表型的量化或 semi-quantification, 计数100动物 ( 例如 , L4s 在这个目标的 rna 干扰屏幕; 表型: 运河长 1/4, 1/2, 3/4 和完全延长后运河, 和流明直径后运河, 小囊肿 (和 #60; 1/3 的动物宽度), 大囊肿 (和 #62; 1/3 的动物宽度);请参见 表 4 ). - 通过显微镜安装的数字电荷耦合器件 (CCD) 摄像机和相应的成像软件 (请参阅 材料表 )
- 获取图像, 以获得来自至少3不同动物的主要型式的图像,第一次打开摄像头, 打开连接的电脑, 双击图像捕获软件图标, 在低放大的情况下手动对焦一个区域, 打开相机快门.
- 单击 #8220; 实时预览和 #8221; 计算机屏幕上的图像捕获软件图标将计算机屏幕上的蠕虫可视化, 手动调整焦点以清晰地显示屏幕上的蠕虫, 然后单击和 #8220; 快照和 #8221; 图标, 然后单击 #8220; 保存和 #8221; 图标.
注意: 动物在萤光下会移动得更快, 因此将一只手放在电脑鼠标上, 同时将板块移动到感兴趣的区域。然后立即单击 #8220; 快照和 #8221; 图标获取图像。通常可以通过几次尝试获得一个好的图像. - 用正确的文件名保存获取的图像 (包括应变名称、rna 干扰克隆名称和日期).
注意: 快速移动的野生型蠕虫, 细长的运河比变种人更难想象。具有囊性导管和/或其他表型的突变体可能会缓慢移动, 从而促进成像。标记质粒, 如卷, 可用于保持动物和 #8220 的成像; 在现场和 #8221, 而不是向前移动, 也可以提供一个改善的看法, 在表型与动物滚动本身.
4。高分辨率激光扫描共聚焦显微镜下的 线虫 排泄管的成像
- 安装活动动物
- 在棉签的顶端或尖端放置少量油脂或凡士林食指, 并传播油脂产生一个直径为6和 #8211 的超薄圈; 8 毫米在一个干净的玻璃幻灯片中间.
- 将6和 #956; L 5% 利多卡因溶液 (麻醉剂) 微到圆圈中.
注: 在水中溶解利多卡因粉可制成利多卡因溶液。用 M9 缓冲区 19 ( 材料表 ) 稀释为5%。对排泄管的分析是至关重要的, 以避免常见的固定性溶液 (如叠氮化钠), 导致囊肿破裂, 并诱导导管表型. - 从一个 rna 干扰板中选取几个动物, 并将它们放入利多卡因溶液中, 通过浸入蠕虫拾取 19 进入解决方案.
注意: 优选地挑选特定阶段的动物, 以均匀的厚度使其更易于安装。动物可以在解剖荧光显微镜上预先选定. - 将 22 mm x 22 mm 的片放在玻璃滑梯上; 让它轻轻地落到油脂圈上.
注意: 不要对片施加任何物理压力, 这可能损害运河的形态, 特别是在突变体或 rna 干扰治疗蠕虫与运河和可能其他表型。因此, 避免一个厚的油脂圈是重要的;理想的动物被轻轻夹在玻璃滑梯和盖板之间. - 在玻璃幻灯片的磨砂一侧写上样品的名称。立即采取幻灯片的共焦显微镜分析运河表型和获取图像.
注意: 延迟可能导致运河囊肿的损坏或管腔形态的改变.
- 将6和 #956; L 5% 利多卡因溶液 (麻醉剂) 微到圆圈中.
- 获取共焦图像
- 将幻灯片放在共焦显微镜的采样阶段, 将蠕虫集中在低放大倍数 (10X) 上.
- 查看和选择60X 和/或100X 目标下的动物, 检查排泄管和 #8217 的细胞和亚单位表型, 如 , 囊肿的腔形和直径, 大小和形状; 或标记为分析的亚细胞成分, 如 , 顶端/腔膜, 基底膜, 细胞质, 内涵与小泡, 其他细胞器 (参见 讨论 , 图 2 , 和 图 4 ).
- 获取感兴趣的特定表型的图像.
注: 本协议描述使用激光扫描共聚焦显微镜 ( 材料表 )。要解决瘦 线虫 排泄管中的亚细胞组分, 需要更高的放大目标 (60X 到 100X)。一个旋转盘共焦显微镜可以用来获取时间推移图像, 但提供较少的 confocality (请参见 讨论 )。- 获取共焦图像, 打开计算机, 双击共聚焦显微镜软件, 然后单击特定激光图标选择激光.
- 单击 #8220; 扫描和 #8221; 图标在计算机屏幕上可视化聚焦蠕虫, 通过调整激光强度软件, 然后再次点击和 #8220; 扫描和 #8221; 图标停止扫描, 然后点击和 #8220; 捕获和 #8221; 图标捕获图像, 然后单击并 #8220; 保存和 #8221; 图标.
- 保存具有正确文件名的图像, 包括 rna 干扰克隆名称、应变名称和日期.
注意: 图像可以作为单个和多个部分 ( 例如 , 10 和 #8211; 15 节沿 z-axis) 获取。剖切允许3D 可视化。获取投影图像并在需要时单独保存 (视显微镜而定)。为了获得最佳分辨率, 使用低增益的激光设置, 不要太多地打开针孔, 并为每个图像添加数个平均值 (参见参考 23 , 24 以进行共焦成像的一般性讨论)。请注意在饱和度以下的亮度下获取图像, 以便在需要时通过成像软件进行修改 (最好使用未修改的图像). - 获取或的图像乘以标记的运河 ( 如 绿色、红色和蓝色), 通过单击多个激光图标, 但使用顺序扫描来避免通道之间的出血 (关键共存研究).
注意: 您可能需要考虑顺序扫描所需的时间 (这也会导致相应的照片漂白增加) 并修改扫描仪设置。不要从一张幻灯片中扫描超过30分钟的动物, 以避免不对运河形态的影响。如果需要更长的扫描, 请安装新的幻灯片. - 获取相应的差分干涉光学 (DIC)/Nomarski 图像, 特别是当量化管长和流明直径相对于蠕虫和 #8217; s 体长和直径。通过点击和 #8220 叠加荧光和 Nomarski 图像; 叠加和 #8221; 图标以演示地标 ( 图 1D 和 图 4A 和 #8211;D ).
- 用于量化, 通过 ImageJ 软件测量感兴趣的标记组件的荧光强度 25 ( 图 5C )。
结果
本协议描述如何使用C. 线虫排泄运河, 以视觉和分子分析单细胞 tubulogenesis 和细胞内腔形态发生在一个单一的细胞。在他们从 mid-embryogenesis 到成年, 四排泄运河继续扩展他们的侧和顶端/腔膜连同他们的小和内涵膜系统, 提供一个独特的模式在体内分析de 从头极化膜生物 (图 1)。通过表达特定的荧光融合蛋白 (在协议1节中描述), 亚细胞成分, 如心尖膜、细胞质和内涵与小泡可以可视化, 并可通过一个单一的转基因动物的双重或三重标记 (图 2)。一个独特的排泄管表型 (图 3A–B) 由表达产生的顶端膜相关分子 (ERM-1), 是用来演示如何执行一个有针对性的 rna 干扰屏幕, 以确定基因功能在顶端膜和腔生物;这是一个例子的分子和视觉分析极化膜生物在这个模型 (描述在协议2节)。这一 ERM-1 [++] 渠道表型是用来演示如何视觉评估和评分抑制 (图 3Cd) 和增强 (图 3Ef) 通过解剖荧光显微镜 (描述在协议3节).ERM-1 水平调制诱导的运河表型显示了如何通过共聚焦显微镜 (图 4) (在协议4节中描述) 来解决亚细胞水平上的缺陷, 以及如何量化简单的运河表型 (运河长度和囊肿大小) 和顶端膜生物缺陷 (图 5)。
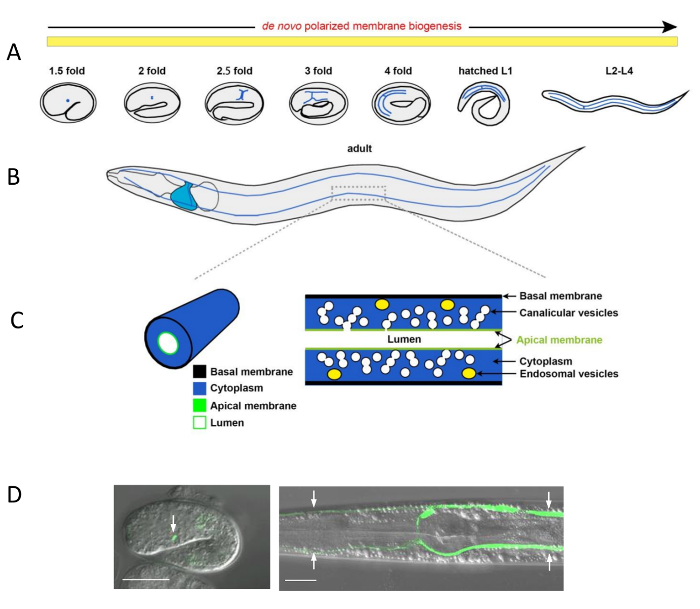
图 1:线虫排泄管和亚细胞管结构的形态发生情况
(A)在胚胎和幼虫发育过程中排泄管延伸 (蓝线) 的示意图表示。排泄细胞到达它的最后位置在左侧腹侧侧的咽后球的逗号阶段的胚胎 (没有显示)。当胚胎拉长, 它首先延伸两个手臂向左右两侧侧向;然后, 每个手臂分成一个前和后支。这些前和后支的分支在四幼体期内进一步延伸到整个动物的伸长期, 第一次赶上动物的生长在 L2 阶段, 然后伴随其进一步增长, 直到成年。De 从头偏光膜生物支持这一延长到成年。(B)在成年动物中, 前运河分支到达鼻尖和后支, 尾部 (蓝线)。排泄细胞体显示在咽后部 (蓝色) 附近。极化膜领域是保持在成年。(C)运河臂部分的放大视图。左: 运河的3D 视图显示: 基底膜 (黑色), 细胞质 (蓝色), 腔膜 (绿色) 和流明 (白色)。右: 运河及其膜的内部视野: 基底膜 (黑色), 细胞质 (蓝色), 体 (黄色椭圆形), 小囊泡 (白色球形, 相互连接, 连接到流明, 或孤立的单泡), 顶端膜 (绿色)和流明 (白色)。(D)分别以腔与细胞质 GFP 为标记的胚胎中排泄细胞和幼虫排泄管的共焦/DIC 叠加显微。左图: 排泄细胞 (绿色, 箭头) 在一个1.5 倍的胚胎, 管腔可视化表达顶端 ERM-1::GFP 在erm-1启动子。正确的图像: 四排泄运河分支 (绿色, 箭头) 在 L3 幼虫中, 通过细胞质的vha-1p的可视化: GFP。缩放条形图 = 20 μ m。请单击此处查看此图的较大版本.

图 2: 用荧光融合蛋白双重标记可视化野生型排泄管武器中的亚细胞成分
(A)将细胞质与顶端膜区分开来。GFP 在sulp-5启动子下的表达可视化运河细胞质 (绿色, 顶部);ERM-1::mCherry 的表达在它自己的启动子之下形象化顶端膜 (红色, 中间);合并这些图像 (底部) 区分细胞质和顶端膜, 否则将无法区分的单一标签, 即使在高倍率。缩放栏 = μ。(B)确定内涵囊泡与流明之间的空间关系。由顶端膜相关的 GFP 融合蛋白 (伪色到红色, 顶端) 的流明的可视化;内涵泡的表达 mCherry::RAB-7 (伪彩色到蓝色, 中部);合并这些图像 (底部) 显示内涵泡的相对空间位置的流明。缩放栏 = μ。(C 和 D)解决运河管形状与亚细胞导管成分在不同的放大。L1 幼虫的细胞质通过在sulp-5启动子和胞浆小泡中表达 GFP, 通过在aqp-8启动子下表达水通道 AQP-8::mCherry 来标记。在较低放大率下获取的(C)图像可解决与阶段特定的静脉曲张相对应的 "beads-on-a 字符串" 模式 (静脉曲张是富含小泡和运河生长所需的其他成分的储层), 但不解决细胞质 AQP-8 点。(D)在较高放大率下获得的图像在运河细胞质中解决 AQP-8 点, 对应小囊泡。标尺:20 μ m 在 C 和5μ m 在 D。所有的面板都显示了10-15 剖面的共焦投影。请单击此处查看此图的较大版本.

图 3: 增强器和抑制器的评分一个囊性管的表型 (ERM-1 [++]) 的解剖显微镜
(A) ERM-1 [++];6 (su1006)排泄管通过在vha-1启动子下表达 GFP 来可视化。后运河延伸到动物的外阴或中间体 (箭头; 被考虑作为1/2 引伸) 在更低的放大倍数 (1.5X 目标和低变焦)。(B)在更高的放大倍数下, 签名 ERM-1 [+ +] 小囊状卷曲管可以解决, 与后运河的尖端 (一臂指示由小箭头) 延伸到外阴或稍超出 (外阴表示大箭头; 运河在面板 D 的流明可以被认为是野生类型比较)。(C)抑制, 低放大率: 在 rna 干扰处理中的细长和细长的运河 1 [++] 动物。(D)在较高的放大倍数下, 可以看到后运河几乎完全伸展到尾部 (小箭头; 与母兽的比较, 如 B 组所示);大箭头表示外阴的位置。(E)增强: 在 rna 干扰处理的 1 [++] 动物中进一步缩短具有较大囊肿的运河;低倍率, 无变焦。(F)在更高的放大倍数下, 后管延伸可以确定为小于 1/2 (小箭头) 或不延伸到外阴 (由大箭头指示) 和囊肿大小超过1/3 的动物的宽度 (比母兽显示的更宽在 B)。缩放栏 = 400 µm.请单击此处查看此图的较大版本.
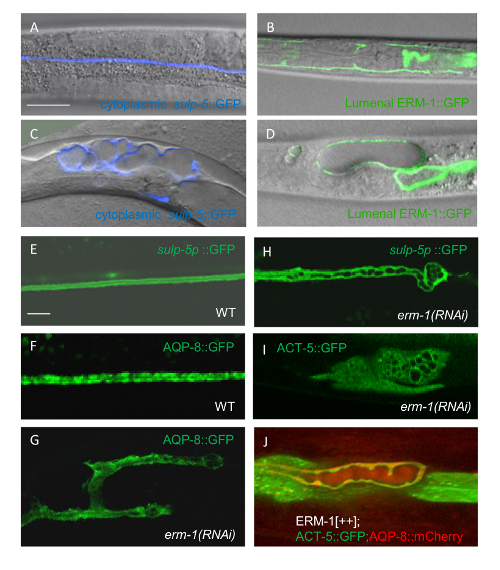
图 4: 通过共焦显微镜观察突变体/rna 干扰动物排泄管形态和亚细胞导管成分的可视化分析
(a-d)区分一个泡从胆囊管表型 (共焦/DIC 叠加显微显示)。(a)野生型运河的细胞质通过在sulp-5启动子下表达 GFP (pseudo-colored 为蓝色, 区别于顶端膜标记, 以绿色显示在面板 B 中) 来可视化。(B)野生型运河的顶端膜通过表达 ERM-1::GFP 可视化;请注意, 流明是不可见的, 在这个放大倍数和单一的标签不能区分细胞质与膜标记。(C) rna 干扰诱导的排泄管表型: 细胞质标记不能区分胞质液泡与 intralumenal 囊肿。(D)由 rna 干扰诱导的排泄管表型: 顶端 ERM-1::GFP 标记检测腔内的液体积聚, 识别 (腔) 囊肿而不是 (细胞质) 液泡 (比较图4I 的细胞质泡)。缩放条 = 40 μ m 为 a-d, 显示在. (E–J)分析对亚细胞导管组件的损耗和功能效应 (显示单管臂的共焦图像)。(电子-g)erm-1 rna 干扰对小亚细胞定位的影响。(E)野生型运河细胞质;注意 GFP 排除表示流明。(F)野生型细胞质 AQP-8::GFP 点, 与小囊泡相对应。(G) AQP-8::GFP 点在erm-1 (rna 干扰)动物中的细胞质和基底移位。(H)在erm-1 (mildRNAi)动物 (参见3中用于调制 rna 干扰强度) 的腔尖端病理 (卷曲和腔内损失) 的间断腔和细节;注意, 运河细胞质的延伸超出了管腔的尖端, 这里的小囊肿表示。(I)排泄管体内的细胞质液泡在强烈影响下没有任何运河延伸的erm-1 (rna 干扰)动物3;请注意, ACT-5::GFP 不被招募到流明 (除了一些小斑点周围的一些空泡)。(J)对三重转基因动物表达 ERM-1 中的腔内 ACT-5::GFP 和 AQP-8::mCherry 的招募 (注意 ACT-5::GFP 的粗带和在囊腔周围重叠的 AQP-8::mCherry 团簇)。标尺 = 5 μ m 为 E–J, 显示在 E.请单击此处查看此图的较大版本.

图 5: 通过解剖和共聚焦显微镜对运河缺损进行定量的例子
(A)野生类型 (上部面板) 和突变囊性 (下部板) 排泄管的示意图表示法, 用于量化运河长度和囊肿大小。后管长度可量化为0、1/4、1/2、3/4 和1。运河长度 "0" 表示没有扩展, "1" 表示全长扩展。囊肿大小可量化为和 #60; 1/3 (小) 和 #62; 1/3 (大) 的身体直径。(B)通过荧光解剖显微镜对控制和 ERM-1 [++](rna 干扰)动物的总干渠形态进行定量。在模拟(rna 干扰)中-1 (+ +) 动物, 后运河长度约1/2 延长95% 动物 (参考图像,图 3A–B)。在抑制器 ERM-1 [++](rna 干扰)动物中, 后运河的长度几乎完全在80-90% 的动物 (参考图像,图 3Cd) 中延伸。在增强剂 ERM-1 [++](rna 干扰)动物中, 大约有60-70% 条运河有较大的囊肿和较短的长度 (和 #60; 1/2) (参考图像,图 3Ef)。数据显示为平均± SD (n & #62; 3)。(C)从共焦图像中 ImageJ 腔管骨架的荧光强度的定量。运河的顶端膜被标记为 ACT-5::GFP, 野生型运河臂显示在左边, ERM-1 [++] 运河臂, 向右。左面板: 野生型膜套的 ACT-5::GFP 强度约为 50 (灰度值/膜; 由黑色和红色箭头表示), 在图像下方显示的图形。右面板: ACT-5::GFP 的强度在 1 [++] 高于 100 (背膜的灰度值大约是 110 (黑色箭头), 腹膜是大约 140 (红色箭头)), 图中显示的图像下方。缩放栏 = 5 µm.请单击此处查看此图的较大版本.
| 表 1: 的标记示例C. 线虫排泄管膜系统 | ||||
| 蛋白质名称 | 小组 | |||
| 表 2: 的示例C. 线虫排泄管特定启动子 | ||
| 促进 | 表达阶段 | |
| erm-1 | 逗号阶段胚胎 | |
| sulp-5 | 3倍胚 | |
| vha-1 | 2倍胚 | |
| vha-5 | 2倍胚 | |
| aqp-8 | 2倍胚 | |
| glt-3 | 晚期胚胎 | |
| 1示例从表3中列出的资源中选择。 | ||
| 表 3: 资源 | |||||
| 用于识别线虫排泄管特异分子的资源, 标记试剂/菌株和抗体 | |||||
| 1. 线虫遗传学中心 (CGC)43适用于可用试剂和菌株 | |||||
| 2. Wormbase44有关排泄管特定分子、菌株和抗体的信息 | |||||
| 3. 关于排泄管特定分子的信息: 参见参考6 | |||||
| 4. Transgeneome 网站45用于平移 GFP 融合构造 | |||||
| 5. 线虫表达模式46用于转录 GFP 融合结构 | |||||
| 6. 国家资源项目 (NBRP):: 线虫47信息关于线虫突变体和促进剂 | |||||
| 7. 荧光: 请参阅参考48,49 | |||||
| 基于 web 的用于目标 rna 干扰库分子组装的资源 | |||||
| 1. GeneMANIA50 | |||||
| 2. AceView51 | |||||
| 3. iHOP52 | |||||
| 4. Wormbase44 | |||||
| 5. 酿酒酵母基因组数据库53 | |||||
| 6. Flybase54 | |||||
| 7. 鼠标基因组数据库55 | |||||
| 8. 人类基因组数据库56 | |||||
| 9. 爆炸57 |
| 表 4: 单表型评分表的示例 | |||||||
| rna 干扰库 | 应变 | 一般表型 (% 合计) | 运河表型 | ||||
| 运河长度和 #60; 1/2 (% L4) | 运河长度和 #62; 1/2 (% L4) | 其他渠道表型 | 计数的动物总数 | ||||
| 车牌号 | 井号 | ||||||
| I-1 | A1 | ERM-1 [++];vha-1p:: GFP | Clr (30) | 80 | 20 | 100 | |
| X-5 | B12 | 相同 | 没有 | 30 | 70 | 100 | |
| III-10 | C5 | 相同 | Unc (54) | 70 | 30 | 大囊肿 | 100 |
讨论
线虫 "遗传多样性、透明性、简单的体计划和不变的细胞谱系都使其成为分析形态发生的良好模型。该协议描述了如何结合标准的遗传操作和成像研究, 以利用2微米薄的线虫排泄运河研究极化膜和细胞内腔生物在一个单一的细胞管。
标签
C. 线虫排泄管可以用荧光融合蛋白的表达进行标记, 允许活体分析 (此处描述), 或通过抗体或化学染色 (见附在肠道 tubulogenesis 抗体染色的纸上3). 两个或多个不同荧光的表达式, 或者这些不同标记技术的组合, 允许对这些细管 (图 2) 进行高分辨率的视觉剥离。针对运河特定启动子导管的荧光融合蛋白是排泄管标记的首选方法, 其中有以下几种原因: (1) 许多运河蛋白的表达水平低, (2) 运河的精细结构, 容易淹没在运河外的染色, 也可以表达感兴趣的蛋白质。另一方面, 运河是敏感的外源性蛋白质和容易发展不表型 (例如, 延长缺陷和囊肿, 甚至致命性) 时, 这种蛋白质的强烈表达。在选择不同的生成转基因动物的方法时, 这应该是一个决定。原则上, 转基因可以被引入为外阵列 (例如, 通过直接注射质粒 DNA 进入性腺进行系转化, 如此处所述), 通常生成高数阵列 (通常具有高表达), 或集成到基因组中, 通常在低或单拷贝数 (例如, 通过轰击26或通过 Mos1-mediated 单拷贝插入 [MosSCI]27)。Extrachromsomal 数组也可以被集成到基因组中的第二步 (但是, 在一个高拷贝数)18。另一方面, 当注入系低浓度 (例如, 1-2/µL dna, 加上更高浓度的标记 dna), 低 (甚至单个) 拷贝数阵列可以很容易地生成28。这种情况下的优势, DNA 浓度可以变化, 这可能有助于找到最好的表达水平, 运河标志, 既不太低也不太高 (有毒)。注射 DNA 浓度与表达水平之间的关系取决于多个因素 (如: 如, 启动子), 因此必须根据经验确定。二者择一地, 兴趣的基因可以直接地被标记与荧光在系由成群经常散置短的复发重复 (CRISPR) 基于标记规程29,30。虽然这种方法将荧光置于其最生理的基因组环境中, 但这并不总是必要的, 甚至是不可取的 (例如,当蛋白质以非常低的水平表达时)。然而, 它可能是最好的选择, 例如, 如果感兴趣的基因是非常大的。
运河可视化可以通过引导转录结构进入运河, 将突出运河细胞质的荧光。相比之下, 标记亚细胞导管成分需要一个平移融合, 其中全长基因是连接在帧的荧光编码基因。当使用一个渠道特定的促进表达 (而不是基因本身的启动子), 它的选择应该是基于启动者的力量, 并为发展分析, 其表达的时间。当运河的渗透功能变得重要时, 许多排泄道特异基因在幼虫阶段之前不表达;对于其活动扩展阶段 (erm-1和pros-1是早期表达的基因) 的分析太晚了10,13。为排泄管内膜和等离子隔膜的标志物和运河特定促进剂的例子分别在表 1和2中给出, 以及用于在表 3中查找其他渠道特定分子的资源。这些资源也可用于寻找已制成的合适的荧光融合蛋白, 可通过线虫遗传学中心 (CGC; 另请参见表 1)。构建重组质粒用于表达这种蛋白质融合, 可以使用各种不同的克隆方法, 每个都有特定的优缺点 (在其他地方讨论过14)。这些包括传统的限制性酶的克隆方法, 这里描述, 模块化克隆使用多站点网关系统31, 吉布森汇编32, 或记者基因构建的 "PCR 缝合" 方法14 ,33。这些不同的方法可以适应选择他们引入到系和/或其他特定需求 (例如, 多功能网关系统, 方便洗牌的发起人和基因更大规模的标签方法).需要注意选择正确的插入位置的荧光 (连接它在 N-与 C 端的蛋白质), 考虑到的功能的蛋白质的利益。
对基因功能的干扰
作为在线虫中扰乱基因功能的多种可能的方法之一, 本协议描述了一种针对表达腔膜成分诱导的囊性管腔表型的靶 rna 干扰交互屏。在这个特定的情况下, 表达一个顶端/腔膜相关的标记, 如 ERM-1 有优势直接引导查询到预期的目标: 分析细胞内顶端/腔膜生物。功能表现出的表型也提供了一定的优势, 当与功能 (rna 干扰) 互动屏幕结合这里所述 (参见34的讨论损失-和功能分析和设计的遗传屏幕)。此外, ERM-1 本身是一个 well-investigated 的 "流明形态发生" 和顶端膜的身份分子12。因此, 在这种情况下, 一个目标 (而不是无偏) 屏幕可能是直接信息的流明形态发生, 而同时进一步表征 ERM-1's 的具体功能在这个过程中。然而, 一个无偏的目标屏幕可以以类似的方式进行, 开始与野生类型的动物, 一个转基因动物与 fluorescently 标记排泄运河, 或与任何运河突变。在其他地方讨论了功能表型生成的 rna 干扰 (例如, 与诱变) 的一般优缺点, 以及在C. 线虫中不同类型的遗传屏幕的传导和讨论34. rna 干扰产生了一系列的表型, 包括更温和的表型, 这是分析通常致命的 tubulogenesis 基因的一个特定优势。这在肠道 tubulogenesis3的附随文件中进行了描述和讨论。不同的方法产生增益和功能突变体和经典的遗传程序, 如十字架, 在一般遗传学方法文献20中进行了详细的讨论。
tubulogenesis 表型的显微与评价
通过使用简单的评分参数 (如运河长度和流明直径) 在荧光解剖显微镜下对明确的运河表型进行视觉评估和评分, 可以在短时间内实现即使在有针对性或系统性的基因或 rna 干扰屏幕上处理大量的动物。相比之下, 一个类似的屏幕搜索的新的运河形态发生表型的应变是野生类型 (除了其运河标记转基因), 是更多的时间消耗, 但可以, 原则上, 以同样的方式执行 (我们已经进行了这样的在几个月的全基因组的基础上屏幕。这样的屏幕将识别多个不同的运河表型 (这里没有显示), 因此必须相应地开发不同的评分参数,例如, 一个定性分类方案 (见9,11, 35、36、37、38以不同的方式通过解剖显微镜对运河表型进行评分。在解释任何渠道表型时, 重要的是要记住, 囊肿的形成可以是许多不同的侮辱对这种薄管状结构的不效应, 它往往是一个不太丰富的终端表型。囊肿的大小和位置, 另一方面, 可能是信息,例如, 一个囊肿接近运河细胞 (在运河延长开始), 囊肿沿运河的长度, 或囊肿的运河尖, 提供线索的潜在机制的缺陷。运河囊肿 (这里定义为 intra-lumenal 液体填充的椭球, 由顶端/腔膜包围) 应区别于泡 (小胞质膜结合液体填充椭球) 或液泡 (扩大胞质膜束缚流体填充的椭球), 不被腔膜包围, 这可能看起来完全相同 (图 4Ad)。细胞质液泡也同样会产生,例如, 通过安装溶液 (叠氮化钠) 的毒性作用。两种情况下, 大的囊肿和细胞质的液泡几乎可以占用动物的大小, 需要进一步区别于传统的 "透明 (Clr)" 运河表型, 这是由于体液在体腔中积聚所引起的。最后, 运河长度几乎总是次要的, 在胆囊管的损害, 因此, 真正的运河延伸缺陷需要证明在一个囊肿自由设置。
尽管其细小的直径, 排泄运河的亚细胞成分, 如顶端与基底膜, 胞内内涵与小囊泡, 细胞器和骨架成分, 可以可视化的更高放大倍数,例如, 共聚焦显微镜 (图 2,图 4)。通过共聚焦成像, 仅有 GFP 阳性的管胞浆就足以通过荧光线 (图 2A,图 4E) 将管腔与运河细胞质区分开来。标记的身份有助于解决小从内涵囊泡 (也显著不同的大小), 虽然明确的分配将需要 immunoelectronmicroscopy39。双和三重标记可以确定感兴趣的分子的亚细胞定位和亚细胞组分之间的关系 (图 2)。单一标记腔运河膜产生相同的细胞质或基底膜的双线, 但可以区分通过双或三重标记。对于共焦分析, 适当的安装是重要的, 鉴于运河结构的脆弱性, 它对渗透变化的敏感性, 其最常见的囊性表型的弱点。囊肿爆裂容易与渗透变化或物理压力, 是敏感的膜毒素, 如叠氮化钠, 并对一些麻醉剂用于固定 (也可能产生细胞质泡)。在我们的手, 5% 利多卡因在 M9 缓冲工作最适用于大多数排泄管化验。成像程序和所有处理应温柔, 如所述。为了避免模仿表型 (例如、囊肿和液泡) 的工件, 最好在安装后立即获取图像。如果这是不可能的, 应该先获取囊肿图像, 然后再成像其他表型。本协议讨论的标准扫描共聚焦显微镜, 提供了优越的 confocality, 与旋转圆盘共聚焦显微镜相比, 减少光, 是显微镜的选择分析的动态变化随着时间的推移, 亚细胞组分。这些关于亚细胞动力学的问题, 也可以通过使用漂白技术或标记融合蛋白与照片切换荧光, 改变颜色40来解决。最后, 通过添加透射电子显微镜 (TEM, 提供最高的结构而非分子分辨率), 超分辨率显微镜 (在纳米范围内提供分子分辨率), 可以进一步增加分辨率的范围;或 immunoelectronmicroscopy (同时提供)39,41。3D 断层扫描可与 TEM 序列相结合, 对排泄渠道的小-等离子体-膜界面的分析特别有用9,10。改进了这些不同类型的显微镜的技术和这些不同成像方法的组合继续被开发。
披露声明
作者声明他们没有竞争的金融利益。
致谢
我们感谢 m. Buechner (堪萨斯大学, 堪萨斯州, 美国), k Nehrke (罗切斯特大学医学中心, 罗切斯特, 纽约, 美国), 和线虫遗传学中心, 由国家卫生研究院资助, 研究基础设施办公室程序 (P40 OD010440)。这项工作得到了资助, NIH GM078653, MGH 是224570和223809至 iii
材料
| Name | Company | Catalog Number | Comments |
| Cloning | |||
| Plasmid pPD95.75 | Addgene | Cat. No. 37464 | |
| PCR Kit | Qiagen | Cat. No. 27106 | |
| Ligation kit | New England Biolabs | Cat. No. E2611L | |
| DNA marker | Thermo Scientific | Cat. No. SM1331 | |
| Agarose DNA grade | Fisher Scientific | Cat. No. BP164-100 | |
| Competent cells | New England Biolabs | Cat. No. C2987H | |
| Tris | Fisher Scientific | Cat. No. BP154-1 | |
| EDTA | Sigma | Cat. No. ED-1KG | |
| Acetic acid | Fisher Scientific | Cat. No. A38S-500 | |
| Ethidium bromide | Fisher Scientific | Cat. No. BP1302-10 | |
| Equipments | |||
| PCR machine | MJ Research | Cat. No. PTG-200 | |
| Centrifuge | Eppendorf | Cat. No. 5415C | |
| Water Bath | Precision Scientific | Cat. No. 666A3 | |
| Gel running instrument | Fisher Scientific | Cat. No. 09-528-165 | |
| Gel running power supply | Fisher Scientific | Cat. No. 45-000-465 | |
| Molecular Imager Gel Doc XR System | Bio-Rad | Cat. No. 1708195EDU | |
| Nanodrop Spectrophotometer | Thermo Scientific | Cat. No. ND1000 | |
| C. elegans related1 | 1see reference19 for standard C. elegans culture and maintenance procedures. | ||
| LB Medium and plates2 | 2see reference19 for protocols. | ||
| Tryptone | Acros Organics | Cat. no. 611845000 | |
| Yeast Extract | BD Biosciences | Cat. no. 212750 | |
| NaCl | Sigma | Cat. no. S7653 | |
| Bacto Agar | BD Biosciences | Cat. no. 214040 | |
| Ampicillin | Sigma | Cat. no. A0116 | |
| Tetracycline | Fisher Scientific | Cat. no. BP912 | |
| M9 Medium2 | 2see reference19 for protocols. | ||
| NaCl | Sigma | Cat. no. S7653 | |
| KH2PO4 | Sigma | Cat. no. P0662 | |
| Na2HPO4 | Sigma | Cat. no. S7907 | |
| MgSO4 | Sigma | Cat. no. M2773 | |
| NGM plates 2 | 2see reference19 for protocols. | ||
| NaCl | Sigma | Cat. no. S7653 | |
| Peptone | BD Biosciences | Cat. no. 211677 | |
| Tryptone | Acros Organics | Cat. no. 611845000 | |
| Bacto Agar | BD Biosciences | Cat. no. 214040 | |
| MgSO4 | Sigma | Cat. no. M2773 | |
| CaCl2 | Sigma | Cat. no. C3881 | |
| Cholesterol | Sigma | Cat. no. C8667 | |
| K2HPO4 | Sigma | Cat. no. P3786 | |
| KH2PO4 | Sigma | Cat. no. P0662 | |
| RNAi plates3 | 3see reference21 for protocols. | ||
| NaCl | Sigma | Cat. no. S7653 | |
| Peptone | BD Biosciences | Cat. no. 211677 | |
| Tryptone | Acros Organics | Cat. no. 611845000 | |
| Bacto Agar | BD Biosciences | Cat. no. 214040 | |
| MgSO4 | Sigma | Cat. no. M2773 | |
| CaCl2 | Sigma | Cat. no. C3881 | |
| Cholesterol | Sigma | Cat. no. C8667 | |
| K2HPO4 | Sigma | Cat. no. P3786 | |
| KH2PO4 | Sigma | Cat. no. P0662 | |
| IPTG | US Biological | Cat. no. I8500 | |
| Carbenicillin | Fisher Scientific | Cat. no. BP2648 | |
| NaOH | Fisher Scientific | Cat. no. SS266-1 | |
| Sodium hypochlorite | Fisher Scientific | Cat. no. 50371500 | |
| Bacteria | |||
| OP50 bacteria | CGC | ||
| HT115 bacteria | CGC | ||
| Genome-wide RNAi libraries | |||
| Ahringer genome-wide RNAi feeding library (ref21,58,59) | Source BioScience | ||
| C. elegans ORF-RNAi feeding library (ref60) | Source BioScience | ||
| Imaging related | |||
| Lidocaine | MP Biomedicals,LLG | Cat. no. 193917 | |
| Materials | |||
| Vacuum Grease Silicone | Beckman | Cat. no. 335148 | |
| Microscope slides | Fisher Scientific | Cat. no. 4448 | |
| Tissue culture plate, 6 well | Corning Inc. | Cat. no. 08-772-33 | |
| Equipment | |||
| SMZ-U dissecting microscope (Nikon) | |||
| SZX12 dissecting microscope (Olympus), equipped with a high-power stereo fluorescence attachment (Kramer Scientific), CCD camera with Q capture software and X-Cite fluorescent lamp (Photonic Solutions). | |||
| TCS SL Laser-scanning confocal microscope (Leica Microsystem) | |||
| C2 laser-scanning confocal mounted on an ECLIPSE Ti-E inverted microscope (Nikon) |
参考文献
- Lubarsky, B., Krasnow, M. A. Tube morphogenesis: making and shaping biological tubes. Cell. 112 (1), (2003).
- Sundaram, M. V., Cohen, J. D. Time to make the doughnuts: Building and shaping seamless tubes. Semin. Cell Dev. Biol. S1084-9521, 30130-30136 (2016).
- Zhang, N. The C. elegans intestine as a model for intercellular lumen morphogenesis and in vivo polarized membrane biogenesis at the single-cell level. JoVE. , (2017).
- Andrew, D. J., Ewald, A. J. Morphogenesis of epithelial tubes: Insights into tube formation, elongation, and elongation. Dev. Biol. 341 (1), 34-55 (2010).
- Nelson, F. K., Albert, P. S., Riddle, D. L. Fine structure of the Caenorhabditis elegans secretory-excretory system. J. Ultrastruct. Res. 82 (2), 156-171 (1983).
- Sundaram, M. V., Buechner, M. The Caenorhabditis elegans Excretory System: A Model for Tubulogenesis, Cell Fate Specification, and Plasticity. Genetics. 203 (1), 35(2016).
- Altun, Z. F., Hall, D. H. Excretory system. WormAtlas. , (2009).
- Buechner, M. Tubes and the single C. elegans excretory cell. Trends Cell Biol. 12 (10), 479-484 (2002).
- Khan, L. A. Intracellular lumen extension requires ERM-1-dependent apical membrane expansion and AQP-8-mediated flux. Nat. Cell Biol. 15 (2), 143-156 (2013).
- Kolotuev, I., Hyenne, V., Schwab, Y., Rodriguez, D., Labouesse, M. A pathway for unicellular tube extension depending on the lymphatic vessel determinant Prox1 and on osmoregulation. Nat. Cell Biol. 15 (2), 157-168 (2013).
- Buechner, M., Hall, D. H., Bhatt, H., Hedgecock, E. M. Cystic canal mutants in Caenorhabditis elegans are defective in the apical membrane domain of the renal (excretory) cell. Dev. Biol. 214 (1), 227-241 (1999).
- Fehon, R. G., McClatchey, A. I., Bretscher, A. Organizing the cell cortex: the role of ERM proteins. Nat. Rev. Mol. Cell Biol. 11 (4), 276-287 (2010).
- Gobel, V., Barrett, P. L., Hall, D. H., Fleming, J. T. Lumen morphogenesis in C. elegans requires the membrane-cytoskeleton linker erm-1. Dev. Cell. 6 (6), 865-873 (2004).
- Boulin, T., et al. Reporter gene fusions, WormBook. The C. elegans Research Community, WormBook. , April 5, 2006 http://www. wormbook.org (2006).
- Sambrook, J. Molecular cloning: a laboratory manual. Sambrook, J., DW, R. ussell , Cold Spring Harbor Laboratory Press . (2006).
- Fire, A., Harrison, S. W., Dixon, D. A modular set of lacZ fusion vectors for studying gene expression in Caenorhabditis elegans. Gene. 93 (2), 189-198 (1990).
- Ahringer, J. Reverse genetics, WormBook. The C. elegans Research Community, WormBook. 6, April 6, 2006 http://www. wormbook.org (2006).
- Transformation and microinjection, WormBook. The C. elegans Research Community, WormBook. Evans, T. C. , April 6, 2006 http://www.wormbook.org (2006).
- Maintenance of C. elegans, WormBook. The C. elegans Research Community, WormBook. Stiernagle, T. , February 11, 2006 http://www.wormbook.org (2006).
- Genetic mapping and manipulation: Chapter 7-Making compound mutants, WormBook. The C. elegans Research Community, WormBook. Fay, D. , February 17, 2006 http://www.wormbook.org (2006).
- Kamath, R. S., Ahringer, J. Genome-wide RNAi screening in Caenorhabditis elegans. Methods. 30 (4), 313-321 (2003).
- Timmons, L., Court, D. L., Fire, A. Ingestion of bacterially expressed dsRNAs can produce specific and potent genetic interference in Caenorhabditis elegans. Gene. 263 (1-2), 103-112 (2001).
- Pawley, J. B. Handbook of Biological Confocal Microscopy. , Springer. (2006).
- Hibbs, A. R. Confocal Microscopy for Biologists. , Springer. US. (2004).
- Bankhead, P. Analyzing fluorescence microscopy images with ImageJ. , (2014).
- Praitis, V., Casey, E., Collar, D., Austin, J. Creation of low-copy integrated transgenic lines in Caenorhabditis elegans. Genetics. 157 (3), 1217-1226 (2001).
- Frøkjaer-Jensen, C. Single-copy insertion of transgenes in Caenorhabditis elegans. Nat. Genet. 40 (11), 1375-1383 (2008).
- Mello, C. C., Kramer, J. M., Stinchcomb, D., Ambros, V. Efficient gene transfer in C. elegans: extrachromosomal maintenance and integration of transforming sequences. EMBO J. 10 (12), 3959-3970 (1991).
- Barrangou, R. Cas9 Targeting and the CRISPR Revolution. Science. 344 (6185), 707-708 (2014).
- Dickinson, D. J., Goldstein, B. CRISPR-Based Methods for Caenorhabditis elegans Genome Engineering. Genetics. 202 (3), 885-901 (2016).
- Esposito, D., Garvey, L. A., Chakiath, C. S. Gateway cloning for protein expression. Methods Mol. Biol. 498, 31-54 (2009).
- Gibson, D. G. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nat. Methods. 6 (5), 343-345 (2009).
- Hobert, O. PCR fusion-based approach to create reporter gene constructs for expression analysis in transgenic C. elegans. Biotechniques. 32 (4), 728-730 (2002).
- Jorgensen, E. M., Mango, S. E. The art and design of genetic screens: caenorhabditis elegans. Nat. Rev. Genet. 3 (5), 356-369 (2002).
- Berry, K. L., Bulow, H. E., Hall, D. H., Hobert, O. A. C. elegans CLIC-like protein required for intracellular tube formation and maintenance. Science. 302 (5653), 2134-2137 (2003).
- Mattingly, B. C., Buechner, M. The FGD homologue EXC-5 regulates apical trafficking in C. elegans tubules. Dev. Biol. 359 (1), 59-72 (2011).
- Shaye, D. D., Greenwald, I. The disease-associated formin INF2/EXC-6 organizes lumen and cell outgrowth during tubulogenesis by regulating F-actin and microtubule cytoskeletons. Dev. Cell. 32 (6), 743-755 (2015).
- Lant, B. CCM-3/STRIPAK promotes seamless tube extension through endocytic recycling. Nat. Commun. 6 (6), 6449(2015).
- Paupard, M. C., Miller, A., Grant, B., Hirsh, D., Hall, D. H. Immuno-EM localization of GFP-tagged yolk proteins in C. elegans using microwave fixation. J. Histochem. Cytochem. 49 (8), 949-956 (2001).
- Lukyanov, K. A., Chudakov, D. M., Lukyanov, S., Verkhusha, V. V. Photoactivatable fluorescent proteins. Nat. Rev. Mol. Cell Biol. 6 (11), 885-891 (2005).
- Bates, M., Huang, B., Dempsey, G. T., Zhuang, X. Multicolor super-resolution imaging with photo-switchable fluorescent probes. Science. 317 (5845), 1749-1753 (2007).
- Sherman, T. The abts and sulp families of anion transporters from Caenorhabditis elegans. Am. J. Physiol. Cell Physiol. 289 (2), C341-C351 (2005).
- Caenorhabditis Genetics Center (CGC). , http://cbs.umn.edu/cgc/home (2017).
- Wormbase. , http://www.wormbase.org/ (2017).
- Transgeneome website. , https://transgeneome.mpi-cbg.de/transgeneomics/index.html (2017).
- C. elegans expression pattern. , http://gfpworm.org/ (2017).
- National BioResource Project (NBRP)::C. elegans. , https://shigen.nig.ac.jp/c.elegans/ (2017).
- Heppert, J. K. Comparative assessment of fluorescent proteins for in vivo imaging in an animal model system. Mol. Biol. Cell. 27 (22), 3385-3394 (2016).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nat Methods. 2 (12), 905-909 (2005).
- GeneMANIA. , http://genemania.org/ (2017).
- AceView. , http://www.ncbi.nlm.nih.gov/ieb/research/acembly/ (2017).
- iHOP. , http://www.ihop-net.org/UniPub/iHOP / (2017).
- Saccharomyces Genome Database. , http://www.yeastgenome.org (2017).
- Flybase. , http://www.flybase.org (2017).
- Mouse Genome Database. , http://www.informatics.jax.org (2017).
- Human Genome Database. , http://www.gdb.org (2017).
- BLAST. , https://blast.ncbi.nlm.nih.gov/Blast.cgi (2017).
- Kamath, R. S., Martinezcampos, M., Zipperlen, P., Fraser, A. G., Ahringer, J. Effectiveness of specific RNA-mediated interference through ingested double-stranded RNA in Caenorhabditis elegans. Genome Biol. 2 (1), RESEARCH0002(2001).
- Kamath, R. S. Systematic functional analysis of the Caenorhabditis elegans genome using RNAi. Nature. 421 (6920), 231-237 (2003).
- Rual, J. F. Toward improving Caenorhabditis elegans phenome mapping with an ORFeome-based RNAi library. Genome research. 14 (10B), 2162-2168 (2004).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。