Method Article
プラズモニック光熱がん治療:光熱温度分布を可視化するためのナノ粒子包埋腫瘍組織模倣ファントム
要約
この記事では、プラズモン光熱療法の光学特性を再現する腫瘍組織ファントムを調製するためのプロトコルを紹介します。ファントムの調製、光熱評価、および治療パラメータを評価するための光熱温度測定に基づく開発された数値モデルの検証について詳しく説明し、予備試験のための in vivo 研究に代わる倫理的で費用対効果の高い代替手段を提供します。
要約
新しいがん治療薬であるプラズモニック光温熱療法(PPTT)は、ナノ粒子(NP)を腫瘍に送達した後、近赤外線(NIR)を照射して局所的な熱を発生させ、がん細胞を破壊するという治療法です。PPTTを投与する前に、治療パラメータ(NP濃度、照射強度、および持続時間)を推定する必要があります。このために、数値シミュレーションが実行されます。しかし、ロバストな計算を確保するためには、これらのシミュレーションを、腫瘍組織の光学特性を再現する腫瘍組織模倣ファントムを用いた光熱実験を通じて検証する必要があります。PPTTの場合、治療パラメータは、組織とNPによる入射放射線の散乱と吸収によって支配されます。そのため、対象腫瘍・組織の減少した散乱係数(μs')と吸収係数(μa)を模倣したファントムで検証実験を行うことができます。
具体的には、このプロトコルは、正常な乳房組織に囲まれた、金ナノロッドを注入された乳房腫瘍のμおよびμaを模倣したファントムを準備するための指示を提供する。このプロトコルでは、NIR照射、温度モニタリング、および時空間温度と熱電対を使用して測定された温度を比較することによる数値結果の検証についても詳しく説明しています。この研究で提示されたプロトコルは、寸法(φ40 x 12 mm)および中央腫瘍領域(φ20 x 6 mm)を有するヒドロゲルベースの円筒形乳房腫瘍組織ファントムの調製を容易にし、1%アガロースをベースマトリックスとして、脂質内を散乱成分として含み、腫瘍領域を25μg/mLの濃度で金ナノロッドで包埋した。ケーススタディの代表的な結果は、PPTTの数値シミュレーションを検証するための作製ファントムの応用を示しています。この研究では、実証されたプロトコルは、in vivo実験の前に治療パラメータを最適化および計画し、PPTTの数値シミュレーションを検証することを目的とした光熱実験を実施するために価値があると結論付けています。
概要
プラズモン光温熱療法(PPTT)は、ナノ粒子(NP)を腫瘍部位に送達した後、近赤外線(NIR)放射線を照射する新たな限局性がん治療法です。NPは通常、腫瘍内(IT)または静脈内(IV)ルート1を介して投与されます。NIR照射を受けると、入射放射線とNPsのプラズモン相互作用により、NPsの表面に局所的な熱が発生し、それが周囲の腫瘍組織に放散されます2,3。この局所的な加熱は腫瘍領域の温度を上昇させ、熱アブレーション4,5を通じて癌細胞死を引き起こします。効果的ながん治療は、さまざまな生物学的プロセスを通じて、1時間6で46°C、4〜6分7で50〜52°C、瞬間的な損傷8で60°Cなどの特定の温度を維持することによって達成できます。
光熱療法の適用については、さまざまな光熱剤が調査および報告されており、その治療効果はin vitroまたはin vivo研究を通じて評価されています。これらの薬剤には、近赤外染料(例えば、インドシアニングリーン、IR780、IR820)、ポリマーベースの光熱剤(例えば、ポリドーパミン)、および無機材料10、例えば、貴金属ベースのNPまたはプラズモニックNP(例えば、金NP)11、遷移金属硫黄/酸化物12、およびMXenes13を含む無機材料10が含まれる.これらの中で、プラズモニックNP、特に金NPは、従来の光熱剤(例えば、染料)に比べて、より優れた光熱安定性、より高い光熱変換効率、および形状およびサイズの変化による調整可能なプラズモニック応答など、いくつかの利点を提供する10。これらの特性により、ゴールドNPは光温熱療法の理想的な候補となっており、現在臨床試験中のものもあります14。
治療効果を最適化し、PPTT中の腫瘍熱損傷を十分に確保するためには、PPTTの前臨床/臨床適用前に、NP投与量(濃度)やNIR放射線パラメータ(照射強度と照射時間を含む)などの治療パラメータを推定することが不可欠です。通常、これらのパラメータを確立するために数値シミュレーションが使用されます。腫瘍組織内の熱損傷を評価するために、さまざまな数値的方法が開発されており、格子ボルツマン法はそのようなアプローチの1つです15,16。ただし、これらのシミュレーションの信頼性を確保するには、組織模倣ファントムと呼ばれる組織アナログを使用して検証する必要があります。これらのファントムは、実際の組織の光学的、熱的、生物学的、または機械的特性を再現するように調製することができ、生物学的応用17,18を意図した新たに開発されたデバイス、材料、または方法の予備試験、治療評価、および検証を実施するための代替品として機能します。これにより、動物や人間の被験者の不必要な苦痛を軽減し、そのような実験に関連する倫理的懸念に対処することができる19,20。
ファントムの設計と製造は、意図されたアプリケーション21に依存します。例えば、PPTTのような光線療法では、入射放射線の線量は、NPおよび組織22,23によって吸収または散乱される光の量によって影響を受ける。したがって、光学特性、特に生体組織の減少散乱係数(μs')および吸収係数(μa)を模倣する光ファントムは、PPTT評価およびその後の数値シミュレーションの検証に使用される24,25。光ファントムは、典型的には、3つの主要な構成要素、すなわち、塩基マトリックス、散乱剤、および吸収剤17,26から構成される。ベースマトリックスは、散乱成分と吸収成分を適切な濃度で保持し、目的の光学特性を再現します。これらのファントムは、ベースマトリックスのタイプに応じて、固体、液体、および半固体(ヒドロゲル)ファントムに分類できます。PPTTのような熱治療研究では、ヒドロゲルファントム、特にアガロースベースのファントムは、その生体適合性、固有の散乱および吸収が無視できること、単純な製造プロセス、および腫瘍の形状に対応する所望の形状およびサイズにキャストできる柔軟性のために好まれる19,22。最も重要なことは、アガロースタイプのファントムの融解温度が~80°Cであるのに対し、調製されたアガロースベースのファントムは、バルク温度~70~80°Cまで使用できることです19。PPTTの場合、50~80°Cの温度範囲で十分であるため、このようなアガロースベースのファントムをPPTTベースの光熱評価に使用できます。
さまざまなハイドロゲルベースの組織模倣ファントムが開発され、さまざまな用途で報告されています。Mustariらは、アガロースベースの組織模倣ファントムを開発し、新たに設計された光学系18の検証においてその有用性を実証した。別の研究では、高密度集束超音波(HIFU)療法中の熱損傷の程度を測定するために、組織を模倣したサーモクロミックファントムが調製された27。ポリアクリルアミドベースの組織模倣ファントムも、HIFUベースの癌治療中のキャビテーション効果を分析するために準備されています28。この研究の目的は、腫瘍組織を模倣するファントムを製造するための段階的な方法を実証することです PPTT評価のためのファントムベースの光熱実験のプロトコルとともに。この提案された詳細なプロトコルは、ファントム製剤の採用と再現性、およびその後のファントムベースの光熱実験方法を促進することを目的としています 新しく開発されたナノ構造の光熱性能をテストするための、それにより数値シミュレーションを検証し、PPTTの治療パラメータの前処理計画または最適化を支援します。この記事では、表面下乳房腫瘍用に特別に設計されたファントム調製プロトコルについて説明します。しかし、光吸収剤および散乱剤の組成を変更することにより、同じステップをさまざまな腫瘍組織タイプ(さまざまな形状およびサイズ)の作製に適合させることができます。一例として、実証された組織模倣ファントムベースの光熱評価は、以前に報告された研究で採用され、表面下前腕腫瘍24、表面下IDC25、および皮膚腫瘍29のPPTTシミュレーションを検証しています。
この論文では、皮膚表面下3 mmに位置し、正常な乳房組織に囲まれた、表面下または皮下乳房腫瘍、特に浸潤性乳管がん(IDC)のμを模倣する光学ファントムの準備手順について説明します。ファントムは、アガロースをベースマトリックスとして使用し、イントラリピッド(IL)を散乱剤として調製した円筒形の形状で、正常および癌性の乳房組織のμs'を模倣するために適切な濃度で添加されています。アガロースは、散乱と吸収が無視できる透明なヒドロゲルであり、光学ファントム18,30の理想的なベースマトリックスです。さらに、ILは、細胞膜の二重層構造を模倣する20%脂肪エマルジョンであり、散乱剤として広く使用されている31,32そして、正常および癌性乳房組織のμs'を再現するためにこの研究のために選ばれた。このファントムは、プラズモンNPとして金ナノロッド(AuNR)を注入した乳房腫瘍(IDC)を模倣し、AuNRのない正常な乳房組織に囲まれるように設計されています。PPTTで使用されるさまざまな金NPの中で、AuNRは、NIR領域での強力なプラズモン応答と、イヌやネコの患者を含む前臨床PPTT研究で広く使用されているため、この研究に選択されました14。このプロトコルは、2種類のファントムの調製を示しています:1つはIV注射で見られるようにAuNR分布を特徴とする腫瘍で、もう1つはIT注射によって達成されたAuNR分布を反映した腫瘍を持つものです。ファントム調製プロトコルに従って、NIR照射の実験セットアップとファントムの光熱評価を行う手順について説明します。最後に、これらの評価から得られた温度分布の結果を解釈し、実験データと数値シミュレーション結果を比較するためのステップバイステップのガイドを提供します。この比較は、開発された数値法の検証に役立ち、腫瘍に特化した最適な治療パラメーターのチューニングを可能にします。
プロトコル
注:ファントムは、文献で報告された組成に基づいてアガロースとイントラリピッドを使用して調製され、所望の光学特性を達成しました。患者や死体からの実際の生体組織は使用されていません。したがって、これらのファントムの準備には倫理的な制約がなく、インフォームドコンセントは必要ありません。
1. 適切な金型の選定または製作
- .適切な金型の選択
- ファントムの希望の形状と寸法に一致する金型を選択します。腫瘍領域がNPで均一に分布し、正常組織に囲まれた円筒形ファントムの場合、ガラスのペトリ皿と小さなビーカーを型8 として使用します(図1A)。
注:これらの手順は、円筒形の形状で腫瘍組織を模倣するファントムを準備するためのものです。その他の形状やサイズについては、適切な金型を選択してください。適切な金型が利用できない場合は、手順1.2で詳しく説明されているように、3次元(3D)印刷を使用して金型を製作します。
- ファントムの希望の形状と寸法に一致する金型を選択します。腫瘍領域がNPで均一に分布し、正常組織に囲まれた円筒形ファントムの場合、ガラスのペトリ皿と小さなビーカーを型8 として使用します(図1A)。
- 3Dプリントによる金型の作製
- CAD(Computer-aided Design)ソフトウェア(SolidWorks、Autodesk Inventor、CATIAなど)を使用して、目的の形状とサイズに合わせて3Dモデルを設計します。このプロトコルに従うには、図1Bに示すように、中空シリンダー(内径40mm、厚さ2mm、高さ12mm、補足ファイル1参照)と2つの固体円筒形マスキングモールド(寸法φ20×6mm、φ14×3mm)を設計します。
- 中空円筒の設計/製図の場合は、CADソフトウェアで直径40mmと44mmの2つの円を作成します。次に、ジオメトリを 12 mm 押し出します。
- 固体の円筒形マスキング金型の場合は、直径20 mmと14 mmの円を作成し、それぞれ6 mmと3 mmだけ押し出します( 補足ファイル2 および 補足ファイル3を参照)。円柱の片側に長方形(辺44mmと5mm)を描き、2mm押し出します。
- 3Dプリンター対応ソフトウェア(Curaなど)を使用して3DモデルをGcode形式に変換して印刷します。
- このGcodeを使用して、3Dプリンターを使用して金型(例えば、ここではポリ乳酸[PLA]φ1.75mm、1kgのeSunを使用)を印刷します。
注:長方形は、マスキング金型を吊り下げるために描かれています。さまざまな金型を設計し、製作して、他の目的の形状のファントムを準備できます。
- CAD(Computer-aided Design)ソフトウェア(SolidWorks、Autodesk Inventor、CATIAなど)を使用して、目的の形状とサイズに合わせて3Dモデルを設計します。このプロトコルに従うには、図1Bに示すように、中空シリンダー(内径40mm、厚さ2mm、高さ12mm、補足ファイル1参照)と2つの固体円筒形マスキングモールド(寸法φ20×6mm、φ14×3mm)を設計します。
2. 腫瘍組織模倣ファントム溶液の調製25
注:この研究では、腫瘍組織を模倣した円筒形のアガロースベースの光学ファントムは、 図2に示すように、ITまたはIV注射を介してAuNRを注入した表面下乳房腫瘍に似せて準備されています。ITファントムには、AuNRを持つ中央腫瘍領域と周囲の正常組織領域の2つの領域があります。IVファントムには、腫瘍末梢にAuNRがある腫瘍領域、AuNRがない中央のむき出し腫瘍領域、および周囲の正常組織領域の3つの領域があります。光学特性(μa と μs')は腫瘍組織と正常組織で異なるため、組成の異なる領域ごとに別々のファントム溶液を調製し、個別に説明します。
- 正常な乳房組織を模倣したファントム溶液の調製(溶液1)
注:このソリューションは、ITファントムとIVファントムの両方に使用されます。 溶液 1 の調製ステップを 図 3A に示します。- 金型の寸法に基づいて、解の理論体積を計算します。
注:ここでは、φ40×12mmの円筒型の場合、計算体積は15cm3またはファントムあたり15mLです。このようなファントムを2つ用意する必要があるため、総容量は15mL×2、つまり30mLとなります。したがって、ファントム調製ステップ中の蒸発またはこぼれを考慮して、35 mLの溶液を調製します。 - 35mL溶液に添加するすべてのファントム成分(アガロース(基材)およびIL(飛散成分))の量(重量/濃度/容量)を計算します。
- 0.35 gのアガロースを加えて、1% w/v濃度に対応する35 mLの溶液を調製します。
- 文献で利用可能な μs' データに対する IL 濃度に基づいて、正常な乳房組織の所望の μs' に対応する IL 濃度 (すなわち、10.1 cm-1 33) を推定します。次に、式(1)を使用して、ファントム溶液に添加されるIL(20%エマルジョンストック)の量を計算します。
 (1)
(1)
ここで、 C1 および V1 は、それぞれ試薬ストックの濃度(ここでは20%ILストック)および添加される試薬ストック溶液の量(ここでは計算される)である。 C2は最終作業溶液中の試薬の必要濃度(文献から得られる)であり、 V2 は最終作業溶液の総容量(ここでは35mL)です。
注:ここで、10.1 cm-1のμs'の場合、報告された文献から推定されるIL濃度は1.04%34,35です。上記の手順を使用して、添加するIL(20%ILストック)の容量は1.82mLです。
- 0.35 gのアガロースを秤量し、ビーカー内の33.18 mLの脱イオン(DI)水に加えます。ビーカーをアルミホイルで覆って、水の損失を防ぎます。
- 溶液の入ったビーカーをホットプレートに載せ、溶液が透明になるまで攪拌しながら120°Cで加熱します。
- ホットプレートの温度を60°Cに下げます。15分後、撹拌しながらIL1.82mLを加えます。得られた 溶液1を、使用する(注ぐ準備ができる)まで60°Cで攪拌します。
注:60°Cのファントム溶液は、攪拌条件下で保管する必要があります。さもなければ、それは溶液の固化につながります。
- 金型の寸法に基づいて、解の理論体積を計算します。
- AuNR包埋腫瘍ファントム溶液の調製(ソリューション2)
注:このソリューションは、ITファントムとIVファントムの両方に使用されます。 ソリューション 2 の準備ステップを 図 3B に示します。- 埋める腫瘍領域の容積(φ20×6mm)を計算します。
注:このような2つの腫瘍ファントムのおおよその容量は3.8mLです。したがって、調製する溶液の量は4.5mLになります。 - 追加する腫瘍ファントム成分の量を計算します - アガロース、IL、およびAuNRs-セクション2.1で説明したのと同様の手順を使用して。
- 45 mgを加えて、1% w/v濃度に対応する4.5 mLの溶液を調製します。
- IL:乳房腫瘍の μs' は 4.6 cm-1 33 であり、それを模倣するには、対応する IL 濃度が必要です 0.472%34,35。したがって、20% ILストックから106.2 μLのILを4.5 mLの腫瘍ファントム溶液に加えます。
- ファントム内のAuNRの所望濃度は25μg/mLです。同じことを達成するために、3.21 mLのAuNRs溶液(ストック濃度:35 μg/mL)を腫瘍ファントム溶液に加えます。
- ビーカーに入れたDI水1.18mLにアガロース45mgを加え、アルミホイルで覆います。
- ビーカーをホットプレートに置き、溶液が透明になるまで120°Cで攪拌します。
- ホットプレートの温度を60°Cに下げ、溶液を15分間放置します。
- 撹拌条件下で、106.2 μL の IL と 3.21 mL の AuNR 懸濁液 (35 μg/mL) を添加します。得られた溶液 である溶液2を、注ぐまで60°Cで攪拌し続けます。
- 埋める腫瘍領域の容積(φ20×6mm)を計算します。
- 裸腫瘍(AuNRなし)ファントム溶液の調製(ソリューション3)
注:このソリューションはIVファントムにのみ使用されます。 ソリューション 2 の準備手順を 図 3C に示します。- 腫瘍領域をむき出しにするために添加する懸濁液の理論体積(~φ20×6mm)を計算します。
注:腫瘍ファントムのおおよその容量は1.9mLです。したがって、調製する溶液の量は2.5mLになります。 - セクション2.1で述べたのと同様の手順を使用して、追加する腫瘍ファントム成分(アガロースおよびIL)の量を計算します。
- 25 mgのアガロースを加えて2.5 mLの溶液を調製し、1%w / v濃度を達成します。.
- IL:乳房腫瘍の μs' は 4.6 cm-1 33 であり、それを模倣するには、対応する IL 濃度が必要です 0.472%34,35。20% ILストック59 μLを添加します。
- ビーカーのDI水2.44mLにアガロース25mgを加え、アルミホイルで覆います。
- ビーカーをホットプレートに置き、溶液が透明になるまで120°Cで攪拌します。
- ホットプレートの温度を60°Cに下げ、溶液を15分間放置します。
- 撹拌条件下で59μLのILを溶液に加えます。得られた溶液である 溶液3を、注ぐまで60°Cの攪拌条件下で保管します。
- 腫瘍領域をむき出しにするために添加する懸濁液の理論体積(~φ20×6mm)を計算します。
3. 腫瘍組織模倣ファントムの作製 24,25,36
- 注湯ステップ用の型を準備します。そのためには、円筒型の底部をパラフィルムでシールし、マスキング型(φ20×6mm)を中央に置きます。
- 溶液1をマスキングモールドのトップマークまで円筒形モールドに注ぎ、固化させます(図4A)。
- 固化後、マスキング型を取り外して、腫瘍領域の空洞を作成します(図4B)。
注:プロトコルは、ステップ3.3まではITファントムとIVファントムの両方で同じです。このプロセスについては、ステップ 3.3 の後に IT ファントムと IV ファントムについて別々に説明します。 - ITファントム 24,25,36
- キャビティに 溶液2 を充填し、固化させます(図4C)。
- ソリューション1をファントムの上部に追加し、完全に固化させます(図4D)。
- IVファントム 24,25
- 小さめのマスキングモールド(φ14×3mm)を挿入し、その周りのキャビティに 溶液2 を充填します(図4E)。
- 固化後、小さい方の金型を取り外し、残りのキャビティに 溶液3 を充填します(図4F)。
- 溶液1を上部に追加し、完全に固化させます(図4G)。
4. ファントム24,25,36内の熱電対の挿入
注意: 空間温度分布を監視するために、図2に示すように、タイプKの熱電対がファントム内のさまざまな半径方向(r)および軸方向(z)の位置に挿入されます。正確な位置に熱電対を挿入するために、ガラスキャピラリーがガイドとして使用され、精度を確保します。熱電対の位置は(r、z)で示され、深さz = 3 mmの腫瘍の上面の中点は、図2A、Bに示すように、ITファントムとIVファントムの両方の基準点として機能し、(0、3)として指定されます。腫瘍領域の熱損傷を定量化するために半径方向と軸方向の位置を選択する場合、腫瘍の周辺部(半径方向と軸方向の両方)の位置が重要です。NIR照射中にこれらの周辺点で必要な温度を達成することで、完全な腫瘍アブレーションが保証されます。したがって、熱電対は、z = 3および9 mmの(腫瘍の)半径方向の極点、すなわち(10,3)および(10,9)に配置され、1つの熱電対は、図2A,Bに示されているように、z = 9 mm(末梢軸位置)の腫瘍-組織界面に配置される。さらに、軸方向の温度分布を評価するために、(0, 3) と (0, 9) の位置の間に熱電対を挿入し、(0, 6) と指定します。最後に、周囲の健康な組織領域の温度上昇を評価するために、1つの熱電対を(15,3)に挿入します。
- ガラスキャピラリーを適切な長さにカットして、ファントム内の目的の半径方向および軸方向の位置に到達するようにします。
- これらのガラスキャピラリー内に熱電対を挿入し、指定された半径方向および軸方向のファントム位置に1つずつ穴を開けます。
- すべての熱電対が所定の位置に配置されたら、 図5Aに示すように、ファントムをガラスのペトリ皿に慎重に配置して、その後のNIR照射に備えます。
5. NIR照射への曝露と結果として生じる光熱温度の測定36
- 図5Aに示すように、ファントムの天面の中央領域がNIR光源の光ファイバーの先端に垂直になるように、ファントムを含むガラスシャーレ(熱電対で挿入)を配置します。
注:ファントム表面のビーム径は、表面と光ファイバー先端の間の距離を変更することで調整できます。ここでは、9 mmの距離を保ち、ビーム径を20 mmにすることで、腫瘍中心領域を覆います。 - データ集録(DAQ)システムをコンピュータに接続し、LabVIEWソフトウェアを開きます。
- NIR光源(図5B)とソフトウェアの 再生 ボタン を同時に オンにして、 照射開始時の温度データを記録します。
- ファントムに20分間照射した後、NIR光源のスイッチを切り、記録を停止します。
- 記録された温度対時間データをプロットします。
6. シミュレーション結果との温度比較24,25
注:実験は通常繰り返され、温度はすべての熱電対の場所で設定された時間間隔で記録されます。検証では、次の手順を実行します。
- すべての熱電対位置 (r、z)における実験温度の平均と標準偏差を計算します。
- 考慮された熱電対の位置での温度を数値で計算します。
- 実験から得られた平均温度と、すべての熱電対位置でのシミュレーションによって得られた温度を、時間に対してプロットします( 図6)。
- 表1に示すように、すべての熱電対位置の二乗平均平方根誤差(RMSE)と平均絶対誤差(MAE)を計算して、温度差を定量化して検証を評価します。
注:MAEとRMSEは、それぞれ式2と式3を使用して計算されます。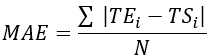 (2)
(2) (3)
(3)
ここで、 TE、 TS、 およびN は実験的に得られた温度、数値で計算された温度、およびデータポイントの数(ここでは、温度は毎秒20分間記録されるため、= 1,200)それぞれです。i は時間の瞬間を表します。
結果
図6は、 図2に示すように、AuNRに埋め込まれた腫瘍組織ファントムをすべての熱電対位置で実験中に得られた時間平均温度と、対応する熱電対位置でのシミュレーション中に得られた温度を比較したものです。ここでは、各分布、つまりAuNRのIT分布とIV分布ごとに4回実験を行いました。実験中の室温は25°Cであったため、シミュレーションでも周囲温度は25°Cに保たれました。 図6A は、AuNRのIT分布の実験平均温度とシミュレーション温度の比較を示しています。 図6B は、AuNRのIV分布の実験平均温度とシミュレーション温度の比較を示しています。 図6A、Bから、IV分布はIT分布よりも温度上昇が低いことがわかります。これは、入射放射線がAuNRに埋め込まれた腫瘍に吸収される前に、散乱媒体(裸組織+裸腫瘍)の層が大きく厚くなるため、入射放射線の散乱がIV分布でより多くなるという事実によるものです。
次に、温度プロットは、ファントム実験中、IT分布とIV分布の(0,3)熱電対位置で温度の最大上昇がそれぞれ~11°Cと~6°Cであったことを示しています。組織は43ºC6,16未満で熱的に安全であることに注意する必要があります。一般に、深部体温は37°Cであるため、>6°Cの温度上昇は腫瘍組織内の熱損傷につながります。本明細書では、25μg/mLのAuNRおよび0.25W/cm2を用いたファントム実験は、熱損傷が両方の場合について地下腫瘍の半径方向および軸方向に3〜4mm以内で誘発され、残りの腫瘍領域は損傷を受けないままであることを示唆している。このようなプロトコルは、腫瘍の完全な熱損傷を達成するために、照射強度とAuNR濃度を最適化するために使用できます。
さらに、シミュレーションされた温度は、誤差が実験温度37と比較して<15%である場合に検証されると言われる。このために、RMSEとMAEは、両方のケースのすべての熱電対位置で計算され、 表1に示されています。IT分布とIV分布でそれぞれ2.10°Cと1.94°Cの最大変動が得られ、これはシミュレートされた温度に対して5.88%と6.09%の誤差に相当します。したがって、実験結果とシミュレーション結果は互いに良好に比較されていると結論付けることができます。
要約すると、この研究は、ここで示すファントム調製およびその後のファントムベースの光熱実験のプロトコルが、数値シミュレーションを検証し、PPTTのその後の in vivo アプリケーションのための導出された治療パラメータの堅牢性を確保するのに役立つと結論付けています。

図1:アガロースベースの腫瘍組織模倣ファントムを作製するための金型。 (A)円筒形の腫瘍組織ファントムを作成するための型として使用されるガラスシャーレとビーカー。(B)円筒形腫瘍組織ファントムを調製するために設計された3Dプリントされた円筒形モールドおよびマスキングモールド。 この図の拡大版を表示するには、ここをクリックしてください。
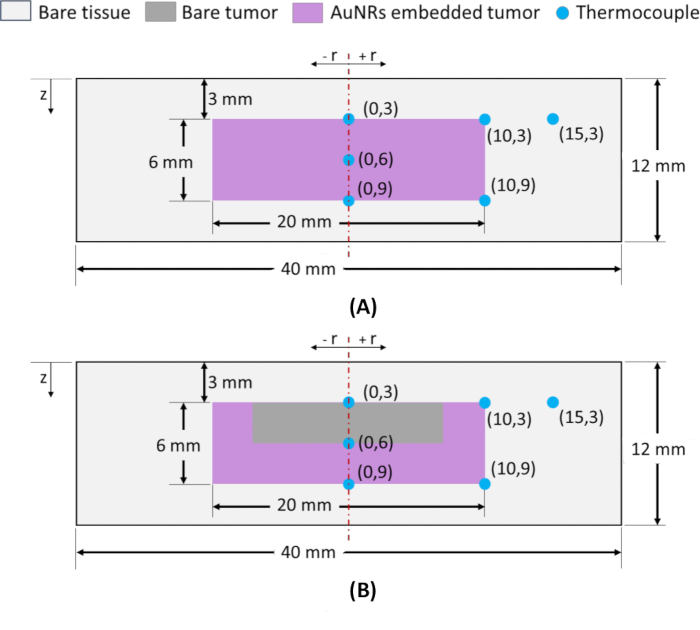
図2:円筒形形状のファントムを模倣したアガロースベースの腫瘍組織の概略図。 全体寸法がφ40×12mmで、中央に腫瘍(φ20×6mm)があり、皮膚表面から3mmの深さに位置し、正常組織領域に囲まれているファントム。(A) IT注射で得られたAuNR分布を有する腫瘍領域を有するファントム。(B) IV 注射で得られた AuNR 分布を有する腫瘍領域を有するファントム。熱電対の位置は (r, z) で表され、 r は半径方向の位置、z はサーフェスからの深さです。略語:AuNRs =金ナノロッド;IT = 腫瘍内;IV = 静脈内。 この図の拡大版を表示するには、ここをクリックしてください。
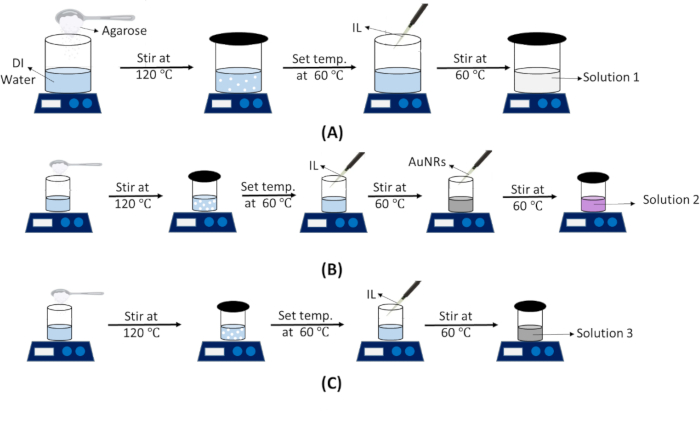
図3:さまざまなファントム溶液の準備を示す概略図。 (A)正常組織ファントム溶液(溶液1)の調製手順。(B)AuNR包埋腫瘍ファントム溶液(ソリューション2)。(C)裸腫瘍(AuNRなし)ファントム溶液(溶液3)。略語:DI =脱イオン化;IL = イントラリピッド;AuNRs=金ナノロッド。 この図の拡大版を表示するには、ここをクリックしてください。

図4:ITおよびIV分布を持つ腫瘍組織模倣ファントムの調製。 全体の直径が40 mm、深さが12 mmで、中央の表面下腫瘍領域が直径20 mm、深さ6 mmで、ファントム/皮膚表面から3 mm下にあるファントム。ITおよびIVファントムの一般的な手順:(A)溶液1を円筒形の型(パラフィルムで密封された底部)に流し込み、マスキング型を中央に配置して腫瘍領域の空洞を作成します。(B)マスキングモールド(φ20×6mm)を取り外した後、正常組織領域を固化させ、腫瘍領域に空洞を形成。ITファントムの調製のための A および B の後のステップ:(C)溶液2を空洞に注ぎ込み、IT分布用のAuNRが埋め込まれた中央腫瘍領域を形成しました。(D)溶液1を固化したファントムに注ぎ込み、最終的にファントム表面から3mm下にIT分布のAuNRが埋め込まれた表面下腫瘍を作製しました。IVファントムの準備のための A と B の後のステップ。(E)中央の空洞に小さなマスキングモールド(φ14×3mm)を装着し、その周囲に溶液2を流し込み、AuNRを埋め込んだ末梢腫瘍領域を形成してIVに分配する。(F)溶液3を残りの空洞に注ぎ込み、IV分布を模倣したAuNRが埋め込まれた腫瘍領域を作製した。(G)溶液1を固化したファントムに注ぎ込み、最終的に、ファントム表面の3mm下にIV分布のAuNRが埋め込まれた表面下腫瘍を作製しました。(H)ファントム表面からの腫瘍の寸法、AuNRの分布、および腫瘍の深さを示す解剖されたファントム。この図はShaw et al.25から引用した。略語:IT =腫瘍内;IV = 静脈内投与;AuNRs=金ナノロッド。 この図の拡大版を表示するには、ここをクリックしてください。

図5:ファントムでの光熱実験のセットアップ。 (A)ファントム内のさまざまな半径方向および軸方向の位置に熱電対(タイプK)を挿入します。(B)ファントムへのNIR照射とその後の挿入熱電対による温度監視。この図はShaw et al.25から引用した。略語:NIR =近赤外線。 この図の拡大版を表示するには、ここをクリックしてください。
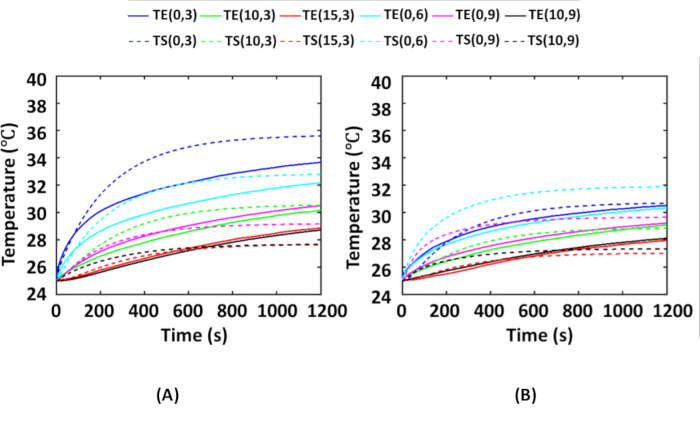
図6:数値シミュレーションの検証のための実験結果とシミュレーション結果の比較。 光熱実験中にファントム上のさまざまな熱電対位置で得られた平均温度と、(A)IT分布および(B)IV分布の対応するシミュレーション温度と比較したもの。熱電対の位置は (r, z) で表され、それぞれ半径と深さを表します。組織内の深さ3mmに位置するAuNRに埋め込まれた腫瘍に、NIR強度0.25 W/cm2を照射します。実線と破線は、それぞれ実験的に得られた温度とシミュレーションによって計算された温度を表します。この図はShaw et al.25から引用した。略語:IT =腫瘍内;IV = 静脈内投与;AuNRs = 金ナノロッド;NIR = 近赤外線;TE = 実験温度;TS = シミュレートされた温度。この図の拡大版を表示するには、ここをクリックしてください。
| AuNRの分布 | エラー | T(0, 3) | T(10, 3) | T(15, 3) | T(0, 6) | T(0, 9) | T(10, 9) |
| ITディストリビューション | 前 | 1.96 | 0.92 | 0.42 | 1.05 | 0.46 | 0.54 |
| RMSEの | 2.1 | 1 | 0.55 | 1.13 | 0.62 | 0.6 | |
| IVディストリビューション | 前 | 0.43 | 0.36 | 0.36 | 1.9 | 1.12 | 0.44 |
| RMSEの | 0.46 | 0.43 | 0.44 | 1.94 | 1.19 | 0.5 |
表1:さまざまな熱電対位置でのAuNRのIT分布とIV分布について計算されたMAEとRMSE。 この表はShaw et al.25から引用した。すべてのデータは摂氏(ºC)です。略語:MAE =平均絶対誤差;RMSE = 二乗平均平方根誤差;IT = 腫瘍内;IV = 静脈内投与;AuNRs=金ナノロッド。
補足ファイル1:A。40 mm x 12 mm 円筒形金型の STL ファイル。このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル2:A .20 mm x 6 mmマスキングモールド用のSTLファイル。 このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル3:A .14 mm x 3 mmマスキング金型用のSTLファイル。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
この論文では、光学ファントムを模倣したアガロースベースの腫瘍組織を調製するためのプロトコルを示します。ファントムは、PPTTの研究で使用するために、腫瘍と正常組織の光学特性を模倣するように設計されています。この研究では、PPTT中の数値法の検証にこれらのファントムを適用することに焦点を当てています。このプロトコルで最も重要なステップは、アガロースとILを含むファントム溶液の温度を、常に攪拌しながら60°Cに維持することです。温度が60°Cを超えると、ILの変性を引き起こし、調製したファントムの所望の光学特性が変化する可能性があります。逆に、温度が40°Cを下回ると、早期のゲル化が起こり、散乱成分(IL)および/または吸収成分(AuNR)の分布が不均一になる可能性がある18。
もう一つの重要な側面は、熱電対の正確な配置です。わずかな位置ずれ(ミリメートルスケール)でも、測定された温度上昇に大きな影響を与える可能性があります。これを防ぐために、ガラスキャピラリーを使用して、熱電対をファントム内の目的の空間位置に正確に導くことが規定されています。さらに、熱電対の不適切な配置による潜在的なエラーをトラブルシューティングするには、光熱評価を少なくとも3倍25で実施する必要があります。
この記事で説明したアガロースベースの光学ファントムは、使用可能な保存期間が1日以下と短くなっています。したがって、光熱実験は、ファントムが準備されたのと同じ日に実施する必要があります。ただし、やむを得ない事情では、保存期間を延ばすために、ファントムは固化直後にペトリ皿に入れ、パラフィルムで密封し、4°Cで保管する必要があります。これにより、ファントムの使い勝手が2〜3日間延長されます。実証されたプロトコルの別の制限は、ファントム成分が入手可能な文献に基づいて濃度で添加され、所望の μs' および μaを達成したことです。所望の光学特性を持つファントムが用意されていると仮定しました。しかし、本研究では、作製したファントムの光学特性を、作製後に適切な技術を用いて測定しませんでした。
アガロースベースの光学ファントムの作製は、簡単で、費用対効果が高く、時間効率が良いです。これらのアガロースベースのファントムは、必要に応じて適切な金型を使用して、さまざまな形状やサイズ、または層で簡単に鋳造できます。液体および固体のファントムには、この柔軟性が欠けています19,38。NIR照射中、ナノ粒子に包埋されたファントムの光熱応答を熱電対ベースの温度モニタリングを用いて評価しました。この方法には、測色法(最小値と最大値の間の温度のみを区別するように限定)、赤外線サーモグラフィー(表面レベルの温度検出に限定)、磁気共鳴温度計(高コストで操作が複雑であるため、主にin vivoアプリケーションに適している)26など、他の技術に比べていくつかの利点があります。.熱電対ベースのモニタリングは、高感度(0.1°C)と高精度、より深い場所での温度検出能力、費用対効果、操作の容易さを提供し、このようなファントムベースの評価に最適な選択肢となっています。さらに、腫瘍組織を模倣したファントムでの光熱実験を通じて数値シミュレーションを検証することは、不必要な痛みや苦痛を引き起こす可能性のあるマウスのような生体内モデルの必要性を減らすという大きな利点を提供します。さらに、ファントムベースの評価は、倫理的な懸念を回避します。
本研究では、PPTTにおける数値シミュレーションの検証に光ファントムの使用を重視しています。組織模倣ファントムは、文献で報告されたデータに基づいて調製され、成分の濃度が、特に散乱係数と吸収係数の減少に関して、目的の光学特性に対応することを確認しました。この研究では光学特性を直接測定していませんが、準備されたファントムは意図した光学特性を示していると考えるのが妥当です。これらのファントムは、実際の組織の光学特性を模倣するように設計されているため、生体組織における光輸送を研究するための参照材料として役立ち、これらの特性を測定する際の光学的方法の精度を検証し、組織シミュレーション条件下での新規ナノ構造の光熱性能を評価し、さらなるin vivo実験の設計を導くための予備データを生成することができます17。18,26.
開示事項
著者らには、開示すべき競合する利害関係はありません。
謝辞
この研究は、公的、商業的、または非営利の資金提供機関からの財政的支援なしに実施されました。著者らは、インドのチャンディーガルにあるCSIR-Central Scientific Instruments Organisationのインフラストラクチャとサポートに感謝しています。
資料
| Name | Company | Catalog Number | Comments |
| Agarose | Sigma-Aldrich | 9012-36-6 | Base matrix for phantoms |
| Deionized (DI) water (18.2 MΩ) | NA | NA | Solvent for the preparation of phantom solutions |
| Gold nanorods (AuNRs) | Nanopartz | A12-10-808 | Plasmonic nanoparticles |
| Intralipid (20% emulsion stock) | Sigma-Aldrich | 68890-65-3 | Scattering agent of phantoms |
| Parafilm | Parafilm M | 380020 | To seal the bottom of cylindrical mold |
| Polylactic acid filament | eSun | NA | Material for molds (1.75 mm dia wire) |
| Name of Equipment | Company | Catalog Number | Comments/Description |
| 3D Printer | Creality | Ender-3 | For printing molds |
| Data acquisition (DAQ) system | National Instruments | cDAQ-9171 | For recording temperatures |
| DI water unit | Merck Millipore | Direct-Q3 | For DI water |
| Hot plate with magnetic stirrer | IKA | C-MAG HS 4 | For phantom solutions preparation |
| NIR light source | NA (In-house developed) | NA | For NIR irradiation of phantoms, (800/50 nm; Center wavelength: 800 nm, Bandwidth: 50 nm) |
| Optical Fiber (1/2" × 12") | Edmund Optics | 38-659 | For NIR irradiation of phantoms |
| Type K thermocouples | RS Components | RS Pro 397-1589 | For temperature monitoring at various phantom locations during NIR irradiation |
| Weighing Balance | Wensar | PGB 200 | For weighing agarose |
| Name of Software | Company | Catalog Number | Comments/Description |
| Autodesk Inventor 2021 | Autodesk | NA | For mechanical designing of molds |
| Cura 5.7 | Ultimaker | NA | For converting mechanical design to Gcode for 3D printing |
| Matlab R2024b | MathWorks | NA | For numerical simulations and temperature data plots |
| Name of Labwares used | Company | Catalog Number | Comments/Description |
| Beakers (50 mL) | Borosil | 1000D12 | For phantom solution preparations |
| Beakers (10 mL) | Borosil | 1000006 | For phantom solution preparations |
| Pipette (100-1000 µL) | Eppendorf Research plus, 1-channel, variable | 3123 000 063 | For adding constituents into the phantom solution |
| Pipette (10-100 µL) | Eppendorf Research plus, 1-channel, variable | 3123 000 047 | For adding constituents into the phantom solution |
| Spatula | Borosil | LASC8888M06 | For weighing agarose and demolding the phantoms from the molds |
| Tips (100-1000 µL) | Tarsons | 521016 | For adding constituents into the phantom solution |
| Tips (10-100 µL) | Tarsons | 521010Y | For adding constituents into the phantom solution |
参考文献
- Riley, R. S., Day, E. S. Gold nanoparticle-mediated photothermal therapy: applications and opportunities for multimodal cancer treatment. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 9 (4), e1449 (2017).
- Webb, J. A., Bardhan, R. Emerging advances in nanomedicine with engineered gold nanostructures. Nanoscale. 6 (5), 2502-2530 (2014).
- Abadeer, N. S., Murphy, C. J. Recent progress in cancer thermal therapy using gold nanoparticles. J Phys Chem C. 120 (9), 4691-4716 (2016).
- Murphy, C. J., et al. Virus-sized gold nanorods: Plasmonic particles for biology. Acc Chem Res. 52 (8), 2124-2135 (2019).
- Overchuk, M., Weersink, R. A., Wilson, B. C., Zheng, G. Photodynamic and photothermal therapies: Synergy opportunities for nanomedicine. ACS Nano. 17 (9), 7979-8003 (2023).
- Goldberg, S. N., Gazelle, G. S., Mueller, P. R. Thermal ablation therapy for focal malignancy. Am J Roentgenol. 174 (2), 323-331 (2000).
- Soni, S., Tyagi, H., Taylor, R. A., Kumar, A. Role of optical coefficients and healthy tissue-sparing characteristics in gold nanorod-assisted thermal therapy. Int J Hyperth. 29 (1), 87-97 (2013).
- Khurana, D., Vikas, A. K., Shaw, S., Soni, Polydopamine coated gold nano blackbodies for tumor-selective spatial thermal damage during plasmonic photothermal cancer therapy. IEEE Trans Nanobiosci. 21 (4), 482-489 (2021).
- Jung, H. S., Verwilst, P., Sharma, A., Shin, J., Sessler, J. L., Kim, J. S. Organic molecule-based photothermal agents: an expanding photothermal therapy universe. Chem Soc Rev. 47 (7), 2280-2297 (2018).
- Ge, R. L., Yan, P. N., Liu, Y., Li, Z. S., Shen, S. Q., Yu, Y. Recent advances and clinical potential of near infrared photothermal conversion materials for photothermal hepatocellular carcinoma therapy. Adv Func Mater. 33 (29), 2301138 (2023).
- Shabani, L., et al. An investigation into green synthesis of Ru template gold nanoparticles and the in vitro photothermal effect on the MCF-7 human breast cancer cell line. Appl Phys A. 129 (8), 564 (2023).
- Mosleh-Shirazi, S., et al. Investigation through the anticancer properties of green synthesized spinel ferrite nanoparticles in present and absent of laser photothermal effect. Ceram Int. 49 (7), 11293-11301 (2023).
- Amani, A. M., et al. Innovation applications of MXenes in biomedicine. Mater Today Commun. 40, 109929 (2024).
- Ali, M. R. K., Wu, Y., El-Sayed, M. A. Gold-nanoparticle-assisted plasmonic photothermal therapy advances toward clinical application. J Phys Chem C. 123 (25), 15375-15393 (2019).
- Lahonian, M., Golneshan, A. A. Numerical study of temperature distribution in a spherical tissue in magnetic fluid hyperthermia using Lattice Boltzmann method. IEEE Trans NanoBiosci. 10 (4), 262-268 (2011).
- Shaw, A. K., Soni, S. Role of periodic irradiation and incident beam radius for plasmonic photothermal therapy of subsurface tumors. J Therm Biol. 121, 103859 (2024).
- Pogue, B. W., Patterson, M. S. Review of tissue simulating phantoms for optical spectroscopy, imaging and dosimetry. J Biomed Opt. 11 (4), 041102 (2006).
- Mustari, A., et al. Agarose-based tissue mimicking optical phantoms for diffuse reflectance spectroscopy. J Vis Exp. (138), e57578 (2018).
- Dabbagh, A., Abdullah, B. J. J., Ramasindarum, C., Abu Kasim, N. H. Tissue-mimicking gel phantoms for thermal therapy studies. Ultrason imaging. 36 (4), 291-316 (2014).
- Khurana, D., et al. Experimental investigation of photothermal conversion and thermal conductivity of broadband absorbing gold nanoblackbodies and graphene oxide nanoparticles for plasmonic photothermal cancer therapy. Int Commun Heat Mass Transf. 156, 107597 (2024).
- Ortega-Palacios, R., Leija, L., Vera, A., Cepeda, M. F. J. Measurement of breast-tumor phantom dielectric properties for microwave breast cancer treatment evaluation. , 216-219 (2010).
- Wagnières, G., et al. An optical phantom with tissue-like properties in the visible for use in PDT and fluorescence spectroscopy. Phys Med Biol. 42 (7), 1415 (1997).
- Didychuk, C. L., Ephrat, P., Chamson-Reig, A., Jacques, S. L., Carson, J. J. L. Depth of photothermal conversion of gold nanorods embedded in a tissue-like phantom. Nanotechnology. 20 (19), 195102 (2009).
- Shaw, A. K., Khurana, D., Soni, S. Thermal damage analysis of sub-surface soft tissue sarcoma for Indocyanine Green mediated photothermal cancer therapy. Therm Sci Eng Prog. 46, 102168 (2023).
- Shaw, A. K., Khurana, D., Soni, S. Assessment of thermal damage for plasmonic photothermal therapy of subsurface tumors. Phys Eng Sci Med. 47 (3), 1107-1121 (2024).
- Khurana, D., Soni, S. Tissue-mimicking phantoms for photothermal performance evaluations. Recent Trends in Cancer Therapeutics: Plasmonic Photothermal-Based Multimodal Cancer Therapy. , 109-136 (2024).
- Eranki, A., et al. Tissue-mimicking thermochromic phantom for characterization of HIFU devices and applications. Int J Hyperth. 36 (1), 517-528 (2019).
- McLaughlan, J. R. Controllable nucleation of cavitation from plasmonic gold nanoparticles for enhancing high intensity focused ultrasound applications. J Vis Exp. (140), e58045 (2018).
- Soni, S., Tyagi, H., Taylor, R. A., Kumar, A. Experimental and numerical investigation of heat confinement during nanoparticle-assisted thermal therapy. Int Commun Heat Mass Transf. 69, 11-17 (2015).
- Ntombela, L., Adeleye, B., Chetty, N. Low-cost fabrication of optical tissue phantoms for use in biomedical imaging. Heliyon. 6 (3), e03602 (2020).
- Lai, P., Xu, X., Wang, L. V. Dependence of optical scattering from Intralipid in gelatin-gel based tissue-mimicking phantoms on mixing temperature and time. J Biomed Opt. 19 (3), 035002 (2014).
- Aernouts, B., Van Beers, R., Watté, R., Lammertyn, J., Saeys, W. Dependent scattering in Intralipid®phantoms in the 600-1850 nm range. Opt Express. 22 (5), 6086-6098 (2014).
- Tromberg, B. J., et al. Non-invasive in vivo characterization of breast tumors using photon migration spectroscopy. Neoplasia. 2 (1-2), 26-40 (2000).
- Kanick, S. C., et al. Scattering phase function spectrum makes reflectance spectrum measured from Intralipid phantoms and tissue sensitive to the device detection geometry. Biomed Opt Express. 3 (5), 1086-1100 (2012).
- Yuan, B., Chen, N., Zhu, Q. Emission and absorption properties of indocyanine green in Intralipid solution. J Biomed Opt. 9 (3), 497-503 (2004).
- Khurana, D., et al. Gold nanoblackbodies-based multifunctional nanocomposite for multimodal cancer therapy. Int J Pharm. 642, 123112 (2023).
- Brough, D., Ramos, J., Delpech, B., Jouhara, H. Development and validation of a TRNSYS type to simulate heat pipe heat exchangers in transient applications of waste heat recovery. Int J Thermofluid. 9, 100056 (2021).
- Vardaki, M. Z., Kourkoumelis, N. Tissue phantoms for biomedical applications in Raman spectroscopy: A review. Biomed Eng Computational Biol. 11, 1179597220948100 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved