Method Article
等离子体光热癌症疗法:用于可视化光热温度分布的纳米颗粒包埋肿瘤组织模拟模型
摘要
本文介绍了制备复制等离子体光热疗法光学特性的肿瘤组织模型方案。它详细介绍了体模制备、光热评估和基于光热温度测量开发的数值模型的验证,用于评估治疗参数,为初步测试的 体内 研究提供了一种合乎道德、经济高效的替代方案。
摘要
等离子体光热疗法 (PPTT) 是一种新兴的癌症治疗方法,包括将纳米颗粒 (NP) 输送到肿瘤,然后进行近红外 (NIR) 照射以产生局部热量,从而破坏癌细胞。在给予 PPTT 之前,需要估计治疗参数 - NP 浓度、照射强度和持续时间 - - 需要估计。为此,进行了数值模拟。然而,为了确保稳健的计算,这些模拟必须通过在复制肿瘤组织光学特性的肿瘤组织模拟模型上进行光热实验来验证。对于 PPTT,治疗参数受组织和 NP 对入射辐射的散射和吸收的控制。因此,可以在模拟目标肿瘤/组织降低的散射系数 (μs') 和吸收系数 (μa) 的模型上进行验证实验。
具体来说,该方案提供了制备模拟注射金纳米棒的乳腺肿瘤 μs 和 μa 的模型的说明,周围环绕着正常的乳腺组织。该协议还详细介绍了 NIR 照射、温度监测以及通过将时空温度与使用热电偶测量的温度进行比较来验证数值结果。本研究中提出的方案有助于制备基于水凝胶的圆柱形乳腺肿瘤组织模型,其尺寸 (φ40 x 12 mm) 和中心肿瘤区域 (φ20 x 6 mm),包括 1% 琼脂糖作为基质和脂肪乳作为散射成分和肿瘤区域嵌入金纳米棒浓度为 25 μg/mL。案例研究的代表性结果说明了制造模型在验证 PPTT 数值模拟中的应用。该研究得出结论,所演示的方案对于进行光热实验很有价值,旨在优化和规划 体内实验之前的 治疗参数以及验证 PPTT 的数值模拟。
引言
等离子体光热疗法 (PPTT) 是一种新兴的局部癌症治疗方式,包括将纳米颗粒 (NP) 输送到肿瘤部位,然后用近红外 (NIR) 辐射照射。NP 通常通过瘤内 (IT) 或静脉内 (IV) 途径给药1。在 NIR 照射下,入射辐射和 NP 的等离子体相互作用导致在 NP 表面产生局部热量,然后消散到周围的肿瘤组织中 2,3。这种局部加热会升高肿瘤区域的温度,导致癌细胞通过热消融死亡 4,5。有效的癌症治疗可以通过保持特定的温度来实现,例如 46 ºC 1 小时 6,50-52 ºC 4-6 分钟7,或 60 ºC 瞬时损伤8 通过各种生物过程。
已经探索和报道了各种光热剂用于光热疗法的应用,其治疗效果已通过体外或体内研究进行评估。这些试剂包括有机材料9,如近红外染料(如吲哚菁绿、IR780、IR820)、聚合物基光热剂(如聚多巴胺)和无机材料10,包括贵金属基NPs或等离子体NPs(如金NPs)11、过渡金属硫/氧化物12和MXenes13.其中,等离子体 NP,特别是金 NP,与传统光热剂(例如染料)相比具有多项优势,例如更好的光热稳定性、更高的光热转换效率以及通过形状和尺寸变化可调的等离子体响应10。这些属性使金 NP 成为光热疗法的理想选择,其中一些目前正在进行临床试验14。
为了优化治疗效果并确保 PPTT 期间足够的肿瘤热损伤,必须在 PPTT 的临床前/临床应用之前估计 NP 剂量(以浓度为单位)和 NIR 辐射参数(包括照射强度和持续时间)等治疗参数。通常采用数值模拟来确定这些参数。已经开发了各种数值方法来评估肿瘤组织内的热损伤,其中晶格玻尔兹曼法就是这样一种方法15,16。然而,为了使这些模拟可靠,必须使用称为组织模拟模型的组织类似物对其进行验证。这些模型可以制备以复制真实组织的光学、热、生物或机械特性,作为替代品,对新开发的用于生物应用的设备、材料或方法进行初步测试、治疗评估和验证17,18。这可以减少动物或人类受试者不必要的痛苦,并解决与此类实验相关的伦理问题19,20。
模型的设计和制造取决于预期的应用21。例如,在像 PPTT 这样的光疗过程中,入射辐射的剂量受 NP 和组织吸收或散射的光量的影响22,23。因此,模拟生物组织光学特性的光学体模,特别是降低的散射系数 (μs') 和吸收系数 (μa),用于 PPTT 评估和随后的数值模拟验证24,25。光学体模通常由三种主要成分组成:基基、散射剂和吸收剂17,26。基基质将散射和吸收成分保持在适当的浓度,以复制所需的光学特性。这些模型可分为固体、液体和半固体(水凝胶)模型,具体取决于基质的类型。对于像 PPTT 这样的热治疗研究,水凝胶体模,尤其是基于琼脂糖的体模,是首选,因为它们具有生物相容性、可忽略不计的固有散射和吸收、简单的制造工艺以及可灵活铸造成与肿瘤几何形状相对应的所需形状和尺寸19,22。最重要的是,制备的基于琼脂糖的体质可在高达 ~70-80 ºC 的体温下使用,因为琼脂糖型体质体的熔解温度为 ~80 ºC19。对于 PPTT,由于 ~50-80 ºC 的温度范围就足够了,因此这种基于琼脂糖的模型可用于基于 PPTT 的光热评估。
已经开发并报道了各种基于水凝胶的组织模拟模型。Mustari 等人开发了基于琼脂糖的组织模拟模型,并在验证新设计的光学系统方面证明了它们的实用性18。在另一项研究中,制备了模拟组织的热致变色模型来测量高强度聚焦超声 (HIFU) 治疗期间的热损伤程度27。还制备了基于聚丙烯酰胺的组织模拟模型来分析基于 HIFU 的癌症治疗过程中的空化效应28。本研究的目的是展示一种制造肿瘤组织模拟模型的分步方法以及用于 PPTT 评估的基于模型的光热实验方案。本拟议的详细协议旨在促进体模制备和随后基于体模的光热实验方法的采用和可重复性,以测试新开发的纳米结构的光热性能,从而验证数值模拟并帮助 PPTT 的治疗前计划或治疗参数的优化。本文介绍了一种专为亚表面乳腺肿瘤设计的体模制备方案;然而,通过改变光吸收剂和散射剂的组成,相同的步骤可以适用于制造各种肿瘤组织类型(各种形状和大小)。例如,先前报道的研究中已采用已证明的模拟组织模拟体模的光热评估,以验证前臂下肿瘤24、下表面 IDC25 和皮肤肿瘤29 的 PPTT 模拟。
本文描述了模拟表面下或皮下乳腺肿瘤 μ的光学体模的制备步骤,特别是浸润性导管癌 (IDC),位于皮肤表面以下 3 毫米处,周围环绕着正常乳腺组织。模型为圆柱形几何形状,使用琼脂糖作为基质,脂肪乳 (IL) 作为散射剂,以适当浓度添加模拟正常和癌变乳腺组织的 μs'。琼脂糖是一种透明的水凝胶,散射和吸收可以忽略不计,是光学体模的理想基质18,30。此外,IL 是一种模拟细胞膜双层结构的 20% 脂肪乳剂,被广泛用作散射剂 31,32,并被选择用于本研究以复制正常和癌变乳腺组织的 μ。该模型旨在模拟注射金纳米棒 (AuNR) 作为等离子体 NP 的乳腺肿瘤 (IDC),周围环绕着没有 AuNR 的正常乳腺组织。在 PPTT 中使用的各种金 NP 中,AuNR 被选中用于本研究,因为它们在 NIR 区域具有很强的等离子体反应,并且在临床前 PPTT 研究中得到广泛使用,包括涉及犬科和猫科患者的研究14。该方案演示了两种模型的制备:一种具有 IV 注射所见的具有 AuNR 分布的肿瘤,另一种具有反映通过 IT 注射实现的 AuNR 分布的肿瘤。按照模型制备方案,描述了 NIR 照射的实验设置和对模型进行光热评估的步骤。最后,本文提供了分步指南,用于解释从这些评估中获得的温度分布结果,并将实验数据与数值仿真结果进行比较。这种比较有助于验证开发的数值方法,从而能够调整专门针对肿瘤的最佳治疗参数。
研究方案
注:根据文献报道的组合物,使用琼脂糖和脂质体制备模型,以实现所需的光学特性。没有使用来自患者或尸体的真实生物组织。因此,这些模型的制备不受道德约束,也不需要知情同意。
1. 选择合适的模具或制作模具
- .选择合适的模具
- 选择与虚拟模型所需的形状和尺寸相匹配的模具。对于肿瘤区域均匀分布有 NP 并被正常组织包围的圆柱形模型,使用玻璃培养皿和小烧杯作为模具8 (图 1A)。
注意:这些步骤用于制备圆柱形几何形状中的肿瘤组织模拟模型。对于其他形状或尺寸,请选择合适的模具。如果没有合适的模具,请使用 3D (3D) 打印制造模具,如步骤 1.2 中所述。
- 选择与虚拟模型所需的形状和尺寸相匹配的模具。对于肿瘤区域均匀分布有 NP 并被正常组织包围的圆柱形模型,使用玻璃培养皿和小烧杯作为模具8 (图 1A)。
- 通过 3D 打印制造模具
- 根据所需的形状和大小,使用计算机辅助设计 (CAD) 软件(例如 SolidWorks、Autodesk Inventor 或 CATIA)设计 3D 模型。为了遵循此协议,设计一个空心圆柱体(内径 40 毫米,厚度 2 毫米,高度 12 毫米;参见 补充文件 1)和两个实心圆柱形遮蔽模具(尺寸 φ20 x 6 毫米和 φ14 x 3 毫米),如图 1B 所示。
- 对于空心圆柱体设计/制图,在 CAD 软件中创建两个直径分别为 40 mm 和 44 mm 的圆。然后,将几何体拉伸 12 mm。
- 对于实心圆柱形遮蔽模具,创建直径为 20 mm 和 14 mm 的圆,然后分别挤出 6 mm 和 3 mm(请参阅 补充文件 2 和 补充文件 3)。在圆柱体的一侧绘制一个矩形(边长 44 毫米和 5 毫米),并将其挤出 2 毫米。
- 使用与 3D 打印机兼容的软件(例如 Cura)将 3D 模型转换为 Gcode 格式进行打印。
- 使用此 Gcode 通过 3D 打印机打印模具(例如,本文使用聚乳酸 [PLA] φ1.75 mm,1 kg eSun)。
注意: 绘制矩形以悬挂遮蔽模具。可以设计和制造不同的模具来准备具有其他所需形状的模型。
- 根据所需的形状和大小,使用计算机辅助设计 (CAD) 软件(例如 SolidWorks、Autodesk Inventor 或 CATIA)设计 3D 模型。为了遵循此协议,设计一个空心圆柱体(内径 40 毫米,厚度 2 毫米,高度 12 毫米;参见 补充文件 1)和两个实心圆柱形遮蔽模具(尺寸 φ20 x 6 毫米和 φ14 x 3 毫米),如图 1B 所示。
2. 制备肿瘤组织模拟体模溶液25
注意:在这项研究中,模拟肿瘤组织的圆柱形几何形状的基于琼脂糖的光学体模制备成类似于通过 IT 或 IV 注射注射 AuNRs 的亚表面乳腺肿瘤,如图 2 所示。IT 模型有两个区域:一个带有 AuNR 的中央肿瘤区域和一个周围的正常组织区域。IV 模型有三个区域:肿瘤外围有 AuNR 的肿瘤区域、没有 AuNR 的中央裸露肿瘤区域和周围的正常组织区域。由于肿瘤和正常组织的光学特性 (μa 和 μs') 不同,因此为具有不同成分的每个区域制备单独的体模溶液,并将单独讨论。
- 制备模拟正常乳房组织的体模溶液(溶液 1)
注意:该解决方案将用于 IT 和 IV 模型。 解决方案 1 的准备步骤如图 3A 所示。- 根据模具的尺寸计算溶液的理论体积。
注:此处,对于 φ40 x 12 mm 的圆柱形模具,计算出的体积为每个模型 15 cm3 或 15 mL。由于需要准备两个这样的模型,总体积为 15 mL x 2,即 30 mL。因此,准备 35 mL 溶液,以解决体模制备步骤中的蒸发或溢出问题。 - 计算要添加到 35 mL 溶液中的所有幻影成分的量(重量/浓度/体积) - 琼脂糖(作为基础材料)和 IL (作为散射成分) - 。
- 加入 0.35 g 琼脂糖以制备 35 mL 溶液,相当于 1% w/v 浓度。
- 根据文献中可用的 IL 浓度与 μs 数据估计对应于正常乳腺组织所需 μs' 的 IL 浓度(即 10.1 cm -1 33)。接下来,使用公式 (20) 计算要添加到体模溶液中的 IL(1% 乳剂原液)的体积:
 (1)
(1)
其中 C1 和 V1 分别是试剂原液的浓度(此处为 20% IL 原液)和要添加的试剂原液的体积(此处要计算)。 C2 是最终工作溶液中试剂的所需浓度(从文献中获得), V2 是最终工作溶液的总体积(此处为 35 mL)。
注意:在这里,对于 10.1 cm-1 的 μs',从报道的文献中估计的 IL 浓度为 1.04%34,35。使用上述步骤,要添加的 IL(20% IL 原液)的体积为 1.82 mL。
- 称取 0.35 g 琼脂糖,将其添加到烧杯中的 33.18 mL 去离子 (DI) 水中。用铝箔盖住烧杯,以避免水分流失。
- 将装有溶液的烧杯放在热板上于 120 °C 加热,同时搅拌直至溶液变得透明。
- 将热板的温度降低到 60 ºC。15 分钟后,在搅拌的同时加入 1.82 mL IL。将所得溶液 1 在 60 ºC 下搅拌直至使用(准备倾倒)。
注:60 ºC 的体模溶液需要在搅拌条件下保存。否则,它会导致溶液凝固。
- 根据模具的尺寸计算溶液的理论体积。
- AuNR 包埋的肿瘤模型溶液的制备 (Solution 2)
注意:该解决方案将用于 IT 和 IV 模型。 解决方案 2 的准备步骤如图 3B 所示。- 计算要填充的肿瘤区域的体积 (φ20 x 6 mm)。
注:两个这样的肿瘤模型大约体积为 3.8 mL。因此,要制备的溶液体积为 4.5 mL。 - 使用第 2.1 节中提到的类似步骤计算要添加的肿瘤幻影成分的量 - 琼脂糖、IL 和 AuNRs。
- 加入 45 mg 以制备 4.5 mL 溶液,相当于 1% w/v 浓度。
- 乳腺肿瘤的 IL:μs' 为 4.6 cm-1 33,为了模拟相同,所需的相应 IL 浓度为 0.472%34,35。因此,将 106.2 μL IL 从 20% IL 原液添加到 4.5 mL 肿瘤模型溶液中。
- 体型中 AuNR 的所需浓度为 25 μg/mL。为了达到相同的效果,向肿瘤模型溶液中加入 3.21 mL 的 AuNRs 溶液(储备浓度:35 μg/mL)。
- 在烧杯中将 45 mg 琼脂糖加入 1.18 mL 去离子水中,并用铝箔覆盖。
- 将烧杯放在热板上,在 120 ºC 下搅拌,直到溶液变得透明。
- 将热板的温度降低到 60 ºC 并放置溶液 15 分钟。
- 在搅拌条件下加入 106.2 μL IL 和 3.21 mL AuNR 悬浮液 (35 μg/mL)。将所得溶液( 溶液 2)在 60 ºC 下搅拌直至倾倒。
- 计算要填充的肿瘤区域的体积 (φ20 x 6 mm)。
- 裸肿瘤(不含 AuNRs)体模溶液(溶液 3)的制备
注意:此解决方案将仅用于 IV 体模。 解决方案 2 的准备步骤如图 3C 所示。- 计算要添加的悬浮液的理论体积以创建裸露的肿瘤区域 (~ φ20 x 6 mm)。
注:肿瘤模型的近似体积为 1.9 mL。因此,要制备的溶液体积为 2.5 mL。 - 使用第 2.1 节中提到的类似步骤计算要添加的肿瘤幻影成分的量 - 琼脂糖和 IL。
- 加入 25 mg 琼脂糖制备 2.5 mL 溶液,以达到 1% w/v 浓度。
- 乳腺肿瘤的 IL:μs' 为 4.6 cm-1 33,为了模拟相同,所需的相应 IL 浓度为 0.472%34,35。加入 59 μL 的 20% IL 原液。
- 在烧杯中将 25 mg 琼脂糖加入 2.44 mL 去离子水中,并用铝箔覆盖。
- 将烧杯放在热板上,在 120 ºC 下搅拌,直到溶液变得透明。
- 将热板的温度降低到 60 ºC 并放置溶液 15 分钟。
- 在搅拌条件下向溶液中加入 59 μL IL。将所得溶液( 溶液 3)在 60 ºC 的搅拌条件下保持至倾倒。
- 计算要添加的悬浮液的理论体积以创建裸露的肿瘤区域 (~ φ20 x 6 mm)。
3. 制备模拟肿瘤组织模型的模型 24,25,36
- 为浇注步骤准备模具。为此,用封口膜密封圆柱形模具的底部,并将遮蔽模具 (φ20 x 6 mm) 放在中心。
- 将 溶液 1 倒入圆柱形模具中,直到遮蔽模具的顶部标记,并使其凝固(图 4A)。
- 凝固后,去除掩蔽模具,为肿瘤区域创建一个空腔(图 4B)。
注意:直到第 3.3 步,IT 和 IV 模型的协议都是相同的。在步骤 3.3 之后,将分别讨论 IT 和 IV 模型的过程。 - IT 幻影 24,25,36
- 用 溶液 2 填充空腔并使其凝固(图 4C)。
- 将 解决方案 1 添加到模型的顶部并使其完全凝固(图 4D)。
- IV 模型24,25
- 插入一个较小的遮蔽模具 (φ14 x 3 mm) 并用 解决方案 2 填充其周围的空腔(图 4E)。
- 凝固后,取出较小的模具并用 溶液 3 填充剩余的型腔(图 4F)。
- 将溶液 1 添加到顶部并使其完全固化(图 4G)。
4. 将热电偶插入模型 24,25,36
注意:为了监测空间温度分布,K 型热电偶入到模型内的各个径向 (r) 和轴向 (z) 位置,如图 2 所示。为了在准确位置插入热电偶,使用玻璃毛细管作为导向装置以确保精度。热电偶位置表示为 (r, z),其中肿瘤顶面深度 z = 3 mm 的中点用作 IT 和 IV 模型的参考点,并被指定为 (0, 3),如图 2A、B 所示。当选择桡骨和轴向位置来量化肿瘤区域的热损伤时,肿瘤外围(桡骨和轴向)的位置至关重要。在 NIR 照射期间,在这些外围点达到所需的温度可确保肿瘤完全消融。因此,将热电偶放置在 z = 3 和 9 mm 的(肿瘤)径向极点,即 (10, 3) 和 (10, 9),并且一个热电偶放置在 z = 9 mm(外周轴位置)的肿瘤-组织界面,即 (0, 9) 如图 2A、B 所示。此外,为了评估轴向温度分布,在位置 (0, 3) 和 (0, 9) 之间插入一个热电偶,指定为 (0, 6)。最后,为了评估周围健康组织区域的温度升高,在 (15, 3) 处插入一个热电偶。
- 将玻璃毛细管切割成合适的长度,使其到达模型内所需的径向和轴向位置。
- 将热电偶插入这些玻璃毛细管中,并在指定的径向和轴向模型位置逐个穿刺。
- 一旦所有热电偶就位,小心地将模型放入玻璃培养皿中进行后续的 NIR 照射,如图 5A 所示。
5. 暴露于 NIR 照射和测量产生的光热温度36
- 放置包含模型的玻璃培养皿(插入热电偶),使模型顶面的中心区域垂直于 NIR 光源的光纤尖端,如图 5A 所示。
注意:可以通过改变表面与光纤尖端之间的距离来调整模型表面上的光束直径。在这里,保持 9 mm 的距离以实现 20 mm 的光束直径,覆盖中央肿瘤区域。 - 将数据采集 (DAQ) 系统连接到计算机并打开 LabVIEW 软件。
- 同时打开软件中的 NIR 光源(图 5B)和播放按钮,以记录照射开始时的温度数据。
- 照射模型 20 分钟,然后关闭 NIR 光源并停止录制。
- 绘制记录的温度与时间数据。
6. 与模拟结果的温度比较24,25
注意:实验通常会重复进行,并在所有热电偶位置以设定的时间间隔记录温度。为了进行验证,将执行以下步骤:
- 计算所有热电偶位置 (r, z) 的实验温度的平均值和标准差。
- 以数值方式计算所考虑的热电偶位置的温度。
- 绘制从实验中获得的平均温度和通过仿真获得的所有热电偶位置获得的温度相对于时间的关系,如图 6 所示。
- 计算所有热电偶位置的均方根误差 (RMSE) 和平均绝对误差 (MAE),以量化温度差以评估验证,如 表 1 所示。
注:MAE 和 RMSE 分别使用公式 2 和 3 计算。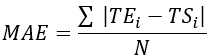 (2)
(2) (3)
(3)
其中 TE、 TS 和 N 分别是实验获得的温度、数值计算的温度和数据点的数量(这里,每秒记录温度 20 分钟;因此,= 1,200)。I 表示时间时刻。
结果
图 6 显示了在所有热电偶位置使用嵌入 AuNR 的肿瘤组织模型进行实验期间获得的时间平均温度,如图 2 所示,与在相应热电偶位置模拟期间获得的温度进行了比较。在这里,对每个分布进行了 4 次实验,即 AuNRs 的 IT 和 IV 分布。在实验期间,室温为 25 ºC。因此,为了进行模拟,周围温度也保持在 25 ºC。 图 6A 显示了 AuNR 的 IT 分布的实验平均温度和模拟温度之间的比较。 图 6B 显示了 AuNR IV 分布的实验平均温度和模拟温度之间的比较。从 图 6A、B 中可以看出,IV 分布显示的温度上升低于 IT 分布。这是因为在入射辐射被 AuNR 包埋的肿瘤吸收之前,由于更大、更厚的散射介质层(裸组织 + 裸露的肿瘤),入射辐射的散射更多地呈 IV 分布。
接下来,温度图显示,在幻象实验期间,IT 和 IV 分布的 (0, 3) 热电偶位置的最大温度上升分别为 ~11 ºC 和 ~6 ºC。需要注意的是,组织在 43 ºC 以下是热安全的 6,16。通常,由于核心体温为 37 ºC,因此 >6 ºC 的升温会导致肿瘤组织内的热损伤。在此,使用 25 μg/mL AuNR 和 0.25 W/cm2 的体模实验表明,在这两种情况下,热损伤在地下肿瘤的径向和轴向 3-4 mm 内诱导,而肿瘤区域的其余部分保持不变。此类方案可用于优化照射强度和 AuNR 浓度,以实现肿瘤的完全热损伤。
此外,如果与实验温度37 相比,误差为 <15%,则称模拟温度得到验证。为此,在两种情况下,计算了所有热电偶位置的 RMSE 和 MAE,如 表 1 所示。IT 分布和 IV 分布的最大变化分别为 2.10 ºC 和 1.94 ºC,对应于模拟温度的 5.88% 和 6.09% 的误差。因此,可以得出结论,实验结果和仿真结果彼此之间具有良好的对比性。
总之,该研究得出结论,此处演示的体模制备和随后基于体模的光热实验的方案有助于验证数值模拟并确保衍生的治疗参数的稳健性,用于 PPTT 的后续 体内 应用。

图 1:用于制造基于琼脂糖的肿瘤组织模拟模型的模具。 (A) 玻璃培养皿和烧杯用作制造圆柱形肿瘤组织模型的模具。(B) 3D 打印的圆柱形模具和掩蔽模具,设计用于制备圆柱形肿瘤组织模型。 请单击此处查看此图的较大版本。
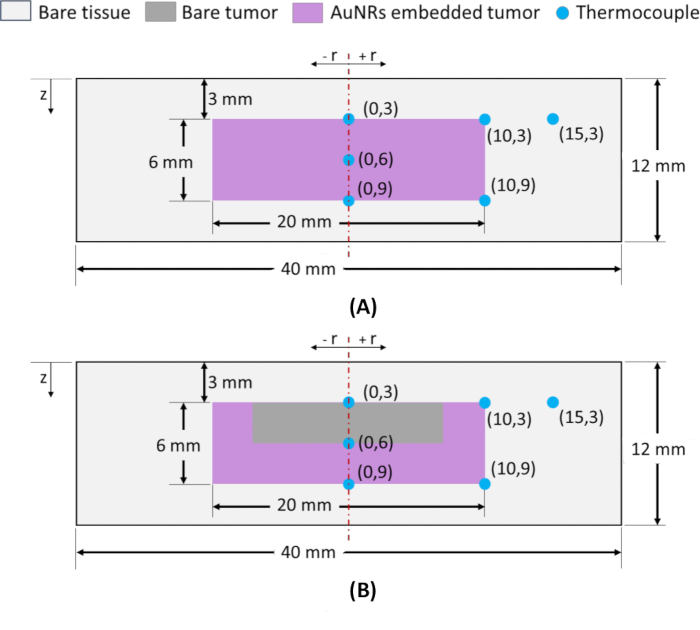
图 2:基于琼脂糖的肿瘤组织模拟圆柱形几何形状的模型示意图。 整体尺寸为 φ40 x 12 mm 的模型,肿瘤位于中心 (φ20 x 6 mm),位于距皮肤表面 3 mm 深处,并被正常组织区域包围。(A) 通过 IT 注射获得的肿瘤区域具有 AuNR 分布的模型。(B) 在 IV 注射中获得的肿瘤区域具有 AuNR 分布的模型。热电偶位置表示为 (r, z),其中 r 是径向位置,z 是距表面的深度。缩写:AuNRs = 金纳米棒;IT = 瘤内;IV = 静脉注射。 请单击此处查看此图的较大版本。
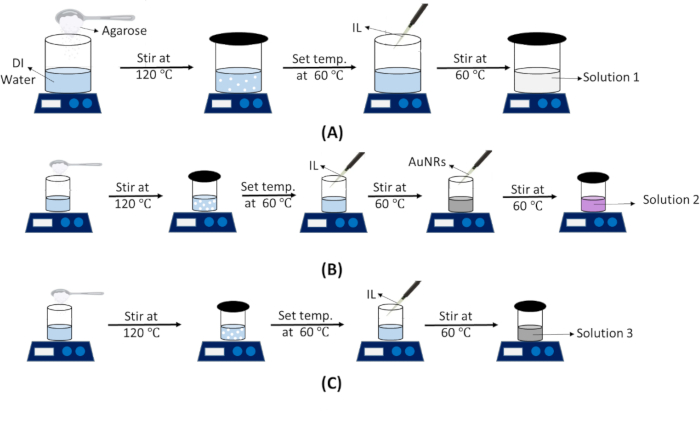
图 3:显示各种幻像溶液制备的示意图。 (A) 正常组织体模溶液(溶液 1)的制备步骤。(B) AuNR 包埋的肿瘤模型溶液(溶液 2)。(C) 裸肿瘤(无 AuNRs)体模溶液(溶液 3)。缩写:DI = 去离子;IL = 脂肪乳;AuNRs = 金纳米棒。 请单击此处查看此图的较大版本。

图 4:制备具有 IT 和 IV 分布的肿瘤组织模拟模型。 体模总直径为 40 mm,深度为 12 mm,中央亚表面肿瘤区域直径为 20 mm,深度为 6 mm,位于体模/皮肤表面以下 3 mm。IT 和 IV 模型的常见步骤:(A) 将溶液 1 倒入圆柱形模具中(底部用封口膜密封),在中心放置遮蔽模具,为肿瘤区域创建一个空腔。(B) 去除遮蔽模 (φ20 x 6 mm) 后固化的正常组织区域,为肿瘤区域创建一个空腔。 A 和 B 之后准备 IT 模型的步骤:(C) 将溶液 2 倒入腔中,形成嵌入 AuNR 的中央肿瘤区域,用于 IT 分布。(D) 溶液 1 倒在凝固的模型上,最终创建一个嵌入 AuNR 的地下肿瘤,具有 IT 分布,位于模型表面下方 3 毫米处。 A 和 B 之后准备 IV 体模的步骤;(E) 放置在中央腔中的小掩蔽模具 (φ14 x 3 mm),在其周围倒入溶液 2 以形成嵌入 AuNR 的外周肿瘤区域以进行 IV 分布。(F) 将溶液 3 倒入剩余的腔中,以创建一个嵌入模拟 IV 分布的 AuNR 的肿瘤区域。(G) 溶液 1 倒在凝固的体模上,最终在体模表面下方 3 mm 处创建一个嵌入 IV 分布的 AuNRs 的亚表面肿瘤。(H) 解剖的模型显示肿瘤尺寸、AuNRs 分布和来自模型表面的肿瘤深度。这个数字取自 Shaw 等人25。缩写: IT = 肿瘤内;IV = 静脉注射;AuNRs = 金纳米棒。 请单击此处查看此图的较大版本。

图 5:模型光热实验的设置。 (A) 热电偶(K 型)插入体模内的各个径向和轴向位置。(B) 模型近红外照射和随后使用插入的热电偶监测温度。这个数字取自 Shaw 等人25。缩写:NIR = 近红外。 请单击此处查看此图的较大版本。
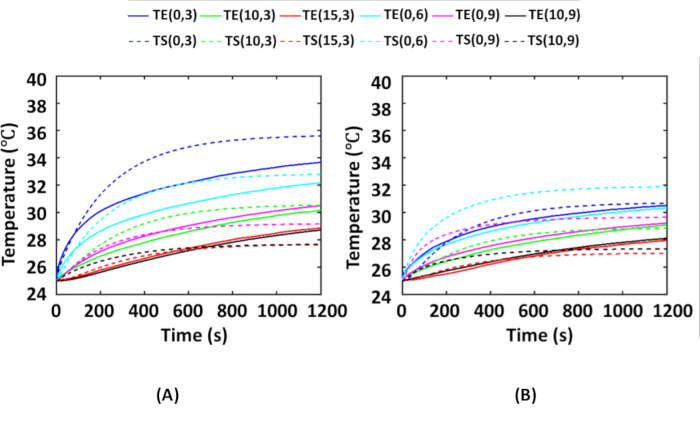
图 6:用于验证数值模拟的实验和模拟结果的比较。 在光热实验期间,在模型上的各个热电偶位置获得的平均温度与 (A) IT 分布和 (B) IV 分布的相应模拟温度进行比较。热电偶位置表示为 (r, z),分别表示半径和深度。位于组织内 3 mm 深度的 AuNR 包埋的肿瘤以 0.25 W/cm2 的 NIR 强度照射。实线和虚线分别表示通过实验获得的温度和通过仿真计算的温度。这个数字取自 Shaw 等人25。缩写: IT = 肿瘤内;IV = 静脉注射;AuNRs = 金纳米棒;NIR = 近红外;TE = 实验温度;TS = 模拟温度。请单击此处查看此图的较大版本。
| AuNRs 分布 | 错误 | T(0, 3) | T(10, 3) | 吨(15, 3) | T(0, 6) | T(0, 9) | T(10, 9) |
| IT 分销 | 梅 | 1.96 | 0.92 | 0.42 | 1.05 | 0.46 | 0.54 |
| 有效值 | 2.1 | 1 | 0.55 | 1.13 | 0.62 | 0.6 | |
| IV 分配 | 梅 | 0.43 | 0.36 | 0.36 | 1.9 | 1.12 | 0.44 |
| 有效值 | 0.46 | 0.43 | 0.44 | 1.94 | 1.19 | 0.5 |
表 1:针对不同热电偶位置的 AuNR 的 IT 分布和 IV 分布计算的 MAE 和 RMSE。 该表摘自 Shaw 等人25。所有数据均以摄氏度 (ºC) 为单位。缩写: MAE = 平均绝对误差;RMSE = 均方根误差;IT = 瘤内;IV = 静脉注射;AuNRs = 金纳米棒。
补充文件 1:A .40 mm x 12 mm 圆柱形模具的 STL 文件。请点击此处下载此文件。
补充文件 2:A .20 mm x 6 mm 遮蔽模具的 STL 文件。 请点击此处下载此文件。
补充文件 3:A .14 mm x 3 mm 遮蔽模具的 STL 文件。请点击此处下载此文件。
讨论
本文介绍了制备基于琼脂糖的模拟光学模型的肿瘤组织的方案。这些模型的设计方式模拟了肿瘤和正常组织的光学特性,用于 PPTT 的研究。在本研究中,强调了这些模型在 PPTT 期间用于数值方法验证的应用。该方案中最关键的步骤是在不断搅拌下将含有琼脂糖和 IL 的幻影溶液的温度保持在 60 ºC。如果温度超过 60 ºC,则可能导致 IL 变性,从而改变制备的体模所需的光学特性。相反,如果温度低于 40 ºC,则会发生过早凝胶化,导致散射分量 (IL) 和/或吸收分量 (AuNRs) 分布不均匀18。
另一个关键方面是热电偶的精确放置。即使是很小的错位(毫米级)也会显著影响测得的温升。为了防止这种情况,规定了使用玻璃毛细管来准确引导热电偶到模型内所需的空间位置。此外,为了解决热电偶放置不当带来的潜在错误,应至少一式三份25 进行光热评估。
本文讨论的基于琼脂糖的光学体模的可用保质期短,不超过 1 天。因此,光热实验必须在准备模型当天进行。然而,在不可避免的情况下,为了延长其保质期,应在模型凝固后立即放入培养皿中,用封口膜密封,并在 4 ºC 下储存。这将使 phantom 的可用性延长 2-3 天。所演示方案的另一个局限性是,根据现有文献以浓度添加幻影成分,以达到所需的 μ s' 和 μa。我们假设已经准备好了具有所需光学特性的体模。然而,在本研究中制备后的体模制备后,没有使用合适的技术测量制备的体模的光学特性。
基于琼脂糖的光学体模的制备简单、经济高效且耗时。如果需要,这些基于琼脂糖的模型可以很容易地铸造成各种形状和大小或层数。液体和固体模型缺乏这种灵活性19,38。在 NIR 照射期间,使用基于热电偶的温度监测评估了纳米颗粒嵌入模型的光热响应。与其他技术相比,这种方法具有多项优势,例如比色法(仅限于区分最小值和最大值)、红外热成像(仅限于表面温度检测)和磁共振测温法(高成本和作复杂性,使其主要适用于体内应用)26.基于热电偶的监测具有高灵敏度 (0.1 °C) 和准确性、在更深位置检测温度的能力、成本效益和易作性,使其成为此类基于幻象的评估的最佳选择。此外,通过对肿瘤组织模拟模型的光热实验来验证数值模拟具有显着的优势,即减少了对小鼠等体内模型的需求,这些模型可能会导致不必要的痛苦和痛苦。此外,基于幻影的评估避免了道德问题。
在本研究中,强调使用光学体模来验证 PPTT 中的数值模拟。根据文献报道的数据制备了组织模拟体模,确保成分的浓度与所需的光学特性相对应,特别是在降低的散射系数和吸收系数方面。虽然本研究中没有直接测量光学特性,但可以合理地假设制备的体模表现出预期的光学特性。由于这些模型旨在模拟真实组织的光学特性,因此它们可以用作研究生物组织中光传输的参考材料,验证光学方法在测量这些特性方面的准确性,评估新型纳米结构在组织模拟条件下的光热性能,并生成初步数据以指导进一步的体内实验设计17,18,26.
披露声明
作者没有需要披露的竞争利益。
致谢
这项研究是在没有任何公共、商业或非营利资助机构的任何财政支持的情况下进行的。作者感谢印度昌迪加尔的 CSIR-Central Scientific Instruments Organisation 提供的基础设施和支持。
材料
| Name | Company | Catalog Number | Comments |
| Agarose | Sigma-Aldrich | 9012-36-6 | Base matrix for phantoms |
| Deionized (DI) water (18.2 MΩ) | NA | NA | Solvent for the preparation of phantom solutions |
| Gold nanorods (AuNRs) | Nanopartz | A12-10-808 | Plasmonic nanoparticles |
| Intralipid (20% emulsion stock) | Sigma-Aldrich | 68890-65-3 | Scattering agent of phantoms |
| Parafilm | Parafilm M | 380020 | To seal the bottom of cylindrical mold |
| Polylactic acid filament | eSun | NA | Material for molds (1.75 mm dia wire) |
| Name of Equipment | Company | Catalog Number | Comments/Description |
| 3D Printer | Creality | Ender-3 | For printing molds |
| Data acquisition (DAQ) system | National Instruments | cDAQ-9171 | For recording temperatures |
| DI water unit | Merck Millipore | Direct-Q3 | For DI water |
| Hot plate with magnetic stirrer | IKA | C-MAG HS 4 | For phantom solutions preparation |
| NIR light source | NA (In-house developed) | NA | For NIR irradiation of phantoms, (800/50 nm; Center wavelength: 800 nm, Bandwidth: 50 nm) |
| Optical Fiber (1/2" × 12") | Edmund Optics | 38-659 | For NIR irradiation of phantoms |
| Type K thermocouples | RS Components | RS Pro 397-1589 | For temperature monitoring at various phantom locations during NIR irradiation |
| Weighing Balance | Wensar | PGB 200 | For weighing agarose |
| Name of Software | Company | Catalog Number | Comments/Description |
| Autodesk Inventor 2021 | Autodesk | NA | For mechanical designing of molds |
| Cura 5.7 | Ultimaker | NA | For converting mechanical design to Gcode for 3D printing |
| Matlab R2024b | MathWorks | NA | For numerical simulations and temperature data plots |
| Name of Labwares used | Company | Catalog Number | Comments/Description |
| Beakers (50 mL) | Borosil | 1000D12 | For phantom solution preparations |
| Beakers (10 mL) | Borosil | 1000006 | For phantom solution preparations |
| Pipette (100-1000 µL) | Eppendorf Research plus, 1-channel, variable | 3123 000 063 | For adding constituents into the phantom solution |
| Pipette (10-100 µL) | Eppendorf Research plus, 1-channel, variable | 3123 000 047 | For adding constituents into the phantom solution |
| Spatula | Borosil | LASC8888M06 | For weighing agarose and demolding the phantoms from the molds |
| Tips (100-1000 µL) | Tarsons | 521016 | For adding constituents into the phantom solution |
| Tips (10-100 µL) | Tarsons | 521010Y | For adding constituents into the phantom solution |
参考文献
- Riley, R. S., Day, E. S. Gold nanoparticle-mediated photothermal therapy: applications and opportunities for multimodal cancer treatment. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 9 (4), e1449 (2017).
- Webb, J. A., Bardhan, R. Emerging advances in nanomedicine with engineered gold nanostructures. Nanoscale. 6 (5), 2502-2530 (2014).
- Abadeer, N. S., Murphy, C. J. Recent progress in cancer thermal therapy using gold nanoparticles. J Phys Chem C. 120 (9), 4691-4716 (2016).
- Murphy, C. J., et al. Virus-sized gold nanorods: Plasmonic particles for biology. Acc Chem Res. 52 (8), 2124-2135 (2019).
- Overchuk, M., Weersink, R. A., Wilson, B. C., Zheng, G. Photodynamic and photothermal therapies: Synergy opportunities for nanomedicine. ACS Nano. 17 (9), 7979-8003 (2023).
- Goldberg, S. N., Gazelle, G. S., Mueller, P. R. Thermal ablation therapy for focal malignancy. Am J Roentgenol. 174 (2), 323-331 (2000).
- Soni, S., Tyagi, H., Taylor, R. A., Kumar, A. Role of optical coefficients and healthy tissue-sparing characteristics in gold nanorod-assisted thermal therapy. Int J Hyperth. 29 (1), 87-97 (2013).
- Khurana, D., Vikas, A. K., Shaw, S., Soni, Polydopamine coated gold nano blackbodies for tumor-selective spatial thermal damage during plasmonic photothermal cancer therapy. IEEE Trans Nanobiosci. 21 (4), 482-489 (2021).
- Jung, H. S., Verwilst, P., Sharma, A., Shin, J., Sessler, J. L., Kim, J. S. Organic molecule-based photothermal agents: an expanding photothermal therapy universe. Chem Soc Rev. 47 (7), 2280-2297 (2018).
- Ge, R. L., Yan, P. N., Liu, Y., Li, Z. S., Shen, S. Q., Yu, Y. Recent advances and clinical potential of near infrared photothermal conversion materials for photothermal hepatocellular carcinoma therapy. Adv Func Mater. 33 (29), 2301138 (2023).
- Shabani, L., et al. An investigation into green synthesis of Ru template gold nanoparticles and the in vitro photothermal effect on the MCF-7 human breast cancer cell line. Appl Phys A. 129 (8), 564 (2023).
- Mosleh-Shirazi, S., et al. Investigation through the anticancer properties of green synthesized spinel ferrite nanoparticles in present and absent of laser photothermal effect. Ceram Int. 49 (7), 11293-11301 (2023).
- Amani, A. M., et al. Innovation applications of MXenes in biomedicine. Mater Today Commun. 40, 109929 (2024).
- Ali, M. R. K., Wu, Y., El-Sayed, M. A. Gold-nanoparticle-assisted plasmonic photothermal therapy advances toward clinical application. J Phys Chem C. 123 (25), 15375-15393 (2019).
- Lahonian, M., Golneshan, A. A. Numerical study of temperature distribution in a spherical tissue in magnetic fluid hyperthermia using Lattice Boltzmann method. IEEE Trans NanoBiosci. 10 (4), 262-268 (2011).
- Shaw, A. K., Soni, S. Role of periodic irradiation and incident beam radius for plasmonic photothermal therapy of subsurface tumors. J Therm Biol. 121, 103859 (2024).
- Pogue, B. W., Patterson, M. S. Review of tissue simulating phantoms for optical spectroscopy, imaging and dosimetry. J Biomed Opt. 11 (4), 041102 (2006).
- Mustari, A., et al. Agarose-based tissue mimicking optical phantoms for diffuse reflectance spectroscopy. J Vis Exp. (138), e57578 (2018).
- Dabbagh, A., Abdullah, B. J. J., Ramasindarum, C., Abu Kasim, N. H. Tissue-mimicking gel phantoms for thermal therapy studies. Ultrason imaging. 36 (4), 291-316 (2014).
- Khurana, D., et al. Experimental investigation of photothermal conversion and thermal conductivity of broadband absorbing gold nanoblackbodies and graphene oxide nanoparticles for plasmonic photothermal cancer therapy. Int Commun Heat Mass Transf. 156, 107597 (2024).
- Ortega-Palacios, R., Leija, L., Vera, A., Cepeda, M. F. J. Measurement of breast-tumor phantom dielectric properties for microwave breast cancer treatment evaluation. , 216-219 (2010).
- Wagnières, G., et al. An optical phantom with tissue-like properties in the visible for use in PDT and fluorescence spectroscopy. Phys Med Biol. 42 (7), 1415 (1997).
- Didychuk, C. L., Ephrat, P., Chamson-Reig, A., Jacques, S. L., Carson, J. J. L. Depth of photothermal conversion of gold nanorods embedded in a tissue-like phantom. Nanotechnology. 20 (19), 195102 (2009).
- Shaw, A. K., Khurana, D., Soni, S. Thermal damage analysis of sub-surface soft tissue sarcoma for Indocyanine Green mediated photothermal cancer therapy. Therm Sci Eng Prog. 46, 102168 (2023).
- Shaw, A. K., Khurana, D., Soni, S. Assessment of thermal damage for plasmonic photothermal therapy of subsurface tumors. Phys Eng Sci Med. 47 (3), 1107-1121 (2024).
- Khurana, D., Soni, S. Tissue-mimicking phantoms for photothermal performance evaluations. Recent Trends in Cancer Therapeutics: Plasmonic Photothermal-Based Multimodal Cancer Therapy. , 109-136 (2024).
- Eranki, A., et al. Tissue-mimicking thermochromic phantom for characterization of HIFU devices and applications. Int J Hyperth. 36 (1), 517-528 (2019).
- McLaughlan, J. R. Controllable nucleation of cavitation from plasmonic gold nanoparticles for enhancing high intensity focused ultrasound applications. J Vis Exp. (140), e58045 (2018).
- Soni, S., Tyagi, H., Taylor, R. A., Kumar, A. Experimental and numerical investigation of heat confinement during nanoparticle-assisted thermal therapy. Int Commun Heat Mass Transf. 69, 11-17 (2015).
- Ntombela, L., Adeleye, B., Chetty, N. Low-cost fabrication of optical tissue phantoms for use in biomedical imaging. Heliyon. 6 (3), e03602 (2020).
- Lai, P., Xu, X., Wang, L. V. Dependence of optical scattering from Intralipid in gelatin-gel based tissue-mimicking phantoms on mixing temperature and time. J Biomed Opt. 19 (3), 035002 (2014).
- Aernouts, B., Van Beers, R., Watté, R., Lammertyn, J., Saeys, W. Dependent scattering in Intralipid®phantoms in the 600-1850 nm range. Opt Express. 22 (5), 6086-6098 (2014).
- Tromberg, B. J., et al. Non-invasive in vivo characterization of breast tumors using photon migration spectroscopy. Neoplasia. 2 (1-2), 26-40 (2000).
- Kanick, S. C., et al. Scattering phase function spectrum makes reflectance spectrum measured from Intralipid phantoms and tissue sensitive to the device detection geometry. Biomed Opt Express. 3 (5), 1086-1100 (2012).
- Yuan, B., Chen, N., Zhu, Q. Emission and absorption properties of indocyanine green in Intralipid solution. J Biomed Opt. 9 (3), 497-503 (2004).
- Khurana, D., et al. Gold nanoblackbodies-based multifunctional nanocomposite for multimodal cancer therapy. Int J Pharm. 642, 123112 (2023).
- Brough, D., Ramos, J., Delpech, B., Jouhara, H. Development and validation of a TRNSYS type to simulate heat pipe heat exchangers in transient applications of waste heat recovery. Int J Thermofluid. 9, 100056 (2021).
- Vardaki, M. Z., Kourkoumelis, N. Tissue phantoms for biomedical applications in Raman spectroscopy: A review. Biomed Eng Computational Biol. 11, 1179597220948100 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。