Method Article
Plasmonische photothermische Krebstherapie: Nanopartikel-eingebettete Tumorgewebe-imitierende Phantome zur Visualisierung der photothermischen Temperaturverteilung
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
In diesem Artikel wird das Protokoll zur Herstellung von Tumor-Gewebe-Phantomen vorgestellt, die optische Eigenschaften für die plasmonische photothermische Therapie replizieren. Es beschreibt die Phantompräparation, photothermische Bewertungen und die Validierung des entwickelten numerischen Modells auf der Grundlage photothermischer Temperaturmessungen zur Bewertung therapeutischer Parameter und bietet eine ethische, kostengünstige Alternative zu In-vivo-Studien für Vortests.
Zusammenfassung
Bei der plasmonischen photothermischen Therapie (PPTT), einer aufkommenden Krebsbehandlung, werden Nanopartikel (NPs) an einen Tumor abgegeben, gefolgt von Nahinfrarotbestrahlung (NIR), um lokale Wärme zu erzeugen, die Krebszellen zerstört. Vor der Verabreichung von PPTT müssen die therapeutischen Parameter -- NP-Konzentration, Bestrahlungsintensität und -dauer -- abgeschätzt werden. Dazu werden numerische Simulationen durchgeführt. Um jedoch eine robuste Berechnung zu gewährleisten, müssen diese Simulationen durch photothermische Experimente an Tumorgewebe nachahmenden Phantomen validiert werden, die die optischen Eigenschaften von Tumorgewebe nachahmen. Bei der PPTT werden die therapeutischen Parameter durch die Streuung und Absorption der einfallenden Strahlung durch das Gewebe und die NPs bestimmt. Daher können Validierungsexperimente an Phantomen durchgeführt werden, die den reduzierten Streukoeffizienten (μs') und Absorptionskoeffizienten (μa) des Zieltumors/-gewebes nachahmen.
Insbesondere enthält dieses Protokoll Anweisungen für die Herstellung von Phantomen, die μ s ' und μa von Brusttumoren nachahmen, die mit Goldnanostäbchen injiziert wurden und von normalem Brustgewebe umgeben sind. Das Protokoll beschreibt auch die NIR-Bestrahlung, die Temperaturüberwachung und die Validierung numerischer Ergebnisse durch den Vergleich von raumzeitlichen Temperaturen mit denen, die mit Thermoelementen gemessen werden. Die in dieser Studie vorgestellten Protokolle ermöglichten die Herstellung von Hydrogel-basierten zylindrischen Brusttumor-Gewebe-Phantomen mit Abmessungen (φ40 x 12 mm) und einer zentralen Tumorregion (φ20 x 6 mm), bestehend aus 1% Agarose als Basismatrix und Intralipid als Streubestandteil und Tumorregion, die mit Goldnanostäbchen bei einer Konzentration von 25 μg/ml eingebettet ist. Repräsentative Ergebnisse einer Fallstudie veranschaulichen die Anwendung von fabrizierten Phantomen zur Validierung numerischer Simulationen für PPTT. Die Studie kommt zu dem Schluss, dass die demonstrierten Protokolle wertvoll für die Durchführung photothermischer Experimente sind, die darauf abzielen, therapeutische Parameter vor in vivo-Experimenten zu optimieren und zu planen und numerische Simulationen für PPTT zu validieren.
Einleitung
Die plasmonische photothermische Therapie (PPTT) ist eine aufstrebende lokalisierte Krebsbehandlungsmethode, bei der Nanopartikel (NPs) an die Tumorstelle abgegeben werden, gefolgt von einer Bestrahlung mit Nahinfrarotstrahlung (NIR). Die NPs werden in der Regel über intratumorale (IT) oder intravenöse (IV) Wege verabreicht1. Bei NIR-Bestrahlung führt die plasmonische Wechselwirkung der einfallenden Strahlung und der NPs zur Erzeugung von lokalisierter Wärme an der Oberfläche der NPs, die sich dann in das umgebende Tumorgewebe auflöst 2,3. Diese lokale Erwärmung erhöht die Temperatur in der Tumorregion, was zum Absterben der Krebszellen durch thermische Ablation führt 4,5. Eine wirksame Krebsbehandlung kann durch verschiedene biologische Prozesse erreicht werden, z. B. 46 ºC für 1 h6, 50-52 ºC für 4-6 min7 oder 60 ºC für sofortige Schäden8 durch verschiedene biologische Prozesse.
Verschiedene photothermische Wirkstoffe wurden für die Anwendung der photothermischen Therapie erforscht und berichtet, und ihre therapeutische Wirksamkeit wurde durch In-vitro - oder In-vivo-Studien bewertet. Zu diesen Mitteln gehören organische Materialien9 , wie z. B. Nahinfrarot-Farbstoffe (z. B. Indocyaningrün, IR780, IR820), photothermische Mittel auf Polymerbasis (z. B. Polydopamin) und anorganische Materialien10, einschließlich Edelmetall-basierter NPs oder plasmonischer NPs (z. B. Gold-NPs)11, Übergangsmetallschwefel/-oxide12 und MXene13. Unter diesen bieten plasmonische NPs, insbesondere Gold-NPs, mehrere Vorteile gegenüber herkömmlichen photothermischen Mitteln (z. B. Farbstoffen), wie z. B. eine bessere photothermische Stabilität, einen höheren photothermischen Umwandlungswirkungsgrad und eine einstellbare plasmonische Reaktion durch Form- und Größenvariationen10. Diese Eigenschaften machen Gold-NPs zu idealen Kandidaten für die photothermische Therapie, von denen einige derzeit klinische Studien durchlaufen14.
Um die therapeutische Wirksamkeit zu optimieren und eine ausreichende thermische Schädigung des Tumors während der PPTT zu gewährleisten, ist es wichtig, Behandlungsparameter wie die NP-Dosis (in Bezug auf die Konzentration) und die NIR-Strahlungsparameter (einschließlich Bestrahlungsintensität und -dauer) vor der präklinischen/klinischen Anwendung der PPTT abzuschätzen. Um diese Parameter zu ermitteln, werden in der Regel numerische Simulationen eingesetzt. Es wurden verschiedene numerische Methoden entwickelt, um thermische Schäden innerhalb von Tumorgewebe zu beurteilen, wobei die Gitter-Boltzmann-Methode ein solcher Ansatz ist15,16. Damit diese Simulationen jedoch zuverlässig sind, müssen sie mit Hilfe von Gewebeanaloga validiert werden, die als gewebeähnliche Phantome bekannt sind. Diese Phantome können so präpariert werden, dass sie die optischen, thermischen, biologischen oder mechanischen Eigenschaften von echten Geweben replizieren und als Ersatz für die Durchführung von Vortests, Behandlungsbewertungen und Validierungen von neu entwickelten Geräten, Materialien oder Methoden dienen, die für biologische Anwendungen bestimmt sind17,18. Dies kann unnötiges Leiden von Tieren oder Menschen verringern und ethische Bedenken ausräumen, die mit solchen Versuchen verbunden sind19,20.
Die Konstruktion und Herstellung eines Phantoms hängt von der beabsichtigten Anwendungab 21. Bei Phototherapien wie PPTT wird beispielsweise die Dosis der einfallenden Strahlung durch die Menge an Licht beeinflusst, die von den NPs und Geweben absorbiert oder gestreut wird22,23. Daher werden optische Phantome, die die optischen Eigenschaften, insbesondere den reduzierten Streukoeffizienten (μs') und den Absorptionskoeffizienten (μa) biologischer Gewebe, nachahmen, für PPTT-Auswertungen und die anschließende Validierung numerischer Simulationen verwendet24,25. Optische Phantome bestehen typischerweise aus drei Hauptbestandteilen: einer Basenmatrix, Streumitteln und Absorptionsmitteln17,26. Die Basismatrix hält die Streu- und Absorptionskomponenten in geeigneten Konzentrationen, um die gewünschten optischen Eigenschaften zu replizieren. Diese Phantome können je nach Art der Basismatrix in feste, flüssige und halbfeste (Hydrogel) Phantome eingeteilt werden. Für thermisch-therapeutische Studien wie PPTT werden Hydrogel-Phantome, insbesondere Agarose-basierte Phantome, aufgrund ihrer Biokompatibilität, ihrer vernachlässigbaren inhärenten Streuung und Absorption, des einfachen Herstellungsprozesses und der Flexibilität, in die gewünschten Formen und Größen gegossen zu werden, die den Tumorgeometrien entsprechen, bevorzugt19,22. Am wichtigsten ist, dass die vorbereiteten Phantome auf Agarosebasis bis zu ~70-80 ºC Bulk-Temperaturen verwendet werden können, da die Schmelztemperatur von Agarose-Phantomen ~80 ºC19 beträgt. Da für PPTT ein Temperaturbereich von ~50-80 ºC ausreichend ist, können solche Agarose-basierten Phantome für PPTT-basierte photothermische Auswertungen verwendet werden.
Verschiedene Hydrogel-basierte gewebeähnliche Phantome wurden für verschiedene Anwendungen entwickelt und berichtet. Mustari et al. entwickelten Agarose-basierte gewebeähnliche Phantome und demonstrierten deren Nutzen bei der Validierung eines neu entwickelten optischen Systems18. In einer anderen Studie wurden gewebeähnliche thermochrome Phantome hergestellt, um das Ausmaß der thermischen Schädigung während der hochintensiven fokussierten Ultraschalltherapie (HIFU) zu messen27. Polyacrylamid-basierte gewebeähnliche Phantome wurden auch hergestellt, um den Kavitationseffekt während der HIFU-basierten Krebstherapie zu analysieren28. Das Ziel dieser Studie ist es, eine Schritt-für-Schritt-Methode zur Herstellung von Tumorgewebe-ähnlichen Phantomen zusammen mit dem Protokoll für phantombasierte photothermische Experimente für PPTT-Auswertungen zu demonstrieren. Dieses vorgeschlagene detaillierte Protokoll zielt darauf ab, die Akzeptanz und Reproduzierbarkeit der Phantompräparation und der nachfolgenden phantombasierten photothermischen Experimentiermethoden zum Testen der photothermischen Leistung neu entwickelter Nanostrukturen zu fördern, wodurch die numerischen Simulationen validiert und die Vorbehandlungsplanung oder Optimierung der therapeutischen Parameter von PPTT unterstützt werden. In diesem Artikel wird ein Phantompräparationsprotokoll beschrieben, das speziell für Brusttumoren unter der Oberfläche entwickelt wurde. Die gleichen Schritte können jedoch für die Herstellung verschiedener Tumorgewebetypen (unterschiedlicher Formen und Größen) angepasst werden, indem die Zusammensetzung der optischen Absorptions- und Streumittel verändert wird. Als Beispiel wurden die demonstrierten phantombasierten photothermischen Auswertungen in zuvor berichteten Studien eingesetzt, um PPTT-Simulationen für Unterarmtumoren24, IDC25 unter der Oberfläche und Hauttumoren29 zu validieren.
Diese Arbeit beschreibt die Präparationsschritte eines optischen Phantoms, das die μs eines suboberflächen- oder subkutanen Brusttumors nachahmt, insbesondere des invasiven duktalen Karzinoms (IDC), das sich 3 mm unter der Hautoberfläche befindet und von normalem Brustgewebe umgeben ist. Das Phantom ist von zylindrischer Geometrie und wird unter Verwendung von Agarose als Basismatrix und Intralipid (IL) als Streumittel hergestellt, das in geeigneten Konzentrationen zugesetzt wird, um μs von normalem und krebsartigem Brustgewebe nachzuahmen. Agarose, ein transparentes Hydrogel mit vernachlässigbarer Streuung und Absorption, ist eine ideale Basismatrix für optische Phantome18,30. Darüber hinaus wird IL, eine 20%ige Fettemulsion, die die Doppelschichtstruktur von Zellmembranen nachahmt, häufig als Streumittelverwendet 31,32 und wurde für diese Studie ausgewählt, um die μs von normalem und krebsartigem Brustgewebe zu replizieren. Das Phantom ist so konzipiert, dass es Brusttumore (IDC) nachahmt, die mit Goldnanostäbchen (AuNRs) als plasmonische NPs injiziert wurden, umgeben von normalem Brustgewebe ohne AuNRs. Unter den verschiedenen Gold-NPs, die in PPTT verwendet werden, wurden AuNRs aufgrund ihrer starken plasmonischen Reaktion im NIR-Bereich und ihrer weit verbreiteten Verwendung in präklinischen PPTT-Studien, einschließlich solcher mit Hunde- und Katzenpatienten, für diese Studie ausgewählt14. Das Protokoll demonstriert die Präparation von zwei Arten von Phantomen: eines mit einem Tumor mit AuNR-Verteilung, wie sie bei der IV-Injektion zu sehen ist, und der andere mit einem Tumor, der die AuNR-Verteilung widerspiegelt, die durch IT-Injektion erreicht wurde. Im Anschluss an das Phantompräparationsprotokoll werden der Versuchsaufbau für die NIR-Bestrahlung und die Schritte zur Durchführung photothermischer Auswertungen an den Phantomen beschrieben. Abschließend wird eine Schritt-für-Schritt-Anleitung zur Interpretation der aus diesen Auswertungen gewonnenen Temperaturverteilungsergebnisse und zum Vergleich der experimentellen Daten mit numerischen Simulationsergebnissen gegeben. Dieser Vergleich hilft bei der Validierung einer entwickelten numerischen Methode, die es ermöglicht, optimale Behandlungsparameter zu finden, die speziell auf einen Tumor zugeschnitten sind.
Protokoll
HINWEIS: Die Phantome wurden unter Verwendung von Agarose und Intralipid auf der Grundlage von in der Literatur berichteten Zusammensetzungen hergestellt, um die gewünschten optischen Eigenschaften zu erzielen. Es wurde kein echtes biologisches Gewebe von Patienten oder Leichen verwendet. Daher ist die Herstellung dieser Phantome frei von ethischen Zwängen und erfordert keine informierte Einwilligung.
1. Auswahl bzw. Herstellung einer geeigneten Form
- . Auswahl eines geeigneten Werkzeugs
- Wählen Sie eine Form, die der gewünschten Form und den gewünschten Abmessungen für die Phantome entspricht. Bei zylindrischen Phantomen mit einer Tumorregion, die gleichmäßig mit NPs verteilt und von normalem Gewebe umgeben ist, verwenden Sie eine Petrischale aus Glas und ein kleines Becherglas als Form8 (Abbildung 1A).
HINWEIS: Diese Schritte dienen zur Herstellung von Tumorgewebe-ähnlichen Phantomen in zylindrischer Geometrie. Wählen Sie für andere Formen oder Größen eine geeignete Form aus. Wenn keine geeignete Form verfügbar ist, stellen Sie eine im dreidimensionalen (3D) Druck her, wie in Schritt 1.2 beschrieben.
- Wählen Sie eine Form, die der gewünschten Form und den gewünschten Abmessungen für die Phantome entspricht. Bei zylindrischen Phantomen mit einer Tumorregion, die gleichmäßig mit NPs verteilt und von normalem Gewebe umgeben ist, verwenden Sie eine Petrischale aus Glas und ein kleines Becherglas als Form8 (Abbildung 1A).
- Herstellung von Formen durch 3D-Druck
- Entwerfen Sie ein 3D-Modell mit CAD-Software (Computer-Aided Design) (z. B. SolidWorks, Autodesk Inventor oder CATIA) entsprechend der gewünschten Form und Größe. Um diesem Protokoll zu folgen, entwerfen Sie einen Hohlzylinder (Innendurchmesser 40 mm, Dicke 2 mm und Höhe 12 mm; siehe Zusatzdatei 1) und zwei massive zylindrische Abdeckformen (Abmessungen φ20 x 6 mm und φ14 x 3 mm), wie in Abbildung 1B gezeigt.
- Für die Konstruktion/Zeichnung von Hohlzylindern erstellen Sie in der CAD-Software zwei Kreise mit Durchmessern von 40 mm und 44 mm. Extrudieren Sie dann die Geometrie für 12 mm.
- Erstellen Sie für feste zylindrische Maskierungsformen Kreise mit den Durchmessern 20 mm und 14 mm und extrudieren Sie dann für 6 mm bzw. 3 mm (siehe Ergänzende Datei 2 und Ergänzende Datei 3). Zeichnen Sie ein Rechteck (Seiten 44 mm und 5 mm) auf einer Seite des Zylinders und extrudieren Sie es um 2 mm.
- Konvertieren Sie die 3D-Modelle mit einer 3D-Drucker-kompatiblen Software (z. B. Cura) in das Gcode-Format für den Druck.
- Verwenden Sie diesen Gcode, um die Formen (z. B. hierin unter Verwendung von Polymilchsäure [PLA] φ1,75 mm, 1 kg eSun) unter Verwendung eines 3D-Druckers zu drucken.
HINWEIS: Das Rechteck wird gezeichnet, um die Maskierungsformen aufzuhängen. Es können verschiedene Formen entworfen und hergestellt werden, um Phantome mit anderen gewünschten Formen herzustellen.
- Entwerfen Sie ein 3D-Modell mit CAD-Software (Computer-Aided Design) (z. B. SolidWorks, Autodesk Inventor oder CATIA) entsprechend der gewünschten Form und Größe. Um diesem Protokoll zu folgen, entwerfen Sie einen Hohlzylinder (Innendurchmesser 40 mm, Dicke 2 mm und Höhe 12 mm; siehe Zusatzdatei 1) und zwei massive zylindrische Abdeckformen (Abmessungen φ20 x 6 mm und φ14 x 3 mm), wie in Abbildung 1B gezeigt.
2. Herstellung von Tumorgewebe imitierenden Phantomlösungen25
HINWEIS: In dieser Studie wurden Agarose-basierte optische Phantome mit zylindrischer Geometrie, die Tumorgewebe nachahmen, so präpariert, dass sie einem Brusttumor unter der Oberfläche ähneln, der mittels IT- oder IV-Injektion mit AuNRs injiziert wurde, wie in Abbildung 2 gezeigt. Das IT-Phantom besteht aus zwei Regionen: einer zentralen Tumorregion mit AuNRs und einer umgebenden Region des Normalgewebes. Das IV-Phantom besteht aus drei Regionen: einer Tumorregion mit AuNRs an der Tumorperipherie, einer zentralen nackten Tumorregion ohne AuNRs und einer umgebenden Normalgewebsregion. Da sich die optischen Eigenschaften (μa und μs') für Tumor- und Normalgewebe unterscheiden, werden für jede Region mit unterschiedlicher Zusammensetzung separate Phantomlösungen hergestellt, die gesondert besprochen werden.
- Herstellung einer Phantomlösung, die normales Brustgewebe nachahmt (Lösung 1)
HINWEIS: Diese Lösung wird sowohl für IT- als auch für IV-Phantome verwendet. Die Vorbereitungsschritte von Lösung 1 sind in Abbildung 3A dargestellt.- Berechnen Sie das theoretische Volumen der Lösung basierend auf den Abmessungen der Form.
HINWEIS: Hier beträgt das berechnete Volumen für die zylindrische Form von φ40 x 12 mm 15 cm3 oder 15 mL pro Phantom. Da zwei solcher Phantome vorbereitet werden müssen, beträgt das Gesamtvolumen 15 mL x 2, was 30 mL entspricht. Bereiten Sie daher 35 ml der Lösung vor, um Verdunstung oder Verschüttung während des Phantomvorbereitungsschritts zu berücksichtigen. - Berechnen Sie die Menge (Gewicht/Konzentration/Volumen) aller Phantombestandteile - Agarose (als Ausgangsmaterial) und IL (als Streubestandteil) -, die der 35-ml-Lösung zugesetzt werden sollen.
- Fügen Sie 0,35 g Agarose hinzu, um 35 ml Lösung herzustellen, die einer Konzentration von 1 % w/v entspricht.
- Schätzen Sie die IL-Konzentration, die den gewünschten μs normalem Brustgewebe (d. h. 10,1 cm-1 33) entspricht, basierend auf der IL-Konzentration im Vergleich zu μ in der Literatur verfügbaren Daten. Berechnen Sie als Nächstes das Volumen von IL (20 % Emulsionsmaterial), das der Phantomlösung mit Hilfe von Gleichung (1) zugesetzt werden soll:
 (1)
(1)
Dabei sind C1 und V1 die Konzentration des Reagenzbestands (hier 20 % IL-Stamm) bzw. das Volumen der zuzugebenden Reagenzstammlösung (hier ist es zu berechnen). C2 ist die erforderliche Konzentration des Reagenzes (aus der Literatur zu erhalten) in der endgültigen Arbeitslösung, und V2 ist das Gesamtvolumen der endgültigen Arbeitslösung (hier 35 ml).
HINWEIS: Hier beträgt die aus der Literatur geschätzte IL-Konzentration für μs' von 10,1 cm-1 1,04%34,35. Mit den obigen Schritten beträgt das Volumen von IL (20% IL-Bestand), das hinzugefügt werden soll, 1,82 ml.
- Wiegen Sie 0,35 g Agarose und geben Sie sie zu 33,18 ml deionisiertem (DI) Wasser in einem Becherglas. Decken Sie den Becher mit Alufolie ab, um Wasserverlust zu vermeiden.
- Das Becherglas mit der Lösung auf einer heißen Platte auf einer heißen Platte bei 120 °C unter Rühren erhitzen, bis die Lösung durchsichtig wird.
- Senken Sie die Temperatur der Heizplatte auf 60 ºC. Nach 15 Minuten 1,82 mL IL unter Rühren hinzufügen. Die resultierende Lösung, Lösung 1, bis zur Verwendung (ausgießbereit) bei 60 ºC unter Rühren aufbewahren.
HINWEIS: Die Phantomlösung bei 60 ºC muss unter Rührbedingungen aufbewahrt werden. Andernfalls führt es zur Verfestigung der Lösung.
- Berechnen Sie das theoretische Volumen der Lösung basierend auf den Abmessungen der Form.
- Herstellung von AuNR-eingebetteter Tumorphantomlösung (Lösung 2)
HINWEIS: Diese Lösung wird sowohl für IT- als auch für IV-Phantome verwendet. Die Vorbereitungsschritte von Lösung 2 sind in Abbildung 3B dargestellt.- Berechnen Sie das Volumen der zu füllenden Tumorregion (φ20 x 6 mm).
HINWEIS: Das ungefähre Volumen für zwei solcher Tumorphantome beträgt 3,8 ml. Das zu präparierende Lösungsvolumen beträgt also 4,5 ml. - Berechnen Sie die Menge der hinzuzufügenden Tumorphantomkomponenten - Agarose, IL und AuNRs - unter Verwendung ähnlicher Schritte wie in Abschnitt 2.1 beschrieben.
- Fügen Sie 45 mg hinzu, um 4,5 ml Lösung herzustellen, was einer Konzentration von 1 % w/v entspricht.
- IL:μs' des Brusttumors beträgt 4,6 cm-1 33 und um dies nachzuahmen, beträgt die entsprechende IL-Konzentration 0,472%34,35. Fügen Sie daher 106,2 μl IL aus 20 % IL-Stamm zu 4,5 mL Tumorphantomlösung hinzu.
- Die gewünschte Konzentration von AuNRs im Phantom beträgt 25 μg/ml. Um dasselbe zu erreichen, geben Sie 3,21 mL AuNRs-Lösung (Stammkonzentration: 35 μg/mL) in die Tumorphantomlösung.
- Geben Sie 45 mg Agarose zu 1,18 mL DI-Wasser in ein Becherglas und decken Sie es mit einer Alufolie ab.
- Stellen Sie das Becherglas auf eine heiße Platte und rühren Sie bei 120 °C, bis die Lösung transparent wird.
- Reduzieren Sie die Temperatur der Heizplatte auf 60 ºC und lassen Sie die Lösung 15 Minuten einwirken.
- 106,2 μl IL und 3,21 mL AuNR-Suspension (35 μg/ml) unter Rührbedingungen zugeben. Lassen Sie die resultierende Lösung, Lösung 2, bis zum Ausgießen bei 60 ºC unter Rühren.
- Berechnen Sie das Volumen der zu füllenden Tumorregion (φ20 x 6 mm).
- Präparation einer Phantomlösung für den nackten Tumor (ohne AuNRs) (Lösung 3)
HINWEIS: Diese Lösung wird nur für IV-Phantome verwendet. Die Vorbereitungsschritte von Lösung 2 sind in Abbildung 3C dargestellt.- Berechnen Sie das theoretische Volumen der Suspension, die hinzugefügt werden soll, um eine nackte Tumorregion zu erzeugen (~ φ20 x 6 mm).
HINWEIS: Das ungefähre Volumen für Tumorphantome beträgt 1,9 ml. Das zu präparierende Lösungsvolumen beträgt also 2,5 ml. - Berechnen Sie die Menge der zuzugebenden Tumorphantombestandteile - Agarose und IL - unter Verwendung ähnlicher Schritte wie in Abschnitt 2.1 beschrieben.
- Fügen Sie 25 mg Agarose hinzu, um 2,5 ml Lösung herzustellen, um eine Konzentration von 1 % w/v zu erreichen.
- IL:μs' des Brusttumors beträgt 4,6 cm-1 33 und um dies nachzuahmen, beträgt die entsprechende IL-Konzentration 0,472%34,35. 59 μl 20 % IL-Stamm zugeben.
- Geben Sie 25 mg Agarose zu 2,44 mL DI-Wasser in ein Becherglas und decken Sie es mit einer Alufolie ab.
- Stellen Sie das Becherglas auf eine heiße Platte und rühren Sie bei 120 °C, bis die Lösung transparent wird.
- Reduzieren Sie die Temperatur der Heizplatte auf 60 ºC und lassen Sie die Lösung 15 Minuten einwirken.
- Geben Sie 59 μl IL unter Rühren in die Lösung. Die resultierende Lösung, Lösung 3, bis zum Ausgießen unter Rühren bei 60 ºC aufbewahren.
- Berechnen Sie das theoretische Volumen der Suspension, die hinzugefügt werden soll, um eine nackte Tumorregion zu erzeugen (~ φ20 x 6 mm).
3. Herstellung eines Tumorgewebe-imitierenden Phantoms 24,25,36
- Bereiten Sie die Formen für den Gießschritt vor. Versiegeln Sie dazu den Boden der zylindrischen Formen mit Parafilm und platzieren Sie die Abdeckform (φ20 x 6 mm) in der Mitte.
- Gießen Sie Lösung 1 bis zur oberen Markierung der Abdeckform in die zylindrischen Formen und lassen Sie sie erstarren (Abbildung 4A).
- Entfernen Sie nach der Erstarrung die Abdeckform, um einen Hohlraum für die Tumorregion zu schaffen (Abbildung 4B).
HINWEIS: Das Protokoll ist für IT- und IV-Phantome bis Schritt 3.3 identisch. Der Prozess wird für IT- und IV-Phantome nach Schritt 3.3 separat besprochen. - IT Phantom 24,25,36
- Füllen Sie den Hohlraum mit Lösung 2 und lassen Sie ihn erstarren (Abbildung 4C).
- Geben Sie Lösung 1 an die Oberseite des Phantoms und lassen Sie es vollständig erstarren (Abbildung 4D).
- IV Phantom24,25
- Setzen Sie eine kleinere Abdeckform (φ14 x 3 mm) ein und füllen Sie den Hohlraum um sie herum mit Lösung 2 (Abbildung 4E).
- Entfernen Sie nach dem Erstarren die kleinere Form und füllen Sie den verbleibenden Hohlraum mit Lösung 3 (Abbildung 4F).
- Geben Sie Lösung 1 nach oben und lassen Sie die vollständige Verfestigung zu (Abbildung 4G).
4. Einsetzen der Thermoelemente in das Phantom 24,25,36
HINWEIS: Zur Überwachung der räumlichen Temperaturverteilung werden Thermoelemente vom Typ K an verschiedenen radialen (r) und axialen (z) Positionen in das Phantom eingesetzt, wie in Abbildung 2 dargestellt. Für das Einsetzen von Thermoelementen an genauen Stellen werden Glaskapillaren als Führungen verwendet, um die Präzision zu gewährleisten. Die Thermoelementpositionen werden als (r, z) bezeichnet, wobei der Mittelpunkt auf der Oberseite des Tumors in der Tiefe z = 3 mm als Referenzpunkt sowohl für IT- als auch für IV-Phantome dient und als (0, 3) bezeichnet wird, wie in Abbildung 2A, B gezeigt. Bei der Auswahl radialer und axialer Lokalisationen zur Quantifizierung der thermischen Schädigung in der Tumorregion sind die Lokalisationen an der Tumorperipherie (sowohl radial als auch axial) entscheidend. Das Erreichen der erforderlichen Temperaturen an diesen peripheren Punkten während der NIR-Bestrahlung gewährleistet eine vollständige Tumorablation. Somit werden die Thermoelemente an radialen Extrempunkten (des Tumors) bei z = 3 und 9 mm, d. h. (10, 3) und (10, 9), platziert, und ein Thermoelement wird an der Tumor-Gewebe-Grenzfläche bei z = 9 mm (periphere axiale Lage), d. h. (0, 9), platziert, wie in Abbildung 2A, B dargestellt. Um die axiale Temperaturverteilung zu beurteilen, wird zusätzlich ein Thermoelement zwischen den Positionen (0, 3) und (0, 9) eingesetzt, das als (0, 6) bezeichnet wird. Um schließlich den Temperaturanstieg in der umgebenden gesunden Geweberegion zu beurteilen, wird ein Thermoelement bei (15, 3) eingesetzt.
- Schneiden Sie die Glaskapillaren auf geeignete Längen zu, so dass diese die gewünschten radialen und axialen Stellen innerhalb des Phantoms erreichen.
- Setzen Sie Thermoelemente in diese Glaskapillaren ein und punktieren Sie nacheinander an den angegebenen radialen und axialen Phantomstellen.
- Sobald alle Thermoelemente an Ort und Stelle sind, legen Sie das Phantom vorsichtig in eine Petrischale aus Glas für die anschließende NIR-Bestrahlung, wie in Abbildung 5A gezeigt.
5. Exposition gegenüber NIR-Strahlung und Messung der daraus resultierenden photothermischen Temperaturen36
- Platzieren Sie die Petrischale aus Glas, in der sich das Phantom befindet (mit Thermoelementen eingesetzt), so, dass der zentrale Bereich der Oberseite des Phantoms senkrecht zur Spitze der optischen Faser der NIR-Lichtquelle steht, wie in Abbildung 5A dargestellt.
HINWEIS: Der Strahldurchmesser auf der Phantomoberfläche kann durch Ändern des Abstands zwischen der Oberfläche und der Glasfaserspitze eingestellt werden. Dabei wird ein Abstand von 9 mm eingehalten, um einen Strahldurchmesser von 20 mm zu erreichen, der die zentrale Tumorregion abdeckt. - Schließen Sie das Datenerfassungssystem an den Computer an und öffnen Sie die LabVIEW-Software.
- Schalten Sie die NIR-Lichtquelle (Abbildung 5B) und die Play-Taste in der Software gleichzeitig ein, um Temperaturdaten zu Beginn der Bestrahlung aufzuzeichnen.
- Bestrahlen Sie das Phantom 20 Minuten lang, schalten Sie dann die NIR-Lichtquelle aus und stoppen Sie die Aufnahme.
- Plotten Sie die aufgezeichneten Temperatur- und Zeitdaten.
6. Temperaturvergleich mit Simulationsergebnissen24,25
HINWEIS: Experimente werden in der Regel wiederholt, und die Temperaturen werden in festgelegten Zeitintervallen an allen Thermoelementstandorten aufgezeichnet. Für die Validierung werden die folgenden Schritte ausgeführt:
- Berechnen Sie den Mittelwert und die Standardabweichung der experimentellen Temperaturen an allen Thermoelementpositionen (r, z).
- Berechnen Sie die Temperaturen an den betrachteten Thermoelementpositionen numerisch.
- Die aus den Experimenten erhaltene mittlere Temperatur und die durch Simulation erhaltene Temperatur an allen Thermoelementstandorten in Bezug auf die Zeit sind dargestellt, siehe Abbildung 6.
- Berechnen Sie den mittleren quadratischen Fehler (RMSE) und den mittleren absoluten Fehler (MAE) für alle Thermoelementstandorte, um den Temperaturunterschied zu quantifizieren und die Validierung zu bewerten, wie in Tabelle 1 gezeigt.
HINWEIS: MAE und RMSE werden anhand der Gleichungen 2 bzw. 3 berechnet.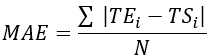 (2)
(2) (3)
(3)
Dabei sind TE, TS und N die experimentell ermittelte Temperatur, die numerisch berechnete Temperatur und die Anzahl der Datenpunkte (hier werden die Temperaturen jeweils 20 Minuten lang pro Sekunde aufgezeichnet; daher = 1.200). I steht für Zeit, Augenblicke.
Ergebnisse
Abbildung 6 zeigt die zeitlichen Mitteltemperaturen, die während Experimenten mit einem AuNR-eingebetteten Tumor-Gewebe-Phantom an allen Thermoelementstandorten erhalten wurden, wie in Abbildung 2 gezeigt, verglichen mit den Temperaturen, die während der Simulationen an entsprechenden Thermoelementstandorten erhalten wurden. Hier wurden die Experimente 4x für jede Verteilung, d.h. IT- und IV-Verteilungen von AuNRs, durchgeführt. Während der Experimente betrug die Raumtemperatur 25 ºC, so dass auch für die Simulation die Umgebungstemperatur bei 25 ºC gehalten wurde. Abbildung 6A zeigt einen Vergleich zwischen experimentellen Mitteltemperaturen und simulierten Temperaturen für die IT-Verteilung von AuNRs. Abbildung 6B zeigt einen Vergleich zwischen experimentellen Mitteltemperaturen und simulierten Temperaturen für die IV-Verteilung von AuNRs. Aus Abbildung 6A,B ist ersichtlich, dass die IV-Verteilung einen geringeren Temperaturanstieg aufweist als die IT-Verteilung. Dies ist auf die Tatsache zurückzuführen, dass die Streuung der einfallenden Strahlung aufgrund einer größeren, dickeren Schicht aus Streumedien (nacktes Gewebe + nackter Tumor) eher in der IV-Verteilung erfolgt, bevor die einfallende Strahlung vom AuNR-eingebetteten Tumor absorbiert wird.
Als nächstes zeigen die Temperaturdiagramme, dass während der Phantomexperimente der maximale Temperaturanstieg ~11 ºC und ~6 ºC an der (0, 3)-Thermoelementposition für die IT- bzw. IV-Verteilung betrug. Es ist zu beachten, dass das Gewebe unter 43 ºC 6,16 thermisch unbedenklich ist. Da die Körperkerntemperatur 37 ºC beträgt, führt ein Temperaturanstieg von >6 ºC im Allgemeinen zu thermischen Schäden im Tumorgewebe. Die Phantomexperimente mit 25 μg/mL AuNRs und 0,25 W/cm2 deuten darauf hin, dass die thermische Schädigung in beiden Fällen innerhalb von 3-4 mm in radialer und axialer Richtung des unterirdischen Tumors induziert wird und der Rest der Tumorregion unbeschädigt bleibt. Solche Protokolle können verwendet werden, um die Bestrahlungsintensität und die AuNR-Konzentration zu optimieren, um eine vollständige thermische Schädigung eines Tumors zu erreichen.
Des Weiteren gelten die simulierten Temperaturen als validiert, wenn der Fehler <15 % im Vergleich zu den experimentellen Temperaturenbeträgt 37. Zu diesem Zweck werden RMSE und MAE an allen Thermoelementstandorten für beide Fälle berechnet und in Tabelle 1 dargestellt. Eine maximale Abweichung von 2,10 ºC bzw. 1,94 ºC wird für die IT-Verteilung bzw. die IV-Verteilung erreicht, was Fehlern von 5,88 % und 6,09 % in Bezug auf die simulierte Temperatur entspricht. Daraus kann geschlossen werden, dass die experimentellen und simulierten Ergebnisse in gutem Vergleich zueinander stehen.
Zusammenfassend kommt die Studie zu dem Schluss, dass die Protokolle für die Phantompräparation und die anschließenden phantombasierten photothermischen Experimente, die hier gezeigt werden, dazu beitragen, numerische Simulationen zu validieren und die Robustheit der abgeleiteten therapeutischen Parameter für nachfolgende in vivo-Anwendungen von PPTT sicherzustellen.

Abbildung 1: Formen zur Herstellung von Agarose-basierten Tumorgewebe-imitierenden Phantomen. (A) Petrischale und Becherglas aus Glas, die als Formen zur Herstellung zylindrischer Tumorgewebsphantome verwendet werden. (B) 3D-gedruckte zylindrische Formen und Maskierungsformen, die für die Vorbereitung zylindrischer Tumorgewebephantome entwickelt wurden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
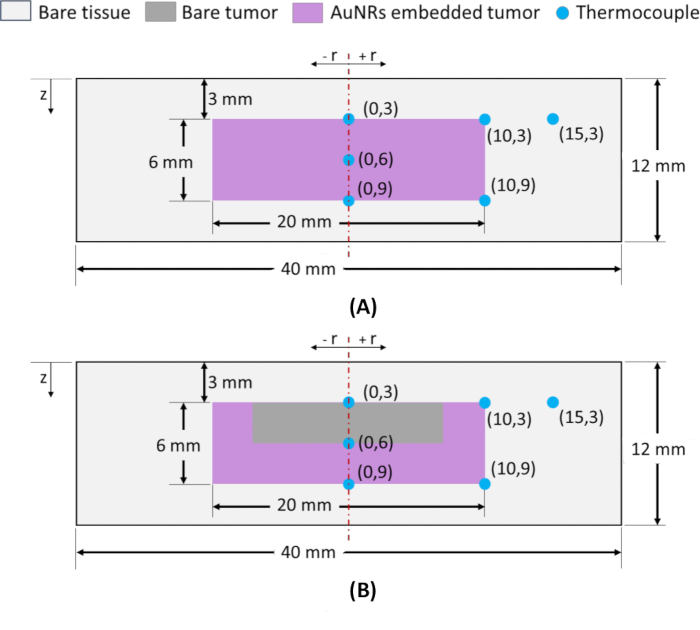
Abbildung 2: Schematische Darstellung von Agarose-basiertem Tumorgewebe, das Phantome zylindrischer Geometrie nachahmt. Phantome mit Gesamtabmessungen von φ40 x 12 mm, mit Tumor in der Mitte (φ20 x 6 mm), der sich in einer Tiefe von 3 mm von der Hautoberfläche befindet und von einer normalen Geweberegion umgeben ist. (A) Phantom mit Tumorregion mit AuNR-Verteilung, wie sie mit IT-Injektion erhalten wurde. (B) Phantom mit Tumorregion mit AuNR-Verteilung, wie bei der i.v. Injektion erhalten. Die Positionen der Thermoelemente werden als (r, z) dargestellt, wobei r die radiale Position und z die Tiefe von der Oberfläche ist. Abkürzungen: AuNRs = Gold-Nanostäbchen; IT = Intratumoral; IV = Intravenös. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
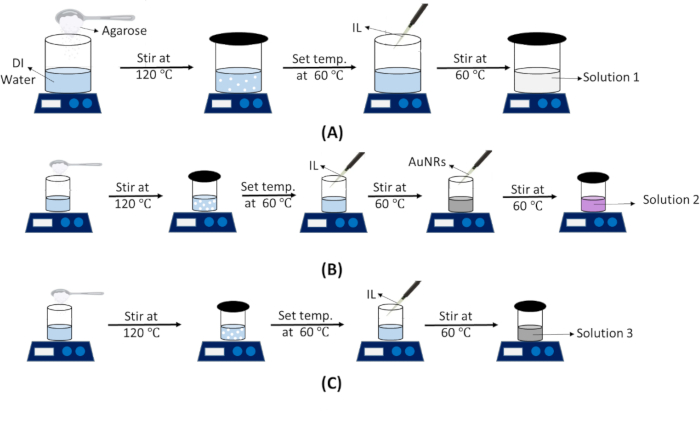
Abbildung 3: Schematische Darstellung der Präparation verschiedener Phantomlösungen. Schritte zur Herstellung von (A) Phantomlösung aus normalem Gewebe (Lösung 1). (B) AuNR-eingebettete Tumorphantomlösung (Lösung 2). (C) Phantomlösung am nackten Tumor (ohne AuNRs) (Lösung 3). Abkürzungen: DI = Deionized; IL = Intralipid; AuNRs = Gold-Nanostäbchen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Präparation von Tumorgewebe-imitierenden Phantomen mit IT- und IV-Verteilung. Phantome mit einem Gesamtdurchmesser von 40 mm und einer Tiefe von 12 mm, mit einer zentralen Tumorregion unter der Oberfläche mit einem Durchmesser von 20 mm und einer Tiefe von 6 mm, die sich 3 mm unter der Phantom-/Hautoberfläche befindet. Übliche Schritte für IT- und IV-Phantome: (A) Lösung 1 wird in die zylindrische Form gegossen (Boden mit Parafilm versiegelt), wobei in der Mitte eine Maskierungsform platziert wird, um einen Hohlraum für die Tumorregion zu schaffen. (B) Verfestigte normale Geweberegion nach Entfernung der Maskierungsform (φ20 x 6 mm), wodurch ein Hohlraum für die Tumorregion entsteht. Schritte nach A und B zur Vorbereitung des IT-Phantoms: (C) Lösung 2 wird in den Hohlraum gegossen, um die zentrale Tumorregion zu bilden, die mit AuNRs für die IT-Verteilung eingebettet ist. (D) Lösung 1 wurde über das erstarrte Phantom gegossen, um schließlich einen unterirdischen Tumor zu erzeugen, der mit AuNRs mit IT-Verteilung eingebettet war und sich 3 mm unter der Phantomoberfläche befand. Schritte nach A und B zur Vorbereitung des IV-Phantoms; (E) Kleine Maskierungsform (φ14 x 3 mm), die in den zentralen Hohlraum eingesetzt wird, wobei Lösung 2 um sie herum gegossen wird, um die periphere Tumorregion zu bilden, die mit AuNRs für die IV-Verteilung eingebettet ist. (F) Lösung 3 wurde in den verbleibenden Hohlraum gegossen, um eine Tumorregion zu erzeugen, die mit AuNRs eingebettet war, die die IV-Verteilung nachahmen. (G) Lösung 1 wurde über das erstarrte Phantom gegossen, um schließlich einen unterirdischen Tumor zu erzeugen, der mit AuNRs mit IV-Verteilung eingebettet war und sich 3 mm unter der Phantomoberfläche befand. (H) Präparierte Phantome, die die Tumordimensionen, die AuNRs-Verteilung und die Tumortiefe von der Phantomoberfläche zeigen. Diese Abbildung stammt von Shaw et al.25. Abkürzungen: IT = Intratumoral; IV = Intravenös; AuNRs = Gold-Nanostäbchen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Aufbau für photothermische Experimente an Phantomen. (A) Einsetzen von Thermoelementen (Typ K) an verschiedenen radialen und axialen Stellen innerhalb des Phantoms. (B) NIR-Bestrahlung von Phantomen und anschließende Überwachung der Temperaturen mit eingesetzten Thermoelementen. Diese Abbildung stammt von Shaw et al.25. Abkürzung: NIR = Nahinfrarot. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
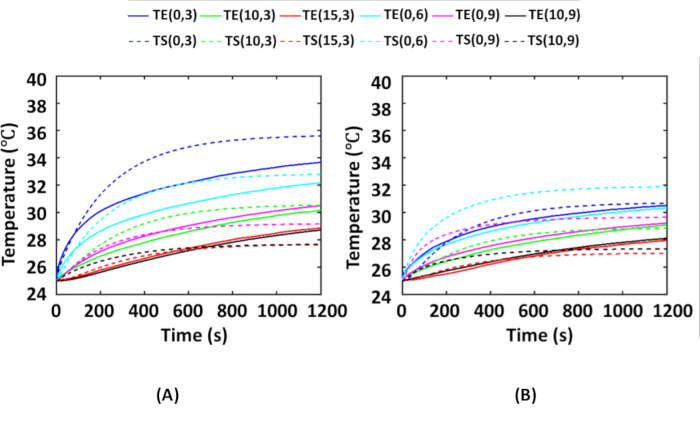
Abbildung 6: Vergleich von experimentellen und simulierten Ergebnissen zur Validierung numerischer Simulationen. Mittlere Temperaturen, die während des photothermischen Experiments an verschiedenen Thermoelementpositionen an Phantomen erhalten wurden, verglichen mit den entsprechenden simulierten Temperaturen für die (A) IT-Verteilung und (B) IV-Verteilung. Die Positionen der Thermoelemente werden als (r, z) dargestellt, die den Radius bzw. die Tiefe darstellen. Der AuNR-eingebettete Tumor, der sich in 3 mm Tiefe im Gewebe befindet, wird mit einer NIR-Intensität von 0,25 W/cm2 bestrahlt. Durchgezogene und gestrichelte Linien stellen experimentell ermittelte bzw. durch Simulation berechnete Temperaturen dar. Diese Abbildung stammt von Shaw et al.25. Abkürzungen: IT = Intratumoral; IV = Intravenös; AuNRs = Gold-Nanostäbchen; NIR = Nahinfrarot; TE = Experimentelle Temperaturen; TS = Simulierte Temperaturen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| AuNRs-Verteilung | Fehler | T(0, 3) | T(10, 3) | T(15, 3) | T(0, 6) | T(0, 9) | T(10, 9) |
| IT-Vertrieb | MAE | 1.96 | 0.92 | 0.42 | 1.05 | 0.46 | 0.54 |
| RMSE | 2.1 | 1 | 0.55 | 1.13 | 0.62 | 0.6 | |
| IV-Verteilung | MAE | 0.43 | 0.36 | 0.36 | 1.9 | 1.12 | 0.44 |
| RMSE | 0.46 | 0.43 | 0.44 | 1.94 | 1.19 | 0.5 |
Tabelle 1: MAE und RMSE berechnet für die IT-Verteilung und IV-Verteilung von AuNRs an verschiedenen Thermoelementstandorten. Diese Tabelle stammt von Shaw et al.25. Alle Angaben sind in Grad Celsius (ºC) angegeben. Abkürzungen: MAE = Mittlerer absoluter Fehler; RMSE = Fehler im mittleren Quadrat; IT = Intratumoral; IV = Intravenös; AuNRs = Gold-Nanostäbchen.
Ergänzende Akte 1: A . STL-Datei für die zylindrische Form 40 mm x 12 mm. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Akte 2: A . STL-Datei für die Abdeckform 20 mm x 6 mm. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Akte 3: A . STL-Datei für die 14 mm x 3 mm Abdeckform. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
In dieser Arbeit wird das Protokoll für die Präparation von Agarose-basierten Tumorgewebe-ähnlichen optischen Phantomen vorgestellt. Die Phantome sind so konzipiert, dass sie die optischen Eigenschaften von Tumor- und Normalgewebe für ihre Verwendung in Studien für PPTT nachahmen. In dieser Studie wird die Anwendung dieser Phantome zur Validierung numerischer Methoden während der PPTT hervorgehoben. Der kritischste Schritt in diesem Protokoll besteht darin, die Temperatur der Phantomlösungen, die Agarose und IL enthalten, unter ständigem Rühren auf 60 ºC zu halten. Wenn die Temperatur 60 ºC überschreitet, kann dies zu einer IL-Denaturierung führen, die die gewünschten optischen Eigenschaften des präparierten Phantoms verändert. Sinkt die Temperatur hingegen unter 40 ºC, kann es zu einer vorzeitigen Gelierung kommen, was zu einer ungleichmäßigen Verteilung der Streukomponente (IL) und/oder der Absorptionskomponente (AuNRs) führt18.
Ein weiterer kritischer Aspekt ist die präzise Platzierung der Thermoelemente. Schon ein kleiner Verschiebefehler (auf der Millimeterskala) kann den gemessenen Temperaturanstieg erheblich beeinflussen. Um dies zu verhindern, ist die Verwendung von Glaskapillaren vorgeschrieben, um die Thermoelemente genau an die gewünschten räumlichen Positionen innerhalb des Phantoms zu führen. Darüber hinaus sollten photothermische Bewertungen mindestens in dreifacher Ausführung durchgeführt werden, um potenzielle Fehler durch unsachgemäße Platzierung von Thermoelementen zu beheben25.
Die in diesem Artikel besprochenen optischen Phantome auf Agarosebasis haben eine kurze nutzbare Haltbarkeit von nicht mehr als 1 Tag. Daher müssen photothermische Experimente am selben Tag durchgeführt werden, an dem die Phantome präpariert werden. Um ihre Haltbarkeit zu verlängern, sollten die Phantome jedoch in unvermeidbaren Fällen sofort nach dem Erstarren in eine Petrischale gelegt, mit Parafilm versiegelt und bei 4 ºC gelagert werden. Dadurch wird die Verwendbarkeit von Phantomen um 2-3 Tage verlängert. Eine weitere Einschränkung des demonstrierten Protokolls besteht darin, dass die Phantombestandteile in Konzentrationen auf der Grundlage der verfügbaren Literatur zugegeben wurden, um die gewünschten μs' und μa zu erreichen. Wir gingen davon aus, dass die Phantome mit den gewünschten optischen Eigenschaften präpariert waren. Die optischen Eigenschaften der präparierten Phantome wurden jedoch nach ihrer Präparation in dieser Studie nicht mit einer geeigneten Technik gemessen.
Die Herstellung von optischen Phantomen auf Agarosebasis ist unkompliziert, kostengünstig und zeitsparend. Diese Phantome auf Agarosebasis können problemlos in einer Vielzahl von Formen und Größen oder Schichten gegossen werden, bei Bedarf mit geeigneten Formen. Flüssigen und festen Phantomen fehlt diese Flexibilität 19,38. Während der NIR-Bestrahlung wurde die photothermische Reaktion der in Nanopartikel eingebetteten Phantome mit Hilfe einer Thermoelement-basierten Temperaturüberwachung bewertet. Diese Methode bietet mehrere Vorteile gegenüber anderen Techniken, wie z. B. der Kolorimetrie (die sich auf die Unterscheidung von Temperaturen nur zwischen Minimal- und Maximalwerten beschränkt), der Infrarot-Thermografie (beschränkt auf die Temperaturerfassung auf Oberflächenebene) und der Magnetresonanz-Thermometrie (hohe Kosten und Betriebskomplexität, wodurch sie vor allem für In-vivo-Anwendungen geeignet ist)26. Die Thermoelement-basierte Überwachung bietet eine hohe Empfindlichkeit (0,1 °C) und Genauigkeit, die Fähigkeit, Temperaturen an tieferen Stellen zu erkennen, Kosteneffizienz und einfache Bedienung, was sie zu einer überlegenen Wahl für solche phantombasierten Auswertungen macht. Darüber hinaus bietet die Validierung der numerischen Simulationen durch photothermische Experimente an Tumorgewebe-imitierenden Phantomen erhebliche Vorteile, d.h. die Reduzierung des Bedarfs an In-vivo-Modellen wie Mäusen, die unnötige Schmerzen und Leiden verursachen können. Darüber hinaus vermeiden phantombasierte Bewertungen ethische Bedenken.
In dieser Studie wird der Schwerpunkt auf der Verwendung optischer Phantome zur Validierung numerischer Simulationen in PPTT gelegt. Die gewebeimitierenden Phantome wurden auf der Grundlage der in der Literatur veröffentlichten Daten hergestellt, um sicherzustellen, dass die Konzentrationen der Bestandteile den gewünschten optischen Eigenschaften entsprechen, insbesondere in Bezug auf den reduzierten Streukoeffizienten und den Absorptionskoeffizienten. Obwohl die optischen Eigenschaften in dieser Studie nicht direkt gemessen wurden, ist es vernünftig anzunehmen, dass die präparierten Phantome die beabsichtigten optischen Eigenschaften aufweisen. Da diese Phantome so konzipiert sind, dass sie die optischen Eigenschaften realer Gewebe nachahmen, können sie als Referenzmaterialien für die Untersuchung des Lichttransports in biologischen Geweben, die Validierung der Genauigkeit optischer Methoden bei der Messung dieser Eigenschaften, die Bewertung der photothermischen Leistung neuartiger Nanostrukturen unter gewebesimulierenden Bedingungen und die Generierung vorläufiger Daten für die Planung weiterer In-vivo-Experimente dienen17. 18,26.
Offenlegungen
Die Autoren haben keine konkurrierenden Interessen offenzulegen.
Danksagungen
Diese Studie wurde ohne jegliche finanzielle Unterstützung durch öffentliche, kommerzielle oder gemeinnützige Fördereinrichtungen durchgeführt. Die Autoren danken der CSIR-Central Scientific Instruments Organisation, Chandigarh, Indien, für Infrastruktur und Unterstützung.
Materialien
| Name | Company | Catalog Number | Comments |
| Agarose | Sigma-Aldrich | 9012-36-6 | Base matrix for phantoms |
| Deionized (DI) water (18.2 MΩ) | NA | NA | Solvent for the preparation of phantom solutions |
| Gold nanorods (AuNRs) | Nanopartz | A12-10-808 | Plasmonic nanoparticles |
| Intralipid (20% emulsion stock) | Sigma-Aldrich | 68890-65-3 | Scattering agent of phantoms |
| Parafilm | Parafilm M | 380020 | To seal the bottom of cylindrical mold |
| Polylactic acid filament | eSun | NA | Material for molds (1.75 mm dia wire) |
| Name of Equipment | Company | Catalog Number | Comments/Description |
| 3D Printer | Creality | Ender-3 | For printing molds |
| Data acquisition (DAQ) system | National Instruments | cDAQ-9171 | For recording temperatures |
| DI water unit | Merck Millipore | Direct-Q3 | For DI water |
| Hot plate with magnetic stirrer | IKA | C-MAG HS 4 | For phantom solutions preparation |
| NIR light source | NA (In-house developed) | NA | For NIR irradiation of phantoms, (800/50 nm; Center wavelength: 800 nm, Bandwidth: 50 nm) |
| Optical Fiber (1/2" × 12") | Edmund Optics | 38-659 | For NIR irradiation of phantoms |
| Type K thermocouples | RS Components | RS Pro 397-1589 | For temperature monitoring at various phantom locations during NIR irradiation |
| Weighing Balance | Wensar | PGB 200 | For weighing agarose |
| Name of Software | Company | Catalog Number | Comments/Description |
| Autodesk Inventor 2021 | Autodesk | NA | For mechanical designing of molds |
| Cura 5.7 | Ultimaker | NA | For converting mechanical design to Gcode for 3D printing |
| Matlab R2024b | MathWorks | NA | For numerical simulations and temperature data plots |
| Name of Labwares used | Company | Catalog Number | Comments/Description |
| Beakers (50 mL) | Borosil | 1000D12 | For phantom solution preparations |
| Beakers (10 mL) | Borosil | 1000006 | For phantom solution preparations |
| Pipette (100-1000 µL) | Eppendorf Research plus, 1-channel, variable | 3123 000 063 | For adding constituents into the phantom solution |
| Pipette (10-100 µL) | Eppendorf Research plus, 1-channel, variable | 3123 000 047 | For adding constituents into the phantom solution |
| Spatula | Borosil | LASC8888M06 | For weighing agarose and demolding the phantoms from the molds |
| Tips (100-1000 µL) | Tarsons | 521016 | For adding constituents into the phantom solution |
| Tips (10-100 µL) | Tarsons | 521010Y | For adding constituents into the phantom solution |
Referenzen
- Riley, R. S., Day, E. S. Gold nanoparticle-mediated photothermal therapy: applications and opportunities for multimodal cancer treatment. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 9 (4), e1449 (2017).
- Webb, J. A., Bardhan, R. Emerging advances in nanomedicine with engineered gold nanostructures. Nanoscale. 6 (5), 2502-2530 (2014).
- Abadeer, N. S., Murphy, C. J. Recent progress in cancer thermal therapy using gold nanoparticles. J Phys Chem C. 120 (9), 4691-4716 (2016).
- Murphy, C. J., et al. Virus-sized gold nanorods: Plasmonic particles for biology. Acc Chem Res. 52 (8), 2124-2135 (2019).
- Overchuk, M., Weersink, R. A., Wilson, B. C., Zheng, G. Photodynamic and photothermal therapies: Synergy opportunities for nanomedicine. ACS Nano. 17 (9), 7979-8003 (2023).
- Goldberg, S. N., Gazelle, G. S., Mueller, P. R. Thermal ablation therapy for focal malignancy. Am J Roentgenol. 174 (2), 323-331 (2000).
- Soni, S., Tyagi, H., Taylor, R. A., Kumar, A. Role of optical coefficients and healthy tissue-sparing characteristics in gold nanorod-assisted thermal therapy. Int J Hyperth. 29 (1), 87-97 (2013).
- Khurana, D., Vikas, A. K., Shaw, S., Soni, Polydopamine coated gold nano blackbodies for tumor-selective spatial thermal damage during plasmonic photothermal cancer therapy. IEEE Trans Nanobiosci. 21 (4), 482-489 (2021).
- Jung, H. S., Verwilst, P., Sharma, A., Shin, J., Sessler, J. L., Kim, J. S. Organic molecule-based photothermal agents: an expanding photothermal therapy universe. Chem Soc Rev. 47 (7), 2280-2297 (2018).
- Ge, R. L., Yan, P. N., Liu, Y., Li, Z. S., Shen, S. Q., Yu, Y. Recent advances and clinical potential of near infrared photothermal conversion materials for photothermal hepatocellular carcinoma therapy. Adv Func Mater. 33 (29), 2301138 (2023).
- Shabani, L., et al. An investigation into green synthesis of Ru template gold nanoparticles and the in vitro photothermal effect on the MCF-7 human breast cancer cell line. Appl Phys A. 129 (8), 564 (2023).
- Mosleh-Shirazi, S., et al. Investigation through the anticancer properties of green synthesized spinel ferrite nanoparticles in present and absent of laser photothermal effect. Ceram Int. 49 (7), 11293-11301 (2023).
- Amani, A. M., et al. Innovation applications of MXenes in biomedicine. Mater Today Commun. 40, 109929 (2024).
- Ali, M. R. K., Wu, Y., El-Sayed, M. A. Gold-nanoparticle-assisted plasmonic photothermal therapy advances toward clinical application. J Phys Chem C. 123 (25), 15375-15393 (2019).
- Lahonian, M., Golneshan, A. A. Numerical study of temperature distribution in a spherical tissue in magnetic fluid hyperthermia using Lattice Boltzmann method. IEEE Trans NanoBiosci. 10 (4), 262-268 (2011).
- Shaw, A. K., Soni, S. Role of periodic irradiation and incident beam radius for plasmonic photothermal therapy of subsurface tumors. J Therm Biol. 121, 103859 (2024).
- Pogue, B. W., Patterson, M. S. Review of tissue simulating phantoms for optical spectroscopy, imaging and dosimetry. J Biomed Opt. 11 (4), 041102 (2006).
- Mustari, A., et al. Agarose-based tissue mimicking optical phantoms for diffuse reflectance spectroscopy. J Vis Exp. (138), e57578 (2018).
- Dabbagh, A., Abdullah, B. J. J., Ramasindarum, C., Abu Kasim, N. H. Tissue-mimicking gel phantoms for thermal therapy studies. Ultrason imaging. 36 (4), 291-316 (2014).
- Khurana, D., et al. Experimental investigation of photothermal conversion and thermal conductivity of broadband absorbing gold nanoblackbodies and graphene oxide nanoparticles for plasmonic photothermal cancer therapy. Int Commun Heat Mass Transf. 156, 107597 (2024).
- Ortega-Palacios, R., Leija, L., Vera, A., Cepeda, M. F. J. Measurement of breast-tumor phantom dielectric properties for microwave breast cancer treatment evaluation. , 216-219 (2010).
- Wagnières, G., et al. An optical phantom with tissue-like properties in the visible for use in PDT and fluorescence spectroscopy. Phys Med Biol. 42 (7), 1415 (1997).
- Didychuk, C. L., Ephrat, P., Chamson-Reig, A., Jacques, S. L., Carson, J. J. L. Depth of photothermal conversion of gold nanorods embedded in a tissue-like phantom. Nanotechnology. 20 (19), 195102 (2009).
- Shaw, A. K., Khurana, D., Soni, S. Thermal damage analysis of sub-surface soft tissue sarcoma for Indocyanine Green mediated photothermal cancer therapy. Therm Sci Eng Prog. 46, 102168 (2023).
- Shaw, A. K., Khurana, D., Soni, S. Assessment of thermal damage for plasmonic photothermal therapy of subsurface tumors. Phys Eng Sci Med. 47 (3), 1107-1121 (2024).
- Khurana, D., Soni, S. Tissue-mimicking phantoms for photothermal performance evaluations. Recent Trends in Cancer Therapeutics: Plasmonic Photothermal-Based Multimodal Cancer Therapy. , 109-136 (2024).
- Eranki, A., et al. Tissue-mimicking thermochromic phantom for characterization of HIFU devices and applications. Int J Hyperth. 36 (1), 517-528 (2019).
- McLaughlan, J. R. Controllable nucleation of cavitation from plasmonic gold nanoparticles for enhancing high intensity focused ultrasound applications. J Vis Exp. (140), e58045 (2018).
- Soni, S., Tyagi, H., Taylor, R. A., Kumar, A. Experimental and numerical investigation of heat confinement during nanoparticle-assisted thermal therapy. Int Commun Heat Mass Transf. 69, 11-17 (2015).
- Ntombela, L., Adeleye, B., Chetty, N. Low-cost fabrication of optical tissue phantoms for use in biomedical imaging. Heliyon. 6 (3), e03602 (2020).
- Lai, P., Xu, X., Wang, L. V. Dependence of optical scattering from Intralipid in gelatin-gel based tissue-mimicking phantoms on mixing temperature and time. J Biomed Opt. 19 (3), 035002 (2014).
- Aernouts, B., Van Beers, R., Watté, R., Lammertyn, J., Saeys, W. Dependent scattering in Intralipid®phantoms in the 600-1850 nm range. Opt Express. 22 (5), 6086-6098 (2014).
- Tromberg, B. J., et al. Non-invasive in vivo characterization of breast tumors using photon migration spectroscopy. Neoplasia. 2 (1-2), 26-40 (2000).
- Kanick, S. C., et al. Scattering phase function spectrum makes reflectance spectrum measured from Intralipid phantoms and tissue sensitive to the device detection geometry. Biomed Opt Express. 3 (5), 1086-1100 (2012).
- Yuan, B., Chen, N., Zhu, Q. Emission and absorption properties of indocyanine green in Intralipid solution. J Biomed Opt. 9 (3), 497-503 (2004).
- Khurana, D., et al. Gold nanoblackbodies-based multifunctional nanocomposite for multimodal cancer therapy. Int J Pharm. 642, 123112 (2023).
- Brough, D., Ramos, J., Delpech, B., Jouhara, H. Development and validation of a TRNSYS type to simulate heat pipe heat exchangers in transient applications of waste heat recovery. Int J Thermofluid. 9, 100056 (2021).
- Vardaki, M. Z., Kourkoumelis, N. Tissue phantoms for biomedical applications in Raman spectroscopy: A review. Biomed Eng Computational Biol. 11, 1179597220948100 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten