Method Article
Thérapie photothermique plasmonique contre le cancer : fantômes imitant les tissus tumoraux incorporés dans des nanoparticules pour visualiser la distribution photothermique de la température
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Cet article présente le protocole de préparation de fantômes tumoraux qui reproduisent les propriétés optiques pour la thérapie photothermique plasmonique. Il détaille la préparation du fantôme, les évaluations photothermiques et la validation du modèle numérique développé basé sur des mesures de température photothermique pour évaluer les paramètres thérapeutiques, offrant une alternative éthique et rentable aux études in vivo pour les tests préliminaires.
Résumé
La thérapie photothermique plasmonique (PPTT), un traitement émergent du cancer, consiste à administrer des nanoparticules (NP) à une tumeur, suivie d’une irradiation proche infrarouge (NIR) pour générer une chaleur localisée qui détruit les cellules cancéreuses. Avant d’administrer le TTPP, les paramètres thérapeutiques - concentration de NP, intensité de l’irradiation et durée - doivent être estimés. Pour cela, des simulations numériques sont effectuées. Cependant, pour garantir un calcul robuste, ces simulations doivent être validées par des expériences photothermiques sur des fantômes imitant le tissu tumoral reproduisant les propriétés optiques du tissu tumoral. Pour le TTPP, les paramètres thérapeutiques sont régis par la diffusion et l’absorption du rayonnement incident par les tissus et les NP. Par conséquent, des expériences de validation peuvent être menées sur des fantômes imitant le coefficient de diffusion réduit (μs') et le coefficient d’absorption (μa) de la tumeur/tissu cible.
Plus précisément, ce protocole fournit des instructions pour préparer des fantômes imitant μs et μa de tumeur mammaire injectée avec des nanotiges d’or, entourées de tissu mammaire normal. Le protocole détaille également l’irradiation NIR, la surveillance de la température et la validation des résultats numériques en comparant les températures spatio-temporelles avec celles mesurées à l’aide de thermocouples. Les protocoles présentés dans cette étude ont facilité la préparation de fantômes tumoraux mammaires cylindriques à base d’hydrogel de dimensions (φ40 x 12 mm) et d’une région tumorale centrale (φ20 x 6 mm), comprenant 1 % d’agarose comme matrice de base et intralipidique comme constituant de diffusion et une région tumorale intégrée avec des nanotiges d’or à une concentration de 25 μg/mL. Les résultats représentatifs d’une étude de cas illustrent l’application de fantômes fabriqués pour la validation de simulations numériques pour PPTT. L’étude conclut que les protocoles démontrés sont précieux pour la réalisation d’expériences photothermiques visant à optimiser et à planifier les paramètres thérapeutiques avant les expériences in vivo et à valider les simulations numériques pour le TTPP.
Introduction
La thérapie photothermique plasmonique (PPTT) est une modalité émergente de traitement localisé du cancer qui consiste à délivrer des nanoparticules (NP) sur le site de la tumeur, suivie d’une irradiation par rayonnement proche infrarouge (NIR). Les NP sont généralement administrées par voie intratumorale (IT) ou intraveineuse (IV)1. Lors de l’irradiation NIR, l’interaction plasmonique du rayonnement incident et des NP conduit à la génération de chaleur localisée à la surface des NP, qui se dissipe ensuite dans le tissu tumoral environnant 2,3. Cet échauffement localisé élève la température dans la région de la tumeur, entraînant la mort des cellules cancéreuses par ablation thermique 4,5. Un traitement efficace du cancer peut être obtenu en maintenant des températures spécifiques, telles que 46 ºC pendant 1 h6, 50-52 ºC pendant 4-6 min7, ou 60 ºC pour des dommages instantanés8 via divers processus biologiques.
Divers agents photothermiques ont été explorés et rapportés pour l’application de la thérapie photothermique, et leur efficacité thérapeutique a été évaluée par des études in vitro ou in vivo . Ces agents comprennent des matières organiques9 telles que des colorants dans le proche infrarouge (par exemple, le vert d’indocyanine, l’IR780, l’IR820), des agents photothermiques à base de polymères (par exemple, la polydopamine) et des matériaux inorganiques10, y compris les NP à base de métaux nobles ou les NP plasmoniques (par exemple, les NP d’or)11, le soufre/oxydes de métaux de transition12 et les MXènes13. Parmi ceux-ci, les NP plasmoniques, en particulier les NP d’or, offrent plusieurs avantages par rapport aux agents photothermiques traditionnels (par exemple, les colorants), tels qu’une meilleure stabilité photothermique, une efficacité de conversion photothermique plus élevée et une réponse plasmonique accordable grâce aux variations de forme et de taille10. Ces attributs font des NP dorés des candidats idéaux pour la thérapie photothermique, certains faisant actuellement l’objet d’essais cliniques14.
Pour optimiser l’efficacité thérapeutique et garantir des dommages thermiques tumoraux suffisants pendant le PPTT, il est essentiel d’estimer les paramètres de traitement tels que la dose de NP (en termes de concentration) et les paramètres de rayonnement NIR (y compris l’intensité et la durée de l’irradiation) avant l’application préclinique/clinique du PPTT. Des simulations numériques sont généralement utilisées pour établir ces paramètres. Diverses méthodes numériques ont été développées pour évaluer les dommages thermiques dans le tissu tumoral, la méthode de Boltzmann sur réseau étant l’une de ces approches15,16. Cependant, pour que ces simulations soient fiables, elles doivent être validées à l’aide d’analogues tissulaires connus sous le nom de fantômes imitant les tissus. Ces fantômes peuvent être préparés pour reproduire les propriétés optiques, thermiques, biologiques ou mécaniques de tissus réels, servant de substituts pour effectuer des tests préliminaires, évaluer le traitement et valider des dispositifs, des matériaux ou des méthodes nouvellement développés destinés à des applications biologiques17,18. Cela peut réduire la souffrance inutile des animaux ou des sujets humains et répondre aux préoccupations éthiques associées à de telles expériences19,20.
La conception et la fabrication d’un fantôme dépendent de l’application prévue21. Par exemple, lors de photothérapies comme le PPTT, la dose de rayonnement incident est influencée par la quantité de lumière absorbée ou diffusée par les NP et les tissus22,23. Par conséquent, des fantômes optiques qui imitent les propriétés optiques, en particulier le coefficient de diffusion réduit (μ s') et le coefficient d’absorption (μa) des tissus biologiques, sont utilisés pour les évaluations PPTT et la validation ultérieure des simulations numériques24,25. Les fantômes optiques sont généralement composés de trois constituants principaux : une matrice de base, des agents de diffusion et des agents d’absorption17,26. La matrice de base maintient les composants de diffusion et d’absorption à des concentrations appropriées pour reproduire les propriétés optiques souhaitées. Ces fantômes peuvent être classés en fantômes solides, liquides et semi-solides (hydrogel), selon le type de matrice de base. Pour les études thérapeutiques thermiques comme le PPTT, les fantômes d’hydrogel, en particulier les fantômes à base d’agarose, sont préférés en raison de leur biocompatibilité, de leur diffusion et de leur absorption inhérentes négligeables, de leur processus de fabrication simple et de leur flexibilité pour être coulés dans les formes et les tailles souhaitées correspondant aux géométries tumorales19,22. Plus important encore, les fantômes préparés à base d’agarose peuvent être utilisés jusqu’à des températures en vrac de ~70-80 ºC, car la température de fusion des fantômes de type agarose est de ~80 ºC19. Pour le PPTT, comme une plage de température de ~50-80 ºC est suffisante, de tels fantômes à base d’agarose peuvent être utilisés pour les évaluations photothermiques basées sur le PPTT.
Divers fantômes imitant les tissus à base d’hydrogel ont été développés et signalés pour diverses applications. Mustari et al. ont développé des fantômes imitant les tissus à base d’agarose et ont démontré leur utilité dans la validation d’un système optique nouvellement conçu18. Dans une autre étude, des fantômes thermochromes imitant les tissus ont été préparés pour mesurer l’étendue des dommages thermiques lors d’un traitement par ultrasons focalisés de haute intensité (HIFU)27. Des fantômes imitant les tissus à base de polyacrylamide ont également été préparés pour analyser l’effet de cavitation lors du traitement du cancer à base d’HIFU28. L’objectif de cette étude est de démontrer une méthode étape par étape pour fabriquer des fantômes imitant le tissu tumoral ainsi que le protocole pour les expériences photothermiques basées sur des fantômes pour les évaluations PPTT. Ce protocole détaillé proposé vise à promouvoir l’adoption et la reproductibilité de la préparation du fantôme et des méthodes d’expérimentation photothermique ultérieures basées sur le fantôme pour tester la performance photothermique des nanostructures nouvellement développées, validant ainsi les simulations numériques et aidant à la planification du prétraitement ou à l’optimisation des paramètres thérapeutiques du PPTT. Cet article décrit un protocole de préparation fantôme spécialement conçu pour les tumeurs mammaires souterraines ; Cependant, les mêmes étapes peuvent être adaptées à la fabrication de divers types de tissus tumoraux (de formes et de tailles diverses) en modifiant la composition des agents d’absorption et de diffusion optiques. À titre d’exemple, les évaluations photothermiques démontrées à base de fantômes imitant les tissus ont été utilisées dans des études précédemment rapportées pour valider les simulations PPTT pour les tumeurs sous-superficielles de l’avant-bras24, les tumeurs sous-superficielles IDC25 et les tumeurs cutanées29.
Cet article décrit les étapes de préparation d’un fantôme optique qui imite les μ s’d’une tumeur du sein sous-superficielle ou sous-cutanée, en particulier le carcinome canalaire invasif (IDC), situé à 3 mm sous la surface de la peau et entouré de tissu mammaire normal. Le fantôme est de géométrie cylindrique préparé à l’aide d’agarose comme matrice de base et d’intralipides (IL) comme agent de diffusion ajoutés à des concentrations appropriées pour imiter les μ de tissu mammaire normal et cancéreux. L’agarose, un hydrogel transparent à diffusion et absorption négligeables, est une matrice de base idéale pour les fantômes optiques18,30. De plus, IL, une émulsion de graisse à 20 % qui imite la structure bicouche des membranes cellulaires, est largement utilisée comme agent de diffusion31,32 et a été choisie pour cette étude pour reproduire les μs’du tissu mammaire normal et cancéreux. Le fantôme est conçu pour imiter une tumeur mammaire (IDC) injectée avec des nanotiges d’or (AuNRs) sous forme de NP plasmoniques, entourées de tissu mammaire normal sans AuNRs. Parmi les différentes NP d’or utilisées dans le PPTT, les AuNR ont été sélectionnés pour cette étude en raison de leur forte réponse plasmonique dans la région NIR et de leur utilisation généralisée dans les études précliniques de PPTT, y compris celles impliquant des patients canins et félins14. Le protocole démontre la préparation de deux types de fantômes : l’un avec une tumeur présentant une distribution AuNR telle qu’observée avec l’injection IV et l’autre avec une tumeur reflétant la distribution AuNR obtenue par injection IT. Selon le protocole de préparation des fantômes, le dispositif expérimental pour l’irradiation proche infrarouge et les étapes de réalisation des évaluations photothermiques sur les fantômes sont décrits. Enfin, un guide étape par étape est fourni pour interpréter les résultats de distribution de température obtenus à partir de ces évaluations et pour comparer les données expérimentales avec les résultats de simulation numérique. Cette comparaison permet de valider une méthode numérique développée, permettant d’ajuster des paramètres de traitement optimaux adaptés spécifiquement à une tumeur.
Protocole
REMARQUE : Les fantômes ont été préparés à l’aide d’agarose et d’intralipides sur la base de compositions publiées dans la littérature pour obtenir les propriétés optiques souhaitées. Aucun tissu biologique réel provenant de patients ou de cadavres n’a été utilisé. Par conséquent, la préparation de ces fantômes est exempte de contraintes éthiques et ne nécessite pas de consentement éclairé.
1. Sélection ou fabrication d’un moule adapté
- . Sélection d’un moule adapté
- Choisissez un moule qui correspond à la forme et aux dimensions souhaitées pour les fantômes. Pour les fantômes cylindriques avec une région tumorale uniformément répartie avec des NP et entourée de tissu normal, utilisez une boîte de Pétri en verre et un petit bécher comme moule8 (Figure 1A).
REMARQUE : Ces étapes sont pour préparer des fantômes imitant le tissu tumoral en géométrie cylindrique. Pour d’autres formes ou tailles, sélectionnez un moule approprié. Si un moule approprié n’est pas disponible, fabriquez-en un à l’aide de l’impression tridimensionnelle (3D), comme détaillé à l’étape 1.2.
- Choisissez un moule qui correspond à la forme et aux dimensions souhaitées pour les fantômes. Pour les fantômes cylindriques avec une région tumorale uniformément répartie avec des NP et entourée de tissu normal, utilisez une boîte de Pétri en verre et un petit bécher comme moule8 (Figure 1A).
- Fabrication de moules par impression 3D
- Concevez un modèle 3D à l’aide d’un logiciel de conception assistée par ordinateur (CAO) (par exemple, SolidWorks, Autodesk Inventor ou CATIA) en fonction de la forme et de la taille souhaitées. Pour suivre ce protocole, concevez un cylindre creux (diamètre intérieur 40 mm, épaisseur 2 mm et hauteur 12 mm ; voir le fichier supplémentaire 1) et deux moules de masquage cylindriques solides (dimensions φ20 x 6 mm et φ14 x 3 mm), comme illustré à la figure 1B.
- Pour la conception/le dessin de cylindres creux, dans un logiciel de CAO, créez deux cercles de 40 mm et 44 mm de diamètre. Ensuite, extrudez la géométrie sur 12 mm.
- Pour les moules de masquage cylindriques solides, créez des cercles de 20 mm et 14 mm de diamètre, puis extrudez sur 6 mm et 3 mm, respectivement (voir Fichier supplémentaire 2 et Fichier supplémentaire 3). Tracez un rectangle (côtés 44 mm et 5 mm) sur un côté du cylindre et extrudez-le sur 2 mm.
- Convertissez les modèles 3D au format Gcode à l’aide d’un logiciel compatible avec l’imprimante 3D (par exemple, Cura) pour l’impression.
- Utilisez ce Gcode pour imprimer les moules (par exemple, ici, en utilisant de l’acide polylactique [PLA] φ1,75 mm, 1 kg d’eSun) à l’aide d’une imprimante 3D.
REMARQUE : Le rectangle est dessiné pour suspendre les moules de masquage. Différents moules peuvent être conçus et fabriqués pour préparer des fantômes avec d’autres formes souhaitées.
- Concevez un modèle 3D à l’aide d’un logiciel de conception assistée par ordinateur (CAO) (par exemple, SolidWorks, Autodesk Inventor ou CATIA) en fonction de la forme et de la taille souhaitées. Pour suivre ce protocole, concevez un cylindre creux (diamètre intérieur 40 mm, épaisseur 2 mm et hauteur 12 mm ; voir le fichier supplémentaire 1) et deux moules de masquage cylindriques solides (dimensions φ20 x 6 mm et φ14 x 3 mm), comme illustré à la figure 1B.
2. Préparation de solutions fantômes imitant le tissu tumoral25
REMARQUE : Dans cette étude, des fantômes optiques à base d’agarose de géométrie cylindrique imitant le tissu tumoral sont préparés pour ressembler à une tumeur du sein souterraine injectée avec des AuNRs, par injection IT ou IV, comme le montre la figure 2. Le fantôme IT a deux régions : une région tumorale centrale avec des AuNR et une région tissulaire normale environnante. Le fantôme IV comporte trois régions : une région tumorale avec des AuNR à la périphérie de la tumeur, une région tumorale nue centrale sans AuNR et une région tissulaire normale environnante. Étant donné que les propriétés optiques (μa et μs') diffèrent pour la tumeur et les tissus normaux, des solutions fantômes distinctes sont préparées pour chaque région ayant des compositions différentes et seront discutées séparément.
- Préparation d’une solution fantôme imitant le tissu mammaire normal (Solution 1)
REMARQUE : Cette solution sera utilisée pour les fantômes IT et IV. Les étapes de préparation de la solution 1 sont illustrées à la figure 3A.- Calculez le volume théorique de la solution en fonction des dimensions du moule.
REMARQUE : Ici, pour le moule cylindrique de φ40 x 12 mm, le volume calculé est de 15 cm3 ou 15 mL par fantôme. Comme deux fantômes de ce type doivent être préparés, le volume total est de 15 ml x 2, soit 30 ml. Par conséquent, préparez 35 ml de la solution pour tenir compte de l’évaporation ou du déversement pendant l’étape de préparation fantôme. - Calculer la quantité (poids/concentration/volume) de tous les constituants fantômes - agarose (comme matériau de base) et IL (comme constituant de diffusion) - à ajouter à la solution de 35 mL.
- Ajouter 0,35 g d’agarose pour préparer 35 mL de solution correspondant à une concentration de 1 % p/v.
- Estimer la concentration de IL correspondant à la μ souhaitée de tissu mammaire normal (c.-à-d. 10,1 cm-1 33) en fonction de la concentration de IL par rapport aux données μ s disponibles dans la littérature. Ensuite, calculez le volume d’IL (20 % de bouillon d’émulsion) à ajouter à la solution fantôme à l’aide de l’équation (1) :
 (1)
(1)
Où C1 et V1 sont la concentration de la matrice de réactif (ici la base de 20 % IL) et le volume de la solution mère de réactif à ajouter (il s’agit ici de la calculer), respectivement. C2 est la concentration requise du réactif (à obtenir dans la littérature) dans la solution de travail finale, et V2 est le volume total de la solution de travail finale (ici, 35 mL).
REMARQUE : Ici, pour μs’de 10,1 cm-1, la concentration en IL estimée d’après la littérature rapportée est de 1,04 %34,35. En suivant les étapes ci-dessus, le volume de IL (stock de 20 % de LI) à ajouter est de 1,82 ml.
- Peser 0,35 g d’agarose et l’ajouter à 33,18 mL d’eau désionisée (DI) dans un bécher. Couvrez le bécher avec du papier d’aluminium pour éviter les pertes d’eau.
- Chauffer le bécher contenant la solution sur une plaque chauffante à 120 °C en remuant jusqu’à ce que la solution devienne transparente.
- Abaissez la température de la plaque chauffante à 60 ºC. Après 15 min, ajouter 1,82 mL de IL en remuant. Maintenir la solution obtenue, la solution 1, sous agitation à 60 ºC jusqu’à ce qu’elle soit utilisée (prête à être versée).
REMARQUE : La solution fantôme à 60 ºC doit être conservée dans des conditions d’agitation. Sinon, cela conduit à la solidification de la solution.
- Calculez le volume théorique de la solution en fonction des dimensions du moule.
- Préparation d’une solution fantôme tumorale intégrée à AuNR (Solution 2)
REMARQUE : Cette solution sera utilisée pour les fantômes IT et IV. Les étapes de préparation de la solution 2 sont illustrées à la figure 3B.- Calculez le volume de la région tumorale à remplir (φ20 x 6 mm).
REMARQUE : Le volume approximatif de deux fantômes tumoraux de ce type est de 3,8 ml. Ainsi, le volume de solution à préparer serait de 4,5 ml. - Calculez la quantité de constituants fantômes tumoraux à ajouter - agarose, IL et AuNR - en utilisant des étapes similaires comme mentionné à la section 2.1.
- Ajouter 45 mg pour préparer 4,5 mL de solution correspondant à une concentration p/v de 1 %.
- IL :μs’de la tumeur du sein est de 4,6 cm-1 33 et pour imiter la même, la concentration correspondante d’IL requise est de 0,472%34,35. Par conséquent, ajoutez 106,2 μL d’IL à partir de 20 % d’IL stock à 4,5 mL de solution fantôme de tumeur.
- La concentration souhaitée d’AuNRs dans le fantôme est de 25 μg/mL. Pour obtenir la même chose, ajoutez 3,21 mL de solution d’AuNRs (concentration stock : 35 μg / mL) à la solution fantôme de tumeur.
- Ajoutez 45 mg d’agarose à 1,18 mL d’eau DI dans un bécher et couvrez-le d’une feuille d’aluminium.
- Placez le bécher sur une plaque chauffante et remuez à 120 ºC jusqu’à ce que la solution devienne transparente.
- Réduire la température de la plaque chauffante à 60 ºC et laisser la solution pendant 15 min.
- Ajouter 106,2 μL d’IL et 3,21 mL de suspension AuNR (35 μg/mL) dans des conditions d’agitation. Maintenir la solution obtenue, la solution 2, sous agitation à 60 ºC jusqu’à ce qu’elle soit versée.
- Calculez le volume de la région tumorale à remplir (φ20 x 6 mm).
- Préparation de la solution fantôme de tumeur nue (sans AuNRs) (Solution 3)
REMARQUE : Cette solution ne sera utilisée que pour le fantôme IV. Les étapes de préparation de la solution 2 sont illustrées à la figure 3C.- Calculez le volume théorique de la suspension à ajouter pour créer une région tumorale nue (~ φ20 x 6 mm).
REMARQUE : Le volume approximatif des fantômes tumoraux est de 1,9 ml. Ainsi, le volume de solution à préparer serait de 2,5 ml. - Calculez la quantité de constituants fantômes tumoraux à ajouter - agarose et IL - en utilisant des étapes similaires comme mentionné à la section 2.1.
- Ajouter 25 mg d’agarose pour préparer 2,5 mL de solution de manière à obtenir une concentration p/v de 1 %.
- IL :μs’de la tumeur du sein est de 4,6 cm-1 33 et pour imiter la même, la concentration correspondante d’IL requise est de 0,472%34,35. Ajouter 59 μL de stock à 20 % IL.
- Ajoutez 25 mg d’agarose à 2,44 mL d’eau DI dans un bécher et couvrez-le d’une feuille d’aluminium.
- Placez le bécher sur une plaque chauffante et remuez à 120 ºC jusqu’à ce que la solution devienne transparente.
- Réduire la température de la plaque chauffante à 60 ºC et laisser la solution pendant 15 min.
- Ajouter 59 μL d’IL à la solution dans des conditions d’agitation. Maintenir la solution obtenue, la solution 3, dans des conditions d’agitation à 60 ºC jusqu’à ce qu’elle soit versée.
- Calculez le volume théorique de la suspension à ajouter pour créer une région tumorale nue (~ φ20 x 6 mm).
3. Préparation d’un fantôme imitant le tissu tumoral 24,25,36
- Préparez les moules pour l’étape de coulée. Pour cela, scellez le fond des moules cylindriques avec du parafilm et placez le moule de masquage (φ20 x 6 mm) au centre.
- Versez la solution 1 dans les moules cylindriques jusqu’au repère supérieur du moule de masquage et laissez-la se solidifier (Figure 4A).
- Après solidification, retirez le moule de masquage pour créer une cavité pour la région tumorale (Figure 4B).
REMARQUE : Le protocole sera le même pour les fantômes IT et IV jusqu’à l’étape 3.3. Le processus sera abordé séparément pour les fantômes IT et IV après l’étape 3.3. - Fantôme informatique 24,25,36
- Remplissez la cavité avec la solution 2 et laissez-la se solidifier (Figure 4C).
- Ajoutez la solution 1 sur le dessus du fantôme et laissez-la se solidifier complètement (Figure 4D).
- Fantôme IV24,25
- Insérez un moule de masquage plus petit (φ14 x 3 mm) et remplissez la cavité qui l’entoure avec la solution 2 (Figure 4E).
- Après la solidification, retirez le moule plus petit et remplissez la cavité restante avec la solution 3 (Figure 4F).
- Ajouter la solution 1 sur le dessus et permettre une solidification complète (Figure 4G).
4. Insertion des thermocouples dans le fantôme 24,25,36
REMARQUE : Pour surveiller la distribution spatiale de la température, des thermocouples de type K sont insérés dans le fantôme à divers emplacements radiaux (r) et axiaux (z), comme illustré à la figure 2. Pour l’insertion de thermocouples à des endroits précis, des capillaires en verre sont utilisés comme guides pour assurer la précision. Les emplacements des thermocouples sont notés (r, z), où le point médian sur la surface supérieure de la tumeur à la profondeur z = 3 mm sert de point de référence pour les fantômes IT et IV et est désigné par (0, 3), comme le montre la figure 2A, B. Lors de la sélection des emplacements radiaux et axiaux pour quantifier les dommages thermiques dans la région tumorale, les emplacements à la périphérie de la tumeur (radiale et axiale) sont critiques. L’obtention des températures requises à ces points périphériques lors de l’irradiation proche infrarouge garantit une ablation complète de la tumeur. Ainsi, les thermocouples sont placés aux points radiaux extrêmes (de la tumeur) à z = 3 et 9 mm, c’est-à-dire (10, 3) et (10, 9), et un thermocouple est placé à l’interface tumeur-tissu à z = 9 mm (emplacement axial périphérique), c’est-à-dire (0, 9) comme illustré sur la figure 2A, B. De plus, pour évaluer la distribution axiale de la température, un thermocouple est inséré entre les emplacements (0, 3) et (0, 9), désignés par (0, 6). Enfin, pour évaluer l’élévation de température dans la région des tissus sains environnants, un thermocouple est inséré en (15, 3).
- Coupez les capillaires en verre à des longueurs appropriées afin qu’ils atteignent les emplacements radiaux et axiaux souhaités dans le fantôme.
- Insérez des thermocouples dans ces capillaires en verre et percez un par un aux emplacements fantômes radiaux et axiaux spécifiés.
- Une fois que tous les thermocouples sont en place, placez soigneusement le fantôme dans une boîte de Pétri en verre pour l’irradiation NIR ultérieure, comme le montre la figure 5A.
5. Exposition à l’irradiation proche infrarouge et mesure des températures photothermiques résultantes36
- Placez la boîte de Pétri en verre contenant le fantôme (insérée avec des thermocouples) de manière à ce que la région centrale de la surface supérieure du fantôme soit perpendiculaire à l’extrémité de la fibre optique de la source lumineuse NIR, comme illustré à la figure 5A.
REMARQUE : Le diamètre du faisceau sur la surface fantôme peut être ajusté en modifiant la distance entre la surface et la pointe de la fibre optique. Ici, une distance de 9 mm est maintenue pour obtenir un diamètre de faisceau de 20 mm, couvrant la région centrale de la tumeur. - Connectez le système d’acquisition de données (DAQ) à l’ordinateur et ouvrez le logiciel LabVIEW.
- Allumez la source lumineuse proche infrarouge (Figure 5B) et le bouton de lecture du logiciel simultanément pour enregistrer les données de température au début de l’irradiation.
- Irradiez le fantôme pendant 20 min, puis éteignez la source lumineuse NIR et arrêtez l’enregistrement.
- Tracez les données de température enregistrées en fonction du temps.
6. Comparaison de la température avec les résultats de la simulation24,25
REMARQUE : Les expériences sont généralement répétées et les températures sont enregistrées à des intervalles de temps définis à tous les emplacements du thermocouple. Pour la validation, les étapes suivantes sont effectuées :
- Calculer la moyenne et l’écart-type des températures expérimentales à tous les emplacements du thermocouple (r, z).
- Calculez numériquement les températures aux emplacements de thermocouples considérés.
- Graphique de la température moyenne obtenue à partir des expériences et de la température obtenue par simulation à tous les emplacements du thermocouple par rapport au temps, comme le montre la figure 6.
- Calculez l’erreur quadratique moyenne (EQM) et l’erreur absolue moyenne (MAE) pour tous les emplacements des thermocouples afin de quantifier la différence de température pour évaluer la validation, comme indiqué dans le tableau 1.
REMARQUE : L’EDI et l’EQM sont calculés à l’aide des équations 2 et 3, respectivement.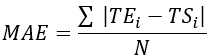 (2)
(2) (3)
(3)
Où TE, TS et N sont la température obtenue expérimentalement, la température calculée numériquement et le nombre de points de données (ici, les températures sont enregistrées chaque seconde pendant 20 min ; donc, = 1 200), respectivement. i représente les instants de temps.
Résultats
La figure 6 montre les températures moyennes temporelles obtenues lors d’expériences avec un fantôme de tissu tumoral intégré à AuNR à tous les emplacements du thermocouple, comme le montre la figure 2, par rapport aux températures obtenues lors des simulations aux emplacements correspondants des thermocouples. Ici, les expériences ont été réalisées 4x pour chaque distribution, c’est-à-dire les distributions IT et IV des AuNRs. Au cours des expériences, la température ambiante était de 25 °C. Par conséquent, pour la simulation également, la température ambiante a été maintenue à 25 °C. La figure 6A montre une comparaison entre les températures moyennes expérimentales et les températures simulées pour la distribution IT des AuNR. La figure 6B montre une comparaison entre les températures moyennes expérimentales et les températures simulées pour la distribution IV des AuNR. D’après la figure 6A, B, on voit que la distribution IV montre une augmentation de température plus faible que la distribution IT. Cela est dû au fait que la diffusion du rayonnement incident est plus importante dans la distribution IV en raison d’une couche plus grande et plus épaisse de milieux diffusés (tissu nu + tumeur nue) avant que le rayonnement incident ne soit absorbé par la tumeur intégrée dans AuNR.
Ensuite, les graphiques de température montrent que pendant les expériences fantômes, l’élévation maximale de la température était de ~11 ºC et ~6 ºC à l’emplacement du thermocouple (0, 3) pour la distribution IT et IV, respectivement. Il est à noter que les tissus sont thermiquement sûrs en dessous de 43 ºC 6,16. Généralement, comme la température corporelle centrale est de 37 °C, une élévation de température de >6 °C entraîne des dommages thermiques dans le tissu tumoral. Ici, les expériences fantômes avec des AuNRs de 25 μg/mL et 0,25 W/cm2 suggèrent que les dommages thermiques sont induits à moins de 3-4 mm dans les directions radiale et axiale de la tumeur souterraine dans les deux cas, et que le reste de la région tumorale reste intact. De tels protocoles peuvent être utilisés pour optimiser l’intensité de l’irradiation et la concentration d’AuNR afin d’obtenir des dommages thermiques complets d’une tumeur.
De plus, les températures simulées sont dites validées si l’erreur est de <15 % par rapport aux températures expérimentales37. Pour cela, l’EQM et l’EAM sont calculés à tous les emplacements des thermocouples dans les deux cas et indiqués dans le tableau 1. Une variation maximale de 2,10 ºC et 1,94 ºC est obtenue pour la distribution IT et les distributions IV, respectivement, ce qui correspond à des erreurs de 5,88 % et 6,09 % par rapport à la température simulée. Par conséquent, on peut conclure que les résultats expérimentaux et simulés sont en bonne comparaison les uns avec les autres.
En résumé, l’étude conclut que les protocoles de préparation de fantômes et les expériences photothermiques ultérieures à base de fantômes démontrés ici aident à valider les simulations numériques et à garantir la robustesse des paramètres thérapeutiques dérivés pour les applications ultérieures in vivo de la TTPP.

Figure 1 : Moules pour la fabrication de fantômes imitant les tissus tumoraux à base d’agarose. (A) Boîte de Pétri en verre et bécher utilisés comme moules pour créer des fantômes cylindriques de tissu tumoral. (B) Moule cylindrique imprimé en 3D et moules de masquage conçus pour la préparation de fantômes cylindriques de tissu tumoral. Veuillez cliquer ici pour voir une version agrandie de cette figure.
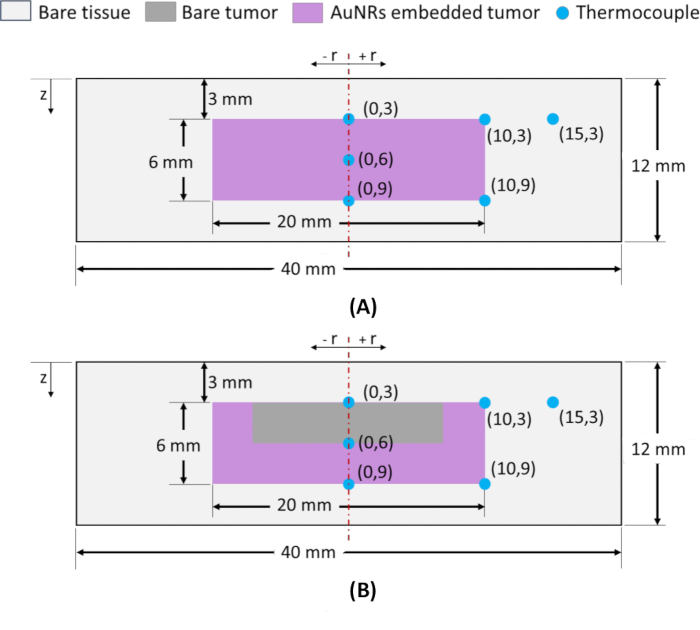
Figure 2 : Schéma d’un tissu tumoral à base d’agarose imitant les fantômes de géométrie cylindrique. Fantômes de dimensions totales de φ40 x 12 mm ayant une tumeur au centre (φ20 x 6 mm) située à 3 mm de profondeur de la surface de la peau et entourée d’une région tissulaire normale. (A) Fantôme avec région tumorale ayant une distribution AuNR obtenue par injection IT. (B) Fantôme avec région tumorale ayant une distribution AuNR telle qu’obtenue par injection IV. Les emplacements des thermocouples sont représentés par (r, z), où r est l’emplacement radial et z est la profondeur de la surface. Abréviations : AuNRs = Nanotiges d’or ; IT = Intratumoral ; IV = Intraveineuse. Veuillez cliquer ici pour voir une version agrandie de cette figure.
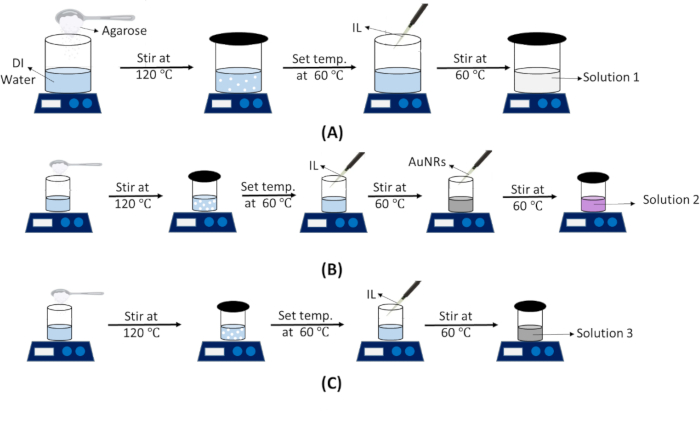
Figure 3 : Schéma montrant la préparation de diverses solutions fantômes. Étapes de préparation de (A) Solution fantôme de tissu normal (Solution 1). (B) Solution fantôme tumorale intégrée à AuNR (Solution 2). (C) Tumeur nue (sans AuNRs) solution fantôme (Solution 3). Abréviations : DI = Désionisé ; IL = Intralipide ; AuNRs = Nanotiges d’or. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Préparation de fantômes imitant le tissu tumoral avec distribution IT et IV. Fantômes d’un diamètre total de 40 mm et d’une profondeur de 12 mm, avec une région tumorale centrale souterraine de 20 mm de diamètre et 6 mm de profondeur, située à 3 mm sous la surface du fantôme/de la peau. Étapes courantes pour les fantômes IT et IV : (A) La solution 1 versée dans le moule cylindrique (fond scellé avec un parafilm), avec un moule de masquage placé au centre pour créer une cavité pour la région tumorale. (B) Solidification de la région tissulaire normale après l’élimination du moule de masquage (φ20 x 6 mm), créant une cavité pour la région tumorale. Étapes après A et B pour la préparation du fantôme IT : (C) La solution 2 versée dans la cavité pour former la région tumorale centrale intégrée avec des AuNRs pour la distribution IT. (D) La solution 1 s’est versée sur le fantôme solidifié pour finalement créer une tumeur souterraine intégrée avec des AuNR avec distribution IT, située à 3 mm sous la surface du fantôme. Étapes après A et B pour la préparation du fantôme IV ; (E) Petit moule de masquage (φ14 x 3 mm) placé dans la cavité centrale, avec la solution 2 versée autour de celui-ci pour former la région tumorale périphérique intégrée avec des AuNRs pour la distribution IV. (F) La solution 3 versée dans la cavité restante pour créer une région tumorale intégrée avec des AuNRs imitant la distribution IV. (G) La solution 1 versée sur le fantôme solidifié pour finalement créer une tumeur souterraine incrustée d’AuNRs avec distribution IV, située à 3 mm sous la surface du fantôme. (H) Fantômes disséqués montrant les dimensions de la tumeur, la distribution des AuNRs et la profondeur de la tumeur à partir de la surface du fantôme. Cette figure est tirée de Shaw et al.25. Abréviations : IT = Intratumoral ; IV = Intraveineuse ; AuNRs = Nanotiges d’or. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Configuration pour des expériences photothermiques sur des fantômes. (A) Insertion de thermocouples (type K) à divers endroits radiaux et axiaux à l’intérieur du fantôme. (B) Irradiation NIR des fantômes et surveillance ultérieure des températures à l’aide de thermocouples insérés. Cette figure est tirée de Shaw et al.25. Abréviation : NIR = Near-infrared. Veuillez cliquer ici pour voir une version agrandie de cette figure.
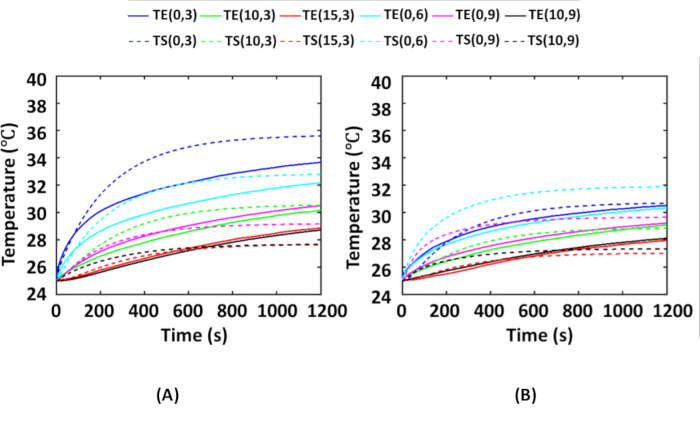
Figure 6 : Comparaison des résultats expérimentaux et simulés pour la validation des simulations numériques. Températures moyennes obtenues à divers emplacements de thermocouple sur des fantômes au cours de l’expérience photothermique comparées aux températures simulées correspondantes pour (A) la distribution IT et (B) la distribution IV. Les emplacements des thermocouples sont représentés par (r, z), qui représentent respectivement le rayon et la profondeur. La tumeur intégrée à AuNR située à 3 mm de profondeur dans le tissu est irradiée avec une intensité NIR de 0,25 W/cm2. Les lignes pleines et pointillées représentent respectivement les températures obtenues expérimentalement et les températures calculées par simulation. Cette figure est tirée de Shaw et al.25. Abréviations : IT = Intratumoral ; IV = Intraveineuse ; AuNRs = Nanotiges d’or ; NIR = Proche infrarouge ; TE = Températures expérimentales ; TS = Températures simulées. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| AuNRs Distribution | Erreur | T(0, 3) | T(10, 3) | T(15, 3) | T(0, 6) | T(0, 9) | T(10, 9) |
| Distribution informatique | MAE | 1.96 | 0.92 | 0.42 | 1.05 | 0.46 | 0.54 |
| RMSE | 2.1 | 1 | 0.55 | 1.13 | 0.62 | 0.6 | |
| Distribution IV | MAE | 0.43 | 0.36 | 0.36 | 1.9 | 1.12 | 0.44 |
| RMSE | 0.46 | 0.43 | 0.44 | 1.94 | 1.19 | 0.5 |
Tableau 1 : MAE et RMSE calculés pour la distribution IT et la distribution IV des AuNR à divers emplacements de thermocouple. Ce tableau est tiré de Shaw et al.25. Toutes les données sont exprimées en degrés Celsius (ºC). Abréviations : MAE = Erreur absolue moyenne ; EQM = Erreur quadratique moyenne ; IT = Intratumoral ; IV = Intraveineuse ; AuNRs = Nanotiges d’or.
Dossier supplémentaire 1 : A . Fichier STL pour le moule cylindrique de 40 mm x 12 mm. Veuillez cliquer ici pour télécharger ce fichier.
Dossier supplémentaire 2 : A . Fichier STL pour le moule de masquage de 20 mm x 6 mm. Veuillez cliquer ici pour télécharger ce fichier.
Dossier supplémentaire 3 : A . Fichier STL pour le moule de masquage de 14 mm x 3 mm. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Cet article présente le protocole pour la préparation de tissus tumoraux à base d’agarose imitant les fantômes optiques. Les fantômes sont conçus de manière à imiter les propriétés optiques de la tumeur et des tissus normaux pour leur utilisation dans les études de PPTT. Dans cette étude, l’application de ces fantômes pour la validation de méthodes numériques au cours de PPTT est mise en évidence. L’étape la plus critique de ce protocole consiste à maintenir la température des solutions fantômes contenant de l’agarose et de l’IL à 60 ºC sous agitation constante. Si la température dépasse 60 ºC, cela peut entraîner une dénaturation de l’IL, modifiant les propriétés optiques souhaitées du fantôme préparé. À l’inverse, si la température descend en dessous de 40 ºC, une gélification prématurée peut se produire, entraînant une distribution non uniforme du composant de diffusion (IL) et/ou du composant d’absorption (AuNRs)18.
Un autre aspect critique est le placement précis des thermocouples. Même une petite erreur de déplacement (à l’échelle millimétrique) peut avoir un impact significatif sur l’élévation de température mesurée. Pour éviter cela, l’utilisation de capillaires en verre est prescrite pour guider avec précision les thermocouples vers les emplacements spatiaux souhaités dans le fantôme. De plus, pour résoudre les erreurs potentielles dues à un mauvais placement du thermocouple, des évaluations photothermiques doivent être effectuées au moins en tripleexemplaire 25.
Les fantômes optiques à base d’agarose dont il est question dans cet article ont une courte durée de conservation utilisable ne dépassant pas 1 jour. Par conséquent, les expériences photothermiques doivent être menées le jour même de la préparation des fantômes. Cependant, dans des circonstances inévitables, pour prolonger leur durée de conservation, les fantômes doivent être placés dans une boîte de Pétri immédiatement après la solidification, scellés avec du parafilm et stockés à 4 ºC. Cela prolongera la facilité d’utilisation des fantômes pendant 2-3 jours. Une autre limite du protocole démontré est que les constituants fantômes ont été ajoutés à des concentrations basées sur la littérature disponible pour atteindre les μs’et μa) souhaitées. Nous avons supposé que les fantômes avec les propriétés optiques souhaitées étaient préparés. Cependant, les propriétés optiques des fantômes préparés n’ont pas été mesurées à l’aide d’une technique appropriée après leur préparation dans cette étude.
La préparation de fantômes optiques à base d’agarose est simple, rentable et rapide. Ces fantômes à base d’agarose peuvent être facilement coulés dans une variété de formes et de tailles ou de couches, si nécessaire à l’aide de moules appropriés. Les fantômes liquides et solides n’ont pas cette flexibilité19,38. Pendant l’irradiation proche infrarouge, la réponse photothermique des fantômes incorporés dans des nanoparticules a été évaluée à l’aide d’une surveillance de la température basée sur un thermocouple. Cette méthode offre plusieurs avantages par rapport à d’autres techniques, telles que la colorimétrie (limitée à la distinction des températures uniquement entre les valeurs minimales et maximales), la thermographie infrarouge (limitée à la détection de la température au niveau de la surface) et la thermométrie par résonance magnétique (coût élevé et complexité opérationnelle, ce qui la rend principalement adaptée aux applications in vivo)26. La surveillance par thermocouple offre une sensibilité (0,1 °C) et une précision élevées, la capacité de détecter les températures dans des endroits plus profonds, une rentabilité et une facilité d’utilisation, ce qui en fait un choix supérieur pour de telles évaluations basées sur le fantôme. De plus, la validation des simulations numériques par des expériences photothermiques sur des fantômes imitant les tissus tumoraux offre des avantages significatifs, c’est-à-dire qu’elle réduit le besoin de modèles in vivo comme les souris qui peuvent causer des douleurs et des souffrances inutiles. De plus, les évaluations basées sur des fantômes évitent les problèmes éthiques.
Dans cette étude, l’utilisation de fantômes optiques est mise en avant pour valider les simulations numériques en PPTT. Les fantômes imitant les tissus ont été préparés sur la base des données rapportées dans la littérature, en veillant à ce que les concentrations des constituants correspondent aux propriétés optiques souhaitées, en particulier en termes de réduction du coefficient de diffusion et du coefficient d’absorption. Bien que les propriétés optiques n’aient pas été mesurées directement dans cette étude, il est raisonnable de supposer que les fantômes préparés présentent les caractéristiques optiques prévues. Comme ces fantômes sont conçus pour imiter les propriétés optiques de tissus réels, ils peuvent servir de matériaux de référence pour l’étude du transport de la lumière dans les tissus biologiques, la validation de la précision des méthodes optiques dans la mesure de ces propriétés, l’évaluation des performances photothermiques de nouvelles nanostructures dans des conditions de simulation de tissus et la génération de données préliminaires pour guider la conception d’autresexpériences in vivo. 18,26.
Déclarations de divulgation
Les auteurs n’ont aucun intérêt concurrent à divulguer.
Remerciements
Cette étude a été menée sans aucun soutien financier d’organismes de financement publics, commerciaux ou à but non lucratif. Les auteurs remercient CSIR-Central Scientific Instruments Organisation, Chandigarh, Inde, pour son infrastructure et son soutien.
matériels
| Name | Company | Catalog Number | Comments |
| Agarose | Sigma-Aldrich | 9012-36-6 | Base matrix for phantoms |
| Deionized (DI) water (18.2 MΩ) | NA | NA | Solvent for the preparation of phantom solutions |
| Gold nanorods (AuNRs) | Nanopartz | A12-10-808 | Plasmonic nanoparticles |
| Intralipid (20% emulsion stock) | Sigma-Aldrich | 68890-65-3 | Scattering agent of phantoms |
| Parafilm | Parafilm M | 380020 | To seal the bottom of cylindrical mold |
| Polylactic acid filament | eSun | NA | Material for molds (1.75 mm dia wire) |
| Name of Equipment | Company | Catalog Number | Comments/Description |
| 3D Printer | Creality | Ender-3 | For printing molds |
| Data acquisition (DAQ) system | National Instruments | cDAQ-9171 | For recording temperatures |
| DI water unit | Merck Millipore | Direct-Q3 | For DI water |
| Hot plate with magnetic stirrer | IKA | C-MAG HS 4 | For phantom solutions preparation |
| NIR light source | NA (In-house developed) | NA | For NIR irradiation of phantoms, (800/50 nm; Center wavelength: 800 nm, Bandwidth: 50 nm) |
| Optical Fiber (1/2" × 12") | Edmund Optics | 38-659 | For NIR irradiation of phantoms |
| Type K thermocouples | RS Components | RS Pro 397-1589 | For temperature monitoring at various phantom locations during NIR irradiation |
| Weighing Balance | Wensar | PGB 200 | For weighing agarose |
| Name of Software | Company | Catalog Number | Comments/Description |
| Autodesk Inventor 2021 | Autodesk | NA | For mechanical designing of molds |
| Cura 5.7 | Ultimaker | NA | For converting mechanical design to Gcode for 3D printing |
| Matlab R2024b | MathWorks | NA | For numerical simulations and temperature data plots |
| Name of Labwares used | Company | Catalog Number | Comments/Description |
| Beakers (50 mL) | Borosil | 1000D12 | For phantom solution preparations |
| Beakers (10 mL) | Borosil | 1000006 | For phantom solution preparations |
| Pipette (100-1000 µL) | Eppendorf Research plus, 1-channel, variable | 3123 000 063 | For adding constituents into the phantom solution |
| Pipette (10-100 µL) | Eppendorf Research plus, 1-channel, variable | 3123 000 047 | For adding constituents into the phantom solution |
| Spatula | Borosil | LASC8888M06 | For weighing agarose and demolding the phantoms from the molds |
| Tips (100-1000 µL) | Tarsons | 521016 | For adding constituents into the phantom solution |
| Tips (10-100 µL) | Tarsons | 521010Y | For adding constituents into the phantom solution |
Références
- Riley, R. S., Day, E. S. Gold nanoparticle-mediated photothermal therapy: applications and opportunities for multimodal cancer treatment. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 9 (4), e1449(2017).
- Webb, J. A., Bardhan, R. Emerging advances in nanomedicine with engineered gold nanostructures. Nanoscale. 6 (5), 2502-2530 (2014).
- Abadeer, N. S., Murphy, C. J. Recent progress in cancer thermal therapy using gold nanoparticles. J Phys Chem C. 120 (9), 4691-4716 (2016).
- Murphy, C. J., et al. Virus-sized gold nanorods: Plasmonic particles for biology. Acc Chem Res. 52 (8), 2124-2135 (2019).
- Overchuk, M., Weersink, R. A., Wilson, B. C., Zheng, G. Photodynamic and photothermal therapies: Synergy opportunities for nanomedicine. ACS Nano. 17 (9), 7979-8003 (2023).
- Goldberg, S. N., Gazelle, G. S., Mueller, P. R. Thermal ablation therapy for focal malignancy. Am J Roentgenol. 174 (2), 323-331 (2000).
- Soni, S., Tyagi, H., Taylor, R. A., Kumar, A. Role of optical coefficients and healthy tissue-sparing characteristics in gold nanorod-assisted thermal therapy. Int J Hyperth. 29 (1), 87-97 (2013).
- Khurana, D., Vikas,, Shaw, A. K., Soni, S. Polydopamine coated gold nano blackbodies for tumor-selective spatial thermal damage during plasmonic photothermal cancer therapy. IEEE Trans Nanobiosci. 21 (4), 482-489 (2021).
- Jung, H. S., Verwilst, P., Sharma, A., Shin, J., Sessler, J. L., Kim, J. S. Organic molecule-based photothermal agents: an expanding photothermal therapy universe. Chem Soc Rev. 47 (7), 2280-2297 (2018).
- Ge, R. L., Yan, P. N., Liu, Y., Li, Z. S., Shen, S. Q., Yu, Y. Recent advances and clinical potential of near infrared photothermal conversion materials for photothermal hepatocellular carcinoma therapy. Adv Func Mater. 33 (29), 2301138(2023).
- Shabani, L., et al. An investigation into green synthesis of Ru template gold nanoparticles and the in vitro photothermal effect on the MCF-7 human breast cancer cell line. Appl Phys A. 129 (8), 564(2023).
- Mosleh-Shirazi, S., et al. Investigation through the anticancer properties of green synthesized spinel ferrite nanoparticles in present and absent of laser photothermal effect. Ceram Int. 49 (7), 11293-11301 (2023).
- Amani, A. M., et al. Innovation applications of MXenes in biomedicine. Mater Today Commun. 40, 109929(2024).
- Ali, M. R. K., Wu, Y., El-Sayed, M. A. Gold-nanoparticle-assisted plasmonic photothermal therapy advances toward clinical application. J Phys Chem C. 123 (25), 15375-15393 (2019).
- Lahonian, M., Golneshan, A. A. Numerical study of temperature distribution in a spherical tissue in magnetic fluid hyperthermia using Lattice Boltzmann method. IEEE Trans NanoBiosci. 10 (4), 262-268 (2011).
- Shaw, A. K., Soni, S. Role of periodic irradiation and incident beam radius for plasmonic photothermal therapy of subsurface tumors. J Therm Biol. 121, 103859(2024).
- Pogue, B. W., Patterson, M. S. Review of tissue simulating phantoms for optical spectroscopy, imaging and dosimetry. J Biomed Opt. 11 (4), 041102(2006).
- Mustari, A., et al. Agarose-based tissue mimicking optical phantoms for diffuse reflectance spectroscopy. J Vis Exp. (138), e57578(2018).
- Dabbagh, A., Abdullah, B. J. J., Ramasindarum, C., Abu Kasim, N. H. Tissue-mimicking gel phantoms for thermal therapy studies. Ultrason imaging. 36 (4), 291-316 (2014).
- Khurana, D., et al. Experimental investigation of photothermal conversion and thermal conductivity of broadband absorbing gold nanoblackbodies and graphene oxide nanoparticles for plasmonic photothermal cancer therapy. Int Commun Heat Mass Transf. 156, 107597(2024).
- Measurement of breast-tumor phantom dielectric properties for microwave breast cancer treatment evaluation. Ortega-Palacios, R., Leija, L., Vera, A., Cepeda, M. F. J. 2010 7th Int Conf Electr Eng Comput Sci Automatic Control, Tuxtla, Guterrez, Mexico, , 216-219 (2010).
- Wagnières, G., et al. An optical phantom with tissue-like properties in the visible for use in PDT and fluorescence spectroscopy. Phys Med Biol. 42 (7), 1415(1997).
- Didychuk, C. L., Ephrat, P., Chamson-Reig, A., Jacques, S. L., Carson, J. J. L. Depth of photothermal conversion of gold nanorods embedded in a tissue-like phantom. Nanotechnology. 20 (19), 195102(2009).
- Shaw, A. K., Khurana, D., Soni, S. Thermal damage analysis of sub-surface soft tissue sarcoma for Indocyanine Green mediated photothermal cancer therapy. Therm Sci Eng Prog. 46, 102168(2023).
- Shaw, A. K., Khurana, D., Soni, S. Assessment of thermal damage for plasmonic photothermal therapy of subsurface tumors. Phys Eng Sci Med. 47 (3), 1107-1121 (2024).
- Khurana, D., Soni, S. Tissue-mimicking phantoms for photothermal performance evaluations. Recent Trends in Cancer Therapeutics: Plasmonic Photothermal-Based Multimodal Cancer Therapy. , 109-136 (2024).
- Eranki, A., et al. Tissue-mimicking thermochromic phantom for characterization of HIFU devices and applications. Int J Hyperth. 36 (1), 517-528 (2019).
- McLaughlan, J. R. Controllable nucleation of cavitation from plasmonic gold nanoparticles for enhancing high intensity focused ultrasound applications. J Vis Exp. (140), e58045(2018).
- Soni, S., Tyagi, H., Taylor, R. A., Kumar, A. Experimental and numerical investigation of heat confinement during nanoparticle-assisted thermal therapy. Int Commun Heat Mass Transf. 69, 11-17 (2015).
- Ntombela, L., Adeleye, B., Chetty, N. Low-cost fabrication of optical tissue phantoms for use in biomedical imaging. Heliyon. 6 (3), e03602(2020).
- Lai, P., Xu, X., Wang, L. V. Dependence of optical scattering from Intralipid in gelatin-gel based tissue-mimicking phantoms on mixing temperature and time. J Biomed Opt. 19 (3), 035002(2014).
- Aernouts, B., Van Beers, R., Watté, R., Lammertyn, J., Saeys, W. Dependent scattering in Intralipid®phantoms in the 600-1850 nm range. Opt Express. 22 (5), 6086-6098 (2014).
- Tromberg, B. J., et al. Non-invasive in vivo characterization of breast tumors using photon migration spectroscopy. Neoplasia. 2 (1-2), 26-40 (2000).
- Kanick, S. C., et al. Scattering phase function spectrum makes reflectance spectrum measured from Intralipid phantoms and tissue sensitive to the device detection geometry. Biomed Opt Express. 3 (5), 1086-1100 (2012).
- Yuan, B., Chen, N., Zhu, Q. Emission and absorption properties of indocyanine green in Intralipid solution. J Biomed Opt. 9 (3), 497-503 (2004).
- Khurana, D., et al. Gold nanoblackbodies-based multifunctional nanocomposite for multimodal cancer therapy. Int J Pharm. 642, 123112(2023).
- Brough, D., Ramos, J., Delpech, B., Jouhara, H. Development and validation of a TRNSYS type to simulate heat pipe heat exchangers in transient applications of waste heat recovery. Int J Thermofluid. 9, 100056(2021).
- Vardaki, M. Z., Kourkoumelis, N. Tissue phantoms for biomedical applications in Raman spectroscopy: A review. Biomed Eng Computational Biol. 11, 1179597220948100(2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon