Method Article
全細胞パッチクランプ法 による H9c2心筋細胞の電位依存性カリウム電流記録
* これらの著者は同等に貢献しました
要約
本プロトコルは、全細胞パッチクランプ技術を使用して、H9c2心筋細胞における電位依存性カリウム(Kv)チャネル電流をリアルタイムかつ動的に取得するための効率的な方法を記載しています。
要約
心筋細胞膜上のカリウムチャネルは、細胞の電気生理学的活動の調節において重要な役割を果たす。主要なイオンチャネルの1つである電位依存性カリウム(Kv)チャネルは、薬物誘発性心筋損傷や心筋梗塞などのいくつかの深刻な心臓病と密接に関連しています。本研究では、全細胞パッチクランプ技術を使用して、H9c2心筋細胞のKvチャネル電流(IKv)に対する1.5 mM 4-アミノピリジン(4-AP、広域スペクトルカリウムチャネル阻害剤)およびアコニチン(AC、25 μM、50 μM、100 μM、および200 μM)の効果を決定しました。その結果、4-APはIKvを約54%阻害するが、ACのIKv阻害効果は用量依存的な傾向を示した(25μMでは効果なし、50μMでは30%の阻害率、100μMでは46%の阻害率、200μMでは54%の阻害率)を示した。本技術は、高感度・高精度という特性から、イオンチャネルを標的としたエスノメディシンの心毒性や薬理効果の探索を促進する。
概要
イオンチャネルは、細胞膜の脂質二重層に埋め込まれた特別な組み込みタンパク質です。活性化剤の存在下では、このような特殊な集積タンパク質の中心が選択性の高い親水性孔を形成し、適切なサイズと電荷のイオンが受動的な輸送様式で通過することを可能にします1。イオンチャネルは、細胞の興奮性と生体電気の基礎であり、さまざまな細胞活動において重要な役割を果たします2。心臓は、活動電位3によって開始される興奮収縮結合プロセスに起因する定期的な収縮を通じて他の臓器に血液を供給します。これまでの研究では、心筋細胞における活動電位の発生は細胞内イオン濃度の変化によって引き起こされ、ヒト心筋細胞におけるNa+、Ca2+、およびK+イオンチャネルの活性化および不活性化は、特定の配列で活動電位の形成につながることが確認されています4,5,6。電位依存性カリウム(Kv)チャネル電流(IKv)の乱れは、正常な心臓のリズムを変化させ、主要な死因の1つである不整脈を引き起こす可能性があります。したがって、IKvを記録することは、生命を脅かす不整脈を治療するための薬物のメカニズムを理解するために重要です7。
Kvチャネルはカリウムチャネルの重要な成分です。Kvチャネルの配位機能は、哺乳類の心臓の電気的活動および心筋収縮性において重要な役割を果たす8、9、10。心筋細胞では、活動電位の振幅と持続時間は、複数のKvチャネルサブタイプによる外向きのK+電流の共伝導に依存します11。Kvチャネル機能の調節は、心臓活動電位の正常な再分極にとって非常に重要です。Kvコンダクタンスのわずかな変化でさえ、心臓の再分極に大きな影響を与え、不整脈の可能性を高めます12,13。
細胞電気生理学的研究の基本的な方法である細胞膜の小さな領域と、全細胞パッチクランプ記録用のピペットチップとの間の高抵抗シールは、負圧を加えることによって確立することができる。連続的な負圧により、細胞膜がピペットチップに接触し、ピペットの内壁に付着します。結果として生じる完全な電気回路は、細胞膜14の表面を横切る任意の単一のイオンチャネル電流を記録することを可能にする。この技術は、細胞膜イオンチャネル電流に対して非常に高い感度を持ち、すべてのイオンチャネルの電流を検出するために使用でき、アプリケーションは非常に広いです15。さらに、蛍光標識や放射性標識と比較して、パッチクランプはより高い権威と精度を持っています16。現在、全細胞パッチクランプ技術は、Kvチャネル電流17,18,19に作用する伝統的な漢方薬成分を検出するために使用されています。例えば、Wangらは全細胞パッチクランプ技術を使用し、ハス種子の有効成分が活性化状態チャネル19を遮断することによってKv4.3チャネルの阻害を達成する可能性があることを確認した。アコニチン(AC)は、トリカブトカーミカエリデブックスやトリカブト振り子ブッシュなどのトリカブト種の効果的で有効成分の1つです。多くの研究は、ACの過剰摂取が不整脈や心停止さえ引き起こす可能性があることを示しています20。ACと電位依存性イオンチャネル間の相互作用は、心毒性の重要なメカニズムである細胞内イオン恒常性の破壊につながります21。したがって、この研究では、全細胞パッチクランプ技術を使用して、心筋細胞のIKvに対するACの影響を決定します。
プロトコル
市販のH9c2ラット心筋細胞( 材料の表を参照)を、10%熱不活化ウシ胎児血清(FBS)および1%ペニシリン-ストレプトマイシンを含むDMEM中で、5%CO2加湿雰囲気中で37°Cでインキュベートした。次に、全細胞パッチクランプ技術を使用して、正常なH9c2細胞および4-APまたはAC処理細胞におけるIKv の変化を検出しました(図1 および 図2)。
1. 溶液調製
- 10%FBSおよび1%ペニシリン-ストレプトマイシンを含むDMEM細胞培養培地を調製します(材料表を参照)。
- 100 μLのDMSO溶液に14.1165 mgの4-APを加えて、1.5 M 4-AP溶液を調製します( 材料の表を参照)。細胞外溶液を添加して1.5 M 4-APを1.5 mMに希釈する(ステップ1.5)。
- 19.36 μLのDMSO溶液に5 mgのACを加えて、400 mM ACを調製します(材料の表を参照)。
注意: 上記の溶液はすべて4°Cの冷蔵庫に保管されており、DMSOの最終濃度は0.1%(v / v)を超えてはなりません。 - 50 mLの二重蒸留水に0.4100 gのKCl(110.0 mM)、0.0120 gのMgCl 2(1.2 mM)、0.1270 gのNa2 ATP(5.0 mM)、0.1190 gのHEPES(10.0 mM)、および0.1900 gのEGTA(10.0 mM)を加えて、50 mLの細胞内溶液を調製します(表1および材料表を参照)。
注:細胞内溶液のpH値は、1 M KOHを使用して7.2に調整され、少量(1.5〜2 mL)に分注され、-20°Cで保存されました。 - 50 mLの二重蒸留水に0.0185 gのKCl(5.0 mM)、0.3945 gのNaCl(135.0 mM)、0.0203 gのMgCl 2·6H2O(2.0 mM)、0.0595 gのHEPES(5.0 mM)、および0.0990 gのD-グルコース(10.0 mM)を加えて、50 mLの細胞外溶液を調製します( 表1 および 材料表を参照)。
注:細胞外溶液はすぐに使用できるように準備する必要があり、そのpH値は1 M NaOHを使用して7.4に調整する必要があります。
2. 細胞培養
- H9c2培養皿が80%コンフルエントになったら、細胞を0.25%トリプシンで30秒間消化します。
- 2 x 10 5細胞/mLを、ガラス板を敷いた35 mmディッシュで、ガラス板を敷いた35 mmディッシュで、5 %のCO2雰囲気と70%から80%の相対湿度で、通常の培地または薬物含有培地(25 μM、50 μM、100 μM、および200 μM AC)で培養します( 材料の表を参照)。
3. マイクロピペットの製作
- マイクロピペットプラーの電源を入れ( 材料の表を参照)、30分間予熱します。
- フィラメント付きのホウケイ酸ガラスキャピラリー(OD:1.5 mm、ID:1.10 mm、長さ10 cm)をマイクロピペットプーラーに置きます。手順3.3で設定したプログラムを選択し、コントロールパネルの Enter をクリックします。右上隅にある ランプ プログラムをクリックして、ガラスキャピラリーの「熱」値を決定します。
- 「ランプ」テストで決定された値に従って電極を引っ張るためのプログラムを作成し、次の手順を使用します:「熱」値=「ランプ」値、引っ張り= 0、Vel=引っ張りロッドの移動速度、時間= 200-250。 プル をクリックして、ピペットの製造を開始します。
注意: 使用する前に、マイクロピペットプラーの密閉容器内の乾燥剤の色を観察してください。色が青からピンクに変わった場合は、乾燥剤を交換する必要があります。電極チップの汚染を防ぐために、ピペットの準備中はガラスキャピラリーの中央部分に触れないようにしてください。その後、作製したピペットを慎重に取り出し、密閉容器に入れます。
4. 機器のセットアップ
- 対応する機器の電源を、デジタル-アナログコンバーター、信号増幅器、マイクロマニピュレーター、顕微鏡、カメラの順にオンにします( 材料表を参照)。
- イメージングアプリケーション、信号増幅ソフトウェア、およびデータ集録ソフトウェアを順番に開きます(材料表を参照)。
注意: 機器は順番にオンにする必要があります。それ以外の場合は、ソフトウェアを開いた後に「デモデジタイザ」状態が表示されます。
5. IKv パラメータ設定
- 以下の手順に従って、IKv を記録するためのプロトコルを編集します。
- [ 編集]をクリックし、データ収集ソフトウェアで [プロトコルの編集 ]を選択します( 材料表を参照)。
- 「波形」インターフェースでプログラムを編集します:エポックA(第1レベル= −60 mV、デルタレベル= 0 mV、第1持続時間 = 20 ミリ秒、デルタ持続時間 = 0 ミリ秒)。エポックB(第1レベル= −40 mV、デルタレベル= 10 mV、第1持続時間 = 150ミリ秒、デルタ持続時間 = 0ミリ秒)、およびエポックC(第1レベル= −60 mV、デルタレベル= 0 mV、第1持続時間 = 30ミリ秒、デルタ持続時間 = 0ミリ秒)。
- 次に、モード/レートインターフェイスをクリックし、「トライアル階層」データを設定します:トライアル遅延= 0秒、実行= 1、スイープ= 11、スイープ期間= 0.22秒22,23。
注:制御条件下で−60mVの保持電位で−40mVから+60mVまで150msの脱分極ステップを10mV刻みで印加することにより、IKv チャネル電流を取得します。プロトコルの合計時間は、「波形」プログラムで設定された時間よりも長くする必要があります。
- P/Nリークサブトラクションプログラムの編集: プロトコルの編集 をクリックして 刺激 ボタンを選択し、 P/N リークサブトラクションダイアログボックスでリークサブトラクションプログラムを設定します:サブスイープの数= 2-8(この研究では4)、セトリング時間= 100-1,000ミリ秒(この研究では200)、 "極性" = "波形と反対"、保持レベル= -80 mV。
注意: P / Nリーク減算の保持レベルは、「最初の保持」(-60mV)よりも低くする必要があります。
6.電圧クランプモードでのI Kv の全セルパッチクランプ記録
- データストレージパスを確立します: ファイルをクリックし、データ集録ソフトウェアで [データファイル名の設定 ]を選択します。確立されたIKv プロトコル(ステップ5.1)を開くには、[ 編集 ]を選択し、データ収集ソフトウェアの [プロトコルを開く ]をクリックします。最後に、[ ツール ]オプションをクリックし、[ メンブレンテスト ]を選択してプロトコルの実行を開始します。
- 細胞外溶液(ステップ1.5)を全細胞パッチクランプ装置( 材料表参照)の細胞浴に加え、H9c2細胞(ステップ2.1で培養)と一緒にカバーガラスを上向きに置きます。
- ステップ3で作製したピペットの30%を細胞外溶液で満たし、パッチクランプ装置に内蔵した記録電極ホルダーに取り付けます。Oリングゴム製ガスケットとプラスチックワッシャーでピペットを締めます。次に、マイクロマニピュレーターでピペットをバスに落とします。信号増幅器ソフトウェアの ピペットオフセット インターフェース( 材料表を参照)をクリックして、IKv 電流ベースラインを0pAに維持します。
注:細胞内溶液(ステップ1.4)は、銀線のAgCl / Ag部分と接触している必要があり、銀線はピペットの内壁に近づいてはいけません。ピペットの抵抗は2〜6MΩである必要があります。ピペットチップの閉塞を避けるために、プラスチックチューブ24を介して記録電極ホルダーに接続された1.0mLシリンジを使用して、連続的な陽圧をピペットに送達しなければならない。 - プラスチックチューブを介して記録電極ホルダーに接続された1.0 mLシリンジを使用して、適切な陽圧を手動で供給します。マイクロマニピュレーターを3次元で操作してピペットを少し動かし、細胞に接触させます。
- ピペットが細胞膜に触れた後、膜試験の方形波が1/3から1/2低下したら、陽圧を取り除き、手動で適切な負圧を供給します。次に、データ収集ソフトウェアのパッチインターフェースをクリックして、GΩシールを形成します。セルのシーリング中に「C p Fast」および「Cp Slow」信号増幅器ソフトウェアを使用して、高速および低速の容量を補償します。
注:メンブレンテストが≥1GΩの場合、ピペットチップとセルの間にセル結合構成が形成されます。 - 負圧の短いパルスを適用して、細胞膜のパッチを破裂させます。
注:膜抵抗の急激な減少は、成功した全細胞記録パターンを特徴づけます。アクセス抵抗(Ra)が≥30MΩの場合、ステップ6.3〜6.6でセルを再選択する必要があります。記録されたIKv データの精度を確保するために、細胞膜が破壊された後に負圧を除去する必要があります。 - 信号増幅器ソフトウェアの Whole-Cell ボタンをクリックして、全細胞膜容量補償を実行します。最後に、[データ記録]ボタンをクリックしてデータを保存および 記録 します。
- 保存したIKvデータをデータ解析ソフトで開きます。電流と電圧(I−V)の関係を保存する:分析をクリックして統計を選択し、次のことを行います:データ分析のために範囲をCousors 1,2として選択します。[ピーク振幅]ボタンと[平均]ボタンをクリックし、[OK]をクリックして[結果]ページにデータを表示します。最後に、IKv平均データの列を関数描画ソフトウェア(材料表を参照)にコピーして、さらに分析します。
- 代表的なIKv現在のトレースを保存します:編集をクリックしてトレースの転送を選択します。次に、転送するリージョンで完全なトレースを選択します。次に、トレース選択で選択をクリックし、信号でIN 0(pA)を選択します。最後に、[OK]をクリックして[結果]ページにデータを表示し、合計データを関数描画ソフトウェアにコピーして現在のトレースを描画します。
- IKv プロトコルを保存します: 編集 をクリックして 刺激波形信号の作成を選択し、 OKを選択します。次に、「シグナル」で A0#0(mA) を選択した以外はステップ6.9をやり直す。
結果
このプロトコルにより、全細胞パッチクランプ技術で設定されたパラメータに従ってIKvを記録することができました。IKvは、−60mVの保持電位で−40〜+60mVの150msの脱分極パルス刺激によってトリガーされました(図3A)。H9c2ラット心筋細胞のIKvは、最初に約-20 mVで出現し、その後、振幅はさらなる脱分極とともに増加しました。なお、IKvと膜電位との平均関係は、測定された電流振幅から算出した。結果は、対照群と比較して、1.5mM 4-APによる5分間の処理後にIKv振幅が観察可能に減少したことを示した(図3B)。さらに、IKvは、24時間AC処理後、線量依存的に膜電位が10mVから60mVに有意に減少しました(図3C-F)。

図1:I Kvを記録するために必要な機器と機器。 この図の拡大版を表示するには、ここをクリックしてください。

図2:全細胞パッチクランプ技術を用いたH9c2細胞におけるIKvの電気生理学的記録のフローチャート。 (A)細胞培養。(b)細胞内および細胞外溶液の調製。(C)全細胞記録の概略図。C1:ピペットをセルに近づけます。C2:ピペットとセルの間に高抵抗シールを形成します。C3:細胞膜を破裂させる。(D)IKvを記録します。D1:K+電流形成の模式図。D2:全セル電圧クランプモードで記録されたIKvの代表的な電流トレース。この図の拡大版を表示するには、ここをクリックしてください。
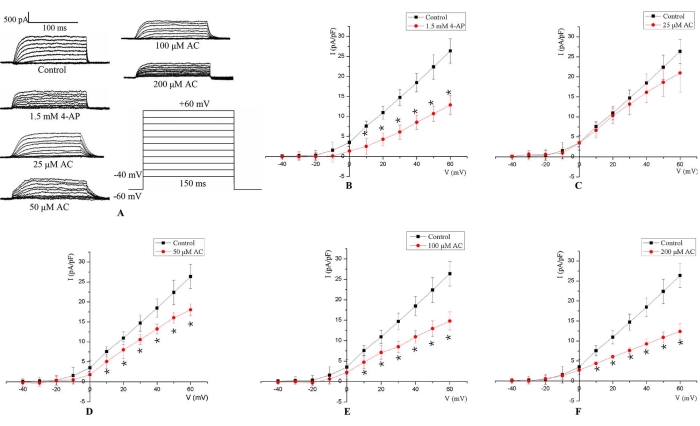
図3:H9c2細胞 における代表IKv。(A)無処理のH9c2細胞(対照群)で、AC含有培地で24時間(25 μM、50 μM、100 μM、200 μM)、および1.5 mM 4-APで5分間測定したIKvの代表的な電流トレース。IKvは、−60mVの保持電位で−40mVから+60mVまでの150msの脱分極パルスによってトリガーされました。(B)1.5 mM 4-AP刺激では、IKvは膜電位で10 mVから60 mVに下降した。(C-F)AC処理は、膜電位で濃度依存的にIKvを10mVから60mVに減少させた。*p<対照群に対して0.05(n = 6)。この図の拡大版を表示するには、ここをクリックしてください。
| 細胞外溶液 | ||
| 化学薬品 | g/50 mL | 組成(ミリオン) |
| ナトリウム | 0.3945 | 135.0 |
| KCl | 0.1865 | 5.0 |
| ヘペス | 0.5958 | 5.0 |
| MgCl 2·6H2O | 0.2033 | 2.0 |
| D-グルコース | 0.9900 | 10.0 |
| 細胞内溶液 | ||
| 化学薬品 | g/50 mL | 組成(ミリオン) |
| KCl | 0.4100 | 110.0 |
| マグネシウム2 | 0.0120 | 1.2 |
| Na2-ATP | 0.1270 | 5.0 |
| ヘペス | 0.1190 | 10.0 |
| エグタ | 0.1900 | 10.0 |
表1:電圧クランプモードでIKv を記録するための細胞内および細胞外溶液。
ディスカッション
パッチクランプ電気生理学的技術は、主に、細胞膜25上のイオンチャネルの電気的活動および機能的特性を記録および反映するために使用される。現在、パッチクランプ技術の主な記録方法には、シングルチャネル記録と全セル記録26が含まれます。全セルモードの場合、ガラス微小電極および負圧を使用して、細胞膜の小さな領域とピペットチップ27との間に高抵抗シールを形成する。持続的な負圧によりピペットの先端が細胞膜を破裂させ、膜がピペットの内壁に付着すると、ピペットと細胞の間に形成される完全な電気回路により、細胞膜表面上の個々のイオンチャネルの電流密度を記録することができます26,27.近年、全細胞パッチクランプ法は、イオンチャネル関連疾患を標的とした創薬研究に広く用いられている。オペレーターには高い要件がありますが、この技術は依然としてイオンチャネル研究の「ゴールドスタンダード」のままです28。加えて、穿孔パッチクランプ技術は、抗生物質を使用して細胞膜29,30に透過性孔を形成することにより、比較的安定した細胞内環境における標的イオンチャネルにおける電流変化を長期間にわたって記録することもできる。電流クランプまたは電圧クランプモードで全細胞パッチクランプ技術を使用して、イオンチャネルの電圧または電流の動的変化を記録および追跡できるため、これは間違いなく薬物の薬理学的活性または毒性メカニズムを評価するための強力なプラットフォームになります31,32。
ACはトリカブト種の主要な毒性成分の1つであり、ジエステル-ジテルペノイドアルカロイドのグループに属し、非常に有毒です20,33。証拠は、ACが心血管毒性を引き起こす可能性があることを示しています34,35。非選択的K +チャネル遮断薬として、ACは過渡的な外向きのK +電流、超高速遅延整流器のK +電流、および高速遅延整流器の外向きのK +電流を遮断し、不整脈を誘発できることが報告されています21,36,37。今日まで、電位依存性カリウム電流がACの心毒性に関与しているという強力な証拠はありません。そこで本研究では、ラットH9c2心筋細胞におけるIKvに対するACの阻害効果を全細胞パッチクランプ法を用いて検討した。Na+チャネルの活性化は、ACが薬理学的または毒物学的効果を発揮する広く認識されているメカニズムです38。興味深いことに、ACがIKv 21,36,37に直接作用できるという証拠があります。ただし、この論文で提示されたデータは、ACがIKvを直接阻害できるという十分な証拠を提供していません。ACのIKv阻害効果は、Na+チャネルの直接活性化に起因する可能性があり、さらなる調査が必要です。
この研究で使用された全細胞パッチクランプ技術は、その開始と開発以来、イオンチャネルの観点から薬物の心毒性を探索するための従来の方法になりました。この実験により、ACは電圧クランプモードで濃度依存的にH9c2細胞のIKvを効果的に阻害することを確認しました。ただし、K+チャネルを含む各タイプのイオンチャネルにはいくつかのサブタイプが含まれており、この研究では電圧に依存するK+チャネル電流の合計のみが記録されました。その後の研究では、特定のイオンチャネルサブタイプを高発現するモデル細胞株を使用して、ACの薬理学的および毒物学的メカニズムを探求することができます37。あるいは、蛍光タンパク質で標識された特定のイオンチャネルを組み込んで、ACの心筋毒性を視覚的に調べることができる39。このプロトコルの重要なステップはステップ6.4-6.6です。これらの3つのステップを完了すると、その後のIKvの記録が成功するかどうかが直接決定されます。他の技術と比較して、全細胞パッチクランプ技術は、細胞膜またはオルガネラ膜の単一イオンチャネルに電流を記録するためのゴールドスタンダードで受け入れられている方法であり、高い技術的要件と低スループットの記録の特徴を備えています40。要約すると、この技術は細胞電気生理学研究の基本的な方法であるだけでなく、神経科学、循環器科学、およびその他の分野でも広く使用されています。
開示事項
著者は開示するものは何もありません。
謝辞
中国国家自然科学基金会(82130113)および青海省科学技術部の主要研究開発および変革プログラム(2020-SF-C33)からの財政的支援に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 4-Aminopyridine | Sigma | MKCJ2184 | |
| Aconitine | Chengdu Lemetian Medical Technology Co., Ltd | DSTDW000602 | |
| Amplifier | Axon Instrument | MultiClamp 700B | |
| Analytical Balance | Sartorius | 124S-CW | |
| ATP Na2 | Solarbio | 416O022 | |
| Borosilicate glass with filament (O.D.: 1.5 mm, I.D.: 1.10 mm, 10 cm length) | Sutter Instrument | 163225-5 | |
| Cell culture dish (100 mm) | Zhejiang Sorfa Life Science Research Co., Ltd | 1192022 | |
| Cell culture dish (35 mm) | Zhejiang Sorfa Life Science Research Co., Ltd | 3012022 | |
| Clampex software | Molecular Devices, LLC. | Version 10. 5 | |
| Clampfit software | Molecular Devices, LLC. | Version 10. 6. 0. 13 | data acqusition software |
| D-(+)-glucose | Rhawn | RH289133 | |
| Digital camera | Hamamatsu | C11440 | |
| Digitizer | Axon Instrument | Axon digidata 1550B | |
| DMSO | Boster Biological Technology Co., Ltd | PYG0040 | |
| Dulbecco's modified eagle medium (1x) | Gibco | 8121587 | |
| EGTA | Biofroxx | EZ6789D115 | |
| Fetal bovine serum | Gibco | 2166090RP | |
| Flaming/brown micropipette puller | Sutter Instrument | Model P-1000 | |
| H9c2 cells | Hunan Fenghui Biotechnology Co., Ltd | CL0111 | |
| HCImageLive | Hamamatsu | 4.5.0.0 | |
| HCl | Sichuan Xilong Scientific Co., Ltd | 2106081 | |
| HEPES | Xiya Chemical Technology (Shandong) Co., Ltd | 20210221 | |
| KCl | Chengdu Colon Chemical Co., Ltd | 2020082501 | |
| KOH | Chengdu Colon Chemical Co., Ltd | 2020112601 | |
| MgCl2 | Tianjin Guangfu Fine Chemical Research Institute | 20160408 | |
| MgCl2·6H2O | Chengdu Colon Chemical Co., Ltd | 2021020101 | |
| Micromanipulator | Sutter Instrument | MP-285A | |
| Microscope | Olympus | IX73 | |
| Microscope cover glass (20 × 20 mm) | Jiangsu Citotest Experimental Equipment Co. Ltd | 80340-0630 | |
| Milli-Q | Chengdu Bioscience Technology Co., Ltd | Milli-Q IQ 7005 | |
| MultiClamp 700B commander | Axon Instrument | MultiClamp commander 2.0 | signal-amplifier software |
| OriginPro 8 software | OriginLab Corporation | v8.0724(B724) | |
| Penicillin-Streptomycin (100x) | Boster Biological Technology Co., Ltd | 17C18B16 | |
| PH meter | Mettler Toledo | S201K | |
| Phosphate buffered saline (1x) | Gibco | 8120485 | |
| Trypsin 0.25% (1x) | HyClone | J210045 |
参考文献
- Luan, Q. H. Passive transport and ion channels in biofilms. Acta Scientiarum Naturalium Universitatis Intramongoljcae. 2, 215-235 (1984).
- Lei, M., Sun, S. Advances in the mechanism of arrhythmia induced by sodium channel disease. Journal of Clinical Cardiology. 21 (4), 246-248 (2005).
- Varró, A., et al. Cardiac transmembrane ion channels and action potentials: Cellular physiology and arrhythmogenic behavior. Physiological Reviews. 101 (3), 1083-1176 (2021).
- Campuzano, O., et al. Negative autopsy and sudden cardiac death. International Journal of Legal Medicine. 128 (4), 599-606 (2014).
- Amin, A. S., Asghari-Roodsari, A., Tan, H. L. Cardiac sodium channelopathies. Pflügers Archiv: European Journal of Physiology. 460 (2), 223-237 (2010).
- Benitah, J. P., et al. Voltage gated Ca2+ currents in the human pathophysiologic heart: A review. Basic Research in Cardiology. 97 (1), 111-118 (2002).
- Banyasz, T., Horvath, B., Jian, Z., Izu, L. T., Chen-Izu, Y. Sequential dissection of multiple ionic currents in single cardiac myocytes under action potential-clamp. Journal of Molecular and Cellular Cardiology. 50 (3), 578-581 (2011).
- Nerbonne, J. M. Molecular basis of functional myocardial potassium channel diversity. Cardiac Electrophysiology Clinics. 8 (2), 257-273 (2016).
- Grant, A. O. Cardiac ion channels. Circulation: Arrhythmia and Electrophysiology. 2 (2), 185-194 (2009).
- Olson, T. M., et al. Kv1.5 channelopathy due to KCNA5 loss-of-function mutation causes human atrial fibrillation. Human Molecular Genetics. 15 (14), 2185-2191 (2006).
- Christophersen, I. E., et al. Genetic variation in KCNA5: impact on the atrial-specific potassium current IKur in patients with lone atrial fibrillation. European Heart Journal. 34 (20), 1517-1525 (2013).
- Barry, D. M., Xu, H., Schuessler, R. B., Nerbonne, J. M. Functional knockout of the transient outward current, long-QT syndrome, and cardiac remodeling in mice expressing a dominant-negative Kv4 alpha subunit. Circulation Research. 83 (5), 560-567 (1998).
- Abbott, G. W., Xu, X., Roepke, T. K. Impact of ancillary subunits on ventricular repolarization. Journal of Electrocardiology. 40, 42-46 (2007).
- Jia, W. J., et al. Recent studies on the application of patch-clamp technique in cellular electrophysiology. Journal of Chemical Engineering of Chinese Universities. 32 (4), 767-778 (2018).
- Leuthardt, E. C., et al. Using the electrocorticographic speech network to control a brain-computer interface in humans. Journal of Neural Engineering. 8 (3), 1-3 (2011).
- Tian, J. The applying progress of patch-clamp technique. Journal of Jilin Medical University. 4, 227-229 (2008).
- Wang, Z. Q., et al. Effects of shensong yangxin capsule on c-type Kv1.4 potassium channel. Chinese Heart Journal. 21 (6), 782-785 (2009).
- Huang, X. Y. The effect of resveratrol on Kv2.1 potassium channels in cardiac myocytes. Chinese Journal of Cardiac Pacing and Electrophysiology. 34 (5), 484-487 (2020).
- Wang, C., et al. Effects of neferine on Kv4.3 channels expressed in HEK293 cells and ex vivo electrophysiology of rabbit hearts. Acta Pharmacologica Sinica. 36 (12), 1451-1461 (2005).
- Gao, Y., et al. Aconitine: A review of its pharmacokinetics, pharmacology, toxicology and detoxification. Journal of Ethnopharmacology. 293, 115270 (2022).
- Zhou, W., et al. Cardiac efficacy and toxicity of aconitine: A new frontier for the ancient poison. Medicinal Research Reviews. 41 (3), 1798-1811 (2021).
- An, J. R., et al. The effects of tegaserod, a gastrokinetic agent, on voltage-gated K+ channels in rabbit coronary arterial smooth muscle cells. Clinical and Experimental Pharmacology & Physiology. 48 (5), 748-756 (2021).
- Sun, Q., Liu, F., Zhao, J., Wang, P., Sun, X. Cleavage of Kv2.1 by BACE1 decreases potassium current and reduces neuronal apoptosis. Neurochemistry International. 155, 105310 (2022).
- Manz, K. M., Siemann, J. K., McMahon, D. G., Grueter, B. A. Patch-clamp and multi-electrode array electrophysiological analysis in acute mouse brain slices. STAR Protocols. 2 (2), 100442 (2021).
- Kanda, H., Tonomura, S., Dai, Y., Gu, J. G. Protocol for pressure-clamped patch-clamp recording at the node of Ranvier of rat myelinated nerves. STAR Protocols. 2 (1), 100266 (2021).
- Ma, J., et al. High purity human-induced pluripotent stem cell-derived cardiomyocytes: electrophysiological properties of action potentials and ionic currents. American Journal of Physiology-Heart and Circulatory Physiology. 301 (5), 2006-2017 (2011).
- Yoshimura, M., et al. Application of in vivo patch-clamp technique to pharmacological analysis of synaptic transmission in the CNS. Nihon Yakurigaku Zasshi. Folia Pharmacologica Japonica. 124 (2), 111-118 (2004).
- Aziz, Q., Nobles, M., Tinker, A. Whole-cell and perforated patch-clamp recordings from acutely-isolated murine sinoatrial node cells. Bio-protocol. 10 (1), 3478 (2020).
- Witchel, H. J., Milnes, J. T., Mitcheson, J. S., Hancox, J. C. Troubleshooting problems with in vitro screening of drugs for QT interval prolongation using HERG K+ channels expressed in mammalian cell lines and Xenopus oocytes. Journal of Pharmacological and Toxicological Methods. 48 (2), 65-80 (2002).
- Rodriguez-Menchaca, A. A., Ferrer, T., Navarro-Polanco, R. A., Sanchez-Chapula, J. A., Moreno-Galindo, E. G. Impact of the whole-cell patch-clamp configuration on the pharmacological assessment of the hERG channel: Trazodone as a case example. Journal of Pharmacological and Toxicological Methods. 69 (3), 237-244 (2014).
- Yang, S., Liu, Z. W., Zhang, Y. X. The development of in vivo patch clamp technique. Chinese Remedies & Clinics. 5, 399-401 (2003).
- Lin, Y. F., Ouyang, S. Research progress and application of patch clamp technique. Strait Pharmaceutical Journal. 9, 8-11 (2008).
- Li, S., et al. An insight into current advances on pharmacology, pharmacokinetics, toxicity and detoxification of aconitine. Biomedicine & Pharmacotherapy. 151, 113115 (2022).
- Chan, T., Chan, J., Tomlinson, B., Critchley, J. Chinese herbal medicines revisited: A Hong Kong perspective. Lancet. 342 (8886-8887), 1532-1534 (1993).
- Jiang, H., Zhang, Y. T., Zhang, Y., Wang, X. B., Meng, X. L. An updated meta-analysis based on the preclinical evidence of mechanism of aconitine-induced cardiotoxicity. Frontiers in Pharmacology. 13, 900842 (2022).
- Liu, Y. Myocardial toxicity of aconite alkaloids. Shenyang Pharmaceutical University. , (2007).
- Li, Y., et al. Aconitine blocks HERG and Kv1.5 potassium channels. Journal of Ethnopharmacology. 131 (1), 187-195 (2010).
- Campbell, D. T. Modified kinetics and selectivity of sodium channels in frog skeletal muscle fibers treated with aconitine. The Journal of General Physiology. 80 (5), 713-731 (1982).
- Huang, X. Y., Ying, Y. C. The effect of specific protein 1 on Kv2.1 potassium channel in cardiac myocytes. Journal of Electrocardiology and Circulation. 39 (4), 338-341 (2020).
- Cao, J. B. Development and application of patch clamp technique. Journal of Yuncheng University. 27 (2), 53-55 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved