Method Article
Registro de corriente de potasio dependiente del voltaje en cardiomiocitos H9c2 mediante la técnica de pinza de parche de células enteras
* Estos autores han contribuido por igual
En este artículo
Resumen
El presente protocolo describe un método eficiente para la adquisición dinámica y en tiempo real de corrientes de canal de potasio (Kv) dependientes de voltaje en cardiomiocitos H9c2 utilizando la técnica de pinza de parche de células enteras.
Resumen
Los canales de potasio en la membrana celular miocárdica juegan un papel importante en la regulación de las actividades electrofisiológicas celulares. Al ser uno de los principales canales iónicos, los canales de potasio dependientes de voltaje (Kv) están estrechamente asociados con algunas enfermedades cardíacas graves, como el daño miocárdico inducido por medicamentos y el infarto de miocardio. En el presente estudio, se empleó la técnica de patch-clamp de células enteras para determinar los efectos de 1,5 mM 4-aminopiridina (4-AP, un inhibidor de los canales de potasio de amplio espectro) y aconitina (AC, 25 μM, 50 μM, 100 μM y 200 μM) sobre la corriente del canal Kv (IKv) en cardiomiocitos H9c2. Se encontró que la 4-AP inhibió el I Kv en aproximadamente un 54%, mientras que el efecto inhibitorio de la CA sobre el IKv mostró una tendencia dependiente de la dosis (ningún efecto para 25 μM, tasa inhibitoria del 30% para 50 μM, tasa inhibitoria del 46% para 100 μM y tasa inhibitoria del 54% para 200 μM). Debido a las características de mayor sensibilidad y precisión, esta técnica promoverá la exploración de la cardiotoxicidad y los efectos farmacológicos de la etnomedicina dirigida a los canales iónicos.
Introducción
Los canales iónicos son proteínas integradas especiales incrustadas en la bicapa lipídica de la membrana celular. En presencia de activadores, los centros de tales proteínas integradas especiales forman poros hidrófilos altamente selectivos, permitiendo que iones de un tamaño y carga apropiados pasen a través de una manera de transporte pasivo1. Los canales iónicos son la base de la excitabilidad celular y la bioelectricidad y desempeñan un papel clave en una variedad de actividades celulares2. El corazón suministra sangre a otros órganos a través de contracciones regulares resultantes de un proceso acoplado excitación-contracción iniciado por potenciales de acción3. Estudios previos han confirmado que la generación de potenciales de acción en los cardiomiocitos es causada por el cambio en la concentración de iones intracelulares, y la activación e inactivación de los canales iónicos Na+, Ca2+ y K+ en los cardiomiocitos humanos conducen a la formación de potenciales de acción en una cierta secuencia 4,5,6. Las corrientes alteradas del canal de potasio (Kv) dependientes de voltaje (IKv) podrían cambiar el ritmo cardíaco normal, lo que lleva a arritmias, que son una de las principales causas de muerte. Por lo tanto, el registro del IKv es crítico para comprender los mecanismos de los fármacos para el tratamiento de arritmias potencialmente mortales7.
El canal Kv es un componente importante del canal de potasio. La función de coordinación del canal Kv juega un papel importante en la actividad eléctrica y la contractilidad miocárdica del corazón de los mamíferos 8,9,10. En los cardiomiocitos, la amplitud y la duración de los potenciales de acción dependen de la coconducción de las corrientes K+ hacia el exterior por múltiples subtipos de canales Kv11. La regulación de la función del canal Kv es muy importante para la repolarización normal del potencial de acción cardíaco. Incluso el más mínimo cambio en la conductancia del Kv afecta en gran medida la repolarización cardíaca y aumenta la posibilidad de arritmia12,13.
Representando un método fundamental en la investigación electrofisiológica celular, se puede establecer un sello de alta resistencia entre un área pequeña de la membrana celular y una punta de pipeta para el registro de pinza de parche de células enteras aplicando una presión negativa. La presión negativa continua hace que la membrana celular entre en contacto con la punta de la pipeta y se adhiera a la pared interna de la pipeta. El circuito eléctrico completo resultante permite registrar cualquier corriente de canal iónico a través de la superficie de la membrana celular14. Esta técnica tiene una sensibilidad muy alta para la corriente del canal iónico de la membrana celular y se puede utilizar para detectar corrientes en todos los canales iónicos, y las aplicaciones son extremadamente amplias15. Además, en comparación con el etiquetado fluorescente y el etiquetado radiactivo, la pinza de parche tiene mayor autoridad y precisión16. En la actualidad, se ha utilizado la técnica de patch-clamp de células enteras para detectar los componentes de la medicina tradicional china que actúan sobre las corrientes del canal Kv17,18,19. Por ejemplo, Wang et al. utilizaron la técnica de patch-clamp de células enteras y confirmaron que el componente efectivo de la semilla de loto podría lograr la inhibición del canal Kv4.3 bloqueando los canales de estado activado19. La aconitina (AC) es uno de los ingredientes efectivos y activos de las especies de Aconitum, como Aconitum carmichaeli Debx y Aconitum pendulum Busch. Numerosos estudios han demostrado que las sobredosis de CA pueden causar arritmias e incluso paro cardíaco20. La interacción entre la CA y los canales iónicos dependientes de voltaje conduce a la interrupción de la homeostasis iónica intracelular, que es el mecanismo clave de la cardiotoxicidad21. Por lo tanto, en este estudio, se utiliza la técnica de patch-clamp de células enteras para determinar los efectos de AC en el IKv de los cardiomiocitos.
Protocolo
Los cardiomiocitos de rata H9c2 obtenidos comercialmente (ver la Tabla de materiales) se incubaron en DMEM que contenía 10% de suero bovino fetal inactivado por calor (FBS) y 1% de penicilina-estreptomicina a 37 °C en una atmósfera humidificada deCO2 al 5%. La técnica de patch-clamp de células enteras se empleó para detectar los cambios en IKv en células H9c2 normales y células tratadas con 4-AP o CA (Figura 1 y Figura 2).
1. Preparación de la solución
- Prepare el medio de cultivo celular DMEM que contenga 10% de FBS y 1% de penicilina-estreptomicina (ver Tabla de materiales).
- Prepare una solución de 4-AP de 1,5 M añadiendo 14,1165 mg de 4-AP a 100 μL de solución de DMSO (ver Tabla de materiales). Diluir 1,5 M 4-AP a 1,5 mM añadiendo la solución extracelular (paso 1.5).
- Prepare 400 mM AC agregando 5 mg de AC a 19.36 μL de solución DMSO (ver Tabla de materiales).
NOTA: Todas las soluciones anteriores se almacenaron en un refrigerador a 4 ° C, y la concentración final del DMSO no debe exceder el 0,1% (v / v). - Prepare 50 ml de solución intracelular agregando 0.4100 g de KCl (110.0 mM), 0.0120 g de MgCl 2 (1.2 mM), 0.1270 g de Na2 ATP (5.0 mM), 0.1190 g de HEPES (10.0 mM) y 0.1900 g de EGTA (10.0 mM) en 50 mL de agua doble destilada (ver Tabla 1 y Tabla de materiales).
NOTA: El valor de pH de la solución intracelular se ajustó a 7,2 utilizando 1 M KOH y se aliquotó en pequeños volúmenes (1,5-2 ml) y se almacenó a −20 °C. - Prepare 50 ml de solución extracelular agregando 0.0185 g de KCl (5.0 mM), 0.3945 g de NaCl (135.0 mM), 0.0203 g de MgCl 2·6H2O (2.0 mM), 0.0595 g de HEPES (5.0 mM) y 0.0990 g de D-glucosa (10.0 mM) en 50 mL de agua doble destilada (ver Tabla 1 y Tabla de materiales).
NOTA: La solución extracelular debe prepararse para su uso inmediato, y su valor de pH debe ajustarse a 7.4 utilizando NaOH 1 M.
2. Cultivo celular
- Una vez que la placa de cultivo H9c2 se vuelve 80% confluente, digiera las células con tripsina al 0,25% durante 30 s.
- Cultivo de 2 x 10 5 células/ml con medio normal o medio que contiene fármaco (25 μM, 50 μM, 100 μM y 200 μM AC) en un plato de 35 mm alfombrado con placas de vidrio durante 24 h a 37 °C, con una atmósfera deCO2 al5% y una humedad relativa del 70% al 80% (ver Tabla de materiales).
3. Fabricación de micropipetas
- Encienda el extractor de micropipetas (consulte la Tabla de materiales) y precaliente durante 30 minutos.
- Coloque un capilar de vidrio de borosilicato con un filamento (OD: 1,5 mm, ID: 1,10 mm, 10 cm de longitud) en el extractor de micropipetas. Seleccione el programa establecido en el paso 3.3 y haga clic en Entrar en el panel de control. Haga clic en el programa Rampa en la esquina superior derecha para determinar el valor de "Calor" del capilar de vidrio.
- Escriba el programa para tirar del electrodo de acuerdo con el valor determinado por la prueba "Rampa" y use los siguientes pasos: valor "Calor" = valor "Rampa", Tracción = 0, Vel = velocidad de movimiento de la varilla de tracción, Tiempo = 200-250. Haga clic en Pull para empezar a fabricar las pipetas.
NOTA: Observe el color de los desecantes en el recipiente sellado del extractor de micropipetas antes de usarlo. Si el color cambia de azul a rosa, los desecantes deben ser reemplazados. Para evitar la contaminación de la punta del electrodo, trate de no tocar la parte media del capilar de vidrio durante la preparación de la pipeta. Posteriormente, retire con cuidado las pipetas producidas y colóquelas en un recipiente cerrado y sellado.
4. Configuración del instrumento
- Encienda los instrumentos correspondientes en el siguiente orden: el convertidor digital-analógico, el amplificador de señal, el micromanipulador, el microscopio y la cámara (consulte la Tabla de materiales).
- Abra la aplicación de imágenes, el software amplificador de señal y el software de adquisición de datos en secuencia (consulte Tabla de materiales).
NOTA: El instrumento debe encenderse secuencialmente; de lo contrario, aparecerá el estado "Demo Digitizer" después de abrir el software.
5. Configuración del parámetro IKv
- Edite el protocolo para grabar el IKv siguiendo los pasos a continuación.
- Haga clic en Editar y seleccione Editar protocolo en el software de adquisición de datos (consulte la Tabla de materiales).
- Edite el programa en la interfaz "Forma de onda": Época A (Primer nivel = −60 mV, Nivel Delta = 0 mV, Primera duración = 20 ms y Duración Delta = 0 ms); Época B (primer nivel = −40 mV, nivel Delta = 10 mV, primera duración = 150 ms y duración delta = 0 ms) y época C (primer nivel = −60 mV, nivel Delta = 0 mV, primera duración = 30 ms y duración delta = 0 ms).
- Luego, haga clic en la interfaz Modo/Velocidad y configure los datos de "Jerarquía de prueba": Retraso de prueba = 0 s, Ejecuciones = 1, Barridos = 11 y Duración del barrido = 0.22 s22,23.
NOTA: Adquiera las corrientes de canal IKv aplicando pasos de despolarización de 150 ms de −40 mV a +60 mV con un incremento de 10 mV a un potencial de retención de −60 mV en condiciones de control. El tiempo total del protocolo debe ser mayor que el tiempo establecido en el programa "Forma de onda".
- Edite el programa de sustracción de fuga P/N: haga clic en Editar protocolo para seleccionar el botón Estímulo y establezca el programa de sustracción de fugas en el cuadro de diálogo Resta de fuga P/N : número de subbarridos = 2-8 (4 en este estudio), tiempo de asentamiento = 100-1.000 ms (200 en este estudio), "polaridad" = "opuesto a la forma de onda", nivel de retención = −80 mV.
NOTA: La resta P/N Leak debe tener un nivel de retención inferior al "First holding" (−60 mV).
6. Registro de abrazadera de parche de celda completa del I Kv en modo de abrazadera de voltaje
- Establezca la ruta de almacenamiento de datos: haga clic en Archivo y seleccione Establecer nombres de archivo de datos en el software de adquisición de datos. Abra el protocolo IKv establecido (paso 5.1) seleccionando Editar y haciendo clic en Abrir protocolo en el software de adquisición de datos. Finalmente, haga clic en la opción Herramientas y seleccione Prueba de membrana para comenzar a ejecutar el protocolo.
- Añadir la solución extracelular (paso 1.5) al baño celular en el aparato de pinza de parche de células enteras (ver Tabla de materiales) y colocar el cubreobjetos hacia arriba con las células H9c2 (cultivadas en el paso 2.1) en el baño.
- Llene el 30% de la pipeta (fabricada en el paso 3) con la solución extracelular e instálela en el soporte del electrodo de registro integrado en el aparato de abrazadera de parche. Apriete la pipeta con la junta tórica de goma y la arandela de plástico. A continuación, deja caer la pipeta en el baño con el micromanipulador. Haga clic en la interfaz de desplazamiento de pipeta del software amplificador de señal (consulte la Tabla de materiales) para mantener la línea base de corriente IKv en 0 pA.
NOTA: La solución intracelular (paso 1.4) debe estar en contacto con la porción AgCl/Ag del alambre de plata, y el alambre de plata no debe estar cerca de la pared interna de la pipeta. La resistencia de la pipeta debe ser de 2-6 MΩ. Para evitar la oclusión de la punta de la pipeta, se debe administrar una presión positiva continua a la pipeta utilizando una jeringa de 1,0 ml conectada al soporte del electrodo registrador a través de un tubo de plástico24. - Administre manualmente una presión positiva adecuada con una jeringa de 1,0 ml conectada al soporte del electrodo de registro a través de un tubo de plástico. Mueva ligeramente la pipeta manipulando el micromanipulador en tres dimensiones para entrar en contacto con la célula.
- Una vez que la onda cuadrada de prueba de la membrana cae de 1/3 a 1/2 después de que la pipeta toque la membrana celular, retire la presión positiva y administre manualmente una presión negativa adecuada. Luego, haga clic en la interfaz de parche del software de adquisición de datos para formar el sello GΩ. Utilice el software amplificador de señal "C p Fast" y "Cp Slow" durante el sellado de celdas para compensar la capacitancia rápida y lenta.
NOTA: Cuando la prueba de membrana es ≥1 GΩ, se forma una configuración unida a la celda entre la punta de la pipeta y la célula. - Aplique pulsos breves de presión negativa para romper un parche de la membrana celular.
NOTA: Una reducción precipitada en la resistencia de la membrana caracteriza un patrón exitoso de registro de células completas. Si la resistencia de acceso (R a) ≥30 MΩ, las celdas deben volvera seleccionarse para los pasos 6.3-6.6. Para garantizar la precisión de los datos registrados de IKv , la presión negativa debe eliminarse después de que se rompa la membrana celular. - Ejecute la compensación de capacitancia de membrana de toda la célula haciendo clic en el botón de celda completa del software del amplificador de señal. Finalmente, guarde y registre los datos haciendo clic en el botón Grabación de datos .
- Abra los datos IKv guardados con el software de análisis de datos. Guarde las relaciones corriente-voltaje (I−V): haga clic en Analizar para seleccionar Estadísticas para hacer lo siguiente: seleccione el Rango como Cousors 1,2 para el análisis de datos; haga clic en los botones Amplitud máxima y Media y, a continuación, haga clic en Aceptar para ver los datos en la página Resultados . Finalmente, copie la columna de datos medios de IKv en el software de dibujo de funciones (consulte Tabla de materiales) para un análisis más detallado.
- Guarde las trazas actuales representativas de IKv : haga clic en Editar para seleccionar Transferir trazas; a continuación, seleccione el seguimiento completo en la región que desea transferir; a continuación, haga clic en Seleccionar en Selección de trazas y seleccione IN 0 (pA) en Señales; finalmente, haga clic en Aceptar para ver los datos en la página "Resultados" y copie los datos totales en el software de dibujo de funciones para dibujar las trazas actuales.
- Guarde el protocolo IKv : haga clic en Editar para seleccionar Crear señal de forma de onda de estímulo y seleccione OK. Luego, rehaga el paso 6.9 excepto para seleccionar A0 # 0 (mA) en "Señales".
Resultados
Este protocolo permitió el registro del IKv de acuerdo con los parámetros establecidos en la técnica de patch-clamp de células enteras. El IKv fue activado por 150 ms de estímulo de pulso despolarizante de -40 a +60 mV a un potencial de retención de -60 mV (Figura 3A). El IKv de los cardiomiocitos de rata H9c2 apareció por primera vez alrededor de -20 mV, y luego la amplitud aumentó con una mayor despolarización. La relación media entre el IKv y el potencial de membrana se calculó a partir de las amplitudes de corriente medidas. Los resultados mostraron que en comparación con el grupo control, la amplitud IKv se redujo observablemente después del tratamiento de 5 min con 1,5 mM 4-AP (Figura 3B). Además, elI Kv disminuyó significativamente a potenciales de membrana de 10 mV a 60 mV de manera dependiente de la dosis después del tratamiento con CA de 24 h (Figura 3C-F).

Figura 1: Equipo e instrumentos necesarios para grabar el IKv. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Diagrama de flujo del registro electrofisiológico de IKv en células H9c2 utilizando una técnica de patch-clamp de células enteras. (A) Cultivo celular. (B) Preparación de las soluciones intracelulares y extracelulares. (C) Ilustración esquemática de la grabación de células completas. C1: Mueva la pipeta cerca de la célula; C2: Formar un sello de alta resistencia entre la pipeta y la celda; C3: Romper la membrana celular. d) Registrar el IKv. D1: Diagrama esquemático de la formación de corriente K+; D2: Trazas de corriente representativas para el IKv registradas en modo de abrazadera de voltaje de celda completa. Haga clic aquí para ver una versión más grande de esta figura.
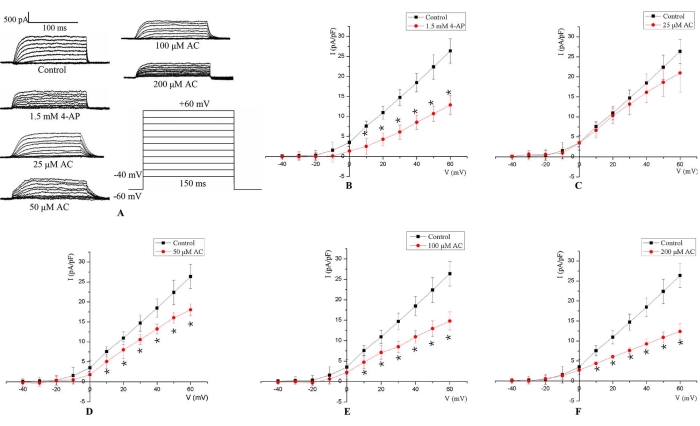
Figura 3: Representante IKv en H9c2 celdas. (A) Trazas de corriente representativas para el IKv medidas en células H9c2 sin ningún tratamiento (grupo control), con medios que contienen CA durante 24 h (25 μM, 50 μM, 100 μM y 200 μM), y con 1,5 mM 4-AP durante 5 min. El IKv fue activado por 150 ms de pulso despolarizante de -40 a +60 mV a un potencial de retención de -60 mV. (B) Para la estimulación de 1,5 mM 4-AP, el IKv descendió a potenciales de membrana de 10 mV a 60 mV. (C-F) El tratamiento con CA disminuyó el IKv de una manera dependiente de la concentración en potenciales de membrana de 10 mV a 60 mV. *p < 0,05 frente al grupo control (n = 6). Haga clic aquí para ver una versión más grande de esta figura.
| Solución extracelular | ||
| Productos químicos | g/50 ml | Composición (mM) |
| NaCl | 0.3945 | 135.0 |
| Kcl | 0.1865 | 5.0 |
| HEPES | 0.5958 | 5.0 |
| MgCl 2·6H2O | 0.2033 | 2.0 |
| D-glucosa | 0.9900 | 10.0 |
| Solución intracelular | ||
| Productos químicos | g/50 ml | Composición (mM) |
| Kcl | 0.4100 | 110.0 |
| MgCl2 | 0.0120 | 1.2 |
| Na2-ATP | 0.1270 | 5.0 |
| HEPES | 0.1190 | 10.0 |
| EGTA | 0.1900 | 10.0 |
Tabla 1: Soluciones intracelulares y extracelulares para registrar el IKv en modo tensión-pinza.
Discusión
La técnica electrofisiológica patch-clamp se utiliza principalmente para registrar y reflejar la actividad eléctrica y las características funcionales de los canales iónicos en la membrana celular25. En la actualidad, los principales métodos de grabación de la técnica patch-clamp incluyen la grabación de un solo canal y la grabación de célulascompletas 26. Para el modo de celda completa, el microelectrodo de vidrio y la presión negativa se utilizan para formar un sello de alta resistencia entre un área pequeña de la membrana celular y una punta de pipeta27. Una vez que la presión negativa sostenida hace que la punta de la pipeta rompa la membrana celular y la membrana se adhiera a la pared interna de la pipeta, el circuito eléctrico completo formado entre la pipeta y la célula permite registrar la densidad de corriente de los canales iónicos individuales en la superficie de la membrana celular26,27 . En los últimos años, la técnica de pinza de parche de células enteras se ha utilizado ampliamente para la investigación de fármacos dirigidos a enfermedades relacionadas con los canales iónicos. A pesar de que tiene altos requisitos para los operadores, esta técnica sigue siendo el "estándar de oro" para la investigación de canales iónicos28. Además, la técnica de patch-clamp perforada también puede registrar los cambios actuales en los canales iónicos objetivo en ambientes intracelulares relativamente estables durante períodos prolongados mediante el uso de antibióticos para formar poros permeables en la membrana celular29,30. Se pueden registrar y rastrear los cambios dinámicos en el voltaje o la corriente de los canales iónicos utilizando la técnica de patch-clamp de células enteras en el modo de sujetador de corriente o clamp de voltaje, lo que la convierte sin duda en una plataforma poderosa para evaluar la actividad farmacológica o los mecanismos de toxicidad de los fármacos31,32.
La CA es uno de los principales componentes tóxicos de las especies Aconitum, pertenece al grupo de alcaloides diéster-diterpenoides, y es altamente tóxica20,33. La evidencia ha indicado que la CA puede causar toxicidad cardiovascular34,35. Como bloqueador no selectivo del canal K+, se ha informado que la CA puede bloquear la corriente K+ transitoria hacia el exterior, la corriente rectificadora retardada ultrarrápida K+ y la corriente K+ rectificadora retardada rápida hacia el exterior, induciendo arritmias21,36,37. Hasta la fecha, no hay pruebas sólidas de que las corrientes de potasio dependientes del voltaje estén involucradas en la cardiotoxicidad de la CA. Por lo tanto, en este estudio, el efecto inhibitorio de AC en el IKv en cardiomiocitos H9c2 de rata se examinó utilizando la técnica de pinza de parche de células enteras. La activación de los canales de Na+ es un mecanismo ampliamente reconocido por el cual la CA ejerce efectos farmacológicos o toxicológicos38. Curiosamente, hay evidencia de que AC puede actuar directamente sobre el IKv 21,36,37. Sin embargo, los datos presentados en este documento no proporcionan evidencia suficiente de que la CA pueda inhibir directamente el IKv. El efecto inhibidor de IKv de la CA puede deberse a la activación directa de los canales de Na+, lo que requiere más investigación.
Desde su inicio y desarrollo, la técnica de patch-clamp de células enteras utilizada en este estudio se ha convertido en un método convencional para explorar la cardiotoxicidad de los fármacos en términos de canales iónicos. Este experimento confirmó que AC inhibió efectivamente el IKv de las células H9c2 de una manera dependiente de la concentración en modo de pinza de voltaje. Sin embargo, cada tipo de canal iónico, incluidos los canales K +, contiene varios subtipos, y solo se registró la corriente total del canal K + dependiente del voltaje en este estudio. Estudios posteriores pueden explorar los mecanismos farmacológicos y toxicológicos de la CA por medio de líneas celulares modelo con una alta expresión de subtipos específicos de canales iónicos37. Alternativamente, se pueden incorporar canales iónicos específicos marcados con proteínas fluorescentes para investigar visualmente la toxicidad miocárdica de la CA39. Los pasos críticos de este protocolo son los pasos 6.4-6.6; completar estos tres pasos determina directamente si la grabación posterior de IKv es exitosa. En comparación con otras tecnologías, la técnica de patch-clamp de células enteras es el método estándar de oro y aceptado para registrar la corriente en canales iónicos individuales en la membrana celular o membrana de orgánulo, con las características de altos requisitos técnicos y registro de bajo rendimiento40. En resumen, esta técnica no solo es un método básico para la investigación de electrofisiología celular, sino que también se usa ampliamente en neurociencia, ciencia cardiovascular y otros campos.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos el apoyo financiero de la Fundación Nacional de Ciencias Naturales de China (82130113) y el Programa Clave de Investigación y Desarrollo y Transformación del Departamento de Ciencia y Tecnología de la provincia de Qinghai (2020-SF-C33).
Materiales
| Name | Company | Catalog Number | Comments |
| 4-Aminopyridine | Sigma | MKCJ2184 | |
| Aconitine | Chengdu Lemetian Medical Technology Co., Ltd | DSTDW000602 | |
| Amplifier | Axon Instrument | MultiClamp 700B | |
| Analytical Balance | Sartorius | 124S-CW | |
| ATP Na2 | Solarbio | 416O022 | |
| Borosilicate glass with filament (O.D.: 1.5 mm, I.D.: 1.10 mm, 10 cm length) | Sutter Instrument | 163225-5 | |
| Cell culture dish (100 mm) | Zhejiang Sorfa Life Science Research Co., Ltd | 1192022 | |
| Cell culture dish (35 mm) | Zhejiang Sorfa Life Science Research Co., Ltd | 3012022 | |
| Clampex software | Molecular Devices, LLC. | Version 10. 5 | |
| Clampfit software | Molecular Devices, LLC. | Version 10. 6. 0. 13 | data acqusition software |
| D-(+)-glucose | Rhawn | RH289133 | |
| Digital camera | Hamamatsu | C11440 | |
| Digitizer | Axon Instrument | Axon digidata 1550B | |
| DMSO | Boster Biological Technology Co., Ltd | PYG0040 | |
| Dulbecco's modified eagle medium (1x) | Gibco | 8121587 | |
| EGTA | Biofroxx | EZ6789D115 | |
| Fetal bovine serum | Gibco | 2166090RP | |
| Flaming/brown micropipette puller | Sutter Instrument | Model P-1000 | |
| H9c2 cells | Hunan Fenghui Biotechnology Co., Ltd | CL0111 | |
| HCImageLive | Hamamatsu | 4.5.0.0 | |
| HCl | Sichuan Xilong Scientific Co., Ltd | 2106081 | |
| HEPES | Xiya Chemical Technology (Shandong) Co., Ltd | 20210221 | |
| KCl | Chengdu Colon Chemical Co., Ltd | 2020082501 | |
| KOH | Chengdu Colon Chemical Co., Ltd | 2020112601 | |
| MgCl2 | Tianjin Guangfu Fine Chemical Research Institute | 20160408 | |
| MgCl2·6H2O | Chengdu Colon Chemical Co., Ltd | 2021020101 | |
| Micromanipulator | Sutter Instrument | MP-285A | |
| Microscope | Olympus | IX73 | |
| Microscope cover glass (20 × 20 mm) | Jiangsu Citotest Experimental Equipment Co. Ltd | 80340-0630 | |
| Milli-Q | Chengdu Bioscience Technology Co., Ltd | Milli-Q IQ 7005 | |
| MultiClamp 700B commander | Axon Instrument | MultiClamp commander 2.0 | signal-amplifier software |
| OriginPro 8 software | OriginLab Corporation | v8.0724(B724) | |
| Penicillin-Streptomycin (100x) | Boster Biological Technology Co., Ltd | 17C18B16 | |
| PH meter | Mettler Toledo | S201K | |
| Phosphate buffered saline (1x) | Gibco | 8120485 | |
| Trypsin 0.25% (1x) | HyClone | J210045 |
Referencias
- Luan, Q. H. Passive transport and ion channels in biofilms. Acta Scientiarum Naturalium Universitatis Intramongoljcae. 2, 215-235 (1984).
- Lei, M., Sun, S. Advances in the mechanism of arrhythmia induced by sodium channel disease. Journal of Clinical Cardiology. 21 (4), 246-248 (2005).
- Varró, A., et al. Cardiac transmembrane ion channels and action potentials: Cellular physiology and arrhythmogenic behavior. Physiological Reviews. 101 (3), 1083-1176 (2021).
- Campuzano, O., et al. Negative autopsy and sudden cardiac death. International Journal of Legal Medicine. 128 (4), 599-606 (2014).
- Amin, A. S., Asghari-Roodsari, A., Tan, H. L. Cardiac sodium channelopathies. Pflügers Archiv: European Journal of Physiology. 460 (2), 223-237 (2010).
- Benitah, J. P., et al. Voltage gated Ca2+ currents in the human pathophysiologic heart: A review. Basic Research in Cardiology. 97 (1), 111-118 (2002).
- Banyasz, T., Horvath, B., Jian, Z., Izu, L. T., Chen-Izu, Y. Sequential dissection of multiple ionic currents in single cardiac myocytes under action potential-clamp. Journal of Molecular and Cellular Cardiology. 50 (3), 578-581 (2011).
- Nerbonne, J. M. Molecular basis of functional myocardial potassium channel diversity. Cardiac Electrophysiology Clinics. 8 (2), 257-273 (2016).
- Grant, A. O. Cardiac ion channels. Circulation: Arrhythmia and Electrophysiology. 2 (2), 185-194 (2009).
- Olson, T. M., et al. Kv1.5 channelopathy due to KCNA5 loss-of-function mutation causes human atrial fibrillation. Human Molecular Genetics. 15 (14), 2185-2191 (2006).
- Christophersen, I. E., et al. Genetic variation in KCNA5: impact on the atrial-specific potassium current IKur in patients with lone atrial fibrillation. European Heart Journal. 34 (20), 1517-1525 (2013).
- Barry, D. M., Xu, H., Schuessler, R. B., Nerbonne, J. M. Functional knockout of the transient outward current, long-QT syndrome, and cardiac remodeling in mice expressing a dominant-negative Kv4 alpha subunit. Circulation Research. 83 (5), 560-567 (1998).
- Abbott, G. W., Xu, X., Roepke, T. K. Impact of ancillary subunits on ventricular repolarization. Journal of Electrocardiology. 40, 42-46 (2007).
- Jia, W. J., et al. Recent studies on the application of patch-clamp technique in cellular electrophysiology. Journal of Chemical Engineering of Chinese Universities. 32 (4), 767-778 (2018).
- Leuthardt, E. C., et al. Using the electrocorticographic speech network to control a brain-computer interface in humans. Journal of Neural Engineering. 8 (3), 1-3 (2011).
- Tian, J. The applying progress of patch-clamp technique. Journal of Jilin Medical University. 4, 227-229 (2008).
- Wang, Z. Q., et al. Effects of shensong yangxin capsule on c-type Kv1.4 potassium channel. Chinese Heart Journal. 21 (6), 782-785 (2009).
- Huang, X. Y. The effect of resveratrol on Kv2.1 potassium channels in cardiac myocytes. Chinese Journal of Cardiac Pacing and Electrophysiology. 34 (5), 484-487 (2020).
- Wang, C., et al. Effects of neferine on Kv4.3 channels expressed in HEK293 cells and ex vivo electrophysiology of rabbit hearts. Acta Pharmacologica Sinica. 36 (12), 1451-1461 (2005).
- Gao, Y., et al. Aconitine: A review of its pharmacokinetics, pharmacology, toxicology and detoxification. Journal of Ethnopharmacology. 293, 115270 (2022).
- Zhou, W., et al. Cardiac efficacy and toxicity of aconitine: A new frontier for the ancient poison. Medicinal Research Reviews. 41 (3), 1798-1811 (2021).
- An, J. R., et al. The effects of tegaserod, a gastrokinetic agent, on voltage-gated K+ channels in rabbit coronary arterial smooth muscle cells. Clinical and Experimental Pharmacology & Physiology. 48 (5), 748-756 (2021).
- Sun, Q., Liu, F., Zhao, J., Wang, P., Sun, X. Cleavage of Kv2.1 by BACE1 decreases potassium current and reduces neuronal apoptosis. Neurochemistry International. 155, 105310 (2022).
- Manz, K. M., Siemann, J. K., McMahon, D. G., Grueter, B. A. Patch-clamp and multi-electrode array electrophysiological analysis in acute mouse brain slices. STAR Protocols. 2 (2), 100442 (2021).
- Kanda, H., Tonomura, S., Dai, Y., Gu, J. G. Protocol for pressure-clamped patch-clamp recording at the node of Ranvier of rat myelinated nerves. STAR Protocols. 2 (1), 100266 (2021).
- Ma, J., et al. High purity human-induced pluripotent stem cell-derived cardiomyocytes: electrophysiological properties of action potentials and ionic currents. American Journal of Physiology-Heart and Circulatory Physiology. 301 (5), 2006-2017 (2011).
- Yoshimura, M., et al. Application of in vivo patch-clamp technique to pharmacological analysis of synaptic transmission in the CNS. Nihon Yakurigaku Zasshi. Folia Pharmacologica Japonica. 124 (2), 111-118 (2004).
- Aziz, Q., Nobles, M., Tinker, A. Whole-cell and perforated patch-clamp recordings from acutely-isolated murine sinoatrial node cells. Bio-protocol. 10 (1), 3478 (2020).
- Witchel, H. J., Milnes, J. T., Mitcheson, J. S., Hancox, J. C. Troubleshooting problems with in vitro screening of drugs for QT interval prolongation using HERG K+ channels expressed in mammalian cell lines and Xenopus oocytes. Journal of Pharmacological and Toxicological Methods. 48 (2), 65-80 (2002).
- Rodriguez-Menchaca, A. A., Ferrer, T., Navarro-Polanco, R. A., Sanchez-Chapula, J. A., Moreno-Galindo, E. G. Impact of the whole-cell patch-clamp configuration on the pharmacological assessment of the hERG channel: Trazodone as a case example. Journal of Pharmacological and Toxicological Methods. 69 (3), 237-244 (2014).
- Yang, S., Liu, Z. W., Zhang, Y. X. The development of in vivo patch clamp technique. Chinese Remedies & Clinics. 5, 399-401 (2003).
- Lin, Y. F., Ouyang, S. Research progress and application of patch clamp technique. Strait Pharmaceutical Journal. 9, 8-11 (2008).
- Li, S., et al. An insight into current advances on pharmacology, pharmacokinetics, toxicity and detoxification of aconitine. Biomedicine & Pharmacotherapy. 151, 113115 (2022).
- Chan, T., Chan, J., Tomlinson, B., Critchley, J. Chinese herbal medicines revisited: A Hong Kong perspective. Lancet. 342 (8886-8887), 1532-1534 (1993).
- Jiang, H., Zhang, Y. T., Zhang, Y., Wang, X. B., Meng, X. L. An updated meta-analysis based on the preclinical evidence of mechanism of aconitine-induced cardiotoxicity. Frontiers in Pharmacology. 13, 900842 (2022).
- Liu, Y. Myocardial toxicity of aconite alkaloids. Shenyang Pharmaceutical University. , (2007).
- Li, Y., et al. Aconitine blocks HERG and Kv1.5 potassium channels. Journal of Ethnopharmacology. 131 (1), 187-195 (2010).
- Campbell, D. T. Modified kinetics and selectivity of sodium channels in frog skeletal muscle fibers treated with aconitine. The Journal of General Physiology. 80 (5), 713-731 (1982).
- Huang, X. Y., Ying, Y. C. The effect of specific protein 1 on Kv2.1 potassium channel in cardiac myocytes. Journal of Electrocardiology and Circulation. 39 (4), 338-341 (2020).
- Cao, J. B. Development and application of patch clamp technique. Journal of Yuncheng University. 27 (2), 53-55 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados