Method Article
Spannungsabhängige Kaliumstromaufzeichnung an H9C2-Kardiomyozyten mittels Ganzzell-Patch-Clamp-Technik
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Das vorliegende Protokoll beschreibt eine effiziente Methode zur Echtzeit- und dynamischen Erfassung von spannungsgesteuerten Kaliumkanalströmen (Kv) in H9c2-Kardiomyozyten unter Verwendung der Ganzzell-Patch-Clamp-Technik.
Zusammenfassung
Kaliumkanäle auf der myokardialen Zellmembran spielen eine wichtige Rolle bei der Regulation der elektrophysiologischen Aktivitäten der Zellen. Als einer der wichtigsten Ionenkanäle sind spannungsgesteuerte Kaliumkanäle (Kv) eng mit einigen schweren Herzerkrankungen wie medikamenteninduzierten Myokardschäden und Myokardinfarkt verbunden. In der vorliegenden Studie wurde die Ganzzell-Patch-Clamp-Technik verwendet, um die Wirkungen von 1,5 mM 4-Aminopyridin (4-AP, ein Breitband-Kaliumkanalinhibitor) und Aconitin (AC, 25 μM, 50 μM, 100 μM und 200 μM) auf den Kv-Kanalstrom (IKv) in H9c2-Kardiomyozyten zu bestimmen. Es wurde festgestellt, dass 4-AP das I Kv um etwa 54% hemmte, während die hemmende Wirkung von AC auf das IKv einen dosisabhängigen Trend zeigte (keine Wirkung für 25 μM, 30% Hemmrate für 50 μM, 46% Hemmrate für 100 μM und 54% Hemmrate für 200 μM). Aufgrund der Eigenschaften einer höheren Empfindlichkeit und Präzision wird diese Technik die Erforschung der Kardiotoxizität und der pharmakologischen Wirkungen der Ethnomedizin auf Ionenkanäle fördern.
Einleitung
Ionenkanäle sind spezielle integrierte Proteine, die in die Lipiddoppelschicht der Zellmembran eingebettet sind. In Gegenwart von Aktivatoren bilden die Zentren solcher speziellen integrierten Proteine hochselektive hydrophile Poren, die Ionen geeigneter Größe und Ladung passiv transportieren1. Ionenkanäle sind die Grundlage der Zellerregbarkeit und Bioelektrizität und spielen eine Schlüsselrolle bei einer Vielzahl von zellulären Aktivitäten2. Das Herz versorgt andere Organe durch regelmäßige Kontraktionen mit Blut, die aus einem Erregungs-Kontraktions-gekoppelten Prozess resultieren, der durch Aktionspotentiale ausgelöstwird 3. Frühere Studien haben bestätigt, dass die Erzeugung von Aktionspotentialen in Kardiomyozyten durch die Änderung der intrazellulären Ionenkonzentration verursacht wird, und die Aktivierung und Inaktivierung von Na+, Ca2+ und K + Ionenkanälen in menschlichen Kardiomyozyten führt zur Bildung von Aktionspotentialen in einer bestimmten Sequenz 4,5,6. Gestörte spannungsabhängige Kalium (Kv) Kanalströme (IKv) können den normalen Herzrhythmus verändern und zu Arrhythmien führen, die eine der häufigsten Todesursachen sind. Daher ist die Erfassung des IKv entscheidend für das Verständnis der Mechanismen von Medikamenten zur Behandlung lebensbedrohlicher Arrhythmien7.
Der Kv-Kanal ist ein wichtiger Bestandteil des Kaliumkanals. Die Koordinationsfunktion des Kv-Kanals spielt eine wichtige Rolle bei der elektrischen Aktivität und myokardialen Kontraktilität des Säugetierherzens 8,9,10. In Kardiomyozyten hängen Amplitude und Dauer der Aktionspotentiale von der Koleitung von nach außen gerichteten K+-Strömen durch mehrere Kv-Kanal-Subtypen11 ab. Die Regulation der Kv-Kanalfunktion ist sehr wichtig für die normale Repolarisation des kardialen Aktionspotentials. Schon die geringste Änderung der Kv-Leitfähigkeit wirkt sich stark auf die kardiale Repolarisation aus und erhöht die Möglichkeit einer Arrhythmie12,13.
Als grundlegende Methode in der zellulären elektrophysiologischen Forschung kann durch Anlegen eines Unterdrucks eine hochohmige Abdichtung zwischen einem kleinen Bereich der Zellmembran und einer Pipettenspitze für die Ganzzell-Patch-Clamp-Aufzeichnung hergestellt werden. Durch den kontinuierlichen Unterdruck kommt die Zellmembran mit der Pipettenspitze in Kontakt und haftet an der Innenwand der Pipette. Der resultierende vollständige elektrische Schaltkreis ermöglicht es, jeden einzelnen Ionenkanalstrom über die Oberfläche der Zellmembran14 aufzuzeichnen. Diese Technik hat eine sehr hohe Empfindlichkeit für den Ionenkanalstrom der Zellmembran und kann verwendet werden, um Ströme in allen Ionenkanälen zu detektieren, und die Anwendungen sind extrem breit15. Darüber hinaus hat Patch-Clamp im Vergleich zur fluoreszierenden Markierung und radioaktiven Markierung eine höhere Autorität und Genauigkeit16. Gegenwärtig wird die Ganzzell-Patch-Clamp-Technik verwendet, um die Komponenten der traditionellen chinesischen Medizin nachzuweisen, die auf Kv-Kanalströme17,18,19 wirken. Zum Beispiel verwendeten Wang et al. die Ganzzell-Patch-Clamp-Technik und bestätigten, dass die effektive Komponente des Lotussamens die Hemmung des Kv4.3-Kanals erreichen könnte, indem sie die aktivierten Zustandskanäleblockiert 19. Aconitin (AC) ist einer der wirksamen und aktiven Inhaltsstoffe von Aconitum-Arten, wie Aconitum carmichaeli Debx und Aconitum pendulum Busch. Zahlreiche Studien haben gezeigt, dass Überdosierungen von AC Arrhythmien und sogar Herzstillstand verursachen können20. Die Wechselwirkung zwischen AC- und spannungsabhängigen Ionenkanälen führt zur Störung der intrazellulären Ionenhomöostase, die der Schlüsselmechanismus der Kardiotoxizität ist21. Daher wird in dieser Studie die Ganzzell-Patch-Clamp-Technik verwendet, um die Auswirkungen von AC auf das IKv von Kardiomyozyten zu bestimmen.
Protokoll
Die kommerziell gewonnenen H9c2-Kardiomyozyten der Ratte (siehe Materialtabelle) wurden in DMEM inkubiert, das 10% hitzeinaktiviertes fetales Rinderserum (FBS) und 1% Penicillin-Streptomycin bei 37 °C in einer mit 5%CO2 befeuchteten Atmosphäre enthielt. Die Ganzzell-Patch-Clamp-Technik wurde dann verwendet, um die Veränderungen in IKv in normalen H9c2-Zellen und 4-AP- oder AC-behandelten Zellen zu erkennen (Abbildung 1 und Abbildung 2).
1. Lösungsvorbereitung
- Bereiten Sie das DMEM-Zellkulturmedium vor, das 10% FBS und 1% Penicillin-Streptomycin enthält (siehe Materialtabelle).
- 1,5 M 4-AP-Lösung werden durch Zugabe von 14,1165 mg 4-AP zu 100 μL DMSO-Lösung hergestellt (siehe Materialtabelle). 1,5 M 4-AP wird durch Zugabe der extrazellulären Lösung auf 1,5 mM verdünnt (Schritt 1.5).
- Bereiten Sie 400 mM AC vor, indem Sie 5 mg AC zu 19,36 μL DMSO-Lösung geben (siehe Materialtabelle).
HINWEIS: Alle oben genannten Lösungen wurden in einem 4 °C Kühlschrank gelagert, und die Endkonzentration des DMSO darf 0,1% (v/v) nicht überschreiten. - 50 ml intrazelluläre Lösung werden durch Zugabe von 0,4100 g KCl (110,0 mM), 0,0120 gMgCl2 (1,2 mM), 0,1270 g Na2ATP (5,0 mM), 0,1190 g HEPES (10,0 mM) und 0,1900 g EGTA (10,0 mM) in 50 ml doppelt destilliertes Wasser gegeben (siehe Tabelle 1 und Materialtabelle).
HINWEIS: Der pH-Wert der intrazellulären Lösung wurde mit 1 M KOH auf 7,2 eingestellt und in kleine Volumina (1,5-2 ml) aliquotiert und bei −20 °C gelagert. - 50 ml extrazelluläre Lösung werden hergestellt, indem 0,0185 g KCl (5,0 mM), 0,3945 g NaCl (135,0 mM), 0,0203 g MgCl 2·6H2O (2,0 mM), 0,0595 g HEPES (5,0 mM) und 0,0990 g D-Glucose (10,0 mM) in 50 ml doppelt destilliertes Wasser gegeben werden (siehe Tabelle 1 und Materialtabelle).
HINWEIS: Die extrazelluläre Lösung muss für die sofortige Verwendung vorbereitet werden, und ihr pH-Wert muss mit 1 M NaOH auf 7,4 eingestellt werden.
2. Zellkultur
- Sobald die H9c2-Kulturschale zu 80% konfluiert ist, verdauen Sie die Zellen mit 0,25% Trypsin für 30 s.
- Kultur 2 x 10 5 Zellen/ml mit normalem Medium oder arzneimittelhaltigem Medium (25 μM, 50 μM, 100 μM und 200 μM AC) in einer 35 mm Schale mit Glasplatten für 24 h bei 37 °C, mit einer Atmosphäre von5 % CO2 und 70% bis 80% relativer Luftfeuchtigkeit (siehe Materialtabelle).
3. Herstellung von Mikropipetten
- Schalten Sie den Mikropipettenzieher ein (siehe Materialtabelle) und heizen Sie 30 min vor.
- Legen Sie eine Borosilikatglaskapillare mit einem Filament (AD: 1,5 mm, ID: 1,10 mm, 10 cm Länge) auf den Mikropipettenzieher. Wählen Sie das in Schritt 3.3 eingestellte Programm aus und klicken Sie in der Systemsteuerung auf Enter . Klicken Sie auf das Programm Rampe in der oberen rechten Ecke, um den "Wärme"-Wert der Glaskapillare zu bestimmen.
- Schreiben Sie das Programm zum Ziehen der Elektrode gemäß dem durch den "Rampen"-Test ermittelten Wert und führen Sie die folgenden Schritte aus: "Heat" -Wert = "Ramp" -Wert, Pull = 0, Vel = Zugstangenbewegungsgeschwindigkeit, Zeit = 200-250. Klicken Sie auf Pull , um mit der Herstellung der Pipetten zu beginnen.
HINWEIS: Beachten Sie die Farbe der Trockenmittel im versiegelten Behälter des Mikropipettenziehers, bevor Sie ihn verwenden. Wenn sich die Farbe von blau nach rosa ändert, müssen die Trockenmittel ersetzt werden. Um eine Kontamination der Elektrodenspitze zu vermeiden, versuchen Sie, den mittleren Teil der Glaskapillare während der Pipettenvorbereitung nicht zu berühren. Entfernen Sie anschließend vorsichtig die produzierten Pipetten und legen Sie sie in einen geschlossenen und verschlossenen Behälter.
4. Geräteeinrichtung
- Schalten Sie die entsprechenden Instrumente in der folgenden Reihenfolge ein: den Digital-Analog-Wandler, den Signalverstärker, den Mikromanipulator, das Mikroskop und die Kamera (siehe Materialtabelle).
- Öffnen Sie die Imaging-Anwendung, die Signalverstärker-Software und die Datenerfassungssoftware nacheinander (siehe Materialtabelle).
HINWEIS: Das Instrument muss nacheinander eingeschaltet werden. Andernfalls erscheint nach dem Öffnen der Software der Status "Demo Digitizer".
5. IKv Parametereinstellung
- Bearbeiten Sie das Protokoll für die Aufzeichnung des IKv, indem Sie die folgenden Schritte ausführen.
- Klicken Sie auf Bearbeiten und wählen Sie Protokoll bearbeiten in der Datenerfassungssoftware (siehe Materialtabelle).
- Bearbeiten Sie das Programm in der "Wellenform"-Schnittstelle: Epoche A (Erster Pegel = −60 mV, Deltapegel = 0 mV, Erste Dauer = 20 ms und Deltadauer = 0 ms); Epoche B (Erste Stufe = −40 mV, Delta-Ebene = 10 mV, Erste Dauer = 150 ms und Delta-Dauer = 0 ms) und Epoche C (Erste Stufe = −60 mV, Delta-Ebene = 0 mV, Erste Dauer = 30 ms und Delta-Dauer = 0 ms).
- Klicken Sie dann auf die Schnittstelle Mode / Rate und legen Sie die Daten "Testhierarchie" fest: Testverzögerung = 0 s, Läufe = 1, Sweeps = 11 und Sweep-Dauer = 0,22 s22,23.
HINWEIS: Erfassen Sie die IKv-Kanalströme durch Anwendung von 150 ms Depolarisationsschritten von -40 mV bis +60 mV mit einem Inkrement von 10 mV bei einem Haltepotential von -60 mV unter Kontrollbedingungen. Die Gesamtzeit des Protokolls muss größer sein als die im Programm "Wellenform" eingestellte Zeit.
- Bearbeiten Sie das P/N Leak Subtraction Programm: Klicken Sie auf Edit Protocol (Protokoll bearbeiten ), um die Schaltfläche Stimulus auszuwählen, und stellen Sie das Lecksubtraktionsprogramm im Dialogfeld P/N Leak Subtraction ein: Anzahl der Subsweeps = 2-8 (4 in dieser Studie), Einschwingzeit = 100-1.000 ms (200 in dieser Studie), "Polarität" = "Entgegengesetzt zur Wellenform", Haltepegel = −80 mV.
HINWEIS: Die P/N-Lecksubtraktion muss einen niedrigeren Haltegrad als den "Ersten Halt" (−60 mV) aufweisen.
6. Ganzzellen-Patch-Clamp-Aufzeichnung des I Kv im Spannungsklemmmodus
- Legen Sie den Datenspeicherpfad fest: Klicken Sie auf Datei und wählen Sie Datendateinamen festlegen in der Datenerfassungssoftware. Öffnen Sie das etablierteI-Kv-Protokoll (Schritt 5.1), indem Sie Bearbeiten auswählen und in der Datenerfassungssoftware auf Protokoll öffnen klicken. Klicken Sie abschließend auf die Option Tools und wählen Sie Membrantest , um die Ausführung des Protokolls zu starten.
- Die extrazelluläre Lösung (Schritt 1.5) wird in das Zellbad auf dem Ganzzell-Patch-Clamp-Gerät gegeben (siehe Materialtabelle) und das Deckglas mit den H9c2-Zellen (kultiviert in Schritt 2.1) im Bad nach oben gelegt.
- Füllen Sie 30% der Pipette (hergestellt in Schritt 3) mit der extrazellulären Lösung und installieren Sie sie auf dem Aufzeichnungselektrodenhalter, der in die Patchklemmvorrichtung integriert ist. Ziehen Sie die Pipette mit der O-Ring-Gummidichtung und der Kunststoffscheibe fest. Dann lassen Sie die Pipette mit dem Mikromanipulator in das Bad fallen. Klicken Sie auf die Pipetten-Offset-Schnittstelle der Signalverstärker-Software (siehe Materialtabelle), um die I-Kv-Strombasislinie bei 0 pA zu halten.
HINWEIS: Die intrazelluläre Lösung (Schritt 1.4) muss in Kontakt mit dem AgCl/Ag-Teil des Silberdrahts sein, und der Silberdraht darf sich nicht in der Nähe der Innenwand der Pipette befinden. Der Widerstand der Pipette muss 2-6 MΩ betragen. Um das Verschließen der Pipettenspitze zu vermeiden, muss ein kontinuierlicher Überdruck an die Pipette unter Verwendung einer 1,0-ml-Spritze abgegeben werden, die über einen Kunststoffschlauch24 mit dem Aufzeichnungselektrodenhalter verbunden ist. - Liefern Sie manuell einen geeigneten Überdruck mit einer 1,0-ml-Spritze, die über einen Kunststoffschlauch mit dem Aufzeichnungselektrodenhalter verbunden ist. Bewegen Sie die Pipette leicht, indem Sie den Mikromanipulator dreidimensional manipulieren, um die Zelle zu kontaktieren.
- Sobald die Rechteckwelle des Membrantests um 1/3 bis 1/2 abfällt, nachdem die Pipette die Zellmembran berührt hat, entfernen Sie den Überdruck und liefern Sie manuell einen entsprechenden Unterdruck. Klicken Sie dann auf die Patch-Schnittstelle der Datenerfassungssoftware, um das GΩ-Siegel zu bilden. Verwenden Sie die Signalverstärkersoftware "C p Fast" und "Cp Slow" während der Zellversiegelung, um die schnelle und langsame Kapazität zu kompensieren.
HINWEIS: Wenn der Membrantest ≥1 GΩ beträgt, wird eine zellgebundene Konfiguration zwischen der Pipettenspitze und der Zelle gebildet. - Wenden Sie kurze Unterdruckimpulse an, um einen Fleck der Zellmembran zu zerreißen.
HINWEIS: Eine steile Verringerung des Membranwiderstands kennzeichnet ein erfolgreiches Ganzzellaufnahmemuster. Wenn der Zugangswiderstand(RA) ≥30 MΩ beträgt, müssen die Zellen für die Schritte 6.3-6.6 erneut ausgewählt werden. Um die Genauigkeit der aufgezeichnetenI-Kv-Daten zu gewährleisten, muss der Unterdruck entfernt werden, nachdem die Zellmembran gebrochen ist. - Führen Sie die Kapazitätskompensation der Ganzzellenmembran durch, indem Sie auf die Schaltfläche Ganzzelle der Signalverstärkersoftware klicken. Speichern und zeichnen Sie abschließend die Daten auf, indem Sie auf die Schaltfläche Datenaufzeichnung klicken.
- Öffnen Sie die gespeicherten IKv-Daten mit der Datenanalysesoftware. Speichern Sie die Strom-Spannungs-Beziehungen (I−V): Klicken Sie auf Analysieren , um Statistik auszuwählen, um Folgendes zu tun: Wählen Sie den Bereich als Cousors 1,2 für die Datenanalyse; Klicken Sie auf die Schaltflächen Spitzenamplitude und Mittelwert , und klicken Sie dann auf OK , um die Daten auf der Seite Ergebnisse anzuzeigen. Kopieren Sie schließlich die Spalte der IKv-Mittelwertdaten zur weiteren Analyse in die Funktionszeichnungssoftware (siehe Materialtabelle).
- Speichern Sie die aktuellen Spuren des Repräsentanten IKv : Klicken Sie auf Bearbeiten , um Leiterbahnen übertragen auszuwählen. Wählen Sie dann die vollständige Ablaufverfolgung in der zu übertragenden Region aus. Klicken Sie anschließend auf Select in Trace Selection und wählen Sie IN 0 (pA) in Signale; Klicken Sie abschließend auf OK , um die Daten auf der Seite "Ergebnisse" anzuzeigen, und kopieren Sie die Gesamtdaten in die Funktionszeichensoftware, um die aktuellen Spuren zu zeichnen.
- Speichern Sie das IKv-Protokoll : Klicken Sie auf Bearbeiten , um Stimulus-Wellenformsignal erstellen auszuwählen, und wählen Sie OK. Wiederholen Sie dann Schritt 6.9, mit Ausnahme der Auswahl von A0 # 0 (mA) unter "Signale".
Ergebnisse
Dieses Protokoll ermöglichte die Aufzeichnung des IKv gemäß den Parametern, die in der Ganzzellen-Patch-Clamp-Technik eingestellt wurden. Das IKv wurde durch 150 ms depolarisierenden Pulsstimulus von −40 bis +60 mV bei einem Haltepotential von −60 mV ausgelöst (Abbildung 3A). Das IKv der H9c2-Kardiomyozyten der Ratte erschien zuerst um −20 mV, und dann nahm die Amplitude mit weiterer Depolarisation zu. Aus den gemessenen Stromamplituden wurde die mittlere Beziehung zwischen dem IKv und dem Membranpotential berechnet. Die Ergebnisse zeigten, dass im Vergleich zur Kontrollgruppe die I-Kv-Amplitude nach der 5-minütigen Behandlung mit 1,5 mM 4-AP beobachtbar reduziert war (Abbildung 3B). Zusätzlich sank das IKv bei Membranpotentialen dosisabhängig nach der 24-stündigen AC-Behandlung dosisabhängig signifikant von 10 mV auf 60 mV ab (Abbildung 3C-F).

Abbildung 1: Erforderliche Ausrüstung und Instrumente zur Aufzeichnung des IKv. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Flussdiagramm der elektrophysiologischen Erfassung von IKv in H9c2 Zellen unter Verwendung einer Ganzzell-Patch-Clamp-Technik. (A) Zellkultur. (B) Herstellung der intrazellulären und extrazellulären Lösungen. (C) Schematische Darstellung der Ganzzellenaufzeichnung. C1: Bewegen Sie die Pipette nahe an die Zelle; C2: Bilden Sie eine hochohmige Dichtung zwischen der Pipette und der Zelle; C3: Reißen Sie die Zellmembran. d) Aufzeichnung des Ikv. D1: Schematische Darstellung der K+-Strombildung; D2: Repräsentative Stromverläufe für das IKv, aufgezeichnet im Ganzzellen-Spannungsklemmmodus. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
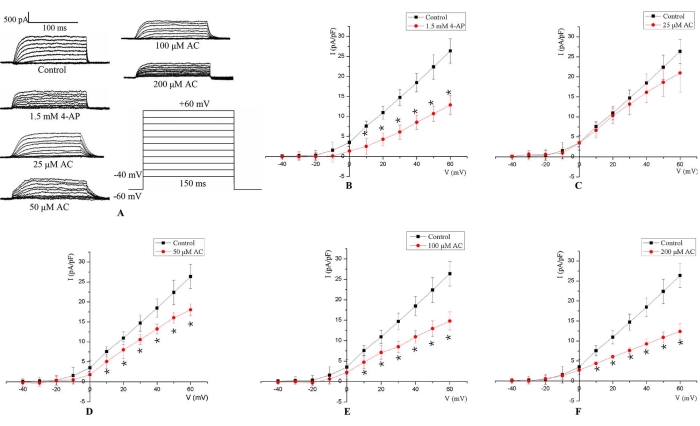
Abbildung 3: Repräsentativ IKv in H9c2 Zellen. (A) Repräsentative Stromspuren für das IKv gemessen in H9c2-Zellen ohne jegliche Behandlung (Kontrollgruppe), mit AC-haltigen Medien für 24 h (25 μM, 50 μM, 100 μM und 200 μM) und mit 1,5 mM 4-AP für 5 min. Der IKv wurde durch 150 ms Depolarisationsimpuls von −40 bis +60 mV bei einem Haltepotential von −60 mV ausgelöst. (B) Für die 1,5 mM 4-AP-Stimulation sank das IKv bei Membranpotentialen von 10 mV auf 60 mV. (C-F) Die AC-Behandlung verringerte den IKv konzentrationsabhängig bei Membranpotentialen von 10 mV auf 60 mV. *p < 0,05 gegenüber der Kontrollgruppe (n = 6). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| Extrazelluläre Lösung | ||
| Chemikalien | g/50 mL | Zusammensetzung (mM) |
| NaCl | 0.3945 | 135.0 |
| Kcl | 0.1865 | 5.0 |
| HEPES | 0.5958 | 5.0 |
| MgCl2·6H2O | 0.2033 | 2.0 |
| D-Glukose | 0.9900 | 10.0 |
| Intrazelluläre Lösung | ||
| Chemikalien | g/50 mL | Zusammensetzung (mM) |
| Kcl | 0.4100 | 110.0 |
| MgCl2 | 0.0120 | 1.2 |
| Na2-ATP | 0.1270 | 5.0 |
| HEPES | 0.1190 | 10.0 |
| EGTA | 0.1900 | 10.0 |
Tabelle 1: Intrazelluläre und extrazelluläre Lösungen zur Aufzeichnung des IKv im Spannungsklemmmodus.
Diskussion
Die elektrophysiologische Patch-Clamp-Technik wird hauptsächlich verwendet, um die elektrische Aktivität und funktionelle Eigenschaften von Ionenkanälen auf der Zellmembran25 aufzuzeichnen und zu reflektieren. Gegenwärtig umfassen die Hauptaufzeichnungsverfahren der Patch-Clamp-Technik die Einkanalaufzeichnung und die Ganzzellenaufzeichnung26. Für den Ganzzellenmodus werden die Glasmikroelektrode und der Unterdruck verwendet, um eine hochohmige Abdichtung zwischen einem kleinen Bereich der Zellmembran und einer Pipettenspitze27 zu bilden. Sobald der anhaltende Unterdruck dazu führt, dass die Spitze der Pipette die Zellmembran reißt und die Membran an der Innenwand der Pipette haftet, ermöglicht der vollständige elektrische Stromkreis zwischen der Pipette und der Zelle die Aufzeichnung der Stromdichte einzelner Ionenkanäle auf der Zellmembranoberfläche26,27 . In den letzten Jahren wurde die Ganzzell-Patch-Clamp-Technik häufig für die Arzneimittelforschung eingesetzt, die auf Ionenkanal-bedingte Krankheiten abzielt. Obwohl sie hohe Anforderungen an die Betreiber stellt, bleibt diese Technik immer noch der "Goldstandard" für die Ionenkanalforschung28. Darüber hinaus kann die perforierte Patch-Clamp-Technik auch die aktuellen Veränderungen der Zielionenkanäle in relativ stabilen intrazellulären Umgebungen über längere Zeiträume aufzeichnen, indem Antibiotika verwendet werden, um Permeabilitätsporen in der Zellmembran29,30 zu bilden. Man kann die dynamischen Änderungen der Spannung oder des Stroms von Ionenkanälen mit der Ganzzellen-Patch-Clamp-Technik im Strom-Klemm- oder Spannungs-Klemm-Modus aufzeichnen und verfolgen, was dies zweifellos zu einer leistungsfähigen Plattform macht, um die pharmakologische Aktivität oder Toxizitätsmechanismen von Arzneimittelnzu bewerten 31,32.
AC ist einer der wichtigsten toxischen Bestandteile von Aconitum-Arten, gehört zur Gruppe der Diester-Diterpenoid-Alkaloide und ist hochgiftig20,33. Es gibt Hinweise darauf, dass AC kardiovaskuläre Toxizität verursachen kann34,35. Als nicht-selektiver K+-Kanalblocker wurde berichtet, dass Wechselstrom den transienten nach außen gerichteten K+-Strom, den ultraschnellen verzögerten Gleichrichter-K+-Strom und den schnell verzögerten Gleichrichter-äußeren K+-Strom blockieren kann, wodurch Arrhythmien21,36,37 induziert werden. Bis heute gibt es keine starken Hinweise darauf, dass spannungsabhängige Kaliumströme an der Kardiotoxizität von Wechselstrom beteiligt sind. Daher wurde in dieser Studie die hemmende Wirkung von AC auf das IKv in H9c2-Kardiomyozyten der Ratte mit der Ganzzell-Patch-Clamp-Technik untersucht. Die Aktivierung von Na+-Kanälen ist ein weithin anerkannter Mechanismus, durch den AC pharmakologische oder toxikologische Wirkungen ausübt38. Interessanterweise gibt es Hinweise darauf, dass AC direkt auf das IKv 21,36,37 wirken kann. Die in diesem Artikel vorgestellten Daten liefern jedoch keine ausreichenden Beweise dafür, dass AC das IKv direkt hemmen kann. DieI-Kv-hemmende Wirkung von AC kann auf die direkte Aktivierung von Na+-Kanälen zurückzuführen sein, die weitere Untersuchungen erfordert.
Seit ihrer Gründung und Entwicklung hat sich die in dieser Studie verwendete Ganzzell-Patch-Clamp-Technik zu einer konventionellen Methode entwickelt, um die Kardiotoxizität von Arzneimitteln in Bezug auf Ionenkanäle zu untersuchen. Dieses Experiment bestätigte, dass AC das IKv von H9c2-Zellen konzentrationsabhängig im Spannungsklemmmodus wirksam hemmt. Jede Art von Ionenkanal, einschließlich K+-Kanäle, enthält jedoch mehrere Subtypen, und in dieser Studie wurde nur der gesamte spannungsabhängige K+-Kanalstrom aufgezeichnet. Nachfolgende Studien können die pharmakologischen und toxikologischen Mechanismen von AC anhand von Modellzelllinien mit einer hohen Expression spezifischer Ionenkanalsubtypenuntersuchen 37. Alternativ kann man spezifische Ionenkanäle einbauen, die mit fluoreszierenden Proteinen markiert sind, um die myokardiale Toxizität von AC visuell zu untersuchen39. Die kritischen Schritte in diesem Protokoll sind die Schritte 6.4 bis 6.6; Der Abschluss dieser drei Schritte bestimmt direkt, ob die anschließende Aufnahme von IKv erfolgreich ist. Im Vergleich zu anderen Technologien ist die Ganzzell-Patch-Clamp-Technik der Goldstandard und die akzeptierte Methode zur Aufzeichnung des Stroms in Einzelionenkanälen in der Zellmembran oder Organellenmembran mit den Eigenschaften hoher technischer Anforderungen und geringer Durchsatzaufzeichnung40. Zusammenfassend lässt sich sagen, dass diese Technik nicht nur eine grundlegende Methode für die zellelektrophysiologische Forschung ist, sondern auch in den Neurowissenschaften, der Herz-Kreislauf-Wissenschaft und anderen Bereichen weit verbreitet ist.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Wir freuen uns über die finanzielle Unterstützung der National Natural Science Foundation of China (82130113) und des Key R&D and Transformation Program der Science & Technology Department der Provinz Qinghai (2020-SF-C33).
Materialien
| Name | Company | Catalog Number | Comments |
| 4-Aminopyridine | Sigma | MKCJ2184 | |
| Aconitine | Chengdu Lemetian Medical Technology Co., Ltd | DSTDW000602 | |
| Amplifier | Axon Instrument | MultiClamp 700B | |
| Analytical Balance | Sartorius | 124S-CW | |
| ATP Na2 | Solarbio | 416O022 | |
| Borosilicate glass with filament (O.D.: 1.5 mm, I.D.: 1.10 mm, 10 cm length) | Sutter Instrument | 163225-5 | |
| Cell culture dish (100 mm) | Zhejiang Sorfa Life Science Research Co., Ltd | 1192022 | |
| Cell culture dish (35 mm) | Zhejiang Sorfa Life Science Research Co., Ltd | 3012022 | |
| Clampex software | Molecular Devices, LLC. | Version 10. 5 | |
| Clampfit software | Molecular Devices, LLC. | Version 10. 6. 0. 13 | data acqusition software |
| D-(+)-glucose | Rhawn | RH289133 | |
| Digital camera | Hamamatsu | C11440 | |
| Digitizer | Axon Instrument | Axon digidata 1550B | |
| DMSO | Boster Biological Technology Co., Ltd | PYG0040 | |
| Dulbecco's modified eagle medium (1x) | Gibco | 8121587 | |
| EGTA | Biofroxx | EZ6789D115 | |
| Fetal bovine serum | Gibco | 2166090RP | |
| Flaming/brown micropipette puller | Sutter Instrument | Model P-1000 | |
| H9c2 cells | Hunan Fenghui Biotechnology Co., Ltd | CL0111 | |
| HCImageLive | Hamamatsu | 4.5.0.0 | |
| HCl | Sichuan Xilong Scientific Co., Ltd | 2106081 | |
| HEPES | Xiya Chemical Technology (Shandong) Co., Ltd | 20210221 | |
| KCl | Chengdu Colon Chemical Co., Ltd | 2020082501 | |
| KOH | Chengdu Colon Chemical Co., Ltd | 2020112601 | |
| MgCl2 | Tianjin Guangfu Fine Chemical Research Institute | 20160408 | |
| MgCl2·6H2O | Chengdu Colon Chemical Co., Ltd | 2021020101 | |
| Micromanipulator | Sutter Instrument | MP-285A | |
| Microscope | Olympus | IX73 | |
| Microscope cover glass (20 × 20 mm) | Jiangsu Citotest Experimental Equipment Co. Ltd | 80340-0630 | |
| Milli-Q | Chengdu Bioscience Technology Co., Ltd | Milli-Q IQ 7005 | |
| MultiClamp 700B commander | Axon Instrument | MultiClamp commander 2.0 | signal-amplifier software |
| OriginPro 8 software | OriginLab Corporation | v8.0724(B724) | |
| Penicillin-Streptomycin (100x) | Boster Biological Technology Co., Ltd | 17C18B16 | |
| PH meter | Mettler Toledo | S201K | |
| Phosphate buffered saline (1x) | Gibco | 8120485 | |
| Trypsin 0.25% (1x) | HyClone | J210045 |
Referenzen
- Luan, Q. H. Passive transport and ion channels in biofilms. Acta Scientiarum Naturalium Universitatis Intramongoljcae. 2, 215-235 (1984).
- Lei, M., Sun, S. Advances in the mechanism of arrhythmia induced by sodium channel disease. Journal of Clinical Cardiology. 21 (4), 246-248 (2005).
- Varró, A., et al. Cardiac transmembrane ion channels and action potentials: Cellular physiology and arrhythmogenic behavior. Physiological Reviews. 101 (3), 1083-1176 (2021).
- Campuzano, O., et al. Negative autopsy and sudden cardiac death. International Journal of Legal Medicine. 128 (4), 599-606 (2014).
- Amin, A. S., Asghari-Roodsari, A., Tan, H. L. Cardiac sodium channelopathies. Pflügers Archiv: European Journal of Physiology. 460 (2), 223-237 (2010).
- Benitah, J. P., et al. Voltage gated Ca2+ currents in the human pathophysiologic heart: A review. Basic Research in Cardiology. 97 (1), 111-118 (2002).
- Banyasz, T., Horvath, B., Jian, Z., Izu, L. T., Chen-Izu, Y. Sequential dissection of multiple ionic currents in single cardiac myocytes under action potential-clamp. Journal of Molecular and Cellular Cardiology. 50 (3), 578-581 (2011).
- Nerbonne, J. M. Molecular basis of functional myocardial potassium channel diversity. Cardiac Electrophysiology Clinics. 8 (2), 257-273 (2016).
- Grant, A. O. Cardiac ion channels. Circulation: Arrhythmia and Electrophysiology. 2 (2), 185-194 (2009).
- Olson, T. M., et al. Kv1.5 channelopathy due to KCNA5 loss-of-function mutation causes human atrial fibrillation. Human Molecular Genetics. 15 (14), 2185-2191 (2006).
- Christophersen, I. E., et al. Genetic variation in KCNA5: impact on the atrial-specific potassium current IKur in patients with lone atrial fibrillation. European Heart Journal. 34 (20), 1517-1525 (2013).
- Barry, D. M., Xu, H., Schuessler, R. B., Nerbonne, J. M. Functional knockout of the transient outward current, long-QT syndrome, and cardiac remodeling in mice expressing a dominant-negative Kv4 alpha subunit. Circulation Research. 83 (5), 560-567 (1998).
- Abbott, G. W., Xu, X., Roepke, T. K. Impact of ancillary subunits on ventricular repolarization. Journal of Electrocardiology. 40, 42-46 (2007).
- Jia, W. J., et al. Recent studies on the application of patch-clamp technique in cellular electrophysiology. Journal of Chemical Engineering of Chinese Universities. 32 (4), 767-778 (2018).
- Leuthardt, E. C., et al. Using the electrocorticographic speech network to control a brain-computer interface in humans. Journal of Neural Engineering. 8 (3), 1-3 (2011).
- Tian, J. The applying progress of patch-clamp technique. Journal of Jilin Medical University. 4, 227-229 (2008).
- Wang, Z. Q., et al. Effects of shensong yangxin capsule on c-type Kv1.4 potassium channel. Chinese Heart Journal. 21 (6), 782-785 (2009).
- Huang, X. Y. The effect of resveratrol on Kv2.1 potassium channels in cardiac myocytes. Chinese Journal of Cardiac Pacing and Electrophysiology. 34 (5), 484-487 (2020).
- Wang, C., et al. Effects of neferine on Kv4.3 channels expressed in HEK293 cells and ex vivo electrophysiology of rabbit hearts. Acta Pharmacologica Sinica. 36 (12), 1451-1461 (2005).
- Gao, Y., et al. Aconitine: A review of its pharmacokinetics, pharmacology, toxicology and detoxification. Journal of Ethnopharmacology. 293, 115270 (2022).
- Zhou, W., et al. Cardiac efficacy and toxicity of aconitine: A new frontier for the ancient poison. Medicinal Research Reviews. 41 (3), 1798-1811 (2021).
- An, J. R., et al. The effects of tegaserod, a gastrokinetic agent, on voltage-gated K+ channels in rabbit coronary arterial smooth muscle cells. Clinical and Experimental Pharmacology & Physiology. 48 (5), 748-756 (2021).
- Sun, Q., Liu, F., Zhao, J., Wang, P., Sun, X. Cleavage of Kv2.1 by BACE1 decreases potassium current and reduces neuronal apoptosis. Neurochemistry International. 155, 105310 (2022).
- Manz, K. M., Siemann, J. K., McMahon, D. G., Grueter, B. A. Patch-clamp and multi-electrode array electrophysiological analysis in acute mouse brain slices. STAR Protocols. 2 (2), 100442 (2021).
- Kanda, H., Tonomura, S., Dai, Y., Gu, J. G. Protocol for pressure-clamped patch-clamp recording at the node of Ranvier of rat myelinated nerves. STAR Protocols. 2 (1), 100266 (2021).
- Ma, J., et al. High purity human-induced pluripotent stem cell-derived cardiomyocytes: electrophysiological properties of action potentials and ionic currents. American Journal of Physiology-Heart and Circulatory Physiology. 301 (5), 2006-2017 (2011).
- Yoshimura, M., et al. Application of in vivo patch-clamp technique to pharmacological analysis of synaptic transmission in the CNS. Nihon Yakurigaku Zasshi. Folia Pharmacologica Japonica. 124 (2), 111-118 (2004).
- Aziz, Q., Nobles, M., Tinker, A. Whole-cell and perforated patch-clamp recordings from acutely-isolated murine sinoatrial node cells. Bio-protocol. 10 (1), 3478 (2020).
- Witchel, H. J., Milnes, J. T., Mitcheson, J. S., Hancox, J. C. Troubleshooting problems with in vitro screening of drugs for QT interval prolongation using HERG K+ channels expressed in mammalian cell lines and Xenopus oocytes. Journal of Pharmacological and Toxicological Methods. 48 (2), 65-80 (2002).
- Rodriguez-Menchaca, A. A., Ferrer, T., Navarro-Polanco, R. A., Sanchez-Chapula, J. A., Moreno-Galindo, E. G. Impact of the whole-cell patch-clamp configuration on the pharmacological assessment of the hERG channel: Trazodone as a case example. Journal of Pharmacological and Toxicological Methods. 69 (3), 237-244 (2014).
- Yang, S., Liu, Z. W., Zhang, Y. X. The development of in vivo patch clamp technique. Chinese Remedies & Clinics. 5, 399-401 (2003).
- Lin, Y. F., Ouyang, S. Research progress and application of patch clamp technique. Strait Pharmaceutical Journal. 9, 8-11 (2008).
- Li, S., et al. An insight into current advances on pharmacology, pharmacokinetics, toxicity and detoxification of aconitine. Biomedicine & Pharmacotherapy. 151, 113115 (2022).
- Chan, T., Chan, J., Tomlinson, B., Critchley, J. Chinese herbal medicines revisited: A Hong Kong perspective. Lancet. 342 (8886-8887), 1532-1534 (1993).
- Jiang, H., Zhang, Y. T., Zhang, Y., Wang, X. B., Meng, X. L. An updated meta-analysis based on the preclinical evidence of mechanism of aconitine-induced cardiotoxicity. Frontiers in Pharmacology. 13, 900842 (2022).
- Liu, Y. Myocardial toxicity of aconite alkaloids. Shenyang Pharmaceutical University. , (2007).
- Li, Y., et al. Aconitine blocks HERG and Kv1.5 potassium channels. Journal of Ethnopharmacology. 131 (1), 187-195 (2010).
- Campbell, D. T. Modified kinetics and selectivity of sodium channels in frog skeletal muscle fibers treated with aconitine. The Journal of General Physiology. 80 (5), 713-731 (1982).
- Huang, X. Y., Ying, Y. C. The effect of specific protein 1 on Kv2.1 potassium channel in cardiac myocytes. Journal of Electrocardiology and Circulation. 39 (4), 338-341 (2020).
- Cao, J. B. Development and application of patch clamp technique. Journal of Yuncheng University. 27 (2), 53-55 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten