Method Article
רישום זרם אשלגן תלוי מתח על קרדיומיוציטים H9C2 באמצעות טכניקת הידוק טלאי של תאים שלמים
* These authors contributed equally
In This Article
Summary
הפרוטוקול הנוכחי מתאר שיטה יעילה לרכישה דינמית בזמן אמת של זרמי תעלה אשלגן מגודר מתח (Kv) בקרדיומיוציטים H9c2 באמצעות טכניקת הידוק טלאי של תאים שלמים.
Abstract
תעלות אשלגן על קרום תא שריר הלב ממלאות תפקיד חשוב בוויסות הפעילות האלקטרופיזיולוגית של התא. בהיותו אחד מתעלות היונים העיקריות, תעלות אשלגן מגודרות מתח (Kv) קשורות קשר הדוק לכמה מחלות לב חמורות, כגון נזק לשריר הלב הנגרם על ידי תרופות ואוטם שריר הלב. במחקר הנוכחי, נעשה שימוש בטכניקת הידוק טלאי של תאים שלמים כדי לקבוע את ההשפעות של 1.5 mM 4-aminopyridine (4-AP, מעכב תעלות אשלגן רחב טווח) ואקוניטין (AC, 25 μM, 50 μM, 100 μM ו- 200 μM) על זרם ערוץ Kv (I Kv) בקרדיומיוציטים H9c2. נמצא כי 4-AP עיכב את ה-I Kv בכ-54%, בעוד שההשפעה המעכבת של AC עלה-I Kv הראתה מגמה תלוית מינון (ללא השפעה עבור 25 μM, שיעור מעכב של 30% עבור 50 μM, שיעור מעכב של 46% עבור 100 μM ושיעור מעכב של 54% עבור 200 μM). בשל המאפיינים של רגישות ודיוק גבוהים יותר, טכניקה זו תקדם את חקר הקרדיוטוקסיות ואת ההשפעות הפרמקולוגיות של אתנו-רפואה המכוונות לתעלות יונים.
Introduction
תעלות יונים הן חלבונים משולבים מיוחדים המוטבעים בדו-שכבת השומנים של קרום התא. בנוכחות אקטיבטורים, המרכזים של חלבונים משולבים מיוחדים כאלה יוצרים נקבוביות הידרופיליות סלקטיביות ביותר, המאפשרות ליונים בגודל ומטען מתאימים לעבור באופן הובלה פסיבי1. תעלות יונים הן הבסיס לרגישות התאים ולביו-אלקטריות וממלאות תפקיד מפתח במגוון פעילויות תאיות2. הלב מספק דם לאיברים אחרים באמצעות התכווצויות קבועות הנובעות מתהליך עירור-כיווץ-מצומד היזום על ידי פוטנציאל פעולה3. מחקרים קודמים אישרו כי הדור של פוטנציאל הפעולה בקרדיומיוציטים נגרם על ידי השינוי בריכוז היונים התוך-תאיים, וההפעלה וההשבתה של תעלות יונים Na+, Ca2+, ו-K+ בקרדיומיוציטים אנושיים מובילות להיווצרות פוטנציאלי פעולה ברצף מסוים 4,5,6. זרמי תעלה של אשלגן מגודר מתח (Kv) (IKv) עלולים לשנות את קצב הלב הרגיל, ולהוביל להפרעות קצב, שהן אחת הסיבות המובילות למוות. לכן, הקלטתה-I Kv היא קריטית להבנת המנגנונים של תרופות לטיפול בהפרעות קצב מסכנות חיים7.
תעלת Kv היא מרכיב חשוב בתעלת האשלגן. פונקציית הקואורדינציה של תעלת Kv ממלאת תפקיד חשוב בפעילות החשמלית ובהתכווצות שריר הלב של לב היונקים 8,9,10. בקרדיומיוציטים, המשרעת ומשך פוטנציאל הפעולה תלויים בהולכה משותפת של זרמי K+ חיצוניים על ידי תת-סוגים מרובים של ערוץ Kv11. הרגולציה של פונקציית ערוץ Kv חשובה מאוד עבור repolarization נורמלי של פוטנציאל הפעולה הלב. אפילו השינוי הקל ביותר במוליכות Kv משפיע מאוד על רה-פולריזציה של הלב ומגדיל את האפשרות להפרעות קצב12,13.
כמייצגת שיטה בסיסית במחקר אלקטרופיזיולוגי תאי, ניתן ליצור חותם בעל עמידות גבוהה בין אזור קטן של קרום התא לבין קצה פיפטה לרישום מהדק טלאי של תא שלם על ידי הפעלת לחץ שלילי. הלחץ השלילי המתמשך גורם לקרום התא לבוא במגע עם קצה הפיפטה ולהידבק לדופן הפנימית של הפיפטה. המעגל החשמלי השלם המתקבל מאפשר להקליט כל זרם של תעלת יונים בודדת על פני השטח של קרום התא14. לטכניקה זו רגישות גבוהה מאוד לזרם תעלת היונים של קרום התא וניתן להשתמש בה לאיתור זרמים בכל תעלות היונים, והיישומים רחבים ביותר15. יתר על כן, בהשוואה לתיוג פלואורסצנטי ותיוג רדיואקטיבי, למהדק טלאי יש סמכות ודיוק גבוהים יותר16. נכון לעכשיו, נעשה שימוש בטכניקת הידוק המדבקות של תאים שלמים כדי לזהות את רכיבי הרפואה הסינית המסורתית הפועלים על זרמי ערוץ Kv17,18,19. לדוגמה, Wang et al. השתמשו בטכניקת הידוק טלאי של תאים שלמים ואישרו כי הרכיב היעיל של זרע הלוטוס עשוי להשיג את העיכוב של ערוץ Kv4.3 על ידי חסימת ערוצי המדינה המופעלים19. אקוניטין (AC) הוא אחד המרכיבים היעילים והפעילים של מיני אקוניטום, כגון אקוניטום קרמיכאלי דבקס ואקוניטום מטוטלת בוש. מחקרים רבים הראו כי מנת יתר של AC יכול לגרום הפרעות קצב ואפילו דום לב20. האינטראקציה בין AC לתעלות יונים מגודרות מתח מובילה לשיבוש של הומאוסטזיס יונים תוך תאי, שהוא מנגנון המפתח של קרדיוטוקסיות21. לכן, במחקר זה, טכניקת הידוק טלאי של תאים שלמים משמשת לקביעת ההשפעות של AC עלI Kv של קרדיומיוציטים.
Protocol
הקרדיומיוציטים של חולדות H9c2 שהתקבלו באופן מסחרי (ראו טבלת החומרים) דוגרו ב-DMEM המכיל 10% סרום בקר עוברי מומת חום (FBS) ו-1% פניצילין-סטרפטומיצין בטמפרטורה של 37 מעלות צלזיוס באטמוספירה לחה של 5% CO2. לאחר מכן, נעשה שימוש בטכניקת הידוק טלאי של תאים שלמים כדי לזהות את השינוייםב-I Kv בתאי H9c2 רגילים ובתאים שטופלו ב-4-AP או ב-AC (איור 1 ואיור 2).
1. הכנת פתרון
- הכינו את תרבית תאי ה-DMEM המכיל 10% FBS ו-1% פניצילין-סטרפטומיצין (ראו טבלת חומרים).
- הכן תמיסת 1.5 M 4-AP על-ידי הוספת 14.1165 מ"ג של 4-AP ל- 100 μL של תמיסת DMSO (ראה טבלת חומרים). דלל 1.5 M 4-AP ל-1.5 mM על-ידי הוספת הפתרון החוץ-תאי (שלב 1.5).
- הכן 400 mM AC על-ידי הוספת 5 מ"ג AC ל-19.36 מיקרון ליטר של תמיסת DMSO (ראה טבלת חומרים).
הערה: כל התמיסות הנ"ל אוחסנו במקרר של 4 מעלות צלזיוס, והריכוז הסופי של ה-DMSO לא יעלה על 0.1% (v/v). - הכן 50 מ"ל של תמיסה תוך-תאית על-ידי הוספת 0.4100 גרם של KCl (110.0 mM), 0.0120 גרם של MgCl 2 (1.2 mM), 0.1270 גרם של Na2 ATP (5.0 mM), 0.1190 גרם של HEPES (10.0 mM) ו-0.1900 גרם של EGTA (10.0 mM) לתוך 50 מ"ל של מים מזוקקים כפולים (ראה טבלה 1 וטבלת חומרים).
הערה: ערך ה- pH של התמיסה התוך-תאית הותאם ל- 7.2 באמצעות 1 M KOH והוכנס לנפחים קטנים (1.5-2 מ"ל) ואוחסן ב- −20 °C. - הכן 50 מ"ל של תמיסה חוץ-תאית על-ידי הוספת 0.0185 גרם של KCl (5.0 mM), 0.3945 גרם של NaCl (135.0 mM), 0.0203 גרם של MgCl 2·6H2O (2.0 mM), 0.0595 גרם של HEPES (5.0 mM), ו-0.0990 גרם של D-גלוקוז (10.0 mM) לתוך 50 מ"ל של מים מזוקקים כפולים (ראה טבלה 1 וטבלת חומרים).
הערה: יש להכין את התמיסה החוץ-תאית לשימוש מיידי, ולהתאים את ערך ה-pH שלה ל-7.4 באמצעות 1 M NaOH.
2. תרבית תאים
- ברגע שצלחת התרבית H9c2 הופכת ל-80% מפגש, עכלו את התאים עם 0.25% טריפסין למשך 30 שניות.
- תרבית 2 x 10 5 תאים למ"ל עם מדיום רגיל או מדיום המכיל תרופות (25 μM, 50 μM, 100 μM, ו- 200 μM AC) בצלחת 35 מ"מ עם שטיח עם לוחות זכוכית במשך 24 שעות ב 37 °C,עם 5% CO 2 אטמוספירה ו 70% עד 80% לחות יחסית (ראה טבלת חומרים).
3. ייצור מיקרופיפטים
- הפעילו את מושך המיקרופיפטה (ראו טבלת חומרים), וחממו מראש למשך 30 דקות.
- שים נימי זכוכית בורוסיליקט עם נימה (OD: 1.5 מ"מ, ID: 1.10 מ"מ, 10 ס"מ אורך) על מושך micropipette. בחר את התוכנית שהוגדרה בשלב 3.3 ולחץ על Enter בלוח הבקרה. לחץ על תוכנית הרמפה בפינה השמאלית העליונה כדי לקבוע את הערך "חום" של נימי הזכוכית.
- כתוב את התוכנית למשיכת האלקטרודה בהתאם לערך שנקבע על ידי בדיקת "רמפה", והשתמש בשלבים הבאים: ערך "חום" = ערך "רמפה", משיכה = 0, Vel = מהירות נעה של מוט משיכה, זמן = 200-250. לחץ על משיכה כדי להתחיל לייצר את הפיפטות.
הערה: שימו לב לצבע חומרי ההתייבשות במיכל האטום של מושך המיקרופיפטה לפני השימוש בו. אם הצבע משתנה מכחול לוורוד, יש להחליף את חומרי הייבוש. כדי למנוע את הזיהום של קצה האלקטרודה, נסה לא לגעת בחלק האמצעי של נימי הזכוכית במהלך הכנת הפיפטה. לאחר מכן, בזהירות להסיר את פיפטות המיוצר, ומניחים אותם במיכל סגור ואטום.
4. הגדרת מכשירים
- הפעל את המכשירים המתאימים בסדר הבא: הממיר הדיגיטלי-אנלוגי, מגבר האות, המיקרומניפולטור, המיקרוסקופ והמצלמה (ראה טבלת חומרים).
- פתח את יישום ההדמיה, את תוכנת מגבר האותות ואת תוכנת רכישת הנתונים ברצף (ראה טבלת חומרים).
הערה: יש להפעיל את המכשיר ברצף; אחרת, המצב "הדגמה Digitizer" יופיע לאחר פתיחת התוכנה.
5. הגדרת פרמטרI Kv
- ערוך את הפרוטוקול להקלטתה- I Kv בהתאם לשלבים הבאים.
- לחץ על ערוך, ובחר ערוך פרוטוקול בתוכנת איסוף הנתונים (ראה טבלת חומרים).
- ערוך את התוכנית בממשק "צורת גל": עידן A (רמה ראשונה = −60 mV, רמת דלתא = 0 mV, משך ראשון = 20 אלפיות השנייה, ומשך דלתא = 0 אלפיות השנייה); עידן B (רמה ראשונה = −40 mV, רמת דלתא = 10 mV, משך ראשון = 150 אלפיות השנייה, ומשך דלתא = 0 אלפיות השנייה), ותקופה C (רמה ראשונה = −60 mV, רמת דלתא = 0 mV, משך ראשון = 30 אלפיות השנייה, ומשך דלתא = 0 אלפיות השנייה).
- לאחר מכן, לחץ על ממשק Mode/Rate והגדר את נתוני "היררכיית הניסיון": השהיית ניסיון = 0 שניות, ריצות = 1, מטאטא = 11, ומשך טאטוא = 0.22 שניות22,23.
הערה: רכוש את זרמי ערוץI Kv על-ידי החלת צעדים דה-פולריזציה של 150 אלפיות השנייה מ- −40 mV ל- +60 mV עם תוספת של 10 mV בפוטנציאל החזקה של −60 mV בתנאי בקרה. הזמן הכולל של הפרוטוקול צריך להיות גדול יותר מהזמן שנקבע בתוכנית "צורת גל".
- ערוך את תוכנית חיסור הדליפה P/N: לחץ על ערוך פרוטוקול כדי לבחור בלחצן גירוי , והגדר את תוכנית חיסור הדליפה בתיבת הדו-שיח חיסור דליפה P/N : מספר תת-גורפים = 2-8 (4 במחקר זה), זמן התיישבות = 100-1,000 אלפיות השנייה (200 במחקר זה), "קוטביות" = "מנוגדת לצורת גל", רמת החזקה = −80 mV.
הערה: רמת ההחזקה של חיסור דליפת P/N חייבת להיות נמוכה מרמת ההחזקה הראשונה (−60 mV).
6. הקלטת מהדק טלאי של תא שלם של ה - I Kv במצב מהדק מתח
- צור את נתיב אחסון הנתונים: לחץ על קובץ ובחר הגדר שמות קבצי נתונים בתוכנת רכישת הנתונים. פתח את פרוטוקולI Kv שהוקם (שלב 5.1) על ידי בחירת עריכה ולחיצה על פרוטוקול פתוח בתוכנת רכישת הנתונים. לבסוף, לחץ על כלים אפשרות ובחר בדיקת ממברנה כדי להתחיל להפעיל את הפרוטוקול.
- הוסיפו את התמיסה החוץ-תאית (שלב 1.5) לאמבטיית התאים במנגנון הידוק הטלאי של התא כולו (ראו טבלת חומרים), והניחו את הכיסוי כלפי מעלה עם תאי H9c2 (בתרבית בשלב 2.1) באמבטיה.
- מלאו 30% מהפיפטה (המיוצרת בשלב 3) בתמיסה החוץ-תאית, והתקינו אותה על מחזיק אלקטרודת ההקלטה המשולב במנגנון המדבקה-מהדק. הדקו את הפיפטה עם אטם הגומי o-ring ומכונת הכביסה מפלסטיק. לאחר מכן, שחרר את פיפטה לתוך האמבטיה עם micromanipulator. לחץ על ממשק ההסטה של Pipette של תוכנת מגבר האותות (ראה טבלת חומרים) כדי לשמור על קו הבסיס הנוכחישל I Kv ב- 0 pA.
הערה: התמיסה התוך-תאית (שלב 1.4) חייבת להיות במגע עם חלק AgCl/Ag של חוט הכסף, וחוט הכסף לא יכול להיות קרוב לדופן הפנימית של הפיפטה. ההתנגדות של פיפטה צריך להיות 2-6 MΩ. כדי למנוע חסימה של קצה הפיפטה, יש להעביר לחץ חיובי מתמשך לפיפטה באמצעות מזרק 1.0 מ"ל המחובר למחזיק אלקטרודת ההקלטה באמצעות צינורות פלסטיק24. - ספק לחץ חיובי מתאים באופן ידני עם מזרק 1.0 מ"ל המחובר למחזיק אלקטרודת ההקלטה דרך צינור פלסטיק. הזז את הפיפטה מעט על ידי מניפולציה של המיקרומניפולטור בשלושה ממדים כדי ליצור קשר עם התא.
- לאחר שהגל המרובע של בדיקת הממברנה יורד ב-1/3 עד 1/2 לאחר שהפיפטה נוגעת בקרום התא, הסר את הלחץ החיובי והעביר לחץ שלילי מתאים באופן ידני. לאחר מכן, לחץ על ממשק התיקון של תוכנת רכישת הנתונים כדי ליצור את חותם GΩ. השתמש בתוכנת מגבר האותות "C p Fast" ו-"Cp Slow" במהלך איטום התאים כדי לפצות על הקיבוליות המהירה והאיטית.
הערה: כאשר בדיקת הממברנה היא ≥1 GΩ, נוצרת תצורה המחוברת לתא בין קצה הפיפטה לתא. - החל פולסים קצרים של לחץ שלילי כדי לקרוע טלאי של קרום התא.
הערה: הפחתה חדה בהתנגדות הממברנה מאפיינת דפוס מוצלח של רישום תאים שלמים. אם התנגדות הגישה (Ra) ≥30 MΩ, יש לבחור מחדש את התאים עבור שלבים 6.3-6.6. על מנת להבטיח את הדיוק של נתוניI Kv שנרשמו, יש להסיר את הלחץ השלילי לאחר שבירת קרום התא. - בצע פיצוי קיבוליות של קרום תא שלם על ידי לחיצה על כפתור התא השלם של תוכנת מגבר האותות. לבסוף, שמור והקלט את הנתונים על ידי לחיצה על הקלטת נתונים לחצן.
- פתח את נתוניה- I Kv השמורים באמצעות תוכנת ניתוח הנתונים. שמור את קשרי הגומלין בין מתח זרם למתח (I−V): לחץ על נתח כדי לבחור סטטיסטיקה כדי לבצע את הפעולות הבאות: בחר את הטווח כ - Cousors 1,2 לניתוח נתונים; לחץ על הלחצנים משרעת שיא וממוצע ולאחר מכן לחץ על אישור כדי להציג את הנתונים בדף התוצאות . לבסוף, העתק את העמודה של נתוני ממוצע IKv לתוכנת שרטוט הפונקציות (ראה טבלת חומרים) לניתוח נוסף.
- שמור את העקיבה הנוכחיתשל I Kv המייצג: לחץ על ערוך כדי לבחור העבר מעקבים; לאחר מכן, בחר את המעקב המלא באזור להעברה; לאחר מכן, לחץ על בחר בבחירת מעקב, ובחר IN 0 (pA) באותות; לבסוף, לחץ על אישור כדי להציג את הנתונים בדף "תוצאות", והעתק את סך הנתונים לתוכנת ציור הפונקציה כדי לצייר את העקבות הנוכחיים.
- שמור את פרוטוקולI Kv : לחץ על ערוך כדי לבחור צור אות צורת גל של גירוי ובחר אישור. לאחר מכן, בצע שוב את שלב 6.9 למעט בחירת A0 # 0 (mA) ב "אותות".
תוצאות
פרוטוקול זה איפשר הקלטה שלI Kv על פי הפרמטרים שנקבעו בטכניקת תיקון תא שלם. ה-I Kv הופעל על-ידי 150 מילישניות של גירוי דופק דה-פולריזציה מ-40+ עד +60 mV בפוטנציאל החזקה של −60 mV (איור 3A). ה-I Kv של קרדיומיוציטים של חולדות H9c2 הופיע לראשונה בסביבות −20 mV, ואז המשרעת גדלה עם דה-פולריזציה נוספת. הקשר הממוצע ביןה-I Kv לפוטנציאל הממברנה חושב מתוך משרעת הזרם שנמדדה. התוצאות הראו כי בהשוואה לקבוצת הביקורת, משרעתה-I Kv הופחתה באופן נצפה לאחר טיפול של 5 דקות עם 1.5 mM 4-AP (איור 3B). בנוסף,ה-I Kv ירד באופן משמעותי בפוטנציאל הממברנה מ-10 mV ל-60 mV באופן תלוי מינון לאחר טיפול AC של 24 שעות (איור 3C-F).

איור 1: ציוד ומכשירים הנדרשים להקלטתה- I Kv. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 2: תרשים זרימה של הרישום האלקטרופיזיולוגי של I Kv בתאי H9c2 באמצעות טכניקת הידוק טלאי של תאים שלמים. (A) תרבית תאים. (B) הכנת הפתרונות התוך-תאיים והחוץ-תאיים. (C) איור סכמטי של הקלטה של תא שלם. C1: הזז את הפיפטה קרוב לתא; C2: צור אטם בעל עמידות גבוהה בין הפיפטה לתא; C3: קרע את קרום התא. (D) הקלט אתה- I Kv. D1: דיאגרמה סכמטית של היווצרות זרם K+ ; D2: עקבות זרם מייצגים עבורה- I Kv שנרשמו במצב מהדק מתח של תא שלם. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
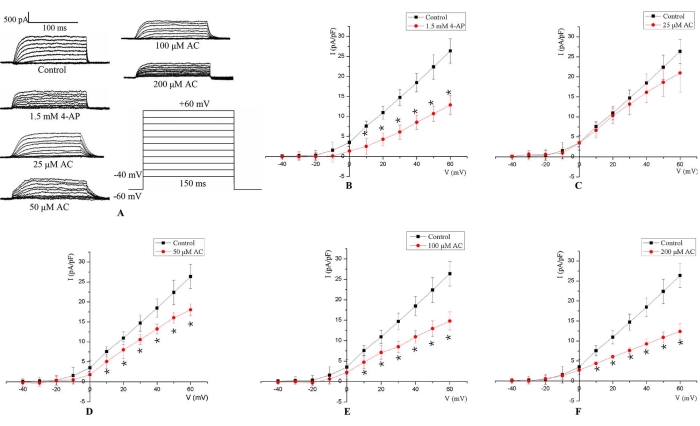
איור 3:מייצג I Kv בתאי H9c2. (A) עקבות זרם מייצגים עבורI Kv שנמדדו בתאי H9c2 ללא כל טיפול (קבוצת ביקורת), עם מדיה המכילה AC במשך 24 שעות (25 μM, 50 μM, 100 μM ו- 200 μM), ועם 1.5 mM 4-AP במשך 5 דקות. ה-I Kv הופעל על ידי 150 מילישניות של דופק דפולריזציה מ- −40 עד +60 mV בפוטנציאל החזקה של −60 mV. (B) עבור גירוי של 1.5 mM 4-AP,ה-I Kv ירד בפוטנציאל הממברנה מ-10 mV ל-60 mV. (ג-ו) טיפול AC הפחית אתה-I Kv באופן תלוי-ריכוז בפוטנציאל הממברנה מ-10 mV ל-60 mV. *p < 0.05 לעומת קבוצת הביקורת (n = 6). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
| פתרון חוץ-תאי | ||
| כימיקלים | גרם/50 מ"ל | קומפוזיציה (mM) |
| נאקל | 0.3945 | 135.0 |
| KCl | 0.1865 | 5.0 |
| האפס | 0.5958 | 5.0 |
| MgCl 2·6H2O | 0.2033 | 2.0 |
| D-גלוקוז | 0.9900 | 10.0 |
| פתרון תוך-תאי | ||
| כימיקלים | גרם/50 מ"ל | קומפוזיציה (mM) |
| KCl | 0.4100 | 110.0 |
| מ.ג.ל.2 | 0.0120 | 1.2 |
| נה2-ATP | 0.1270 | 5.0 |
| האפס | 0.1190 | 10.0 |
| אגטה | 0.1900 | 10.0 |
טבלה 1: פתרונות תוך-תאיים וחוץ-תאיים להקלטתה-I Kv במצב מהדק מתח.
Discussion
הטכניקה האלקטרופיזיולוגית של מהדק טלאי משמשת בעיקר לתיעוד ושיקוף הפעילות החשמלית והמאפיינים התפקודיים של תעלות יונים על קרום התא25. כיום, שיטות ההקלטה העיקריות של טכניקת מהדק הטלאי כוללות הקלטה חד-ערוצית והקלטת תאים שלמים26. עבור מצב התא כולו, מיקרואלקטרודת הזכוכית והלחץ השלילי משמשים ליצירת חותם בעל התנגדות גבוהה בין אזור קטן של קרום התא לבין קצה פיפטה27. ברגע שהלחץ השלילי המתמשך גורם לקצה הפיפטה לקרוע את קרום התא והממברנה מתחברת לדופן הפנימית של הפיפטה, המעגל החשמלי השלם שנוצר בין הפיפטה לתא מאפשר לרשום את צפיפות הזרם של תעלות יונים בודדות על פני קרום התא26,27 . בשנים האחרונות, טכניקת הידוק טלאי של תאים שלמים נמצאת בשימוש נרחב למחקרי תרופות המכוונות למחלות הקשורות לתעלות יונים. למרות שיש לו דרישות גבוהות למפעילים, טכניקה זו עדיין נשארת "תקן הזהב" לחקר תעלות יונים28. בנוסף, טכניקת הידוק הטלאי המחורר יכולה גם לתעד את השינויים הנוכחיים בתעלות יוני המטרה בסביבות תוך-תאיות יציבות יחסית לאורך זמן ממושך על ידי שימוש באנטיביוטיקה ליצירת נקבוביות חדירות בקרום התא29,30. ניתן להקליט ולעקוב אחר השינויים הדינמיים במתח או בזרם של תעלות יונים באמצעות טכניקת מהדק כל התא במצב מהדק זרם או מהדק מתח, מה שהופך את זה ללא ספק לפלטפורמה רבת עוצמה להערכת הפעילות הפרמקולוגית או מנגנוני הרעילות של תרופות31,32.
AC הוא אחד המרכיבים הרעילים העיקריים של מיני אקוניטום, שייך לקבוצה של אלקלואידים דיסטר-דיטרפנואידים, והוא רעיל מאוד20,33. עדויות מצביעות על כך ש-AC יכול לגרום לרעילות קרדיווסקולרית34,35. כחוסם ערוצי K+ שאינו סלקטיבי, דווח כי AC יכול לחסום את זרם K+ החיצוני החולף, זרם K+ מתעכב מהיר במיוחד, ומיישר מושהה מהיר כלפי חוץ K+ זרם, גרימת הפרעות קצב21,36,37. נכון להיום, אין ראיות חזקות לכך שזרמי אשלגן תלויי מתח מעורבים בקרדיוטוקסיות של AC. לכן, במחקר זה, ההשפעה המעכבת של AC על IKv בקרדיומיוציטים H9c2 חולדות נבדקה באמצעות טכניקת הידוק טלאי של תאים שלמים. ההפעלה של ערוצי Na+ היא מנגנון מוכר שבאמצעותו AC מפעיל השפעות פרמקולוגיות או טוקסיקולוגיות38. מעניין, יש ראיות כי AC יכול לפעול ישירות על IKv 21,36,37. עם זאת, הנתונים המוצגים במאמר זה אינם מספקים ראיות מספיקות לכך ש- AC יכול לעכב ישירות אתה- I Kv. ההשפעה המעכבתשל I Kv של AC עשויה לנבוע מהפעלה ישירה של ערוצי Na+, הדורשת חקירה נוספת.
מאז הקמתה ופיתוחה, טכניקת הידוק המדבקות של תאים שלמים ששימשה במחקר זה הפכה לשיטה קונבנציונלית לחקור את הקרדיוטוקסיות של תרופות במונחים של תעלות יונים. ניסוי זה אישר כי AC עיכב ביעילות אתה-I Kv של תאי H9c2 באופן תלוי ריכוז במצב מהדק מתח. עם זאת, כל סוג של תעלת יונים, כולל ערוצי K+, מכיל מספר תת-סוגים, ורק זרם ערוץ K+ התלוי במתח הכולל נרשם במחקר זה. מחקרים מאוחרים יותר יכולים לחקור את המנגנונים הפרמקולוגיים והטוקסיקולוגיים של AC באמצעות קווי תאי מודל עם ביטוי גבוה של תת-סוגים ספציפיים של תעלות יונים37. לחלופין, ניתן לשלב תעלות יונים ספציפיות המסומנות בחלבונים פלואורסצנטיים כדי לחקור את רעילות שריר הלב של ACבאופן חזותי 39. השלבים הקריטיים בפרוטוקול זה הם שלבים 6.4-6.6; השלמת שלושת השלבים הללו קובעת ישירות אם ההקלטה הבאה שלI Kv מוצלחת. בהשוואה לטכנולוגיות אחרות, טכניקת הידוק טלאי התא כולו היא תקן הזהב והשיטה המקובלת להקלטת הזרם בתעלות יונים בודדות בקרום התא או בקרום האברון, עם המאפיינים של דרישות טכניות גבוהות והקלטה בתפוקה נמוכה40. לסיכום, טכניקה זו היא לא רק שיטה בסיסית לחקר אלקטרופיזיולוגיה של התא, אלא גם בשימוש נרחב במדעי המוח, מדעי הלב וכלי הדם ותחומים אחרים.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מעריכים את התמיכה הכספית מהקרן הלאומית למדעי הטבע של סין (82130113) ומתוכנית המו"פ והטרנספורמציה המרכזית של מחלקת המדע והטכנולוגיה של מחוז צ'ינגהאי (2020-SF-C33).
Materials
| Name | Company | Catalog Number | Comments |
| 4-Aminopyridine | Sigma | MKCJ2184 | |
| Aconitine | Chengdu Lemetian Medical Technology Co., Ltd | DSTDW000602 | |
| Amplifier | Axon Instrument | MultiClamp 700B | |
| Analytical Balance | Sartorius | 124S-CW | |
| ATP Na2 | Solarbio | 416O022 | |
| Borosilicate glass with filament (O.D.: 1.5 mm, I.D.: 1.10 mm, 10 cm length) | Sutter Instrument | 163225-5 | |
| Cell culture dish (100 mm) | Zhejiang Sorfa Life Science Research Co., Ltd | 1192022 | |
| Cell culture dish (35 mm) | Zhejiang Sorfa Life Science Research Co., Ltd | 3012022 | |
| Clampex software | Molecular Devices, LLC. | Version 10. 5 | |
| Clampfit software | Molecular Devices, LLC. | Version 10. 6. 0. 13 | data acqusition software |
| D-(+)-glucose | Rhawn | RH289133 | |
| Digital camera | Hamamatsu | C11440 | |
| Digitizer | Axon Instrument | Axon digidata 1550B | |
| DMSO | Boster Biological Technology Co., Ltd | PYG0040 | |
| Dulbecco's modified eagle medium (1x) | Gibco | 8121587 | |
| EGTA | Biofroxx | EZ6789D115 | |
| Fetal bovine serum | Gibco | 2166090RP | |
| Flaming/brown micropipette puller | Sutter Instrument | Model P-1000 | |
| H9c2 cells | Hunan Fenghui Biotechnology Co., Ltd | CL0111 | |
| HCImageLive | Hamamatsu | 4.5.0.0 | |
| HCl | Sichuan Xilong Scientific Co., Ltd | 2106081 | |
| HEPES | Xiya Chemical Technology (Shandong) Co., Ltd | 20210221 | |
| KCl | Chengdu Colon Chemical Co., Ltd | 2020082501 | |
| KOH | Chengdu Colon Chemical Co., Ltd | 2020112601 | |
| MgCl2 | Tianjin Guangfu Fine Chemical Research Institute | 20160408 | |
| MgCl2·6H2O | Chengdu Colon Chemical Co., Ltd | 2021020101 | |
| Micromanipulator | Sutter Instrument | MP-285A | |
| Microscope | Olympus | IX73 | |
| Microscope cover glass (20 × 20 mm) | Jiangsu Citotest Experimental Equipment Co. Ltd | 80340-0630 | |
| Milli-Q | Chengdu Bioscience Technology Co., Ltd | Milli-Q IQ 7005 | |
| MultiClamp 700B commander | Axon Instrument | MultiClamp commander 2.0 | signal-amplifier software |
| OriginPro 8 software | OriginLab Corporation | v8.0724(B724) | |
| Penicillin-Streptomycin (100x) | Boster Biological Technology Co., Ltd | 17C18B16 | |
| PH meter | Mettler Toledo | S201K | |
| Phosphate buffered saline (1x) | Gibco | 8120485 | |
| Trypsin 0.25% (1x) | HyClone | J210045 |
References
- Luan, Q. H. Passive transport and ion channels in biofilms. Acta Scientiarum Naturalium Universitatis Intramongoljcae. 2, 215-235 (1984).
- Lei, M., Sun, S. Advances in the mechanism of arrhythmia induced by sodium channel disease. Journal of Clinical Cardiology. 21 (4), 246-248 (2005).
- Varró, A., et al. Cardiac transmembrane ion channels and action potentials: Cellular physiology and arrhythmogenic behavior. Physiological Reviews. 101 (3), 1083-1176 (2021).
- Campuzano, O., et al. Negative autopsy and sudden cardiac death. International Journal of Legal Medicine. 128 (4), 599-606 (2014).
- Amin, A. S., Asghari-Roodsari, A., Tan, H. L. Cardiac sodium channelopathies. Pflügers Archiv: European Journal of Physiology. 460 (2), 223-237 (2010).
- Benitah, J. P., et al. Voltage gated Ca2+ currents in the human pathophysiologic heart: A review. Basic Research in Cardiology. 97 (1), 111-118 (2002).
- Banyasz, T., Horvath, B., Jian, Z., Izu, L. T., Chen-Izu, Y. Sequential dissection of multiple ionic currents in single cardiac myocytes under action potential-clamp. Journal of Molecular and Cellular Cardiology. 50 (3), 578-581 (2011).
- Nerbonne, J. M. Molecular basis of functional myocardial potassium channel diversity. Cardiac Electrophysiology Clinics. 8 (2), 257-273 (2016).
- Grant, A. O. Cardiac ion channels. Circulation: Arrhythmia and Electrophysiology. 2 (2), 185-194 (2009).
- Olson, T. M., et al. Kv1.5 channelopathy due to KCNA5 loss-of-function mutation causes human atrial fibrillation. Human Molecular Genetics. 15 (14), 2185-2191 (2006).
- Christophersen, I. E., et al. Genetic variation in KCNA5: impact on the atrial-specific potassium current IKur in patients with lone atrial fibrillation. European Heart Journal. 34 (20), 1517-1525 (2013).
- Barry, D. M., Xu, H., Schuessler, R. B., Nerbonne, J. M. Functional knockout of the transient outward current, long-QT syndrome, and cardiac remodeling in mice expressing a dominant-negative Kv4 alpha subunit. Circulation Research. 83 (5), 560-567 (1998).
- Abbott, G. W., Xu, X., Roepke, T. K. Impact of ancillary subunits on ventricular repolarization. Journal of Electrocardiology. 40, 42-46 (2007).
- Jia, W. J., et al. Recent studies on the application of patch-clamp technique in cellular electrophysiology. Journal of Chemical Engineering of Chinese Universities. 32 (4), 767-778 (2018).
- Leuthardt, E. C., et al. Using the electrocorticographic speech network to control a brain-computer interface in humans. Journal of Neural Engineering. 8 (3), 1-3 (2011).
- Tian, J. The applying progress of patch-clamp technique. Journal of Jilin Medical University. 4, 227-229 (2008).
- Wang, Z. Q., et al. Effects of shensong yangxin capsule on c-type Kv1.4 potassium channel. Chinese Heart Journal. 21 (6), 782-785 (2009).
- Huang, X. Y. The effect of resveratrol on Kv2.1 potassium channels in cardiac myocytes. Chinese Journal of Cardiac Pacing and Electrophysiology. 34 (5), 484-487 (2020).
- Wang, C., et al. Effects of neferine on Kv4.3 channels expressed in HEK293 cells and ex vivo electrophysiology of rabbit hearts. Acta Pharmacologica Sinica. 36 (12), 1451-1461 (2005).
- Gao, Y., et al. Aconitine: A review of its pharmacokinetics, pharmacology, toxicology and detoxification. Journal of Ethnopharmacology. 293, 115270 (2022).
- Zhou, W., et al. Cardiac efficacy and toxicity of aconitine: A new frontier for the ancient poison. Medicinal Research Reviews. 41 (3), 1798-1811 (2021).
- An, J. R., et al. The effects of tegaserod, a gastrokinetic agent, on voltage-gated K+ channels in rabbit coronary arterial smooth muscle cells. Clinical and Experimental Pharmacology & Physiology. 48 (5), 748-756 (2021).
- Sun, Q., Liu, F., Zhao, J., Wang, P., Sun, X. Cleavage of Kv2.1 by BACE1 decreases potassium current and reduces neuronal apoptosis. Neurochemistry International. 155, 105310 (2022).
- Manz, K. M., Siemann, J. K., McMahon, D. G., Grueter, B. A. Patch-clamp and multi-electrode array electrophysiological analysis in acute mouse brain slices. STAR Protocols. 2 (2), 100442 (2021).
- Kanda, H., Tonomura, S., Dai, Y., Gu, J. G. Protocol for pressure-clamped patch-clamp recording at the node of Ranvier of rat myelinated nerves. STAR Protocols. 2 (1), 100266 (2021).
- Ma, J., et al. High purity human-induced pluripotent stem cell-derived cardiomyocytes: electrophysiological properties of action potentials and ionic currents. American Journal of Physiology-Heart and Circulatory Physiology. 301 (5), 2006-2017 (2011).
- Yoshimura, M., et al. Application of in vivo patch-clamp technique to pharmacological analysis of synaptic transmission in the CNS. Nihon Yakurigaku Zasshi. Folia Pharmacologica Japonica. 124 (2), 111-118 (2004).
- Aziz, Q., Nobles, M., Tinker, A. Whole-cell and perforated patch-clamp recordings from acutely-isolated murine sinoatrial node cells. Bio-protocol. 10 (1), 3478 (2020).
- Witchel, H. J., Milnes, J. T., Mitcheson, J. S., Hancox, J. C. Troubleshooting problems with in vitro screening of drugs for QT interval prolongation using HERG K+ channels expressed in mammalian cell lines and Xenopus oocytes. Journal of Pharmacological and Toxicological Methods. 48 (2), 65-80 (2002).
- Rodriguez-Menchaca, A. A., Ferrer, T., Navarro-Polanco, R. A., Sanchez-Chapula, J. A., Moreno-Galindo, E. G. Impact of the whole-cell patch-clamp configuration on the pharmacological assessment of the hERG channel: Trazodone as a case example. Journal of Pharmacological and Toxicological Methods. 69 (3), 237-244 (2014).
- Yang, S., Liu, Z. W., Zhang, Y. X. The development of in vivo patch clamp technique. Chinese Remedies & Clinics. 5, 399-401 (2003).
- Lin, Y. F., Ouyang, S. Research progress and application of patch clamp technique. Strait Pharmaceutical Journal. 9, 8-11 (2008).
- Li, S., et al. An insight into current advances on pharmacology, pharmacokinetics, toxicity and detoxification of aconitine. Biomedicine & Pharmacotherapy. 151, 113115 (2022).
- Chan, T., Chan, J., Tomlinson, B., Critchley, J. Chinese herbal medicines revisited: A Hong Kong perspective. Lancet. 342 (8886-8887), 1532-1534 (1993).
- Jiang, H., Zhang, Y. T., Zhang, Y., Wang, X. B., Meng, X. L. An updated meta-analysis based on the preclinical evidence of mechanism of aconitine-induced cardiotoxicity. Frontiers in Pharmacology. 13, 900842 (2022).
- Liu, Y. Myocardial toxicity of aconite alkaloids. Shenyang Pharmaceutical University. , (2007).
- Li, Y., et al. Aconitine blocks HERG and Kv1.5 potassium channels. Journal of Ethnopharmacology. 131 (1), 187-195 (2010).
- Campbell, D. T. Modified kinetics and selectivity of sodium channels in frog skeletal muscle fibers treated with aconitine. The Journal of General Physiology. 80 (5), 713-731 (1982).
- Huang, X. Y., Ying, Y. C. The effect of specific protein 1 on Kv2.1 potassium channel in cardiac myocytes. Journal of Electrocardiology and Circulation. 39 (4), 338-341 (2020).
- Cao, J. B. Development and application of patch clamp technique. Journal of Yuncheng University. 27 (2), 53-55 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved