Method Article
Registrazione della corrente di potassio voltaggio-dipendente su cardiomiociti H9C2 tramite la tecnica del patch-clamp a cellule intere
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Il presente protocollo descrive un metodo efficiente per l'acquisizione dinamica e in tempo reale delle correnti del canale del potassio voltaggio-dipendente (Kv) nei cardiomiociti H9c2 utilizzando la tecnica patch-clamp dell'intera cellula.
Abstract
I canali del potassio sulla membrana cellulare miocardica svolgono un ruolo importante nella regolazione delle attività elettrofisiologiche cellulari. Essendo uno dei principali canali ionici, i canali del potassio voltaggio-dipendenti (Kv) sono strettamente associati ad alcune gravi malattie cardiache, come il danno miocardico indotto da farmaci e l'infarto del miocardio. Nel presente studio, la tecnica patch-clamp dell'intera cellula è stata impiegata per determinare gli effetti di 1,5 mM 4-aminopiridina (4-AP, un inibitore del canale del potassio ad ampio spettro) e aconitina (AC, 25 μM, 50 μM, 100 μM e 200 μM) sulla corrente del canale Kv (IKv) nei cardiomiociti H9c2. È stato riscontrato che il 4-AP ha inibito I Kv di circa il 54%, mentre l'effetto inibitorio dell'AC sull'IKv ha mostrato una tendenza dose-dipendente (nessun effetto per 25 μM, tasso inibitorio del 30% per 50 μM, tasso inibitorio del 46% per 100 μM e tasso inibitorio del 54% per 200 μM). A causa delle caratteristiche di maggiore sensibilità e precisione, questa tecnica promuoverà l'esplorazione della cardiotossicità e degli effetti farmacologici dell'etnomedicina che prendono di mira i canali ionici.
Introduzione
I canali ionici sono speciali proteine integrate incorporate nel doppio strato lipidico della membrana cellulare. In presenza di attivatori, i centri di tali speciali proteine integrate formano pori idrofili altamente selettivi, consentendo agli ioni di dimensioni e cariche appropriate di passare attraverso in modo di trasporto passivo1. I canali ionici sono alla base dell'eccitabilità cellulare e della bioelettricità e svolgono un ruolo chiave in una varietà di attività cellulari2. Il cuore fornisce sangue ad altri organi attraverso contrazioni regolari derivanti da un processo accoppiato eccitazione-contrazione avviato da potenziali d'azione3. Studi precedenti hanno confermato che la generazione di potenziali d'azione nei cardiomiociti è causata dal cambiamento della concentrazione di ioni intracellulari e l'attivazione e l'inattivazione dei canali ionici Na+, Ca2+ e K+ nei cardiomiociti umani portano alla formazione di potenziali d'azione in una certa sequenza 4,5,6. Le correnti disturbate del canale del potassio voltaggio-dipendente (Kv) (IKv) potrebbero modificare il normale ritmo cardiaco, portando ad aritmie, che sono una delle principali cause di morte. Pertanto, la registrazione dell'IKv è fondamentale per comprendere i meccanismi dei farmaci per il trattamento di aritmie potenzialmente letali7.
Il canale Kv è un componente importante del canale del potassio. La funzione di coordinazione del canale Kv svolge un ruolo importante nell'attività elettrica e nella contrattilità miocardica del cuore dei mammiferi 8,9,10. Nei cardiomiociti, l'ampiezza e la durata dei potenziali d'azione dipendono dalla co-conduzione di correnti K+ verso l'esterno da parte di più sottotipi di canale Kv11. La regolazione della funzione del canale Kv è molto importante per la normale ripolarizzazione del potenziale d'azione cardiaco. Anche il minimo cambiamento nella conduttanza Kv influisce notevolmente sulla ripolarizzazione cardiaca e aumenta la possibilità di aritmia12,13.
Rappresentando un metodo fondamentale nella ricerca elettrofisiologica cellulare, un sigillo ad alta resistenza tra una piccola area della membrana cellulare e una punta di pipetta per la registrazione di patch-clamp a cellule intere può essere stabilito applicando una pressione negativa. La pressione negativa continua fa sì che la membrana cellulare entri in contatto con la punta della pipetta e si attacchi alla parete interna della pipetta. Il circuito elettrico completo risultante consente di registrare qualsiasi corrente di canale ionico singolo attraverso la superficie della membrana cellulare14. Questa tecnica ha una sensibilità molto elevata per la corrente del canale ionico della membrana cellulare e può essere utilizzata per rilevare correnti in tutti i canali ionici e le applicazioni sono estremamente ampie15. Inoltre, rispetto all'etichettatura fluorescente e all'etichettatura radioattiva, il patch-clamp ha maggiore autorità e precisione16. Allo stato attuale, la tecnica patch-clamp a cellule intere è stata utilizzata per rilevare i componenti della medicina tradizionale cinese che agiscono sulle correnti del canale Kv17,18,19. Ad esempio, Wang et al. hanno utilizzato la tecnica patch-clamp dell'intera cellula e hanno confermato che il componente efficace del seme di loto potrebbe raggiungere l'inibizione del canale Kv4.3 bloccando i canali di stato attivati19. L'aconitina (AC) è uno dei principi attivi ed efficaci delle specie di Aconitum, come Aconitum carmichaeli Debx e Aconitum pendulum Busch. Numerosi studi hanno dimostrato che overdose di AC può causare aritmie e persino arresto cardiaco20. L'interazione tra AC e canali ionici voltaggio-dipendenti porta alla rottura dell'omeostasi ionica intracellulare, che è il meccanismo chiave della cardiotossicità21. Pertanto, in questo studio, la tecnica patch-clamp dell'intera cellula viene utilizzata per determinare gli effetti dell'AC sui cardiomiociti IKv.
Protocollo
I cardiomiociti di ratto H9c2 ottenuti commercialmente (vedere la tabella dei materiali) sono stati incubati in DMEM contenente il 10% di siero bovino fetale inattivato dal calore (FBS) e l'1% di penicillina-streptomicina a 37 °C in atmosfera umidificata al 5% di CO2. La tecnica patch-clamp dell'intera cellula è stata quindi impiegata per rilevare i cambiamenti in IKv nelle cellule H9c2 normali e nelle cellule trattate con 4-AP o AC (Figura 1 e Figura 2).
1. Preparazione della soluzione
- Preparare il terreno di coltura cellulare DMEM contenente il 10% di FBS e l'1% di penicillina-streptomicina (vedere la tabella dei materiali).
- Preparare la soluzione 4-AP 1,5 M aggiungendo 14,1165 mg di 4-AP a 100 μL di soluzione DMSO (vedere Tabella dei materiali). Diluire 1,5 M 4-AP a 1,5 mM aggiungendo la soluzione extracellulare (fase 1.5).
- Preparare 400 mM AC aggiungendo 5 mg di AC a 19,36 μL di soluzione DMSO (vedere Tabella dei materiali).
NOTA: Tutte le soluzioni di cui sopra sono state conservate in un frigorifero a 4 °C e la concentrazione finale del DMSO non deve superare lo 0,1% (v/v). - Preparare 50 mL di soluzione intracellulare aggiungendo 0,4100 g di KCl (110,0 mM), 0,0120 g di MgCl 2 (1,2 mM), 0,1270 g di Na2 ATP (5,0 mM), 0,1190 g di HEPES (10,0 mM) e 0,1900 g di EGTA (10,0 mM) in 50 mL di acqua bidistillata (vedere Tabella 1 e Tabella dei materiali).
NOTA: Il valore del pH della soluzione intracellulare è stato regolato a 7,2 utilizzando 1 M KOH ed è stato aliquotato in piccoli volumi (1,5-2 ml) e conservato a -20 °C. - Preparare 50 mL di soluzione extracellulare aggiungendo 0,0185 g di KCl (5,0 mM), 0,3945 g di NaCl (135,0 mM), 0,0203 g di MgCl 2·6H2O (2,0 mM), 0,0595 g di HEPES (5,0 mM) e 0,0990 g di D-glucosio (10,0 mM) in 50 mL di acqua bidistillata (vedere Tabella 1 e Tabella dei materiali).
NOTA: La soluzione extracellulare deve essere preparata per l'uso immediato e il suo valore di pH deve essere regolato a 7,4 utilizzando 1 M NaOH.
2. Coltura cellulare
- Una volta che il piatto di coltura H9c2 diventa confluente all'80%, digerire le cellule con tripsina allo 0,25% per 30 s.
- Coltura 2 x 10 5 cellule/ml con terreno normale o terreno contenente farmaci (25 μM, 50 μM, 100 μM e 200 μM AC) in un piatto da 35 mm tappezzato con lastre di vetro per 24 ore a 37 °C, con un'atmosfera di CO2 al5% e un'umidità relativa dal 70% all'80% (vedi Tabella dei materiali).
3. Fabbricazione di micropipette
- Accendere l'estrattore di micropipette (vedere Tabella dei materiali) e preriscaldare per 30 minuti.
- Mettere un capillare di vetro borosilicato con un filamento (OD: 1,5 mm, ID: 1,10 mm, lunghezza 10 cm) sull'estrattore di micropipette. Selezionare il programma impostato nel punto 3.3 e fare clic su Invio nel pannello di controllo. Fare clic sul programma Rampa nell'angolo in alto a destra per determinare il valore "Calore" del capillare di vetro.
- Scrivere il programma per tirare l'elettrodo in base al valore determinato dal test "Rampa" e utilizzare i seguenti passaggi: valore "Calore" = valore "Rampa", Pull = 0, Vel = velocità di movimento dell'asta di trazione, Tempo = 200-250. Fare clic su Tirare per iniziare a fabbricare le pipette.
NOTA: Osservare il colore degli essiccanti nel contenitore sigillato dell'estrattore di micropipette prima di utilizzarlo. Se il colore cambia dal blu al rosa, gli essiccanti devono essere sostituiti. Per evitare la contaminazione della punta dell'elettrodo, cercare di non toccare la parte centrale del capillare di vetro durante la preparazione della pipetta. Successivamente, rimuovere con cura le pipette prodotte e metterle in un contenitore chiuso e sigillato.
4. Configurazione dello strumento
- Accendere gli strumenti corrispondenti nel seguente ordine: il convertitore digitale-analogico, l'amplificatore di segnale, il micromanipolatore, il microscopio e la fotocamera (vedi Tabella dei materiali).
- Aprire l'applicazione di imaging, il software di amplificazione del segnale e il software di acquisizione dati in sequenza (vedere Tabella dei materiali).
NOTA: Lo strumento deve essere acceso in sequenza; in caso contrario, lo stato "Demo Digitizer" apparirà dopo l'apertura del software.
5. Impostazione dei parametri IKv
- Modificare il protocollo per la registrazione di IKv seguendo i passaggi seguenti.
- Fare clic su Modifica e selezionare Modifica protocollo nel software di acquisizione dati (vedere Tabella dei materiali).
- Modificare il programma nell'interfaccia "Forma d'onda": Epoca A (Primo livello = −60 mV, livello Delta = 0 mV, Prima durata = 20 ms e Durata Delta = 0 ms); Epoca B (Primo livello = −40 mV, livello Delta = 10 mV, Prima durata = 150 ms e durata Delta = 0 ms), ed Epoca C (Primo livello = −60 mV, livello Delta = 0 mV, Prima durata = 30 ms e Durata Delta = 0 ms).
- Quindi, fai clic sull'interfaccia Mode/Rate e imposta i dati "Trial Hierarchy": Ritardo di prova = 0 s, Esecuzioni = 1, Sweep = 11 e Durata sweep = 0,22 s22,23.
NOTA: acquisire le correnti del canale IKv applicando passi di depolarizzazione di 150 ms da -40 mV a +60 mV con un incremento di 10 mV con un potenziale di mantenimento di -60 mV in condizioni di controllo. Il tempo totale del protocollo deve essere maggiore del tempo impostato nel programma "Waveform".
- Modificare il programma di sottrazione di perdite P/N: fare clic su Modifica protocollo per selezionare il pulsante Stimolo e impostare il programma di sottrazione perdita nella finestra di dialogo Sottrazione perdita P/N : numero di Subsweep = 2-8 (4 in questo studio), Tempo di assestamento = 100-1.000 ms (200 in questo studio), "Polarità" = "Opposto alla forma d'onda", livello di mantenimento = −80 mV.
NOTA: la sottrazione P/N Leak deve avere un livello di mantenimento inferiore alla "Prima tenuta" (−60 mV).
6. Registrazione patch-clamp a cella intera di I Kv in modalità tension-clamp
- Stabilire il percorso di memorizzazione dei dati: fare clic su File e selezionare Imposta nomi file di dati nel software di acquisizione dati. Aprire il protocollo IKv stabilito (passo 5.1) selezionando Modifica e facendo clic su Protocollo aperto nel software di acquisizione dati. Infine, fai clic sull'opzione Strumenti e seleziona Membrane Test per avviare l'esecuzione del protocollo.
- Aggiungere la soluzione extracellulare (punto 1.5) al bagno cellulare sull'apparecchio patch-clamp a cellula intera (vedere Tabella dei materiali) e posizionare il vetrino di copertura verso l'alto con le cellule H9c2 (coltivate al punto 2.1) nel bagno.
- Riempire il 30% della pipetta (fabbricata nella fase 3) con la soluzione extracellulare e installarla sul supporto dell'elettrodo di registrazione integrato nell'apparecchio patch-mors. Stringere la pipetta con la guarnizione in gomma dell'o-ring e la rondella di plastica. Quindi, rilasciare la pipetta nella vasca da bagno con il micromanipolatore. Fare clic sull'interfaccia Pipette offset del software dell'amplificatore di segnale (vedere Tabella dei materiali) per mantenere la linea di base della corrente IKv a 0 pA.
NOTA: La soluzione intracellulare (punto 1.4) deve essere a contatto con la porzione AgCl/Ag del filo d'argento e il filo d'argento non deve trovarsi vicino alla parete interna della pipetta. La resistenza della pipetta deve essere 2-6 MΩ. Per evitare l'occlusione della punta della pipetta, è necessario erogare una pressione positiva continua alla pipetta utilizzando una siringa da 1,0 mL collegata al supporto dell'elettrodo di registrazione tramite un tubo di plastica24. - Erogare manualmente una pressione positiva appropriata con una siringa da 1,0 mL collegata al supporto dell'elettrodo di registrazione attraverso un tubo di plastica. Spostare leggermente la pipetta manipolando il micromanipolatore in tre dimensioni per contattare la cella.
- Una volta che l'onda quadra di prova della membrana scende da 1/3 a 1/2 dopo che la pipetta tocca la membrana cellulare, rimuovere la pressione positiva e fornire manualmente una pressione negativa appropriata. Quindi, fare clic sull'interfaccia Patch del software di acquisizione dati per formare il sigillo GΩ. Utilizzare il software di amplificazione del segnale "C p Fast" e "Cp Slow" durante la sigillatura delle celle per compensare la capacità veloce e lenta.
NOTA: quando il test della membrana è ≥1 GΩ, si forma una configurazione collegata alla cella tra la punta della pipetta e la cella. - Applicare brevi impulsi di pressione negativa per rompere una zona della membrana cellulare.
NOTA: Una riduzione precipitosa della resistenza della membrana caratterizza un modello di registrazione di cellule intere di successo. Se la resistenza di accesso (Ra) ≥30 MΩ, le celle devono essere riselezionate per i passaggi 6.3-6.6. Al fine di garantire l'accuratezza dei dati IKv registrati, la pressione negativa deve essere rimossa dopo la rottura della membrana cellulare. - Eseguire la compensazione della capacità della membrana dell'intera cella facendo clic sul pulsante Intera cella del software dell'amplificatore di segnale. Infine, salva e registra i dati facendo clic sul pulsante Registrazione dati .
- Aprire i dati IKv salvati con il software di analisi dei dati. Salvare le relazioni corrente-tensione (I−V): cliccare su Analizza per selezionare Statistiche e fare quanto segue: selezionare l'Intervallo come Cousors 1,2 per l'analisi dei dati; fare clic sui pulsanti Ampiezza picco e Media , quindi fare clic su OK per visualizzare i dati nella pagina Risultati . Infine, copiare la colonna dei dati medi IKv nel software di disegno delle funzioni (vedi Tabella dei materiali) per ulteriori analisi.
- Salvare le tracce correnti rappresentative IKv : cliccare su Modifica per selezionare Transfer Traces; quindi, selezionare la traccia completa nella regione da trasferire; quindi, fare clic su Seleziona in Selezione traccia e selezionare IN 0 (pA) in Segnali; infine, fare clic su OK per visualizzare i dati nella pagina "Risultati" e copiare i dati totali nel software di disegno della funzione per disegnare le tracce correnti.
- Salvare il protocollo IKv : cliccare su Modifica per selezionare Create Stimulus Waveform Signal, e selezionare OK. Quindi, ripetere il passaggio 6.9 tranne che per selezionare A0 # 0 (mA) in "Segnali".
Risultati
Questo protocollo ha permesso la registrazione dell'IKv secondo i parametri impostati nella tecnica patch-clamp a tutta cella. L'IKv è stato attivato da 150 ms di stimolo impulsivo depolarizzante da -40 a +60 mV con un potenziale di mantenimento di -60 mV (Figura 3A). IKv dei cardiomiociti di ratto H9c2 sono apparsi per la prima volta intorno a -20 mV, e poi l'ampiezza è aumentata con un'ulteriore depolarizzazione. La relazione media tra IKv e potenziale di membrana è stata calcolata dalle ampiezze di corrente misurate. I risultati hanno mostrato che, rispetto al gruppo di controllo, l'ampiezza di IKv è stata osservabilmente ridotta dopo il trattamento di 5 minuti con 1,5 mM 4-AP (Figura 3B). Inoltre, l'IKv è diminuito significativamente ai potenziali di membrana da 10 mV a 60 mV in modo dose-dipendente dopo il trattamento AC di 24 ore (Figura 3C-F).

Figura 1: Attrezzature e strumenti necessari per registrare IKv. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 2: Diagramma di flusso della registrazione elettrofisiologica di IKv in cellule H9c2 mediante una tecnica patch-clamp a cellule intere. (A) Coltura cellulare. (B) Preparazione delle soluzioni intracellulari ed extracellulari. (C) Illustrazione schematica della registrazione di intere celle. C1: Avvicinare la pipetta alla cella; C2: Formare una guarnizione ad alta resistenza tra la pipetta e la cella; C3: Rompere la membrana cellulare. (d) Registrare l'IKv. D1: Diagramma schematico della formazione della corrente K+; D2: Tracce di corrente rappresentative per IKv registrate in modalità tension-clamp a cella intera. Fare clic qui per visualizzare una versione ingrandita di questa figura.
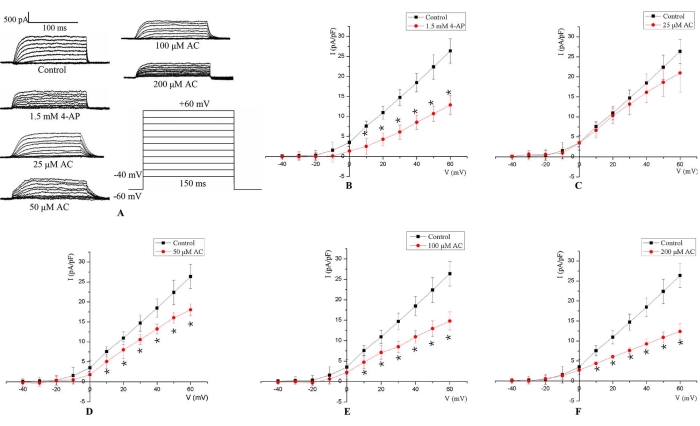
Figura 3: Rappresentativo IKv in H9c2 celle. (A) Tracce di corrente rappresentative per IKv misurate in cellule H9c2 senza alcun trattamento (gruppo di controllo), con mezzi contenenti CA per 24 ore (25 μM, 50 μM, 100 μM e 200 μM) e con 1,5 mM 4-AP per 5 min. L'IKv è stato attivato da 150 ms di impulso depolarizzatore da -40 a +60 mV con un potenziale di mantenimento di -60 mV. (B) Per la stimolazione 4-AP da 1,5 mM, iKv sono scesi a potenziali di membrana da 10 mV a 60 mV. (C-F) Il trattamento AC ha ridotto l'IKv in modo dipendente dalla concentrazione ai potenziali di membrana da 10 mV a 60 mV. *p < 0,05 rispetto al gruppo di controllo (n = 6). Fare clic qui per visualizzare una versione ingrandita di questa figura.
| Soluzione extracellulare | ||
| Prodotti chimici | g/50 mL | Composizione (mM) |
| NaCl | 0.3945 | 135.0 |
| Kcl | 0.1865 | 5.0 |
| HEPES | 0.5958 | 5.0 |
| MgCl 2·6H2O | 0.2033 | 2.0 |
| D-glucosio | 0.9900 | 10.0 |
| Soluzione intracellulare | ||
| Prodotti chimici | g/50 mL | Composizione (mM) |
| Kcl | 0.4100 | 110.0 |
| MgCl2 | 0.0120 | 1.2 |
| Na2-ATP | 0.1270 | 5.0 |
| HEPES | 0.1190 | 10.0 |
| EGTA | 0.1900 | 10.0 |
Tabella 1: Soluzioni intracellulari ed extracellulari per la registrazione di IKv in modalità tensionale-morsetto.
Discussione
La tecnica elettrofisiologica patch-clamp viene utilizzata principalmente per registrare e riflettere l'attività elettrica e le caratteristiche funzionali dei canali ionici sulla membrana cellulare25. Allo stato attuale, i principali metodi di registrazione della tecnica patch-clamp includono la registrazione a canale singolo e la registrazione a cella intera26. Per la modalità a cella intera, il microelettrodo di vetro e la pressione negativa vengono utilizzati per formare una guarnizione ad alta resistenza tra una piccola area della membrana cellulare e una punta di pipetta27. Una volta che la pressione negativa sostenuta provoca la rottura della membrana cellulare da parte della punta della pipetta e la membrana si attacca alla parete interna della pipetta, il circuito elettrico completo formato tra la pipetta e la cella consente di registrare la densità di corrente dei singoli canali ionici sulla superficie della membrana cellulare26,27 . Negli ultimi anni, la tecnica patch-clamp a cellule intere è stata ampiamente utilizzata per la ricerca farmacologica mirata alle malattie legate ai canali ionici. Sebbene abbia requisiti elevati per gli operatori, questa tecnica rimane ancora il "gold standard" per la ricerca sui canali ionici28. Inoltre, la tecnica del patch-clamp perforato può anche registrare i cambiamenti attuali nei canali ionici bersaglio in ambienti intracellulari relativamente stabili per periodi prolungati utilizzando antibiotici per formare pori di permeabilità nella membrana cellulare 29,30. Si possono registrare e tracciare i cambiamenti dinamici nella tensione o nella corrente dei canali ionici utilizzando la tecnica patch-clamp a tutta cella in modalità current-clamp o voltage-clamp, rendendo questa senza dubbio una potente piattaforma per valutare l'attività farmacologica o i meccanismi di tossicità dei farmaci31,32.
L'AC è uno dei principali componenti tossici delle specie di Aconitum, appartiene al gruppo degli alcaloidi diestere-diterpenoidi ed è altamente tossico20,33. L'evidenza ha indicato che l'AC può causare tossicità cardiovascolare34,35. Come bloccante del canale K+ non selettivo, è stato riportato che AC può bloccare la corrente K+ transitoria verso l'esterno, la corrente K+ del raddrizzatore ritardato ultra-rapido e la corrente K+ del raddrizzatore ritardato veloce, inducendo aritmie21,36,37. Ad oggi, non ci sono prove evidenti che le correnti di potassio dipendenti dalla tensione siano coinvolte nella cardiotossicità dell'AC. Pertanto, in questo studio, l'effetto inibitorio dell'AC sul IKv nei cardiomiociti H9c2 del ratto è stato esaminato utilizzando la tecnica patch-clamp dell'intera cellula. L'attivazione dei canali Na+ è un meccanismo ampiamente riconosciuto mediante il quale l'AC esercita effetti farmacologici o tossicologici38. È interessante notare che ci sono prove che AC può agire direttamente su IKv 21,36,37. Tuttavia, i dati presentati in questo documento non forniscono prove sufficienti che l'AC possa inibire direttamente l'IKv. L'effetto inibitorio IKv di AC può essere dovuto all'attivazione diretta dei canali Na+, che richiede ulteriori indagini.
Fin dal suo inizio e sviluppo, la tecnica patch-clamp a cellule intere utilizzata in questo studio è diventata un metodo convenzionale per esplorare la cardiotossicità dei farmaci in termini di canali ionici. Questo esperimento ha confermato che l'AC ha inibito efficacemente iKv delle celle H9c2 in modo dipendente dalla concentrazione in modalità tensionale-morsetto. Tuttavia, ogni tipo di canale ionico, compresi i canali K +, contiene diversi sottotipi e in questo studio è stata registrata solo la corrente totale del canale K + dipendente dalla tensione. Studi successivi possono esplorare i meccanismi farmacologici e tossicologici dell'AC mediante linee cellulari modello ad alta espressione di specifici sottotipi di canali ionici37. In alternativa, si possono incorporare specifici canali ionici marcati con proteine fluorescenti per studiare visivamente la tossicità miocardica dell'AC39. I passaggi critici di questo protocollo sono i passaggi 6.4-6.6; il completamento di questi tre passaggi determina direttamente se la successiva registrazione di IKv ha esito positivo. Rispetto ad altre tecnologie, la tecnica patch-clamp a cellula intera è il metodo gold standard e accettato per registrare la corrente in singoli canali ionici nella membrana cellulare o nella membrana dell'organello, con le caratteristiche di elevati requisiti tecnici e registrazione a bassa produttività40. In sintesi, questa tecnica non è solo un metodo di base per la ricerca sull'elettrofisiologia cellulare, ma è anche ampiamente utilizzata nelle neuroscienze, nelle scienze cardiovascolari e in altri campi.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Apprezziamo il sostegno finanziario della National Natural Science Foundation of China (82130113) e del Key R&D and Transformation Program del Dipartimento di Scienza e Tecnologia della Provincia del Qinghai (2020-SF-C33).
Materiali
| Name | Company | Catalog Number | Comments |
| 4-Aminopyridine | Sigma | MKCJ2184 | |
| Aconitine | Chengdu Lemetian Medical Technology Co., Ltd | DSTDW000602 | |
| Amplifier | Axon Instrument | MultiClamp 700B | |
| Analytical Balance | Sartorius | 124S-CW | |
| ATP Na2 | Solarbio | 416O022 | |
| Borosilicate glass with filament (O.D.: 1.5 mm, I.D.: 1.10 mm, 10 cm length) | Sutter Instrument | 163225-5 | |
| Cell culture dish (100 mm) | Zhejiang Sorfa Life Science Research Co., Ltd | 1192022 | |
| Cell culture dish (35 mm) | Zhejiang Sorfa Life Science Research Co., Ltd | 3012022 | |
| Clampex software | Molecular Devices, LLC. | Version 10. 5 | |
| Clampfit software | Molecular Devices, LLC. | Version 10. 6. 0. 13 | data acqusition software |
| D-(+)-glucose | Rhawn | RH289133 | |
| Digital camera | Hamamatsu | C11440 | |
| Digitizer | Axon Instrument | Axon digidata 1550B | |
| DMSO | Boster Biological Technology Co., Ltd | PYG0040 | |
| Dulbecco's modified eagle medium (1x) | Gibco | 8121587 | |
| EGTA | Biofroxx | EZ6789D115 | |
| Fetal bovine serum | Gibco | 2166090RP | |
| Flaming/brown micropipette puller | Sutter Instrument | Model P-1000 | |
| H9c2 cells | Hunan Fenghui Biotechnology Co., Ltd | CL0111 | |
| HCImageLive | Hamamatsu | 4.5.0.0 | |
| HCl | Sichuan Xilong Scientific Co., Ltd | 2106081 | |
| HEPES | Xiya Chemical Technology (Shandong) Co., Ltd | 20210221 | |
| KCl | Chengdu Colon Chemical Co., Ltd | 2020082501 | |
| KOH | Chengdu Colon Chemical Co., Ltd | 2020112601 | |
| MgCl2 | Tianjin Guangfu Fine Chemical Research Institute | 20160408 | |
| MgCl2·6H2O | Chengdu Colon Chemical Co., Ltd | 2021020101 | |
| Micromanipulator | Sutter Instrument | MP-285A | |
| Microscope | Olympus | IX73 | |
| Microscope cover glass (20 × 20 mm) | Jiangsu Citotest Experimental Equipment Co. Ltd | 80340-0630 | |
| Milli-Q | Chengdu Bioscience Technology Co., Ltd | Milli-Q IQ 7005 | |
| MultiClamp 700B commander | Axon Instrument | MultiClamp commander 2.0 | signal-amplifier software |
| OriginPro 8 software | OriginLab Corporation | v8.0724(B724) | |
| Penicillin-Streptomycin (100x) | Boster Biological Technology Co., Ltd | 17C18B16 | |
| PH meter | Mettler Toledo | S201K | |
| Phosphate buffered saline (1x) | Gibco | 8120485 | |
| Trypsin 0.25% (1x) | HyClone | J210045 |
Riferimenti
- Luan, Q. H. Passive transport and ion channels in biofilms. Acta Scientiarum Naturalium Universitatis Intramongoljcae. 2, 215-235 (1984).
- Lei, M., Sun, S. Advances in the mechanism of arrhythmia induced by sodium channel disease. Journal of Clinical Cardiology. 21 (4), 246-248 (2005).
- Varró, A., et al. Cardiac transmembrane ion channels and action potentials: Cellular physiology and arrhythmogenic behavior. Physiological Reviews. 101 (3), 1083-1176 (2021).
- Campuzano, O., et al. Negative autopsy and sudden cardiac death. International Journal of Legal Medicine. 128 (4), 599-606 (2014).
- Amin, A. S., Asghari-Roodsari, A., Tan, H. L. Cardiac sodium channelopathies. Pflügers Archiv: European Journal of Physiology. 460 (2), 223-237 (2010).
- Benitah, J. P., et al. Voltage gated Ca2+ currents in the human pathophysiologic heart: A review. Basic Research in Cardiology. 97 (1), 111-118 (2002).
- Banyasz, T., Horvath, B., Jian, Z., Izu, L. T., Chen-Izu, Y. Sequential dissection of multiple ionic currents in single cardiac myocytes under action potential-clamp. Journal of Molecular and Cellular Cardiology. 50 (3), 578-581 (2011).
- Nerbonne, J. M. Molecular basis of functional myocardial potassium channel diversity. Cardiac Electrophysiology Clinics. 8 (2), 257-273 (2016).
- Grant, A. O. Cardiac ion channels. Circulation: Arrhythmia and Electrophysiology. 2 (2), 185-194 (2009).
- Olson, T. M., et al. Kv1.5 channelopathy due to KCNA5 loss-of-function mutation causes human atrial fibrillation. Human Molecular Genetics. 15 (14), 2185-2191 (2006).
- Christophersen, I. E., et al. Genetic variation in KCNA5: impact on the atrial-specific potassium current IKur in patients with lone atrial fibrillation. European Heart Journal. 34 (20), 1517-1525 (2013).
- Barry, D. M., Xu, H., Schuessler, R. B., Nerbonne, J. M. Functional knockout of the transient outward current, long-QT syndrome, and cardiac remodeling in mice expressing a dominant-negative Kv4 alpha subunit. Circulation Research. 83 (5), 560-567 (1998).
- Abbott, G. W., Xu, X., Roepke, T. K. Impact of ancillary subunits on ventricular repolarization. Journal of Electrocardiology. 40, 42-46 (2007).
- Jia, W. J., et al. Recent studies on the application of patch-clamp technique in cellular electrophysiology. Journal of Chemical Engineering of Chinese Universities. 32 (4), 767-778 (2018).
- Leuthardt, E. C., et al. Using the electrocorticographic speech network to control a brain-computer interface in humans. Journal of Neural Engineering. 8 (3), 1-3 (2011).
- Tian, J. The applying progress of patch-clamp technique. Journal of Jilin Medical University. 4, 227-229 (2008).
- Wang, Z. Q., et al. Effects of shensong yangxin capsule on c-type Kv1.4 potassium channel. Chinese Heart Journal. 21 (6), 782-785 (2009).
- Huang, X. Y. The effect of resveratrol on Kv2.1 potassium channels in cardiac myocytes. Chinese Journal of Cardiac Pacing and Electrophysiology. 34 (5), 484-487 (2020).
- Wang, C., et al. Effects of neferine on Kv4.3 channels expressed in HEK293 cells and ex vivo electrophysiology of rabbit hearts. Acta Pharmacologica Sinica. 36 (12), 1451-1461 (2005).
- Gao, Y., et al. Aconitine: A review of its pharmacokinetics, pharmacology, toxicology and detoxification. Journal of Ethnopharmacology. 293, 115270 (2022).
- Zhou, W., et al. Cardiac efficacy and toxicity of aconitine: A new frontier for the ancient poison. Medicinal Research Reviews. 41 (3), 1798-1811 (2021).
- An, J. R., et al. The effects of tegaserod, a gastrokinetic agent, on voltage-gated K+ channels in rabbit coronary arterial smooth muscle cells. Clinical and Experimental Pharmacology & Physiology. 48 (5), 748-756 (2021).
- Sun, Q., Liu, F., Zhao, J., Wang, P., Sun, X. Cleavage of Kv2.1 by BACE1 decreases potassium current and reduces neuronal apoptosis. Neurochemistry International. 155, 105310 (2022).
- Manz, K. M., Siemann, J. K., McMahon, D. G., Grueter, B. A. Patch-clamp and multi-electrode array electrophysiological analysis in acute mouse brain slices. STAR Protocols. 2 (2), 100442 (2021).
- Kanda, H., Tonomura, S., Dai, Y., Gu, J. G. Protocol for pressure-clamped patch-clamp recording at the node of Ranvier of rat myelinated nerves. STAR Protocols. 2 (1), 100266 (2021).
- Ma, J., et al. High purity human-induced pluripotent stem cell-derived cardiomyocytes: electrophysiological properties of action potentials and ionic currents. American Journal of Physiology-Heart and Circulatory Physiology. 301 (5), 2006-2017 (2011).
- Yoshimura, M., et al. Application of in vivo patch-clamp technique to pharmacological analysis of synaptic transmission in the CNS. Nihon Yakurigaku Zasshi. Folia Pharmacologica Japonica. 124 (2), 111-118 (2004).
- Aziz, Q., Nobles, M., Tinker, A. Whole-cell and perforated patch-clamp recordings from acutely-isolated murine sinoatrial node cells. Bio-protocol. 10 (1), 3478 (2020).
- Witchel, H. J., Milnes, J. T., Mitcheson, J. S., Hancox, J. C. Troubleshooting problems with in vitro screening of drugs for QT interval prolongation using HERG K+ channels expressed in mammalian cell lines and Xenopus oocytes. Journal of Pharmacological and Toxicological Methods. 48 (2), 65-80 (2002).
- Rodriguez-Menchaca, A. A., Ferrer, T., Navarro-Polanco, R. A., Sanchez-Chapula, J. A., Moreno-Galindo, E. G. Impact of the whole-cell patch-clamp configuration on the pharmacological assessment of the hERG channel: Trazodone as a case example. Journal of Pharmacological and Toxicological Methods. 69 (3), 237-244 (2014).
- Yang, S., Liu, Z. W., Zhang, Y. X. The development of in vivo patch clamp technique. Chinese Remedies & Clinics. 5, 399-401 (2003).
- Lin, Y. F., Ouyang, S. Research progress and application of patch clamp technique. Strait Pharmaceutical Journal. 9, 8-11 (2008).
- Li, S., et al. An insight into current advances on pharmacology, pharmacokinetics, toxicity and detoxification of aconitine. Biomedicine & Pharmacotherapy. 151, 113115 (2022).
- Chan, T., Chan, J., Tomlinson, B., Critchley, J. Chinese herbal medicines revisited: A Hong Kong perspective. Lancet. 342 (8886-8887), 1532-1534 (1993).
- Jiang, H., Zhang, Y. T., Zhang, Y., Wang, X. B., Meng, X. L. An updated meta-analysis based on the preclinical evidence of mechanism of aconitine-induced cardiotoxicity. Frontiers in Pharmacology. 13, 900842 (2022).
- Liu, Y. Myocardial toxicity of aconite alkaloids. Shenyang Pharmaceutical University. , (2007).
- Li, Y., et al. Aconitine blocks HERG and Kv1.5 potassium channels. Journal of Ethnopharmacology. 131 (1), 187-195 (2010).
- Campbell, D. T. Modified kinetics and selectivity of sodium channels in frog skeletal muscle fibers treated with aconitine. The Journal of General Physiology. 80 (5), 713-731 (1982).
- Huang, X. Y., Ying, Y. C. The effect of specific protein 1 on Kv2.1 potassium channel in cardiac myocytes. Journal of Electrocardiology and Circulation. 39 (4), 338-341 (2020).
- Cao, J. B. Development and application of patch clamp technique. Journal of Yuncheng University. 27 (2), 53-55 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon