Method Article
Enregistrement du courant de potassium voltage-dépendant sur les cardiomyocytes H9C2 via la technique de patch-clamp à cellules entières
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Le présent protocole décrit une méthode efficace pour l’acquisition dynamique et en temps réel des courants des canaux potassiques voltage-dépendants (Kv) dans les cardiomyocytes H9c2 en utilisant la technique de patch-clamp à cellules entières.
Résumé
Les canaux potassiques sur la membrane cellulaire du myocarde jouent un rôle important dans la régulation des activités électrophysiologiques cellulaires. Étant l’un des principaux canaux ioniques, les canaux potassiques voltage-dépendants (Kv) sont étroitement associés à certaines maladies cardiaques graves, telles que les lésions myocardiques induites par les médicaments et l’infarctus du myocarde. Dans la présente étude, la technique de patch-clamp à cellules entières a été utilisée pour déterminer les effets de 1,5 mM de 4-aminopyridine (4-AP, un inhibiteur des canaux potassiques à large spectre) et d’aconitine (AC, 25 μM, 50 μM, 100 μM et 200 μM) sur le courant du canal Kv (IKv) dans les cardiomyocytes H9c2. Il a été constaté que la 4-AP inhibait le I Kv d’environ 54%, tandis que l’effet inhibiteur de l’AC sur le IKv montrait une tendance dose-dépendante (aucun effet pour 25 μM, taux inhibiteur de 30% pour 50 μM, taux inhibiteur de 46% pour 100 μM et taux inhibiteur de 54% pour 200 μM). En raison des caractéristiques de sensibilité et de précision plus élevées, cette technique favorisera l’exploration de la cardiotoxicité et des effets pharmacologiques de l’ethnomédecine ciblant les canaux ioniques.
Introduction
Les canaux ioniques sont des protéines intégrées spéciales intégrées dans la bicouche lipidique de la membrane cellulaire. En présence d’activateurs, les centres de ces protéines intégrées spéciales forment des pores hydrophiles hautement sélectifs, permettant aux ions d’une taille et d’une charge appropriées de passer à travers de manière passive1. Les canaux ioniques sont à la base de l’excitabilité cellulaire et de la bioélectricité et jouent un rôle clé dans une variété d’activités cellulaires2. Le cœur fournit du sang à d’autres organes par des contractions régulières résultant d’un processus couplé excitation-contraction initié par des potentiels d’action3. Des études antérieures ont confirmé que la génération de potentiels d’action dans les cardiomyocytes est causée par le changement de la concentration d’ions intracellulaires, et l’activation et l’inactivation des canaux ioniques Na+, Ca2+ et K+ dans les cardiomyocytes humains conduisent à la formation de potentiels d’action dans une certaine séquence 4,5,6. Les courants perturbés des canaux potassiques voltage-dépendants (Kv) (IKv) pourraient modifier le rythme cardiaque normal, entraînant des arythmies, qui sont l’une des principales causes de décès. Par conséquent, l’enregistrement de l’IKv est essentiel pour comprendre les mécanismes des médicaments pour traiter les arythmies potentiellement mortelles7.
Le canal Kv est un composant important du canal potassique. La fonction de coordination du canal Kv joue un rôle important dans l’activité électrique et la contractilité myocardique du cœur des mammifères 8,9,10. Dans les cardiomyocytes, l’amplitude et la durée des potentiels d’action dépendent de la co-conduction des courants K+ sortants par plusieurs sous-types de canaux Kv11. La régulation de la fonction du canal Kv est très importante pour la repolarisation normale du potentiel d’action cardiaque. Même le moindre changement de conductance Kv a un impact considérable sur la repolarisation cardiaque et augmente la possibilité d’arythmie12,13.
Représentant une méthode fondamentale dans la recherche électrophysiologique cellulaire, un joint à haute résistance entre une petite zone de la membrane cellulaire et une pointe de pipette pour l’enregistrement de patch-clamp à cellules entières peut être établi en appliquant une pression négative. La pression négative continue fait que la membrane cellulaire entre en contact avec l’embout de la pipette et colle à la paroi interne de la pipette. Le circuit électrique complet résultant permet d’enregistrer n’importe quel courant de canal ionique unique à travers la surface de la membrane cellulaire14. Cette technique a une très grande sensibilité pour le courant du canal ionique de la membrane cellulaire et peut être utilisée pour détecter des courants dans tous les canaux ioniques, et les applications sont extrêmement larges15. De plus, par rapport au marquage fluorescent et au marquage radioactif, le patch-clamp a une autorité et une précision plus élevées16. À l’heure actuelle, la technique de patch-clamp à cellules entières a été utilisée pour détecter les composants de la médecine traditionnelle chinoise agissant sur les courants du canal Kv17,18,19. Par exemple, Wang et al. ont utilisé la technique du patch-clamp à cellules entières et ont confirmé que le composant efficace de la graine de lotus pourrait atteindre l’inhibition du canal Kv4.3 en bloquant les canaux d’étatactivés 19. L’aconitine (AC) est l’un des ingrédients efficaces et actifs des espèces d’Aconitum, telles que Aconitum carmichaeli Debx et Aconitum pendulum Busch. De nombreuses études ont montré que les surdoses de CA peuvent provoquer des arythmies et même un arrêt cardiaque20. L’interaction entre l’AC et les canaux ioniques voltage-dépendants conduit à la perturbation de l’homéostasie ionique intracellulaire, qui est le mécanisme clé de la cardiotoxicité21. Par conséquent, dans cette étude, la technique de patch-clamp à cellules entières est utilisée pour déterminer les effets de l’AC sur le IKv des cardiomyocytes.
Protocole
Les cardiomyocytes H9c2 de rat obtenus commercialement (voir le tableau des matières) ont été incubés dans du DMEM contenant 10 % de sérum fœtal bovin (FBS) inactivé par la chaleur et 1 % de pénicilline-streptomycine à 37 °C dans une atmosphère humidifiée à 5 % de CO2. La technique de patch-clamp à cellules entières a ensuite été utilisée pour détecter les changements dans IKv dans les cellules H9c2 normales et les cellules traitées 4-AP- ou AC (Figure 1 et Figure 2).
1. Préparation de la solution
- Préparer le milieu de culture cellulaire DMEM contenant 10 % de FBS et 1 % de pénicilline-streptomycine (voir le tableau des matières).
- Préparer une solution de 4-AP de 1,5 M en ajoutant 14,1165 mg de 4-AP à 100 μL de solution de DMSO (voir le tableau des matériaux). Diluer 1,5 M4-AP à 1,5 mM en ajoutant la solution extracellulaire (étape 1.5).
- Préparer 400 mM de courant alternatif en ajoutant 5 mg de courant alternatif à 19,36 μL de solution de DMSO (voir le tableau des matériaux).
REMARQUE: Toutes les solutions ci-dessus ont été stockées dans un réfrigérateur à 4 ° C et la concentration finale du DMSO ne doit pas dépasser 0,1% (v / v). - Préparer 50 mL de solution intracellulaire en ajoutant 0,4100 g de KCl (110,0 mM), 0,0120 g de MgCl2 (1,2 mM), 0,1270 g de Na2 ATP (5,0 mM), 0,1190 g de HEPES (10,0 mM) et 0,1900 g d’EGTA (10,0 mM) dans 50 mL d’eau bidistillée(voir le tableau 1 et le tableau des matières).
NOTE: La valeur du pH de la solution intracellulaire a été ajustée à 7,2 en utilisant 1 M KOH et a été aliquote en petits volumes (1,5-2 mL) et stockée à -20 °C. - Préparer 50 mL de solution extracellulaire en ajoutant 0,0185 g de KCl (5,0 mM), 0,3945 g de NaCl (135,0 mM), 0,0203 g de MgCl 2·6H2O (2,0 mM), 0,0595 g de HEPES (5,0 mM) et 0,0990 g de D-glucose (10,0 mM) dans 50 mL d’eau bidistillée (voir le tableau 1 et le tableau des matières).
REMARQUE: La solution extracellulaire doit être préparée pour une utilisation immédiate et sa valeur de pH doit être ajustée à 7,4 en utilisant 1 M NaOH.
2. Culture cellulaire
- Une fois que la boîte de culture H9c2 devient confluente à 80%, digérer les cellules avec 0,25% de trypsine pendant 30 s.
- Culture de 2 x 10 5 cellules/mL avec un milieu normal ou contenant un médicament (25 μM, 50 μM, 100 μM et 200 μM AC) dans une boîte de 35 mm tapissée de plaques de verre pendant 24 h à 37 °C, avec une atmosphère de CO2 à5 % et une humidité relative de 70 % à 80 % (voir le tableau des matières).
3. Fabrication de micropipettes
- Allumez l’extracteur de micropipette (voir le tableau des matériaux) et préchauffez pendant 30 minutes.
- Placez un capillaire en verre borosilicaté avec un filament (OD: 1,5 mm, ID: 1,10 mm, 10 cm de longueur) sur l’extracteur de micropipette. Sélectionnez l’ensemble de programmes à l’étape 3.3 et cliquez sur Entrée dans le panneau de configuration. Cliquez sur le programme Rampe dans le coin supérieur droit pour déterminer la valeur « Chaleur » du capillaire en verre.
- Écrivez le programme pour tirer l’électrode selon la valeur déterminée par le test « Rampe » et utilisez les étapes suivantes: valeur « Heat » = valeur « Rampe », Pull = 0, Vel = vitesse de déplacement de la tige de traction, Temps = 200-250. Cliquez sur Pull pour commencer à fabriquer les pipettes.
REMARQUE: Observez la couleur des dessiccants dans le récipient scellé de l’extracteur de micropipette avant de l’utiliser. Si la couleur passe du bleu au rose, les dessiccants doivent être remplacés. Pour éviter la contamination de l’embout de l’électrode, essayez de ne pas toucher la partie médiane du capillaire en verre pendant la préparation de la pipette. Ensuite, retirez soigneusement les pipettes produites et placez-les dans un récipient fermé et scellé.
4. Configuration de l’instrument
- Allumez les instruments correspondants dans l’ordre suivant : le convertisseur numérique-analogique, l’amplificateur de signal, le micromanipulateur, le microscope et la caméra (voir Tableau des matériaux).
- Ouvrez l’application d’imagerie, le logiciel d’amplificateur de signal et le logiciel d’acquisition de données en séquence (voir le tableau des matériaux).
REMARQUE: L’instrument doit être allumé séquentiellement; sinon, l’état « Demo Digitizer » apparaîtra après l’ouverture du logiciel.
5. Réglage des paramètres IKv
- Modifiez le protocole d’enregistrement du IKv en suivant les étapes ci-dessous.
- Cliquez sur Modifier et sélectionnez Modifier le protocole dans le logiciel d’acquisition de données (voir Tableau des matériaux).
- Modifiez le programme dans l’interface « Forme d’onde »: Époque A (Premier niveau = −60 mV, Niveau Delta = 0 mV, Première durée = 20 ms et Durée Delta = 0 ms); Époque B (premier niveau = −40 mV, niveau Delta = 10 mV, première durée = 150 ms et durée Delta = 0 ms) et époque C (premier niveau = −60 mV, niveau Delta = 0 mV, première durée = 30 ms et durée delta = 0 ms).
- Ensuite, cliquez sur l’interface Mode/Rate et définissez les données « Trial Hierarchy »: Trial delay = 0 s, Runs = 1, Sweeps = 11 et Sweep duration = 0.22 s22,23.
NOTE: Acquérir les courants du canal IKv en appliquant des pas de dépolarisation de 150 ms de −40 mV à +60 mV avec un incrément de 10 mV à un potentiel de maintien de −60 mV dans des conditions de contrôle. La durée totale du protocole doit être supérieure à la durée définie dans le programme « Waveform ».
- Modifier le programme de soustraction de fuite par réfection : cliquez sur Modifier le protocole pour sélectionner le bouton Stimulus , et définissez le programme de soustraction des fuites dans la boîte de dialogue Soustraction des fuites par réfection : nombre de balayages = 2-8 (4 dans cette étude), Temps de stabilisation = 100-1 000 ms (200 dans cette étude), « Polarité » = « Opposé à la forme d’onde », niveau de maintien = −80 mV.
REMARQUE : La soustraction de fuite P / N doit avoir un niveau de maintien inférieur au « Premier maintien » (−60 mV).
6. Enregistrement patch-clamp à cellules entières de l’I Kv en mode pince de tension
- Établissez le chemin de stockage des données : cliquez sur Fichier et sélectionnez Définir les noms des fichiers de données dans le logiciel d’acquisition de données. Ouvrez le protocole IKv établi (étape 5.1) en sélectionnant Modifier et en cliquant sur Ouvrir le protocole dans le logiciel d’acquisition de données. Enfin, cliquez sur l’option Outils et sélectionnez Test de membrane pour commencer à exécuter le protocole.
- Ajouter la solution extracellulaire (étape 1.5) au bain cellulaire sur l’appareil de serrage patch-clamp à cellules entières (voir le tableau des matériaux) et placer la lame de couverture vers le haut avec les cellules H9c2 (cultivées à l’étape 2.1) dans le bain.
- Remplissez 30% de la pipette (fabriquée à l’étape 3) avec la solution extracellulaire et installez-la sur le porte-électrode d’enregistrement intégré dans l’appareil de serrage patch. Serrez la pipette avec le joint torique en caoutchouc et la rondelle en plastique. Ensuite, déposez la pipette dans le bain avec le micromanipulateur. Cliquez sur l’interface de décalage de la pipette du logiciel d’amplificateur de signal (voir Tableau des matériaux) pour maintenir la ligne de base du courant IKv à 0 pA.
NOTE: La solution intracellulaire (étape 1.4) doit être en contact avec la partie AgCl/Ag du fil d’argent, et le fil d’argent ne doit pas être proche de la paroi interne de la pipette. La résistance de la pipette doit être de 2-6 MΩ. Pour éviter l’occlusion de l’embout de la pipette, une pression positive continue doit être délivrée à la pipette à l’aide d’une seringue de 1,0 mL reliée au porte-électrode d’enregistrement via un tube en plastique24. - Délivrez manuellement une pression positive appropriée à l’aide d’une seringue de 1,0 mL connectée au porte-électrode d’enregistrement par un tube en plastique. Déplacez légèrement la pipette en manipulant le micromanipulateur en trois dimensions pour entrer en contact avec la cellule.
- Une fois que l’onde carrée de test de la membrane chute de 1/3 à 1/2 après que la pipette a touché la membrane cellulaire, retirez la pression positive et délivrez manuellement une pression négative appropriée. Cliquez ensuite sur l’interface Patch du logiciel d’acquisition de données pour former le sceau GΩ. Utilisez le logiciel d’amplificateur de signal « C p Fast » et « Cp Slow » pendant l’étanchéité des cellules pour compenser la capacité rapide et lente.
REMARQUE: Lorsque l’essai sur membrane est ≥1 GΩ, une configuration fixée à la cellule se forme entre l’extrémité de la pipette et la cellule. - Appliquez de brèves impulsions de pression négative pour rompre un patch de la membrane cellulaire.
REMARQUE: Une réduction précipitée de la résistance de la membrane caractérise un modèle d’enregistrement de cellules entières réussi. Si la résistance d’accès (Ra) ≥30 MΩ, les cellules doivent être resélectionnées pour les étapes 6.3-6.6. Afin d’assurer l’exactitude des données IKv enregistrées, la pression négative doit être éliminée après la rupture de la membrane cellulaire. - Exécutez la compensation capacitive de la membrane de cellule entière en cliquant sur le bouton Cellule entière du logiciel d’amplificateur de signal. Enfin, enregistrez et enregistrez les données en cliquant sur le bouton Enregistrement des données .
- Ouvrez les données IKv enregistrées avec le logiciel d’analyse de données. Enregistrez les relations courant-tension (I−V): cliquez sur Analyser pour sélectionner Statistiques pour effectuer les opérations suivantes: sélectionnez la plage comme Cousors 1,2 pour l’analyse des données; cliquez sur les boutons Amplitude de crête et Moyenne , puis cliquez sur OK pour afficher les données dans la page Résultats . Enfin, copiez la colonne des données moyennes IKv dans le logiciel de dessin de fonction (voir Tableau des matériaux) pour une analyse plus approfondie.
- Enregistrer les traces actuelles IKv représentatives : cliquez sur Modifier pour sélectionner Transférer les traces ; ensuite, sélectionnez la trace complète dans la région à transférer ; ensuite, cliquez sur Sélectionner dans Trace Selection, et sélectionnez IN 0 (pA) dans Signaux; enfin, cliquez sur OK pour afficher les données dans la page « Résultats », et copiez les données totales dans le logiciel de dessin de fonction pour dessiner les traces actuelles.
- Enregistrez le protocole IKv : cliquez sur Modifier pour sélectionner Créer un signal de forme d’onde de stimulus, puis sélectionnez OK. Ensuite, refaites l’étape 6.9 sauf pour sélectionner A0 # 0 (mA) dans « Signaux ».
Résultats
Ce protocole a permis l’enregistrement du IKv selon les paramètres définis dans la technique du patch-clamp à cellules entières. Le IKv a été déclenché par 150 ms de stimulus d’impulsion dépolarisant de −40 à +60 mV à un potentiel de maintien de −60 mV (Figure 3A). Le IKv des cardiomyocytes H9c2 du rat est d’abord apparu autour de -20 mV, puis l’amplitude a augmenté avec la dépolarisation. La relation moyenne entre le IKv et le potentiel membranaire a été calculée à partir des amplitudes de courant mesurées. Les résultats ont montré qu’en comparaison avec le groupe témoin, l’amplitude IKv était sensiblement réduite après le traitement de 5 minutes avec 1,5 mM 4-AP (Figure 3B). De plus, le IKv a diminué de manière significative aux potentiels membranaires de 10 mV à 60 mV de manière dose-dépendante après le traitement CA de 24 h (Figure 3C-F).

Figure 1: Équipement et instruments nécessaires pour enregistrer le IKv. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Organigramme de l’enregistrement électrophysiologique de IKv dans des cellules H 9c2 à l’aide d’une technique de patch-clamp sur cellules entières. (A) Culture cellulaire. (B) Préparation des solutions intracellulaires et extracellulaires. C) Illustration schématique de l’enregistrement sur cellules entières. C1: Déplacer la pipette près de la cellule; C2: Former un joint à haute résistance entre la pipette et la cellule; C3: Rupture de la membrane cellulaire. d) Enregistrer le IKv. D1: Diagramme schématique de la formation du courant K+; D2: Traces de courant représentatives pour le IKv enregistrées en mode de serrage de tension de cellule entière. Veuillez cliquer ici pour voir une version agrandie de cette figure.
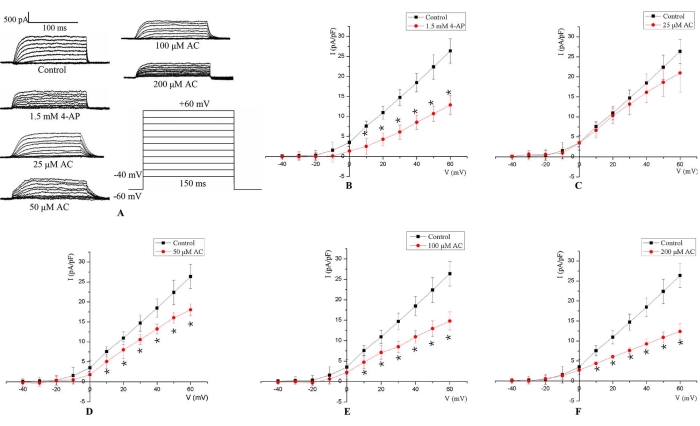
Figure 3 : Représentant IKv dans les cellules H9c2. (A) Traces de courant représentatives pour le IKv mesurées dans des cellules H9c2 sans aucun traitement (groupe témoin), avec des milieux contenant du courant alternatif pendant 24 h (25 μM, 50 μM, 100 μM et 200 μM), et avec 1,5 mM 4-AP pendant 5 min. Le IKv a été déclenché par 150 ms d’impulsion dépolarisante de −40 à +60 mV à un potentiel de maintien de −60 mV. (B) Pour la stimulation 4-AP de 1,5 mM, le IKv est descendu à des potentiels membranaires de 10 mV à 60 mV. (C-F) Le traitement AC a diminué le IKv d’une manière dépendante de la concentration aux potentiels membranaires de 10 mV à 60 mV. *p < 0,05 par rapport au groupe témoin (n = 6). Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Solution extracellulaire | ||
| Produits chimiques | g/50 mL | Composition (mM) |
| NaCl | 0.3945 | 135.0 |
| Kcl | 0.1865 | 5.0 |
| HEPES | 0.5958 | 5.0 |
| MgCl 2·6H2O | 0.2033 | 2.0 |
| D-glucose | 0.9900 | 10.0 |
| Solution intracellulaire | ||
| Produits chimiques | g/50 mL | Composition (mM) |
| Kcl | 0.4100 | 110.0 |
| MgCl2 | 0.0120 | 1.2 |
| Na2-ATP | 0.1270 | 5.0 |
| HEPES | 0.1190 | 10.0 |
| L’EGTA | 0.1900 | 10.0 |
Tableau 1 : Solutions intracellulaires et extracellulaires pour l’enregistrement de l’IKv en mode tension-pince.
Discussion
La technique électrophysiologique patch-clamp est principalement utilisée pour enregistrer et refléter l’activité électrique et les caractéristiques fonctionnelles des canaux ioniques sur la membrane cellulaire25. À l’heure actuelle, les principales méthodes d’enregistrement de la technique patch-clamp comprennent l’enregistrement monocanal et l’enregistrement de cellules entières26. Pour le mode cellule entière, la microélectrode de verre et la pression négative sont utilisées pour former un joint à haute résistance entre une petite zone de la membrane cellulaire et une pointe de pipette27. Une fois que la pression négative soutenue provoque la rupture de la membrane cellulaire par l’extrémité de la pipette et que la membrane se fixe à la paroi interne de la pipette, le circuit électrique complet formé entre la pipette et la cellule permet d’enregistrer la densité de courant des canaux ioniques individuels sur la surface de la membrane cellulaire26,27 . Au cours des dernières années, la technique de patch-clamp à cellules entières a été largement utilisée pour la recherche de médicaments ciblant les maladies liées aux canaux ioniques. Bien qu’elle ait des exigences élevées pour les opérateurs, cette technique reste la « référence » pour la recherche sur les canaux ioniques28. En outre, la technique de patch-clamp perforé peut également enregistrer les changements actuels dans les canaux ioniques cibles dans des environnements intracellulaires relativement stables sur des durées prolongées en utilisant des antibiotiques pour former des pores de perméabilité dans la membrane cellulaire29,30. On peut enregistrer et tracer les changements dynamiques de la tension ou du courant des canaux ioniques en utilisant la technique du patch-clamp à cellules entières en mode pince de courant ou tension-pince, ce qui en fait sans aucun doute une plate-forme puissante pour évaluer l’activité pharmacologique ou les mécanismes de toxicité des médicaments31,32.
L’AC est l’un des principaux composants toxiques des espèces d’Aconitum, appartient au groupe des alcaloïdes diester-diterpénoïdes et est hautement toxique20,33. Des preuves ont indiqué que le courant alternatif peut causer une toxicité cardiovasculaire34,35. En tant que bloqueur non sélectif du canal K +, il a été rapporté que le courant alternatif peut bloquer le courant K+ transitoire vers l’extérieur, le courant K+ du redresseur retardé ultra-rapide et le courant K+ du redresseur retardé rapide, induisant des arythmies21,36,37. À ce jour, il n’existe aucune preuve solide que les courants de potassium voltage-dépendants sont impliqués dans la cardiotoxicité du courant alternatif. Par conséquent, dans cette étude, l’effet inhibiteur de l’AC sur le IKv dans les cardiomyocytes H9c2 du rat a été examiné à l’aide de la technique de patch-clamp à cellules entières. L’activation des canaux Na+ est un mécanisme largement reconnu par lequel l’AC exerce des effets pharmacologiques ou toxicologiques38. Fait intéressant, il existe des preuves que AC peut agir directement sur le IKv 21,36,37. Cependant, les données présentées dans cet article ne fournissent pas suffisamment de preuves que l’AC peut inhiber directement le IKv. L’effet inhibiteur IKv de l’AC peut être dû à l’activation directe des canaux Na+, ce qui nécessite une étude plus approfondie.
Depuis sa création et son développement, la technique de patch-clamp à cellules entières utilisée dans cette étude est devenue une méthode conventionnelle pour explorer la cardiotoxicité des médicaments en termes de canaux ioniques. Cette expérience a confirmé que le courant alternatif inhibait efficacement le IKv des cellules H9c2 d’une manière dépendante de la concentration en mode tension-pince. Cependant, chaque type de canal ionique, y compris les canaux K+, contient plusieurs sous-types, et seul le courant total du canal K+ dépendant de la tension a été enregistré dans cette étude. Des études ultérieures peuvent explorer les mécanismes pharmacologiques et toxicologiques de l’AC au moyen de lignées cellulaires modèles avec une expression élevée de sous-types de canaux ioniques spécifiques37. Alternativement, on peut incorporer des canaux ioniques spécifiques marqués avec des protéines fluorescentes pour étudier visuellement la toxicité myocardique de l’AC39. Les étapes critiques de ce protocole sont les étapes 6.4 à 6.6; l’achèvement de ces trois étapes détermine directement si l’enregistrement ultérieur de IKv est réussi. Par rapport à d’autres technologies, la technique de patch-clamp à cellules entières est la méthode de référence et acceptée pour enregistrer le courant dans des canaux ioniques simples dans la membrane cellulaire ou la membrane organite, avec les caractéristiques des exigences techniques élevées et de l’enregistrement à faible débit40. En résumé, cette technique n’est pas seulement une méthode de base pour la recherche en électrophysiologie cellulaire, mais elle est également largement utilisée en neurosciences, en sciences cardiovasculaires et dans d’autres domaines.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous apprécions le soutien financier de la Fondation nationale des sciences naturelles de Chine (82130113) et du programme clé de R&D et de transformation du Département des sciences et de la technologie de la province du Qinghai (2020-SF-C33).
matériels
| Name | Company | Catalog Number | Comments |
| 4-Aminopyridine | Sigma | MKCJ2184 | |
| Aconitine | Chengdu Lemetian Medical Technology Co., Ltd | DSTDW000602 | |
| Amplifier | Axon Instrument | MultiClamp 700B | |
| Analytical Balance | Sartorius | 124S-CW | |
| ATP Na2 | Solarbio | 416O022 | |
| Borosilicate glass with filament (O.D.: 1.5 mm, I.D.: 1.10 mm, 10 cm length) | Sutter Instrument | 163225-5 | |
| Cell culture dish (100 mm) | Zhejiang Sorfa Life Science Research Co., Ltd | 1192022 | |
| Cell culture dish (35 mm) | Zhejiang Sorfa Life Science Research Co., Ltd | 3012022 | |
| Clampex software | Molecular Devices, LLC. | Version 10. 5 | |
| Clampfit software | Molecular Devices, LLC. | Version 10. 6. 0. 13 | data acqusition software |
| D-(+)-glucose | Rhawn | RH289133 | |
| Digital camera | Hamamatsu | C11440 | |
| Digitizer | Axon Instrument | Axon digidata 1550B | |
| DMSO | Boster Biological Technology Co., Ltd | PYG0040 | |
| Dulbecco's modified eagle medium (1x) | Gibco | 8121587 | |
| EGTA | Biofroxx | EZ6789D115 | |
| Fetal bovine serum | Gibco | 2166090RP | |
| Flaming/brown micropipette puller | Sutter Instrument | Model P-1000 | |
| H9c2 cells | Hunan Fenghui Biotechnology Co., Ltd | CL0111 | |
| HCImageLive | Hamamatsu | 4.5.0.0 | |
| HCl | Sichuan Xilong Scientific Co., Ltd | 2106081 | |
| HEPES | Xiya Chemical Technology (Shandong) Co., Ltd | 20210221 | |
| KCl | Chengdu Colon Chemical Co., Ltd | 2020082501 | |
| KOH | Chengdu Colon Chemical Co., Ltd | 2020112601 | |
| MgCl2 | Tianjin Guangfu Fine Chemical Research Institute | 20160408 | |
| MgCl2·6H2O | Chengdu Colon Chemical Co., Ltd | 2021020101 | |
| Micromanipulator | Sutter Instrument | MP-285A | |
| Microscope | Olympus | IX73 | |
| Microscope cover glass (20 × 20 mm) | Jiangsu Citotest Experimental Equipment Co. Ltd | 80340-0630 | |
| Milli-Q | Chengdu Bioscience Technology Co., Ltd | Milli-Q IQ 7005 | |
| MultiClamp 700B commander | Axon Instrument | MultiClamp commander 2.0 | signal-amplifier software |
| OriginPro 8 software | OriginLab Corporation | v8.0724(B724) | |
| Penicillin-Streptomycin (100x) | Boster Biological Technology Co., Ltd | 17C18B16 | |
| PH meter | Mettler Toledo | S201K | |
| Phosphate buffered saline (1x) | Gibco | 8120485 | |
| Trypsin 0.25% (1x) | HyClone | J210045 |
Références
- Luan, Q. H. Passive transport and ion channels in biofilms. Acta Scientiarum Naturalium Universitatis Intramongoljcae. 2, 215-235 (1984).
- Lei, M., Sun, S. Advances in the mechanism of arrhythmia induced by sodium channel disease. Journal of Clinical Cardiology. 21 (4), 246-248 (2005).
- Varró, A., et al. Cardiac transmembrane ion channels and action potentials: Cellular physiology and arrhythmogenic behavior. Physiological Reviews. 101 (3), 1083-1176 (2021).
- Campuzano, O., et al. Negative autopsy and sudden cardiac death. International Journal of Legal Medicine. 128 (4), 599-606 (2014).
- Amin, A. S., Asghari-Roodsari, A., Tan, H. L. Cardiac sodium channelopathies. Pflügers Archiv: European Journal of Physiology. 460 (2), 223-237 (2010).
- Benitah, J. P., et al. Voltage gated Ca2+ currents in the human pathophysiologic heart: A review. Basic Research in Cardiology. 97 (1), 111-118 (2002).
- Banyasz, T., Horvath, B., Jian, Z., Izu, L. T., Chen-Izu, Y. Sequential dissection of multiple ionic currents in single cardiac myocytes under action potential-clamp. Journal of Molecular and Cellular Cardiology. 50 (3), 578-581 (2011).
- Nerbonne, J. M. Molecular basis of functional myocardial potassium channel diversity. Cardiac Electrophysiology Clinics. 8 (2), 257-273 (2016).
- Grant, A. O. Cardiac ion channels. Circulation: Arrhythmia and Electrophysiology. 2 (2), 185-194 (2009).
- Olson, T. M., et al. Kv1.5 channelopathy due to KCNA5 loss-of-function mutation causes human atrial fibrillation. Human Molecular Genetics. 15 (14), 2185-2191 (2006).
- Christophersen, I. E., et al. Genetic variation in KCNA5: impact on the atrial-specific potassium current IKur in patients with lone atrial fibrillation. European Heart Journal. 34 (20), 1517-1525 (2013).
- Barry, D. M., Xu, H., Schuessler, R. B., Nerbonne, J. M. Functional knockout of the transient outward current, long-QT syndrome, and cardiac remodeling in mice expressing a dominant-negative Kv4 alpha subunit. Circulation Research. 83 (5), 560-567 (1998).
- Abbott, G. W., Xu, X., Roepke, T. K. Impact of ancillary subunits on ventricular repolarization. Journal of Electrocardiology. 40, 42-46 (2007).
- Jia, W. J., et al. Recent studies on the application of patch-clamp technique in cellular electrophysiology. Journal of Chemical Engineering of Chinese Universities. 32 (4), 767-778 (2018).
- Leuthardt, E. C., et al. Using the electrocorticographic speech network to control a brain-computer interface in humans. Journal of Neural Engineering. 8 (3), 1-3 (2011).
- Tian, J. The applying progress of patch-clamp technique. Journal of Jilin Medical University. 4, 227-229 (2008).
- Wang, Z. Q., et al. Effects of shensong yangxin capsule on c-type Kv1.4 potassium channel. Chinese Heart Journal. 21 (6), 782-785 (2009).
- Huang, X. Y. The effect of resveratrol on Kv2.1 potassium channels in cardiac myocytes. Chinese Journal of Cardiac Pacing and Electrophysiology. 34 (5), 484-487 (2020).
- Wang, C., et al. Effects of neferine on Kv4.3 channels expressed in HEK293 cells and ex vivo electrophysiology of rabbit hearts. Acta Pharmacologica Sinica. 36 (12), 1451-1461 (2005).
- Gao, Y., et al. Aconitine: A review of its pharmacokinetics, pharmacology, toxicology and detoxification. Journal of Ethnopharmacology. 293, 115270 (2022).
- Zhou, W., et al. Cardiac efficacy and toxicity of aconitine: A new frontier for the ancient poison. Medicinal Research Reviews. 41 (3), 1798-1811 (2021).
- An, J. R., et al. The effects of tegaserod, a gastrokinetic agent, on voltage-gated K+ channels in rabbit coronary arterial smooth muscle cells. Clinical and Experimental Pharmacology & Physiology. 48 (5), 748-756 (2021).
- Sun, Q., Liu, F., Zhao, J., Wang, P., Sun, X. Cleavage of Kv2.1 by BACE1 decreases potassium current and reduces neuronal apoptosis. Neurochemistry International. 155, 105310 (2022).
- Manz, K. M., Siemann, J. K., McMahon, D. G., Grueter, B. A. Patch-clamp and multi-electrode array electrophysiological analysis in acute mouse brain slices. STAR Protocols. 2 (2), 100442 (2021).
- Kanda, H., Tonomura, S., Dai, Y., Gu, J. G. Protocol for pressure-clamped patch-clamp recording at the node of Ranvier of rat myelinated nerves. STAR Protocols. 2 (1), 100266 (2021).
- Ma, J., et al. High purity human-induced pluripotent stem cell-derived cardiomyocytes: electrophysiological properties of action potentials and ionic currents. American Journal of Physiology-Heart and Circulatory Physiology. 301 (5), 2006-2017 (2011).
- Yoshimura, M., et al. Application of in vivo patch-clamp technique to pharmacological analysis of synaptic transmission in the CNS. Nihon Yakurigaku Zasshi. Folia Pharmacologica Japonica. 124 (2), 111-118 (2004).
- Aziz, Q., Nobles, M., Tinker, A. Whole-cell and perforated patch-clamp recordings from acutely-isolated murine sinoatrial node cells. Bio-protocol. 10 (1), 3478 (2020).
- Witchel, H. J., Milnes, J. T., Mitcheson, J. S., Hancox, J. C. Troubleshooting problems with in vitro screening of drugs for QT interval prolongation using HERG K+ channels expressed in mammalian cell lines and Xenopus oocytes. Journal of Pharmacological and Toxicological Methods. 48 (2), 65-80 (2002).
- Rodriguez-Menchaca, A. A., Ferrer, T., Navarro-Polanco, R. A., Sanchez-Chapula, J. A., Moreno-Galindo, E. G. Impact of the whole-cell patch-clamp configuration on the pharmacological assessment of the hERG channel: Trazodone as a case example. Journal of Pharmacological and Toxicological Methods. 69 (3), 237-244 (2014).
- Yang, S., Liu, Z. W., Zhang, Y. X. The development of in vivo patch clamp technique. Chinese Remedies & Clinics. 5, 399-401 (2003).
- Lin, Y. F., Ouyang, S. Research progress and application of patch clamp technique. Strait Pharmaceutical Journal. 9, 8-11 (2008).
- Li, S., et al. An insight into current advances on pharmacology, pharmacokinetics, toxicity and detoxification of aconitine. Biomedicine & Pharmacotherapy. 151, 113115 (2022).
- Chan, T., Chan, J., Tomlinson, B., Critchley, J. Chinese herbal medicines revisited: A Hong Kong perspective. Lancet. 342 (8886-8887), 1532-1534 (1993).
- Jiang, H., Zhang, Y. T., Zhang, Y., Wang, X. B., Meng, X. L. An updated meta-analysis based on the preclinical evidence of mechanism of aconitine-induced cardiotoxicity. Frontiers in Pharmacology. 13, 900842 (2022).
- Liu, Y. Myocardial toxicity of aconite alkaloids. Shenyang Pharmaceutical University. , (2007).
- Li, Y., et al. Aconitine blocks HERG and Kv1.5 potassium channels. Journal of Ethnopharmacology. 131 (1), 187-195 (2010).
- Campbell, D. T. Modified kinetics and selectivity of sodium channels in frog skeletal muscle fibers treated with aconitine. The Journal of General Physiology. 80 (5), 713-731 (1982).
- Huang, X. Y., Ying, Y. C. The effect of specific protein 1 on Kv2.1 potassium channel in cardiac myocytes. Journal of Electrocardiology and Circulation. 39 (4), 338-341 (2020).
- Cao, J. B. Development and application of patch clamp technique. Journal of Yuncheng University. 27 (2), 53-55 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon