Method Article
骨格筋中の脂肪滴含量の線維タイプおよび細胞下特異的分析
要約
増加する証拠は、骨格筋内の脂質の過剰な浸潤が脂肪毒性および糖尿病をもたらすことを示している。ここでは、線維型特異的な方法で脂肪滴のサイズ、密度、および細胞内分布を定量化するために、組織処理、Bodipyによる染色、画像取得、および分析を含む完全なプロトコルを提示する。
要約
筋症として知られている骨格筋脂質浸潤は、肥満および老化とともに増加する。筋症はまた、心血管疾患および癌のようないくつかの他の障害のための負の予後因子として最近発見されている。過剰な脂質浸潤は筋肉量と強度を低下させます。それはまた、総筋細胞内脂質含量、脂肪滴(LD)形態、および細胞内分布に依存して脂肪毒性およびインスリン抵抗性をもたらす。酸化繊維は脂質を利用する能力が大きいため、繊維タイプ(酸化性対解糖系)も重要です。病態生理学におけるそれらの決定的な意味合いのために、LDのダイナミクスおよび繊維タイプ特異的な方法での機能に関する詳細な研究が正当化される。
本明細書では、筋細胞内脂質含量の定量化およびLD形態および細胞内分布の分析をファイバータイプ特異的な様式で分析するための完全なプロトコールが提示される。この目的のために、連続筋凍結切片を、蛍光色素Bodipyおよびミオシン重鎖アイソフォームに対する抗体で染色した。このプロトコルは、異なる筋肉の同時処理を可能にし、時間を節約し、可能性のあるアーチファクトを回避し、フィジーで作成されたパーソナライズされたマクロのおかげで、LD分析の自動化も可能です。
概要
筋症として知られている骨格筋脂質浸潤は、肥満および老化とともに増加する。筋症は、筋肉量および強度およびインスリン感受性1と負の相関がある。さらに、最近の研究は、筋食症の程度が心血管疾患2、非アルコール性脂肪性肝疾患3、または癌4などの他の状態の予後因子として使用できることを示している。脂質は、筋細胞外脂質として、または筋線維内の骨格筋に筋細胞内脂質(IMCL)として蓄積することができる。IMCLsは、主に脂肪滴(LD)中のトリグリセリドとして貯蔵され、身体運動中に代謝燃料として使用される5,6。しかし、脂質供給が需要を上回ったり、ミトコンドリアが機能不全になったりすると、IMCLは代謝的に不健康な肥満の個人や2型糖尿病患者に見られるように、筋肉インスリン抵抗性に関与します7。興味深いことに、持久力アスリートは、高いインスリン感受性を維持しながら、2型糖尿病の肥満患者に見られるものと同様のレベルのIMCLを有する。この現象は「アスリートのパラドックス」8,9として記述され、筋肉LDのサイズ、密度、局在化、動態、脂質種の組成に関連する筋肉LDのより微妙な評価によって説明される。
第1に、LDサイズはインスリン感受性および体力に反比例する10、11。実際、より小さいLDは、リパーゼ作用に対して比較的大きな表面積を示し、したがって、潜在的に、脂質12を動員するより大きな能力を有する。第二に、LD密度(数/表面)は、インスリン作用において物議を醸す役割を果たしている8,10;しかし、アスリートでは増えているようです。第3に、表面膜のすぐ下に位置するLDs(サルコレマール下または末梢)は、中心膜よりもインスリン感受性に対してより有害な影響を及ぼすので、LDの細胞内局在化は重要である8、9、13。後者は、より大きな呼吸活動を有し、収縮に必要な高いエネルギー需要を満たすためにより専門化された中枢ミトコンドリアに燃料を供給する14。対照的に、末梢LDは、膜関連プロセスに関与するサルコレンマル下ミトコンドリアを供給する8。最後に、トリグリセリドを超えて、筋肉内の特定の複合脂質は、他の脂質よりも有害であり得る。例えば、ジアシルグリセロール、長鎖アシルCoA、およびセラミドは、トリグリセリドの代謝回転率が低いときに筋肉に蓄積し、それによってインスリンシグナル伝達を損なう9、15。「アスリートのパラドックス」に戻ると、持久力アスリートはI型(酸化)線維において高い回転率を有する多数のより小さな中枢LDを有するが、肥満および糖尿病患者は、II型(解糖系)線維において低いターンオーバー率を有するより大きな末梢LDを有する8,15,16。エネルギー貯蔵および放出におけるそれらの役割に加えて、誘導脂肪酸(FA)およびコートタンパク質(ペリリピン5)を介したLDは、FA酸化およびミトコンドリア生合成の転写調節に関与する重要なプレーヤーとしても機能し得る8。生理学および病態生理学におけるそれらの決定的な意味合いのために、LDsのダイナミクスおよび機能に関する詳細な研究が正当化される。
IMCLを研究するにはいくつかの手法がありますが、繊維固有の方法でLDのサイズ、密度、および分布を正確に定量化するのには適していません。例えば、磁気共鳴分光法によるIMCLの評価は、非侵襲的でありながら、繊維内のLDのサイズおよび正確な位置を研究するのに十分ではないレベルの分解能を提供し、繊維タイプ特異的ではない17,18。同様に、全筋ホモジネート19に対して行われる生化学的技術は、脂質の位置およびサイズを評価することができない。したがって、LDの形態および位置を分析するための最も適切な方法は、定量的透過電子顕微鏡13であるが、この技術は高価で時間がかかる。したがって、オイルレッドO(ORO)20,21、モノダンシルペンタン(MDH)22、またはボディピー23,24,25などの色素を含む調製物に対する共焦点蛍光イメージングは、これらの研究のための最良のツールとして浮上している。
ここでは、組織サンプリングと処理、ボディ染色、共焦点画像の取得と分析を含む完全なプロトコルが説明され、マウス筋肉凍結切片におけるLDのサイズ、数、および局在を定量化します。IMCLは酸化性繊維と解糖系繊維の間で均等に分布しておらず、各繊維タイプはLDダイナミクスを異なる方法で調節するので、IMCLの研究は繊維タイプ特異的でなければならない16,25,26,27。したがって、このプロトコルは、シリアルセクションの免疫蛍光を使用して、各ファイバーによって発現されるミオシン重鎖(MyHC)アイソフォームを同定します。このプロトコルのもう1つの利点は、解糖系(伸筋デジトルムロンガス、EDL)と酸化的(ヒラメ)筋肉を同時に処理して凍結前に並べて配置することです(図1)。この同時処理により、時間を節約できるだけでなく、サンプルの個別の処理による変動も回避されます。

図1:手順の概略概要 筋肉解剖(1)後、類似の大きさの選択された筋肉が調製され、一緒に凍結される(2)。10μmの連続横切片は、クライオスタットを使用して得られ、接着スライドに直接取り付けられる(3)。2つの連続スライドから、第1の(4A)はラミニンについて免疫標識され、LDを認識するためにボディピーで染色され、第2の(4B)は筋線維タイプの認識のためにMyHCに対する抗体で免疫染色される。画像は、ボディピーの共焦点顕微鏡(5A)および筋線維タイプの落射蛍光顕微鏡(5B)を使用して取得される。フィジーでは、閾値を適用し、粒子(6A)を定量化して、LD(7)または計数細胞(6B)が占める総面積の数、平均サイズ、密度、および割合を取得して、セクション(7)内の各タイプの繊維の割合を得ることによって、画像が分析されます。略語: LDs = 脂肪滴;EDL = 伸筋デジトーラム・ロンガス;MyHCs=ミオシン重鎖アイソフォーム。 この図の拡大版を表示するには、ここをクリックしてください。
プロトコル
マウスに対して実施されたすべての手順は、ルーヴァン・カトリック大学の医学部門の動物実験倫理委員会によって承認されました(2019/UCL/MD/013)。
1. 凍結用試料の解剖・調製
- 筋肉の各ペアに厚さ3mmのコルク片にラベルを付けます。
- コルクの中央に刃先で作った小さな切開部を通して、支持体となる長方形の硬質プラスチック片(0.5 cm W、1 cm H)を垂直に挿入します(図2B)。
注:長方形のプラスチック片のサイズは、筋肉のサイズによって異なります。ここで、記載された寸法は、生後3ヶ月のC57BL/6J雄マウスのヒラメ(〜9mg、1cmL、2〜3mmW)およびEDL(〜5mg、1cmL、2〜3mmW)のサイズに適合している。 - 解剖時には、マウス後肢のヒラメおよびEDLを除去する。解剖中にサンプルが乾燥するのを防ぐために、氷の上に置かれたペトリ皿に生理食塩水で軽く湿らせた圧縮の上にそれらを置きます。
注:これら2つの四肢の筋肉を解剖する方法の説明については、Wang et al.28 を参照してください。 - 最適切削温度コンパウンド(OCT)をコルク/プラスチック接合部に少量置き、気泡を避けます。
- サンプルをペーパータオルで優しく乾燥させて余分な水分を取り除き(図2A)、コルクに垂直なプラスチックに両方の筋肉を置きます(図2C)。
- 実体顕微鏡下で筋筋線維の向きを確認する(図2D)。
注:その絶縁効果は急速な凍結を防ぎ、凍結アーチファクトを生成するため、OCTで筋肉を覆わないことが重要です。
2. 凍結切断のための凍結骨格筋サンプル
警告: 筋肉の凍結は、適切な個人用保護具を装着した状態で、化学フードの下で行う必要があります( 「材料表」を参照)。
- 長さ25cm以上の2つのサイドストラップが取り付けられたステンレス製のタンブラー(高さ約8cm、6cmØ)を使用し(図2F)、タンブラーを容量の2/3までイソペンタンで満たします。
- タンブラーのストラップをつかみ、容器外の窒素レベルが内部のイソペンタンのレベルを超えるように、液体窒素で満たされたポリスチレンボックスに静かに浸します(図2F、G)。
警告: タンブラーが窒素に接触すると、熱衝撃によって渦巻くことがあります。タンブラーが十分に浸漬されていることを確認してくださいが、イソペンタン沈殿を引き起こすため、窒素の侵入を避けてください。このような場合は、イソペンタンを冷やし、タンブラーを新しいイソペンタンで満たし、最初からやり直してください。 - タンブラーの内部がイソペンタンの白色固体層で完全に覆われたら、液体窒素ボックスから取り出します(図2H)。
注:イソペンタンの溶融温度は-159°Cであり、タンブラーの端は十分に寒いときに白くなります。 - 固体イソペンタン片を、全体積が再び液体になるまで鉗子で残りの液体イソペンタンに穏やかに攪拌する。
- イソペンタンがタンブラーの底部と端全体に白い小石を形成するまで、タンブラーを液体窒素に再浸漬します(図2G,H)。
メモ:この2番目の冷却ステップは、イソペンタンの適切な凍結温度を保証します。 - 液体窒素からタンブラーを取り出し、ラットの歯のピンセットでコルクを保持しながら、タンブラーの底に筋肉を素早く浸します。コルクをイソペンタンで15秒間旋回させ、処理するまで-80°Cで保管します(図2I)。
メモ:短期間保存する場合、サンプルは-20°Cの冷凍庫に保管することができます。骨格筋の急速凍結のための完全なプロトコルは、すでに他の場所で公開されています。詳細な参考文献とトラブルシューティングについては、Meng et al.29、Kumar et al.30、および Leiva-Cepas et al.31 を参照してください。
3. 凍結切断
- サンプルを、事前に-20 °C に冷却し、ブレード温度を -25 °C に設定したクライオスタットのチャンバーに入れます。
メモ: -20 °C/-80 °C の冷凍庫からドライアイスで満たされたポリスチレン製ボックス内のクライオスタットにサンプルを輸送し、切断前にチャンバー温度まで少なくとも 20 ~ 30 分間平衡化できるようにします。 - 細かいピンセットでコルクからプラスチックを取り出し、クライオスタット標本ディスクを急速凍結プレートの上に置き、冷却します。プレートが-50°Cに達したら、ディスクにOCTを置き、コルクをディスクの上に置き、しっかりと押します。OCTが固まり、コルクがディスクにしっかりと固定されるまで待ちます。
- 目的の切断方向(図2J、K)で対象物頭にディスクを置き、筋肉の長さの少なくとも1/3を超えて、筋肉の両方の断面が見えるまで筋肉ブロックをトリミングします。
- 切断厚さを10μmに設定し、接着スライドに1つのセクションを置き、明視野顕微鏡で繊維の正しい配向を確認します。
メモ: ファイバーの横方向の向きを確認することが重要です。繊維の向きが適切でない場合は、オブジェクトヘッドの角度を調整し、別のセクションをカットしてもう一度確認します。 - 2つの予めラベル付けされた接着スライドに2つの連続断面を配置します:1つのスライドは繊維タイプを決定し、もう1つは脂質含有量を定量化します(図2L)。
注:追加の連続断面が得られ、他の組織学的研究のために-80°Cに保たれます。しかしながら、脂質含量および細胞内形態24の変化を避けるためには、風乾を防ぐために切断直後に最初の2枚のスライドを処理することが不可欠である。LD定量化のためにスライドを凍結および解凍しても同じ効果が得られるため、非常にお勧めできません。
4. ファイバータイピングとボディ染色
- 筋線維型の免疫組織化学的検出
注:以下のプロトコールの場合、250μLの総溶液量は、1セント硬貨のおおよその大きさの疎水性ペンで描かれた円で囲まれた筋肉部分全体を覆うのに十分である。- 疎水性ペンで描かれた輪郭で切片を囲み、氷冷した0.1 Mリン酸緩衝生理食塩水(PBS)で室温(RT)で1分間すすいでください。スライドを湿潤チャンバーに入れ、ブロッキング溶液(PBS中の10%正常ヤギ血清(NGS)およびマウス上のマウス(MOM)ブロッキング試薬)中で37°Cで90分間ブロックする。
- ブロッキング溶液を除去し、一次抗体(5%NGS、1:30 MOMブロッキング試薬、I型を認識するマウス一次抗体(IgG2b、1:10)、IIa型(IgG1、1:10)、およびIIx型(IgM、1:5)繊維およびラット抗ラミニン(α2鎖、 1:1,000) (PBS 単位)。
- スライドをPBS 3 x 5 minでRTで洗います。
- 二次抗体(PBS中のヤギ抗IgG2b AF405(1:500)、ヤギ抗IgG1 AF488(1:500)、ヤギ抗IgM AF568(1:1,000)、およびヤギ抗ラミニンAF647(1:500))を含む溶液と共にRTで1時間暗所でスライドをインキュベートする。
警告: プロトコルの残りの部分では、蛍光を保つためにスライドを光から遠ざけてください。 - PBSで再度3 x 5分間洗浄し、二重蒸留H2Oですすぎ、余分な水分を取り除き、退色防止試薬でマウントします。
メモ:スライドを4°Cで保存し、光から保護して画像取得まで蛍光を維持します。スライドは固定されていないため、各実験に新しく作られた溶液を使用し、PBSをオートクレーブし、切片の汚染を避けるためにできるだけ早く画像を取得することをお勧めします。
- ボディピーによるLDの染色
注:ステップ4.1と同様に、250μLの総溶液量は、1セント硬貨のおおよその大きさの疎水性ペンで描かれた円で囲まれた筋肉部分全体を覆うのに十分である。- 疎水性ペンで描かれた輪郭で切片を囲み、氷冷0.1 M PBSでRTで10分間すすぎます。すべてのすすぎと洗浄には氷冷PBSを使用してください。
- メタノールを含まない冷たい4%パラホルムアルデヒド(PFA)でRTで10分間固定します。最初のクイックリンスの後、RTでPBS 3 x 5分でスライドを洗い流します。
警告: この手順は、化学フードの下で実行してください。 - 湿気の多いチャンバーにスライドを置き、PBSで5%NGSでRTで1時間ブロックします。
- スライドを一次抗体(PBS中の2%NGSおよびラット抗ラミニン(α2鎖、1:1,000))の溶液と共に37°Cで90分間インキュベートする。スライドをPBS 3 x 5 minでRTで洗います。
警告: プロトコルの残りの部分では、蛍光を保つためにスライドを光から遠ざけてください。 - PBS中のヤギ抗ラットAF647抗体(1:500)を含む二次抗体溶液と共にRTで1時間インキュベートする。スライドをPBS 3 x 5 minでRTで洗います。
- PBS中の4',6-ジアミジノ-2-フェニルインドール(DAPI、0.5μg/mL)およびBODIPY(1μg/mL)の溶液を用いてRTで20分間インキュベートする。
注:BODIPY原液を調製するには、DMSOに1mg/mLの濃度で溶解します。異なるボディピー製剤がLD染色のために市販されている。行った選択に応じて、染色方法は同じです(同じステップ、濃度、およびインキュベーション時間)。ただし、取得方法は若干異なります。 - 最初のクイックリンスの後、RTでPBS 3 x 5分間スライドを洗浄し、ダブル蒸留H2Oですすぎ、余分な水分を除去し、退色防止試薬でマウントします。
メモ:スライドを光から保護した4°Cで保存し、画像が取得されるまで蛍光を保持します。
5. 画像の取得
注:染色プロトコルが完了したら、汚染を避けるためだけでなく、LDの形態、サイズ、および数を維持するためにも、直ちに画像取得(次の24時間以内)に進むことが重要です。
- サンプリングした各筋肉の線維型を評価するための画像の取得
注:このステップは、スライド全体の蛍光走査顕微鏡または従来の落射蛍光顕微鏡で達成できます。後者では、セクションを再構築するために、画像の手動または自動ステッチングを行う必要があります。- ファイバー型認識には、対物レンズが10x/0.3の落射蛍光顕微鏡を使用してください。DAPI(405 nm)、FITC、TRITC、および Cy5 の励起フィルターを選択して、それぞれ I、IIa、IIx ファイバー、およびラミニンを検出します。
注:タイプIIb繊維は免疫標識されません。それらは、黒い筋漿を有するサルコレンマの限界でラミニンによって染色された繊維として認識されるであろう。 - 各チャンネルの適切な露出時間を調整します。
- 従来の落射蛍光顕微鏡を用いる場合、筋肉再建を容易にするために常に同じ順序に従って筋肉全体の画像を取得する。1 つのイメージの右端のファイバーが、次のイメージの左端にも表示されることを確認します。画像の上部と下部についても同じことが言えます(図3A)。
注:参考として、生後3ヶ月のマウスから解剖されたEDLまたはヒラメのセクションでは、それぞれ平均6枚と8枚の画像が筋肉断面全体をカバーします。 - 筋肉をスキャンした後、繊維形態(ラミニン)と筋肉部の組織学に基づいて、撮影したデジタル画像を再構成(ステッチング)用の画像処理ソフトウェアにアップロードし、すべてのチャンネル(色)をマージしたTIFF、PNG、またはJPGファイルとして保存します(図3A)。
- ファイバー型認識には、対物レンズが10x/0.3の落射蛍光顕微鏡を使用してください。DAPI(405 nm)、FITC、TRITC、および Cy5 の励起フィルターを選択して、それぞれ I、IIa、IIx ファイバー、およびラミニンを検出します。
- ラミニンとボディピーの共染色による画像の取得
注:繊維タイプを認識し、キャプチャされた各タイプの繊維数の推定値を得るには、ボディピラミニンの画像取得を開始する前に、繊維タイプのセクションをすでにスキャンし、筋肉を再構築することが不可欠です(図3B)。- ボディピー像の観察と取得には、開口数1.4の40倍油浸対物レンズを備えた共焦点顕微鏡を使用してください。
- 1 AU のピンホール、2,048 ピクセル x 2,048 ピクセルの解像度、0.08 μm のピクセル サイズ、一方向モード、スキャン速度 4 (~4 μs/ピクセル)、ライン平均を 4 倍に設定、デジタル ズームを 1 に設定します。
- Bodipy-558/568とラミニン-AF647の間のクロストークを回避するには、共焦点ソフトウェアでシーケンシャルスキャンモードを使用します。
注:選択した色素がBodipy-493/503の場合、ボディピーチャンネルとラミニン-AF647チャンネルの間にクロストークなしで同時共焦点レーザースキャンが可能です。これにより、画像の取得が高速化されます。 - Bodipy-493/503は488nmレーザーラインまたはアルゴンレーザーラインで励起し、Bodipy-555/568は561nmダイオードレーザーラインを使用して励起します。最後に、640nmのダイオードレーザーラインでラミニン-AF647を検出します。
警告: ボディピー分子はフォトブリーチングに非常に敏感であるため、不要なレーザースキャンは避けてください。繊維を認識するには、ラミニンにレーザーのみを使用してください。 - 選択した色素に応じて、Bodipy-493/50324 の場合は 570-650 nm、Bodipy-558/568 の場合は 565-620 nm に発光範囲を設定します。ラミニンの発光範囲を656-700nmに設定します。
- ゲインとデジタルゲインを適切に設定して、レンジインジケータで飽和ピクセルが検出されないようにします。オフセットを調整してバックグラウンド信号を修正します。
メモ:フィルターの選択と上記のその他のスキャンパラメータは、共焦点顕微鏡ごとに最適化する必要があります。上記のすべての設定は、サンプルからキャプチャされたすべての画像を比較するために一定に保たれることが重要です。 - 共焦点顕微鏡で可視化されたものの中からファイバーの種類を特定するには、ファイバー型免疫検出後に再構築された断面の画像をチェックするパーソナルラップトップを使用します(図3B)。
- 繊維のグループが正しく識別されたら、ボディピーチャンネルとラミニンチャンネルで画像を取得します。
注:LDの後の線維特異的分析を容易にするために、MyHC認識のために取得した画像上のこれらの線維が位置する筋肉の領域に身体ラミニン画像名を書き留めておくことが推奨される。
6. 画像の解析
- 各筋肉サンプルの繊維タイプの分析
- フィジー(またはImageJ)32で、ファイバーアイソフォームを検出するために使用されるすべてのチャネルのマージから得られた再構築された筋肉を含むTIFF、PNG、またはJPGファイルを開きます。
- セルカウントツールを起動するには、[プラグイン]||の分析セルカウンター|セル カウンター。
- [ セル カウンター ] ウィンドウで、[ アクション] | をクリックします。初期化します。
- 同じウィンドウ の [カウンター] で、[ タイプ 1] を選択します。
- フィジーのメインウィンドウ で、ワンド ツールを選択します。
- 各タイプのファイバーの数を定量化するには、同じタイプの各ファイバーをクリックして、クリックされたファイバーの数を記録します。
- 完了したら、次のタイプのファイバーを選択し、同じ手順を繰り返します。
- 画像のすべてのファイバーが特定のファイバータイプに割り当てられたら、[セルカウンター]ウィンドウの[結果]をクリックして結果をテーブルに表示します。
- このテーブルをスプレッドシートのテーブルとして保存するには、[ファイル] |[結果] ウィンドウで [名前を付けて保存] をクリックします。
- セルカウントウィンドウで、それぞれ「マーカーの保存」または「マーカーの読み込み」をクリックして、同じ画像の選択内容をいつでも保存および再読み込みできます。
- 線維型依存的な脂肪滴の解析
- LDの定量化のためにフィジーを使用して共焦点で得られたボディピーとラミニンの画像を解析します。
注: 著者らは、分析を自動化するためにカスタマイズされたマクロを設計しました。このマクロは、その使用方法に関する詳細な説明とともに、それぞれ 補足ファイル 1 および 補足ファイル 2 として入手できます。 - フィジーの バイオフォーマットインポーター の助けを借りて、各画像を開きます。[ スタックの表示方法] オプションで 、[ ハイパースタック |] を選択します。カラーモード、デフォルト。 「自動スケール」 ウィンドウが選択されていることを確認します。
メモ: 次の手順では、画像上の 1 つのファイバーを分析するためのプロトコルについて説明しますが、ファイバー全体の数が画像に表示される回数だけ繰り返す必要があります。 - フリーハンド選択ツールを使用して、ラミニンチャネルに基づいてファイバのサルコレンマを手動で選択し(図4A)、キーボードのTを押してROIウィンドウの選択または関心領域(ROI)を記録します。
- フィジーの メイン ウィンドウに移動し、[ |の分析]をクリックします。「測定値」を設定し、ポップアップウィンドウで「 面積 」と 「フェレットの直径」を選択します。残りのボックスとその他のパラメータは、デフォルトで表示されるままにしておきます。
- ROIウィンドウの[測定]をクリックして、選択した繊維の面積と最小フェレの直径(MF)を取得し、後で使用するためにメモしておきます。
注:LDを分析する場合、LDのサイズと密度は繊維の中心と末梢(サルコレンマル下領域-SS)の間で異なることに留意することが重要です。したがって、分析は個別に実行する必要があります。 - MF の 1/6 の値を計算して、ファイバーの中央部分を区切ります。
メモ: マクロでは、デフォルトの MF 値は 6 に設定されており、これは適用される縮小が MF の 1/6 として設定されることを意味します。この値は、高脂肪食を与えられた動物のヒラメから得られた経験的データに基づいて選択された。しかし、各研究者は、経験的データと分析された筋肉、繊維の種類、および動物の状態に基づいてこの数値を変更する必要があります。 - ROIウィンドウで、[追加]をクリックして最初のROIの複製を作成し、ウィンドウに表示される2番目のROIを選択します。
- フィジーのメインウィンドウで、[|の編集]をクリックします。 セレクション|以前に計算した値(ステップ6.2.6から)を拡大して導入し、数字の前にマイナス記号を付けて[ OK]をクリックします。ROIウィンドウで、[追加][ t ](3番目のROIが表示される必要があります)と [削除]をクリックして、2番目のROIを削除します。
注:研究者は、ROIウィンドウの[すべて表示]ボックスをクリックして結果を確認できます。この時点で、ファイバの全周を囲むROI(図4B)と中央に配置されたROI(図4C)の2つのROIが表示されます。 - ROIウィンドウで両方の ROI を選択し、[ その他の|]をクリックします。XOR |追加[t]。ファイバの周辺に対応する3番目のROIが表示されるのを待ちます(図4D)。
- [詳細] をクリックして ROI を保存 |保存 して、同じファイバーを後で再分析する必要がある場合に備えて、ROI を節約します。
- ボディピーチャンネルを選択し、画像|をクリックしてしきい値ツールを開きます|の調整フィジーのメインウィンドウのしきい値。
- [ しきい値] ポップアップ ウィンドウで、値を 70/255 に設定し、[ 円|] を選択します。白黒メソッドをクリックし、 暗い背景|適用します。
注: しきい値に適用される値は、実験の条件によって異なる場合があり、分析を最適化するには しきい値 を適切に設定する必要があります。白で示したスレッショルド制限を超えるボディ信号と黒の背景を持つB&Wウィンドウが表示される必要があります( 図4E の元のボディピ画像と 図4Fの画像を比較してください)。 - フィジーのメインウィンドウに移動し、[|の分析]をクリックします。[測定値]を設定し、ポップアップウィンドウで、[面積]、[面積分数]、[しきい値に制限]を選択します。残りのボックスとその他のパラメータは、デフォルトで表示されるままにしておきます。
注: 研究者が LD の「円形度」を分析する場合 (完全な球の場合は 1 から線の場合は 0 の範囲の球面形態のインデックスです) は、[測定の設定] ポップアップ ウィンドウの [形状記述子] ボックスをクリックします。 - ROIウィンドウに移動し、最初の ROI を選択します。フィジーの メイン ウィンドウで、[ |の分析]をクリックしますパーティクルの解析ツール。
メモ: このツールは、各選択範囲のパーティクルがカバーする合計面積の数、サイズ、カバーされる面積、および割合を定量化し、結果をスプレッドシートファイルとして保存します。 - [パーティクルの解析]ウィンドウで値を2から無限大(2-無限大)に設定し、[ピクセル]チェックボックスをオンにしてデフォルトの円形度値を維持し、[要約]を選択して[OK]をクリックします。
メモ: ファイバーの結果を確認するには、[表示] オプションで、使用可能なオプションのいずれかを選択します。テーブル内の選択範囲で各 LD の情報を認識させるには、[パーティクルの解析]ウィンドウの[結果の表示]オプションをオンにします。繊維の総面積の分析結果は平均化され、いくつかの列(数、総面積、平均サイズ、%面積;これらは粒子の数[LD]、これらの粒子が占める面積、それらの平均サイズ、および粒子が占める選択の総面積に対する割合、 それぞれ)。密度を計算するには、パーティクルの数を各選択範囲の合計面積で割ります。 - ファイバーの中心と周辺値を取得するには、ステップ 6.2.14 と 6.2.15 を繰り返し、2 番目 (中心) と 3 番目の ROI (周辺) を毎回選択します。
- [ファイル]をクリックして結果を保存 | [概要] ウィンドウに [名前を付けて保存] をクリックします。
メモ: 結果の割り当てられた名前にファイバーの種類、条件、およびイメージ名を含めて、後でデータの統一と統計分析を容易にします。同じ画像内の残りの繊維を分析するには、手順 6.2.3 ~ 6.2.17 を繰り返します。統計分析のためには、動物1匹あたり少なくとも10〜15本の各タイプの繊維を分析しなければならない。
- LDの定量化のためにフィジーを使用して共焦点で得られたボディピーとラミニンの画像を解析します。
結果
本明細書に記載されるプロトコルは、ファイバータイプおよびサブセルラー特異的な様式でLDsを容易に定量するための効率的な方法を提供する。EDLとヒラメなどの同様のサイズの2つの筋肉を一緒に凍結することによって、次のステップに費やされる時間とリソースが半分に減少する方法を示しています。
免疫染色、画像取得、および成体マウスの筋肉で発現するさまざまなMyHCアイソフォームの分析のための完全なプロトコルが提供されています。このプロトコルは、1989 33でSchiaffinoらによって最初に設計されたものに基づいており、ラミニンを標識するための追加の抗体の使用など、いくつかの調整が加えられています。この後の修飾は、IIb型線維の位置にとって重要であり、いずれの抗体でも染色されないため黒色になります。図5に示すように、この免疫組織化学的プロトコルは、マウスの低酸化性(I型およびIIa型)および速解糖系(IIx型およびIIb型)線維の認識を可能にするだけでなく、ハイブリッド線維の存在も可能にする(図5Dのアスタリスクを参照)。さらに、両方の筋肉の断面を同じスライド上に配置することで、選択した2つの筋肉間の各繊維タイプの比率を比較し、実験条件が両方の部分で同一であることが保証されます。
LD標識の場合、ここで提示される結果は、脂質色素としてのBodipy-558/568 C12 の使用に基づいている。しかし、読者は、筋肉セクション23における古典的な色素Bodipy-493/503の使用を詳述した優れたプロトコル論文を参照される。提示されたプロトコールは、線維サルコレンマを区別するために、α2-ラミニンに対する免疫組織化学に基づくLDsの染色を組み合わせました。繊維タイプの実験と同様に、このステップは、個々の繊維の認識だけでなく、繊維の中央領域と末梢領域の両方における脂質のその後の分析にも不可欠です(図4)。このプロトコルの重要なステップの 1 つは、2 つのスライド上の同じファイバーの識別とタグ付けです。前に説明したように、LDの画像を取得する前に、スライドをファイバータイプでスキャンし、マージされた色で筋肉断面を再構築することが重要です(図3B)。軸索小枝や筋紡錘などの各筋肉セクションの顕著な構造は、研究者が両方のスライドで同じ繊維を見つけるのに役立つ優れたランドマークです(図6)。スライドはほとんどの共焦点顕微鏡では逆さまに置かれているため、位置決め作業を容易にするために、パーソナルコンピュータ上のファイバー型再構成画像を反転させることをお勧めします。
共焦点顕微鏡によるボディピーラミニン染色の取得について説明した設定により、3~6本の繊維のLDのサイズ、数、分布を同時に可視化し、後で分析することができます(図6 および 図7)。画像解析ソフトウェアフィジーでLDを分析するための詳細なステップバイステッププロトコルもここで提供されています。プロトコルに示されているように、画像上に存在する各ファイバーの完全な分析は長くて退屈です。しかし、フィジーには、Java言語に基づいてマクロと呼ばれるカスタマイズされたプログラムの設計を許可するという利点 があります。著者らは、上記の一連の個々のコマンドを自動化して、ループで自動的に実行され、数分で分析できるマクロを設計しました - 画像上に存在する各ファイバーだけでなく、画像の大規模なセットも。研究者からの唯一の入力は、毎回分析される繊維の周囲長の手動選択、繊維タイプの選択、および閾値を適用して粒子を定量化した後の結果画像の目視検査である。
ここでは、場所依存の方法でLDの分析が実装されています。繊維の面積およびMF直径を予め測定することにより、サイズ依存的な(Straussらによって記述されているように非固定の)縮小が適用され、各繊維の中央および周辺領域が得られる(図4 および 図7)。図 7のヒストグラムに見られるように、この方法は、LDが占める繊維面積の割合(図7E)、LDの密度 -μm2 あたりのLDの数(図7F)、およびLDの平均サイズ(図7G)の3つの重要なパラメータの定量化を可能にします。その結果、生後3ヶ月のマウス(N=5)では、IIa型(緑色の輪郭)およびIIx型(赤色の輪郭)の線維が、末梢のLDが占める面積の割合が最も大きい(図7E)。粒子の密度に関して、EDL繊維は、細胞内位置とは無関係に、ヒラメ繊維よりも常に高い密度を示す(図7F)。最後に、これらのLDの平均サイズは、常に中央よりも周辺部で大きくなります(図7G)。
げっ歯類骨格筋34,35におけるLDの蓄積を評価するために他のグループによって使用される異なる方法は、これらの結果を以前の研究の結果と比較することを困難にする。しかし、Komiya et al.34の結果に沿って、LDsが占める繊維面積の割合は、ヒラメ型IIaおよびEDL型IIx繊維においてより高い。最も重要なのは、IIb型繊維がLDが占める面積の割合が最も低いことである(図7E、灰色のヒストグラム)。繊維タイプIIbはEDLの最も優勢な繊維タイプ(75%、図5E)であるため、これらの結果は、他のグループが以前に説明したことを確認する:脂質の全体的な蓄積は、ヒラメ34,35よりもEDLにおいて低い。
ヒト25で述べられていることとは反対に、またKomiya et al.34の結果と一致して、ここで提示された結果は、ヒラメのI型繊維におけるLDsの蓄積が比較的低いことを示している。これは、ヒトI型線維の代謝特性がげっ歯類IIa型およびIIxのものとより類似しているのに対し、ヒトIIx繊維の代謝特性はげっ歯類IIb型に近いため、マウスとヒト36との間の繊維型種間差異によって説明することができる37。要約すると、ここで説明するさまざまな技術は、繊維タイプに依存する方法でLDおよび細胞内のそれらの分布に関連するいくつかのパラメータを研究および比較するための、再現可能で信頼性が高く、時間効率の良い方法を提供する。
最適でない実験
凍結手順が正しく行われず、イソペンタンが適切な温度にない場合、 氷結晶 が繊維の内部に形成されます(図8A)。これらの凍結アーチファクトは、サンプルの組織学的調製後にのみ検出可能であり、繊維の穴として認識することができる。LDを適切に定量化するためには、これらのアーチファクトを避ける必要があります。筋肉ブロックを適切に融解および再凍結すると、これらのアーチファクト29を有意に減少させることができることが実証されている。
もう1つの問題は、 繊維が長手方向の軸に垂直に切断されていない場合に 発生します(図8B)。LDの定量化と繊維、筋肉、または動物間の比較は、切片が横方向でない場合には実行できません。このため、凍結する前に実体顕微鏡の助けを借りて筋肉をコルクに正しく配置し、クライオスタットの近くに明視野顕微鏡を設置することが不可欠です。後者は、研究者がクライオスタット上のサンプルの正しい位置合わせを見つけることを可能にします。
まれに、 MyHCアイソフォームの標識が 1つ以上の繊維タイプで非常に弱い場合があります(図8C)。この場合、LD の分析は不完全になります。この場合、筋肉の切断から始めて実験を繰り返す必要があります。最後に、 ボディピーは筋肉断面の周辺に蓄積することができた (図8D)。これが起こると、染色はそれらの繊維に非常に強くなり、人工的な結果を生み出します。これらのファイバーからの画像の取得は避けてください。

図2:凍結および凍結切断のためのサンプルの調製(A-D)マウスヒラメおよびEDL筋肉を解剖し、OCTの滴を有する硬質プラスチックによって保持されたコルク上に置く。 (E-G)ステンレス鋼タンブラーはイソペンタンで満たされ、液体窒素中でその溶融温度まで冷却される。(H,I)冷イソペンタンの入ったタンブラーを液体窒素から取り出し、試料をタンブラーの底部まで浸漬し、15秒間旋回させる(J-L)試料の入ったコルクをプラスチック支持体なしでクライオスタットホルダーディスクに載せ、10μmの直列横切片を接着スライドに直接取り付けます。隣接する2つの連続断面は、LDの染色およびMyHCの検出のために直ちに処理される。略語: LDs = 脂肪滴;EDL = 伸筋デジトーラム・ロンガス;MyHCs=ミオシン重鎖アイソフォーム;OCT = 最適切削温度。この図の拡大版を表示するには、ここをクリックしてください。
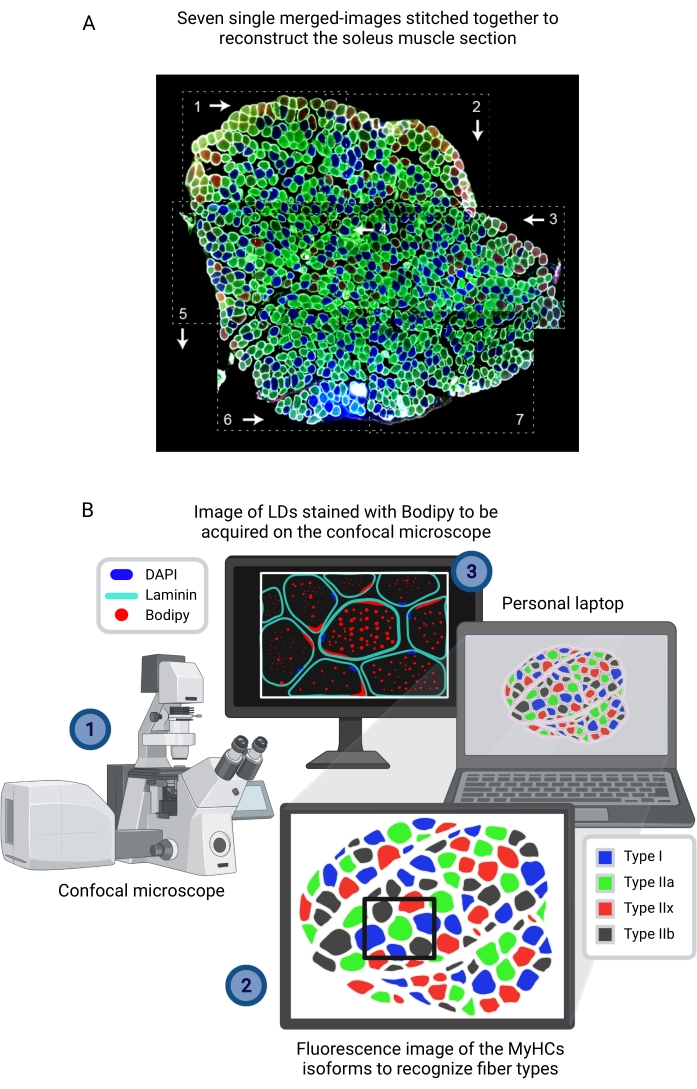
図3:別のコンピュータで見た再構成された合成画像からファイバーの種類を特定した後のボディピー画像取得。 (A)画像処理ソフトウェアを使用して縫い合わせた7つの独立したマージ画像(破線長方形)から、ファイバータイプ(MyHC)について免疫標識されたヒラメ断面全体の再構成。白矢印及び数字は、従来の落射蛍光顕微鏡を用いた画像取得時の順序を表す。(B)ボディピー画像取得のために、(1)ラミニン-AF647およびBodipy-555/568で免疫染色された筋肉切片を含む視野を、共焦点顕微鏡に接続されたコンピュータのスクリーン上に可視化する。(2)線維が免疫染色された筋肉部の再構成画像上に位置するものを線維(MyHCs)の種類を検出する。(3)共焦点顕微鏡を用いて画像を取得する。略語: LDs = 脂肪滴;DAPI=4',6-ジアミジノ-2-フェニルインドール;MyHCs=ミオシン重鎖アイソフォーム。 この図の拡大版を表示するには、ここをクリックしてください。
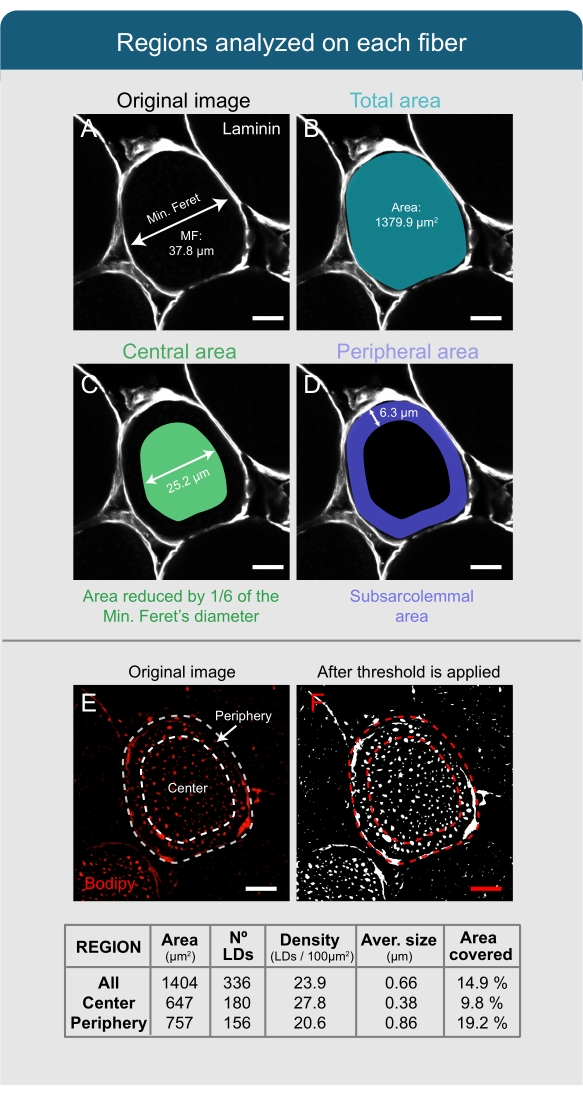
図4:フィジーによる脂肪滴の分析(A,B)繊維のサルコレンマはラミニン画像に基づいて認識され、ROIとして選択される。総面積とMFが測定されます。(c)繊維の中央部を認識するために、選択はMFの値の1/6だけ減少する。(D)中央と全選択の間の領域は、末梢またはサルコレマール下領域として設定される。(E)ボディピーで染色されたLDの分析には閾値が適用され、(F)粒子分析ツールを使用してLDに関連するさまざまなパラメータを定量化します(表を参照)。これらの値は、完全な繊維(すべて)、中央部(中心)、およびサルコレンマル下領域(周辺)について、独立して得られます。スケールバー = 12 μm。略語: LDs = 脂肪滴;ROI = 関心領域;MF = フェレットの最小直径。この図の拡大版を表示するには、ここをクリックしてください。
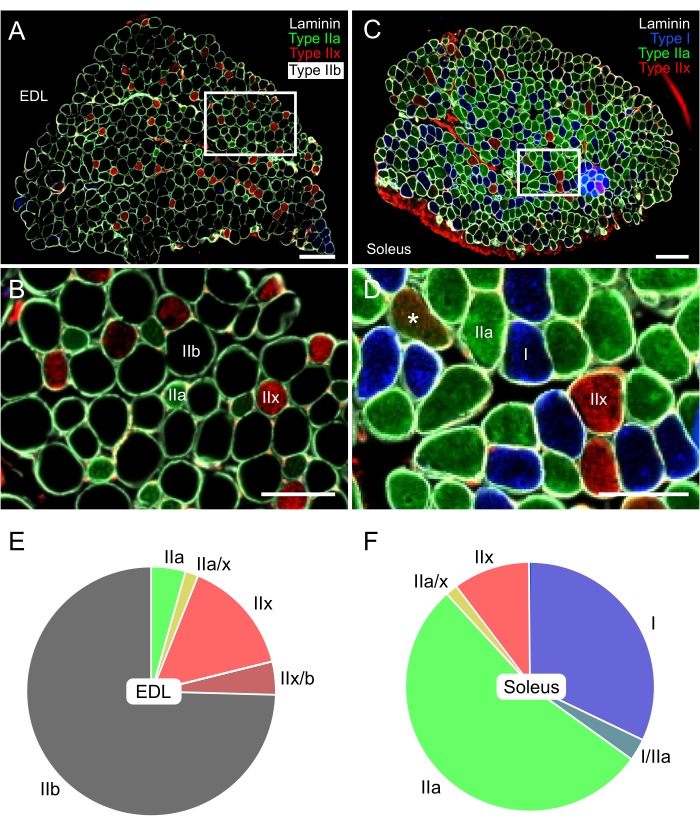
図5:EDL(解糖系)およびヒラメ(酸化性)マウス筋肉における繊維タイプの代表的な免疫染色。EDL(A,B)とヒラメ(C,D)の蛍光画像をデジタルのホールスライド蛍光顕微鏡で合成しました。I型(青-AF405)、IIa型(緑-AF488)、IIx型(赤-AF568)、およびラミニン(白-AF647)に対する抗体を使用した。黒色繊維は繊維タイプIIbに対応する。B と D は、それぞれパネル A と C の白い長方形の内側のファイバーの詳細を示しています。パネル D のアスタリスク (*) は、IIa/IIx ハイブリッド ファイバーを示しています。(E,F)3ヶ月齢マウス(N=5)由来のEDLおよびヒラメにおける繊維型分布の代表的な定量化。EDLは、IIb型、次いでIIx、およびIIa繊維(それぞれ〜75%、15%、および5%)を主成分としていた。対照的に、ヒラメはIIa型(>50%)とI型繊維(30%)を主成分としていた。IIx型線維の割合は両方の筋肉でかなり類似していたが、ハイブリッド線維の割合は非常に低かった。スケールバー = 200 μm (A,C), 100 μm (B,D).略語: EDL = 伸筋桁長尺。この図の拡大版を表示するには、ここをクリックしてください。
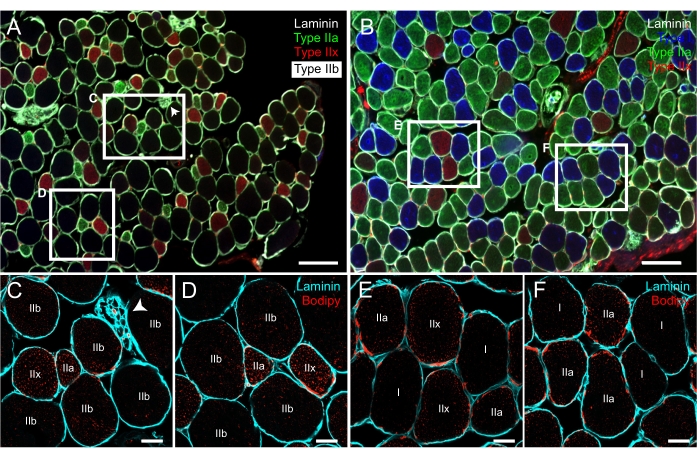
図6:MyHCアイソフォームについて以前に免疫標識した連続断面上のボディピーによるLDsの代表的な染色。落射蛍光顕微鏡を用いて取得したマウスEDL(A)とヒラメ(B)の蛍光マージ画像は、I型(青色)、IIa(緑色)、IIx(赤色)、IIb(黒色)繊維、およびラミニン(繊維を取り囲む白色シグナル)を示す。(C-F)ラミニン(シアン)とボディピー(赤)で共標識されたEDL(C、D)とヒラメ(E、F)からの共焦点蛍光画像。 C-Fに示す繊維は、パネルAおよびBの白い長方形の内側の繊維と同じであることに注意してください。Aの白い長方形の右隅には、軸索小枝を区別することができます(白い矢印)。スケールバー = 200 μm (A,B), 20 μm (C-F).略語: LDs = 脂肪滴;EDL = 伸筋デジトーラム・ロンガス;MyHCs=ミオシン重鎖アイソフォーム。この図の拡大版を表示するには、ここをクリックしてください。

図7:線維型および細胞下特異的な方法でのLDの定量化。 ヒラメ(A,B)からのI型およびIIa型線維の代表的な蛍光共焦点画像、ならびにボディピー(赤色)およびα2-ラミニン(図示せず)との共標識後に得られたEDL(C,D)由来のIIx型およびIIb型線維。LD含量(ボディピーおよび密度が占める面積の%)および形態(サイズ)を、細胞下特異的な様式で分析した。繊維周囲長はラミニン染色によって定義され、中央または周辺領域はMF直径に基づいて設定された。各繊維タイプの中央領域または周辺領域におけるボディピー(LD)(E)、LD密度(数/μm2)(F)、または平均LDサイズ(G)が占める繊維面積の割合。結果はSEM±平均として表されます。スケールバー = 10 μm。略語: LDs = 脂肪滴;EDL = 伸筋デジトーラム・ロンガス;C = 中央;P = 周辺機器。 この図の拡大版を表示するには、ここをクリックしてください。
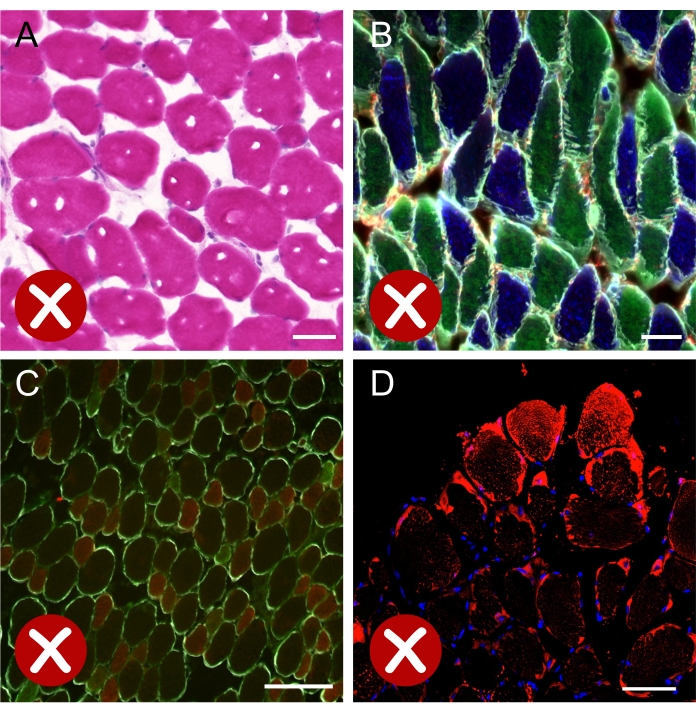
(A)凍結プロセス中に形成された氷結晶を示すヘマトキシリン-エオジンについて染色された筋肉断面の明視野画像。(b)MyHCsおよびラミニンについて免疫染色されたヒラメ切片の蛍光マージ画像は、線維の大部分が長手方向軸に沿って切断されていることを示す。(c)MyHCsおよびラミニンについて免疫染色したEDL切片の蛍光画像。繊維タイプIIa(緑色)の弱い染色は、各繊維タイプの正しい定量化を妨げる。(d)筋断面の周縁部に位置する線維上のボディピー(赤色)の強い人工染色を示す共焦点像。スケールバー = 50 μm (A,B), 200 μm (C,D).略語: EDL = 伸筋桁長尺;MyHCs=ミオシン重鎖アイソフォーム。この図の拡大版を表示するには、ここをクリックしてください。
補足図S1:筋肉断面上のオイルレッドOによるLD染色。 (A,B)ヒラメおよびEDLにおけるオイルレッドOで得られた染色のパターンをそれぞれ示す共焦点画像。この染色に使用されるプロトコルは、Pratsらによって詳細に説明されている24。LDsの蓄積は、以前にBodipyについて説明したように、筋線維の筋肉下領域においてより高いことに留意されたい。スケールバー = 20 μm。略語:LD=脂肪滴;EDL = 伸筋桁長尺。このファイルをダウンロードするには、ここをクリックしてください。
補足図S2:ヒラメ筋におけるLDsとミトコンドリアの共染色。(a)ミトコンドリア膜上に存在するタンパク質であるTomm20(緑色)、DAPI(青色)、およびBodipy-558/568標識LD(赤色)の免疫標識を示す共焦点マージ画像。Aの差し込み図は、LD(赤)に結合したいくつかのミトコンドリア(緑)を示しています。この画像は、エアリスカン共焦点超解像顕微鏡を適用して得られた。(B,C)LDおよびミトコンドリアの対応するシングルチャネル画像、それぞれ。スケールバー = 10 μm (A-C)、5 μm (A、差し込み図)。略語: LDs = 脂肪滴;DAPI = 4',6-ジアミジノ-2-フェニルインドール。このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル1: 複数のラミニン+ボディピ画像上のLDの自動分析のためのフィジーマクロ。 このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル2: マクロBodipy_JoVE.ijmを操作する方法のステップバイステップの説明。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
ここで詳述するプロトコルは、繊維タイプおよびサブセルラー特異的にBodipyでタグ付けされたLDを定量する効率的な方法を説明しています。近年、OROやスーダンブラックBなどの古典的な脂質色素は、中性脂質に結合する細胞透過性、親油性、蛍光色素(例えば、Bodipy)の新しい配列で置き換えられています。異なるコンジュゲートとして利用可能なBodipyは、異なる固定組織および細胞23、38、39、40だけでなく、生細胞41,42においても、それらの形態、ダイナミクス、および他の細胞小器官との相互作用を研究するためにLDをタグ付けするのに非常に有効であることが証明されている41,42。
プロトコル内には、研究者が最適な結果を得るために考慮しなければならないいくつかの重要な側面があります。一度凍結すると、ホルダーのわずかな再調整しかクライオスタット上で行うことができるので、筋肉筋線維の完全な整列と向きを確保するために、選択した筋肉をコルクに正しく配置することが不可欠です。さらに、風乾凍結切片(わずか15分間)はLDに深刻な悪影響を及ぼし、LD密度が66%減少し、平均サイズが37%減少するため、切片が切断された直後に免疫染色プロトコルを開始することが重要です24。同様に、スライドを凍結および解凍すると悪影響を及ぼすため、推奨されません。このプロトコルの3番目の重要な特徴は、サンプルの固定に関連しています。ここで引用した抗体とは異なるMyHCアイソフォームを同定するためには、選択した抗体のエピトープへの結合を妨害するため、組織固定を避ける必要があります。筋肉サンプルが以前に固定されている場合、読者は、異なる抗体43を用いて最近公開された論文を参照される。メタノールまたはアセトンの使用はLDの形態を破壊するため、LDの標識および定量にはメタノールを含まないPFAのみが推奨される23,44。さらに、ラミニンで免疫標識されたスライド上のLDsの定量に透過工程は必要ありません。いくつかのグループは、TritonX-100、サポニン、またはグリシンなどの洗剤による透過処理がLDのサイズまたは数を44,45に減少させることができることを示しているので、透過処理は非常に推奨されない。最後に、共焦点顕微鏡の設定の微調整は、LDsに存在する中性脂質のみを認識し、他の細胞小器官24の膜に存在する中性脂質は認識しないために極めて重要である。
ここでは、LDマーカーとしてBodipy-558/568C12を用いた。しかし、LDにタグを付け、骨格筋筋線維内の形態と位置を研究するために使用される最も頻繁に使用されるボディピーは、Bodipy-493/503です。両方の色素は、インキュベーション時間、作業濃度、および狭い発光スペクトルにおいて類似していますが、励起および発光範囲はわずかに異なります。Bodipy-493/503の使用に関する完全なプロトコルについては、読者はListenberger and Brown46またはSpangenburg et al.23の研究を参照されたい。Bodipy−558/568C12は、脂肪組織47、変性網膜48、線維性腎臓49、または線維芽細胞50などの他の組織におけるLDsを染色するために使用されてきた。このボディピーは、OROで得られた染色と同様の染色(補足図S1参照)をもたらすが、技術的負担はかなり少なく、より特異性が高い24,51。さらに、Bodipy-558/568 C12は、緑色スペクトル二次抗体でタグ付けされたタンパク質または細胞小器官の検出(補足図S2およびYanら49を参照)またはGFP遺伝子組み換えモデル52と組み合わせてLDの定量を可能にするという利点を有する。これら2つのアプリケーションは、LDと他の細胞小器官およびタンパク質とのダイナミクスおよび相互作用を解明するための非常に強力なツールである。それにもかかわらず、細胞内のタンパク質の共標識が意図されていない場合、著者らは、最も特徴付けられるLD色素Bodipy-493/503の使用を推奨している。
このプロトコルの限界の1つは、画像の取得およびLD形態学的特徴の定量化に関連する。共焦点レーザー走査顕微鏡の技術的進歩により、広視野顕微鏡と比較して平面分解能が大幅に向上し、Z平面でサンプルをスキャンするときに物体の3D再構成が可能になりました。これは、LD形態24および骨格筋線維38,53における他のタンパク質との相互作用の研究に非常に有用であったが、各3D再構成画像がいくつかの独立した2D画像で構成されているため、画像取得および処理時間を増加させた。上記のプロトコルでは、共焦点画像は40倍の対物レンズで2Dでのみ取得されました。この方法では、63倍の対物レンズを使用する場合のように1本だけでなく、画像あたり3~6本の筋線維を取得できます。その結果、分解能が低下し、LDサイズと形態の全体的な推定が完全に正確ではありません。それにもかかわらず、それはサンプルあたりのより多くの繊維の分析を可能にし、これは特に多数の筋肉および状態を比較しなければならない動物実験において考慮すべき重要な事実でもある。
ここでは、互いに隣接する類似の大きさの2つの筋肉34を凍結することにより、サンプルの処理時間が大幅に短縮され、それらの独立した処理に由来する可能性のある人工的な差異が低減されることが示される。さらに、LDsを分析するこの方法は、繊維タイプ54内および繊維タイプ間のLDの細胞内分布の違いを考慮に入れている54。筋線維の周囲長を選択し、繊維の最小フェレ径に関連してこの選択を減らすことは、中枢および末梢(サルコレム下)LDのサイズおよび密度の研究を独立して容易にする。LDsのサルコレム下蓄積がインスリン抵抗性に直接寄与することが実証されているため、この方法を適用することは非常に重要です。ヒトにおけるいくつかの報告は、繊維の種類および位置に依存する方法でLDを研究しているが、11,16,25、これは、我々の知る限り、この方法がげっ歯類の筋肉に適用されたのは初めてである。さらに、フィジーの自己設計マクロの助けを借りてLDを定量化することで、画像解析時間が大幅に短縮され、簡素化されました。マクロとその使用方法に関する詳細な説明は、それぞれ補足ファイル 1 および補足ファイル 2 として利用できます。
全体として、著者らは、本明細書に記載されるプロトコールが、骨格筋における脂質代謝を研究する他の研究者にとって有用なツールとなり得ると考えている。説明されている技術は、異なる筋肉や異なる条件(絶食/過剰摂取、訓練/座りがち、若年/加齢、痩せ/肥満)に適用され、LDの動態、細胞の他の成分との相互作用の重要性、解糖系および酸化性線維における脂質の貯蔵および代謝方法、および2型糖尿病におけるインスリン抵抗性の発症におけるそれらの役割をよりよく理解するのに役立つことを願っています。
開示事項
著者は、宣言する利益相反を持っていません。
謝辞
この研究は 、Fonds National de la Recherche Scientifique (FNRS-Crédit de Recherche J.0022.20)と Société Francophone du Diabète (SFD-Roche Diabetes Care)からの助成金によって支援されました。M.A.D.-L.d.C.はワロニー・ブリュッセル国際エクセレンス・プログラムからフェローシップを受けました。
著者らは、このプロトコルの開発に貢献したアリス・モニエと、画像取得プロセスにおける彼女の専門知識と技術的支援に対してキャロライン・ブーザンに感謝します。我々はまた、クライオスタット及び顕微鏡へのアクセスについて、2IP-IRECイメージングプラットフォーム(2IP-IRECイメージングプラットフォーム、実験臨床研究所、ルーヴァンカトリック大学、1200ブリュッセル、ベルギー)にも感謝する。最後に、著者らは、原稿の建設的な批判に対して、ニコラ・デュビュイソン、ロマン・ヴェルセル、ミシェル・アブー=サムラに感謝したい。これらの記事の数字のいくつかは、BioRender.com で作成されました。
資料
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| AxioCam 506 mono 6 Mpix camera | Zeiss | ||
| AxioCam MRm 1.4MPix CCD camera | Zeiss | ||
| Chemical hood | Potteau Labo | EN-14175 | |
| Confocal microscope | Zeiss | LSM800 | |
| Cork discs (ø 20 mm, 3 mm thick) | Electron Microscopy Sciences | 63305 | |
| Cryo-Gloves | Tempshield | 16072252 | |
| Cryostat | Thermo Scientific | Microm Cryo Star HM 560 | |
| Dissecting Stereo Microscope SMZ745 | Nikon | ||
| Dry Ice | |||
| Dumont Forceps | F.S.T | 11295-10 | |
| Epifluorescence microscope | Zeiss | AxioImage-Apotome Z1 | |
| Extra Fine Bonn Scissors | F.S.T | 14084-08 | |
| FisherBrand Disposable Base Molds (0.7 x 0.7 cm) | ThermoFisher | 22-363-552 | Used to cut a piece to hold the muscle on the cork for freezing |
| Glass petri dish (H 25 mm, ø 150 mm) | BRAND Petri dish, MERK | BR455751 | Used to place the muscles on ice during dissection |
| ImmEdge Hydrophobic barrier PAP Pen | Vector Labs | H-4000 | Used to create an hidrophobic barrier around the muscle sections |
| Incubator | MMM Medcenter | Incucell 707 | |
| Microscope Cover Glasses (24x50 mm) | Assistent | 40990151 | |
| Microscope Slide Boxes | Kartell | 278 | Used as humid chambers for immunohistochemistry |
| Neck holder | Linie zwo | SB-035X-02 | Used as strap to hold the stainless steel tumbler |
| No 15 Sterile Carbon Steel Scalpel Blade | Swann-Morton | 0205 | |
| Paint brushes | Van Bleiswijck | Amazon B07W7KJQ2X | Used to handle cryosections |
| Permanent Marker Pen Black | Klinipath/VWR | 98307-R | Used to label slides |
| Pierce Fixation Forceps | F.S.T | 18155-13 | |
| Polystyrene Box | H 12 cm x L 25 cm x W 18 cm, used as a liquid nitrogen container and to transport the samples to the cryostat | ||
| Scalpel Handle, 125 mm (5"), No. 3 | Aesculap | BB073R | |
| Stainless Steel Cup 10oz | Eboxer | B07GFCBPFH | Tumbler to fill with isopentene for muscle freezing |
| Superfrost Ultra Plus slides | ThermoFisher | J1800AMNZ | |
| Surgical tweezers 1/2 teeth | Medische Vakhandel | 1303152 | Also called "Rat teeth tweezers" |
| Vannas Spring Scissors - 3 mm Cutting Edge | F.S.T | 15000-00 | |
| Weighing boats | VWR international | 611-2249 | |
| Whole-Slide Scanner for Fluorescence | Zeiss | Axio Scan.Z1 | |
| Reagents | |||
| Alexa Fluor 405 Goat Anti-Mouse IgG2b | Sigma-Aldrich | SAB4600477 | Used at a final concentration of 1:500 |
| Alexa Fluor 488 Goat Anti-Mouse IgG1 | ThermoFisher | A-21121 | Used at a final concentration of 1:500 |
| Alexa Fluor 568 Goat Anti-Mouse IgM | Abcam | ab175702 | Used at a final concentration of 1:1,000 |
| Alexa Fluor 647 goat anti rat-IgG (H+L) secondary antibody | ThermoFisher | A-21247 | Used at a final concentration of 1:500 |
| BODIPY-493/503 (4,4-difluoro-1,3,5,7,8-pentametil-4-bora-3a,4a-diaza-s-indaceno) | ThermoFisher | D3922 | Used at a final concentration of 1 µg/mL |
| BODIPY-558/568 C12 (4,4-Difluoro-5-(2-Thienyl)-4-Bora-3a,4a-Diaza-s-Indacene-3-Dodecanoic Acid) | ThermoFisher | D3835 | Used at a final concentration of 1 µg/mL |
| DAPI (4',6-diamidino-2-phenylindole) | ThermoFisher | D1306 | Used at a final concentration of 0.5 µg/mL |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | D-8418 | Used to solve Bodipy for the 1 mg/mL stock solution. CAUTION: Toxic and flammable. Vapors may cause irritation. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Formaldehyde solution 4%, buffered, pH 6.9 | Sigma-Aldrich | 1004969011 | CAUTION: May cause an allergic skin reaction. Suspected of causing genetic defects. May cause cancer. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Isopentane GPR RectaPur | VWR international | 24872.298 | CAUTION: Extremely flammable liquid and vapor. May be fatal if swallowed and enters airways. May cause drowsiness or dizziness. Repeated exposure may cause skin dryness or cracking. Wear protective gloves/protective clothing/eye protection/face protection. |
| Liquid Nitrogen | CAUTION: Extremely cold. Wear gloves. Handle slowly to minimize boiling and splashing and in well ventilated areas. Use containers designed for low-temperature liquids. | ||
| Mouse on mouse Blocking Reagent | Vector Labs | MKB-2213-1 | Used at concentration of 1:30 |
| Myosin heavy chain Type I (BA-D5-s Primary Antibody) Gene: MYH7, monoclonal bovine anti mouse IgG2b | DSHB University of Iowa | BA-D5-supernatant | Used at a final concentration of 1:10 |
| Myosin heavy chain Type IIA (SC-71-s Primary Antibody) Gene: MYH2, Monoclonal bovine anti mouse IgG1 | DSHB University of Iowa | SC-71-supernatant | Used at a final concentration of 1:10 |
| Myosin heavy chain Type IIX (6H1-s Primary Antibody), Gene: MYH1, Monoclonal rabbit anti mouse IgM | Developmental Studies Hybridoma Bank, University of Iowa | 6H1-supernatant | Used at a final concentration of 1:5 |
| Normal Goat Serum (NGS) | Vector Labs | S-1000 | |
| PBS 0.1 M | Commonly used on histology laboratories | ||
| ProLong Gold Antifade Mountant | Invitrogen | P36930 | |
| Rat anti-Laminin-2 (α-2 Chain) primary antibody (monoclonal) | Sigma-Aldrich | L0663 | Used at a final concentration of 1:1,000 |
| Tissue-Tek O.C.T compound | Sakura | 4583 | |
| Software | |||
| Adobe Illustrator CC | Adobe Inc. | Used to design the figures | |
| Adobe Photoshop | Adobe Inc. | Confocal software | |
| BioRender | https://biorender.com/ | Used to design the figures | |
| Fiji/ImageJ | https://imagej.net/software/fiji/ | Used to analyse the acquired images | |
| Microsoft PowerPoint | Microsoft | Used to reconstruct the histology of the whole muscle after scanning the fiber types | |
| Zen Blue 2.6 | Zeiss | Used to reconstruct the histology of the whole muscle after scanning the fiber types |
参考文献
- Correa-de-Araujo, R., et al. Myosteatosis in the context of skeletal muscle function deficit: an interdisciplinary workshop at the National Institute on Aging. Frontiers in Physiology. 11, 963(2020).
- Miljkovic, I., et al. Greater skeletal muscle fat infiltration is associated with higher all-cause and cardiovascular mortality in older men. Journals of Gerontology Series A: Biomedical Sciences and Medical Sciences. 70 (9), 1133-1140 (2015).
- Nachit, M., et al. Myosteatosis rather than sarcopenia associates with non-alcoholic steatohepatitis in non-alcoholic fatty liver disease preclinical models. Journal of Cachexia, Sarcopenia, and Muscle. 12 (1), 144-158 (2021).
- Aleixo, G. F. P., et al. Myosteatosis and prognosis in cancer: Systematic review and meta-analysis. Critical Reviews in Oncology/Hematolgoy. 145, 102839(2020).
- Gemmink, A., Schrauwen, P., Hesselink, M. K. C. Exercising your fat (metabolism) into shape: a muscle-centred view. Diabetologia. 63 (8), 1453-1463 (2020).
- van Loon, L. J. Use of intramuscular triacylglycerol as a substrate source during exercise in humans. Journal of Applied Physiology. 97 (4), 1170-1187 (2004).
- Coen, P. M., Goodpaster, B. H. Role of intramyocelluar lipids in human health. Trends in Endocrinology and Metabolism. 23 (8), 391-398 (2012).
- Seibert, J. T., Najt, C. P., Heden, T. D., Mashek, D. G., Chow, L. S. Muscle lipid droplets: cellular signaling to exercise physiology and beyond. Trends in Endocrinology and Metabolism. 31 (12), 928-938 (2020).
- Bergman, B. C., Goodpaster, B. H. Exercise and muscle lipid content, composition, and localization: influence on muscle insulin sensitivity. Diabetes. 69 (5), 848-858 (2020).
- Nielsen, J., Christensen, A. E., Nellemann, B., Christensen, B. Lipid droplet size and location in human skeletal muscle fibers are associated with insulin sensitivity. American Journal of Physiology-Endocrinology and Metabolism. 313 (6), 721-730 (2017).
- Covington, J. D., et al. Intramyocellular lipid droplet size rather than total lipid content is related to insulin sensitivity after 8 weeks of overfeeding. Obesity (Silver Spring). 25 (12), 2079-2087 (2017).
- Bosma, M. Lipid droplet dynamics in skeletal muscle). Experimental Cell Research. 340 (2), 180-186 (2016).
- Nielsen, J., et al. Increased subsarcolemmal lipids in type 2 diabetes: effect of training on localization of lipids, mitochondria, and glycogen in sedentary human skeletal muscle. American Journal of Physiology-Endocrinology and Metabolism. 298 (3), 706-713 (2010).
- Ferreira, R., et al. Subsarcolemmal and intermyofibrillar mitochondria proteome differences disclose functional specializations in skeletal muscle. Proteomics. 10 (17), 3142-3154 (2010).
- Barrett, J. S., Whytock, K. L., Strauss, J. A., Wagenmakers, A. J. M., Shepherd, S. O. High intramuscular triglyceride turnover rates and the link to insulin sensitivity: influence of obesity, type 2 diabetes and physical activity. Applied Physiology, Nutrition and Metabolism. , 1-14 (2022).
- Daemen, S., et al. Distinct lipid droplet characteristics and distribution unmask the apparent contradiction of the athlete's paradox. Molecular Metabolism. 17, 71-81 (2018).
- Bredella, M. A., Ghomi, R. H., Thomas, B. J., Miller, K. K., Torriani, M. Comparison of 3.0 T proton magnetic resonance spectroscopy short and long echo-time measures of intramyocellular lipids in obese and normal-weight women. Journal of Magnetic Resonance Imaging. 32 (2), 388-393 (2010).
- Schrauwen-Hinderling, V. B., Hesselink, M. K., Schrauwen, P., Kooi, M. E. Intramyocellular lipid content in human skeletal muscle. Obesity (Silver Spring). 14 (3), 357-367 (2006).
- De Bock, K., et al. Evaluation of intramyocellular lipid breakdown during exercise by biochemical assay, NMR spectroscopy, and Oil Red O staining. American Journal of Physiology-Endocrinology and Metabolism. 293 (1), 428-434 (2007).
- Koopman, R., Schaart, G., Hesselink, M. K. Optimisation of oil red O staining permits combination with immunofluorescence and automated quantification of lipids. Histochemistry and Cell Biology. 116 (1), 63-68 (2001).
- Gueugneau, M., et al. Skeletal muscle lipid content and oxidative activity in relation to muscle fiber type in aging and metabolic syndrome. Journal of Gerontology Series A: Biomedical Sciences and Medical Sciences. 70 (5), 566-576 (2015).
- Gemmink, A., et al. Super-resolution microscopy localizes perilipin 5 at lipid droplet-mitochondria interaction sites and at lipid droplets juxtaposing to perilipin 2. Biochimica et Biophysica Acta-Molecular and Cell Biology of Lipids. 1863 (11), 1423-1432 (2018).
- Spangenburg, E. E., Pratt, S. J. P., Wohlers, L. M., Lovering, R. M. Use of BODIPY (493/503) to visualize intramuscular lipid droplets in skeletal muscle. Journal of Biomedicine and Biotechnology. 598358, (2011).
- Prats, C., et al. An optimized histochemical method to assess skeletal muscle glycogen and lipid stores reveals two metabolically distinct populations of type I muscle fibers. PLoS One. 8 (10), 77774(2013).
- Strauss, J. A., Shepherd, D. A., Macey, M., Jevons, E. F. P., Shepherd, S. O. Divergence exists in the subcellular distribution of intramuscular triglyceride in human skeletal muscle dependent on the choice of lipid dye. Histochemistry and Cell Biology. 154 (4), 369-382 (2020).
- Shepherd, S. O., et al. Sprint interval and traditional endurance training increase net intramuscular triglyceride breakdown and expression of perilipin 2 and 5. Journal of Physiology. 591 (3), 657-675 (2013).
- Whytock, K. L., et al. A 7-day high-fat, high-calorie diet induces fibre-specific increases in intramuscular triglyceride and perilipin protein expression in human skeletal muscle. Journal of Physiology. 598 (6), 1151-1167 (2020).
- Wang, C., Yue, F., Kuang, S. Muscle histology characterization using h&e staining and muscle fiber type classification using immunofluorescence staining. Bio-Protocol. 7 (10), (2017).
- Meng, H., et al. Tissue triage and freezing for models of skeletal muscle disease. Journal of Visualized Experiments: JoVE. (89), e51586(2014).
- Kumar, A., Accorsi, A., Rhee, Y., Girgenrath, M. Do's and don'ts in the preparation of muscle cryosections for histological analysis. Journal of Visualized Experiments: JoVE. (99), e52793(2015).
- Leiva-Cepas, F., et al. Laboratory methodology for the histological study of skeletal muscle. Archivos de Medicina del Deporte. 35 (186), 254-262 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Schiaffino, S., et al. Three myosin heavy chain isoforms in type 2 skeletal muscle fibres. Journal of Muscle Research & Cell Motility. 10 (3), 197-205 (1989).
- Komiya, Y., et al. Mouse soleus (slow) muscle shows greater intramyocellular lipid droplet accumulation than EDL (fast) muscle: fiber type-specific analysis. Journal of Muscle Research & Cell Motility. 38 (2), 163-173 (2017).
- Andrich, D. E., et al. Altered lipid metabolism impairs skeletal muscle force in young rats submitted to a short-term high-fat diet. Frontiers in Physiology. 9, 1327(2018).
- Schiaffino, S. Fibre types in skeletal muscle: a personal account. Acta Physiologica. 199 (4), 451-463 (2010).
- Bloemberg, D., Quadrilatero, J. Rapid determination of myosin heavy chain expression in rat, mouse, and human skeletal muscle using multicolor immunofluorescence analysis. PLoS One. 7 (4), 35273(2012).
- Gemmink, A., et al. Decoration of intramyocellular lipid droplets with PLIN5 modulates fasting-induced insulin resistance and lipotoxicity in humans. Diabetologia. 59 (5), 1040-1048 (2016).
- Askinas, C., et al. Biophotonics Congress: Biomedical Optics Congress 2018 (Microscopy/Translational/Brain/OTS). , JTu3A.4 (Optical Society of America) (2018).
- Morén, B., et al. EHD2 regulates adipocyte function and is enriched at cell surface-associated lipid droplets in primary human adipocytes. Molecular Biology of the Cell. 30 (10), 1147-1159 (2019).
- Benador, I. Y., et al. Mitochondria bound to lipid droplets have unique bioenergetics, composition, and dynamics that support lipid droplet expansion. Cell Metabolism. 27 (4), 869-885 (2018).
- de la Rosa Rodriguez, M. A., et al. Hypoxia-inducible lipid droplet-associated induces DGAT1 and promotes lipid storage in hepatocytes. Molecular Metabolism. 47, 101168(2021).
- Jevons, E. F. P., Gejl, K. D., Strauss, J. A., Ørtenblad, N., Shepherd, S. O. Skeletal muscle lipid droplets are resynthesized before being coated with perilipin proteins following prolonged exercise in elite male triathletes. American Journal of Physiology-Endocrinology and Metabolism. 318 (3), 357-370 (2020).
- Ohsaki, Y., Maeda, T., Fujimoto, T. Fixation and permeabilization protocol is critical for the immunolabeling of lipid droplet proteins. Histochemistry and Cell Biology. 124 (5), 445-452 (2005).
- Prats, C., et al. Decrease in intramuscular lipid droplets and translocation of HSL in response to muscle contraction and epinephrine. Journal of Lipid Research. 47 (11), 2392-2399 (2006).
- Listenberger, L. L., Brown, D. A. Fluorescent detection of lipid droplets and associated proteins. Current Protocols in Cell Biology. , Chapter 24 (Unit 24.22) (2007).
- Xue, Y., Lim, S., Bråkenhielm, E., Cao, Y. Adipose angiogenesis: quantitative methods to study microvessel growth, regression and remodeling in vivo. Nature Protocols. 5 (5), 912-920 (2010).
- Muliyil, S., et al. ADAM17-triggered TNF signalling protects the ageing Drosophila retina from lipid droplet-mediated degeneration. The EMBO Journal. 39 (17), 104415(2020).
- Yan, Q., et al. Autophagy activation contributes to lipid accumulation in tubular epithelial cells during kidney fibrosis. Cell Death Discovery. 4, 2(2018).
- Coassin, S., et al. Investigation and functional characterization of rare genetic variants in the adipose triglyceride lipase in a large healthy working population. PLoS Genetics. 6 (12), 1001239(2010).
- Daemen, S., van Zandvoort, M., Parekh, S. H., Hesselink, M. K. C. Microscopy tools for the investigation of intracellular lipid storage and dynamics. Molecular Metabolism. 5 (3), 153-163 (2016).
- Chen, Q., et al. Rab8a deficiency in skeletal muscle causes hyperlipidemia and hepatosteatosis by impairing muscle lipid uptake and storage. Diabetes. 66 (9), 2387-2399 (2017).
- Gemmink, A., et al. Decoration of myocellular lipid droplets with perilipins as a marker for in vivo lipid droplet dynamics: A super-resolution microscopy study in trained athletes and insulin resistant individuals. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids. 1866 (2), 158852(2021).
- Bergman, B. C., Hunerdosse, D. M., Kerege, A., Playdon, M. C., Perreault, L. Localisation and composition of skeletal muscle diacylglycerol predicts insulin resistance in humans. Diabetologia. 55 (4), 1140-1150 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved