Method Article
Fasertyp- und subzellspezifische Analyse des Lipidtröpfchengehalts in der Skelettmuskulatur
In diesem Artikel
Zusammenfassung
Immer mehr Beweise deuten darauf hin, dass eine übermäßige Infiltration von Lipiden in der Skelettmuskulatur zu Lipotoxizität und Diabetes führt. Hier präsentieren wir ein vollständiges Protokoll, einschließlich Gewebeverarbeitung, Färbung mit Bodipy, Bildaufnahme und Analyse, um die Größe, Dichte und subzelluläre Verteilung von Lipidtröpfchen auf fasertypspezifische Weise zu quantifizieren.
Zusammenfassung
Die Lipidinfiltration der Skelettmuskulatur, bekannt als Myosteatose, nimmt mit Fettleibigkeit und Alterung zu. Myosteatose wurde kürzlich auch als negativer prognostischer Faktor für mehrere andere Erkrankungen wie Herz-Kreislauf-Erkrankungen und Krebs entdeckt. Übermäßige Lipidinfiltration verringert die Muskelmasse und Kraft. Es führt auch zu Lipotoxizität und Insulinresistenz in Abhängigkeit vom gesamten intramyozellulären Lipidgehalt, der Lipidtröpfchenmorphologie (LD) und der subzellulären Verteilung. Der Fasertyp (oxidativ vs. glykolytisch) ist ebenfalls wichtig, da oxidative Fasern eine größere Kapazität zur Nutzung von Lipiden haben. Aufgrund ihrer entscheidenden Implikationen in der Pathophysiologie sind eingehende Studien zur LD-Dynamik und -Funktion in einer fasertypspezifischen Weise gerechtfertigt.
Hierin wird ein vollständiges Protokoll für die Quantifizierung des intramyozellulären Lipidgehalts und die Analyse der LD-Morphologie und der subzellulären Verteilung in einer fasertypspezifischen Weise vorgestellt. Dazu wurden serielle Muskelkryosektionen mit dem fluoreszierenden Farbstoff Bodipy und Antikörpern gegen Myosin-Schwerkettenisoformen angefärbt. Dieses Protokoll ermöglicht die gleichzeitige Verarbeitung verschiedener Muskeln, spart Zeit und vermeidet mögliche Artefakte und dank eines personalisierten Makros, das in Fidschi erstellt wurde, ist auch die Automatisierung der LD-Analyse möglich.
Einleitung
Die Lipidinfiltration der Skelettmuskulatur, bekannt als Myosteatose, nimmt mit Fettleibigkeit und Alterung zu. Die Myosteatose korreliert negativ mit Muskelmasse und Kraft und mit der Insulinsensitivität1. Darüber hinaus deuten neuere Studien darauf hin, dass der Grad der Myosteatose als prognostischer Faktor für andere Erkrankungen wie Herz-Kreislauf-Erkrankungen2, nicht-alkoholische Fettlebererkrankungen3 oder Krebs4 verwendet werden könnte. Lipide können sich in der Skelettmuskulatur zwischen Muskelfasern als extramyozelluläre Lipide oder innerhalb der Fasern, als intramyozelluläre Lipide (IMCLs), ansammeln. IMCLs werden überwiegend als Triglyceride in Lipidtröpfchen (LDs) gespeichert, die als Stoffwechselbrennstoff bei körperlicher Betätigung verwendet werden 5,6. Wenn jedoch das Lipidangebot die Nachfrage übersteigt oder wenn Mitochondrien dysfunktional werden, werden IMCLs an der Muskelinsulinresistenz beteiligt, wie sie bei metabolisch ungesunden, fettleibigen Personen und bei Typ-2-Diabetes-Patientenbeobachtet wird 7. Interessanterweise haben Ausdauersportler ähnliche, wenn nicht sogar höhere IMCLs-Spiegel wie bei adipösen Patienten mit Typ-2-Diabetes mellitus, während sie gleichzeitig eine hohe Insulinsensitivität beibehalten. Dieses Phänomen wird als "Athletenparadoxon"8,9 beschrieben und wird durch eine nuanciertere Bewertung der Muskel-LDs in Bezug auf ihre Größe, Dichte, Lokalisation, Dynamik und Zusammensetzung der Lipidspezies erklärt.
Erstens korreliert die LD-Größe umgekehrt mit der Insulinsensitivität und der körperlichen Fitness10,11. Tatsächlich weisen kleinere LDs eine relativ größere Oberfläche für die Lipasewirkung auf und haben daher möglicherweise eine größere Fähigkeit, Lipide zu mobilisieren12. Zweitens spielt die LD-Dichte (Anzahl/Oberfläche) eine umstrittene Rolle bei der Insulinwirkung 8,10; Dennoch scheint es bei Athleten erhöht zu sein. Drittens ist die subzelluläre Lokalisation von LDs wichtig, da LDs, die sich direkt unter der Oberflächenmembran (subsarkolemmal oder peripher) befinden, eine schädlichere Wirkung auf die Insulinsensitivität ausüben als zentrale 8,9,13. Letztere liefern Brennstoff für zentrale Mitochondrien, die eine größere Atmungsaktivität haben und spezialisierter sind, um den hohen Energiebedarf zu decken, der für die Kontraktionerforderlich ist 14. Im Gegensatz dazu liefern periphere LDs subsarkolämale Mitochondrien, die an membranbezogenen Prozessen beteiligt sind8. Schließlich können über Triglyceride hinaus spezifische komplexe Lipide im Muskel schädlicher sein als andere. Zum Beispiel können sich Diacylglycerin, langkettiges Acyl-CoA und Ceramide im Muskel ansammeln, wenn die Triglycerid-Umsatzrate niedrig ist, wodurch die Insulinsignalisierung 9,15 beeinträchtigt wird. Um auf das "Athletenparadoxon" zurückzukommen: Ausdauersportler haben eine hohe Anzahl kleinerer zentraler LDs mit erhöhten Fluktuationsraten in Typ I (oxidativen) Fasern, während adipöse und diabetische Patienten größere periphere LDs mit niedrigen Fluktuationsraten in Typ II (glykolytischen) Fasern haben 8,15,16. Zusätzlich zu ihrer Rolle bei der Energiespeicherung und -freisetzung könnten LDs über abgeleitete Fettsäuren (FA) und ein Mantelprotein (Perilipin 5) auch als kritische Akteure fungieren, die an der transkriptionellen Regulation der FA-Oxidation und der mitochondrialen Biogenese beteiligt sind8. Aufgrund ihrer entscheidenden Implikationen in der Physiologie und Pathophysiologie sind eingehende Studien über die Dynamik und Funktionen von LDs gerechtfertigt.
Obwohl es mehrere Techniken gibt, um IMCLs zu untersuchen, sind sie nicht alle geeignet, LD-Größe, -Dichte und -Verteilung auf faserspezifische Weise genau zu quantifizieren. Zum Beispiel bietet die Bewertung von IMCLs durch Magnetresonanzspektroskopie zwar nicht-invasiv, bietet aber eine Auflösung, die nicht ausreicht, um die Größe und genaue Position von LDs innerhalb der Faser zu untersuchen, und sie ist nicht fasertypspezifisch17,18. Ebenso können biochemische Techniken, die an Ganzmuskelhomogenaten19 durchgeführt werden, die Lage und Größe von Lipiden nicht beurteilen. Folglich ist die am besten geeignete Methode zur Analyse der LD-Morphologie und -Ortung die quantitative elektronische Transmissionsmikroskopie13, aber diese Technik ist teuer und zeitaufwendig. Daher hat sich die konfokale Fluoreszenzbildgebung auf Präparaten mit Farbstoffen wie Oil Red O (ORO)20,21, Monodansylpentan (MDH)22 oder Bodipy23,24,25 als das beste Werkzeug für diese Studien herausgestellt.
Hier wird ein vollständiges Protokoll beschrieben, einschließlich Gewebeentnahme und -verarbeitung, Bodipy-Färbung und konfokaler Bildaufnahme und -analyse zur Quantifizierung der LD-Größe, -Anzahl und -Lokalisation in Mausmuskel-Kryosektionen. Da IMCLs nicht gleichmäßig auf oxidative und glykolytische Fasern verteilt sind und jeder Fasertyp die LD-Dynamik unterschiedlich reguliert, muss die Untersuchung von IMCLs fasertypspezifischsein 16,25,26,27. Daher verwendet dieses Protokoll Immunfluoreszenz auf seriellen Abschnitten, um Myosin Heavy Chain (MyHC) Isoform(en) zu identifizieren, die von jeder Faser exprimiert werden. Ein weiterer Vorteil dieses Protokolls ist die gleichzeitige Verarbeitung eines glykolytischen (Extensor digitorum longus, EDL) und eines oxidativen (Soleus) Muskels, die vor dem Einfrieren nebeneinander angeordnet sind (Abbildung 1). Diese gleichzeitige Verarbeitung spart nicht nur Zeit, sondern vermeidet auch Variabilität durch die getrennte Verarbeitung der Proben.

Abbildung 1: Schematische Übersicht des Vorgehens. Nach der Muskeldissektion (1) werden ausgewählte Muskeln ähnlicher Größe vorbereitet und zusammen eingefroren (2). Serielle Querschnitte von 10 μm werden mit einem Kryostaten erhalten und direkt auf Adhäsionsobjektträgern montiert (3). Aus zwei seriellen Objektträgern ist der erste (4A) für Laminin immunmarkiert und mit Bodipy gefärbt, um LDs zu erkennen, und der zweite (4B) ist mit Antikörpern gegen MyHCs zur Erkennung von Muskelfasertypen immunresistent. Die Bilder werden mit einem konfokalen Mikroskop für Bodipy (5A) und einem Epifluoreszenzmikroskop für Muskelfasertypen (5B) aufgenommen. Die Bilder werden in Fidschi analysiert, indem ein Schwellenwert angewendet und Partikel (6A) quantifiziert werden, um die Anzahl, die durchschnittliche Größe, die Dichte und den Prozentsatz der Gesamtfläche zu erhalten, die von LDs (7) oder Zählzellen (6B) eingenommen wird, um den Prozentsatz der Fasern jedes Typs im Abschnitt (7) zu erhalten. Abkürzungen: LDs = Lipidtröpfchen; EDL = Extensor digitorum longus; MyHCs = Myosin-Schwerkettenisoformen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Protokoll
Alle an Mäusen durchgeführten Verfahren wurden von der Ethikkommission für Tierversuche aus dem medizinischen Bereich der Université Catholique de Louvain genehmigt (2019/UCL/MD/013).
1. Sezierung und Vorbereitung der Proben zum Einfrieren
- Beschriften Sie ein 3 mm dickes Stück Kork für jedes Muskelpaar.
- Setzen Sie durch einen kleinen Einschnitt mit einer Klinge in der Mitte des Korkens senkrecht ein rechteckiges Stück starren Kunststoffs (0,5 cm W, 1 cm H) ein, das als Stütze dient (Abbildung 2B).
HINWEIS: Die Größe des rechteckigen Kunststoffstücks hängt von der Größe des Muskels ab. Hierbei werden die beschriebenen Maße an die Größe des Soleus (~9 mg, 1 cm L, 2-3 mm W) und EDL (~5 mg, 1 cm L, 2-3 mm W) einer 3 Monate alten C57BL/6J männlichen Maus angepasst. - Entfernen Sie zum Zeitpunkt der Dissektion den Soleus und die EDL der Hintergliedmaße der Maus. Um zu verhindern, dass die Proben während der Dissektion austrocknen, legen Sie sie auf eine Kompresse, die leicht mit Kochsalzlösung angefeuchtet ist, in einer auf Eis gelegten Petrischale.
HINWEIS: Siehe Wang et al.28 für Erklärungen, wie man diese beiden Gliedmaßenmuskeln seziert. - Legen Sie einen kleinen Tropfen Optimal Cutting Temperature Compound (OCT) an die Kork-Kunststoff-Verbindung und vermeiden Sie Luftblasen.
- Beseitigen Sie überschüssige Feuchtigkeit aus den Proben, indem Sie sie vorsichtig mit einem Papiertuch trocknen (Abbildung 2A) und legen Sie beide Muskeln senkrecht zum Korken auf den Kunststoff (Abbildung 2C).
- Überprüfen Sie die Orientierung der Muskelmyofasern unter einem Stereomikroskop (Abbildung 2D).
HINWEIS: Es ist wichtig, den Muskel nicht mit OCT zu bedecken, da seine isolierende Wirkung ein schnelles Einfrieren verhindern und gefrierende Artefakte erzeugen würde.
2. Einfrieren von Skelettmuskelproben für die Kryosektion
ACHTUNG: Das Einfrieren des Muskels muss unter einer chemischen Haube unter geeigneter persönlicher Schutzausrüstung erfolgen (siehe Materialtabelle).
- Verwenden Sie einen Edelstahlbecher (~8 cm H, 6 cm Ø) mit zwei Seitengurten, die mindestens 25 cm lang sind (Abbildung 2F), und füllen Sie den Becher bis zu 2/3 seines Fassungsvermögens mit Isopentan.
- Nehmen Sie den Becher an den Bändern und tauchen Sie ihn vorsichtig in eine mit flüssigem Stickstoff gefüllte Styroporbox, so dass der Stickstoffgehalt außerhalb des Behälters über dem Isopentangehalt im Inneren liegt (Abbildung 2F, G).
VORSICHT: Wenn der Becher mit dem Stickstoff in Berührung kommt, kann der Temperaturschock zu einem Verwirbeln führen. Stellen Sie sicher, dass der Becher ausreichend eingetaucht ist, vermeiden Sie jedoch das Eindringen von Stickstoff, da dies zu Isopentanausfällungen führen würde. Wenn dies geschieht, lassen Sie das Isopentan abkühlen, füllen Sie den Becher mit neuem Isopentan und beginnen Sie von vorne. - Wenn das Innere des Bechers vollständig mit einer weißen festen Schicht Isopentan bedeckt ist, nehmen Sie es aus der Flüssigstickstoffbox (Abbildung 2H).
HINWEIS: Die Schmelztemperatur von Isopentan beträgt -159 ° C, die Ränder des Bechers werden weiß, wenn es kalt genug ist. - Rühren Sie die festen Isopentanstücke vorsichtig mit einer Pinzette in das verbleibende flüssige Isopentan ein, bis das gesamte Volumen wieder flüssig wird.
- Tauchen Sie den Becher wieder in den flüssigen Stickstoff ein, bis Isopentan am Boden und an den Rändern des Bechers weiße Kieselsteine bildet (Abbildung 2G, H).
HINWEIS: Dieser zweite Kühlschritt sorgt für die entsprechende Gefriertemperatur des Isopentans. - Entfernen Sie den Becher aus dem flüssigen Stickstoff und tauchen Sie die Muskeln schnell in den Boden des Bechers, indem Sie den Korken mit einer Rattenzahnpinzette halten. Schwenken Sie den Korken für 15 s im Isopentan und lagern Sie ihn bis zur Verarbeitung bei -80 °C (Abbildung 2I).
HINWEIS: Für die kurzfristige Lagerung können die Proben in einem Gefrierschrank von -20 °C aufbewahrt werden. Das vollständige Protokoll für das schnelle Einfrieren der Skelettmuskulatur wurde bereits an anderer Stelle veröffentlicht. Für detaillierte Referenzen und Fehlerbehebung siehe: Meng et al.29, Kumar et al.30 und Leiva-Cepas et al.31.
3. Kryosektion
- Bringen Sie die Proben in die Kammer eines Kryostaten, der zuvor auf -20 °C abgekühlt und die Klingentemperatur auf -25 °C eingestellt wurde.
HINWEIS: Transportieren Sie die Proben aus dem Gefrierschrank von -20 °C/-80 °C zum Kryostaten in einer mit Trockeneis gefüllten Styroporbox und lassen Sie die Proben vor dem Schneiden mindestens 20-30 min auf die Kammertemperatur ausgleichen. - Entfernen Sie den Kunststoff mit einer feinen Pinzette vom Korken und legen Sie die Kryostat-Probenscheibe zum Abkühlen auf die Schnellgefrierplatte. Sobald die Platte -50 °C erreicht hat, legen Sie etwas OCT auf die Disc und legen Sie den Korken schnell auf die Scheibe, wobei Sie fest drücken. Warten Sie, bis das OAT erstarrt und der Korken gut auf der Disc befestigt ist.
- Legen Sie die Bandscheibe auf den Objektkopf in der gewünschten Schnittausrichtung (Abbildung 2J,K) und trimmen Sie den Muskelblock über mindestens 1/3 der Länge der Muskeln hinaus und bis beide Querschnitte der Muskeln sichtbar sind.
- Stellen Sie die Schnittstärke auf 10 μm ein und legen Sie einen Abschnitt auf einen Haftobjektträger, um die korrekte Ausrichtung der Fasern auf einem Hellfeldmikroskop zu überprüfen.
HINWEIS: Die Überprüfung der Querorientierung der Fasern ist von entscheidender Bedeutung. Wenn die Fasern nicht ausreichend ausgerichtet sind, passen Sie den Winkel des Objektkopfes an, schneiden Sie einen anderen Abschnitt ab und überprüfen Sie ihn erneut. - Legen Sie zwei serielle Querschnitte auf zwei vorbeschriftete Haftobjektträger: einen Objektträger zur Bestimmung der Fasertypen, den anderen zur Quantifizierung des Lipidgehalts (Abbildung 2L).
HINWEIS: Zusätzliche serielle Querschnitte können erhalten und für andere histologische Studien bei -80 °C gehalten werden. Um jedoch eine Veränderung des Lipidgehalts und der intrazellulären Morphologie24 zu vermeiden, ist es wichtig, die ersten beiden Objektträger unmittelbar nach dem Schneiden zu verarbeiten, um ein Austrocknen an der Luft zu verhindern. Das Einfrieren und Auftauen der Objektträger zur LD-Quantifizierung hätte den gleichen Effekt und ist daher höchst unratsam.
4. Fasertypisierung und Bodipy-Färbung
- Immunhistochemischer Nachweis des Muskelfasertyps
HINWEIS: Für das folgende Protokoll reicht ein Gesamtlösungsvolumen von 250 μL aus, um den gesamten Muskelabschnitt zu bedecken, der von einem Kreis umgeben ist, der mit einem hydrophoben Stift von der ungefähren Größe einer 1-Cent-Münze gezeichnet wird.- Umgeben Sie die Abschnitte mit einem Umriss, der mit einem hydrophoben Pen gezeichnet wurde, und spülen Sie sie mit eiskalter 0,1 M phosphatgepufferter Kochsalzlösung (PBS) für 1 min bei Raumtemperatur (RT) ab. Legen Sie den Objektträger in eine feuchte Kammer und blockieren Sie ihn für 90 min bei 37 °C in Blockierlösung (10% normales Ziegenserum (NGS) und 1:30 Maus auf Maus (MOM) blockierendes Reagenz in PBS).
- Entfernen Sie die blockierende Lösung und inkubieren Sie die Objektträger für 90 min bei 37 °C mit der Lösung, die die primären Antikörper (5% NGS, 1:30 MOM blockierendes Reagenz, die primären Mausantikörper zur Erkennung von Typ I (IgG2b, bei 1:10), Typ IIa (IgG1, bei 1:10) und Typ IIx (IgM, bei 1:5) Fasern und einem Ratten-Antilaminin (α2-Kette, 1:1.000) in PBS.
- Waschen Sie die Dias mit PBS 3 x 5 min bei RT.
- Die Objektträger werden bei RT 1 h lang im Dunkeln mit der Lösung inkubiert, die die sekundären Antikörper enthält (Ziegen-Anti-IgG2b AF405 (1:500), Ziegen-Anti-IgG1 AF488 (1:500), Ziegen-Anti-IgM AF568 (1:1.000) und Ziegen-Antilaminin AF647 (1:500) in PBS).
VORSICHT: Achten Sie für den Rest des Protokolls darauf, die Schienen vom Licht fernzuhalten, um die Fluoreszenz zu erhalten. - Noch einmal 3 x 5 min in PBS waschen, in doppelt destilliertem H2O abspülen, überschüssiges Wasser entfernen und mit einem Antifade-Reagenz montieren.
HINWEIS: Lagern Sie die Dias bei 4 °C, lichtgeschützt, um die Fluoreszenz bis zur Bildaufnahme zu erhalten. Da die Objektträger nicht fixiert sind, wird empfohlen, für jedes Experiment frisch hergestellte Lösungen zu verwenden, das PBS zu autoklavieren und die Bilder so schnell wie möglich zu erfassen, um eine Kontamination der Abschnitte zu vermeiden.
- Färben von LDs mit Bodipy
HINWEIS: Ähnlich wie bei Schritt 4.1. reicht ein Gesamtlösungsvolumen von 250 μL aus, um den gesamten Muskelabschnitt zu bedecken, der von einem Kreis umgeben ist, der mit einem hydrophoben Stift von der ungefähren Größe einer 1-Cent-Münze gezeichnet wird.- Umgeben Sie die Abschnitte mit einem Umriss, der von einem hydrophoben Stift gezeichnet wird, und spülen Sie mit eiskalten 0,1 M PBS für 10 Minuten bei RT ab. Verwenden Sie eiskaltes PBS für alle Spülungen und Wäschen.
- Mit kaltem 4% Paraformaldehyd (PFA) ohne Methanol für 10 min bei RT fixieren. Nach einer ersten schnellen Spülung waschen Sie die Dias mit PBS 3 x 5 min bei RT.
VORSICHT: Führen Sie diesen Schritt unter einer chemischen Haube durch. - Legen Sie den Objektträger in eine feuchte Kammer und blockieren Sie ihn für 1 h bei RT mit 5% NGS in PBS.
- Die Objektträger werden 90 min bei 37 °C mit der Lösung des primären Antikörpers (2% NGS und Ratten-Antilaminin (α2-Kette, 1:1.000) in PBS) inkubiert. Waschen Sie die Dias mit PBS 3 x 5 min bei RT.
VORSICHT: Achten Sie für den Rest des Protokolls darauf, die Schienen vom Licht fernzuhalten, um die Fluoreszenz zu erhalten. - Inkubieren Sie für 1 h bei RT mit der sekundären Antikörperlösung, die den Ziegenanti-Ratten-AF647-Antikörper (1:500) in PBS enthält. Waschen Sie die Dias mit PBS 3 x 5 min bei RT.
- Für 20 min bei RT mit einer Lösung von 4',6-Diamidino-2-phenylindol (DAPI, 0,5 μg/ml) und BODIPY (1 μg/ml) in PBS inkubieren.
HINWEIS: Um BODIPY Stammlösung herzustellen, lösen Sie es in DMSO in einer Konzentration von 1 mg/ml auf. Für die LD-Färbung sind verschiedene Bodipy-Formulierungen im Handel erhältlich. Abhängig von der getroffenen Wahl ist die Färbemethode die gleiche (gleiche Schritte, Konzentration und Inkubationszeit); Die Erfassungsmethode wird jedoch etwas anders sein. - Nach einer ersten schnellen Spülung die Objektträger mit PBS 3 x 5 min bei RT waschen, in doppelt destilliertem H2O abspülen, überschüssiges Wasser entfernen und mit einem Antifade-Reagenz montieren.
HINWEIS: Lagern Sie die Dias bei 4 °C, geschützt vor Licht, um die Fluoreszenz bis zur Bildaufnahme zu erhalten.
5. Aufnahme von Bildern
HINWEIS: Sobald die Färbeprotokolle abgeschlossen sind, ist es wichtig, sofort mit der Bildaufnahme (innerhalb der folgenden 24 Stunden) fortzufahren, nicht nur, um eine Kontamination zu vermeiden, sondern auch, um die Morphologie, Größe und Anzahl der LDs zu erhalten.
- Aufnahme von Bildern zur Beurteilung der Fasertypen jedes untersuchten Muskels
HINWEIS: Dieser Schritt könnte mit einem Fluoreszenz-Rastermikroskop für ganze Objektträger oder mit einem herkömmlichen Epifluoreszenzmikroskop erreicht werden. Bei letzterem muss ein manuelles oder automatisiertes Zusammenfügen der Bilder erfolgen, um den Ausschnitt zu rekonstruieren.- Verwenden Sie für die Fasertyperkennung ein Epifluoreszenzmikroskop mit einem 10x/0,3-Objektiv. Wählen Sie Anregungsfilter für DAPI (405 nm), FITC, TRITC und Cy5 aus, um Typ-I-, IIa-, IIx-Fasern bzw. Laminin zu erkennen.
HINWEIS: Typ-IIb-Fasern werden nicht immunmarkiert. Sie werden als Fasern erkannt, die an den Grenzen des Sarkolemmas mit einem schwarzen Sarkoplasma mit Laminin gefärbt sind. - Stellen Sie die entsprechende Belichtungszeit für jeden Kanal ein.
- Wenn Sie ein herkömmliches Epifluoreszenzmikroskop verwenden, erfassen Sie immer die Bilder des gesamten Muskels in der gleichen Reihenfolge, um den Muskelaufbau zu erleichtern. Stellen Sie sicher, dass die Fasern am rechten Rand eines Bildes auch am linken Rand des folgenden Bildes angezeigt werden. Gleiches gilt für den oberen und unteren Teil der Bilder (Abbildung 3A).
HINWEIS: Als Referenz decken für einen Abschnitt der EDL oder des Soleus, der von einer 3 Monate alten Maus seziert wurde, durchschnittlich sechs bzw. acht Bilder den gesamten Muskelquerschnitt ab. - Nachdem der Muskel gescannt wurde, laden Sie die aufgenommenen digitalen Bilder in eine beliebige Bildverarbeitungssoftware zur Rekonstruktion (Stitching) hoch, basierend auf der Fasermorphologie (Laminin) und der Histologie des Muskelabschnitts, und speichern Sie sie als TIFF-, PNG- oder JPG-Datei, in der alle Kanäle (Farben) zusammengeführt werden (Abbildung 3A).
- Verwenden Sie für die Fasertyperkennung ein Epifluoreszenzmikroskop mit einem 10x/0,3-Objektiv. Wählen Sie Anregungsfilter für DAPI (405 nm), FITC, TRITC und Cy5 aus, um Typ-I-, IIa-, IIx-Fasern bzw. Laminin zu erkennen.
- Aufnahme von Bildern mit Laminin und Bodipy Co-Färbung
HINWEIS: Um den Fasertyp zu erkennen und eine Schätzung der Anzahl der Fasern für jeden erfassten Typ zu erhalten, ist es wichtig, dass der Fasertypabschnitt bereits gescannt und die Muskeln rekonstruiert werden, bevor mit der Bildaufnahme von Bodipy-Laminin begonnen wird (Abbildung 3B).- Verwenden Sie für die Beobachtung und Aufnahme von Bodipy-Bildern ein konfokales Mikroskop mit einem 40-fachen Öl-Tauchobjektiv mit einer numerischen Blende von 1,4.
- Verwenden Sie die folgenden Einstellungen: Pinhole bei 1 AE, 2.048 Pixel x 2.048 Pixel Auflösung, Pixelgröße bei 0,08 μm, unidirektionaler Modus, Scangeschwindigkeit bei 4 (~4 μs/Pixel), Zeilenmittelwert auf 4x eingestellt und digitaler Zoom auf 1 eingestellt.
- Um ein Übersprechen zwischen Bodipy-558/568 und Laminin-AF647 zu vermeiden, verwenden Sie den sequenziellen Scanmodus der konfokalen Software.
HINWEIS: Wenn der gewählte Farbstoff Bodipy-493/503 ist, ist simultanes konfokales Laserscanning ohne Übersprechen zwischen dem Bodipy-Kanal und dem Laminin-AF647-Kanal möglich. Dies beschleunigt die Aufnahme von Bildern. - Anregung von Bodipy-493/503 mit der 488-nm-Laserlinie oder Argon-Laserlinie und Anregung von Bodipy-555/568 mit der 561-nm-Diodenlaserlinie. Erkennen Sie schließlich Laminin-AF647 mit einer 640-nm-Diodenlaserlinie.
VORSICHT: Denken Sie daran, dass Bodipy-Moleküle sehr empfindlich auf Photobleichen reagieren, vermeiden Sie daher unnötiges Laserscannen. Um Fasern zu erkennen, verwenden Sie nur den Laser für Laminin. - Je nach gewähltem Farbstoff legen Sie die Emissionsbereiche auf 570-650 nm für Bodipy-493/503 24 und auf 565-620 nm für Bodipy-558/568 fest. Legen Sie den Emissionsbereich für Laminin auf 656-700 nm fest.
- Stellen Sie die Verstärkung und die digitale Verstärkung entsprechend ein, damit keine gesättigten Pixel auf der Bereichsanzeige erkannt werden. Korrigieren Sie das Hintergrundsignal, indem Sie den Versatz anpassen.
HINWEIS: Die Filterauswahl und andere oben genannte Scanning-Parameter müssen für jedes konfokale Mikroskop optimiert werden. Es ist wichtig, dass alle oben genannten Einstellungen konstant gehalten werden, damit alle aus Proben aufgenommenen Bilder verglichen werden können. - Um den Fasertyp unter den auf dem konfokalen Mikroskop visualisierten Fasern zu identifizieren, verwenden Sie einen persönlichen Laptop, auf dem das Bild des Abschnitts rekonstruiert wird, nachdem die Faserimmundetektion überprüft wurde (Abbildung 3B).
- Sobald eine Gruppe von Fasern korrekt identifiziert wurde, erfassen Sie das Bild mit den Bodipy- und Lamininkanälen.
HINWEIS: Es wird empfohlen, den Bodipy-Laminin-Bildnamen in der Region des Muskels zu notieren, in der sich diese Fasern auf dem für die MyHC-Erkennung aufgenommenen Bild befinden, um die spätere faserspezifische Analyse von LDs zu erleichtern.
6. Analyse von Bildern
- Analyse der Fasertypen an jeder Muskelprobe
- Öffnen Sie in Fidschi (oder ImageJ)32 die TIFF-, PNG- oder JPG-Datei mit dem rekonstruierten Muskel, der aus der Zusammenführung aller Kanäle gewonnen wurde, die zum Nachweis der Faserisoformen verwendet werden.
- Um das Cell Counting Tool zu starten, klicken Sie auf Plugins | | analysieren | des Zellzählers Zellzähler.
- Klicken Sie im Fenster Zellzähler auf Aktionen | Initialisieren.
- Wählen Sie im selben Fenster unter Leistungsindikatoren die Option Typ 1 aus.
- Wählen Sie im Hauptfenster von Fidschi das Zauberstab-Werkzeug aus.
- Um die Anzahl der Verbindungslinien jedes Typs zu quantifizieren, klicken Sie auf jede Verbindungslinie desselben Typs, damit das Programm die Anzahl der angeklickten Verbindungslinien aufzeichnet.
- Wenn Sie fertig sind, wählen Sie den nächsten Fasertyp aus und wiederholen Sie die gleichen Schritte.
- Wenn alle Verbindungslinien des Bildes einem bestimmten Verbindungslinientyp zugewiesen wurden, klicken Sie im Fenster Zellzähler auf Ergebnisse, um die Ergebnisse in einer Tabelle anzuzeigen.
- Speichern Sie diese Tabelle als Tabellentabelle, indem Sie auf Datei | klicken Speichern unter im Ergebnisfenster .
- Speichern und laden Sie die Auswahl jederzeit auf demselben Bild, indem Sie im Fenster Zellenzählung auf Markierungen speichern bzw. Lademarkierungen klicken.
- Analyse von Lipidtröpfchen faserabhängig
- Analysieren Sie die Bilder von Bodipy und Laminin, die auf dem konfokalen mit Fidschi für die Quantifizierung von LDs erhalten wurden.
HINWEIS: Die Autoren haben ein benutzerdefiniertes Makro entworfen, um die Analyse zu automatisieren. Dieses Makro ist zusammen mit einer Schritt-für-Schritt-Anleitung zur Verwendung als Ergänzungsdatei 1 bzw. Ergänzungsdatei 2 verfügbar. - Öffnen Sie jedes Bild mit Hilfe des Bio-Formats Importers aus Fidschi. Wählen Sie unter der Option Stapel anzeigen mit die Option Hyperstack | aus. Farbmodus, Standard. Stellen Sie sicher, dass das Fenster Automatische Skalierung ausgewählt ist.
HINWEIS: Die folgenden Schritte beschreiben das Protokoll für die Analyse einer Faser auf dem Bild, aber es muss so oft wiederholt werden, wie die Anzahl der gesamten Fasern auf dem Bild erscheint. - Verwenden Sie das Freihandauswahlwerkzeug , um das Sarkolemma der Faser basierend auf dem Lamininkanal manuell auszuwählen (Abbildung 4A), und drücken Sie T auf der Tastatur, um die Auswahl oder Region of Interest (ROI) im ROI-Fenster aufzuzeichnen.
- Gehen Sie zum Hauptfenster von Fidschi und klicken Sie auf | analysieren Legen Sie die Maße fest und wählen Sie im Popup-Fenster Fläche und Durchmesser von Feret aus. Lassen Sie die verbleibenden Kontrollkästchen deaktiviert und andere Parameter so, wie sie standardmäßig angezeigt werden.
- Klicken Sie im ROI-Fenster auf Messen, um die Fläche und den minimalen Feret-Durchmesser (MF) der ausgewählten Faser abzurufen und sie für die spätere Verwendung zu notieren.
HINWEIS: Bei der Analyse von LDs ist es wichtig zu berücksichtigen, dass ihre Größe und Dichte zwischen dem Zentrum und der Peripherie (subsarkolemmale Region-SS) der Faser variieren. Daher muss die Analyse separat durchgeführt werden. - Berechnen Sie den Wert von 1/6 des MF, um den zentralen Teil der Faser abzugrenzen.
HINWEIS: Im Makro ist der Standard-MF-Wert auf 6 festgelegt, was bedeutet, dass die angewendete Reduktion als 1/6 der MF festgelegt wird. Dieser Wert wurde auf der Grundlage der empirischen Daten aus dem Soleus von Tieren gewählt, die mit einer fettreichen Ernährung gefüttert wurden. Jeder Forscher muss diese Zahl jedoch basierend auf den empirischen Daten und dem analysierten Muskel, der Art der Faser und dem Tierzustand ändern. - Klicken Sie im ROI-Fenster auf Hinzufügen, um ein Duplikat des ersten ROI zu erhalten, und wählen Sie den zweiten ROI aus, der im Fenster angezeigt wird.
- Klicken Sie im Hauptfenster von Fidschi auf | bearbeiten Auswahl | Vergrößern und geben Sie den zuvor berechneten Wert (aus Schritt 6.2.6.) mit einem Minuszeichen vor der Zahl ein und klicken Sie auf OK. Klicken Sie im ROI-Fenster auf Add[t] (ein dritter ROI muss erscheinen) und Löschen, um den zweiten ROI zu löschen.
HINWEIS: Der Forscher kann die Ergebnisse überprüfen, indem er im ROI-Fenster auf das Feld Alle anzeigen klickt. An diesem Punkt müssen zwei ROIs angezeigt werden, einer, der den gesamten Umfang der Faser umgibt (Abbildung 4B) und ein anderer, der in der Mitte platziert ist (Abbildung 4C). - Wählen Sie beide ROIs im ROI-Fenster aus und klicken Sie auf Weitere | XOR-| Hinzufügen[t]. Warten Sie, bis ein dritter ROI angezeigt wird, der der Peripherie der Faser entspricht (Abbildung 4D).
- Speichern Sie die ROIs, indem Sie auf Weitere | klicken Speichern Sie , um die ROIs zu sparen, falls eine spätere erneute Analyse der gleichen Fasern erforderlich ist.
- Wählen Sie den Bodipy-Kanal aus und öffnen Sie das Schwellenwert-Tool , indem Sie auf Image | klicken | anpassen Schwelle am Hauptfenster von Fidschi.
- Stellen Sie im Popup-Fenster Schwellenwert die Werte auf 70/255 ein und wählen Sie Yen | B & W-Methode, und klicken Sie auf Dark Hintergrund | Bewerben Sie sich.
HINWEIS: Die auf den Schwellenwert angewendeten Werte können je nach den Bedingungen des Experiments variieren, und der Schwellenwert muss entsprechend eingestellt werden , um die Analyse zu optimieren. Ein Schwarz-Weiß-Fenster mit dem Bodipy-Signal oberhalb der in Weiß dargestellten Schwelle und der Hintergrund in Schwarz muss angezeigt werden (vergleichen Sie das ursprüngliche Bodipy-Bild in Abbildung 4E mit dem in Abbildung 4F). - Gehen Sie zum Hauptfenster von Fidschi und klicken Sie auf | analysieren Legen Sie Messungen fest, und wählen Sie im Popupfenster Fläche, Flächenanteil und Auf Schwellenwert begrenzen aus. Lassen Sie die verbleibenden Kontrollkästchen deaktiviert und andere Parameter so, wie sie standardmäßig angezeigt werden.
HINWEIS: Wenn der Forscher die "Zirkularität" von LDs analysieren möchte, bei der es sich um einen Index der sphärischen Morphologie handelt, der von 1 für eine perfekte Kugel bis 0 für eine Linie reicht, klicken Sie im Popup-Fenster Maße festlegen auf das Feld Formdeskriptoren. - Gehen Sie zum ROI-Fenster und wählen Sie den ersten ROI aus. Klicken Sie im Hauptfenster von Fidschi auf | analysieren Werkzeug "Partikel analysieren".
HINWEIS: Dieses Tool quantifiziert die Anzahl, Größe, abgedeckte Fläche und den Prozentsatz der gesamten Fläche, die bei jeder Auswahl von Partikeln bedeckt ist, und speichert die Ergebnisse als Tabellenkalkulationsdatei. - Legen Sie die Werte im Fenster Partikel analysieren von 2 auf Unendlich (2-Unendlich) fest, aktivieren Sie das Kontrollkästchen Pixel, behalten Sie die Standardkreiswerte bei, wählen Sie Zusammenfassen und klicken Sie auf OK.
HINWEIS: Um die Ergebnisse auf der Verbindungslinie zu überprüfen, wählen Sie unter der Option Anzeigen eine der verfügbaren Optionen aus. Damit die Informationen jeder LD in der Auswahl in einer Tabelle erkannt werden, aktivieren Sie die Option Ergebnisse anzeigen im Fenster Partikel analysieren . Die Ergebnisse der Analyse der Gesamtfläche der Faser werden gemittelt und in einer Tabelle mit mehreren Spalten zusammengefasst (Anzahl, Gesamtfläche, Durchschnittsgröße, % Fläche; diese entsprechen der Anzahl der Partikel [LDs], der von diesen Partikeln besetzten Fläche, ihrer durchschnittlichen Größe und dem Prozentsatz der Gesamtfläche der Selektion, die von Partikeln besetzt wird. b. Um die Dichte zu berechnen, dividieren Sie die Anzahl der Partikel durch die Gesamtfläche jeder Auswahl. - Um die Werte des Mittelpunkts und der Peripherie der Verbindungslinie zu erhalten, wiederholen Sie die Schritte 6.2.14 und 6.2.15, wobei Sie jedes Mal den zweiten (Mitte) und den dritten ROI (Peripherie) auswählen.
- Speichern Sie die Ergebnisse, indem Sie auf Datei | klicken Speichern unter im Fenster Zusammenfassung .
HINWEIS: Geben Sie den Typ der Verbindungslinie, die Bedingung und den Bildnamen in den zugewiesenen Namen der Ergebnisse ein, um eine spätere Vereinheitlichung und statistische Analyse der Daten zu erleichtern. Um den Rest der Verbindungslinien im selben Bild zu analysieren, wiederholen Sie die Schritte 6.2.3 bis 6.2.17. Für die statistische Analyse müssen mindestens 10-15 Fasern jedes Typs pro Tier analysiert werden.
- Analysieren Sie die Bilder von Bodipy und Laminin, die auf dem konfokalen mit Fidschi für die Quantifizierung von LDs erhalten wurden.
Ergebnisse
Das hierin beschriebene Protokoll bietet eine effiziente Methode zur einfachen Quantifizierung von LDs in einer faserartigen und subzellularspezifischen Weise. Es zeigt, wie durch das Einfrieren von zwei Muskeln ähnlicher Größe, wie dem EDL und dem Soleus, die Zeit und die Ressourcen, die für die folgenden Schritte aufgewendet werden, um die Hälfte reduziert werden.
Es wird ein vollständiges Protokoll für die Immunfärbung, Bildaufnahme und Analyse der verschiedenen MyHC-Isoformen bereitgestellt, die in erwachsenen Mausmuskeln exprimiert werden. Dieses Protokoll basiert auf dem Protokoll, das erstmals 1989 von Schiaffino et al. 3 3 entworfen wurde, mit einigen Anpassungen wie der Verwendung eines zusätzlichen Antikörpers zur Kennzeichnung vonLaminin. Diese spätere Modifikation ist entscheidend für die Lage von Typ-IIb-Fasern, die schwarz sind, da sie nicht mit Antikörpern angefärbt sind. Wie in Abbildung 5 gezeigt, ermöglicht dieses immunhistochemische Protokoll nicht nur die Erkennung von langsam-oxidativen (Typ I und IIa) und schnell-glykolytischen (Typ IIx und IIb) Fasern der Maus, sondern auch das Vorhandensein von Hybridfasern (siehe Sternchen in Abbildung 5D). Darüber hinaus ermöglichen die Querschnitte beider Muskeln auf demselben Objektträger den Vergleich der Proportionen jedes Fasertyps zwischen den beiden ausgewählten Muskeln, wodurch sichergestellt wird, dass die experimentellen Bedingungen auf beiden Abschnitten identisch waren.
Für die LD-Kennzeichnung basieren die hier vorgestellten Ergebnisse auf der Verwendung von Bodipy-558/568 C12 als Lipidfarbstoff; Der Leser wird jedoch auf ein ausgezeichnetes Protokollpapier verwiesen, in dem die Verwendung des klassischen Farbstoffs Bodipy-493/503 bei Muskelabschnitten23 beschrieben wird. Das vorgestellte Protokoll kombinierte die Färbung von LDs auf der Grundlage der Immunhistochemie gegen α2-Laminin, um das Fasersarkolemma zu unterscheiden. Wie beim Fasertyp-Experiment ist dieser Schritt nicht nur für die Erkennung einzelner Fasern, sondern auch für die anschließende Analyse von Lipiden sowohl im zentralen als auch im peripheren Bereich von Fasern unerlässlich (Abbildung 4). Einer der kritischen Schritte dieses Protokolls ist die Identifizierung und Markierung derselben Fasern auf den beiden Objektträgern. Wie bereits erläutert, ist es wichtig, das Dia mit Fasertypen zu scannen und die Rekonstruktion von Muskelquerschnitten mit den zusammengeführten Farben vor der Aufnahme von Bildern für LDs zu haben (Abbildung 3B). Bemerkenswerte Strukturen jedes Muskelabschnitts, wie Axonzweige oder Muskelspindeln, sind gute Landmarken, die dem Forscher helfen könnten, die gleichen Fasern auf beiden Objektträgern zu lokalisieren (Abbildung 6). Denken Sie daran, dass, da der Objektträger auf den meisten konfokalen Mikroskopen verkehrt herum platziert wird, empfohlen wird, das vom Fasertyp rekonstruierte Bild auf dem PC umzukehren, um die Ortungsaufgabe zu erleichtern.
Die für die Erfassung der Bodipy-Laminin-Färbung durch konfokale Mikroskopie beschriebenen Einstellungen ermöglichen die Visualisierung und spätere Analyse der Größe, Anzahl und Verteilung von LDs von drei bis sechs Fasern gleichzeitig (Abbildung 6 und Abbildung 7). Ein detailliertes Schritt-für-Schritt-Protokoll zur Analyse von LDs mit der Bildanalysesoftware Fidschi wird hier ebenfalls bereitgestellt. Wie im Protokoll gezeigt, ist die vollständige Analyse jeder der auf einem Bild vorhandenen Fasern lang und mühsam. Fidschi hat jedoch den Vorteil, dass es das Design von benutzerdefinierten Programmen, sogenannten Makros, ermöglicht, die auf der Java-Sprache basieren. Die Autoren entwarfen ein Makro, das die Automatisierung der oben beschriebenen Reihe einzelner Befehle ermöglicht, die automatisch in einer Schleife ausgeführt wird, um in wenigen Minuten zu analysieren - nicht nur jede der auf einem Bild vorhandenen Fasern, sondern auch eine große Anzahl von Bildern. Der einzige Input des Forschers ist die manuelle Auswahl des Umfangs der Faser, die jedes Mal analysiert werden soll, die Auswahl des Fasertyps und die visuelle Inspektion des resultierenden Bildes nach Anwendung des Schwellenwerts und Quantifizierung der Partikel.
Hier wird die standortabhängige Analyse von LDs umgesetzt. Durch vorherige Messung der Fläche und des MF-Durchmessers der Faser wird eine größenabhängige (nicht fixierte, wie in Strauss et al.25 beschrieben) Reduktion angewendet, um die zentralen und die peripheren Bereiche jeder Faser zu erhalten (Abbildung 4 und Abbildung 7). Wie in den Histogrammen von Abbildung 7 zu sehen ist, ermöglicht diese Methode die Quantifizierung von drei wichtigen Parametern: dem Prozentsatz der von LDs besetzten Faserfläche (Abbildung 7E), der Dichte der LDs - der Anzahl der LDs pro μm2 (Abbildung 7F) und der durchschnittlichen Größe der LDs (Abbildung 7G). Infolgedessen stellen Fasern bei 3 Monate alten Mäusen (N = 5), Typ IIa (grüner Umriss) und Typ IIx (roter Umriss) den größten Anteil der von LDs in der Peripherie besetzten Fläche dar (Abbildung 7E). In Bezug auf die Dichte von Partikeln zeigen EDL-Fasern unabhängig von der subzellulären Position immer eine höhere Dichte als Soleusfasern (Abbildung 7F). Schließlich ist die durchschnittliche Größe dieser LDs in der Peripherie immer größer als in der Mitte (Abbildung 7G).
Die verschiedenen Methoden, die von anderen Gruppen zur Beurteilung der Ansammlung von LDs in der Nagetierskelettmuskulatur34,35 verwendet werden, machen es schwierig, diese Ergebnisse mit denen früherer Studien zu vergleichen. In Übereinstimmung mit den Ergebnissen von Komiya et al.34 ist der Prozentsatz der von LDs besetzten Faserfläche bei Soleus-Typ-IIa- und EDL-Typ-IIx-Fasern jedoch höher. Am wichtigsten ist, dass Typ-IIb-Fasern den niedrigsten Prozentsatz der von LDs besetzten Fläche aufwiesen (Abbildung 7E, graue Histogramme). Da der Fasertyp IIb der vorherrschende Fasertyp der EDL ist (75%, Abbildung 5E), bestätigen diese Ergebnisse, was andere Gruppen zuvor beschrieben haben: Die Gesamtakkumulation von Lipiden ist in EDL niedriger als im Soleus34,35.
Im Gegensatz zu dem, was beim Menschen25 beschrieben wurde, und auch in Übereinstimmung mit den Ergebnissen von Komiya et al.34, zeigen die hier vorgestellten Ergebnisse, dass die Akkumulation von LDs in Soleus-Typ-I-Fasern relativ gering ist. Dies könnte durch faserartige Interspeziesunterschiede zwischen Mäusen und Menschenerklärt werden 36, da die metabolischen Eigenschaften von Fasern des menschlichen Typs I denen von Nagetieren Typ IIa und IIx ähnlicher sind, während die von Fasern des menschlichen Typs IIx dem NagetiertypIIb 37 nahe kommen. Zusammenfassend lässt sich sagen, dass die verschiedenen hier beschriebenen Techniken eine reproduzierbare, zuverlässige und zeiteffiziente Methode bieten, um mehrere Parameter im Zusammenhang mit LDs und ihrer Verteilung innerhalb der Zelle in einer fasertypabhängigen Weise zu untersuchen und zu vergleichen.
Suboptimale Experimente
Wenn der Gefriervorgang nicht korrekt durchgeführt wird und Isopentan nicht die richtige Temperatur hat, bilden sich Eiskristalle in den Fasern (Abbildung 8A). Diese gefrierenden Artefakte sind erst nach der histologischen Vorbereitung der Probe nachweisbar und können als Löcher in den Fasern erkannt werden. Für eine ordnungsgemäße Quantifizierung von LDs müssen diese Artefakte vermieden werden. Es wurde gezeigt, dass das Auftauen und Wiedereinfrieren des Muskelblocks diese Artefakte signifikant reduzierenkann 29.
Ein weiteres Problem tritt auf, wenn Fasern nicht senkrecht zur Längsachse geschnitten werden (Abbildung 8B). Die LD-Quantifizierung und der Vergleich zwischen Fasern, Muskeln oder Tieren können nicht durchgeführt werden, wenn die Abschnitte nicht quer sind. Aus diesem Grund ist es wichtig, die Muskeln vor dem Einfrieren mit Hilfe eines Stereomikroskops richtig auf den Korken zu legen und ein Hellfeldmikroskop in der Nähe des Kryostaten zu haben. Letzteres ermöglicht es dem Forscher, die korrekte Ausrichtung der Probe auf dem Kryostaten zu finden.
In einigen seltenen Fällen ist die Markierung von MyHC-Isoformen auf einem oder mehreren Fasertypen sehr schwach (Abbildung 8C). In diesem Fall ist die Analyse der LDs unvollständig. In diesem Fall muss das Experiment wiederholt werden, beginnend mit dem Schneiden der Muskeln. Schließlich könnte sich Bodipy in der Peripherie des Muskelquerschnitts ansammeln (Abbildung 8D). Wenn dies geschieht, ist die Färbung auf diesen Fasern sehr stark, was zu einem künstlichen Ergebnis führt. Vermeiden Sie die Aufnahme von Bildern aus diesen Fasern.

Abbildung 2: Vorbereitung der Proben für das Einfrieren und Kryosektionieren. (A-D) Maus-Soleus- und EDL-Muskeln werden seziert und auf einen Korken gelegt, der von einem starren Kunststoff mit einem Tropfen OCT gehalten wird. (E-G) Ein Edelstahlbecher wird mit Isopentan gefüllt und in flüssigem Stickstoff auf seine Schmelztemperatur abgekühlt. (H,I) Der Becher mit dem kalten Isopentan wird aus dem flüssigen Stickstoff entnommen, und die Probe wird bis zum Boden des Bechers eingetaucht und 15 s lang gewirbelt. (J-L) Der Korken mit den Proben wird ohne Kunststoffstütze auf die Kryostatenhalterscheibe gelegt, und serielle Querschnitte von 10 μm werden direkt auf Haftobjektträgern montiert. Zwei benachbarte serielle Querschnitte werden sofort für die Färbung von LDs und die Detektion von MyHCs verarbeitet. Abkürzungen: LDs = Lipidtröpfchen; EDL = Extensor digitorum longus; MyHCs = Myosin-Schwerkettenisoformen; OCT = optimale Schnitttemperatur. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
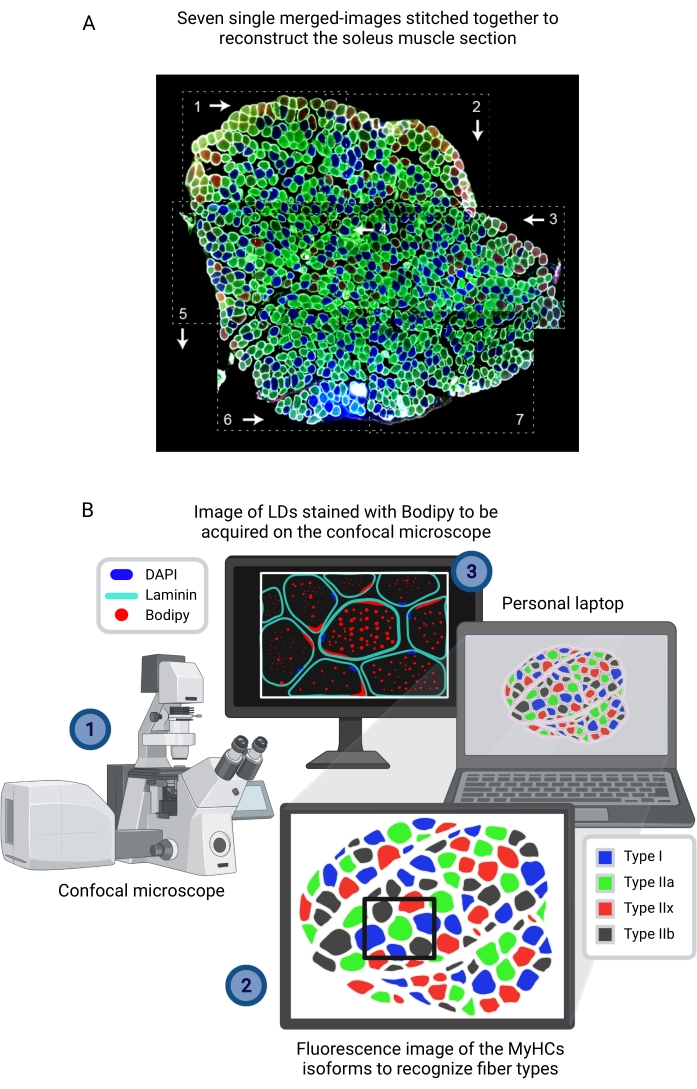
Abbildung 3: Bodipy-Bildaufnahme nach Identifizierung des Fasertyps aus dem rekonstruierten zusammengesetzten Bild, das auf einem anderen Computer aufgenommen wurde. (A) Rekonstruktion des gesamten Soleus-Abschnitts, der für den Fasertyp (MyHCs) immunmarkiert ist, aus sieben unabhängigen zusammengeführten Bildern (gestrichelte Rechtecke), die mit Bildverarbeitungssoftware zusammengefügt wurden. Die weißen Pfeile und die Zahlen stellen die Reihenfolge dar, die bei der Bilderfassung mit einem herkömmlichen Epifluoreszenzmikroskop befolgt wurde. (B) Für die Bodipy-Bildaufnahme (1) wird ein Feld, das den mit Laminin-AF647 und Bodipy-555/568 immungefärbten Muskelabschnitt enthält, auf dem Bildschirm eines an das konfokale Mikroskop angeschlossenen Computers visualisiert. (2) Diese Fasern befinden sich auf dem rekonstruierten Bild des Muskelabschnitts, der immungefärbt ist, um die Art der Fasern (MyHCs) zu erkennen. (3) Das Bild wird mit einem konfokalen Mikroskop aufgenommen. Abkürzungen: LDs = Lipidtröpfchen; DAPI = 4',6-Diamidino-2-phenylindol; MyHCs = Myosin-Schwerkettenisoformen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
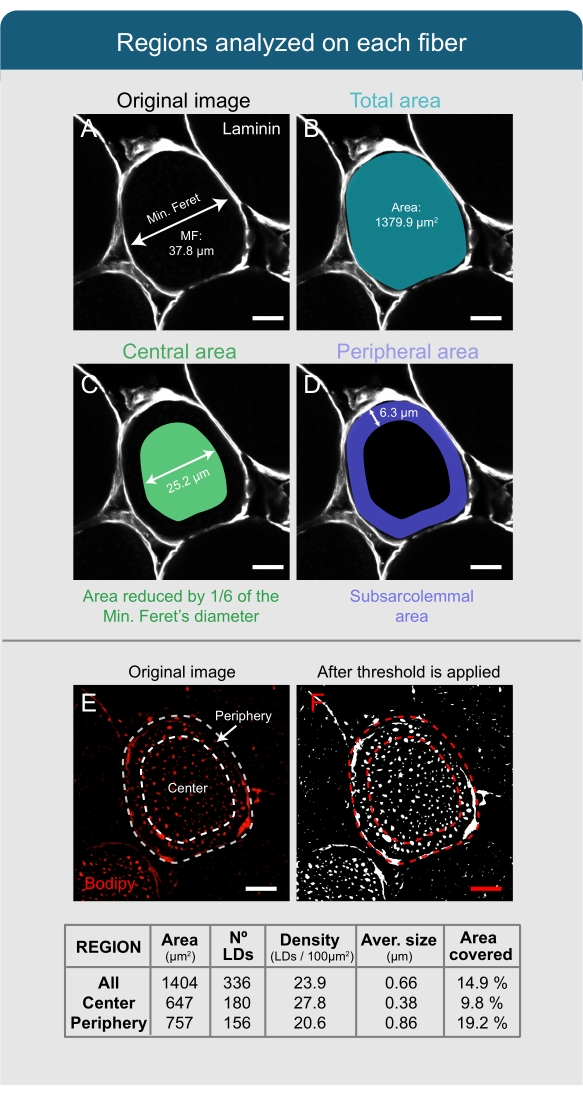
Abbildung 4: Analyse von Lipidtröpfchen mit Fidschi. (A,B) Das Sarkolemma der Faser wird anhand des Lamininbildes erkannt und als ROI ausgewählt. Gesamtfläche und MF werden gemessen. (C) Um den zentralen Teil der Faser zu erkennen, wird die Auswahl um 1/6 des Wertes der MF reduziert. (D) Der Bereich zwischen der zentralen und der Gesamtselektion wird als Peripherie oder subsarkolemmale Fläche festgelegt. (E) Für die Analyse von LDs, die mit Bodipy gefärbt sind, wird ein Schwellenwert angewendet, (F) und das Werkzeug Partikel analysieren wird verwendet, um verschiedene Parameter in Bezug auf die LDs zu quantifizieren (siehe Tabelle). Diese Werte werden für die gesamte Faser (All), für den zentralen Teil (Mitte) und für den subsarkolemmalen Bereich (Peripherie) unabhängig voneinander erhalten. Maßstabsstäbe = 12 μm. Abkürzungen: LDs = Lipidtröpfchen; ROI = Region des Interesses; MF = Minimaler Feret-Durchmesser. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
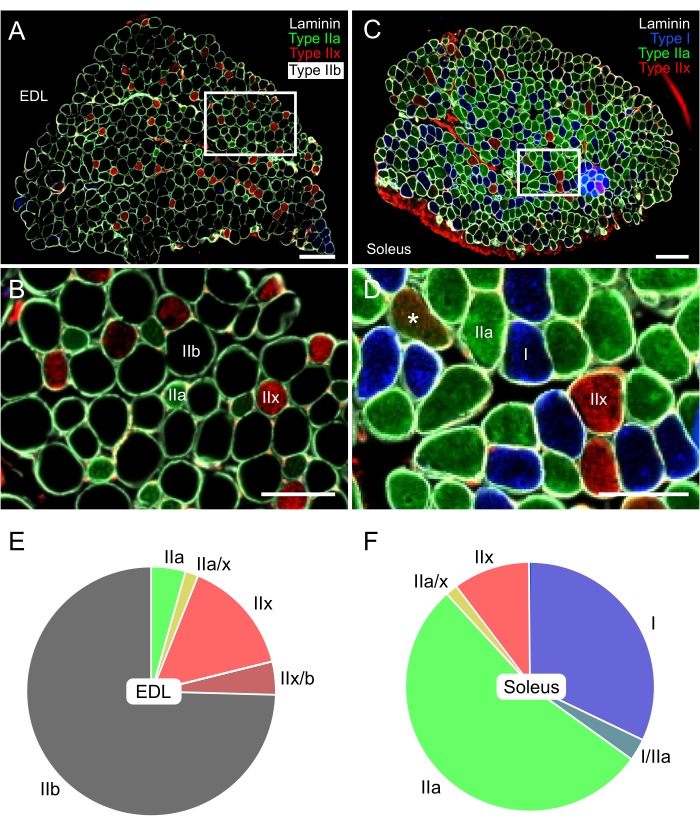
Abbildung 5: Repräsentative Immunfärbung von Fasertypen im EDL (glykolytischen) und soleus (oxidativen) Mausmuskel. Zusammengeführte Fluoreszenzbilder von EDL (A,B) und Soleus (C,D), aufgenommen mit einem digitalen, Objektträger-Fluoreszenzmikroskop. Es wurden Antikörper gegen Typ I (blau-AF405), Typ IIa (grün-AF488), Typ IIx (rot-AF568) und Laminin (weiß-AF647) verwendet. Schwarze Fasern entsprechen dem Fasertyp IIb. B und D zeigen Details der Fasern in den weißen Rechtecken der Paneele A bzw. C. Das Sternchen (*) in Panel D zeigt eine IIa/IIx-Hybridfaser. (E,F) Repräsentative Quantifizierung der Fasertypverteilung in EDL und Soleus von 3 Monate alten Mäusen (N = 5). EDL bestand hauptsächlich aus Typ-IIb-, dann IIx- und IIa-Fasern (~ 75%, 15% bzw. 5%). Im Gegensatz dazu bestand Soleus hauptsächlich aus Typ-IIa- (>50%) und Typ-I-Fasern (30%). Die Anteile von Typ-IIx-Fasern waren in beiden Muskeln ziemlich ähnlich, während die von Hybridfasern sehr niedrig waren. Skalenbalken = 200 μm (A,C), 100 μm (B,D). Abkürzung: EDL = Extensor digitorum longus. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
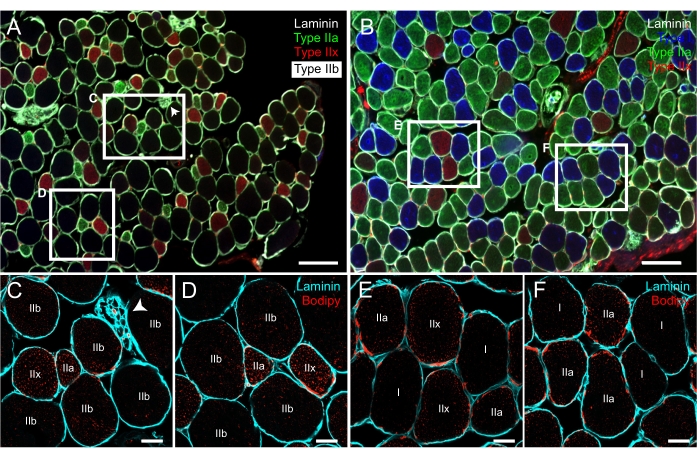
Abbildung 6: Repräsentative Färbung von LDs mit Bodipy auf seriellen Querschnitten, die zuvor für MyHC-Isoformen immunmarkiert waren. Fluoreszenzzusammengeführte Bilder von Maus EDL (A) und Soleus (B), die mit einem Epifluoreszenzmikroskop aufgenommen wurden und Typ I (blau), IIa (grün), IIx (rot), IIb (schwarz) Fasern und Laminin (weißes Signal, das die Fasern umgibt) zeigen. (C-F) Konfokale Fluoreszenzbilder aus dem EDL (C,D) und dem Soleus (E,F), die mit Laminin (Cyan) und Bodipy (rot) co-markiert sind. Beachten Sie, dass die in C-F gezeigten Fasern die gleichen sind wie die in den weißen Rechtecken auf den Feldern A und B. In der rechten Ecke des weißen Rechtecks in A ist ein Axonzweig zu unterscheiden (weiße Pfeilspitze). Maßstabsstäbe = 200 μm (A,B), 20 μm (C-F). Abkürzungen: LDs = Lipidtröpfchen; EDL = Extensor digitorum longus; MyHCs = Myosin-Schwerkettenisoformen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 7: Quantifizierung von LDs in fasertyp- und subzellspezifischer Weise. Repräsentative konfokale Fluoreszenzbilder von Typ I und Typ IIa Fasern aus Soleus (A,B) und Typ IIx und Typ IIb Fasern aus EDL (C,D), erhalten nach Co-Markierung mit Bodipy (rot) und α2-Laminin (nicht gezeigt). LD-Gehalt (% der von Bodipy besetzten Fläche und Dichte) und Morphologie (Größe) wurden subzellspezifisch analysiert. Der Faserumfang wurde durch Lamininflecken definiert und die zentralen oder peripheren Bereiche wurden basierend auf dem MF-Durchmesser festgelegt. Prozentsatz der von Bodipy (LDs) (E) besetzten Faserfläche, LD-Dichte (Anzahl/μm2) (F) oder durchschnittliche LD-Größe (G) in zentralen oder peripheren Regionen für jeden Fasertyp. Die Ergebnisse werden als Mittelwert ± REM dargestellt. Maßstabsbalken = 10 μm. Abkürzungen: LDs = Lipidtröpfchen; EDL = Extensor digitorum longus; C = zentral; P = peripher. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
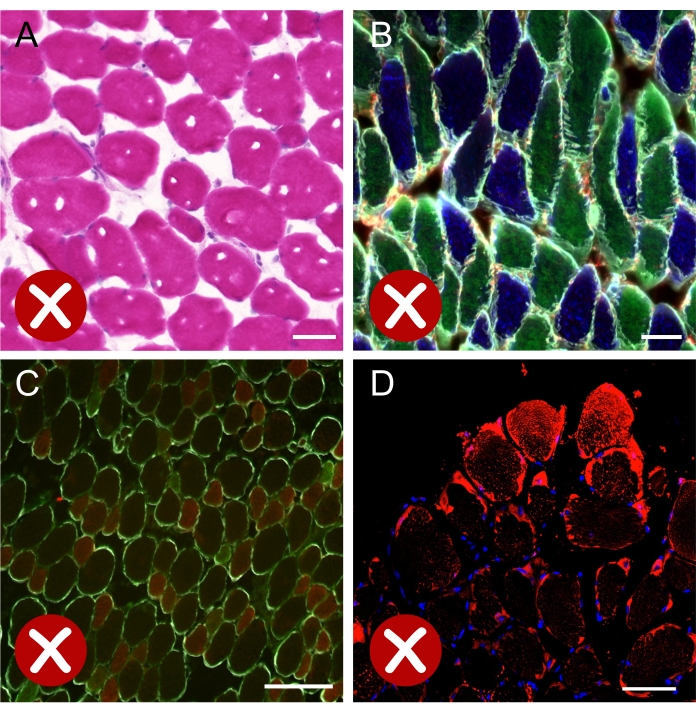
Abbildung 8: Bilder, die suboptimalen Ergebnissen entsprechen . (A) Hellfeldbild des Muskelquerschnitts, der auf Hämatoxylin-Eosin gefärbt ist und Eiskristalle zeigt, die während des Gefrierprozesses gebildet wurden. (B) Fluoreszenz-zusammengeführtes Bild eines Soleus-Abschnitts, der für MyHCs und Laminin immungefärbt ist und zeigt, dass die Mehrheit der Fasern entlang der Längsachse geschnitten ist. (C) Fluoreszenzbild eines auf MyHCs und Laminin immungefärbten EDL-Abschnitts. Die schwache Färbung der Faser Typ IIa (grün) behindert die korrekte Quantifizierung jedes Fasertyps. (D) Konfokales Bild, das eine starke artefaktische Färbung von Bodipy (rot) auf Fasern zeigt, die sich an der Peripherie des Muskelquerschnitts befinden. Maßstabsstäbe = 50 μm (A,B), 200 μm (C,D). Abkürzungen: EDL = Extensor digitorum longus; MyHCs = Myosin-Schwerkettenisoformen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Zusatzfigur S1: LD-Färbung mit Oil Red O auf Muskelquerschnitten. (A,B) Konfokale Bilder, die das Muster der Färbung zeigen, das mit Oil Red O im Soleus bzw. EDL erhalten wurde. Das für diese Färbung verwendete Protokoll wird von Prats et al.24 ausführlich beschrieben. Beachten Sie, dass die Akkumulation von LDs in der subsarkolämischen Region der Myofasern höher ist, wie zuvor für Bodipy beschrieben. Maßstabsstäbe = 20 μm. Abkürzungen: LD = Lipidtröpfchen; EDL = Extensor digitorum longus. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Figur S2: Co-Färbung von LDs und Mitochondrien im Musculus soleus. (A) Konfokales zusammengeführtes Bild, das die Immunmarkierung von Tomm20 zeigt, einem Protein, das auf der mitochondrialen Membran (grün), DAPI (blau) und Bodipy-558/568 markierten LDs (rot) vorhanden ist. Der Einschub in A zeigt mehrere Mitochondrien (grün), die an LDs gebunden sind (rot). Dieses Bild wurde durch Anwendung der konfokalen hochauflösenden Airyscan-Mikroskopie erhalten. (B,C) Entsprechende Einkanalbilder von LDs bzw. Mitochondrien. Maßstabsstäbe = 10 μm (A-C), 5 μm (A, Einschub). Abkürzungen: LDs = Lipidtröpfchen; DAPI = 4',6-Diamidino-2-phenylindol. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Datei 1: Fidschi-Makro zur automatisierten Analyse von LDs auf mehreren Laminin+Bodipy-Bildern. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Datei 2: Schritt-für-Schritt-Erklärung für die Arbeit mit dem Makro Bodipy_JoVE.ijm. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Das hier beschriebene Protokoll beschreibt eine effiziente Methode zur Quantifizierung von LDs, die mit Bodipy auf einer faser- und subzellularspezifischen Basis markiert sind. In den letzten Jahren wurden klassische Lipidfarbstoffe wie ORO oder Sudan Black B durch eine neue Reihe von zelldurchlässigen, lipophilen, fluoreszierenden Farbstoffen ersetzt, die an neutrale Lipide binden (z. B. Bodipy). Bodipy ist als verschiedene Konjugate erhältlich und hat sich als sehr effektiv bei der Markierung von LDs erwiesen, um ihre Morphologie, Dynamik und Interaktion mit anderen Organellen zu untersuchen, nicht nur in verschiedenen fixierten Geweben und Zellen 23,38,39,40, sondern auch in lebenden Zellen 41,42.
Innerhalb des Protokolls gibt es mehrere kritische Aspekte, die der Forscher berücksichtigen muss, um optimale Ergebnisse zu erzielen. Es ist wichtig, die gewählten Muskeln richtig auf dem Korken zu platzieren, um eine perfekte Ausrichtung und Orientierung der Muskelmyofasern zu gewährleisten, da nach dem Einfrieren nur geringfügige Nachjustierungen des Halters am Kryostaten vorgenommen werden können. Darüber hinaus ist es wichtig, das Immunfärbungsprotokoll unmittelbar nach dem Schneiden der Abschnitte zu beginnen, da lufttrocknende Kryoabschnitte (nur für 15 min) schwerwiegende nachteilige Auswirkungen auf LDs haben, was zu einer Abnahme der LD-Dichte um 66% und einer Abnahme der durchschnittlichen Größe um 37%führt 24. Ebenso hätte das Einfrieren und Auftauen der Objektträger nachteilige Auswirkungen und wird daher nicht empfohlen. Ein drittes wichtiges Merkmal dieses Protokolls bezieht sich auf die Fixierung von Proben. Für die Identifizierung der verschiedenen MyHC-Isoformen mit den hier zitierten Antikörpern muss eine Gewebefixierung vermieden werden, da sie die Bindung der ausgewählten Antikörper an ihre Epitope stört. Wenn die Muskelproben zuvor fixiert wurden, wird der Leser auf eine kürzlich veröffentlichte Arbeit mit verschiedenen Antikörpern43 verwiesen. Für die Kennzeichnung und Quantifizierung von LDs wird nur PFA ohne Methanol empfohlen, da die Verwendung von Methanol oder Aceton die Morphologie von LDs23,44 stört. Darüber hinaus ist ein Permeabilisierungsschritt für die Quantifizierung von LDs auf mit Laminin immunmarkierten Objektträgern nicht erforderlich. Da einige Gruppen gezeigt haben, dass die Permeabilisierung mit Reinigungsmitteln wie TritonX-100, Saponin oder Glycin die Größe oder Anzahl der LDs44,45 reduzieren kann, wird von der Permeabilisierung dringend abgeraten. Schließlich ist die Feinabstimmung der konfokalen Mikroskopeinstellungen entscheidend, um nur die neutralen Lipide zu erkennen, die in LDs vorhanden sind, und nicht die in Membranen anderer Organellen24.
Hier wurde Bodipy-558/568 C 12 als LD-Marker verwendet. Der am häufigsten verwendete Bodipy zur Markierung von LDs und zur Untersuchung ihrer Morphologie und Lage innerhalb der Myofasern der Skelettmuskulatur ist jedoch Bodipy-493/503. Beide Farbstoffe ähneln sich in ihrer Inkubationszeit, Arbeitskonzentration und ihren engen Emissionsspektren, obwohl ihre Anregungs- und Emissionsbereiche leicht unterschiedlich sind. Für ein vollständiges Protokoll über die Verwendung von Bodipy-493/503 wird der Leser auf die Arbeit von Listenberger und Brown46 oder Spangenburg et al.23 v.a. verwiesen. Bodipy-558/568 C12 wurde zur Färbung von LDs in anderen Geweben wie Fettgewebe 47, degenerierender Netzhaut48, fibrotischen Nieren49 oder Fibroblasten50 verwendet. Dieser Bodipy ergibt eine ähnliche Färbung wie die mit ORO erhaltene (siehe Ergänzende Abbildung S1), jedoch mit wesentlich geringerem technischem Aufwand und größerer Spezifität24,51. Darüber hinaus hat Bodipy-558/568 C 12 den Vorteil, dass es die Quantifizierung von LDs in Kombination mit dem Nachweis von Proteinen oder Organellen ermöglicht, die mit einem Green-Spectrum-Sekundärantikörper (siehe Supplemental Figure S2 und Yan et al.49) oder mit GFP-gentechnisch veränderten Modellen52 markiert sind. Diese beiden Anwendungen sind sehr leistungsfähige Werkzeuge, um die Dynamik und Wechselwirkungen von LDs mit anderen Zellorganellen und Proteinen zu entschlüsseln. Wenn jedoch keine Komarkierung von Proteinen innerhalb der Zellen beabsichtigt ist, empfehlen die Autoren die Verwendung des am besten charakterisierten LD-Farbstoffs Bodipy-493/503.
Eine der Einschränkungen dieses Protokolls bezieht sich auf die Aufnahme von Bildern und die Quantifizierung morphologischer LD-Merkmale. Technologische Fortschritte in der konfokalen Laser-Scanning-Mikroskopie haben die ebene Auflösung im Vergleich zu Weitfeldmikroskopen erheblich verbessert und ermöglichen die 3D-Rekonstruktion von Objekten beim Scannen der Probe in der Z-Ebene. Dies war sehr nützlich für die Untersuchung der LD-Morphologie24 und der Interaktion mit anderen Proteinen in skelettalen Myofasern 38,53, hat aber die Bildaufnahme- und Verarbeitungszeit erhöht, da jedes3D-rekonstruierte Bild aus mehreren unabhängigen 2D-Bildern besteht. Im obigen Protokoll wurden konfokale Bilder mit einem 40-fachen Objektiv und nur in 2D aufgenommen. Diese Methode ermöglicht die Aufnahme von drei bis sechs Myofasern pro Bild anstelle von nur einer, wie es bei der Verwendung eines 63x-Objektivs der Fall wäre. Dies führt zu einer geringeren Auflösung und einer Gesamtschätzung der LD-Größe und -Morphologie, die nicht vollständig genau ist. Dennoch erlaubt es die Analyse einer größeren Anzahl von Fasern pro Probe, was auch eine wichtige Tatsache ist, die insbesondere in Tierversuchen, in denen eine hohe Anzahl von Muskeln und Zuständen verglichen werden muss, zu berücksichtigen ist.
Hier wird gezeigt, dass durch das Einfrieren von zwei Muskeln ähnlicher Größe, die nebeneinanderliegen 34, die Verarbeitungszeit der Proben erheblich verkürzt und mögliche künstliche Unterschiede, die sich aus ihrer unabhängigen Verarbeitung ergeben, reduziert werden. Darüber hinaus berücksichtigt diese Methode zur Analyse von LDs die Unterschiede zwischen der subzellulären Verteilung von LDs innerhalb und zwischen den Fasertypen54. Die Auswahl des Umfangs der Myofaser und die Reduzierung dieser Auswahl in Bezug auf den minimalen Feret-Durchmesser der Faser erleichtert die unabhängige Untersuchung der Größe und Dichte von zentralen und peripheren (subsarkolemmalen) LDs. Die Anwendung dieser Methode ist äußerst wichtig, da gezeigt wurde, dass die subsarkolemmale Akkumulation von LDs direkt zur Insulinresistenz beiträgt. Während einige Berichte bei Menschen LDs faser- und ortsabhängiguntersucht haben 11,16,25, ist dies unseres Wissens das erste Mal, dass diese Methode auf Muskeln von Nagetieren angewendet wurde. Darüber hinaus reduzierte und vereinfachte die Quantifizierung von LDs mit Hilfe eines selbst entwickelten Makros für Fidschi die Bildanalysezeit erheblich. Sowohl das Makro als auch eine Schritt-für-Schritt-Anleitung zu seiner Verwendung sind als Supplemental File 1 bzw. Supplemental File 2 verfügbar.
Insgesamt sind die Autoren der Ansicht, dass das hier beschriebene Protokoll ein nützliches Werkzeug für andere Forscher sein könnte, die den Fettstoffwechsel in der Skelettmuskulatur untersuchen. Die erklärten Techniken können auf verschiedene Muskeln und unter unterschiedlichen Bedingungen angewendet werden (gefastet / überfüttert, trainiert / sesshaft, jung / gealtert, schlank / fettleibig) und werden hoffentlich dazu beitragen, die Dynamik von LDs, die Bedeutung ihrer Interaktionen mit anderen Komponenten der Zelle, wie Lipide in glykolytischen und oxidativen Fasern gespeichert und metabolisiert werden, und ihre Rolle beim Auftreten einer Insulinresistenz bei Typ-2-Diabetes besser zu verstehen.
Offenlegungen
Die Autoren haben keine Interessenkonflikte zu erklären.
Danksagungen
Diese Arbeit wurde durch Zuschüsse des Fonds National de la Recherche Scientifique (FNRS-Crédit de Recherche J.0022.20) und der Société Francophone du Diabète (SFD-Roche Diabetes Care) unterstützt.C.M.S. erhält ein Ph.D.-Stipendium der FRIA (FNRS). M.A.D.-L.d.C. erhielt ein Stipendium des Wallonie-Bruxelles International Excellence Program.
Die Autoren danken Alice Monnier für ihren Beitrag zur Entwicklung dieses Protokolls und Caroline Bouzin für ihre Expertise und technische Hilfe bei der Bildaufnahme. Wir danken auch der Bildgebungsplattform 2IP-IREC für den Zugang zum Kryostaten und den Mikroskopen (2IP-IREC Imaging Platform, Institute of Experimental and Clinical Research, Université Catholique de Louvain, 1200 Brüssel, Belgien). Abschließend möchten sich die Autoren bei Nicolas Dubuisson, Romain Versele und Michel Abou-Samra für ihre konstruktive Kritik am Manuskript bedanken. Einige der Figuren dieses Artikels wurden mit BioRender.com erstellt.
Materialien
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| AxioCam 506 mono 6 Mpix camera | Zeiss | ||
| AxioCam MRm 1.4MPix CCD camera | Zeiss | ||
| Chemical hood | Potteau Labo | EN-14175 | |
| Confocal microscope | Zeiss | LSM800 | |
| Cork discs (ø 20 mm, 3 mm thick) | Electron Microscopy Sciences | 63305 | |
| Cryo-Gloves | Tempshield | 16072252 | |
| Cryostat | Thermo Scientific | Microm Cryo Star HM 560 | |
| Dissecting Stereo Microscope SMZ745 | Nikon | ||
| Dry Ice | |||
| Dumont Forceps | F.S.T | 11295-10 | |
| Epifluorescence microscope | Zeiss | AxioImage-Apotome Z1 | |
| Extra Fine Bonn Scissors | F.S.T | 14084-08 | |
| FisherBrand Disposable Base Molds (0.7 x 0.7 cm) | ThermoFisher | 22-363-552 | Used to cut a piece to hold the muscle on the cork for freezing |
| Glass petri dish (H 25 mm, ø 150 mm) | BRAND Petri dish, MERK | BR455751 | Used to place the muscles on ice during dissection |
| ImmEdge Hydrophobic barrier PAP Pen | Vector Labs | H-4000 | Used to create an hidrophobic barrier around the muscle sections |
| Incubator | MMM Medcenter | Incucell 707 | |
| Microscope Cover Glasses (24x50 mm) | Assistent | 40990151 | |
| Microscope Slide Boxes | Kartell | 278 | Used as humid chambers for immunohistochemistry |
| Neck holder | Linie zwo | SB-035X-02 | Used as strap to hold the stainless steel tumbler |
| No 15 Sterile Carbon Steel Scalpel Blade | Swann-Morton | 0205 | |
| Paint brushes | Van Bleiswijck | Amazon B07W7KJQ2X | Used to handle cryosections |
| Permanent Marker Pen Black | Klinipath/VWR | 98307-R | Used to label slides |
| Pierce Fixation Forceps | F.S.T | 18155-13 | |
| Polystyrene Box | H 12 cm x L 25 cm x W 18 cm, used as a liquid nitrogen container and to transport the samples to the cryostat | ||
| Scalpel Handle, 125 mm (5"), No. 3 | Aesculap | BB073R | |
| Stainless Steel Cup 10oz | Eboxer | B07GFCBPFH | Tumbler to fill with isopentene for muscle freezing |
| Superfrost Ultra Plus slides | ThermoFisher | J1800AMNZ | |
| Surgical tweezers 1/2 teeth | Medische Vakhandel | 1303152 | Also called "Rat teeth tweezers" |
| Vannas Spring Scissors - 3 mm Cutting Edge | F.S.T | 15000-00 | |
| Weighing boats | VWR international | 611-2249 | |
| Whole-Slide Scanner for Fluorescence | Zeiss | Axio Scan.Z1 | |
| Reagents | |||
| Alexa Fluor 405 Goat Anti-Mouse IgG2b | Sigma-Aldrich | SAB4600477 | Used at a final concentration of 1:500 |
| Alexa Fluor 488 Goat Anti-Mouse IgG1 | ThermoFisher | A-21121 | Used at a final concentration of 1:500 |
| Alexa Fluor 568 Goat Anti-Mouse IgM | Abcam | ab175702 | Used at a final concentration of 1:1,000 |
| Alexa Fluor 647 goat anti rat-IgG (H+L) secondary antibody | ThermoFisher | A-21247 | Used at a final concentration of 1:500 |
| BODIPY-493/503 (4,4-difluoro-1,3,5,7,8-pentametil-4-bora-3a,4a-diaza-s-indaceno) | ThermoFisher | D3922 | Used at a final concentration of 1 µg/mL |
| BODIPY-558/568 C12 (4,4-Difluoro-5-(2-Thienyl)-4-Bora-3a,4a-Diaza-s-Indacene-3-Dodecanoic Acid) | ThermoFisher | D3835 | Used at a final concentration of 1 µg/mL |
| DAPI (4',6-diamidino-2-phenylindole) | ThermoFisher | D1306 | Used at a final concentration of 0.5 µg/mL |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | D-8418 | Used to solve Bodipy for the 1 mg/mL stock solution. CAUTION: Toxic and flammable. Vapors may cause irritation. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Formaldehyde solution 4%, buffered, pH 6.9 | Sigma-Aldrich | 1004969011 | CAUTION: May cause an allergic skin reaction. Suspected of causing genetic defects. May cause cancer. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Isopentane GPR RectaPur | VWR international | 24872.298 | CAUTION: Extremely flammable liquid and vapor. May be fatal if swallowed and enters airways. May cause drowsiness or dizziness. Repeated exposure may cause skin dryness or cracking. Wear protective gloves/protective clothing/eye protection/face protection. |
| Liquid Nitrogen | CAUTION: Extremely cold. Wear gloves. Handle slowly to minimize boiling and splashing and in well ventilated areas. Use containers designed for low-temperature liquids. | ||
| Mouse on mouse Blocking Reagent | Vector Labs | MKB-2213-1 | Used at concentration of 1:30 |
| Myosin heavy chain Type I (BA-D5-s Primary Antibody) Gene: MYH7, monoclonal bovine anti mouse IgG2b | DSHB University of Iowa | BA-D5-supernatant | Used at a final concentration of 1:10 |
| Myosin heavy chain Type IIA (SC-71-s Primary Antibody) Gene: MYH2, Monoclonal bovine anti mouse IgG1 | DSHB University of Iowa | SC-71-supernatant | Used at a final concentration of 1:10 |
| Myosin heavy chain Type IIX (6H1-s Primary Antibody), Gene: MYH1, Monoclonal rabbit anti mouse IgM | Developmental Studies Hybridoma Bank, University of Iowa | 6H1-supernatant | Used at a final concentration of 1:5 |
| Normal Goat Serum (NGS) | Vector Labs | S-1000 | |
| PBS 0.1 M | Commonly used on histology laboratories | ||
| ProLong Gold Antifade Mountant | Invitrogen | P36930 | |
| Rat anti-Laminin-2 (α-2 Chain) primary antibody (monoclonal) | Sigma-Aldrich | L0663 | Used at a final concentration of 1:1,000 |
| Tissue-Tek O.C.T compound | Sakura | 4583 | |
| Software | |||
| Adobe Illustrator CC | Adobe Inc. | Used to design the figures | |
| Adobe Photoshop | Adobe Inc. | Confocal software | |
| BioRender | https://biorender.com/ | Used to design the figures | |
| Fiji/ImageJ | https://imagej.net/software/fiji/ | Used to analyse the acquired images | |
| Microsoft PowerPoint | Microsoft | Used to reconstruct the histology of the whole muscle after scanning the fiber types | |
| Zen Blue 2.6 | Zeiss | Used to reconstruct the histology of the whole muscle after scanning the fiber types |
Referenzen
- Correa-de-Araujo, R., et al. Myosteatosis in the context of skeletal muscle function deficit: an interdisciplinary workshop at the National Institute on Aging. Frontiers in Physiology. 11, 963 (2020).
- Miljkovic, I., et al. Greater skeletal muscle fat infiltration is associated with higher all-cause and cardiovascular mortality in older men. Journals of Gerontology Series A: Biomedical Sciences and Medical Sciences. 70 (9), 1133-1140 (2015).
- Nachit, M., et al. Myosteatosis rather than sarcopenia associates with non-alcoholic steatohepatitis in non-alcoholic fatty liver disease preclinical models. Journal of Cachexia, Sarcopenia, and Muscle. 12 (1), 144-158 (2021).
- Aleixo, G. F. P., et al. Myosteatosis and prognosis in cancer: Systematic review and meta-analysis. Critical Reviews in Oncology/Hematolgoy. 145, 102839 (2020).
- Gemmink, A., Schrauwen, P., Hesselink, M. K. C. Exercising your fat (metabolism) into shape: a muscle-centred view. Diabetologia. 63 (8), 1453-1463 (2020).
- van Loon, L. J. Use of intramuscular triacylglycerol as a substrate source during exercise in humans. Journal of Applied Physiology. 97 (4), 1170-1187 (2004).
- Coen, P. M., Goodpaster, B. H. Role of intramyocelluar lipids in human health. Trends in Endocrinology and Metabolism. 23 (8), 391-398 (2012).
- Seibert, J. T., Najt, C. P., Heden, T. D., Mashek, D. G., Chow, L. S. Muscle lipid droplets: cellular signaling to exercise physiology and beyond. Trends in Endocrinology and Metabolism. 31 (12), 928-938 (2020).
- Bergman, B. C., Goodpaster, B. H. Exercise and muscle lipid content, composition, and localization: influence on muscle insulin sensitivity. Diabetes. 69 (5), 848-858 (2020).
- Nielsen, J., Christensen, A. E., Nellemann, B., Christensen, B. Lipid droplet size and location in human skeletal muscle fibers are associated with insulin sensitivity. American Journal of Physiology-Endocrinology and Metabolism. 313 (6), 721-730 (2017).
- Covington, J. D., et al. Intramyocellular lipid droplet size rather than total lipid content is related to insulin sensitivity after 8 weeks of overfeeding. Obesity (Silver Spring). 25 (12), 2079-2087 (2017).
- Bosma, M. Lipid droplet dynamics in skeletal muscle). Experimental Cell Research. 340 (2), 180-186 (2016).
- Nielsen, J., et al. Increased subsarcolemmal lipids in type 2 diabetes: effect of training on localization of lipids, mitochondria, and glycogen in sedentary human skeletal muscle. American Journal of Physiology-Endocrinology and Metabolism. 298 (3), 706-713 (2010).
- Ferreira, R., et al. Subsarcolemmal and intermyofibrillar mitochondria proteome differences disclose functional specializations in skeletal muscle. Proteomics. 10 (17), 3142-3154 (2010).
- Barrett, J. S., Whytock, K. L., Strauss, J. A., Wagenmakers, A. J. M., Shepherd, S. O. High intramuscular triglyceride turnover rates and the link to insulin sensitivity: influence of obesity, type 2 diabetes and physical activity. Applied Physiology, Nutrition and Metabolism. , 1-14 (2022).
- Daemen, S., et al. Distinct lipid droplet characteristics and distribution unmask the apparent contradiction of the athlete's paradox. Molecular Metabolism. 17, 71-81 (2018).
- Bredella, M. A., Ghomi, R. H., Thomas, B. J., Miller, K. K., Torriani, M. Comparison of 3.0 T proton magnetic resonance spectroscopy short and long echo-time measures of intramyocellular lipids in obese and normal-weight women. Journal of Magnetic Resonance Imaging. 32 (2), 388-393 (2010).
- Schrauwen-Hinderling, V. B., Hesselink, M. K., Schrauwen, P., Kooi, M. E. Intramyocellular lipid content in human skeletal muscle. Obesity (Silver Spring). 14 (3), 357-367 (2006).
- De Bock, K., et al. Evaluation of intramyocellular lipid breakdown during exercise by biochemical assay, NMR spectroscopy, and Oil Red O staining. American Journal of Physiology-Endocrinology and Metabolism. 293 (1), 428-434 (2007).
- Koopman, R., Schaart, G., Hesselink, M. K. Optimisation of oil red O staining permits combination with immunofluorescence and automated quantification of lipids. Histochemistry and Cell Biology. 116 (1), 63-68 (2001).
- Gueugneau, M., et al. Skeletal muscle lipid content and oxidative activity in relation to muscle fiber type in aging and metabolic syndrome. Journal of Gerontology Series A: Biomedical Sciences and Medical Sciences. 70 (5), 566-576 (2015).
- Gemmink, A., et al. Super-resolution microscopy localizes perilipin 5 at lipid droplet-mitochondria interaction sites and at lipid droplets juxtaposing to perilipin 2. Biochimica et Biophysica Acta-Molecular and Cell Biology of Lipids. 1863 (11), 1423-1432 (2018).
- Spangenburg, E. E., Pratt, S. J. P., Wohlers, L. M., Lovering, R. M. Use of BODIPY (493/503) to visualize intramuscular lipid droplets in skeletal muscle. Journal of Biomedicine and Biotechnology. 598358, (2011).
- Prats, C., et al. An optimized histochemical method to assess skeletal muscle glycogen and lipid stores reveals two metabolically distinct populations of type I muscle fibers. PLoS One. 8 (10), 77774 (2013).
- Strauss, J. A., Shepherd, D. A., Macey, M., Jevons, E. F. P., Shepherd, S. O. Divergence exists in the subcellular distribution of intramuscular triglyceride in human skeletal muscle dependent on the choice of lipid dye. Histochemistry and Cell Biology. 154 (4), 369-382 (2020).
- Shepherd, S. O., et al. Sprint interval and traditional endurance training increase net intramuscular triglyceride breakdown and expression of perilipin 2 and 5. Journal of Physiology. 591 (3), 657-675 (2013).
- Whytock, K. L., et al. A 7-day high-fat, high-calorie diet induces fibre-specific increases in intramuscular triglyceride and perilipin protein expression in human skeletal muscle. Journal of Physiology. 598 (6), 1151-1167 (2020).
- Wang, C., Yue, F., Kuang, S. Muscle histology characterization using h&e staining and muscle fiber type classification using immunofluorescence staining. Bio-Protocol. 7 (10), (2017).
- Meng, H., et al. Tissue triage and freezing for models of skeletal muscle disease. Journal of Visualized Experiments: JoVE. (89), e51586 (2014).
- Kumar, A., Accorsi, A., Rhee, Y., Girgenrath, M. Do's and don'ts in the preparation of muscle cryosections for histological analysis. Journal of Visualized Experiments: JoVE. (99), e52793 (2015).
- Leiva-Cepas, F., et al. Laboratory methodology for the histological study of skeletal muscle. Archivos de Medicina del Deporte. 35 (186), 254-262 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Schiaffino, S., et al. Three myosin heavy chain isoforms in type 2 skeletal muscle fibres. Journal of Muscle Research & Cell Motility. 10 (3), 197-205 (1989).
- Komiya, Y., et al. Mouse soleus (slow) muscle shows greater intramyocellular lipid droplet accumulation than EDL (fast) muscle: fiber type-specific analysis. Journal of Muscle Research & Cell Motility. 38 (2), 163-173 (2017).
- Andrich, D. E., et al. Altered lipid metabolism impairs skeletal muscle force in young rats submitted to a short-term high-fat diet. Frontiers in Physiology. 9, 1327 (2018).
- Schiaffino, S. Fibre types in skeletal muscle: a personal account. Acta Physiologica. 199 (4), 451-463 (2010).
- Bloemberg, D., Quadrilatero, J. Rapid determination of myosin heavy chain expression in rat, mouse, and human skeletal muscle using multicolor immunofluorescence analysis. PLoS One. 7 (4), 35273 (2012).
- Gemmink, A., et al. Decoration of intramyocellular lipid droplets with PLIN5 modulates fasting-induced insulin resistance and lipotoxicity in humans. Diabetologia. 59 (5), 1040-1048 (2016).
- Askinas, C., et al. . Biophotonics Congress: Biomedical Optics Congress 2018 (Microscopy/Translational/Brain/OTS). , (2018).
- Morén, B., et al. EHD2 regulates adipocyte function and is enriched at cell surface-associated lipid droplets in primary human adipocytes. Molecular Biology of the Cell. 30 (10), 1147-1159 (2019).
- Benador, I. Y., et al. Mitochondria bound to lipid droplets have unique bioenergetics, composition, and dynamics that support lipid droplet expansion. Cell Metabolism. 27 (4), 869-885 (2018).
- de la Rosa Rodriguez, M. A., et al. Hypoxia-inducible lipid droplet-associated induces DGAT1 and promotes lipid storage in hepatocytes. Molecular Metabolism. 47, 101168 (2021).
- Jevons, E. F. P., Gejl, K. D., Strauss, J. A., Ørtenblad, N., Shepherd, S. O. Skeletal muscle lipid droplets are resynthesized before being coated with perilipin proteins following prolonged exercise in elite male triathletes. American Journal of Physiology-Endocrinology and Metabolism. 318 (3), 357-370 (2020).
- Ohsaki, Y., Maeda, T., Fujimoto, T. Fixation and permeabilization protocol is critical for the immunolabeling of lipid droplet proteins. Histochemistry and Cell Biology. 124 (5), 445-452 (2005).
- Prats, C., et al. Decrease in intramuscular lipid droplets and translocation of HSL in response to muscle contraction and epinephrine. Journal of Lipid Research. 47 (11), 2392-2399 (2006).
- Listenberger, L. L., Brown, D. A. Fluorescent detection of lipid droplets and associated proteins. Current Protocols in Cell Biology. , (2007).
- Xue, Y., Lim, S., Bråkenhielm, E., Cao, Y. Adipose angiogenesis: quantitative methods to study microvessel growth, regression and remodeling in vivo. Nature Protocols. 5 (5), 912-920 (2010).
- Muliyil, S., et al. ADAM17-triggered TNF signalling protects the ageing Drosophila retina from lipid droplet-mediated degeneration. The EMBO Journal. 39 (17), 104415 (2020).
- Yan, Q., et al. Autophagy activation contributes to lipid accumulation in tubular epithelial cells during kidney fibrosis. Cell Death Discovery. 4, 2 (2018).
- Coassin, S., et al. Investigation and functional characterization of rare genetic variants in the adipose triglyceride lipase in a large healthy working population. PLoS Genetics. 6 (12), 1001239 (2010).
- Daemen, S., van Zandvoort, M., Parekh, S. H., Hesselink, M. K. C. Microscopy tools for the investigation of intracellular lipid storage and dynamics. Molecular Metabolism. 5 (3), 153-163 (2016).
- Chen, Q., et al. Rab8a deficiency in skeletal muscle causes hyperlipidemia and hepatosteatosis by impairing muscle lipid uptake and storage. Diabetes. 66 (9), 2387-2399 (2017).
- Gemmink, A., et al. Decoration of myocellular lipid droplets with perilipins as a marker for in vivo lipid droplet dynamics: A super-resolution microscopy study in trained athletes and insulin resistant individuals. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids. 1866 (2), 158852 (2021).
- Bergman, B. C., Hunerdosse, D. M., Kerege, A., Playdon, M. C., Perreault, L. Localisation and composition of skeletal muscle diacylglycerol predicts insulin resistance in humans. Diabetologia. 55 (4), 1140-1150 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten