Method Article
ゼブラフィッシュ角膜創傷治癒:擦過傷から創傷閉鎖画像分析まで
要約
このプロトコルは、細胞レベルでのその後の創傷閉鎖を評価するために、擦過傷によってゼブラフィッシュの眼表面を損傷することに焦点を当てている。このアプローチは、眼のバリを利用して角膜上皮を部分的に除去し、走査型電子顕微鏡を使用して創傷閉鎖中の細胞形態の変化を追跡する。
要約
目の透明な表面として、角膜は明確な視力のために役立ちます。その場所のために、この組織は環境侮辱を受けやすいです。実際、臨床的に最も頻繁に遭遇する眼の損傷は、角膜に対するものである。角膜創傷治癒は小型哺乳類(すなわち、マウス、ラット、ウサギ)で広く研究されてきたが、ゼブラフィッシュは古典的な研究モデルであるにもかかわらず、角膜生理学研究はゼブラフィッシュを含む他の種を無視してきた。
この報告は、ゼブラフィッシュに角膜擦過傷を行う方法について記載する。創傷は、眼のバリを用いて麻酔をかけた魚に インビボで 行われる。この方法は、再現性のある上皮創傷を可能にし、眼の残りの部分を無傷のままにする。擦過傷後、創傷閉鎖を3時間にわたって監視し、その後、創傷を再上皮化する。走査型電子顕微鏡法を用いて、続いて画像処理することにより、上皮細胞形状、および頂端突起を調査して、角膜上皮創傷閉鎖中の様々なステップを研究することができる。
ゼブラフィッシュモデルの特徴は、上皮組織の生理機能および組織が挑戦されたときの上皮細胞の集団的挙動の研究を可能にする。さらに、涙液膜の影響を奪われたモデルの使用は、ストレスに対する角膜応答に関する新しい答えを生み出すことができる。最後に、このモデルはまた、物理的創傷に供される任意の上皮組織に関与する細胞および分子事象の描写を可能にする。この方法は、前臨床試験における薬剤有効性の評価に適用することができる。
概要
上皮のほとんどは外部環境と接触しているため、身体的な損傷を受けやすく、創傷治癒プロセスの研究に適しています。よく研究された組織の中で、角膜は創傷治癒の細胞的および分子的側面の調査において非常に有用なモデルである。透明な外面として、それは目に物理的な保護を提供し、網膜に光を集中させる最初の要素です。網膜の構造と細胞組成は種1によって異なるが、角膜のこれらの要素は、種に関係なく、すべてのカメラタイプの目で一般的に類似している。
角膜は、3つの主要な層2から構成される。最初で最外層は上皮であり、その透明性を確保するために絶えず更新されています。第2の層は間質であり、厳密に組織化されたコラーゲン線維の厚い層内に、角化細胞と呼ばれる散在細胞を含む。第3および最内層は内皮であり、これは前房から外層への栄養素および液体拡散を可能にする。上皮細胞と間質細胞は、成長因子とサイトカインを介して相互作用する3。この相互作用は、上皮損傷後の急速なアポトーシスおよびその後の角化細胞の増殖によって強調される4,5。穿刺などのより深い創傷の場合、角化細胞は治癒過程6において積極的な役割を果たす。
外部環境と接触しているため、角膜の身体的傷害が一般的です。それらの多くは、砂やほこりなどの小さな異物7によって引き起こされます。眼の擦れの反射は、広範な上皮擦過傷および角膜リモデリングにつながる可能性がある8。創傷の大きさと深さに応じて、これらの身体的傷害は痛みを伴い、治癒に数日かかる9。モデルの最適な創傷治癒特性は、創傷閉鎖の細胞的および分子的側面の理解を容易にする。さらに、このようなモデルは、以前に実証したように、角膜治癒を促進する可能性のある新しい分子の試験にも有用であることが証明されている10,11。
ここで説明するプロトコルは、角膜の物理的損傷を研究するための関連モデルとしてゼブラフィッシュを使用することを目的としています。このモデルは、分子をタンク水に直接添加し、治癒角膜と接触させることができるため、薬理学的スクリーニング研究に非常に便利です。ここで提供される詳細は、科学者がゼブラフィッシュモデルに関する研究を行うのに役立ちます。インビボ傷害は、鈍い眼のバリで行われる。隣接する、またはそれから離れている上皮細胞への影響は、角膜上皮の中心を特異的に除去することによって分析することができる。近年、げっ歯類角膜に関するこのような方法に焦点を当てた多数の報告12、13、14、15、16、17;しかし、今日まで、この方法をゼブラフィッシュ18に適用した報告は1つだけです。
その単純さのために、物理的創傷は、創傷閉鎖における上皮細胞の役割を描写するのに有用である。角膜損傷の別の十分に確立されたモデルは、化学火傷、特にアルカリ火傷19、20、21である。しかしながら、このようなアプローチは、末梢角膜および角膜間質19を含む眼表面全体を間接的に損傷する。実際、アルカリ火傷は角膜潰瘍、穿孔、上皮不透明化、および迅速な新生血管形成を誘発する可能性があり22、アルカリ火傷の制御不能な結果は、一般的な創傷治癒研究のためのそのアプローチを失格にする。多数の他の方法もまた、問題となっている研究の特定の焦点に従って角膜創傷治癒を調査するために使用される(例えば、完全な上皮デブリードマン23、部分厚創傷24に対する化学的および機械的損傷の組み合わせ、間質25に延びる創傷に対するエキシマレーザーアブレーション)。眼バリの使用は、焦点を創傷に対する上皮反応に制限し、再現性の高い創傷を提供する。
創傷を与える各方法と同様に、眼垢の使用には長所と短所がある。主な欠点は、応答が主に上皮的であり、臨床現場で見られる擦過傷を完全に反映していないことである。しかし、この方法には、セットアップと実行の容易さ、その精度、再現性、および非侵襲的であるという事実など、多くの利点があり、動物によって十分に許容される方法となっています。
プロトコル
すべての実験は、国家動物実験委員会によって承認された。
1. 準備
- 麻酔26 に用いるトリカイン原液を予め用意しておく(このプロトコールで用いる0.4%原液)。手袋を着用し、可能な限り材料をヒュームフードに入れてください。
- 50 mLの0.4%溶液の場合、200 mgのトリカイン粉末を50 mLチューブに秤量する。粉末を約45mLの二重蒸留水に溶解する。
- トリカイン原液のpHを1 Mトリス(pH 8.8、〜1.25 mL)で7に調整する。トリス溶液をアリコート中のトリカインストックに加え、各アリコートの後にストックを十分に混合し、トリスを添加するたびにpHを確認する。
- 実験の前に、トリカインの0.02%作用溶液を調製する。
- 0.4%原液2 mLを解凍し、40 mLのシステム水(最終濃度0.02%)に加える。溶液を小さな容器に入れる。
- 実験前に、鎮痛剤を含む回収水を調製する。手袋を着用し、可能な限り材料をヒュームフードに入れてください。
- 1リットルの回収水に対して、2.5mgの塩酸リドカイン粉末を計量し、それを淡系水に溶解する。pHを確認し、必要に応じて7に調整します。
- 実験の前に、固定溶液(pH7.4の0.1 Mリン酸ナトリウム(Na-PO4)溶液中の2.5%グルタルアルデヒド)を調製する。手袋を着用し、材料をヒュームフードに入れてください。
- 10 mLの固定溶液について、0.2 M Na-PO4の5 mLをチューブにピペットで留めた。0.5 mLの50%グルタルアルデヒドを加え、二重蒸留水を加えて最終容量10 mLを得た。溶液を光から保護し、使用前に氷の上または冷蔵庫に保管してください。
注:巻傷後数時間サンプルを採取する必要がある場合は、使用直前に固定溶液を調製してください。
- 10 mLの固定溶液について、0.2 M Na-PO4の5 mLをチューブにピペットで留めた。0.5 mLの50%グルタルアルデヒドを加え、二重蒸留水を加えて最終容量10 mLを得た。溶液を光から保護し、使用前に氷の上または冷蔵庫に保管してください。
- 負傷用の機器を準備します(図1)。
- 回収タンクまたは小さな容器にシステム水を満たします。
- 眼科用バリを準備してください。バリの先端が汚れていないことを確認します。必要に応じて、湿った綿棒で細胞の破片を取り除きます。
- 柔らかいスポンジの側面に切開し、スポンジをシステム水で湿らせます。スポンジを解剖顕微鏡のベース/ステージに置きます。バリを使用するための十分な作業スペースと、目の表面を正しく見るために側面および/または上からの十分な照明を確保してください。
2.麻酔
- 魚をタンクから0.02%トリカイン溶液にできるだけ穏やかにネットで移します。
- 麻酔を監視し、軽い機械的刺激に対する反応の欠如をチェックする。
注:一貫した麻酔のために、成体の野生型AB魚との擦過の前にトリカインへの2分間の暴露が使用される。他の遺伝的背景を持つ魚では、異なる期間が必要になるかもしれません。
3. 摩耗
- スプーンで麻酔をかけられた魚をスポンジの切開部にそっと置き、頭をスポンジ表面から突き出します。
- バリをオンにし、顕微鏡ビューを目の表面に焦点を合わせます。
- バリの先端で目元に慎重に近づきます。目面に触れたら、眼面上のバリ先を円運動で動かし始める。突然の動きは、ソケットの目が傾いたり、バリの先端が滑ったりする可能性があるため、避けてください。
- 擦り傷が終わったら、回復のために鎮痛剤を含むシステム水に魚を慎重に置きます。
- 使用直後のバリは湿った綿棒で拭いてください。
4. サンプルの収集
- 目的の時点で、ネットで魚を拾い上げ、0.02%トリカイン溶液に入れます。操作性の動きが完全に止まり、魚が触れることに反応しなくなるまで、動物を溶液に入れておく。
- 魚をスプーンでペトリ皿の上に置き、ピンセットで保持します。解剖ハサミで魚を斬首する。サンプルを取り扱うときは、目の表面に傷をつけないでください。
- 1 M Na-PO4を含むサンプル管に組織を入れた。
- 0.1 M Na-PO4 を清潔な緩衝液で置き換えて組織をすすぎ、溶液中に血液が残らないようにします。
5. 電子顕微鏡用試料処理
- 組織を2.5%グルタルアルデヒド/0.1M Na-PO4(pH 7.4)で+4°Cで約24 時間固定する。 適切な固定を確実にするために、サンプルを回転/振るサンプルホルダーに保管してください。
- 固定溶液を取り出し、0.1 M Na-PO4でサンプルを数回すすいだ。
- この時点でサンプルを解剖します。
- 解剖プレート上の0.1 MNa-PO4 の滴の上にサンプルを置きます。同じ魚の両目を画像化する必要がある場合は、細かい解剖はさみで頭のサンプルを2つに切ります。
- あるいは、目の表面を傷つけないように細心の注意を払って、細かいピンセットの先端を目の側面から眼窩に慎重に入れることによってのみ目を集めてください。次に、ソケットから目を引き出します。
- 解剖した試料を0.1 M Na-PO4を含むチューブに移す。サンプル処理中に目の上部に付着する可能性があるため、サンプルチューブに余分な組織がないことを確認してください。
- サンプルを0.1 M Na-PO4(最大1週間)に+4°Cで保存する。
- 電子顕微鏡イメージングのためにサンプルを処理します。
- サンプルを0.1 M Na-PO4バッファー中の2%四酸化オスミウムに室温(RT)で1時間後固定します。
- サンプルをRTで0.1 M Na-PO4中で5分間3回洗浄する。
- サンプルをRTで各溶液中で30%、50%、および70%エタノール中で1時間連続して脱水する。
- サンプルを96%エタノールにRTで2〜3時間浸漬する。
- 次に、サンプルを100%エタノール中で2回インキュベートし、まず1時間、次いで新鮮な100%エタノール中で+4°Cで一晩インキュベートする。
- サンプルを自動臨界点乾燥機で30サイクルにかけます。
- サンプルを埋め込んでプラチナコートします。
- 粘着タブをマウントの上に置きます。マウントの上にサンプルをマークする必要がある場合は、タブにタブカバーの紙を残し、サンプルIDを紙に書きます。
- タブ付きのマウントを解剖顕微鏡のベースに置きます。
- 組織サンプルを細かいピンセットでマウントの上にそっと置き、角膜を上向きにします。
- 適切な装置を用いて試料を白金でコーティングする。コーティング後、イメージングするまでサンプルを室温で保存する。
6. イメージング(図2)
- ユーザーズマニュアルおよびイメージングの専門家の指示に従ってデバイスを操作します。
- 所望の倍率の画像を取得し、2,000〜2,500倍の画像を解析に使用する。
- 明るさとコントラストを調整して、画像に露出過多の領域がないようにし、セルの境界線とマイクロリッジができるだけはっきりと見えるようにします。
メモ: 組織の位置と角度は、明るさとコントラストの設定に影響します。それらは、サンプルからサンプルへ、および組織の異なる領域間で調整する必要があるかもしれません。
7. 細胞の形状、大きさ、マイクロリッジパターンの測定
- フィジー ImageJ 1.5327 で TIFF イメージを開きます。画像のスケールバーを使用してスケールを設定する:ラインツールを使用して、スケールバーと同じサイズの ライン を作成します。 [|の分析] を選択します。スケールを設定し、既知の距離で入力します。分析|から ROIマネージャ を開きます。 ツール メニュー。
- セルのサイズと丸みについては、[ |の分析] を選択します。測定値を|に設定する図形記述子。 虫 眼鏡ツールを使用して、拡大鏡の下の細胞を確認します。 ポリゴン ツールでセルを選択し、各選択範囲をROIマネージャに追加します。最後に、選択したセルを測定し、測定値を保存します。
- マイクロリッジ解析(図3 、 図4)
- イメージ |イルのイメージが 8 ビット形式であることを確認します。 タイプ メニュー。
- ポリゴンツールでセルを選択し、編集から背景をクリア|外は澄んでいる。
- [処理] を選択して画像を 1 ~ 3 回滑らか に|スムーズで、画像|から明るさとコントラストを調整し ます|を調整するマイクロ リッジができるだけはっきりと目立つように明るさ/コントラスト。
- プロセス|から画像を畳むフィルター|プロセス|からバイナリに変わる、複雑になるバイナリ|バイナリを作成し、[処理] を選択して白黒画像をスケルトン化|バイナリ|スケルトン化。
- [分析] |で [スケルトンを分析] 機能を使用するスケルトンメニューは、マイクロリッジパラメータを測定し、値を保存します。
メモ: SEM では、個々の画像の明るさとコントラストが異なる場合があります。したがって、解析のステップでは、画像ごとに調整が必要な場合があります。
結果
この研究は、ゼブラフィッシュ角膜創傷治癒実験において眼科バリを用いる方法を記載する。この方法は、バリが上皮細胞層を効率的に除去することが示されたマウスに関する以前の研究から改変された13。ゼブラフィッシュの角膜創傷における課題には、眼のサイズが比較的小さいこと、および時間のかかる実験の場合、えらを通る一定の水流を維持する必要性が含まれる(Xuら28によって説明されるように)。この方法の主な利点は、そのシンプルさとスピードです。バリの制御された使用には、標準的な解剖顕微鏡が使用されます(図1)。手順は短期間(麻酔開始から約3分)であるため、魚は取り扱いからよく回復し、麻酔と酸素供給の維持に余分な機器は必要ありません。
角膜創傷を可視化するにはいくつかの方法があります。このプロトコルは走査型電子顕微鏡(SEM、図2)を使用しており、角膜研究における使用の長い歴史を持っています29,30。このアプローチは上皮の下層の評価を可能にしないが、創傷治癒速度を推定し、眼の異なる領域の角膜表面を比較する簡単な方法を提供する。創傷後3時間で、創傷領域が閉じられている間(図2)、創傷境界が接合された部位は目に見えるままである(図2)。
ゼブラフィッシュ角膜上の表在細胞は、顕著なマイクロリッジ31を含む。最近、ある研究が、ゼブラフィッシュの皮膚32上の創傷に隣接する細長い細胞においてこれらの構造が失われていると報告した。しかしながら、提示された結果は、擦過傷された角膜上皮上で、創傷部位の隣にあるいくつかの細長い細胞においてマイクロリッジが観察され得ることを示している(図4B)。いくつかの周辺領域では、マイクロリッジは細胞の中心から失われる(図4C、D)。より詳細な分析のために、ImageJ27(図3および図4E-H)においてマイクロリッジ量および平均長さに加えて、頂端細胞面積および真円度が定量化される。
マイクロリッジ解析は、Skeleton関数(van Loonら33から修正)を用いて行われる。2つの周辺領域(図4A(領域CおよびD)、図4C、および図4D)を比較すると、図4Dの細胞はより細長く(創傷に対する反応としての細胞再配列を示す)、図4Cの細胞よりも平均マイクロリッジが短いことが明らかになった。この結果は、細胞形状の変化がマイクロリッジ修飾と相関し、創傷応答における角膜上皮内の不均一性を強調することを示唆している。
SEM画像上の頂端細胞面積および真円度を測定することは、角膜の異なる領域における細胞外観に関する定量的データを得るための簡単で再現性のある方法である。2Dに限定されていますが、このアプローチは、創傷閉鎖中の細胞再配列のダイナミクスと速度の全体的な理解を得るのに役立ちます。SEM画像は、頂端細胞表面のマイクロリッジパターンを分析するために利用される。ここで説明する画像処理は、マイクロリッジパラメータの変化を近似したもので、手作業で測定するのは面倒です。

図1:角膜擦過傷のセットアップ。 (A)小さなゼブラフィッシュの眼の制御された擦過傷には、解剖顕微鏡が必要です。(B)スポンジは、処置中に麻酔をかけられた魚を安定させるのに役立ちます。(C)魚をペトリ皿に麻酔し、麻酔をかけた動物を小さなスプーンでスポンジに移す。0.5mmの先端を有する眼のバリは、角膜を擦過するために使用される。 この図の拡大版を表示するには、ここをクリックしてください。
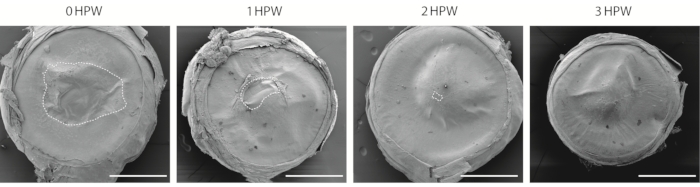
図2:走査型電子顕微鏡による傷ついた角膜の可視化。 創傷後0、1、2、または3時間で採取した擦過角膜(HPW)の概要。破線の輪郭は、創傷の境界線を示す。スケール バー = 500 μm。 この図の拡大版を表示するには、ここをクリックしてください。

図3:マイクロリッジ測定前の画像修正の一例。 元の細胞表面の正確なレプリカではありませんが、最終的な骨格化されたパターンは、細胞中心と末梢の違いを捉えています。スケール バー = 10 μm。 この図の拡大版を表示するには、ここをクリックしてください。

図4:角膜擦過傷後の2つの末梢領域間の頂端細胞面積、真円度、およびマイクロリッジ値の比較。ボックスは、倍率の高い画像の位置(B、C、D)を示します。(C, D)図形記述子の分析用に選択されたセルは、緑色のアウトラインでマークされます。(E, F)選択したセルの頂端細胞面積 (E) と真円度 (F) の値。(G, H)マイクロリッジ全長(G)と平均長(H)は同一の細胞である。群を両側t検定(*p≤0.05、**p≤0.01)スケールバー=Aで500μm、B、C、Dで50μmと統計的に比較した。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
角膜の身体的傷害は、眼科患者が病院を訪れる最も一般的な原因である。したがって、角膜病態生理学のさまざまな側面の研究に関連するモデルを確立することが重要です。これまでのところ、マウスは角膜創傷治癒の研究に最も一般的に使用されるモデルである。しかし、角膜創傷治癒に対する特定の薬物の影響を検証するために、マウスの創傷眼に点眼剤を添加することは困難な場合がある。この点で、ゼブラフィッシュモデルは、角膜創傷治癒に影響を及ぼす分子の薬理学的スクリーニングに特に有用である。ここで説明する方法は、マウス13について説明した方法と非常によく似ています。
ただし、2 つの特定の相違点に留意する必要があります。第1に、眼科バリの使用は、特に適切な擦過傷に重要な眼にかかる圧力に関して、創傷の再現性を確保するための練習を必要とする。さらに、上皮が効率的に除去されなくなったときに研磨チップを交換する必要があります。第二に、ゼブラフィッシュ角膜の構造および形態は他の角膜31と類似しているが、この動物は哺乳類生物34、35、36において比類のない再生能力を有する。マウスの創傷閉鎖は48〜72時間11、14、37時間続くが、ゼブラフィッシュについては3時間のタイムラインが報告されている。構造的および分子的類似性のために、角膜物理的創傷によって誘発される細胞挙動は、おそらくほとんどの脊椎動物において類似している。しかし、ゼブラフィッシュの迅速な反応は、おそらくその動物に特有の高度な再生メカニズムによって導かれています。
記載されたプロトコルは、SEMを使用して創傷閉鎖を追跡する。他の多くの研究が、このプロセスを追跡するために代わりに蛍光顕微鏡法を用いている15,17,38。しかし、SEMを使用すると、上皮擦過後の細胞形状変化の分析が容易になります。この技術の欠点は、SEMが最も外部層のイメージングのみを許可するため、層別化ステップを追跡できないことです。完全な角膜治癒中に上皮を3Dで研究するには、Zebrabow39などの蛍光モデル、または免疫標識を使用する必要があります。
ゼブラフィッシュを角膜創傷治癒モデルとして使用することで、遺伝子組み換え魚系統、モルホリノ、化学スクリーニングなど、利用可能な多数の分子ツールを適用して角膜創傷治癒研究の可能な範囲を大幅に拡大できるため、調査の範囲が広がります。さらに、ゼブラフィッシュアイのサイズは、マウスの目で行うことができるよりも詳細に上皮細胞ダイナミクスを研究するための新しいイメージング戦略の開発を可能にする。
この報告書の主な目的は、物理的な角膜創傷アプローチをゼブラフィッシュモデルに適応させるだけでなく、新しいモデルの使用によって新しい質問が尋ねられ、答えられ、基本的な生命現象を調査する新しい方法を指し示すことを実証することです。これらの利点は、最終的に患者にとって有益である。
開示事項
著者らは、開示する利益相反はありません。
謝辞
著者らは、ゼブラフィッシュユニットへのアクセスについてPertti Panulaに感謝し、ゼブラフィッシュ実験の指導と支援についてHenri Koivulaに感謝している。この研究は、フィンランドアカデミー、ジェーン・アンド・アートス・エルッコ財団、フィンランド文化財団、ATIP-Avenirプログラムの支援を受けました。イメージングは、HiLIFEとBiocenter Finlandの支援を受けて、バイオテクノロジー研究所の電子顕微鏡ユニットと光顕微鏡ユニットで行われました。
資料
| Name | Company | Catalog Number | Comments |
| 0.1M Na-PO4 (sodium phosphate buffer), pH 7.4 | in-house | Solution is prepared from 1M sodium phosphate buffer (1M Na2HPO4 adjusted to pH 7.4 with 1M NaH2PO4). | |
| 0.2M Na-PO4 (sodium phosphate buffer), pH 7.4 | in-house | Solution is prepared from 1M sodium phosphate buffer (1M Na2HPO4 adjusted to pH 7.4 with 1M NaH2PO4). | |
| 0.5mm burr tips | Alger Equipment Company | BU-5S | |
| 1M Tris, pH 8.8 | in-house | ||
| adhesive tabs | Agar Scientific | G3347N | |
| Algerbrush burr, Complete instrument | Alger Equipment Company | BR2-5 | |
| Cotton swaps | Heinz Herenz Hamburg | 1030128 | |
| Dissecting plate | in-house | ||
| Dissecting tools | Fine Science Tools | ||
| double-distilled water | in-house | ||
| Eppedorf tubes, 2ml | any provider | ||
| Ethyl 3-aminobenzoate methanesulfonate salt | Sigma | A5040 | Caution: causes irritation. |
| Glutaraldehyde, 50% aqueous solution, grade I | Sigma | G7651 | Caution: toxic. |
| Lidocaine hydrochloride | Sigma | L5647 | Caution: toxic. |
| mounts | Agar Scientific | G301P | |
| Petri dish | Thermo Scientific | 101VR20 | |
| pH indicator strips | Macherey-Nagel | 92110 | |
| Plastic spoons | any provider | ||
| Plastic tubes, 15 ml | Greiner Bio-One | 188271 | |
| Plastic tubes, 50 ml | Greiner Bio-One | 227261 | |
| Scanning electron microscope | FEI | Quanta 250 FEG | |
| Soft sponge | any provider | ||
| Sputter coater | Quorum Technologies | GQ150TS | |
| Stereomicroscope | Leica |
参考文献
- Baden, T., Euler, T., Berens, P. Understanding the retinal basis of vision across species. Nature Reviews.Neuroscience. 21 (1), 5-20 (2020).
- Nishida, T., Saika, S., Morishige, N., Manis, M. J., Holland, E. J. Cornea and sclera: Anatomy and physiology. Cornea: Fundamentals, diagnosis and management, 4th ed. , 1-22 (2017).
- Wilson, S. E., Liu, J. J., Mohan, R. R. Stromal-epithelial interactions in the cornea. Progress in Retinal and Eye Research. 18 (3), 293-309 (1999).
- Wilson, S. E., et al. Epithelial injury induces keratocyte apoptosis: hypothesized role for the interleukin-1 system in the modulation of corneal tissue organization and wound healing. Experimental Eye Research. 62 (4), 325-327 (1996).
- Zieske, J. D., Guimaraes, S. R., Hutcheon, A. E. Kinetics of keratocyte proliferation in response to epithelial debridement. Experimental Eye Research. 72 (1), 33-39 (2001).
- West-Mays, J. A., Dwivedi, D. J. The keratocyte: corneal stromal cell with variable repair phenotypes. The International Journal of Biochemistry & Cell Biology. 38 (10), 1625-1631 (2006).
- Ahmed, F., House, R. J., Feldman, B. H. Corneal abrasions and corneal foreign bodies. Primary Care. 42 (3), 363-375 (2015).
- Ben-Eli, H., Erdinest, N., Solomon, A. Pathogenesis and complications of chronic eye rubbing in ocular allergy. Current Opinion in Allergy and Clinical Immunology. 19 (5), 526-534 (2019).
- Wilson, S. A., Last, A. Management of corneal abrasions. American Family Physician. 70 (1), 123-128 (2004).
- Nagata, M., et al. JBP485 promotes corneal epithelial wound healing. Scientific Reports. 5, 14776 (2015).
- Wang, X., et al. MANF promotes diabetic corneal epithelial wound healing and nerve regeneration by attenuating hyperglycemia-induced endoplasmic reticulum stress. Diabetes. 69 (6), 1264-1278 (2020).
- Li, F. J., et al. Evaluation of the AlgerBrush II rotating burr as a tool for inducing ocular surface failure in the New Zealand White rabbit. Experimental Eye Research. 147, 1-11 (2016).
- Kalha, S., Kuony, A., Michon, F. Corneal epithelial abrasion with ocular burr as a model for cornea wound healing. Journal of Visualized Experiments:JoVE. (137), e58071 (2018).
- Kalha, S., et al. Bmi1+ progenitor cell dynamics in murine cornea during homeostasis and wound healing. Stem Cells. 36 (4), 562-573 (2018).
- Park, M., et al. Visualizing the contribution of keratin-14(+) limbal epithelial precursors in corneal wound healing. Stem Cell Reports. 12 (1), 14-28 (2019).
- Kuony, A., et al. Ectodysplasin-A signaling is a key integrator in the lacrimal gland-cornea feedback loop. Development. 146 (14), (2019).
- Farrelly, O., et al. Two-photon live imaging of single corneal stem cells reveals compartmentalized organization of the limbal niche. Cell Stem Cell. 28 (7), 1233-1247 (2021).
- Ikkala, K., Michon, F., Stratoulias, V. Unilateral Zebrafish corneal injury induces bilateral cell plasticity supporting wound closure. Scientific Reports. , (2021).
- Ormerod, L. D., Abelson, M. B., Kenyon, K. R. Standard models of corneal injury using alkali-immersed filter discs. Investigative Ophthalmology & Visual Science. 30 (10), 2148-2153 (1989).
- Anderson, C., Zhou, Q., Wang, S. An alkali-burn injury model of corneal neovascularization in the mouse. Journal of visualized experiments: JoVE. (86), e51159 (2014).
- Choi, H., et al. Comprehensive modeling of corneal alkali injury in the rat eye. Current Eye Research. 42 (10), 1348-1357 (2017).
- Singh, P., Tyagi, M., Kumar, Y., Gupta, K. K., Sharma, P. D. Ocular chemical injuries and their management. Oman Journal of Ophthalmology. 6 (2), 83-86 (2013).
- Pal-Ghosh, S. BALB/c and C57BL6 mouse strains vary in their ability to heal corneal epithelial debridement wounds. Experimental Eye Research. 87 (5), 478-486 (2008).
- Chen, J. J., Tseng, S. C. Abnormal corneal epithelial wound healing in partial-thickness removal of limbal epithelium. Investigative Ophthalmology & Visual Science. 32 (8), 2219-2233 (1991).
- Xeroudaki, M., Peebo, B., Germundsson, J., Fagerholm, P., Lagali, N. RGTA in corneal wound healing after transepithelial laser ablation in a rabbit model: a randomized, blinded, placebo-controlled study. Acta Ophthalmologica. 94 (7), 685-691 (2016).
- . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio Available from: https://zfinorg/zf_info/zfbook/zfbk.html (2000)
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Xu, C., Volkery, S., Siekmann, A. F. Intubation-based anesthesia for long-term time-lapse imaging of adult zebrafish. Nature Protocols. 10 (12), 2064-2073 (2015).
- Crosson, C. E., Klyce, S. D., Beuerman, R. W. Epithelial wound closure in the rabbit cornea. A biphasic process. Investigative Ophthalmology & Visual Science. 27 (4), 464-473 (1986).
- Parlanti, P., et al. Axonal debris accumulates in corneal epithelial cells after intraepithelial corneal nerves are damaged: A focused Ion Beam Scanning Electron Microscopy (FIB-SEM) study. Experimental Eye Research. 194, 107998 (2020).
- Zhao, X. C., et al. The zebrafish cornea: structure and development. Investigative Ophthalmology & Visual Science. 47 (10), 4341-4348 (2006).
- Richardson, R., et al. Re-epithelialization of cutaneous wounds in adult zebrafish combines mechanisms of wound closure in embryonic and adult mammals. Development. 143 (12), 2077-2088 (2016).
- van Loon, A. P., Erofeev, I. S., Maryshev, I. V., Goryachev, A. B., Sagasti, A. Cortical contraction drives the 3D patterning of epithelial cell surfaces. The Journal of Cell Biology. 219 (3), (2020).
- Vihtelic, T. S., Hyde, D. R. Light-induced rod and cone cell death and regeneration in the adult albino zebrafish (Danio rerio) retina. Journal of Neurobiology. 44 (3), 289-307 (2000).
- Poss, K. D., Wilson, L. G., Keating, M. T. Heart regeneration in zebrafish. Science. 298 (5601), 2188-2190 (2002).
- Becker, T., Wullimann, M. F., Becker, C. G., Bernhardt, R. R., Schachner, M. Axonal regrowth after spinal cord transection in adult zebrafish. The Journal of Comparative Neurology. 377 (4), 577-595 (1997).
- Hu, X., et al. Sirt6 deficiency impairs corneal epithelial wound healing. Aging. 10 (8), 1932-1946 (2018).
- Ksander, B. R., et al. ABCB5 is a limbal stem cell gene required for corneal development and repair. Nature. 511 (7509), 353-357 (2014).
- Pan, Y. A., et al. Zebrabow: multispectral cell labeling for cell tracing and lineage analysis in zebrafish. Development. 140 (13), 2835-2846 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved