Method Article
Cicatrización de heridas corneales de pez cebra: de la abrasión al análisis de imágenes de cierre de heridas
En este artículo
Resumen
Este protocolo se centra en dañar la superficie ocular del pez cebra a través de la abrasión para evaluar el posterior cierre de la herida a nivel celular. Este enfoque explota una rebaba ocular para eliminar parcialmente el epitelio corneal y utiliza microscopía electrónica de barrido para rastrear los cambios en la morfología celular durante el cierre de la herida.
Resumen
Como la superficie transparente del ojo, la córnea es fundamental para una visión clara. Debido a su ubicación, este tejido es propenso a los insultos ambientales. De hecho, las lesiones oculares que se encuentran clínicamente con mayor frecuencia son las de la córnea. Si bien la cicatrización de heridas corneales se ha estudiado ampliamente en pequeños mamíferos (es decir, ratones, ratas y conejos), los estudios de fisiología corneal han descuidado otras especies, incluido el pez cebra, a pesar de que el pez cebra es un modelo de investigación clásico.
Este informe describe un método para realizar una abrasión corneal en el pez cebra. La herida se realiza in vivo en peces anestesiados utilizando una rebaba ocular. Este método permite una herida epitelial reproducible, dejando el resto del ojo intacto. Después de la abrasión, el cierre de la herida se controla en el transcurso de 3 h, después de lo cual la herida se reepiteliza. Mediante el uso de microscopía electrónica de barrido, seguida de procesamiento de imágenes, se puede investigar la forma de la célula epitelial y las protuberancias apicales para estudiar los diversos pasos durante el cierre de la herida epitelial corneal.
Las características del modelo de pez cebra permiten estudiar la fisiología del tejido epitelial y el comportamiento colectivo de las células epiteliales cuando el tejido es desafiado. Además, el uso de un modelo privado de la influencia de la película lagrimal puede producir nuevas respuestas con respecto a la respuesta corneal al estrés. Finalmente, este modelo también permite la delineación de los eventos celulares y moleculares involucrados en cualquier tejido epitelial sometido a una herida física. Este método se puede aplicar a la evaluación de la eficacia del fármaco en las pruebas preclínicas.
Introducción
Como la mayoría de los epitelios están en contacto con el entorno externo, son propensos a lesiones físicas, lo que los hace muy adecuados para el estudio de los procesos de curación de heridas. Entre los tejidos bien estudiados, la córnea es un modelo extremadamente útil en la investigación de los aspectos celulares y moleculares de la cicatrización de heridas. Como superficie externa transparente, proporciona protección física al ojo y es el primer elemento para enfocar la luz en la retina. Si bien la estructura y la composición celular de la retina difieren entre las especies1, estos elementos de la córnea son generalmente similares en todos los ojos de tipo cámara, independientemente de la especie.
La córnea se compone de tres capas principales2. La primera y más externa capa es el epitelio, que se renueva constantemente para garantizar su transparencia. La segunda capa es el estroma, que contiene células dispersas, llamadas queratocitos, dentro de una capa gruesa de fibras de colágeno estrictamente organizadas. La tercera capa más interna es el endotelio, que permite la difusión de nutrientes y líquidos desde la cámara anterior a las capas externas. Las células epiteliales y estromales interactúan a través de factores de crecimiento y citoquinas3. Esta interacción se pone de manifiesto por la rápida apoptosis y posterior proliferación de queratocitos tras lesión epitelial 4,5. En caso de una herida más profunda, como una punción, los queratocitos toman parte activa en el proceso de curación6.
Al estar en contacto con el entorno externo, las lesiones físicas corneales son comunes. Muchos de ellos son causados por pequeños objetos extraños7, como arena o polvo. El reflejo del frotamiento ocular puede dar lugar a abrasiones epiteliales extensas y remodelación corneal8. De acuerdo con el tamaño y la profundidad de la herida, estas lesiones físicas son dolorosas y tardan varios días en sanar9. Las características óptimas de cicatrización de heridas de un modelo facilitan la comprensión de los aspectos celulares y moleculares del cierre de heridas. Además, tales modelos también han demostrado ser útiles para probar nuevas moléculas con el potencial de acelerar la curación corneal, como se demostró previamente10,11.
El protocolo descrito aquí tiene como objetivo utilizar el pez cebra como un modelo relevante para estudiar la lesión física corneal. Este modelo es muy conveniente para los estudios de cribado farmacológico, ya que permite que las moléculas se agreguen directamente al agua del tanque y, por lo tanto, entren en contacto con una córnea curativa. Los detalles proporcionados aquí ayudarán a los científicos a realizar sus estudios sobre el modelo de pez cebra. La lesión in vivo se realiza con una rebaba ocular opaca. El impacto en las células epiteliales adyacentes o a distancia de él se puede analizar eliminando específicamente el epitelio corneal central. En los últimos años, numerosos informes se centraron en dicho método en la córnea de roedores 12,13,14,15,16,17; sin embargo, hasta la fecha, sólo un informe ha aplicado este método al pez cebra18.
Debido a su simplicidad, la herida física es útil para delinear el papel de las células epiteliales en el cierre de la herida. Otro modelo bien establecido de lesión corneal es la quemadura química, especialmente la quemadura alcalina 19,20,21. Sin embargo, tal enfoque daña indirectamente toda la superficie del ojo, incluida la córnea periférica y el estroma corneal19. De hecho, las quemaduras alcalinas potencialmente inducen úlceras corneales, perforaciones, opacificación epitelial y neovascularización rápida22, y el resultado incontrolable de las quemaduras alcalinas descalifica ese enfoque para los estudios generales de cicatrización de heridas. También se utilizan muchos otros métodos para investigar la cicatrización de heridas corneales de acuerdo con el enfoque particular del estudio en cuestión (por ejemplo, desbridamiento epitelial completo23, la combinación de lesiones químicas y mecánicas para heridas de espesor parcial24, ablación con láser excímero para heridas que se extienden hasta el estroma25). El uso de una rebaba ocular restringe el punto focal a la respuesta epitelial a la herida y proporciona una herida altamente reproducible.
Al igual que con cada método de infligir heridas, el uso de una rebaba ocular tiene ventajas y desventajas. La principal desventaja es que la respuesta es en su mayoría epitelial, no refleja perfectamente las abrasiones observadas en el entorno clínico. Sin embargo, este método tiene numerosas ventajas, incluida la facilidad con la que se puede configurar y realizar, su precisión, su reproducibilidad y el hecho de que no es invasivo, lo que lo convierte en un método bien tolerado por los animales.
Protocolo
Todos los experimentos fueron aprobados por la junta nacional de experimentación con animales.
1. Preparativos
- Prepare la solución madre de tricaína utilizada para la anestesiacon 26 de anticipación (solución madre al 0,4% utilizada en este protocolo). Use guantes y mantenga los materiales en una campana de humos siempre que sea posible.
- Para 50 ml de una solución al 0,4%, pesar 200 mg de polvo de tricaína en un tubo de 50 ml. Disolver el polvo en aproximadamente 45 ml de agua de doble destilación.
- Ajuste el pH de la solución madre de tricaína a 7 con 1 M Tris (pH 8.8, ~ 1.25 ml). Agregue la solución de Tris a la culata de tricaína en alícuotas, mezcle bien la cepa después de cada alícuota y verifique el pH después de cada adición de Tris.
- Antes del experimento, prepare una solución de trabajo al 0,02% de tricaína.
- Descongelar 2 ml de solución madre al 0,4% y añadir a 40 ml de agua del sistema (concentración final 0,02%). Coloque la solución en un recipiente pequeño.
- Antes del experimento, prepare el agua de recuperación que contiene analgésico. Use guantes y mantenga los materiales en la campana de humos siempre que sea posible.
- Para un litro de agua de recuperación, pese 2,5 mg de polvo de clorhidrato de lidocaína y disuelva en agua dulce del sistema. Compruebe el pH y ajuste a 7 si es necesario.
- Antes del experimento, prepare la solución fijadora (glutaraldehído al 2,5% en solución de fosfato de sodio (Na-PO4) al 0,1 M a pH 7,4). Use guantes y mantenga los materiales en una campana de humos.
- Para 10 ml de la solución de fijación, pipetear 5 ml de 0,2 m de Na-PO4 en un tubo. Añadir 0,5 mL de glutaraldehído al 50%, y añadir agua doble destilada para obtener el volumen final de 10 mL. Proteja la solución de la luz y manténgala en hielo o en el refrigerador antes de usarla.
NOTA: Si las muestras deben recogerse durante varias horas después de la herida, prepare la solución de fijación justo antes de su uso.
- Para 10 ml de la solución de fijación, pipetear 5 ml de 0,2 m de Na-PO4 en un tubo. Añadir 0,5 mL de glutaraldehído al 50%, y añadir agua doble destilada para obtener el volumen final de 10 mL. Proteja la solución de la luz y manténgala en hielo o en el refrigerador antes de usarla.
- Preparar el equipo para la herida (Figura 1).
- Llene los tanques de recuperación o recipientes más pequeños con agua del sistema.
- Tenga la rebaba oftálmica lista. Compruebe que la punta de la rebaba esté limpia. Si es necesario, retire los restos celulares con un hisopo de algodón húmedo.
- Haga una incisión en el costado de una esponja suave y humedezca la esponja con agua del sistema. Coloque la esponja en la base/etapa de un microscopio de disección. Asegúrese de suficiente espacio de trabajo para usar la rebaba y suficiente iluminación desde los lados y / o por encima para ver la superficie del ojo correctamente.
2. Anestesia
- Transfiera un pez del tanque a la solución de tricaína al 0.02% con una red lo más suavemente posible.
- Monitoree la anestesia, verificando la falta de respuesta al estímulo mecánico ligero.
NOTA: Para una anestesia consistente, se usa una exposición de 2 minutos a la tricaína antes de la abrasión con peces AB adultos de tipo silvestre. Con peces de otros antecedentes genéticos, puede ser necesaria una duración diferente.
3. Abrasión
- Coloque suavemente el pescado anestesiado con una cuchara en la incisión en la esponja, con la cabeza que sobresale de la superficie de la esponja.
- Encienda la rebaba y enfoque la vista del microscopio en la superficie del ojo.
- Acérquese cuidadosamente a la superficie del ojo con la punta de la rebaba. Al tocar la superficie del ojo, comience a mover la punta de la rebaba en la superficie del ojo con movimiento circular. Evite el movimiento repentino, ya que podría provocar que el ojo se incline en la cavidad y la punta de la rebaba se deslice.
- Cuando se realice la abrasión, coloque cuidadosamente el pez en el agua del sistema que contiene el analgésico para su recuperación.
- Limpie la rebaba inmediatamente después de su uso con un hisopo de algodón húmedo.
4. Recogida de muestras
- En el punto de tiempo deseado, recoja el pescado con una red y colóquelo en una solución de tricaína al 0,02%. Mantenga al animal en la solución hasta que el movimiento opercular haya cesado por completo y el pez no reaccione al tacto.
- Coloque el pescado en una placa de Petri con una cuchara y sosténgalo con pinzas. Decapita a los peces con tijeras de disección. Evite hacer rasguños en la superficie del ojo al manipular la muestra.
- Coloque el tejido en un tubo de muestra que contenga 0,1 M de Na-PO4.
- Enjuague el tejido reemplazando el Na-PO4 de 0.1 M con un tampón limpio para que no quede sangre en la solución.
5. Procesamiento de muestras para microscopía electrónica
- Fije el tejido en glutaraldehído al 2,5%/0,1 M Na-PO4 (pH 7,4) durante ~24 h a +4 °C. Mantenga la muestra en un soporte de muestra giratorio / agitado para garantizar una fijación adecuada.
- Retire la solución fijadora y enjuague la muestra varias veces con 0,1 M de Na-PO4.
- Diseccionar la muestra en este punto.
- Coloque la muestra en una gota de 0,1 M Na-PO4 en una placa de disección. Si se deben tomar imágenes de ambos ojos del mismo pez, corte la muestra de la cabeza en dos con tijeras de disección finas.
- Alternativamente, recoja los ojos solo colocando cuidadosamente las puntas de las pinzas finas en la cuenca del ojo desde el lado del ojo, teniendo especial cuidado de no rascar la superficie del ojo. Luego, saque el ojo de la cuenca.
- Transfiera la muestra disecada a un tubo que contenga 0,1 M de Na-PO4. Asegúrese de que no haya tejido adicional en el tubo de muestra, ya que puede adherirse a la parte superior del ojo durante el procesamiento de la muestra.
- Conservar la muestra en 0,1 M Na-PO4 (máximo una semana) a +4 °C.
- Procese las muestras para imágenes de microscopía electrónica.
- Coloque las muestras en tetróxido de osmio al 2% en tampón na-PO4 de 0,1 M durante 1 h a temperatura ambiente (RT).
- Lave las muestras 3 veces durante 5 minutos cada lavado en 0.1 M Na-PO4 en RT.
- Deshidrate las muestras sucesivamente en etanol al 30%, 50% y 70% durante 1 h en cada solución a RT.
- Sumergir las muestras en etanol al 96% durante 2-3 h en RT.
- A continuación, incubar las muestras dos veces en etanol al 100%, primero durante 1 h y luego en etanol fresco al 100% durante la noche a +4 °C.
- Someta las muestras a 30 ciclos en un secador automatizado de puntos críticos.
- Incrustar y recubrir con platino las muestras.
- Coloque una pestaña adhesiva en un soporte. Si la muestra debe estar marcada en la parte superior del soporte, deje un trozo de papel de cubierta de pestaña en la pestaña y escriba el ID de muestra en el papel.
- Coloque el soporte con la pestaña en la base de un microscopio de disección.
- Coloque suavemente la muestra de tejido en el soporte con pinzas finas, la córnea hacia arriba.
- Cubra la muestra con platino utilizando el dispositivo apropiado. Después del recubrimiento, guarde las muestras a temperatura ambiente hasta la obtención de imágenes.
6. Imágenes (Figura 2)
- Opere los dispositivos según lo aconsejado en el manual del usuario y por expertos en imágenes.
- Adquiera imágenes de la ampliación deseada y utilice imágenes de 2.000-2.500x para el análisis.
- Ajuste el brillo y el contraste para que no haya áreas sobreexpuestas en la imagen, y los bordes celulares y las microneveras se vean lo más claramente posible.
NOTA: La posición y el ángulo del tejido afectan la configuración de brillo y contraste. Es posible que deban ajustarse de una muestra a otra y entre diferentes regiones del tejido.
7. Medición de la forma, el tamaño y el patrón de microneveras de la celda
- Abra la imagen TIFF en Fiji ImageJ 1.5327. Establezca la escala utilizando la barra de escala de la imagen: cree una línea de tamaño igual a la barra de escala con la herramienta Línea . Seleccione Analizar | Establezca la escala y escriba la distancia conocida. Abra el administrador de ROI desde el | Analizar Menú Herramientas .
- Para conocer el tamaño y la redondez de las celdas, seleccione Analizar | Establecer medidas | Descriptores de formas. Utilice la herramienta Lupa para ver las celdas bajo aumento. Seleccione celdas con la herramienta Polígono y agregue cada selección al administrador de ROI. Finalmente, mida las celdas seleccionadas y guarde la medición.
- Análisis de microneveras (Figura 3 y Figura 4)
- Asegúrese de que la imagen está en formato de 8 bits desde el | Escriba menú.
- Seleccione una celda con la herramienta Polígono y borre el fondo de editar | Despejar por fuera.
- Suavizar la imagen de una a tres veces seleccionando Procesar | Suaviza y ajusta el brillo y el contraste de la imagen | Ajustar | Brillo/Contraste para que las microneveras destaquen lo más claramente posible.
- Convolver la imagen desde Process | Filtros | Convolve, convertir en binario desde Process | | binaria Hacer binario y esqueletizar la imagen en blanco y negro seleccionando Procesar | | binaria Esqueletizar.
- Utilice la función Analizar esqueleto en el | Analizar Menú esqueleto para medir los parámetros de microridge y guardar los valores.
NOTA: En SEM, las imágenes individuales pueden diferir en brillo y contraste. Por lo tanto, los pasos en el análisis pueden necesitar ajustes de imagen a imagen.
Resultados
Este estudio describe un método que utiliza una rebaba oftálmica en experimentos de curación de heridas corneales de pez cebra. El método se modifica a partir de estudios previos en ratones, donde se demostró que la rebaba elimina las capas de células epiteliales de manera eficiente13. Los desafíos en la herida corneal del pez cebra incluyen el tamaño relativamente pequeño del ojo y, en el caso de experimentos que consumen mucho tiempo, la necesidad de mantener un flujo constante de agua a través de las branquias (como lo describen Xu y sus colegas28). Los principales beneficios de este método son su simplicidad y velocidad. Se utiliza un microscopio de disección estándar para el uso controlado de la rebaba (Figura 1). Como el procedimiento es de corta duración (aproximadamente 3 minutos desde el inicio de la anestesia), los peces se recuperan bien de la manipulación y no se necesita equipo adicional para el mantenimiento de la anestesia y el suministro de oxígeno.
Hay varias formas de visualizar la herida corneal. Este protocolo utiliza microscopía electrónica de barrido (SEM, Figura 2), que tiene una larga historia de uso en estudios corneales29,30. Aunque este enfoque no permite una evaluación de las capas inferiores del epitelio, proporciona un método fácil para estimar la velocidad de curación de la herida y comparar las superficies corneales de diferentes regiones del ojo. A las 3 h después de la herida, mientras que el área de la herida está cerrada (Figura 2), el sitio donde se unen los bordes de la herida permanece visible (Figura 2).
Las células superficiales de la córnea del pez cebra contienen microneveras pronunciadas31. Recientemente, un estudio informó que estas estructuras se perdieron en células alargadas adyacentes a heridas en la piel del pez cebra32. Sin embargo, los resultados presentados muestran que en el epitelio corneal desgastado, se pueden observar microneveras en algunas células alargadas junto al sitio de la herida (Figura 4B). En algunas regiones periféricas, las microneveras se pierden desde el centro de la célula (Figura 4C, D). Para un análisis más detallado, se cuantifican el área y la redondez de las células apicales, además de la cantidad de microneveras y la longitud promedio en la ImagenJ27 (Figura 3 y Figura 4E-H).
El análisis de microridge se realiza utilizando la función Esqueleto (modificada de van Loon y colegas33). Una comparación entre las dos regiones periféricas (Figura 4A (regiones C y D), Figura 4C y Figura 4D) revela que las células de la Figura 4D son más alargadas (lo que indica reordenamientos celulares como reacción a la herida) y tienen microneveras promedio más cortas que las células de la Figura 4C. Este resultado sugiere que el cambio en la forma celular se correlaciona con la modificación de la micronega y enfatiza la heterogeneidad dentro del epitelio corneal en la respuesta de la herida.
La medición del área celular apical y la redondez en imágenes SEM es una forma simple y reproducible de obtener datos cuantitativos sobre la apariencia celular en diferentes regiones de la córnea. Aunque limitado a 2D, este enfoque ayuda a adquirir una comprensión general de la dinámica y la velocidad de los reordenamientos celulares durante el cierre de la herida. Las imágenes SEM se utilizan para analizar los patrones de microneveras en la superficie de la célula apical. El procesamiento de imágenes descrito aquí da una aproximación de los cambios en los parámetros de microridge, que sería tedioso medir a mano.

Figura 1: La configuración para la abrasión corneal. (A) Es necesario un microscopio de disección para la abrasión controlada en el pequeño ojo de pez cebra. (B) La esponja ayuda a estabilizar los peces anestesiados durante el procedimiento. (C) El pescado se anestesia en una placa de Petri, y el animal anestesiado se transfiere a la esponja con una cuchara pequeña. Se utiliza una rebaba ocular con una punta de 0,5 mm para desgastar la córnea. Haga clic aquí para ver una versión más grande de esta figura.
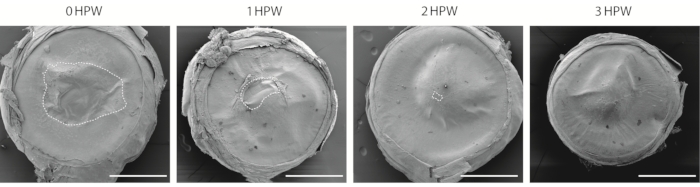
Figura 2: Visualización de la córnea herida con microscopía electrónica de barrido. La visión general de la córnea desgastada recolectada a las 0, 1, 2 o 3 h después de la herida (HPW). El contorno discontinuo indica el borde de la herida. Barras de escala = 500 μm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Un ejemplo de la modificación de la imagen antes de la medición de microridges. Aunque no es una réplica exacta de la superficie celular original, el patrón esqueletizado final captura las diferencias entre el centro celular y la periferia. Barra de escala = 10 μm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Una comparación del área celular apical, la redondez y los valores de micronevera entre dos regiones periféricas después de la abrasión corneal. (A) Una visión general del ojo herido. Los cuadros indican la ubicación de las imágenes de mayor aumento (en B, C y D). (C, D) Las celdas seleccionadas para el análisis del descriptor de forma se marcan con un contorno verde. (E, F) Valores de área celular apical (E) y redondez (F) de celdas seleccionadas. (G, H) Longitud total (G) de microridge y longitud media (H) de las mismas células. Los grupos se compararon estadísticamente con una prueba t de dos colas (*p ≤ 0,05, **p ≤ 0,01) Barras de escala = 500 μm en A, 50 μm en B, C y D. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Las lesiones físicas corneales son la causa más común de visitas de pacientes oftalmológicos al hospital. Por lo tanto, es importante establecer modelos relevantes para el estudio de diferentes aspectos de la fisiopatología corneal. Hasta ahora, el ratón es el modelo más utilizado para el estudio de la cicatrización de heridas corneales. Sin embargo, agregar gotas para los ojos en los ojos heridos murinos para validar el impacto de medicamentos específicos en la cicatrización de heridas corneales puede ser difícil. En este sentido, el modelo de pez cebra es particularmente útil para el cribado farmacológico de moléculas que afectan a la cicatrización de heridas corneales. El método descrito aquí es muy similar al descrito para el ratón13.
Sin embargo, hay que tener en cuenta dos puntos específicos de diferencia. En primer lugar, el uso de una rebaba oftálmica requiere práctica para garantizar la reproducibilidad de la herida, particularmente con respecto a la presión ejercida sobre el ojo, que es crítica para una abrasión adecuada. Además, la punta abrasiva debe cambiarse cuando el epitelio ya no se elimina de manera eficiente. En segundo lugar, si bien la estructura y morfología de la córnea del pez cebra son similares a otras córneas31, este animal posee capacidades regenerativas que no tienen paralelo en los organismos mamíferos 34,35,36. Mientras que el cierre de la herida en el ratón dura 48-72 h 11,14,37, se informa una línea de tiempo de 3 h para el pez cebra. Debido a las similitudes estructurales y moleculares, el comportamiento celular inducido por una herida física corneal es probablemente similar en la mayoría de los vertebrados. Sin embargo, la rápida respuesta en el pez cebra probablemente esté guiada por un mecanismo regenerativo avanzado que es específico de ese animal.
El protocolo descrito utiliza SEM para rastrear el cierre de heridas. Muchos otros estudios han utilizado la microscopía de fluorescencia para rastrear este proceso 15,17,38. Sin embargo, el uso de SEM facilita el análisis de la modificación de la forma celular después de la abrasión epitelial. La desventaja de esa tecnología es que los pasos de estratificación no se pueden rastrear, ya que SEM solo permite la obtención de imágenes de la capa más externa. Para estudiar el epitelio en 3D durante la curación corneal completa, se deben utilizar modelos fluorescentes, como Zebrabow39, o inmunoetiquetado.
El uso del pez cebra como modelo de cicatrización de heridas corneales mejora el alcance de la investigación, ya que permite la aplicación de numerosas herramientas moleculares disponibles, como líneas de peces modificadas genéticamente, morfolinos y cribado químico, para ampliar significativamente la posible gama de estudios de curación de heridas corneales. Además, el tamaño de los ojos de pez cebra permite el desarrollo de nuevas estrategias de imagen para estudiar la dinámica de las células epiteliales con mayor detalle que con los ojos murinos.
El objetivo principal de este informe no es solo adaptar el enfoque de la herida física de la córnea al modelo del pez cebra, sino también demostrar que el uso de nuevos modelos permite hacer y responder nuevas preguntas y apunta a nuevas formas de investigar los fenómenos biológicos fundamentales. Estas ventajas serán en última instancia beneficiosas para los pacientes.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Los autores agradecen a Pertti Panula por el acceso a la unidad de pez cebra y a Henri Koivula por la orientación y ayuda con los experimentos del pez cebra. Esta investigación fue apoyada por la Academia de Finlandia, la Fundación Jane y Aatos Erkko, la Fundación Cultural Finlandesa y el Programa ATIP-Avenir. Las imágenes se realizaron en la unidad de Microscopía Electrónica y la Unidad de Microscopía de Luz, Instituto de Biotecnología, con el apoyo de HiLIFE y Biocenter Finland.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.1M Na-PO4 (sodium phosphate buffer), pH 7.4 | in-house | Solution is prepared from 1M sodium phosphate buffer (1M Na2HPO4 adjusted to pH 7.4 with 1M NaH2PO4). | |
| 0.2M Na-PO4 (sodium phosphate buffer), pH 7.4 | in-house | Solution is prepared from 1M sodium phosphate buffer (1M Na2HPO4 adjusted to pH 7.4 with 1M NaH2PO4). | |
| 0.5mm burr tips | Alger Equipment Company | BU-5S | |
| 1M Tris, pH 8.8 | in-house | ||
| adhesive tabs | Agar Scientific | G3347N | |
| Algerbrush burr, Complete instrument | Alger Equipment Company | BR2-5 | |
| Cotton swaps | Heinz Herenz Hamburg | 1030128 | |
| Dissecting plate | in-house | ||
| Dissecting tools | Fine Science Tools | ||
| double-distilled water | in-house | ||
| Eppedorf tubes, 2ml | any provider | ||
| Ethyl 3-aminobenzoate methanesulfonate salt | Sigma | A5040 | Caution: causes irritation. |
| Glutaraldehyde, 50% aqueous solution, grade I | Sigma | G7651 | Caution: toxic. |
| Lidocaine hydrochloride | Sigma | L5647 | Caution: toxic. |
| mounts | Agar Scientific | G301P | |
| Petri dish | Thermo Scientific | 101VR20 | |
| pH indicator strips | Macherey-Nagel | 92110 | |
| Plastic spoons | any provider | ||
| Plastic tubes, 15 ml | Greiner Bio-One | 188271 | |
| Plastic tubes, 50 ml | Greiner Bio-One | 227261 | |
| Scanning electron microscope | FEI | Quanta 250 FEG | |
| Soft sponge | any provider | ||
| Sputter coater | Quorum Technologies | GQ150TS | |
| Stereomicroscope | Leica |
Referencias
- Baden, T., Euler, T., Berens, P. Understanding the retinal basis of vision across species. Nature Reviews.Neuroscience. 21 (1), 5-20 (2020).
- Nishida, T., Saika, S., Morishige, N., Manis, M. J., Holland, E. J. Cornea and sclera: Anatomy and physiology. Cornea: Fundamentals, diagnosis and management, 4th ed. , 1-22 (2017).
- Wilson, S. E., Liu, J. J., Mohan, R. R. Stromal-epithelial interactions in the cornea. Progress in Retinal and Eye Research. 18 (3), 293-309 (1999).
- Wilson, S. E., et al. Epithelial injury induces keratocyte apoptosis: hypothesized role for the interleukin-1 system in the modulation of corneal tissue organization and wound healing. Experimental Eye Research. 62 (4), 325-327 (1996).
- Zieske, J. D., Guimaraes, S. R., Hutcheon, A. E. Kinetics of keratocyte proliferation in response to epithelial debridement. Experimental Eye Research. 72 (1), 33-39 (2001).
- West-Mays, J. A., Dwivedi, D. J. The keratocyte: corneal stromal cell with variable repair phenotypes. The International Journal of Biochemistry & Cell Biology. 38 (10), 1625-1631 (2006).
- Ahmed, F., House, R. J., Feldman, B. H. Corneal abrasions and corneal foreign bodies. Primary Care. 42 (3), 363-375 (2015).
- Ben-Eli, H., Erdinest, N., Solomon, A. Pathogenesis and complications of chronic eye rubbing in ocular allergy. Current Opinion in Allergy and Clinical Immunology. 19 (5), 526-534 (2019).
- Wilson, S. A., Last, A. Management of corneal abrasions. American Family Physician. 70 (1), 123-128 (2004).
- Nagata, M., et al. JBP485 promotes corneal epithelial wound healing. Scientific Reports. 5, 14776 (2015).
- Wang, X., et al. MANF promotes diabetic corneal epithelial wound healing and nerve regeneration by attenuating hyperglycemia-induced endoplasmic reticulum stress. Diabetes. 69 (6), 1264-1278 (2020).
- Li, F. J., et al. Evaluation of the AlgerBrush II rotating burr as a tool for inducing ocular surface failure in the New Zealand White rabbit. Experimental Eye Research. 147, 1-11 (2016).
- Kalha, S., Kuony, A., Michon, F. Corneal epithelial abrasion with ocular burr as a model for cornea wound healing. Journal of Visualized Experiments:JoVE. (137), e58071 (2018).
- Kalha, S., et al. Bmi1+ progenitor cell dynamics in murine cornea during homeostasis and wound healing. Stem Cells. 36 (4), 562-573 (2018).
- Park, M., et al. Visualizing the contribution of keratin-14(+) limbal epithelial precursors in corneal wound healing. Stem Cell Reports. 12 (1), 14-28 (2019).
- Kuony, A., et al. Ectodysplasin-A signaling is a key integrator in the lacrimal gland-cornea feedback loop. Development. 146 (14), (2019).
- Farrelly, O., et al. Two-photon live imaging of single corneal stem cells reveals compartmentalized organization of the limbal niche. Cell Stem Cell. 28 (7), 1233-1247 (2021).
- Ikkala, K., Michon, F., Stratoulias, V. Unilateral Zebrafish corneal injury induces bilateral cell plasticity supporting wound closure. Scientific Reports. , (2021).
- Ormerod, L. D., Abelson, M. B., Kenyon, K. R. Standard models of corneal injury using alkali-immersed filter discs. Investigative Ophthalmology & Visual Science. 30 (10), 2148-2153 (1989).
- Anderson, C., Zhou, Q., Wang, S. An alkali-burn injury model of corneal neovascularization in the mouse. Journal of visualized experiments: JoVE. (86), e51159 (2014).
- Choi, H., et al. Comprehensive modeling of corneal alkali injury in the rat eye. Current Eye Research. 42 (10), 1348-1357 (2017).
- Singh, P., Tyagi, M., Kumar, Y., Gupta, K. K., Sharma, P. D. Ocular chemical injuries and their management. Oman Journal of Ophthalmology. 6 (2), 83-86 (2013).
- Pal-Ghosh, S. BALB/c and C57BL6 mouse strains vary in their ability to heal corneal epithelial debridement wounds. Experimental Eye Research. 87 (5), 478-486 (2008).
- Chen, J. J., Tseng, S. C. Abnormal corneal epithelial wound healing in partial-thickness removal of limbal epithelium. Investigative Ophthalmology & Visual Science. 32 (8), 2219-2233 (1991).
- Xeroudaki, M., Peebo, B., Germundsson, J., Fagerholm, P., Lagali, N. RGTA in corneal wound healing after transepithelial laser ablation in a rabbit model: a randomized, blinded, placebo-controlled study. Acta Ophthalmologica. 94 (7), 685-691 (2016).
- . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio Available from: https://zfinorg/zf_info/zfbook/zfbk.html (2000)
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Xu, C., Volkery, S., Siekmann, A. F. Intubation-based anesthesia for long-term time-lapse imaging of adult zebrafish. Nature Protocols. 10 (12), 2064-2073 (2015).
- Crosson, C. E., Klyce, S. D., Beuerman, R. W. Epithelial wound closure in the rabbit cornea. A biphasic process. Investigative Ophthalmology & Visual Science. 27 (4), 464-473 (1986).
- Parlanti, P., et al. Axonal debris accumulates in corneal epithelial cells after intraepithelial corneal nerves are damaged: A focused Ion Beam Scanning Electron Microscopy (FIB-SEM) study. Experimental Eye Research. 194, 107998 (2020).
- Zhao, X. C., et al. The zebrafish cornea: structure and development. Investigative Ophthalmology & Visual Science. 47 (10), 4341-4348 (2006).
- Richardson, R., et al. Re-epithelialization of cutaneous wounds in adult zebrafish combines mechanisms of wound closure in embryonic and adult mammals. Development. 143 (12), 2077-2088 (2016).
- van Loon, A. P., Erofeev, I. S., Maryshev, I. V., Goryachev, A. B., Sagasti, A. Cortical contraction drives the 3D patterning of epithelial cell surfaces. The Journal of Cell Biology. 219 (3), (2020).
- Vihtelic, T. S., Hyde, D. R. Light-induced rod and cone cell death and regeneration in the adult albino zebrafish (Danio rerio) retina. Journal of Neurobiology. 44 (3), 289-307 (2000).
- Poss, K. D., Wilson, L. G., Keating, M. T. Heart regeneration in zebrafish. Science. 298 (5601), 2188-2190 (2002).
- Becker, T., Wullimann, M. F., Becker, C. G., Bernhardt, R. R., Schachner, M. Axonal regrowth after spinal cord transection in adult zebrafish. The Journal of Comparative Neurology. 377 (4), 577-595 (1997).
- Hu, X., et al. Sirt6 deficiency impairs corneal epithelial wound healing. Aging. 10 (8), 1932-1946 (2018).
- Ksander, B. R., et al. ABCB5 is a limbal stem cell gene required for corneal development and repair. Nature. 511 (7509), 353-357 (2014).
- Pan, Y. A., et al. Zebrabow: multispectral cell labeling for cell tracing and lineage analysis in zebrafish. Development. 140 (13), 2835-2846 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados