Method Article
斑马鱼角膜伤口愈合:从磨损到伤口闭合成像分析
摘要
该协议的重点是通过磨损破坏斑马鱼的眼表面,以评估细胞水平上随后的伤口闭合。这种方法利用眼毛刺来部分去除角膜上皮,并使用扫描电子显微镜来跟踪伤口闭合过程中细胞形态的变化。
摘要
作为眼睛的透明表面,角膜有助于清晰的视力。由于其位置,这种组织容易受到环境侮辱。事实上,临床上最常遇到的眼部损伤是角膜损伤。虽然角膜伤口愈合已经在小型哺乳动物(即小鼠,大鼠和兔子)中进行了广泛的研究,但角膜生理学研究忽略了其他物种,包括斑马鱼,尽管斑马鱼是一种经典的研究模型。
本报告描述了一种对斑马鱼进行角膜擦伤的方法。伤口在 体内 使用眼毛刺在麻醉鱼身上进行。这种方法允许可重复的上皮伤口,使眼睛的其余部分完好无损。擦伤后,在3小时的过程中监测伤口闭合,之后伤口再上皮化。通过使用扫描电子显微镜,然后进行图像处理,可以研究上皮细胞的形状和顶端突起,以研究角膜上皮伤口闭合过程中的各个步骤。
斑马鱼模型的特征允许研究上皮组织生理学和上皮细胞在组织受到挑战时的集体行为。此外,使用剥夺泪膜影响的模型可以产生关于角膜对压力反应的新答案。最后,该模型还允许描绘受物理伤口的任何上皮组织中涉及的细胞和分子事件。该方法可应用于临床前试验中药物有效性的评价。
引言
由于大多数上皮细胞与外部环境接触,它们容易受到身体伤害,因此非常适合研究伤口愈合过程。在经过充分研究的组织中,角膜是研究伤口愈合的细胞和分子方面的一个非常有用的模型。作为一个透明的外表面,它为眼睛提供物理保护,是将光线聚焦到视网膜上的第一个元素。虽然视网膜的结构和细胞组成在物种1之间不同,但角膜的这些元素在所有相机型眼睛中通常都是相似的,无论物种如何。
角膜由三个主要层组成2。第一层和最外层是上皮,它不断更新以确保其透明度。第二层是基质,它含有分散的细胞,称为角质细胞,在一层厚厚的严格组织的胶原纤维中。第三层也是最内层是内皮,它允许营养物质和液体从前室扩散到外层。上皮细胞和基质细胞通过生长因子和细胞因子相互作用3。这种相互作用通过上皮损伤后角质细胞的快速凋亡和随后的增殖4,5而突出。在更深的伤口的情况下,例如穿刺,角质细胞积极参与愈合过程6。
与外部环境接触,角膜身体损伤很常见。其中许多是由小异物7引起的,例如沙子或灰尘。揉眼的反射可导致广泛的上皮擦伤和角膜重塑8.根据伤口的大小和深度,这些身体伤害是痛苦的,需要几天才能愈合9。模型的最佳伤口愈合特性有助于理解伤口闭合的细胞和分子方面。此外,这些模型也被证明可用于测试具有加速角膜愈合潜力的新分子,如前所述10,11。
这里描述的方案旨在使用斑马鱼作为研究角膜物理损伤的相关模型。该模型对于药理学筛选研究非常方便,因为它允许将分子直接添加到罐水中,从而与愈合的角膜接触。这里提供的细节将帮助科学家对斑马鱼模型进行研究。体内损伤是用暗沉的眼毛刺进行的。对毗邻或远离它的上皮细胞的影响可以通过特异性去除中央角膜上皮来分析。近年来,许多关于啮齿动物角膜的方法的报道集中在12,13,14,15,16,17上;然而,到目前为止,只有一份报告将这种方法应用于斑马鱼18。
由于其简单性,物理伤口有助于描绘上皮细胞在伤口闭合中的作用。角膜损伤的另一个公认模型是化学烧伤,特别是碱烧伤19,20,21。然而,这种方法间接损害整个眼表面,包括外周角膜和角膜基质19。事实上,碱性烧伤可能诱发角膜溃疡、穿孔、上皮混浊和快速新生血管形成22,碱烧伤的不可控结果使该方法不符合一般伤口愈合研究的资格。根据所讨论研究的特定重点,还使用许多其他方法来研究角膜伤口愈合(例如,完全上皮清创23,部分厚度伤口24的化学和机械损伤的组合,延伸到基质25的伤口的准分子激光消融)。眼毛刺的使用将焦点限制在对伤口的上皮反应上,并提供高度可重复的伤口。
与每种伤口施加方法一样,使用眼毛刺有优点和缺点。主要缺点是反应大多是上皮性的,它不能完美地反映临床环境中看到的擦伤。然而,这种方法具有许多优点,包括易于设置和执行,其精度,可重复性以及它是非侵入性的事实,使其成为动物耐受性良好的方法。
研究方案
所有实验均获得国家动物实验委员会的批准。
1. 准备工作
- 提前准备用于麻醉的三卡因储备溶液26 (本方案中使用的0.4%储备溶液)。尽可能戴上手套并将材料放在通风橱中。
- 对于50 mL 0.4%溶液,称取200mg三卡因粉末进入50mL管中。将粉末溶解在约45 mL双蒸馏水中。
- 用1 M Tris(pH 8.8,〜1.25 mL)将三卡因储备溶液的pH值调节至7。将Tris溶液以等分试样加入三卡因储备中,每次等分试样后彻底混合储备液,并在每次加入Tris后检查pH值。
- 在实验之前,准备0.02%的三卡因工作溶液。
- 解冻2毫升0.4%储备溶液,加入40毫升系统水(终浓度0.02%)。将溶液放在一个小容器中。
- 实验前,准备含有镇痛药的回收水。尽可能戴上手套并将材料放在通风橱中。
- 对于一升回收水,称取2.5mg盐酸利多卡因粉末并将其溶解在新鲜系统水中。检查pH值,如有必要,调整至7。
- 实验前,制备固色液(2.5%戊二醛在pH7.4的0.1M磷酸钠(Na-PO 4)溶液中)。戴上手套并将材料放在通风橱中。
- 对于10 mL固定溶液,将5 mL 0.2 M Na-PO4 移液到管中。加入0.5 mL的50%戊二醛,加入双蒸馏水,得到最终体积为10 mL。保护溶液免受光照,并在使用前将其保存在冰上或冰箱中。
注意:如果受伤后必须收集样品数小时,请在使用前准备固定溶液。
- 对于10 mL固定溶液,将5 mL 0.2 M Na-PO4 移液到管中。加入0.5 mL的50%戊二醛,加入双蒸馏水,得到最终体积为10 mL。保护溶液免受光照,并在使用前将其保存在冰上或冰箱中。
- 准备受伤设备(图1)。
- 在回收罐或较小的容器中装满系统水。
- 准备好眼部毛刺。检查毛刺尖端是否干净。如果需要,用湿棉签去除细胞碎片。
- 在柔软海绵的侧面做一个切口,并用系统水润湿海绵。将海绵放在解剖显微镜的底座/载物台上。确保有足够的工作空间来使用毛刺,并从侧面和/或上方获得足够的照明,以正确看到眼睛表面。
2. 麻醉
- 将鱼从水箱中转移到0.02%三卡因溶液中,尽可能轻柔地用网。
- 监测麻醉,检查对轻机械刺激缺乏反应。
注意:为了保持麻醉,在成年野生型AB鱼擦伤之前,先暴露于三卡因2分钟。对于其他遗传背景的鱼,可能需要不同的持续时间。
3. 磨损
- 用勺子轻轻地将麻醉的鱼放入海绵上的切口中,头部从海绵表面突出。
- 打开毛刺,将显微镜视图聚焦到眼图上。
- 用毛刺尖端小心地接近眼表。触摸眼表面时,开始以圆周运动在眼表面上移动毛刺尖端。避免突然移动,因为这可能导致眼睛在眼窝中倾斜,毛刺尖端滑落。
- 擦伤完成后,小心地将鱼放入含有镇痛剂的系统水中以进行恢复。
- 使用后立即用湿棉签清洁毛刺。
4. 采集样品
- 在所需的时间点,用网将鱼捡起来,并将其放入0.02%三卡因溶液中。将动物保持在溶液中,直到眼球运动完全停止,鱼对触摸没有反应。
- 用勺子将鱼放在培养皿上,然后用镊子握住。用解剖剪刀将鱼斩首。处理样品时,避免在眼部表面划伤。
- 将组织放入含有0.1M Na-PO4的样品管中。
- 通过将0.1 M Na-PO4 替换为干净的缓冲液来冲洗组织,以便溶液中没有血液残留。
5. 电子显微镜样品处理
- 在+4°C下将组织固定在2.5%戊二醛/ 0.1M Na-PO4 (pH 7.4)中约24小时。 将样品保存在旋转/振荡的样品架上,以确保正确固定。
- 取出固定溶液,并用0.1 M Na-PO4冲洗样品几次。
- 此时剖析样本。
- 将样品滴在解剖板上的0.1M Na-PO4 上。如果必须对同一条鱼的两只眼睛进行成像,请用细解剖剪刀将头部样品切成两半。
- 或者,只需小心地将细镊子的尖端从眼睛侧面放入眼窝中来收集眼睛,并特别注意不要划伤眼睛表面。然后,将眼睛从眼窝中拉出。
- 将解剖的样品转移到含有0.1 M Na-PO4的管中。确保样品管中没有多余的组织,因为它在样品处理过程中可能会粘附在眼睛的顶部。
- 将样品储存在+4°C的0.1 M Na-PO4 (最长一周)中。
- 处理样品以进行电子显微镜成像。
- 将样品在2%四氧化锇中在0.1M Na-PO4 缓冲液中在室温(RT)下后置1小时。
- 将样品洗涤3次,每次5分钟,每次在0.1 M Na-PO4 中在室温下洗涤。
- 样品在室温下在每个溶液中连续在30%,50%和70%乙醇中脱水1小时。
- 将样品浸入96%乙醇中,在室温下2-3小时。
- 接下来,将样品在100%乙醇中孵育两次,首先孵育1小时,然后在+4°C下在新鲜的100%乙醇中过夜。
- 在自动临界点干燥器中对样品进行30次循环。
- 在样品上嵌入并镀铂。
- 将粘性卡舌放在支架上。如果样品必须标记在支架顶部,请在标签上留下一张标签封面纸,并在纸上写下样品ID。
- 将支架与卡舌放在解剖显微镜的底座上。
- 用细镊子轻轻地将组织样本放在支架上,角膜朝上。
- 使用适当的装置用铂金涂覆试样。包衣后,将样品储存在室温下直至成像。
6. 成像(图2)
- 按照用户手册和成像专家的建议操作设备。
- 获取所需放大倍率的图像,并使用 2,000-2,500 倍图像进行分析。
- 调整亮度和对比度,使图像中没有过度曝光的区域,并且尽可能清晰地看到细胞边界和微脊。
注意:组织的位置和角度会影响亮度和对比度设置。它们可能需要在样品之间以及组织的不同区域之间进行调整。
7. 测量细胞形状、大小和微量滴模式
- 在斐济 ImageJ 1.5327 中打开 TIFF 图像。使用图像的比例尺设置比例:使用线条工具创建一条与比例尺大小相等的 线条 。选择 分析|设置比例,然后键入已知距离。从分析|打开 ROI 管理器 工具 菜单。
- 对于像元大小和圆度,请选择 分析|设置测量|形状描述符。使用 放大镜 工具查看放大后的单元格。使用 面 工具选择单元格,然后将每个选择添加到 ROI 管理器。最后,测量所选单元格,并保存测量值。
- 微量滴定片分析(图3 和 图4)
- 确保图像采用图像|中的 8 位格式 键入 菜单。
- 使用 面 工具选择一个单元格,然后从 编辑|中清除背景外面很清晰。
- 通过选择"处理|将图像平滑一到三次 平滑,并调整 图像|的亮度和对比度调整|亮度/对比度 ,使微脊尽可能清晰地突出。
- 从进程|卷积图像 过滤器|卷积,从 进程|转换为二进制二进制|创建二进制文件,并通过选择"处理黑白图像" |二进制|镂空化。
- 使用"分析"|中的"分析 骨架 "函数 骨架 菜单,用于测量微量槽参数并保存值。
注意:在SEM中,单个图像的亮度和对比度可能不同。因此,分析中的步骤可能需要从图像到图像进行调整。
结果
本研究描述了一种在斑马鱼角膜伤口愈合实验中使用眼部毛刺的方法。该方法从先前对小鼠的研究进行了修改,其中毛刺被证明可以有效地去除上皮细胞层13。斑马鱼角膜损伤的挑战包括眼睛的尺寸相对较小,并且在耗时的实验的情况下,需要保持恒定的水流通过鳃(如Xu及其同事所描述的28)。这种方法的主要优点是它的简单性和速度。标准解剖显微镜用于控制毛刺的使用(图1)。由于该过程持续时间短(从麻醉开始约3分钟),鱼从处理中恢复良好,并且不需要额外的设备来维持麻醉和氧气输送。
有几种方法可以可视化角膜伤口。该协议使用扫描电子显微镜(SEM, 图2),其在角膜研究中具有悠久的使用历史29,30。虽然这种方法不允许评估上皮的下层,但它提供了一种简单的方法来估计伤口愈合速度并比较眼睛不同区域的角膜表面。在伤口后3小时,当伤口区域关闭时(图2),伤口边界连接的部位仍然可见(图2)。
斑马鱼角膜上的浅表细胞含有明显的微脊31。最近,一项研究报告称,这些结构在斑马鱼皮32上靠近伤口的细长细胞中丢失。然而,所提出的结果表明,在磨损的角膜上皮上,可以在伤口部位旁边的一些细长细胞中观察到微巩(图4B)。在一些外围区域,微药从细胞中心丢失(图4C,D)。为了进行更详细的分析,除了ImageJ27中的微量和平均长度外,还量化了顶端细胞面积和圆度(图3和图4E-H)。
微量脊分析是使用Skeleton函数(从van Loon及其同事33修改)完成的。两个外周区域(图4A(区域C和D),图4C和图4D)之间的比较表明,图4D中的细胞更细长(表明细胞重排作为对伤口的反应),并且具有比图4C中的细胞更短的平均微量。该结果表明,细胞形状的变化与微岭修饰相关,并强调了角膜上皮内伤口反应的异质性。
测量SEM图像上的顶端细胞面积和圆度是获得角膜不同区域细胞外观定量数据的一种简单且可重复的方法。虽然仅限于2D,但这种方法有助于全面了解伤口闭合过程中细胞重排的动力学和速度。利用SEM图像分析顶端细胞表面的微岭图。这里描述的图像处理给出了微量脊参数变化的近似值,手动测量起来很繁琐。

图1:角膜磨损的设置。 (A)剖面显微镜对于小斑马鱼眼睛的受控磨损是必要的。(B)海绵有助于在手术过程中稳定麻醉鱼。(C)将鱼在培养皿上麻醉,用小勺子将麻醉的动物转移到海绵上。尖端为 0.5 mm 的眼毛刺用于磨损角膜。 请点击此处查看此图的大图。
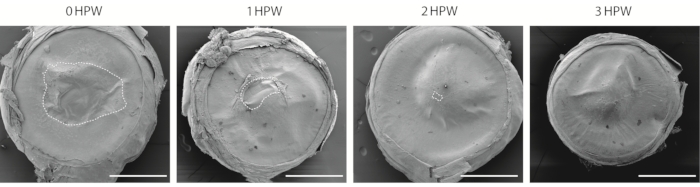
图2:用扫描电子显微镜观察受伤的角膜。 在伤口后0,1,2或3小时(HPW)收集的磨损角膜的概述。虚线轮廓表示伤口边界。比例尺 = 500 μm。 请点击此处查看此图的放大版本。

图3:微量滴定测量前的图像修改示例。 虽然不是原始细胞表面的精确复制品,但最终的骨架化图案捕获了细胞中心和外围之间的差异。比例尺 = 10 μm。 请点击此处查看此图的大图。

图4:角膜擦伤后两个外周区域之间的顶端细胞面积,圆度和微液滴值的比较。 (A)受伤眼睛的概述。这些框指示放大倍率较高的图像的位置(在 B、 C 和 D 中)。(C、 D)为形状描述符分析选择的单元格用绿色轮廓标记。(英、英)所选像元的顶端像元面积 (E) 和圆度 (F) 值。(G, H)相同细胞的微量滴定总长度(G)和平均长度(H)。对组进行统计学比较,双尾 t检验(*p ≤0.05,**p≤0.01)比例尺在 A中为500μm,在 B, C和 D中为50μm。 请点击此处查看此图的大图。
讨论
角膜物理损伤是眼科患者就诊的最常见原因。因此,建立相关模型以研究角膜病理生理学的不同方面非常重要。到目前为止,小鼠是研究角膜伤口愈合的最常用模型。然而,在鼠伤的眼睛上添加眼药水以验证特定药物对角膜伤口愈合的影响可能很困难。在这方面,斑马鱼模型对于影响角膜伤口愈合的分子的药理学筛选特别有用。这里描述的方法与为鼠标13描述的方法非常相似。
但是,必须牢记两个具体的区别点。首先,使用眼科毛刺需要练习确保伤口的可重复性,特别是对施加在眼睛上的压力,这对于适当的擦伤至关重要。此外,当上皮不再有效去除时,应更换磨料尖端。其次,虽然斑马鱼角膜的结构和形态与其他角膜31相似,但这种动物具有哺乳动物生物34,35,36中无与伦比的再生能力。虽然小鼠的伤口闭合持续48-72小时11,14,37,但据报道斑马鱼的时间表为3小时。由于结构和分子的相似性,角膜物理伤口诱导的细胞行为在大多数脊椎动物中可能是相似的。然而,斑马鱼的快速反应可能是由该动物特有的高级再生机制引导的。
所描述的协议使用SEM来跟踪伤口闭合。许多其他研究已经使用荧光显微镜代替跟踪这一过程15,17,38。然而,SEM的使用有助于分析上皮擦伤后的细胞形状修饰。该技术的缺点是无法跟踪分层步骤,因为SEM仅允许对最外部层进行成像。为了在完全角膜愈合期间以3D形式研究上皮,应使用荧光模型(如Zebrabow39)或免疫标记。
使用斑马鱼作为角膜伤口愈合模型增强了研究范围,因为它允许应用许多可用的分子工具,如转基因鱼系,吗啉和化学筛选,以显着扩大角膜伤口愈合研究的可能范围。此外,斑马鱼眼睛的大小允许开发新的成像策略,用于研究上皮细胞动力学,比用小鼠眼睛更详细。
本报告的主要目的不仅是使物理角膜损伤方法适应斑马鱼模型,而且还要证明使用新模型可以提出和回答新的问题,并指出研究基本生物学现象的新方法。这些优势最终将对患者有益。
披露声明
作者没有利益冲突需要披露。
致谢
作者感谢Pertti Panula访问斑马鱼单元,并感谢Henri Koivula对斑马鱼实验的指导和帮助。这项研究得到了芬兰科学院,Jane and Aatos Erkko基金会,芬兰文化基金会和ATIP-Avenir计划的支持。成像在生物技术研究所的电子显微镜部门和光学显微镜部门进行,由HiLIFE和芬兰生物中心支持。
材料
| Name | Company | Catalog Number | Comments |
| 0.1M Na-PO4 (sodium phosphate buffer), pH 7.4 | in-house | Solution is prepared from 1M sodium phosphate buffer (1M Na2HPO4 adjusted to pH 7.4 with 1M NaH2PO4). | |
| 0.2M Na-PO4 (sodium phosphate buffer), pH 7.4 | in-house | Solution is prepared from 1M sodium phosphate buffer (1M Na2HPO4 adjusted to pH 7.4 with 1M NaH2PO4). | |
| 0.5mm burr tips | Alger Equipment Company | BU-5S | |
| 1M Tris, pH 8.8 | in-house | ||
| adhesive tabs | Agar Scientific | G3347N | |
| Algerbrush burr, Complete instrument | Alger Equipment Company | BR2-5 | |
| Cotton swaps | Heinz Herenz Hamburg | 1030128 | |
| Dissecting plate | in-house | ||
| Dissecting tools | Fine Science Tools | ||
| double-distilled water | in-house | ||
| Eppedorf tubes, 2ml | any provider | ||
| Ethyl 3-aminobenzoate methanesulfonate salt | Sigma | A5040 | Caution: causes irritation. |
| Glutaraldehyde, 50% aqueous solution, grade I | Sigma | G7651 | Caution: toxic. |
| Lidocaine hydrochloride | Sigma | L5647 | Caution: toxic. |
| mounts | Agar Scientific | G301P | |
| Petri dish | Thermo Scientific | 101VR20 | |
| pH indicator strips | Macherey-Nagel | 92110 | |
| Plastic spoons | any provider | ||
| Plastic tubes, 15 ml | Greiner Bio-One | 188271 | |
| Plastic tubes, 50 ml | Greiner Bio-One | 227261 | |
| Scanning electron microscope | FEI | Quanta 250 FEG | |
| Soft sponge | any provider | ||
| Sputter coater | Quorum Technologies | GQ150TS | |
| Stereomicroscope | Leica |
参考文献
- Baden, T., Euler, T., Berens, P. Understanding the retinal basis of vision across species. Nature Reviews.Neuroscience. 21 (1), 5-20 (2020).
- Nishida, T., Saika, S., Morishige, N., Manis, M. J., Holland, E. J. Cornea and sclera: Anatomy and physiology. Cornea: Fundamentals, diagnosis and management, 4th ed. , 1-22 (2017).
- Wilson, S. E., Liu, J. J., Mohan, R. R. Stromal-epithelial interactions in the cornea. Progress in Retinal and Eye Research. 18 (3), 293-309 (1999).
- Wilson, S. E., et al. Epithelial injury induces keratocyte apoptosis: hypothesized role for the interleukin-1 system in the modulation of corneal tissue organization and wound healing. Experimental Eye Research. 62 (4), 325-327 (1996).
- Zieske, J. D., Guimaraes, S. R., Hutcheon, A. E. Kinetics of keratocyte proliferation in response to epithelial debridement. Experimental Eye Research. 72 (1), 33-39 (2001).
- West-Mays, J. A., Dwivedi, D. J. The keratocyte: corneal stromal cell with variable repair phenotypes. The International Journal of Biochemistry & Cell Biology. 38 (10), 1625-1631 (2006).
- Ahmed, F., House, R. J., Feldman, B. H. Corneal abrasions and corneal foreign bodies. Primary Care. 42 (3), 363-375 (2015).
- Ben-Eli, H., Erdinest, N., Solomon, A. Pathogenesis and complications of chronic eye rubbing in ocular allergy. Current Opinion in Allergy and Clinical Immunology. 19 (5), 526-534 (2019).
- Wilson, S. A., Last, A. Management of corneal abrasions. American Family Physician. 70 (1), 123-128 (2004).
- Nagata, M., et al. JBP485 promotes corneal epithelial wound healing. Scientific Reports. 5, 14776 (2015).
- Wang, X., et al. MANF promotes diabetic corneal epithelial wound healing and nerve regeneration by attenuating hyperglycemia-induced endoplasmic reticulum stress. Diabetes. 69 (6), 1264-1278 (2020).
- Li, F. J., et al. Evaluation of the AlgerBrush II rotating burr as a tool for inducing ocular surface failure in the New Zealand White rabbit. Experimental Eye Research. 147, 1-11 (2016).
- Kalha, S., Kuony, A., Michon, F. Corneal epithelial abrasion with ocular burr as a model for cornea wound healing. Journal of Visualized Experiments:JoVE. (137), e58071 (2018).
- Kalha, S., et al. Bmi1+ progenitor cell dynamics in murine cornea during homeostasis and wound healing. Stem Cells. 36 (4), 562-573 (2018).
- Park, M., et al. Visualizing the contribution of keratin-14(+) limbal epithelial precursors in corneal wound healing. Stem Cell Reports. 12 (1), 14-28 (2019).
- Kuony, A., et al. Ectodysplasin-A signaling is a key integrator in the lacrimal gland-cornea feedback loop. Development. 146 (14), (2019).
- Farrelly, O., et al. Two-photon live imaging of single corneal stem cells reveals compartmentalized organization of the limbal niche. Cell Stem Cell. 28 (7), 1233-1247 (2021).
- Ikkala, K., Michon, F., Stratoulias, V. Unilateral Zebrafish corneal injury induces bilateral cell plasticity supporting wound closure. Scientific Reports. , (2021).
- Ormerod, L. D., Abelson, M. B., Kenyon, K. R. Standard models of corneal injury using alkali-immersed filter discs. Investigative Ophthalmology & Visual Science. 30 (10), 2148-2153 (1989).
- Anderson, C., Zhou, Q., Wang, S. An alkali-burn injury model of corneal neovascularization in the mouse. Journal of visualized experiments: JoVE. (86), e51159 (2014).
- Choi, H., et al. Comprehensive modeling of corneal alkali injury in the rat eye. Current Eye Research. 42 (10), 1348-1357 (2017).
- Singh, P., Tyagi, M., Kumar, Y., Gupta, K. K., Sharma, P. D. Ocular chemical injuries and their management. Oman Journal of Ophthalmology. 6 (2), 83-86 (2013).
- Pal-Ghosh, S. BALB/c and C57BL6 mouse strains vary in their ability to heal corneal epithelial debridement wounds. Experimental Eye Research. 87 (5), 478-486 (2008).
- Chen, J. J., Tseng, S. C. Abnormal corneal epithelial wound healing in partial-thickness removal of limbal epithelium. Investigative Ophthalmology & Visual Science. 32 (8), 2219-2233 (1991).
- Xeroudaki, M., Peebo, B., Germundsson, J., Fagerholm, P., Lagali, N. RGTA in corneal wound healing after transepithelial laser ablation in a rabbit model: a randomized, blinded, placebo-controlled study. Acta Ophthalmologica. 94 (7), 685-691 (2016).
- . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio Available from: https://zfinorg/zf_info/zfbook/zfbk.html (2000)
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Xu, C., Volkery, S., Siekmann, A. F. Intubation-based anesthesia for long-term time-lapse imaging of adult zebrafish. Nature Protocols. 10 (12), 2064-2073 (2015).
- Crosson, C. E., Klyce, S. D., Beuerman, R. W. Epithelial wound closure in the rabbit cornea. A biphasic process. Investigative Ophthalmology & Visual Science. 27 (4), 464-473 (1986).
- Parlanti, P., et al. Axonal debris accumulates in corneal epithelial cells after intraepithelial corneal nerves are damaged: A focused Ion Beam Scanning Electron Microscopy (FIB-SEM) study. Experimental Eye Research. 194, 107998 (2020).
- Zhao, X. C., et al. The zebrafish cornea: structure and development. Investigative Ophthalmology & Visual Science. 47 (10), 4341-4348 (2006).
- Richardson, R., et al. Re-epithelialization of cutaneous wounds in adult zebrafish combines mechanisms of wound closure in embryonic and adult mammals. Development. 143 (12), 2077-2088 (2016).
- van Loon, A. P., Erofeev, I. S., Maryshev, I. V., Goryachev, A. B., Sagasti, A. Cortical contraction drives the 3D patterning of epithelial cell surfaces. The Journal of Cell Biology. 219 (3), (2020).
- Vihtelic, T. S., Hyde, D. R. Light-induced rod and cone cell death and regeneration in the adult albino zebrafish (Danio rerio) retina. Journal of Neurobiology. 44 (3), 289-307 (2000).
- Poss, K. D., Wilson, L. G., Keating, M. T. Heart regeneration in zebrafish. Science. 298 (5601), 2188-2190 (2002).
- Becker, T., Wullimann, M. F., Becker, C. G., Bernhardt, R. R., Schachner, M. Axonal regrowth after spinal cord transection in adult zebrafish. The Journal of Comparative Neurology. 377 (4), 577-595 (1997).
- Hu, X., et al. Sirt6 deficiency impairs corneal epithelial wound healing. Aging. 10 (8), 1932-1946 (2018).
- Ksander, B. R., et al. ABCB5 is a limbal stem cell gene required for corneal development and repair. Nature. 511 (7509), 353-357 (2014).
- Pan, Y. A., et al. Zebrabow: multispectral cell labeling for cell tracing and lineage analysis in zebrafish. Development. 140 (13), 2835-2846 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。