Method Article
Zebrafisch-Hornhautwundheilung: Von der Abrieb- bis zur Wundverschluss-Bildgebungsanalyse
In diesem Artikel
Zusammenfassung
Dieses Protokoll konzentriert sich auf die Schädigung der Augenoberfläche von Zebrafischen durch Abrieb, um den anschließenden Wundverschluss auf zellulärer Ebene zu beurteilen. Dieser Ansatz nutzt einen Augengrat, um das Hornhautepithel teilweise zu entfernen, und verwendet Rasterelektronenmikroskopie, um Veränderungen in der Zellmorphologie während des Wundverschlusses zu verfolgen.
Zusammenfassung
Als transparente Oberfläche des Auges ist die Hornhaut für eine klare Sicht von entscheidender Bedeutung. Aufgrund seiner Lage ist dieses Gewebe anfällig für Umweltbeleidigungen. In der Tat sind die Augenverletzungen, die klinisch am häufigsten auftreten, die der Hornhaut. Während die Wundheilung der Hornhaut bei kleinen Säugetieren (dh Mäusen, Ratten und Kaninchen) ausführlich untersucht wurde, haben Studien zur Hornhautphysiologie andere Arten, einschließlich Zebrafische, vernachlässigt, obwohl Zebrafische ein klassisches Forschungsmodell sind.
Dieser Bericht beschreibt eine Methode zur Durchführung eines Hornhautabriebs an Zebrafischen. Die Wunde wird in vivo an betäubten Fischen mit einem Augengrat durchgeführt. Diese Methode ermöglicht eine reproduzierbare Epithelwunde, wobei der Rest des Auges intakt bleibt. Nach dem Abrieb wird der Wundverschluss im Laufe von 3 h überwacht, danach wird die Wunde reepithelialisiert. Mit Hilfe der Rasterelektronenmikroskopie, gefolgt von der Bildverarbeitung, können die Epithelzellform und apikale Vorsprünge untersucht werden, um die verschiedenen Schritte während des Hornhautepithel-Wundverschlusses zu untersuchen.
Die Eigenschaften des Zebrafischmodells erlauben es, die Epithelgewebephysiologie und das kollektive Verhalten der Epithelzellen zu untersuchen, wenn das Gewebe herausgefordert wird. Darüber hinaus kann die Verwendung eines Modells, das des Einflusses des Tränenfilms beraubt ist, neue Antworten auf die Reaktion der Hornhaut auf Stress liefern. Schließlich ermöglicht dieses Modell auch die Abgrenzung der zellulären und molekularen Ereignisse, die an jedem Epithelgewebe beteiligt sind, das einer physischen Wunde ausgesetzt ist. Diese Methode kann auf die Bewertung der Arzneimittelwirksamkeit in präklinischen Tests angewendet werden.
Einleitung
Da die meisten Epithel in Kontakt mit der äußeren Umgebung stehen, sind sie anfällig für körperliche Verletzungen, was sie gut für das Studium von Wundheilungsprozessen geeignet macht. Unter den gut untersuchten Geweben ist die Hornhaut ein äußerst nützliches Modell bei der Untersuchung der zellulären und molekularen Aspekte der Wundheilung. Als transparente Außenfläche schützt es das Auge physisch und ist das erste Element, das das Licht auf die Netzhaut fokussiert. Während sich die Struktur und die Zellzusammensetzung der Netzhaut zwischen Spezies1 unterscheiden, sind diese Elemente der Hornhaut im Allgemeinen in allen kameraartigen Augen ähnlich, unabhängig von der Art.
Die Hornhaut besteht aus drei Hauptschichten2. Die erste und äußerste Schicht ist das Epithel, das ständig erneuert wird, um seine Transparenz zu gewährleisten. Die zweite Schicht ist das Stroma, das verstreute Zellen, Keratozyten genannt, in einer dicken Schicht streng organisierter Kollagenfasern enthält. Die dritte und innerste Schicht ist das Endothel, das eine Nährstoff- und Flüssigkeitsdiffusion von der Vorderkammer zu den äußeren Schichten ermöglicht. Die Epithel- und Stromazellen interagieren über Wachstumsfaktoren und Zytokine3. Diese Wechselwirkung wird durch die schnelle Apoptose und die anschließende Proliferation von Keratozyten nach Epithelverletzunghervorgehoben 4,5. Bei einer tieferen Wunde, wie z.B. einer Punktion, nehmen Keratozyten aktiv am Heilungsprozessteil 6.
In Kontakt mit der äußeren Umgebung sind körperliche Verletzungen der Hornhaut häufig. Viele von ihnen werden durch kleine Fremdkörperverursacht 7, wie Sand oder Staub. Der Reflex des Augenreibens kann zu ausgedehnten Epithelabschürfungen und Hornhautumbauführen 8. Je nach Wundgröße und -tiefe sind diese körperlichen Verletzungen schmerzhaft und dauern mehrere Tage,um 9 zu heilen. Die optimalen wundheilenden Eigenschaften eines Modells erleichtern das Verständnis der zellulären und molekularen Aspekte des Wundverschlusses. Darüber hinaus haben sich solche Modelle auch als nützlich erwiesen, um neue Moleküle mit dem Potenzial zur Beschleunigung der Hornhautheilung zu testen, wie bereits gezeigtwurde 10,11.
Das hier beschriebene Protokoll zielt darauf ab, Zebrafische als relevantes Modell zur Untersuchung der körperlichen Verletzung der Hornhaut zu verwenden. Dieses Modell ist sehr praktisch für pharmakologische Screening-Studien, da es ermöglicht, Moleküle direkt in das Tankwasser zu geben und somit mit einer heilenden Hornhaut in Kontakt zu kommen. Die hier bereitgestellten Details werden den Wissenschaftlern helfen, ihre Studien am Zebrafischmodell durchzuführen. Die in vivo Verletzung wird mit einem stumpfen Augengrat durchgeführt. Die Auswirkungen auf Epithelzellen, die an sie angrenzen oder sich in einiger Entfernung davon befinden, können analysiert werden, indem das zentrale Hornhautepithel gezielt entfernt wird. In den letzten Jahren konzentrierten sich zahlreiche Berichte auf eine solche Methode bei Nagetierhornhaut 12,13,14,15,16,17; Bisher hat jedoch nur ein einziger Bericht diese Methode auf Zebrafisch18 angewendet.
Aufgrund ihrer Einfachheit ist die physische Wunde nützlich, um die Rolle von Epithelzellen beim Wundverschluss zu beschreiben. Ein weiteres etabliertes Modell der Hornhautverletzung ist die chemische Verbrennung, insbesondere die Alkaliverbrennung 19,20,21. Ein solcher Ansatz schädigt jedoch indirekt die gesamte Augenoberfläche, einschließlich der peripheren Hornhaut und des Hornhautstromas19. Tatsächlich induzieren Alkaliverbrennungen möglicherweise Hornhautgeschwüre, Perforationen, epitheliale Trübung und schnelle Neovaskularisation22, und das unkontrollierbare Ergebnis von Alkaliverbrennungen disqualifiziert diesen Ansatz für allgemeine Wundheilungsstudien. Zahlreiche andere Methoden werden auch verwendet, um die Hornhautwundheilung entsprechend dem besonderen Schwerpunkt der jeweiligen Studie zu untersuchen (z. B. vollständiges Epitheldebridement23, die Kombination von chemischer und mechanischer Verletzung bei Teildickenwunden 24, Excimer-Laserablation für Wunden, die sich bis zum Stroma25 erstrecken). Die Verwendung eines Augengrats beschränkt den Fokus auf die epitheliale Reaktion auf die Wunde und sorgt für eine hochgradig reproduzierbare Wunde.
Wie bei jeder Methode der Wundzufügung hat die Verwendung eines Augengrats Vor- und Nachteile. Der Hauptnachteil ist, dass die Reaktion meist epithelisch ist und die Abschürfungen im klinischen Umfeld nicht perfekt widerspiegelt. Diese Methode hat jedoch zahlreiche Vorteile, einschließlich der Leichtigkeit, mit der sie eingerichtet und durchgeführt werden kann, ihrer Präzision, ihrer Reproduzierbarkeit und der Tatsache, dass sie nicht-invasiv ist, was sie zu einer Methode macht, die von Tieren gut vertragen wird.
Protokoll
Alle Experimente wurden vom nationalen Tierversuchsausschuss genehmigt.
1. Vorbereitungen
- Bereiten Sie die für die Anästhesie verwendete Tricain-Stammlösung26 im Voraus vor (0,4% ige Stammlösung, die in diesem Protokoll verwendet wird). Verwenden Sie Handschuhe und bewahren Sie die Materialien wann immer möglich in einem Abzug auf.
- Für 50 ml einer 0,4% igen Lösung wiegen Sie 200 mg Tricainpulver in ein 50-ml-Röhrchen. Lösen Sie das Pulver in ca. 45 ml doppelt destilliertem Wasser auf.
- Stellen Sie den pH-Wert der Tricain-Stammlösung mit 1 M Tris (pH 8,8, ~ 1,25 ml) auf 7 ein. Fügen Sie die Tris-Lösung der Tricain-Brühe in Aliquots hinzu, mischen Sie die Brühe nach jedem Aliquot gründlich und überprüfen Sie den pH-Wert nach jeder Zugabe von Tris.
- Bereiten Sie vor dem Experiment eine 0,02% ige Arbeitslösung von Tricain vor.
- 2 ml 0,4%ige Stammlösung auftauen und zu 40 ml Systemwasser (Endkonzentration 0,02 %) hinzufügen. Legen Sie die Lösung in einen kleinen Behälter.
- Bereiten Sie vor dem Experiment das Rückgewinnungswasser vor, das Analgetika enthält. Verwenden Sie Handschuhe und bewahren Sie die Materialien wann immer möglich im Abzug auf.
- Für einen Liter Rückgewinnungswasser wiegen Sie 2,5 mg Lidocainhydrochloridpulver und lösen es in frischem Systemwasser auf. Überprüfen Sie den pH-Wert und stellen Sie ihn bei Bedarf auf 7 ein.
- Vor dem Experiment wird die Fixierlösung (2,5%iges Glutaraldehyd in 0,1 M Natriumphosphat (Na-PO 4)-Lösung bei pH7,4) hergestellt. Verwenden Sie Handschuhe und bewahren Sie die Materialien in einem Abzug auf.
- Für 10 ml der Befestigungslösung werden 5 ml 0,2 MNa-PO 4 in ein Rohr pipettiert. Fügen Sie 0,5 ml 50% Glutaraldehyd hinzu und fügen Sie doppelt destilliertes Wasser hinzu, um das endgültige Volumen von 10 ml zu erhalten. Schützen Sie die Lösung vor Licht und bewahren Sie sie vor dem Gebrauch auf Eis oder im Kühlschrank auf.
HINWEIS: Wenn Proben nach der Wunde mehrere Stunden lang entnommen werden müssen, bereiten Sie die Befestigungslösung kurz vor der Verwendung vor.
- Für 10 ml der Befestigungslösung werden 5 ml 0,2 MNa-PO 4 in ein Rohr pipettiert. Fügen Sie 0,5 ml 50% Glutaraldehyd hinzu und fügen Sie doppelt destilliertes Wasser hinzu, um das endgültige Volumen von 10 ml zu erhalten. Schützen Sie die Lösung vor Licht und bewahren Sie sie vor dem Gebrauch auf Eis oder im Kühlschrank auf.
- Bereiten Sie das Gerät für die Verwundung vor (Abbildung 1).
- Füllen Sie die Rückgewinnungstanks oder kleineren Behälter mit Systemwasser.
- Halten Sie den Augengrat bereit. Überprüfen Sie, ob die Gratspitze sauber ist. Entfernen Sie bei Bedarf Zellablagerungen mit einem feuchten Wattestäbchen.
- Machen Sie einen Schnitt an der Seite eines weichen Schwammes und befeuchten Sie den Schwamm mit Systemwasser. Legen Sie den Schwamm auf die Basis/den Tisch eines Seziermikroskops. Stellen Sie genügend Arbeitsraum für die Verwendung des Grats und genügend Beleuchtung von den Seiten und / oder oben sicher, um die Augenoberfläche richtig zu sehen.
2. Anästhesie
- Übertragen Sie einen Fisch aus dem Tank so vorsichtig wie möglich mit einem Netz in die 0,02% ige Tricainlösung.
- Überwachen Sie die Anästhesie und überprüfen Sie, ob Sie nicht auf leichte mechanische Reize reagieren.
HINWEIS: Für eine konsequente Anästhesie wird vor dem Abrieb mit erwachsenen Wildtyp-AB-Fischen eine 2-minütige Exposition gegenüber Tricain verwendet. Bei Fischen mit einem anderen genetischen Hintergrund kann eine andere Dauer erforderlich sein.
3. Abrieb
- Legen Sie den betäubten Fisch vorsichtig mit einem Löffel in den Schnitt auf dem Schwamm, wobei der Kopf aus der Schwammoberfläche herausragt.
- Schalten Sie den Grat ein und fokussieren Sie die Mikroskopansicht auf die Augenoberfläche.
- Nähern Sie sich vorsichtig der Augenoberfläche mit der Gratspitze. Wenn Sie die Augenoberfläche berühren, beginnen Sie, die Gratspitze auf der Augenoberfläche mit kreisförmiger Bewegung zu bewegen. Vermeiden Sie plötzliche Bewegungen, da dies dazu führen kann, dass sich das Auge in der Augenhöhle neigt und die Gratspitze rutscht.
- Wenn der Abrieb abgeschlossen ist, legen Sie den Fisch vorsichtig in das Systemwasser, das das Analgetikum zur Erholung enthält.
- Reinigen Sie den Grat direkt nach Gebrauch mit einem feuchten Wattestäbchen.
4. Proben sammeln
- Nehmen Sie den Fisch zum gewünschten Zeitpunkt mit einem Netz auf und legen Sie ihn in 0,02% ige Tricainlösung. Halten Sie das Tier in der Lösung, bis die operkuläre Bewegung vollständig aufgehört hat und der Fisch nicht auf Berührungen reagiert.
- Legen Sie den Fisch mit einem Löffel auf eine Petrischale und halten Sie ihn mit einer Pinzette. Enthaupten Sie den Fisch mit einer Sezierschere. Vermeiden Sie bei der Handhabung der Probe Kratzer auf der Augenoberfläche.
- Geben Sie das Gewebe in ein Probenröhrchen, das 0,1 MNa-PO 4 enthält.
- Spülen Sie das Gewebe aus, indem Sie das 0,1 MNa-PO 4 durch sauberen Puffer ersetzen, damit kein Blut in der Lösung verbleibt.
5. Probenaufbereitung für die Elektronenmikroskopie
- Fixieren Sie das Gewebe in 2,5% Glutaraldehyd/0,1 M Na-PO 4 (pH7,4) für ~24 h bei +4 °C. Bewahren Sie die Probe auf einem rotierenden/schüttelnden Probenhalter auf, um eine ordnungsgemäße Fixierung sicherzustellen.
- Entfernen Sie die Befestigungslösung und spülen Sie die Probe mehrmals mit 0,1 M Na-PO4 ab.
- Sezieren Sie die Probe an dieser Stelle.
- Legen Sie die Probe auf einen Tropfen von 0,1 MNa-PO 4 auf einer Sezierplatte. Wenn beide Augen desselben Fisches abgebildet werden müssen, schneiden Sie die Kopfprobe mit einer feinen Sezierschere in zwei Teile.
- Alternativ können Sie die Augen nur sammeln, indem Sie die Spitzen einer feinen Pinzette von der Seite des Auges vorsichtig in die Augenhöhle legen und besonders darauf achten, die Augenoberfläche nicht zu zerkratzen. Ziehen Sie dann das Auge aus der Augenhöhle.
- Die sezierte Probe wird in ein Röhrchen mit 0,1 MNa-PO 4 überführt. Stellen Sie sicher, dass sich kein zusätzliches Gewebe im Probenröhrchen befindet, da es während der Probenverarbeitung an der Oberseite des Auges haften bleiben kann.
- Lagern Sie die Probe in 0,1 M Na-PO4 (maximal eine Woche) bei +4 °C.
- Verarbeiten Sie die Proben für die elektronenmikroskopische Bildgebung.
- Postfixieren Sie die Proben in 2% Osmiumtetroxid in 0,1 M Na-PO4 Puffer für 1 h bei Raumtemperatur (RT).
- Waschen Sie die Proben 3 Mal für 5 Minuten jede Wäsche in 0,1 M Na-PO4 bei RT.
- Dehydrieren Sie die Proben nacheinander in 30%, 50% und 70% Ethanol für 1 h in jeder Lösung bei RT.
- Tauchen Sie die Proben in 96% Ethanol für 2-3 h bei RT.
- Als nächstes inkubieren Sie die Proben zweimal in 100% Ethanol, zuerst für 1 h und dann in frischem 100% Ethanol über Nacht bei +4 °C.
- Die Proben werden in einem automatisierten kritischen Punkttrockner 30 Zyklen unterzogen.
- Betten Sie die Proben ein und platinieren Sie sie.
- Legen Sie eine Klebelasche auf eine Halterung. Wenn die Probe oben auf der Halterung markiert werden muss, lassen Sie ein Stück Tab-Deckpapier auf der Lasche und schreiben Sie die Proben-ID auf das Papier.
- Platzieren Sie die Halterung mit der Lasche auf der Basis eines Seziermikroskops.
- Legen Sie die Gewebeprobe vorsichtig mit einer feinen Pinzette auf die Montierung, die Hornhaut nach oben.
- Beschichten Sie die Probe mit dem entsprechenden Gerät mit Platin. Nach dem Beschichten lagern Sie die Proben bei Raumtemperatur bis zur Bildgebung.
6. Bildgebung (Abbildung 2)
- Bedienen Sie die Geräte wie im Benutzerhandbuch und von Imaging-Experten empfohlen.
- Erfassen Sie Bilder der gewünschten Vergrößerung und verwenden Sie 2.000-2.500-fache Bilder für die Analyse.
- Passen Sie die Helligkeit und den Kontrast so an, dass keine überbelichteten Bereiche im Bild vorhanden sind und Zellränder und Mikrokämme so klar wie möglich sichtbar sind.
HINWEIS: Die Position und der Winkel des Gewebes beeinflussen die Helligkeits- und Kontrasteinstellungen. Sie müssen möglicherweise von Probe zu Probe und zwischen verschiedenen Regionen des Gewebes angepasst werden.
7. Messen von Zellform, -größe und Mikrokammmuster
- Öffnen Sie das TIFF-Bild in Fiji ImageJ 1.5327. Legen Sie den Maßstab mithilfe der Maßstabsleiste des Bildes fest: Erstellen Sie mit dem Linienwerkzeug eine Linie, deren Größe der Maßstabsleiste entspricht. Wählen Sie | analysieren aus. Legen Sie die Skalierung fest und geben Sie die bekannte Entfernung ein. Öffnen Sie den ROI-Manager über die Analyse| Extras-Menü .
- Wählen Sie für Zellengröße und Rundheit die Option | analysieren aus. Festlegen von Messungen | Formdeskriptoren. Verwenden Sie das Lupenwerkzeug , um die Zellen unter Vergrößerung anzuzeigen. Markieren Sie Zellen mit dem Polygon-Werkzeug und fügen Sie jede Auswahl dem ROI-Manager hinzu. Messen Sie abschließend die ausgewählten Zellen und speichern Sie die Messung.
- Mikrokammanalyse (Abbildung 3 und Abbildung 4)
- Stellen Sie sicher, dass das Bild im 8-Bit-Format von der Bild| vorliegt Menü Typ .
- Markieren Sie eine Zelle mit dem Polygon-Werkzeug und löschen Sie den Hintergrund unter | bearbeiten Außen klar.
- Glätten Sie das Bild ein- bis dreimal, indem Sie | verarbeiten auswählen Glätten und Anpassen der Helligkeit und des Kontrasts von Bild | | anpassen Helligkeit/Kontrast , damit sich die Mikrokämme so deutlich wie möglich abheben.
- Drehen Sie das Bild aus Process | Filtert | Konvolvieren, von Process | in Binärdateien umwandeln Binäre | Erstellen Sie binäre Werte, und skelettieren Sie das Schwarz-Weiß-Bild, indem Sie | verarbeiten auswählen Binäre | Skelettieren.
- Verwenden Sie die Funktion Skelett analysieren im | Analysieren Skelettmenü zum Messen der Mikrokammparameter und Speichern der Werte.
HINWEIS: In REM können sich einzelne Bilder in Helligkeit und Kontrast unterscheiden. Daher müssen die Schritte in der Analyse möglicherweise von Bild zu Bild angepasst werden.
Ergebnisse
Diese Studie beschreibt eine Methode mit einem ophthalmologischen Grat in Zebrafisch-Hornhaut-Wundheilungsexperimenten. Die Methode ist modifiziert gegenüber früheren Studien an Mäusen, bei denen gezeigt wurde, dass der Grat die Epithelzellschichten effizient13 entfernt. Zu den Herausforderungen bei der Hornhautverletzung von Zebrafischen gehören die relativ geringe Größe des Auges und im Falle zeitaufwendiger Experimente die Notwendigkeit, einen konstanten Wasserfluss durch die Kiemen aufrechtzuerhalten (wie von Xu und Kollegen28 beschrieben). Die Hauptvorteile dieser Methode sind ihre Einfachheit und Geschwindigkeit. Für die kontrollierte Verwendung des Grats wird ein Standard-Seziermikroskop verwendet (Abbildung 1). Da der Eingriff von kurzer Dauer ist (ca. 3 Minuten ab Beginn der Anästhesie), erholen sich die Fische gut von der Handhabung, und es ist keine zusätzliche Ausrüstung für die Aufrechterhaltung der Anästhesie und der Sauerstoffzufuhr erforderlich.
Es gibt mehrere Möglichkeiten, die Hornhautwunde zu visualisieren. Dieses Protokoll verwendet Rasterelektronenmikroskopie (REM, Abbildung 2), die eine lange Geschichte der Verwendung in Hornhautstudien hat29,30. Obwohl dieser Ansatz keine Beurteilung der unteren Schichten des Epithels zulässt, bietet er eine einfache Methode zur Abschätzung der Wundheilungsgeschwindigkeit und zum Vergleich der Hornhautoberflächen verschiedener Augenregionen. Bei 3 h nach der Wunde, während der Wundbereich geschlossen ist (Abbildung 2), bleibt die Stelle, an der die Wundränder verbunden sind, sichtbar (Abbildung 2).
Die oberflächlichen Zellen auf der Hornhaut des Zebrafisches enthalten ausgeprägte Mikrokämme31. Kürzlich berichtete eine Studie, dass diese Strukturen in länglichen Zellen neben Wunden auf der Zebrafischhaut verlorengegangen sind 32. Die vorgestellten Ergebnisse zeigen jedoch, dass am abgeschliffenen Hornhautepithel Mikrokämme in einigen länglichen Zellen neben der Wundstelle beobachtet werden können (Abbildung 4B). In einigen peripheren Regionen gehen die Mikrokämme aus der Mitte der Zelle verloren (Abbildung 4C, D). Für eine detailliertere Analyse werden apikale Zellfläche und Rundheit zusätzlich zu Mikrokammmenge und durchschnittlicher Länge in Bild J27 quantifiziert (Abbildung 3 und Abbildung 4E-H).
Die Mikrokammanalyse wird mit der Skeleton-Funktion durchgeführt (modifiziert von van Loon und Kollegen33). Ein Vergleich zwischen den beiden peripheren Regionen (Abbildung 4A (Regionen C und D), Abbildung 4C und Abbildung 4D) zeigt, dass die Zellen in Abbildung 4D länglicher sind (was auf Zellumlagerungen als Reaktion auf Wunden hinweist) und kürzere durchschnittliche Mikrokamme aufweisen als Zellen in Abbildung 4C. Dieses Ergebnis legt nahe, dass die Veränderung der Zellform mit der Mikrokammmodifikation korreliert und die Heterogenität innerhalb des Hornhautepithels in der Wundreaktion betont.
Die Messung der apikalen Zellfläche und Rundheit auf REM-Bildern ist eine einfache und reproduzierbare Möglichkeit, quantitative Daten über das Zellbild in verschiedenen Regionen der Hornhaut zu erhalten. Obwohl dieser Ansatz auf 2D beschränkt ist, hilft er, ein allgemeines Verständnis der Dynamik und Geschwindigkeit von Zellumlagerungen während des Wundverschlusses zu erlangen. Die REM-Bilder werden zur Analyse der Mikrokammmuster auf der apikalen Zelloberfläche verwendet. Die hier beschriebene Bildverarbeitung ergibt eine Annäherung an die Änderungen der Mikrokammparameter, die mühsam von Hand zu messen wäre.

Abbildung 1: Das Setup für den Hornhautabrieb . (A) Für den kontrollierten Abrieb am kleinen Zebrafischauge ist ein Seziermikroskop notwendig. (B) Der Schwamm hilft, den betäubten Fisch während des Eingriffs zu stabilisieren. (C) Der Fisch wird auf einer Petrischale betäubt, und das betäubte Tier wird mit einem kleinen Löffel auf den Schwamm übertragen. Ein Augengrat mit einer 0,5 mm großen Spitze wird verwendet, um die Hornhaut abzuschleifen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
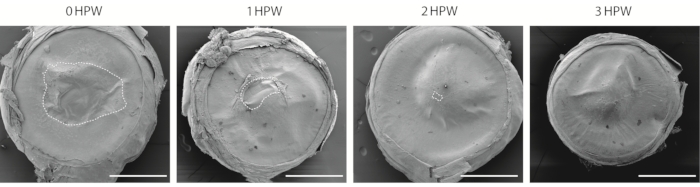
Abbildung 2: Visualisierung der verwundeten Hornhaut mit Rasterelektronenmikroskopie. Die Übersicht der abgeschliffenen Hornhaut, die bei 0, 1, 2 oder 3 h nach der Wunde (HPW) gesammelt wurde. Der gestrichelte Umriss zeigt den Wundrand an. Maßstabsbalken = 500 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 3: Ein Beispiel für die Bildmodifikation vor der Mikrokammmessung. Obwohl es sich nicht um eine exakte Nachbildung der ursprünglichen Zelloberfläche handelt, erfasst das endgültige skelettierte Muster die Unterschiede zwischen dem Zellzentrum und der Peripherie. Maßstabsleiste = 10 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 4: Ein Vergleich der apikalen Zellfläche, der Rundheit und der Mikrokammwerte zwischen zwei peripheren Regionen nach dem Hornhautabrieb . (A) Ein Überblick über das verletzte Auge. Die Felder geben die Position der Bilder mit höherer Vergrößerung an (in B, C und D). (C, D) Zellen, die für die Formdeskriptoranalyse ausgewählt wurden, sind mit einem grünen Umriss gekennzeichnet. (E, F) Apikale Zellfläche (E) und Rundheitswerte (F) ausgewählter Zellen. (G, H) Mikrokamm-Gesamtlänge (G) und durchschnittliche Länge (H) derselben Zellen. Die Gruppen wurden statistisch mit einem zweiseitigen t-Test verglichen (*p ≤ 0,05, **p ≤ 0,01) Skalenbalken = 500 μm in A, 50 μm in B, C und D. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
Hornhautverletzungen sind die häufigste Ursache für ophthalmologische Patientenbesuche im Krankenhaus. Daher ist es wichtig, relevante Modelle für die Untersuchung verschiedener Aspekte der Pathophysiologie der Hornhaut zu erstellen. Bisher ist die Maus das am häufigsten verwendete Modell für das Studium der Hornhautwundheilung. Das Hinzufügen von Augentropfen auf murinen verwundeten Augen, um die Auswirkungen bestimmter Medikamente auf die Wundheilung der Hornhaut zu validieren, kann jedoch schwierig sein. In dieser Hinsicht ist das Zebrafischmodell besonders nützlich für das pharmakologische Screening von Molekülen, die die Wundheilung der Hornhaut beeinflussen. Das hier beschriebene Verfahren ist dem für Maus13 beschriebenen sehr ähnlich.
Zwei spezifische Unterschiede müssen jedoch im Auge behalten werden. Erstens erfordert die Verwendung eines Augengrats Übung, um die Reproduzierbarkeit der Wunde zu gewährleisten, insbesondere in Bezug auf den Druck, der auf das Auge ausgeübt wird, was für den richtigen Abrieb entscheidend ist. Zudem sollte die Schleifmittelspitze gewechselt werden, wenn das Epithel nicht mehr effizient entfernt wird. Zweitens, während die Struktur und Morphologie der Zebrafischhornhaut anderen Hornhäutenähnelt 31, besitzt dieses Tier Regenerationsfähigkeiten, die bei Säugetierorganismenbeispiellos sind 34,35,36. Während der Wundverschluss bei der Maus 48-72 h11,14,37 dauert, wird für Zebrafische eine Zeitleiste von 3 h gemeldet. Aufgrund struktureller und molekularer Ähnlichkeiten ist das zelluläre Verhalten, das durch eine physikalische Hornhautwunde induziert wird, bei den meisten Wirbeltieren wahrscheinlich ähnlich. Die schnelle Reaktion bei Zebrafischen wird jedoch wahrscheinlich von einem fortschrittlichen regenerativen Mechanismus geleitet, der für dieses Tier spezifisch ist.
Das beschriebene Protokoll verwendet SEM, um den Wundverschluss zu verfolgen. Zahlreiche andere Studien haben stattdessen die Fluoreszenzmikroskopie verwendet, um diesen Prozesszu verfolgen 15,17,38. Die Verwendung von REM erleichtert jedoch die Analyse der Zellformmodifikation nach Epithelabrionen. Der Nachteil dieser Technologie ist, dass die Schichtungsschritte nicht verfolgt werden können, da SEM nur die Abbildung der äußersten Schicht zulässt. Um das Epithel während der vollständigen Hornhautheilung in 3D zu untersuchen, sollten fluoreszierende Modelle wie Zebrabow39 oder Immunmarkierung verwendet werden.
Die Verwendung von Zebrafisch als Hornhautwundheilungsmodell erweitert den Untersuchungsumfang, da es die Anwendung zahlreicher molekularer Werkzeuge wie gentechnisch veränderter Fischlinien, Morpholinos und chemisches Screening ermöglicht, um das mögliche Spektrum von Hornhautwundheilungsstudien signifikant zu erweitern. Darüber hinaus ermöglicht die Größe der Zebrafischaugen die Entwicklung neuer Bildgebungsstrategien, um die Epithelzelldynamik detaillierter zu untersuchen, als dies mit murinen Augen möglich ist.
Das Hauptziel dieses Berichts besteht nicht nur darin, den Ansatz der physischen Hornhautverwundung an das Zebrafischmodell anzupassen, sondern auch zu zeigen, dass die Verwendung neuer Modelle es ermöglicht, neue Fragen zu stellen und zu beantworten und neue Wege zur Untersuchung grundlegender biologischer Phänomene aufzuzeigen. Diese Vorteile werden letztendlich für die Patienten von Vorteil sein.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Die Autoren danken Pertti Panula für den Zugang zur Zebrafischeinheit und Henri Koivula für die Anleitung und Hilfe bei den Zebrafischexperimenten. Diese Forschung wurde von der Akademie von Finnland, der Jane und Aatos Erkko Foundation, der Finnish Cultural Foundation und dem ATIP-Avenir-Programm unterstützt. Die Bildgebung wurde an der Elektronenmikroskopie-Einheit und der Light Microscopy Unit, Institute of Biotechnology, durchgeführt, unterstützt von HiLIFE und Biocenter Finland.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.1M Na-PO4 (sodium phosphate buffer), pH 7.4 | in-house | Solution is prepared from 1M sodium phosphate buffer (1M Na2HPO4 adjusted to pH 7.4 with 1M NaH2PO4). | |
| 0.2M Na-PO4 (sodium phosphate buffer), pH 7.4 | in-house | Solution is prepared from 1M sodium phosphate buffer (1M Na2HPO4 adjusted to pH 7.4 with 1M NaH2PO4). | |
| 0.5mm burr tips | Alger Equipment Company | BU-5S | |
| 1M Tris, pH 8.8 | in-house | ||
| adhesive tabs | Agar Scientific | G3347N | |
| Algerbrush burr, Complete instrument | Alger Equipment Company | BR2-5 | |
| Cotton swaps | Heinz Herenz Hamburg | 1030128 | |
| Dissecting plate | in-house | ||
| Dissecting tools | Fine Science Tools | ||
| double-distilled water | in-house | ||
| Eppedorf tubes, 2ml | any provider | ||
| Ethyl 3-aminobenzoate methanesulfonate salt | Sigma | A5040 | Caution: causes irritation. |
| Glutaraldehyde, 50% aqueous solution, grade I | Sigma | G7651 | Caution: toxic. |
| Lidocaine hydrochloride | Sigma | L5647 | Caution: toxic. |
| mounts | Agar Scientific | G301P | |
| Petri dish | Thermo Scientific | 101VR20 | |
| pH indicator strips | Macherey-Nagel | 92110 | |
| Plastic spoons | any provider | ||
| Plastic tubes, 15 ml | Greiner Bio-One | 188271 | |
| Plastic tubes, 50 ml | Greiner Bio-One | 227261 | |
| Scanning electron microscope | FEI | Quanta 250 FEG | |
| Soft sponge | any provider | ||
| Sputter coater | Quorum Technologies | GQ150TS | |
| Stereomicroscope | Leica |
Referenzen
- Baden, T., Euler, T., Berens, P. Understanding the retinal basis of vision across species. Nature Reviews.Neuroscience. 21 (1), 5-20 (2020).
- Nishida, T., Saika, S., Morishige, N., Manis, M. J., Holland, E. J. Cornea and sclera: Anatomy and physiology. Cornea: Fundamentals, diagnosis and management, 4th ed. , 1-22 (2017).
- Wilson, S. E., Liu, J. J., Mohan, R. R. Stromal-epithelial interactions in the cornea. Progress in Retinal and Eye Research. 18 (3), 293-309 (1999).
- Wilson, S. E., et al. Epithelial injury induces keratocyte apoptosis: hypothesized role for the interleukin-1 system in the modulation of corneal tissue organization and wound healing. Experimental Eye Research. 62 (4), 325-327 (1996).
- Zieske, J. D., Guimaraes, S. R., Hutcheon, A. E. Kinetics of keratocyte proliferation in response to epithelial debridement. Experimental Eye Research. 72 (1), 33-39 (2001).
- West-Mays, J. A., Dwivedi, D. J. The keratocyte: corneal stromal cell with variable repair phenotypes. The International Journal of Biochemistry & Cell Biology. 38 (10), 1625-1631 (2006).
- Ahmed, F., House, R. J., Feldman, B. H. Corneal abrasions and corneal foreign bodies. Primary Care. 42 (3), 363-375 (2015).
- Ben-Eli, H., Erdinest, N., Solomon, A. Pathogenesis and complications of chronic eye rubbing in ocular allergy. Current Opinion in Allergy and Clinical Immunology. 19 (5), 526-534 (2019).
- Wilson, S. A., Last, A. Management of corneal abrasions. American Family Physician. 70 (1), 123-128 (2004).
- Nagata, M., et al. JBP485 promotes corneal epithelial wound healing. Scientific Reports. 5, 14776 (2015).
- Wang, X., et al. MANF promotes diabetic corneal epithelial wound healing and nerve regeneration by attenuating hyperglycemia-induced endoplasmic reticulum stress. Diabetes. 69 (6), 1264-1278 (2020).
- Li, F. J., et al. Evaluation of the AlgerBrush II rotating burr as a tool for inducing ocular surface failure in the New Zealand White rabbit. Experimental Eye Research. 147, 1-11 (2016).
- Kalha, S., Kuony, A., Michon, F. Corneal epithelial abrasion with ocular burr as a model for cornea wound healing. Journal of Visualized Experiments:JoVE. (137), e58071 (2018).
- Kalha, S., et al. Bmi1+ progenitor cell dynamics in murine cornea during homeostasis and wound healing. Stem Cells. 36 (4), 562-573 (2018).
- Park, M., et al. Visualizing the contribution of keratin-14(+) limbal epithelial precursors in corneal wound healing. Stem Cell Reports. 12 (1), 14-28 (2019).
- Kuony, A., et al. Ectodysplasin-A signaling is a key integrator in the lacrimal gland-cornea feedback loop. Development. 146 (14), (2019).
- Farrelly, O., et al. Two-photon live imaging of single corneal stem cells reveals compartmentalized organization of the limbal niche. Cell Stem Cell. 28 (7), 1233-1247 (2021).
- Ikkala, K., Michon, F., Stratoulias, V. Unilateral Zebrafish corneal injury induces bilateral cell plasticity supporting wound closure. Scientific Reports. , (2021).
- Ormerod, L. D., Abelson, M. B., Kenyon, K. R. Standard models of corneal injury using alkali-immersed filter discs. Investigative Ophthalmology & Visual Science. 30 (10), 2148-2153 (1989).
- Anderson, C., Zhou, Q., Wang, S. An alkali-burn injury model of corneal neovascularization in the mouse. Journal of visualized experiments: JoVE. (86), e51159 (2014).
- Choi, H., et al. Comprehensive modeling of corneal alkali injury in the rat eye. Current Eye Research. 42 (10), 1348-1357 (2017).
- Singh, P., Tyagi, M., Kumar, Y., Gupta, K. K., Sharma, P. D. Ocular chemical injuries and their management. Oman Journal of Ophthalmology. 6 (2), 83-86 (2013).
- Pal-Ghosh, S. BALB/c and C57BL6 mouse strains vary in their ability to heal corneal epithelial debridement wounds. Experimental Eye Research. 87 (5), 478-486 (2008).
- Chen, J. J., Tseng, S. C. Abnormal corneal epithelial wound healing in partial-thickness removal of limbal epithelium. Investigative Ophthalmology & Visual Science. 32 (8), 2219-2233 (1991).
- Xeroudaki, M., Peebo, B., Germundsson, J., Fagerholm, P., Lagali, N. RGTA in corneal wound healing after transepithelial laser ablation in a rabbit model: a randomized, blinded, placebo-controlled study. Acta Ophthalmologica. 94 (7), 685-691 (2016).
- . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio Available from: https://zfinorg/zf_info/zfbook/zfbk.html (2000)
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Xu, C., Volkery, S., Siekmann, A. F. Intubation-based anesthesia for long-term time-lapse imaging of adult zebrafish. Nature Protocols. 10 (12), 2064-2073 (2015).
- Crosson, C. E., Klyce, S. D., Beuerman, R. W. Epithelial wound closure in the rabbit cornea. A biphasic process. Investigative Ophthalmology & Visual Science. 27 (4), 464-473 (1986).
- Parlanti, P., et al. Axonal debris accumulates in corneal epithelial cells after intraepithelial corneal nerves are damaged: A focused Ion Beam Scanning Electron Microscopy (FIB-SEM) study. Experimental Eye Research. 194, 107998 (2020).
- Zhao, X. C., et al. The zebrafish cornea: structure and development. Investigative Ophthalmology & Visual Science. 47 (10), 4341-4348 (2006).
- Richardson, R., et al. Re-epithelialization of cutaneous wounds in adult zebrafish combines mechanisms of wound closure in embryonic and adult mammals. Development. 143 (12), 2077-2088 (2016).
- van Loon, A. P., Erofeev, I. S., Maryshev, I. V., Goryachev, A. B., Sagasti, A. Cortical contraction drives the 3D patterning of epithelial cell surfaces. The Journal of Cell Biology. 219 (3), (2020).
- Vihtelic, T. S., Hyde, D. R. Light-induced rod and cone cell death and regeneration in the adult albino zebrafish (Danio rerio) retina. Journal of Neurobiology. 44 (3), 289-307 (2000).
- Poss, K. D., Wilson, L. G., Keating, M. T. Heart regeneration in zebrafish. Science. 298 (5601), 2188-2190 (2002).
- Becker, T., Wullimann, M. F., Becker, C. G., Bernhardt, R. R., Schachner, M. Axonal regrowth after spinal cord transection in adult zebrafish. The Journal of Comparative Neurology. 377 (4), 577-595 (1997).
- Hu, X., et al. Sirt6 deficiency impairs corneal epithelial wound healing. Aging. 10 (8), 1932-1946 (2018).
- Ksander, B. R., et al. ABCB5 is a limbal stem cell gene required for corneal development and repair. Nature. 511 (7509), 353-357 (2014).
- Pan, Y. A., et al. Zebrabow: multispectral cell labeling for cell tracing and lineage analysis in zebrafish. Development. 140 (13), 2835-2846 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten