Method Article
Zebrafish Corneal Wound Healing: dall'abrasione all'analisi di imaging della chiusura della ferita
In questo articolo
Riepilogo
Questo protocollo si concentra sul danneggiamento della superficie oculare del pesce zebra attraverso l'abrasione per valutare la successiva chiusura della ferita a livello cellulare. Questo approccio sfrutta una bava oculare per rimuovere parzialmente l'epitelio corneale e utilizza la microscopia elettronica a scansione per tracciare i cambiamenti nella morfologia cellulare durante la chiusura della ferita.
Abstract
Come la superficie trasparente dell'occhio, la cornea è strumentale per la visione chiara. A causa della sua posizione, questo tessuto è soggetto a insulti ambientali. In effetti, le lesioni oculari più frequentemente riscontrate clinicamente sono quelle alla cornea. Mentre la guarigione delle ferite corneali è stata ampiamente studiata nei piccoli mammiferi (cioè topi, ratti e conigli), gli studi di fisiologia corneale hanno trascurato altre specie, incluso il pesce zebra, nonostante il pesce zebra sia un classico modello di ricerca.
Questo rapporto descrive un metodo per eseguire un'abrasione corneale sul pesce zebra. La ferita viene eseguita in vivo su pesci anestetizzati utilizzando una bava oculare. Questo metodo consente una ferita epiteliale riproducibile, lasciando intatto il resto dell'occhio. Dopo l'abrasione, la chiusura della ferita viene monitorata nel corso di 3 ore, dopo di che la ferita viene rielettileializzata. Utilizzando la microscopia elettronica a scansione, seguita dall'elaborazione delle immagini, la forma della cellula epiteliale e le protrusioni apicali possono essere studiate per studiare i vari passaggi durante la chiusura della ferita epiteliale corneale.
Le caratteristiche del modello zebrafish consentono lo studio della fisiologia del tessuto epiteliale e del comportamento collettivo delle cellule epiteliali quando il tessuto viene sfidato. Inoltre, l'uso di un modello privato dell'influenza del film lacrimale può produrre nuove risposte per quanto riguarda la risposta corneale allo stress. Infine, questo modello permette anche la delineazione degli eventi cellulari e molecolari coinvolti in qualsiasi tessuto epiteliale sottoposto ad una ferita fisica. Questo metodo può essere applicato alla valutazione dell'efficacia del farmaco nei test preclinici.
Introduzione
Poiché la maggior parte degli epiteli sono a contatto con l'ambiente esterno, sono soggetti a lesioni fisiche, rendendoli adatti per lo studio dei processi di guarigione delle ferite. Tra i tessuti ben studiati, la cornea è un modello estremamente utile nello studio degli aspetti cellulari e molecolari della guarigione delle ferite. Come superficie esterna trasparente, fornisce protezione fisica all'occhio ed è il primo elemento a focalizzare la luce sulla retina. Mentre la struttura e la composizione cellulare della retina differiscono tra la specie1, questi elementi della cornea sono generalmente simili in tutti gli occhi di tipo camera, indipendentemente dalla specie.
La cornea è composta da tre strati principali2. Il primo e più esterno strato è l'epitelio, che viene costantemente rinnovato per garantirne la trasparenza. Il secondo strato è lo stroma, che contiene cellule sparse, chiamate cheratociti, all'interno di uno spesso strato di fibre di collagene rigorosamente organizzate. Il terzo e più interno strato è l'endotelio, che consente la diffusione di nutrienti e liquidi dalla camera anteriore agli strati esterni. Le cellule epiteliali e stromali interagiscono attraverso fattori di crescita e citochine3. Questa interazione è evidenziata dalla rapida apoptosi e dalla successiva proliferazione dei cheratociti dopo danno epiteliale 4,5. In caso di una ferita più profonda, come una puntura, i cheratociti prendono parte attiva al processo di guarigione6.
Essendo a contatto con l'ambiente esterno, le lesioni fisiche corneali sono comuni. Molti di loro sono causati da piccoli oggetti estranei7, come sabbia o polvere. Il riflesso dello sfregamento degli occhi può portare a estese abrasioni epiteliali e rimodellamento corneale8. Secondo le dimensioni e la profondità della ferita, queste lesioni fisiche sono dolorose e richiedono diversi giorni per guarire9. Le caratteristiche ottimali di guarigione delle ferite di un modello facilitano la comprensione degli aspetti cellulari e molecolari della chiusura della ferita. Inoltre, tali modelli si sono dimostrati utili anche per testare nuove molecole con il potenziale di accelerare la guarigione corneale, come precedentemente dimostrato10,11.
Il protocollo qui descritto mira a utilizzare il pesce zebra come modello rilevante per studiare le lesioni fisiche corneali. Questo modello è molto conveniente per gli studi di screening farmacologico in quanto consente di aggiungere molecole direttamente all'acqua del serbatoio e, quindi, di entrare in contatto con una cornea curativa. I dettagli forniti qui aiuteranno gli scienziati a eseguire i loro studi sul modello di zebrafish. La lesione in vivo viene eseguita con una bava oculare opaca. L'impatto sulle cellule epiteliali adiacenti o a distanza da esso può essere analizzato rimuovendo specificamente l'epitelio corneale centrale. Negli ultimi anni, numerosi rapporti si sono concentrati su tale metodo sulla cornea dei roditori 12,13,14,15,16,17; tuttavia, ad oggi, solo un singolo rapporto ha applicato questo metodo al pesce zebra18.
A causa della sua semplicità, la ferita fisica è utile per delineare il ruolo delle cellule epiteliali nella chiusura della ferita. Un altro modello ben consolidato di danno corneale è l'ustione chimica, in particolare l'ustione alcalina 19,20,21. Tuttavia, un tale approccio danneggia indirettamente l'intera superficie oculare, compresa la cornea periferica e lo stroma corneale19. In effetti, le ustioni alcaline potenzialmente inducono ulcere corneali, perforazioni, opacizzazione epiteliale e rapida neovascolarizzazione22, e l'esito incontrollabile delle ustioni alcaline squalifica tale approccio per gli studi generali di guarigione delle ferite. Numerosi altri metodi sono utilizzati anche per studiare la guarigione delle ferite corneali secondo il particolare focus dello studio in questione (ad esempio, debridement epiteliale completo23, la combinazione di lesioni chimiche e meccaniche per ferite a spessore parziale24, ablazione laser ad eccimeri per ferite che si estendono allo stroma25). L'uso di una bava oculare limita il punto focale alla risposta epiteliale alla ferita e fornisce una ferita altamente riproducibile.
Come con ogni metodo di inflizione della ferita, l'uso di una bava oculare presenta vantaggi e svantaggi. Lo svantaggio principale è che la risposta essendo per lo più epiteliale, non riflette perfettamente le abrasioni osservate in ambito clinico. Tuttavia, questo metodo presenta numerosi vantaggi, tra cui la facilità con cui può essere impostato ed eseguito, la sua precisione, la sua riproducibilità e il fatto che non sia invasivo, rendendolo un metodo ben tollerato dagli animali.
Protocollo
Tutti gli esperimenti sono stati approvati dal consiglio nazionale per gli esperimenti sugli animali.
1. Preparativi
- Preparare in anticipo la soluzione madre di tricaina utilizzata per l'anestesia26 (soluzione madre allo 0,4% utilizzata in questo protocollo). Utilizzare guanti e tenere i materiali in una cappa aspirante quando possibile.
- Per 50 ml di una soluzione allo 0,4%, pesare 200 mg di polvere di tricaina in un tubo da 50 ml. Sciogliere la polvere in circa 45 ml di acqua a doppio distillato.
- Regolare il pH della soluzione madre di tricaina a 7 con 1 M Tris (pH 8,8, ~1,25 mL). Aggiungere la soluzione di Tris allo stock di tricaina in aliquote, mescolare accuratamente il brodo dopo ogni aliquota e controllare il pH dopo ogni aggiunta di Tris.
- Prima dell'esperimento, preparare una soluzione di lavoro allo 0,02% di tricaina.
- Scongelare 2 mL di soluzione madre allo 0,4% e aggiungere a 40 mL di acqua di sistema (concentrazione finale 0,02%). Posizionare la soluzione in un piccolo contenitore.
- Prima dell'esperimento, preparare l'acqua di recupero contenente analgesico. Utilizzare guanti e tenere i materiali nel cappuccio dei fumi quando possibile.
- Per un litro di acqua di recupero, pesare 2,5 mg di lidocaina cloridrato in polvere e scioglierlo in acqua dolce del sistema. Controllare il pH e regolare a 7 se necessario.
- Prima dell'esperimento, preparare la soluzione fissante (glutaraldeide al 2,5% in soluzione di fosfato di sodio 0,1 M (Na-PO4) a pH 7,4). Utilizzare guanti e tenere i materiali in una cappa aspirante.
- Per 10 mL della soluzione di fissaggio, pipettare 5 mL di 0,2 M Na-PO4 in un tubo. Aggiungere 0,5 ml di glutaraldeide al 50% e aggiungere acqua a doppio distillato per ottenere il volume finale di 10 ml. Proteggere la soluzione dalla luce e conservarla sul ghiaccio o in frigorifero prima dell'uso.
NOTA: se i campioni devono essere raccolti per diverse ore dopo l'avvolgimento, preparare la soluzione fissante appena prima dell'uso.
- Per 10 mL della soluzione di fissaggio, pipettare 5 mL di 0,2 M Na-PO4 in un tubo. Aggiungere 0,5 ml di glutaraldeide al 50% e aggiungere acqua a doppio distillato per ottenere il volume finale di 10 ml. Proteggere la soluzione dalla luce e conservarla sul ghiaccio o in frigorifero prima dell'uso.
- Preparare l'attrezzatura per il ferimento (Figura 1).
- Riempire i serbatoi di recupero o i contenitori più piccoli con acqua di sistema.
- Avere la bava oftalmica pronta. Controllare che la punta della bava sia pulita. Se necessario, rimuovere i detriti cellulari con un batuffolo di cotone umido.
- Fai un'incisione sul lato di una spugna morbida e inumidisci la spugna con acqua di sistema. Posizionare la spugna sulla base/ stadio di un microscopio di dissezione. Garantire uno spazio di lavoro sufficiente per l'utilizzo della bava e un'illuminazione sufficiente dai lati e/o dall'alto per vedere correttamente la superficie dell'occhio.
2. Anestesia
- Trasferire un pesce dall'acquario alla soluzione di tricaina allo 0,02% con una rete il più delicatamente possibile.
- Monitorare l'anestesia, verificando la mancanza di risposta allo stimolo meccanico della luce.
NOTA: per un'anestesia coerente, viene utilizzata un'esposizione di 2 minuti alla tricaina prima dell'abrasione con pesci AB selvatici adulti. Con pesci di altro background genetico, potrebbe essere necessaria una durata diversa.
3. Abrasione
- Posizionare delicatamente il pesce anestetizzato con un cucchiaio nell'incisione sulla spugna, con la testa sporgente dalla superficie della spugna.
- Accendere la bava e focalizzare la vista del microscopio sulla superficie dell'occhio.
- Avvicinarsi con attenzione alla superficie dell'occhio con la punta della bava. Quando tocchi la superficie dell'occhio, inizia a muovere la punta della bava sulla superficie dell'occhio con un movimento circolare. Evitare movimenti improvvisi, in quanto potrebbero portare all'inclinazione dell'occhio nella presa e alla punta della bava per scivolare.
- Quando l'abrasione è fatta, posizionare con cura il pesce nell'acqua di sistema contenente l'analgesico per il recupero.
- Pulire la bava subito dopo l'uso con un batuffolo di cotone umido.
4. Raccolta di campioni
- Nel momento desiderato, raccogliere il pesce con una rete e metterlo in soluzione di tricaina allo 0,02%. Tenere l'animale nella soluzione fino a quando il movimento opercolare non è cessato completamente e il pesce non reagisce al tatto.
- Metti il pesce su una capsula di Petri con un cucchiaio e tienilo con una pinzetta. Decapitare il pesce con le forbici sezionanti. Evitare di fare graffi sulla superficie dell'occhio durante la manipolazione del campione.
- Mettere il tessuto in una provetta contenente 0,1 M Na-PO4.
- Risciacquare il tessuto sostituendo il Na-PO4 0,1 M con un tampone pulito in modo che non rimanga sangue nella soluzione.
5. Elaborazione del campione per microscopia elettronica
- Fissare il tessuto in glutaraldeide al 2,5%/0,1 M Na-PO4 (pH 7,4) per ~24 h a +4 °C. Tenere il campione su un portacampioni rotante/tremante per garantire una corretta fissazione.
- Rimuovere la soluzione fissante e risciacquare il campione più volte con 0,1 M Na-PO4.
- Sezionare il campione a questo punto.
- Posizionare il campione su una goccia di 0,1 M Na-PO4 su una piastra di dissezione. Se entrambi gli occhi dello stesso pesce devono essere ripresi, tagliare il campione di testa in due con forbici da dissezione fine.
- In alternativa, raccogliere gli occhi solo posizionando con cura le punte delle pinzette sottili nell'orbita oculare dal lato dell'occhio, facendo particolare attenzione a non graffiare la superficie dell'occhio. Quindi, estrarre l'occhio dalla presa.
- Trasferire il campione sezionato in una provetta contenente 0,1 M Na-PO4. Assicurarsi che non vi sia tessuto extra nella provetta del campione, in quanto potrebbe aderire alla parte superiore dell'occhio durante l'elaborazione del campione.
- Conservare il campione in 0,1 M Na-PO4 (massimo una settimana) a +4 °C.
- Elaborare i campioni per l'imaging al microscopio elettronico.
- Postfiggere i campioni in tetrossido di osmio al 2% in tampone Na-PO4 da 0,1 M per 1 ora a temperatura ambiente (RT).
- Lavare i campioni 3 volte per 5 minuti ogni lavaggio in 0,1 M Na-PO4 a RT.
- Disidratare i campioni successivamente in etanolo al 30%, 50% e 70% per 1 ora in ogni soluzione a RT.
- Immergere i campioni in etanolo al 96% per 2-3 ore a RT.
- Successivamente, incubare i campioni due volte in etanolo al 100%, prima per 1 ora e poi in etanolo fresco al 100% durante la notte a +4 °C.
- Sottoporre i campioni a 30 cicli in un essiccatore automatico a punti critici.
- Incorporare e rivestire in platino i campioni.
- Posizionare una linguetta adesiva su un supporto. Se il campione deve essere contrassegnato sulla parte superiore del supporto, lasciare un pezzo di carta da copertina della scheda sulla scheda e scrivere l'ID del campione sulla carta.
- Posizionare il supporto con la linguetta sulla base di un microscopio di dissezione.
- Posizionare delicatamente il campione di tessuto sul supporto con una pinzetta fine, la cornea rivolta verso l'alto.
- Rivestire il campione con platino utilizzando il dispositivo appropriato. Dopo il rivestimento, conservare i campioni a temperatura ambiente fino all'imaging.
6. Imaging (Figura 2)
- Utilizzare i dispositivi come consigliato nel manuale dell'utente e dagli esperti di imaging.
- Acquisisci immagini dell'ingrandimento desiderato e utilizza immagini 2.000-2.500x per l'analisi.
- Regola la luminosità e il contrasto in modo che non ci siano aree sovraesposte nell'immagine e i bordi delle celle e le microridge siano visti nel modo più chiaro possibile.
NOTA: la posizione e l'angolo del tessuto influiscono sulle impostazioni di luminosità e contrasto. Potrebbe essere necessario regolarli da campione a campione e tra diverse regioni del tessuto.
7. Misurazione della forma, delle dimensioni e del modello di microridge della cella
- Aprire l'immagine TIFF in Fiji ImageJ 1.5327. Impostate la scala utilizzando la barra della scala dell'immagine: create una linea di dimensioni uguali alla barra della scala con lo strumento linea . Seleziona Analizza | Impostare la scala e digitare la distanza nota. Aprire il ROI manager dal | Analizza Menu Strumenti .
- Per le dimensioni e l'rotondità della cella, selezionate Analizza | Impostare le misure | Descrittori di forma. Utilizzare lo strumento Lente di ingrandimento per visualizzare le celle in ingrandimento. Selezionare le celle con lo strumento Poligono e aggiungere ogni selezione al gestore del ROI. Infine, misurare le celle selezionate e salvare la misurazione.
- Analisi di Microridge (Figura 3 e Figura 4)
- Assicurarsi che l'immagine sia in formato a 8 bit dal | Menu Tipo .
- Selezionate una cella con lo strumento Poligono e cancellate lo sfondo da Modifica | Chiaro all'esterno.
- Smussate l'immagine da una a tre volte selezionando Elabora | Fluida e regola la luminosità e il contrasto da Image | Regolare | Luminosità / Contrasto in modo che le microridge si distinguano nel modo più chiaro possibile.
- Convolvere l'immagine da Process | Filtri | Convolvere, trasforma in binario da Process | | binaria Crea binario e scheletra l'immagine in bianco e nero selezionando Elabora | | binaria Scheletrare.
- Utilizzare la funzione Analizza ossatura nel | Analizza Menu Scheletro per misurare i parametri microridge e salvare i valori.
NOTA: in SEM, le singole immagini possono differire in termini di luminosità e contrasto. Pertanto, i passaggi dell'analisi potrebbero richiedere regolazioni da un'immagine all'altra.
Risultati
Questo studio descrive un metodo che utilizza una bava oftalmica in esperimenti di guarigione delle ferite corneali zebrafish. Il metodo è stato modificato da studi precedenti sui topi, dove la bava ha dimostrato di rimuovere gli strati cellulari epiteliali in modo efficiente13. Le sfide nel ferimento corneale del pesce zebra includono le dimensioni relativamente piccole dell'occhio e, nel caso di esperimenti che richiedono tempo, la necessità di mantenere un flusso d'acqua costante attraverso le branchie (come descritto da Xu e colleghi28). I principali vantaggi di questo metodo sono la sua semplicità e velocità. Un microscopio di dissezione standard viene utilizzato per l'uso controllato della bava (Figura 1). Poiché la procedura è di breve durata (circa 3 minuti dall'inizio dell'anestesia), il pesce si riprende bene dalla manipolazione e non è necessaria alcuna attrezzatura aggiuntiva per il mantenimento dell'anestesia e l'erogazione di ossigeno.
Esistono diversi modi per visualizzare la ferita corneale. Questo protocollo utilizza la microscopia elettronica a scansione (SEM, Figura 2), che ha una lunga storia di utilizzo negli studicorneali 29,30. Sebbene questo approccio non consenta una valutazione degli strati inferiori dell'epitelio, fornisce un metodo semplice per stimare la velocità di guarigione delle ferite e confrontare le superfici corneali di diverse regioni dell'occhio. A 3 ore dopo la ferita, mentre l'area della ferita è chiusa (Figura 2), il sito in cui sono uniti i bordi della ferita rimane visibile (Figura 2).
Le cellule superficiali sulla cornea del pesce zebra contengono microridge pronunciate31. Recentemente, uno studio ha riportato che queste strutture sono perse in cellule allungate adiacenti alle ferite sulla pelle di zebrafish32. Tuttavia, i risultati presentati mostrano che sull'epitelio corneale abraso, le microridge possono essere osservate in alcune cellule allungate vicino al sito della ferita (Figura 4B). In alcune regioni periferiche, le microridge vengono perse dal centro della cellula (Figura 4C, D). Per un'analisi più dettagliata, l'area e la rotondità delle cellule apicali sono quantificate, oltre alla quantità di microridge e alla lunghezza media in ImageJ27 (Figura 3 e Figura 4E-H).
L'analisi della microridge viene eseguita utilizzando la funzione Skeleton (modificata da van Loon e colleghi33). Un confronto tra le due regioni periferiche (Figura 4A (regioni C e D), Figura 4C e Figura 4D) rivela che le cellule nella Figura 4D sono più allungate (indicando riarrangiamenti cellulari come reazione alla ferita) e hanno microridge medie più corte rispetto alle cellule nella Figura 4C. Questo risultato suggerisce che il cambiamento nella forma cellulare è correlato con la modifica della microridge e sottolinea l'eterogeneità all'interno dell'epitelio corneale nella risposta della ferita.
Misurare l'area e la rotondità delle cellule apicali su immagini SEM è un modo semplice e riproducibile per ottenere dati quantitativi sull'aspetto cellulare in diverse regioni della cornea. Sebbene limitato al 2D, questo approccio aiuta ad acquisire una comprensione generale della dinamica e della velocità dei riarrangiamenti cellulari durante la chiusura della ferita. Le immagini SEM vengono utilizzate per analizzare i modelli di microridge sulla superficie della cellula apicale. L'elaborazione delle immagini qui descritta fornisce un'approssimazione dei cambiamenti nei parametri microridge, che sarebbe noioso misurare a mano.

Figura 1: La configurazione per l'abrasione corneale. (A) Un microscopio di dissezione è necessario per l'abrasione controllata sul piccolo occhio di zebrafish. (B) La spugna aiuta a stabilizzare il pesce anestetizzato durante la procedura. (C) Il pesce viene anestetizzato su una capsula di Petri e l'animale anestetizzato viene trasferito sulla spugna con un cucchiaino. Una bava oculare con una punta di 0,5 mm viene utilizzata per abradere la cornea. Fare clic qui per visualizzare una versione più grande di questa figura.
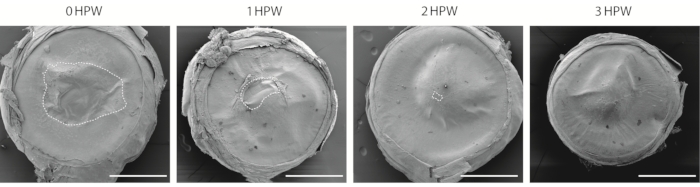
Figura 2: Visualizzazione della cornea ferita con microscopia elettronica a scansione. La panoramica della cornea abrasa raccolta a 0, 1, 2 o 3 ore dopo la ferita (HPW). Il contorno tratteggiato indica il bordo della ferita. Barre di scala = 500 μm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Un esempio di modifica dell'immagine prima della misurazione della microridge. Sebbene non sia una replica esatta della superficie cellulare originale, il modello scheletrato finale cattura le differenze tra il centro cellulare e la periferia. Barra della scala = 10 μm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Un confronto tra l'area delle cellule apicali, la rotondità e i valori di microridge tra due regioni periferiche dopo l'abrasione corneale. (A) Una panoramica dell'occhio ferito. Le caselle indicano la posizione delle immagini di ingrandimento superiore (in B, C e D). (C, D) Le celle selezionate per l'analisi del descrittore di forma sono contrassegnate da un contorno verde. (E, F) Valori di area cellulare apicale (E) e rotondità (F) delle celle selezionate. (G, H) Microridge lunghezza totale (G) e lunghezza media (H) delle stesse celle. I gruppi sono stati confrontati statisticamente con un t-test a due code (*p ≤ 0,05, **p ≤ 0,01) Barre di scala = 500 μm in A, 50 μm in B, C e D. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Le lesioni fisiche corneali sono la causa più comune di visite dei pazienti oftalmologici in ospedale. Pertanto, è importante stabilire modelli pertinenti per lo studio di diversi aspetti della fisiopatologia corneale. Finora, il topo è il modello più comunemente usato per lo studio della guarigione delle ferite corneali. Tuttavia, l'aggiunta di colliri sugli occhi feriti murini per convalidare l'impatto di farmaci specifici sulla guarigione delle ferite corneali può essere difficile. A questo proposito, il modello zebrafish è particolarmente utile per lo screening farmacologico di molecole che influenzano la guarigione delle ferite corneali. Il metodo qui descritto è molto simile a quello descritto per il mouse13.
Due punti specifici di differenza, tuttavia, devono essere tenuti a mente. In primo luogo, l'uso di una bava oftalmica richiede pratica per garantire la riproducibilità della ferita, in particolare per quanto riguarda la pressione esercitata sull'occhio, che è fondamentale per una corretta abrasione. Inoltre, la punta abrasiva deve essere cambiata quando l'epitelio non viene più rimosso in modo efficiente. In secondo luogo, mentre la struttura e la morfologia della cornea del pesce zebra sono simili ad altre cornee31, questo animale possiede capacità rigenerative che non hanno eguali negli organismi dei mammiferi 34,35,36. Mentre la chiusura della ferita nel topo dura per 48-72 h 11,14,37, una timeline di 3 h è riportata per il pesce zebra. A causa delle somiglianze strutturali e molecolari, il comportamento cellulare indotto da una ferita fisica corneale è probabilmente simile nella maggior parte dei vertebrati. Tuttavia, la risposta rapida nel pesce zebra è probabilmente guidata da un meccanismo rigenerativo avanzato specifico per quell'animale.
Il protocollo descritto utilizza SEM per tracciare la chiusura della ferita. Numerosi altri studi hanno utilizzato invece la microscopia a fluorescenza per tracciare questo processo 15,17,38. Tuttavia, l'uso di SEM facilita l'analisi della modifica della forma cellulare a seguito di abrasione epiteliale. Il rovescio della medaglia di questa tecnologia è che le fasi di stratificazione non possono essere tracciate, poiché SEM consente solo l'imaging dello strato più esterno. Per studiare l'epitelio in 3D durante la guarigione corneale completa, devono essere utilizzati modelli fluorescenti, come Zebrabow39 o immunolabeling.
L'uso del pesce zebra come modello di guarigione delle ferite corneali migliora l'ambito di indagine in quanto consente l'applicazione di numerosi strumenti molecolari disponibili, come linee di pesce geneticamente modificate, morfolinos e screening chimico, per espandere significativamente la possibile gamma di studi di guarigione delle ferite corneali. Inoltre, la dimensione degli occhi di zebrafish consente lo sviluppo di nuove strategie di imaging per studiare la dinamica delle cellule epiteliali in modo più dettagliato di quanto si possa fare con gli occhi murini.
L'obiettivo principale di questo rapporto non è solo quello di adattare l'approccio fisico alle ferite corneali al modello di zebrafish, ma anche di dimostrare che l'uso di nuovi modelli consente di porre e rispondere a nuove domande e indica nuovi modi di indagare i fenomeni biologici fondamentali. Questi vantaggi saranno in definitiva vantaggiosi per i pazienti.
Divulgazioni
Gli autori non hanno conflitti di interesse da divulgare.
Riconoscimenti
Gli autori ringraziano Pertti Panula per l'accesso all'unità Zebrafish e Henri Koivula per la guida e l'aiuto con gli esperimenti di zebrafish. Questa ricerca è stata sostenuta dall'Accademia di Finlandia, dalla Fondazione Jane e Aatos Erkko, dalla Fondazione culturale finlandese e dal programma ATIP-Avenir. L'imaging è stato eseguito presso l'unità di microscopia elettronica e l'unità di microscopia ottica, Istituto di biotecnologia, supportato da HiLIFE e Biocenter Finland.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.1M Na-PO4 (sodium phosphate buffer), pH 7.4 | in-house | Solution is prepared from 1M sodium phosphate buffer (1M Na2HPO4 adjusted to pH 7.4 with 1M NaH2PO4). | |
| 0.2M Na-PO4 (sodium phosphate buffer), pH 7.4 | in-house | Solution is prepared from 1M sodium phosphate buffer (1M Na2HPO4 adjusted to pH 7.4 with 1M NaH2PO4). | |
| 0.5mm burr tips | Alger Equipment Company | BU-5S | |
| 1M Tris, pH 8.8 | in-house | ||
| adhesive tabs | Agar Scientific | G3347N | |
| Algerbrush burr, Complete instrument | Alger Equipment Company | BR2-5 | |
| Cotton swaps | Heinz Herenz Hamburg | 1030128 | |
| Dissecting plate | in-house | ||
| Dissecting tools | Fine Science Tools | ||
| double-distilled water | in-house | ||
| Eppedorf tubes, 2ml | any provider | ||
| Ethyl 3-aminobenzoate methanesulfonate salt | Sigma | A5040 | Caution: causes irritation. |
| Glutaraldehyde, 50% aqueous solution, grade I | Sigma | G7651 | Caution: toxic. |
| Lidocaine hydrochloride | Sigma | L5647 | Caution: toxic. |
| mounts | Agar Scientific | G301P | |
| Petri dish | Thermo Scientific | 101VR20 | |
| pH indicator strips | Macherey-Nagel | 92110 | |
| Plastic spoons | any provider | ||
| Plastic tubes, 15 ml | Greiner Bio-One | 188271 | |
| Plastic tubes, 50 ml | Greiner Bio-One | 227261 | |
| Scanning electron microscope | FEI | Quanta 250 FEG | |
| Soft sponge | any provider | ||
| Sputter coater | Quorum Technologies | GQ150TS | |
| Stereomicroscope | Leica |
Riferimenti
- Baden, T., Euler, T., Berens, P. Understanding the retinal basis of vision across species. Nature Reviews.Neuroscience. 21 (1), 5-20 (2020).
- Nishida, T., Saika, S., Morishige, N., Manis, M. J., Holland, E. J. Cornea and sclera: Anatomy and physiology. Cornea: Fundamentals, diagnosis and management, 4th ed. , 1-22 (2017).
- Wilson, S. E., Liu, J. J., Mohan, R. R. Stromal-epithelial interactions in the cornea. Progress in Retinal and Eye Research. 18 (3), 293-309 (1999).
- Wilson, S. E., et al. Epithelial injury induces keratocyte apoptosis: hypothesized role for the interleukin-1 system in the modulation of corneal tissue organization and wound healing. Experimental Eye Research. 62 (4), 325-327 (1996).
- Zieske, J. D., Guimaraes, S. R., Hutcheon, A. E. Kinetics of keratocyte proliferation in response to epithelial debridement. Experimental Eye Research. 72 (1), 33-39 (2001).
- West-Mays, J. A., Dwivedi, D. J. The keratocyte: corneal stromal cell with variable repair phenotypes. The International Journal of Biochemistry & Cell Biology. 38 (10), 1625-1631 (2006).
- Ahmed, F., House, R. J., Feldman, B. H. Corneal abrasions and corneal foreign bodies. Primary Care. 42 (3), 363-375 (2015).
- Ben-Eli, H., Erdinest, N., Solomon, A. Pathogenesis and complications of chronic eye rubbing in ocular allergy. Current Opinion in Allergy and Clinical Immunology. 19 (5), 526-534 (2019).
- Wilson, S. A., Last, A. Management of corneal abrasions. American Family Physician. 70 (1), 123-128 (2004).
- Nagata, M., et al. JBP485 promotes corneal epithelial wound healing. Scientific Reports. 5, 14776 (2015).
- Wang, X., et al. MANF promotes diabetic corneal epithelial wound healing and nerve regeneration by attenuating hyperglycemia-induced endoplasmic reticulum stress. Diabetes. 69 (6), 1264-1278 (2020).
- Li, F. J., et al. Evaluation of the AlgerBrush II rotating burr as a tool for inducing ocular surface failure in the New Zealand White rabbit. Experimental Eye Research. 147, 1-11 (2016).
- Kalha, S., Kuony, A., Michon, F. Corneal epithelial abrasion with ocular burr as a model for cornea wound healing. Journal of Visualized Experiments:JoVE. (137), e58071 (2018).
- Kalha, S., et al. Bmi1+ progenitor cell dynamics in murine cornea during homeostasis and wound healing. Stem Cells. 36 (4), 562-573 (2018).
- Park, M., et al. Visualizing the contribution of keratin-14(+) limbal epithelial precursors in corneal wound healing. Stem Cell Reports. 12 (1), 14-28 (2019).
- Kuony, A., et al. Ectodysplasin-A signaling is a key integrator in the lacrimal gland-cornea feedback loop. Development. 146 (14), (2019).
- Farrelly, O., et al. Two-photon live imaging of single corneal stem cells reveals compartmentalized organization of the limbal niche. Cell Stem Cell. 28 (7), 1233-1247 (2021).
- Ikkala, K., Michon, F., Stratoulias, V. Unilateral Zebrafish corneal injury induces bilateral cell plasticity supporting wound closure. Scientific Reports. , (2021).
- Ormerod, L. D., Abelson, M. B., Kenyon, K. R. Standard models of corneal injury using alkali-immersed filter discs. Investigative Ophthalmology & Visual Science. 30 (10), 2148-2153 (1989).
- Anderson, C., Zhou, Q., Wang, S. An alkali-burn injury model of corneal neovascularization in the mouse. Journal of visualized experiments: JoVE. (86), e51159 (2014).
- Choi, H., et al. Comprehensive modeling of corneal alkali injury in the rat eye. Current Eye Research. 42 (10), 1348-1357 (2017).
- Singh, P., Tyagi, M., Kumar, Y., Gupta, K. K., Sharma, P. D. Ocular chemical injuries and their management. Oman Journal of Ophthalmology. 6 (2), 83-86 (2013).
- Pal-Ghosh, S. BALB/c and C57BL6 mouse strains vary in their ability to heal corneal epithelial debridement wounds. Experimental Eye Research. 87 (5), 478-486 (2008).
- Chen, J. J., Tseng, S. C. Abnormal corneal epithelial wound healing in partial-thickness removal of limbal epithelium. Investigative Ophthalmology & Visual Science. 32 (8), 2219-2233 (1991).
- Xeroudaki, M., Peebo, B., Germundsson, J., Fagerholm, P., Lagali, N. RGTA in corneal wound healing after transepithelial laser ablation in a rabbit model: a randomized, blinded, placebo-controlled study. Acta Ophthalmologica. 94 (7), 685-691 (2016).
- . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio Available from: https://zfinorg/zf_info/zfbook/zfbk.html (2000)
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Xu, C., Volkery, S., Siekmann, A. F. Intubation-based anesthesia for long-term time-lapse imaging of adult zebrafish. Nature Protocols. 10 (12), 2064-2073 (2015).
- Crosson, C. E., Klyce, S. D., Beuerman, R. W. Epithelial wound closure in the rabbit cornea. A biphasic process. Investigative Ophthalmology & Visual Science. 27 (4), 464-473 (1986).
- Parlanti, P., et al. Axonal debris accumulates in corneal epithelial cells after intraepithelial corneal nerves are damaged: A focused Ion Beam Scanning Electron Microscopy (FIB-SEM) study. Experimental Eye Research. 194, 107998 (2020).
- Zhao, X. C., et al. The zebrafish cornea: structure and development. Investigative Ophthalmology & Visual Science. 47 (10), 4341-4348 (2006).
- Richardson, R., et al. Re-epithelialization of cutaneous wounds in adult zebrafish combines mechanisms of wound closure in embryonic and adult mammals. Development. 143 (12), 2077-2088 (2016).
- van Loon, A. P., Erofeev, I. S., Maryshev, I. V., Goryachev, A. B., Sagasti, A. Cortical contraction drives the 3D patterning of epithelial cell surfaces. The Journal of Cell Biology. 219 (3), (2020).
- Vihtelic, T. S., Hyde, D. R. Light-induced rod and cone cell death and regeneration in the adult albino zebrafish (Danio rerio) retina. Journal of Neurobiology. 44 (3), 289-307 (2000).
- Poss, K. D., Wilson, L. G., Keating, M. T. Heart regeneration in zebrafish. Science. 298 (5601), 2188-2190 (2002).
- Becker, T., Wullimann, M. F., Becker, C. G., Bernhardt, R. R., Schachner, M. Axonal regrowth after spinal cord transection in adult zebrafish. The Journal of Comparative Neurology. 377 (4), 577-595 (1997).
- Hu, X., et al. Sirt6 deficiency impairs corneal epithelial wound healing. Aging. 10 (8), 1932-1946 (2018).
- Ksander, B. R., et al. ABCB5 is a limbal stem cell gene required for corneal development and repair. Nature. 511 (7509), 353-357 (2014).
- Pan, Y. A., et al. Zebrabow: multispectral cell labeling for cell tracing and lineage analysis in zebrafish. Development. 140 (13), 2835-2846 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon