Method Article
التئام جروح قرنية الزرد: من التآكل إلى تحليل التصوير لإغلاق الجرح
In This Article
Summary
يركز هذا البروتوكول على إتلاف سطح العين لسمك الزرد من خلال التآكل لتقييم إغلاق الجرح اللاحق على المستوى الخلوي. يستغل هذا النهج نتوء العين لإزالة ظهارة القرنية جزئيا ويستخدم المجهر الإلكتروني الماسح لتتبع التغيرات في مورفولوجيا الخلية أثناء إغلاق الجرح.
Abstract
باعتبارها السطح الشفاف للعين ، فإن القرنية مفيدة للرؤية الواضحة. بسبب موقعه ، هذا النسيج عرضة للإهانات البيئية. في الواقع ، فإن إصابات العين الأكثر شيوعا التي تتم مواجهتها سريريا هي تلك الموجودة في القرنية. في حين تمت دراسة التئام جروح القرنية على نطاق واسع في الثدييات الصغيرة (أي الفئران والجرذان والأرانب) ، فقد أهملت دراسات فسيولوجيا القرنية الأنواع الأخرى ، بما في ذلك الزرد ، على الرغم من أن أسماك الزرد هي نموذج بحثي كلاسيكي.
يصف هذا التقرير طريقة لإجراء تآكل القرنية على سمك الزرد. يتم تنفيذ الجرح في الجسم الحي على الأسماك المخدرة باستخدام نتوء العين. تسمح هذه الطريقة بجرح ظهاري قابل للتكرار ، تاركا بقية العين سليمة. بعد التآكل ، يتم مراقبة إغلاق الجرح على مدار 3 ساعات ، وبعد ذلك يتم إعادة ظهارة الجرح. باستخدام المجهر الإلكتروني الماسح ، متبوعا بمعالجة الصور ، يمكن التحقيق في شكل الخلية الظهارية ، والنتوءات القمية لدراسة الخطوات المختلفة أثناء إغلاق الجرح الظهاري القرنية.
تسمح خصائص نموذج الزرد بدراسة فسيولوجيا الأنسجة الظهارية والسلوك الجماعي للخلايا الظهارية عند تحدي الأنسجة. علاوة على ذلك ، فإن استخدام نموذج محروم من تأثير الفيلم المسيل للدموع يمكن أن ينتج إجابات جديدة فيما يتعلق باستجابة القرنية للإجهاد. وأخيرا، يسمح هذا النموذج أيضا بتحديد الأحداث الخلوية والجزيئية التي ينطوي عليها أي نسيج ظهاري يتعرض لجرح مادي. يمكن تطبيق هذه الطريقة على تقييم فعالية الدواء في الاختبارات قبل السريرية.
Introduction
نظرا لأن معظم الظهارة على اتصال بالبيئة الخارجية ، فهي عرضة للإصابة الجسدية ، مما يجعلها مناسبة تماما لدراسة عمليات التئام الجروح. من بين الأنسجة المدروسة جيدا ، تعد القرنية نموذجا مفيدا للغاية في التحقيق في الجوانب الخلوية والجزيئية لالتئام الجروح. كسطح خارجي شفاف ، فإنه يوفر الحماية المادية للعين وهو العنصر الأول لتركيز الضوء على شبكية العين. في حين أن بنية وتكوين الخلية في شبكية العين تختلف بين الأنواع1 ، فإن هذه العناصر من القرنية متشابهة بشكل عام في جميع العيون من نوع الكاميرا ، بغض النظر عن الأنواع.
تتكون القرنية من ثلاث طبقات رئيسية2. الطبقة الأولى والخارجية هي الظهارة ، التي يتم تجديدها باستمرار لضمان شفافيتها. الطبقة الثانية هي السدى ، التي تحتوي على خلايا متناثرة ، تسمى الخلايا القرنية ، داخل طبقة سميكة من ألياف الكولاجين المنظمة بدقة. الطبقة الثالثة والأعمق هي البطانة ، والتي تسمح بانتشار المغذيات والسوائل من الغرفة الأمامية إلى الطبقات الخارجية. تتفاعل الخلايا الظهارية واللحمية عبر عوامل النمو والسيتوكينات3. يتم تسليط الضوء على هذا التفاعل من خلال موت الخلايا المبرمج السريع والانتشار اللاحق للخلايا القرنية بعد الإصابة الظهارية 4,5. في حالة وجود جرح أعمق ، مثل ثقب ، تلعب الخلايا القرنية دورا نشطا في عملية الشفاء6.
كونها على اتصال مع البيئة الخارجية ، والإصابات الجسدية القرنية شائعة. كثير منها ناتج عن أجسام غريبة صغيرة7 ، مثل الرمل أو الغبار. يمكن أن يؤدي رد فعل فرك العين إلى سحجات ظهارية واسعة النطاق وإعادة تشكيل القرنية8. وفقا لحجم الجرح وعمقه ، فإن هذه الإصابات الجسدية مؤلمة وتستغرق عدة أيام للشفاء9. تسهل الخصائص المثلى لالتئام الجروح للنموذج فهم الجوانب الخلوية والجزيئية لإغلاق الجروح. علاوة على ذلك ، أثبتت هذه النماذج أيضا فائدتها لاختبار جزيئات جديدة لديها القدرة على تسريع شفاء القرنية ، كما هو موضح سابقا10,11.
يهدف البروتوكول الموصوف هنا إلى استخدام أسماك الزرد كنموذج ذي صلة لدراسة الإصابة الجسدية للقرنية. هذا النموذج مناسب للغاية لدراسات الفحص الدوائي لأنه يسمح بإضافة الجزيئات مباشرة إلى ماء الخزان ، وبالتالي ، للتلامس مع قرنية الشفاء. ستساعد التفاصيل المقدمة هنا العلماء على إجراء دراساتهم على نموذج الزرد. يتم تنفيذ الإصابة في الجسم الحي مع لدغ العين باهتة. يمكن تحليل التأثير على الخلايا الظهارية المجاورة أو على مسافة منه عن طريق إزالة ظهارة القرنية المركزية على وجه التحديد. في السنوات الأخيرة ، ركزت العديد من التقارير على مثل هذه الطريقة على قرنية القوارض12،13،14،15،16،17. ومع ذلك ، حتى الآن ، طبق تقرير واحد فقط هذه الطريقة على الزرد18.
بسبب بساطته ، فإن الجرح المادي مفيد في تحديد دور الخلايا الظهارية في إغلاق الجرح. نموذج آخر راسخ لإصابة القرنية هو الحرق الكيميائي ، وخاصة حرق القلويات19،20،21. ومع ذلك ، فإن مثل هذا النهج يضر بشكل غير مباشر بسطح العين بأكمله ، بما في ذلك القرنية الطرفية وسدى القرنية19. في الواقع ، من المحتمل أن تحفز الحروق القلوية قرحة القرنية ، والثقوب ، والعتامة الظهارية ، والأوعية الدموية الجديدة السريعة22 ، والنتيجة التي لا يمكن السيطرة عليها للحروق القلوية تستبعد هذا النهج للدراسات العامة لالتئام الجروح. تستخدم العديد من الطرق الأخرى أيضا للتحقيق في التئام جروح القرنية وفقا للتركيز الخاص للدراسة المعنية (على سبيل المثال ، التنضير الظهاري الكامل23 ، والجمع بين الإصابة الكيميائية والميكانيكية للجرح ذي السماكة الجزئية 24 ، والاستئصال بالليزر الإكسيمر للجروح التي تمتد إلى السدى25). استخدام لدغ العين يحد من النقطة البؤرية إلى الاستجابة الظهارية للجرح ويوفر جرحا قابلا للتكرار للغاية.
كما هو الحال مع كل طريقة لإلحاق الجرح ، فإن استخدام نتوء العين له مزايا وعيوب. العيب الرئيسي هو أن الاستجابة تكون في الغالب ظهارية ، فهي لا تعكس تماما السحجات التي شوهدت في الإعداد السريري. ومع ذلك ، فإن هذه الطريقة لها العديد من المزايا ، بما في ذلك السهولة التي يمكن بها إعدادها وتنفيذها ، ودقتها ، وقابليتها للتكرار ، وحقيقة أنها غير غازية ، مما يجعلها طريقة جيدة التحمل من قبل الحيوانات.
Protocol
تمت الموافقة على جميع التجارب من قبل المجلس الوطني للتجارب على الحيوانات.
1. التحضيرات
- قم بإعداد محلول مخزون التريكاين المستخدم في التخدير26 مقدما (محلول مخزون 0.4٪ المستخدم في هذا البروتوكول). استخدم القفازات واحتفظ بالمواد في غطاء الدخان كلما أمكن ذلك.
- للحصول على 50 مل من محلول 0.4٪ ، قم بوزن 200 ملغ من مسحوق التريكاين في أنبوب 50 مل. يذوب المسحوق في حوالي 45 مل من الماء المقطر المزدوج.
- اضبط الرقم الهيدروجيني لمحلول مخزون التريكاين على 7 مع 1 M Tris (الرقم الهيدروجيني 8.8 ، ~ 1.25 مل). أضف محلول Tris إلى مخزون التريكاين في الأليكوتس ، واخلط المخزون جيدا بعد كل أليكوت ، وتحقق من الرقم الهيدروجيني بعد كل إضافة من تريس.
- قبل التجربة ، قم بإعداد حل عمل بنسبة 0.02٪ من التريكاين.
- قم بإذابة 2 مل من محلول المخزون بنسبة 0.4٪ وأضف إلى 40 مل من مياه النظام (التركيز النهائي 0.02٪). ضع المحلول في حاوية صغيرة.
- قبل التجربة ، قم بإعداد مياه الاسترداد التي تحتوي على مسكن. استخدم القفازات واحتفظ بالمواد في غطاء الدخان كلما أمكن ذلك.
- للحصول على لتر واحد من مياه الاسترداد ، يزن 2.5 ملغ من مسحوق هيدروكلوريد ليدوكائين ويذوبه في مياه النظام العذبة. تحقق من الرقم الهيدروجيني واضبط على 7 إذا لزم الأمر.
- قبل التجربة ، قم بإعداد محلول التثبيت (2.5٪ glutaraldehyde في محلول 0.1 M فوسفات الصوديوم (Na-PO 4) عند درجة الحموضة7.4). استخدم القفازات واحتفظ بالمواد في غطاء الدخان.
- بالنسبة إلى 10 مل من محلول التثبيت ، قم بماصة 5 مل من 0.2 م Na-PO4 في أنبوب. أضف 0.5 مل من 50٪ glutaraldehyde ، وأضف الماء المقطر المزدوج للحصول على الحجم النهائي البالغ 10 مل. احمي المحلول من الضوء، واحفظه على الجليد أو في الثلاجة قبل الاستخدام.
ملاحظة: إذا كان يجب جمع العينات لعدة ساعات بعد الجرح ، فقم بإعداد محلول التثبيت قبل الاستخدام مباشرة.
- بالنسبة إلى 10 مل من محلول التثبيت ، قم بماصة 5 مل من 0.2 م Na-PO4 في أنبوب. أضف 0.5 مل من 50٪ glutaraldehyde ، وأضف الماء المقطر المزدوج للحصول على الحجم النهائي البالغ 10 مل. احمي المحلول من الضوء، واحفظه على الجليد أو في الثلاجة قبل الاستخدام.
- إعداد المعدات اللازمة للجرح (الشكل 1).
- املأ خزانات الاسترداد أو الحاويات الأصغر بمياه النظام.
- اجعل لدغة العيون جاهزة. تحقق من أن طرف لدغ نظيف. إذا لزم الأمر ، قم بإزالة حطام الخلايا باستخدام قطعة قطن رطبة.
- قم بعمل شق على جانب إسفنجة ناعمة ، وقم بترطيب الإسفنجة بماء النظام. ضع الإسفنجة على قاعدة / مرحلة مجهر تشريح. تأكد من وجود مساحة عمل كافية لاستخدام النتوء وإضاءة كافية من الجانبين و / أو أعلى لرؤية سطح العين بشكل صحيح.
2. التخدير
- انقل سمكة من الخزان إلى محلول تريكاين بنسبة 0.02٪ بشبكة بلطف قدر الإمكان.
- راقب التخدير ، وتحقق من عدم الاستجابة للتحفيز الميكانيكي الخفيف.
ملاحظة: للتخدير المستمر ، يتم استخدام التعرض لمدة 2 دقيقة للتريكاين قبل التآكل مع أسماك AB من النوع البري البالغ. مع الأسماك ذات الخلفية الوراثية الأخرى ، قد تكون هناك حاجة إلى مدة مختلفة.
3. التآكل
- ضع السمك المخدر بلطف بملعقة في الشق الموجود على الإسفنجة ، والرأس بارز من سطح الإسفنج.
- قم بتشغيل اللدغ ، وركز عرض المجهر على سطح العين.
- اقترب بعناية من سطح العين بطرف لدغ. عند لمس سطح العين ، ابدأ في تحريك طرف اللدغ على سطح العين بحركة دائرية. تجنب الحركة المفاجئة ، لأنها قد تؤدي إلى إمالة العين في المقبس وانزلاق طرف اللدغ.
- عند الانتهاء من التآكل ، ضع الأسماك بعناية في مياه النظام التي تحتوي على مسكن للتعافي.
- نظف النتوء مباشرة بعد الاستخدام باستخدام قطعة قطن رطبة.
4. جمع العينات
- في الوقت المطلوب ، التقط السمك بشبكة وضعه في محلول تريكاين بنسبة 0.02٪. احتفظ بالحيوان في المحلول حتى تتوقف حركة التشغيل تماما ، ولا تتفاعل الأسماك مع اللمس.
- ضع السمك على طبق بتري بملعقة ، وأمسكه بملاقط. قطع رأس الأسماك بمقص تشريح. تجنب حدوث أي خدوش على سطح العين عند التعامل مع العينة.
- ضع الأنسجة في أنبوب عينة يحتوي على 0.1 M Na-PO4.
- شطف الأنسجة عن طريق استبدال 0.1 M Na-PO4 مع مخزن مؤقت نظيف بحيث لا يبقى الدم في المحلول.
5. معالجة العينات للمجهر الإلكتروني
- إصلاح الأنسجة في 2.5٪ غلوتارالدهيد / 0.1 M Na-PO 4 (الرقم الهيدروجيني7.4 ) لمدة ~ 24 ساعة عند +4 درجة مئوية. احتفظ بالعينة على حامل عينة دوار/مهتز لضمان التثبيت المناسب.
- قم بإزالة محلول التثبيت وشطف العينة عدة مرات باستخدام 0.1 M Na-PO4.
- تشريح العينة في هذه المرحلة.
- ضع العينة على قطرة 0.1 M Na-PO4 على لوحة تشريح. إذا كان يجب تصوير كلتا العينين من نفس السمكة ، فقم بقطع عينة الرأس إلى قسمين باستخدام مقص تشريح دقيق.
- بدلا من ذلك ، اجمع العينين فقط عن طريق وضع أطراف الملقط الناعم بعناية في محجر العين من جانب العين ، مع الحرص الشديد على عدم خدش سطح العين. ثم اسحب العين من المقبس.
- انقل العينة المشوهة إلى أنبوب يحتوي على 0.1 M Na-PO4. تأكد من عدم وجود أنسجة إضافية في أنبوب العينة، لأنها قد تلتصق بالجزء العلوي من العين أثناء معالجة العينة.
- قم بتخزين العينة في 0.1 M Na-PO4 (بحد أقصى أسبوع واحد) عند +4 درجة مئوية.
- معالجة العينات للتصوير المجهري الإلكتروني.
- قم بتثبيت العينات في رابع أكسيد الأوزميوم بنسبة 2٪ في مخزن مؤقت Na-PO4 0.1 M لمدة 1 ساعة في درجة حرارة الغرفة (RT).
- اغسل العينات 3 مرات لمدة 5 دقائق كل غسل في 0.1 M Na-PO4 في RT.
- تجفيف العينات على التوالي في 30 ٪ ، 50 ٪ ، و 70 ٪ من الإيثانول لمدة 1 ساعة في كل محلول في RT.
- اغمر العينات في 96٪ من الإيثانول لمدة 2-3 ساعات في RT.
- بعد ذلك ، احتضن العينات مرتين في الإيثانول بنسبة 100٪ ، أولا لمدة 1 ساعة ثم في الإيثانول الطازج بنسبة 100٪ بين عشية وضحاها عند +4 درجة مئوية.
- إخضاع العينات ل 30 دورة في مجفف آلي للنقاط الحرجة.
- تضمين وتغليف العينات بالبلاتين.
- ضع علامة تبويب لاصقة على حامل. إذا كان يجب وضع علامة على العينة أعلى الحامل، فاترك قطعة من ورق غلاف علامة التبويب على علامة التبويب واكتب معرف العينة على الورق.
- ضع الحامل مع علامة التبويب على قاعدة مجهر تشريح.
- ضع عينة الأنسجة بلطف على الحامل باستخدام ملاقط دقيقة ، والقرنية متجهة لأعلى.
- قم بتغطية العينة بالبلاتين باستخدام الجهاز المناسب. بعد الطلاء ، قم بتخزين العينات في درجة حرارة الغرفة حتى التصوير.
6. التصوير (الشكل 2)
- قم بتشغيل الأجهزة كما هو موضح في دليل المستخدم ومن قبل خبراء التصوير.
- احصل على صور للتكبير المطلوب، واستخدم 2000-2500 صورة للتحليل.
- اضبط السطوع والتباين بحيث لا توجد مناطق معرضة بشكل مفرط في الصورة ، ويتم رؤية حدود الخلايا و microridges بأكبر قدر ممكن من الوضوح.
ملاحظة: يؤثر موضع الأنسجة وزاويتها على إعدادات السطوع والتباين. قد تحتاج إلى تعديلها من عينة إلى أخرى وبين مناطق مختلفة من الأنسجة.
7. قياس شكل الخلية وحجمها ونمط microridge
- افتح صورة TIFF في فيجي ImageJ 1.5327. تعيين المقياس باستخدام شريط القياس للصورة: قم بإنشاء خط مساو في الحجم لشريط المقياس باستخدام أداة الخط . حدد تحليل | اضبط المقياس، واكتب المسافة المعروفة. افتح مدير عائد الاستثمار من | التحليل قائمة الأدوات .
- بالنسبة لحجم الخلية واستدارتها، حدد تحليل | تعيين القياسات | واصفات الشكل. استخدم أداة التكبير الزجاجي لرؤية الخلايا تحت التكبير. حدد الخلايا باستخدام أداة المضلع ، وأضف كل تحديد إلى مدير عائد الاستثمار. وأخيرا، قم بقياس الخلايا المحددة، واحفظ القياس.
- تحليل ميكروريدج (الشكل 3 والشكل 4)
- تأكد من أن الصورة بتنسيق 8 بت من | الصور اكتب القائمة.
- حدد خلية باستخدام أداة المضلع ، وامسح الخلفية من تحرير | واضح في الخارج.
- قم بتنعيم الصورة من مرة إلى ثلاث مرات عن طريق تحديد عملية | قم بالسلاسة، واضبط السطوع والتباين من Image | ضبط | السطوع / التباين بحيث تبرز microridges بأكبر قدر ممكن من الوضوح.
- قم بتجميع الصورة من | العملية | الفلاتر إشراك ، تتحول إلى ثنائية من عملية | | الثنائية اجعل الصورة ثنائية، وقم بتهيئة الهيكل العظمي للصورة بالأبيض والأسود عن طريق تحديد عملية | | الثنائية الهيكل العظمي.
- استخدم الدالة تحليل الهيكل العظمي في | قائمة الهيكل العظمي لقياس معلمات microridge وحفظ القيم.
ملاحظة: في SEM، قد تختلف الصور الفردية في السطوع والتباين. وبالتالي ، قد تحتاج الخطوات في التحليل إلى تعديلات من صورة إلى أخرى.
النتائج
تصف هذه الدراسة طريقة تستخدم نتوء العين في تجارب التئام جروح القرنية الزردية. تم تعديل هذه الطريقة من الدراسات السابقة على الفئران ، حيث تبين أن اللدغ يزيل طبقات الخلايا الظهارية بكفاءة13. تشمل التحديات في جرح قرنية الزرد الحجم الصغير نسبيا للعين ، وفي حالة التجارب التي تستغرق وقتا طويلا ، الحاجة إلى الحفاظ على تدفق مستمر للمياه عبر الخياشيم (كما وصفها شو وزملاؤه28). الفوائد الرئيسية لهذه الطريقة هي بساطتها وسرعتها. يستخدم مجهر تشريح قياسي للاستخدام المتحكم فيه للنتوء (الشكل 1). نظرا لأن الإجراء قصير المدة (حوالي 3 دقائق من بداية التخدير) ، فإن الأسماك تتعافى بشكل جيد من المناولة ، ولا توجد حاجة إلى معدات إضافية للحفاظ على التخدير وتوصيل الأكسجين.
هناك عدة طرق لتصور جرح القرنية. يستخدم هذا البروتوكول المجهر الإلكتروني الماسح (SEM ، الشكل 2) ، والذي له تاريخ طويل من الاستخدام في دراسات القرنية29,30. على الرغم من أن هذا النهج لا يسمح بتقييم الطبقات السفلى من الظهارة ، إلا أنه يوفر طريقة سهلة لتقدير سرعة التئام الجروح ومقارنة أسطح القرنية في مناطق مختلفة من العين. في الساعة 3 بعد الجرح ، بينما تكون منطقة الجرح مغلقة (الشكل 2) ، يظل الموقع الذي يتم فيه ربط حدود الجرح مرئيا (الشكل 2).
تحتوي الخلايا السطحية الموجودة على قرنية الزرد على ميكروريدجواضح 31. في الآونة الأخيرة ، ذكرت دراسة أن هذه الهياكل مفقودة في خلايا ممدودة مجاورة للجروح على جلد الزرد32. ومع ذلك ، تظهر النتائج المقدمة أنه في ظهارة القرنية المتآكلة ، يمكن ملاحظة microridges في بعض الخلايا الممدودة بجوار موقع الجرح (الشكل 4B). في بعض المناطق الطرفية ، يتم فقدان microridges من مركز الخلية (الشكل 4C ، D). للحصول على تحليل أكثر تفصيلا ، يتم تحديد مساحة الخلية القمية واستدارتها كميا ، بالإضافة إلى كمية microridge ومتوسط الطول في ImageJ27 (الشكل 3 والشكل 4E-H).
يتم إجراء تحليل microridge باستخدام وظيفة الهيكل العظمي (المعدلة من فان لون وزملاؤه33). تكشف المقارنة بين المنطقتين المحيطيتين (الشكل 4A (المنطقتان C و D) والشكل 4C والشكل 4D) أن الخلايا الموجودة في الشكل 4D أكثر استطالة (مما يشير إلى إعادة ترتيب الخلايا كرد فعل على الجرح) ولها متوسط ميكروريدج أقصر من الخلايا في الشكل 4C. تشير هذه النتيجة إلى أن التغيير في شكل الخلية يرتبط بتعديل microridge ويؤكد على عدم التجانس داخل ظهارة القرنية في استجابة الجرح.
يعد قياس مساحة الخلية القمية واستدارتها على صور SEM طريقة بسيطة وقابلة للتكرار للحصول على بيانات كمية عن مظهر الخلية في مناطق مختلفة من القرنية. على الرغم من أن هذا النهج يقتصر على 2D ، إلا أنه يساعد على اكتساب فهم شامل لديناميكيات وسرعة إعادة ترتيب الخلايا أثناء إغلاق الجرح. تستخدم صور SEM لتحليل أنماط microridge على سطح الخلية القمي. تعطي معالجة الصور الموصوفة هنا تقديرا تقريبيا للتغيرات في معلمات microridge ، والتي سيكون من الممل قياسها يدويا.

الشكل 1: إعداد تآكل القرنية . (أ) المجهر التشريحي ضروري للتآكل المتحكم فيه على عين الزرد الصغيرة. (ب) تساعد الإسفنجة على تثبيت الأسماك المخدرة أثناء العملية. (ج) يتم تخدير السمكة على طبق بتري ، ويتم نقل الحيوان المخدر إلى الإسفنجة بملعقة صغيرة. يتم استخدام نتوء العين مع طرف 0.5 مم لشق القرنية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
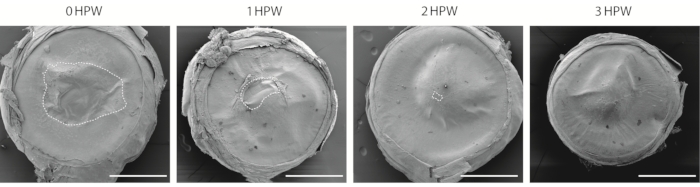
الشكل 2: تصور القرنية المصابة باستخدام المجهر الإلكتروني الماسح. نظرة عامة على القرنية المتآكلة التي تم جمعها في 0 أو 1 أو 2 أو 3 ساعات بعد الجرح (HPW). يشير المخطط التفصيلي المتقطع إلى حدود الجرح. أشرطة المقياس = 500 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: مثال على تعديل الصورة قبل قياس microridge. على الرغم من أنه ليس نسخة طبق الأصل من سطح الخلية الأصلي ، إلا أن النمط الهيكلي النهائي يلتقط الاختلافات بين مركز الخلية والمحيط. شريط المقياس = 10 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: مقارنة بين مساحة الخلية القمية والاستدارة وقيم الميكروريدج بين منطقتين محيطيتين بعد تآكل القرنية . (أ) نظرة عامة على العين المصابة. تشير المربعات إلى موقع صور التكبير الأعلى ( في B وC وD). (ج، دال) يتم تمييز الخلايا المحددة لتحليل واصف الشكل بمخطط تفصيلي أخضر. (هاء، واو) قيم مساحة الخلية القمية (E) والاستدارة (F) للخلايا المحددة. (ز، ح) الطول الكلي ل Microridge (G) ومتوسط الطول (H) لنفس الخلايا. تمت مقارنة المجموعات إحصائيا مع اختبار t ثنائي الذيل (* p ≤ 0.05 ، ** p ≤ 0.01) أشرطة المقياس = 500 ميكرومتر في A ، 50 ميكرومتر في B و C و D. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
إصابات القرنية الجسدية هي السبب الأكثر شيوعا لزيارات مرضى العيون إلى المستشفى. لذلك ، من المهم إنشاء نماذج ذات صلة لدراسة الجوانب المختلفة لفيزيولوجيا القرنية المرضية. حتى الآن ، يعد الماوس هو النموذج الأكثر استخداما لدراسة التئام جروح القرنية. ومع ذلك ، فإن إضافة قطرات العين على العيون المصابة بالفئران للتحقق من تأثير أدوية معينة على التئام جروح القرنية قد يكون صعبا. في هذا الصدد ، يعد نموذج الزرد مفيدا بشكل خاص للفحص الدوائي للجزيئات التي تؤثر على التئام جروح القرنية. الطريقة الموضحة هنا تشبه إلى حد كبير الطريقة الموصوفة للماوس13.
ومع ذلك، يجب أن تؤخذ في الاعتبار نقطتان محددتان للاختلاف. أولا، يتطلب استخدام نتوء العيون ممارسة لضمان تكرار الجرح، خاصة فيما يتعلق بالضغط الممارس على العين، وهو أمر بالغ الأهمية للتآكل السليم. بالإضافة إلى ذلك ، يجب تغيير الطرف الكاشط عندما لا تتم إزالة الظهارة بكفاءة. ثانيا ، في حين أن بنية ومورفولوجيا قرنية الزرد تشبه القرنيات الأخرى31 ، فإن هذا الحيوان يمتلك قدرات تجديدية لا مثيل لها في الكائنات الحية الثديية34،35،36. في حين أن إغلاق الجرح في الفأر يستمر لمدة 48-72 ساعة11،14،37 ، يتم الإبلاغ عن جدول زمني لمدة 3 ساعات لسمك الزرد. بسبب أوجه التشابه الهيكلية والجزيئية ، فإن السلوك الخلوي الناجم عن جرح القرنية المادي ربما يكون مشابها في معظم الفقاريات. ومع ذلك ، فإن الاستجابة السريعة في أسماك الزرد ربما تسترشد بآلية تجديدية متقدمة خاصة بهذا الحيوان.
يستخدم البروتوكول الموصوف SEM لتتبع إغلاق الجرح. استخدمت العديد من الدراسات الأخرى المجهر الفلوري بدلا من ذلك لتتبع هذه العملية15،17،38. ومع ذلك ، فإن استخدام SEM يسهل تحليل تعديل شكل الخلية بعد التآكل الظهاري. الجانب السلبي لهذه التكنولوجيا هو أنه لا يمكن تتبع خطوات التقسيم الطبقي ، لأن SEM يسمح فقط بتصوير الطبقة الأكثر خارجية. لدراسة الظهارة في 3D أثناء الشفاء الكامل للقرنية ، يجب استخدام نماذج الفلورسنت ، مثل Zebrabow39 ، أو وضع العلامات المناعية.
إن استخدام أسماك الزرد كنموذج لالتئام جروح القرنية يعزز نطاق التحقيق لأنه يسمح بتطبيق العديد من الأدوات الجزيئية المتاحة ، مثل خطوط الأسماك المعدلة وراثيا ، والمورفولينوس ، والفحص الكيميائي ، لتوسيع النطاق المحتمل لدراسات التئام جروح القرنية بشكل كبير. علاوة على ذلك ، يسمح حجم عيون الزرد بتطوير استراتيجيات تصوير جديدة لدراسة ديناميكيات الخلايا الظهارية بتفصيل أكبر مما يمكن القيام به مع عيون الفئران.
الهدف الرئيسي من هذا التقرير ليس فقط تكييف نهج جرح القرنية الجسدي مع نموذج الزرد ولكن أيضا لإثبات أن استخدام نماذج جديدة يسمح بطرح أسئلة جديدة والإجابة عليها ويشير إلى طرق جديدة للتحقيق في الظواهر البيولوجية الأساسية. هذه المزايا ستكون مفيدة في نهاية المطاف للمرضى.
Disclosures
وليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
يشكر المؤلفون بيرتي بانولا على الوصول إلى وحدة الزرد وهنري كويفولا على التوجيه والمساعدة في تجارب الزرد. تم دعم هذا البحث من قبل أكاديمية فنلندا ، ومؤسسة جين وأتوس إركو ، والمؤسسة الثقافية الفنلندية ، وبرنامج ATIP-Avenir. تم إجراء التصوير في وحدة المجهر الإلكتروني ووحدة المجهر الضوئي ، معهد التكنولوجيا الحيوية ، بدعم من HiLIFE و Biocenter Finland.
Materials
| Name | Company | Catalog Number | Comments |
| 0.1M Na-PO4 (sodium phosphate buffer), pH 7.4 | in-house | Solution is prepared from 1M sodium phosphate buffer (1M Na2HPO4 adjusted to pH 7.4 with 1M NaH2PO4). | |
| 0.2M Na-PO4 (sodium phosphate buffer), pH 7.4 | in-house | Solution is prepared from 1M sodium phosphate buffer (1M Na2HPO4 adjusted to pH 7.4 with 1M NaH2PO4). | |
| 0.5mm burr tips | Alger Equipment Company | BU-5S | |
| 1M Tris, pH 8.8 | in-house | ||
| adhesive tabs | Agar Scientific | G3347N | |
| Algerbrush burr, Complete instrument | Alger Equipment Company | BR2-5 | |
| Cotton swaps | Heinz Herenz Hamburg | 1030128 | |
| Dissecting plate | in-house | ||
| Dissecting tools | Fine Science Tools | ||
| double-distilled water | in-house | ||
| Eppedorf tubes, 2ml | any provider | ||
| Ethyl 3-aminobenzoate methanesulfonate salt | Sigma | A5040 | Caution: causes irritation. |
| Glutaraldehyde, 50% aqueous solution, grade I | Sigma | G7651 | Caution: toxic. |
| Lidocaine hydrochloride | Sigma | L5647 | Caution: toxic. |
| mounts | Agar Scientific | G301P | |
| Petri dish | Thermo Scientific | 101VR20 | |
| pH indicator strips | Macherey-Nagel | 92110 | |
| Plastic spoons | any provider | ||
| Plastic tubes, 15 ml | Greiner Bio-One | 188271 | |
| Plastic tubes, 50 ml | Greiner Bio-One | 227261 | |
| Scanning electron microscope | FEI | Quanta 250 FEG | |
| Soft sponge | any provider | ||
| Sputter coater | Quorum Technologies | GQ150TS | |
| Stereomicroscope | Leica |
References
- Baden, T., Euler, T., Berens, P. Understanding the retinal basis of vision across species. Nature Reviews.Neuroscience. 21 (1), 5-20 (2020).
- Nishida, T., Saika, S., Morishige, N., Manis, M. J., Holland, E. J. Cornea and sclera: Anatomy and physiology. Cornea: Fundamentals, diagnosis and management, 4th ed. , 1-22 (2017).
- Wilson, S. E., Liu, J. J., Mohan, R. R. Stromal-epithelial interactions in the cornea. Progress in Retinal and Eye Research. 18 (3), 293-309 (1999).
- Wilson, S. E., et al. Epithelial injury induces keratocyte apoptosis: hypothesized role for the interleukin-1 system in the modulation of corneal tissue organization and wound healing. Experimental Eye Research. 62 (4), 325-327 (1996).
- Zieske, J. D., Guimaraes, S. R., Hutcheon, A. E. Kinetics of keratocyte proliferation in response to epithelial debridement. Experimental Eye Research. 72 (1), 33-39 (2001).
- West-Mays, J. A., Dwivedi, D. J. The keratocyte: corneal stromal cell with variable repair phenotypes. The International Journal of Biochemistry & Cell Biology. 38 (10), 1625-1631 (2006).
- Ahmed, F., House, R. J., Feldman, B. H. Corneal abrasions and corneal foreign bodies. Primary Care. 42 (3), 363-375 (2015).
- Ben-Eli, H., Erdinest, N., Solomon, A. Pathogenesis and complications of chronic eye rubbing in ocular allergy. Current Opinion in Allergy and Clinical Immunology. 19 (5), 526-534 (2019).
- Wilson, S. A., Last, A. Management of corneal abrasions. American Family Physician. 70 (1), 123-128 (2004).
- Nagata, M., et al. JBP485 promotes corneal epithelial wound healing. Scientific Reports. 5, 14776 (2015).
- Wang, X., et al. MANF promotes diabetic corneal epithelial wound healing and nerve regeneration by attenuating hyperglycemia-induced endoplasmic reticulum stress. Diabetes. 69 (6), 1264-1278 (2020).
- Li, F. J., et al. Evaluation of the AlgerBrush II rotating burr as a tool for inducing ocular surface failure in the New Zealand White rabbit. Experimental Eye Research. 147, 1-11 (2016).
- Kalha, S., Kuony, A., Michon, F. Corneal epithelial abrasion with ocular burr as a model for cornea wound healing. Journal of Visualized Experiments:JoVE. (137), e58071 (2018).
- Kalha, S., et al. Bmi1+ progenitor cell dynamics in murine cornea during homeostasis and wound healing. Stem Cells. 36 (4), 562-573 (2018).
- Park, M., et al. Visualizing the contribution of keratin-14(+) limbal epithelial precursors in corneal wound healing. Stem Cell Reports. 12 (1), 14-28 (2019).
- Kuony, A., et al. Ectodysplasin-A signaling is a key integrator in the lacrimal gland-cornea feedback loop. Development. 146 (14), (2019).
- Farrelly, O., et al. Two-photon live imaging of single corneal stem cells reveals compartmentalized organization of the limbal niche. Cell Stem Cell. 28 (7), 1233-1247 (2021).
- Ikkala, K., Michon, F., Stratoulias, V. Unilateral Zebrafish corneal injury induces bilateral cell plasticity supporting wound closure. Scientific Reports. , (2021).
- Ormerod, L. D., Abelson, M. B., Kenyon, K. R. Standard models of corneal injury using alkali-immersed filter discs. Investigative Ophthalmology & Visual Science. 30 (10), 2148-2153 (1989).
- Anderson, C., Zhou, Q., Wang, S. An alkali-burn injury model of corneal neovascularization in the mouse. Journal of visualized experiments: JoVE. (86), e51159 (2014).
- Choi, H., et al. Comprehensive modeling of corneal alkali injury in the rat eye. Current Eye Research. 42 (10), 1348-1357 (2017).
- Singh, P., Tyagi, M., Kumar, Y., Gupta, K. K., Sharma, P. D. Ocular chemical injuries and their management. Oman Journal of Ophthalmology. 6 (2), 83-86 (2013).
- Pal-Ghosh, S. BALB/c and C57BL6 mouse strains vary in their ability to heal corneal epithelial debridement wounds. Experimental Eye Research. 87 (5), 478-486 (2008).
- Chen, J. J., Tseng, S. C. Abnormal corneal epithelial wound healing in partial-thickness removal of limbal epithelium. Investigative Ophthalmology & Visual Science. 32 (8), 2219-2233 (1991).
- Xeroudaki, M., Peebo, B., Germundsson, J., Fagerholm, P., Lagali, N. RGTA in corneal wound healing after transepithelial laser ablation in a rabbit model: a randomized, blinded, placebo-controlled study. Acta Ophthalmologica. 94 (7), 685-691 (2016).
- . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio Available from: https://zfinorg/zf_info/zfbook/zfbk.html (2000)
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Xu, C., Volkery, S., Siekmann, A. F. Intubation-based anesthesia for long-term time-lapse imaging of adult zebrafish. Nature Protocols. 10 (12), 2064-2073 (2015).
- Crosson, C. E., Klyce, S. D., Beuerman, R. W. Epithelial wound closure in the rabbit cornea. A biphasic process. Investigative Ophthalmology & Visual Science. 27 (4), 464-473 (1986).
- Parlanti, P., et al. Axonal debris accumulates in corneal epithelial cells after intraepithelial corneal nerves are damaged: A focused Ion Beam Scanning Electron Microscopy (FIB-SEM) study. Experimental Eye Research. 194, 107998 (2020).
- Zhao, X. C., et al. The zebrafish cornea: structure and development. Investigative Ophthalmology & Visual Science. 47 (10), 4341-4348 (2006).
- Richardson, R., et al. Re-epithelialization of cutaneous wounds in adult zebrafish combines mechanisms of wound closure in embryonic and adult mammals. Development. 143 (12), 2077-2088 (2016).
- van Loon, A. P., Erofeev, I. S., Maryshev, I. V., Goryachev, A. B., Sagasti, A. Cortical contraction drives the 3D patterning of epithelial cell surfaces. The Journal of Cell Biology. 219 (3), (2020).
- Vihtelic, T. S., Hyde, D. R. Light-induced rod and cone cell death and regeneration in the adult albino zebrafish (Danio rerio) retina. Journal of Neurobiology. 44 (3), 289-307 (2000).
- Poss, K. D., Wilson, L. G., Keating, M. T. Heart regeneration in zebrafish. Science. 298 (5601), 2188-2190 (2002).
- Becker, T., Wullimann, M. F., Becker, C. G., Bernhardt, R. R., Schachner, M. Axonal regrowth after spinal cord transection in adult zebrafish. The Journal of Comparative Neurology. 377 (4), 577-595 (1997).
- Hu, X., et al. Sirt6 deficiency impairs corneal epithelial wound healing. Aging. 10 (8), 1932-1946 (2018).
- Ksander, B. R., et al. ABCB5 is a limbal stem cell gene required for corneal development and repair. Nature. 511 (7509), 353-357 (2014).
- Pan, Y. A., et al. Zebrabow: multispectral cell labeling for cell tracing and lineage analysis in zebrafish. Development. 140 (13), 2835-2846 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved