Method Article
2次元クロマトグラフィーおよび質量分析と組み合わせた16プレックスタンデム質量タグ標識によるハイスループットおよびディーププロテオームプロファイリング
* これらの著者は同等に貢献しました
要約
ここでは、16-plex タンデム質量タグ試薬を使用して開発された最適化されたハイスループットプロトコルを紹介し、生体サンプルの定量的プロテオームプロファイリングを可能にします。広範な塩基性 pH 分画と高分解能 LC-MS/MS により、比率の圧縮が緩和され、プロテオームの深いカバレッジが得られます。
要約
等圧タンデム質量タグ(TMT)ラベリングは、その高いマルチプレックス能力と深いプロテオームカバレッジにより、プロテオミクスで広く使用されています。最近、拡張された16-plex TMT法が導入され、プロテオミクス研究のスループットがさらに向上しました。この原稿では、タンパク質サンプル調製、酵素消化、TMT標識反応、2次元逆相液体クロマトグラフィー(LC/LC)分画、タンデム質量分析(MS/MS)、計算データ処理など、16プレックスTMTベースのディーププロテオームプロファイリングに最適化されたプロトコールを紹介します。16-plex TMT分析に特化したプロセスにおける重要な品質管理ステップと改善点が強調されています。このマルチプレックスプロセスは、細胞、組織、臨床検体など、さまざまな複雑なサンプルをプロファイリングするための強力なツールを提供します。10,000種類以上のタンパク質と、最大16の異なるサンプルからの非常に複雑な生体サンプル中のリン酸化、メチル化、アセチル化、ユビキチン化などの翻訳後修飾を1回の実験で定量でき、基礎研究および臨床研究に強力なツールを提供します。
概要
質量分析技術の急速な発展により、プロテオミクスアプリケーション1,2において高感度と深いプロテオームカバレッジを達成することが可能になりました。これらの開発にもかかわらず、サンプルのマルチプレックス化は、大規模なサンプルコホートの分析を扱う研究者にとって依然としてボトルネックとなっています。
マルチプレックスアイソバリックラベリング技術は、サンプル3,4,5,6の大規模バッチのプロテオームワイドな相対定量に広く使用されています。タンデム質量タグ(TMT)ベースの定量は、その高いマルチプレックス化能力7,8から一般的な選択肢です。TMT試薬は当初、最大6つのサンプルを同時に定量できる6-plexキットとして発売されました9。この技術はさらに拡張され、10〜11のサンプル10,11を定量化しました。最近開発された16プレックスTMTpro(以下、TMT16と称する)試薬は、1回の実験で16サンプルに多重化能力をさらに増加させた12,13。TMT16試薬はプロリンベースのレポーター基を使用しますが、11-plex TMTはジメチルピペリジン由来のレポーター基を使用します。TMT11とTMT16はどちらも同じアミン反応性基を使用していますが、TMT16のマスバランス基はTMT11よりも大きいため、レポーターイオン中の8つの安定なC13およびN15同位体の組み合わせにより、16個のレポーターを達成できます(図1)。
マルチプレックス機能の向上は、統計上の課題を克服するのに十分な反復数を持つ実験を設計するためのプラットフォームを提供する14。さらに、16-plex TMTにおける追加のチャンネルは、チャンネル当たりの出発物質の総量を減らすのに役立ち、これは、新たなシングルセルプロテオミクス15の開発に役立つ可能性がある。高いマルチプレックス能力は、通常、大量の出発物質を必要とする翻訳後修飾の定量においても価値があります16,17。
TMT技術を用いたプロテオミクスワークフローは合理化され18,19,20、過去10年間でサンプル調製、液体クロマトグラフィー分離、質量分析データ取得、計算分析の面で大きく進化した21,22,23,24,25,26 .前回の記事では、10プレックスTMTプラットフォーム27の詳細な概要を説明しています。ここで説明するプロトコールでは、タンパク質の抽出と消化、TMT16 の標識、サンプルのプーリングと脱塩、塩基性 pH、酸性 pH 逆相(RP)LC、高分解能 MS、データ解析など、TMT16 の詳細で最適化されたメソッドを紹介します(図 2)。また、このプロトコルでは、定量的プロテオミクス実験を成功させるために組み込まれた主要な品質管理ステップも強調しています。このプロトコルは、生物学的経路、細胞プロセス、および疾患の進行を研究するために、高い再現性で10,000を超えるタンパク質を同定および定量するために日常的に使用できます20,28,29,30。
プロトコル
この研究のためのヒト組織は、Banner Sun Health Research InstituteのBrain and Body Donation Programの承認を得て入手しました。
1. 組織からのタンパク質抽出と品質管理
注:サンプル採取がプロテオームに与える影響を減らすためには、可能であれば低温で最小限の時間でサンプルを収集することが重要です31。これは、翻訳後修飾が一般的に不安定であるため、特に重要です。たとえば、一部のリン酸化イベントでは半減期が数秒しかありません32,33。
- 組織サンプルの物乙取と秤量
- 分析天びんを使用して1.5 mLの微量遠心チューブを風袋引きし、ドライアイスでチューブを予冷します。
- 凍結組織(例:ヒト脳組織、~10 mg)を所定の領域から小片に切り取り、その組織片を予冷したチューブに直ちに移します。
注:サンプルの不均一性を減らすには、16個のサンプルすべてに均質なサイズと解剖学的領域を使用することが重要です。組織から得られるタンパク質の量は、通常、組織重量の5〜10%です。 - ティッシュと一緒にチューブの重量を量り、すぐにドライアイスの上に置きます。残りの15個のサンプルも同じ手順で処理します。解剖後すぐにサンプルをドライアイスに保管し、80°Cで保存してください。
- 組織サンプルの溶解
- 実験当日に、新しい溶解バッファー(50 mM HEPES pH 8.5、8 M尿素、および0.5%デオキシコール酸ナトリウム)を調製します。ホスファターゼ阻害剤を溶解バッファーに添加して、タンパク質のリン酸化状態を維持する必要があります。
注:8 M尿素が氷上に沈殿し、サンプル溶解中にタンパク質の変性が不完全になり、タンパク質消化効率が低下する可能性があるため、溶解バッファーを使用する前に室温で保存してください。 - 各サンプルに溶解バッファー(組織10 mgあたり100 μLの溶解バッファーを添加して、最終タンパク質濃度5〜10 μg/μLを達成)とガラスビーズ(ライセート容量の~20%、直径0.5 mm)を添加します。
- ブレンダーで組織を 4 °C に 4 °C で溶解し、速度を 8 にして 30 秒間 30 秒間溶解し、5 秒間休ませ、サンプルが均質になるまで繰り返します (~ 5 サイクル)。
- 実験当日に、新しい溶解バッファー(50 mM HEPES pH 8.5、8 M尿素、および0.5%デオキシコール酸ナトリウム)を調製します。ホスファターゼ阻害剤を溶解バッファーに添加して、タンパク質のリン酸化状態を維持する必要があります。
- ライセートのアリコートを準備します。
- 各サンプルに少なくとも2つのアリコートを準備します。少量のアリコート(~10 μL)は、タンパク質濃度の分析やタンパク質の品質評価(ポジティブコントロールタンパク質のウェスタンブロッティングバリデーションなど)に使用されます。より大きなアリコート(~50 μL)がプロテオーム分析に使用されます。
- アリコートはすぐにドライアイスで凍結し、さらに使用するまで-80°Cで保存します。
- タンパク質濃度の測定
注:タンパク質濃度は、BCAアッセイまたはショートSDSゲル染色法34(図3A)によって測定することができる。組織溶解物中の非タンパク質還元成分はBCAアッセイの測定に影響を与える可能性があるため、ユーザーは短いSDSゲル染色法でタンパク質濃度を検証できます。ここでは、短いSDSゲル染色法を紹介します。- 分注した16個のサンプルを10倍に希釈し、BSA標準試料を調製します(例:0.15、0.5、1.5、3μgのBSA滴定)。
- 10% SDS-PAGEゲル(26ウェル)にサンプルとBSA標準試料をスタッキングゲルで注入し、すべてのタンパク質がゲル内に約3 mm移動するまで分析します。
- ゲルをクマシーブルーで1時間染色し、空白領域の背景が鮮明になるまでゲルを脱汚します。
- ゲルをスキャンして、ImageJでクマシー染色されたタンパク質バンドの強度を測定し、測定値に従ってBSA標準曲線を作成します。
- 標準曲線により絶対タンパク質濃度を計算します。
注:この実験の各サンプルの最終タンパク質濃度は、~5-10 μg/μLでした。TMT16ベースのプロテオミクス分析では、サンプルあたり50 μgのタンパク質(全プロテオーム分析では合計0.8 mgのタンパク質)で十分です。
- サンプルの品質管理
注:この品質管理ステップは、TMT分析を実行する前に低品質サンプルを特定するために重要です。タンパク質の変化がわかっているサンプルについては、ウェスタンブロッティングで変化を検証することをお勧めします。タンパク質パターンを調べ、分解度の高いサンプルを除外するために、標準的なSDS-PAGE分析も推奨されます(図3B)。- 小さなアリコートから各サンプルを~10 μg取り出し、ブロモフェノールブルー色素がゲルの底に到達するまでグラジエントSDS-PAGEゲルでサンプルを分析します。
- ゲルをクマシーブルーで染色し、ゲルを脱汚します。タンパク質の品質を検査して、高度に分解されたタンパク質サンプルを除去します。
注:分解されたサンプルは、高分子量領域にタンパク質バンドが非常に少なく、低分子量領域に強化されたバンドを持つサンプルとして識別できます(図3B)。
2.溶液内タンパク質消化、ペプチド還元とアルキル化、消化効率試験、ペプチド脱塩
- Lys-Cとトリプシンによるタンパク質消化
- 各サンプルの大きな分量から~50 μgのタンパク質を取り出し、50 μLに溶解バッファーを加えます。
- 100%アセトニトリル(ACN)を添加して、最終濃度を10%にします。
- Lys-C消化を行うには、Lys-Cをタンパク質:Lys-C比100:1(w/w)で添加し、室温で3時間インキュベートします。
- サンプルは、最終濃度の 2 M 尿素を 50 mM HEPES (pH 8.5) で含むように希釈します。
- タンパク質:トリプシン比50:1(w / w)で各サンプルにトリプシンを加え、室温で3時間または一晩消化します。
- ペプチド還元とアルキル化
- 調製したばかりのジチオスレイトール(1 M DTT)溶液を最終濃度1 mMに添加し、室温で1時間インキュベートしてジスルフィド結合を減少させます。
- 調製したばかりのヨードアセトアミド(1 M IAA)溶液を最終濃度10 mMに増温し、暗所で30分間添加し、システイン残基をアルキル化します。
- 未反応のIAAを1M DTTを最終30 mMの濃度に加えてクエンチし、室温でさらに30分間インキュベートします。
- 消化効率を調べる
- 各サンプルを~1 μg取り、メーカーのプロトコルに従ってC18樹脂コーティングピペットチップを使用して脱塩します。
- 各サンプルを短時間のグラジエント LC-MS/MS 分析で分析します(詳細についてはステップ 5 を参照)。
- MS 生データのデータベース検索を実行します(詳細については、手順 6 を参照してください)。少なくとも1つのトリプシンミスクレージ部位を持つ同定されたペプチドの割合を計算します。通常、この割合は15%未満です。
- パーセンテージが15%より大きい場合は、サンプルにトリプシンを追加して分解を繰り返します。
- 分解後、TFAを0.5%(v/v)に添加してサンプルを酸性化します。pHストリップでpHをチェックして、pHが3未満であることを確認します。
- ペプチド脱塩
- 酸性化ペプチドを21,000 x g で10分間遠心分離します。上清を新しいチューブに移します。
- C18 脱塩カラム (~25 μL レジン) を 250 μL の 100% メタノールで 250 μL で 2 回洗浄し、500 x g で 30 秒間遠心分離します。
注:脱塩プロセス中のペプチドの損失を減らすには、インプット量に一致する結合能を持つ脱塩カラムを選択します。 - 250 μL の溶出バッファー (60% ACN、0.1% TFA) を使用してカラムを 2 回洗浄し、500 x g で 30 秒間遠心分離します。
- 250 μL の平衡化バッファーと洗浄バッファー (0.1% TFA) でカラムを 2 回平衡化し、500 x g で 30 秒間遠心分離します。
- 事前に平衡化したカラムにサンプルをロードします。サンプルをカラムに結合させ、100 x g で6分間回転させます。すべてのソリューションが列を通過したことを確認します。
- カラムを 250 μL の平衡化で 3 回洗浄し、500 x g で 30 秒間遠心分離してバッファーを洗浄します。
- 各カラムに125 μLの溶出バッファーを添加し、100 x g で3分間遠心してペプチドを溶出します。列に残りのソリューションが含まれていないことを確認します。
- 溶出したペプチドを真空濃縮器で乾燥させ、将来のTMT標識のためにペプチドを-80°Cで保存します。
3.ペプチドのTMT16標識、標識効率試験、サンプルプーリング、および標識ペプチド脱塩
- ペプチドのTMT16標識
- 脱塩した各ペプチドサンプルを50 μLの50 μLの50 mM HEPES(pH 8.5)に再懸濁するか、数回ボルテックスするか、超音波溶解した後、pHストリップを使用してpHを確認します。
注:ラベリング前に完全に乾燥させないと、サンプルが酸性になる可能性があり、ラベリング効率に悪影響を及ぼします。pHが7〜8であることを確認してください。 - 各サンプルから~1 μgの非標識ペプチドをTMT標識効率試験のネガティブコントロールとして採取します。
- TMT16試薬を無水ACNに溶解します。TMT:タンパク質比1.5:1(w/w)で試薬を添加し、室温で30分間インキュベートすることにより、標識反応を行います。
注:TMT16に用いられるTMT:タンパク質比は、TMT11に用いられる比より50%高い。この小さな不一致は、TMT16の分子量がTMT11試薬の分子量よりも大きい(1.2倍)ためである可能性があります。タンパク質量は、脱塩中の損失を考慮せずにサンプルから推定されます。
- 脱塩した各ペプチドサンプルを50 μLの50 μLの50 mM HEPES(pH 8.5)に再懸濁するか、数回ボルテックスするか、超音波溶解した後、pHストリップを使用してpHを確認します。
- ラベリング効率試験
- 各サンプルから~1 μgの標識ペプチドを採取し、標識効率試験を行います。残りのサンプルを反応を急冷せずに-80°Cに置きます。
- TMT16 標識サンプルと非標識サンプルをそれぞれ 1 ~1 μg ずつ、C18 樹脂コーティングピペットチップでメーカーのプロトコルに従って脱塩します。
- LC-MS/MS でサンプルを分析します(セクション 5 を参照、ただしグラジエントは 10 分です)。
- 非標識ペプチドの非標識サンプルと標識サンプル間のMS1強度低下を分析することにより、標識効率を推定します。6〜10種類のペプチドを選択してラベリング効率を確認し、すべてのペプチドがラベリングされていることを確認します。 完全な標識では、標識されていないペプチドは観察されません。
注:下流の正確なタンパク質の同定と定量のためには、すべてのサンプルの完全な標識を確保することが重要です。 - 標識が完了していない場合は、TMT試薬を追加して残りのペプチドを標識し、クエンチする前に標識効率を再度確認してください。サンプルが完全に標識されたら、ヒドロキシルアミンを最終濃度0.5%まで加えて室温で反応を急冷し、室温で15分間インキュベートします。
- サンプルプーリングと脱塩
- 各TMT標識サンプルの半分をプールして、混合物を作ります。
- 混合物から 1 μg を取り出し、C18 樹脂コーティングピペットチップで脱塩した後、短いグラジエント (~30 分) を使用して LC-MS/MS で分析します。
- 各TMT16レポーターイオンの平均強度を使用し、16のチャンネル間の不一致を比較して、相対濃度を計算します。各チャンネルを均等に混合するには、計算された平均強度に従って、TMT標識サンプルの残りを混合物に加えます。すべてのサンプルが均等に混合されるまで、調整を繰り返します。サンプルプーリングのプロセスを示す代表的なデータを 表1に示します。
注:ピペッティングエラーは濃度やタンパク質定量の精度に影響を与える可能性があるため、プーリング量を正しく確認することが重要です。16個のサンプル間の強度の不一致は5%未満である必要があります。
- 標識ペプチド脱塩
注:TMT16標識反応のバックグラウンド誘導体(例えば、ヒドロキシルアミン消光反応のTMTpro-NHOHやTMTヒドロキシル化反応のTMTpro-OH)は疎水性であるため、TMT16標識サンプルには広範な洗浄条件を使用して誘導体を効果的に除去します。通常の洗浄バッファーに 5% ACN (0.1% TFA) を添加し、10 倍のベッド容量の洗浄バッファーを使用します。- pH < 3に10% TFAを添加して、プールしたサンプルを酸性化します。
- プールしたサンプルを21,000 x g で10分間遠心分離し、上清を新しいチューブに入れます。
- 真空濃縮器を使用してサンプルを乾燥させ、ACNを除去します。
- 50 mg の吸着剤カラムを含む固相抽出カートリッジを、2 mL の 100% メタノール、2 mL の溶出バッファー(60% ACN と 0.1% TFA)、最後に 2 mL の洗浄バッファー(0.1% TFA)でカラムを洗浄して、プレコンディショニングします。
- サンプルをカラムにロードします。流速を~100 μL/minに調整して、ペプチド結合の全範囲を確保します。フローを保存します。
- カラムを 1 mL の洗浄バッファーで 3 回洗浄します。
- ペプチドを1 mLの溶出バッファーで溶出します。
- 溶出したペプチドを真空濃縮器で乾燥させ、ペプチドを-80°Cで保存してさらに分画します。
4. オフラインの塩基性pH LCプレフラクショネーション
- 分画システムの準備
- マイクロリットルフローの高性能 LC システム用に、バッファー A(10 mM ギ酸アンモニウム、pH 8.0)およびバッファー B(10 mM ギ酸アンモニウム、90% ACN、pH 8.0)を調製します。
- 架橋型エチレンハイブリッド粒子(粒子径3.5 μm、粒子径4.6 mm×25 cm)を含むHPLCカラムを、マイクロリットルフローの高性能LCシステムにセットして分画します。
- 100 μLのサンプルループを取り付け、300 μLのメタノール、水、バッファーAでループを順次洗浄します。
- イソプロパノール:メタノール:アセトニトリル:水の比率1:1:1の100μLを使用してカラムを洗浄します。次に、バッファーAの95%でカラムを0.5時間さらに平衡化します。
- サンプル調製
- プールおよび脱塩したTMT16サンプルを70 μLのバッファーAに溶解し、サンプルのpHが~8.0であることを確認します。それでも酸性の場合は、28%水酸化アンモニウム(NH4OH)を使用してpHを8.0に調整します。
注:サンプルの損失を避けるために、サンプル量はループボリュームの70%未満にする必要があります。 - サンプルを21,000 x g で10分間遠心分離し、沈殿物を除去します。
- プールおよび脱塩したTMT16サンプルを70 μLのバッファーAに溶解し、サンプルのpHが~8.0であることを確認します。それでも酸性の場合は、28%水酸化アンモニウム(NH4OH)を使用してpHを8.0に調整します。
- 分画と連結
注:実際のサンプル分画の前に、LCシステムが良好な状態にあることを確認するために、パイロット実験を強くお勧めします。これは、少量の実際のサンプル(~5%)で、またはTMT標識されていないペプチドの混合物で行うことができます。- サンプルを注入し、次のグラジエントで分画します:5%バッファーBで10分間、5-15%バッファーBで2分間、15-45%バッファーBで148分間、45-95%バッファーBで5分間。0.4 mL/minの流速を使用してください。
- フラクションコレクターを 1 分ごとに収集するように設定し、160 個のフラクションを 4 サイクルで 40 個のフラクションに連結します。
注:連結は、同時期の内部から溶出された初期、中期、および後期のLCフラクションを連結フラクションに組み合わせることによって実行されます。連結されたフラクションは、LCの1次元ではほとんど重なり合わないため、2次元LCでの溶出ウィンドウを効率的に使用できます。さらに、数回の連結ラウンドを通じて、ペプチドをすべての連結画分に均一に分布させることができます。このアプローチは、個々のフラクション35,36の分析と比較して、プロテオームカバレッジを増加させることが実証されている。 - 連結したすべての画分を真空濃縮器で乾燥させ、乾燥させたサンプルを-80°Cで保存して、さらにLC-MS/MS分析を行います。
5. 酸性 pH RPLC-MS/MS 分析
- 酸性 pH RPLC-MS/MS システム調製
- 空のカラム(内径75 μm、先端オリフィス15 μm)に1.9 μm C18樹脂を10〜15 cmの長さに充てます。
- バタフライポートフォリオヒーターを使用してカラムを 65 °C に加熱し、背圧を低減します。
- カラムを 95% バッファー B(3% ジメチルスルホキシド、0.2% ギ酸、67% ACN)で十分に洗浄します。次に、95% バッファー A(3% ジメチルスルホキシドと 0.2% ギ酸)でカラムを完全に平衡化します。
- 実験サンプルを分析する前に、100 ng のラット脳ペプチドまたは BSA ペプチドを実行して、LC-MS/MS システムの性能を確認してください。
- 連結フラクションのLC-MS/MS分析
- 塩基性pH画分から乾燥ペプチドを5%FAに再構成し、21,000 × gで5分間遠心分離します。各サンプルの上清をHPLCバイアルインサートに移します。
- 各画分のペプチドを~1 μgカラムにロードします。ペプチドは、18–45% バッファー B の 60 分間グラジエントで 0.25 μL/min の流速で溶出されます。
注:高い識別番号を取得するには、1つのフラクションを実行し、最初のランに基づいて残りのフラクションの勾配を調整します。最適なグラジエントは、ペプチドがグラジエント全体に均等に分布している必要があります(図4A)。 - TMT16標識サンプルの分析のために、次のパラメータで質量分析計を操作します:MS1スキャン(全MSスキャン範囲:450-1600 m/z;Orbitrapの解像度:60,000;自動ゲイン制御ターゲット:1 x 106;最大イオン時間:50 ms)および20回のデータ依存型MS2スキャン(Orbitrap分解能:60,000;AGCターゲット:1 x 105;最大イオン時間:110 ms;HCD正規化衝突エネルギー:32%;アイソレーションウィンドウ:1.0 m / z;アイソレーションオフセット:0.2m / z;動的除外: 10 秒)。
注:ここで使用するパラメータは、1種類の質量分析計で最適化されています( 材料の表を参照)。MS機器が異なる場合、ユーザーは高品質の結果を得るために機器のパラメーターを微調整する必要があります。1つの設定は、TMT11とTMT16の間で最適なエネルギーが機器間で異なる可能性があるため、正規化されたHCD衝突エネルギーを監視することです。
6. データ処理
注:データ解析は、ハイブリッドデータベース検索エンジン(パターンベースおよびタグベース)、同定されたペプチド/タンパク質の偽発見率(FDR)を制御するフィルタリングソフトウェア、およびTMTデータセットの定量ソフトウェアを含むJUMPソフトウェアスイート37,38,39を使用して行った。ユーザーの状況に応じて、データ分析は他の商用プログラムまたは無料で入手できるプログラムを使用して行うことができます。
- データベース検索
- MS装置からの.rawファイルを.mzXMLファイルに変換し、UniProtヒトタンパク質配列(または別の適切な種特異的データベース)から生成された非冗長なターゲットデコイデータベース40 に対してMS2スペクトルを検索し、同定されたタンパク質のFDRを計算する。
注:Swiss-ProtデータベースとTrEMBLデータベースからのタンパク質配列を組み合わせて、非冗長データベースを生成します。また、プロテアーゼ切断タンパク質、一塩基多型タンパク質、一般的な汚染物質など、これらの参照データベースに含まれていないカスタマイズされたタンパク質配列を追加することもできます。 - 次のパラメータを使用して検索を実行します。前駆体の質量許容範囲:10 ppm;プロダクトイオンの質量許容範囲:15 ppm;最大欠落した胸の谷間:2;最大修飾部位:3;静的修飾:304.20715 Da(Lys残基およびN末端上のTMT16タグ用)、57.02146 Da(Cys残基上のカルバミドメチル化用)。動的修飾:15.99492 Da(Met上の酸化用)
- MS装置からの.rawファイルを.mzXMLファイルに変換し、UniProtヒトタンパク質配列(または別の適切な種特異的データベース)から生成された非冗長なターゲットデコイデータベース40 に対してMS2スペクトルを検索し、同定されたタンパク質のFDRを計算する。
- 検索結果をフィルタリングする
- 得られたペプチドスペクトルマッチ(PSM)を、ペプチド長(>6アミノ酸)、プリカーサーイオンの質量精度、およびJUMPベースのマッチングスコア(JscoreおよびΔJn)でフィルタリングします。次に、ペプチドは、ペプチドの長さ、トリプシン末端、修飾、欠落した切断部位、および電荷状態によってグループ化されます。
- マッチングスコアでデータをさらにフィルタリングし、タンパク質(全プロテオーム分析)またはペプチド(リン酸化プロテオーム分析)レベルでFDRが1%未満になるようにします。
注:ポジティブコントロールのペプチド/タンパク質がフィルタリングステップで欠落している場合は、FDRを妥当なレベルまで増加させて、それらのペプチド/タンパク質をレスキューできるようにすることができます。 - タンパク質ファミリーの複数のメンバーによって共有されるペプチドについては、一致したメンバーを1つのグループにクラスター化します。
注:倹約の法則により、グループは、共有ペプチドの数が最も多い相同タンパク質と、固有のペプチドに一致する他のタンパク質で表されます。
- タンパク質の定量
- 統計ソフトウェアスイートの組み込みプログラムを使用してタンパク質を定量し、一致したすべてのPSMのTMTレポーターイオン強度を要約します。
- 受け入れられた各PSMからTMTレポーターイオン強度を抽出し、各標識試薬の同位体分布に従って生強度を補正します(例えば、TMT16-126は、126、127C、および128C m/zイオンをそれぞれ92.6%、7.2%、および0.2%を生成します)、ユーザー定義の閾値に基づいて低強度および/または非常にノイズの多いPSMをろ過します。サンプルのトリミング平均(または中央値)強度を使用して定量データを正規化し、負荷バイアスを補正します。
- 同定された各タンパク質について、一致したPSMのサンプル全体の平均中心強度(つまり、相対強度)を計算し、サンプルごとの平均を取ることでPSMの相対強度を要約します。最も豊富に一致した 3 つの PSM の全体的な平均強度を乗算して、相対信号を絶対信号に変換します。
- y1イオン強度がレポーターイオン強度と相関していると仮定する、以前に報告されたy1イオン補正アプローチ37 を使用して、定量干渉を補正します。クリーンなスキャンからy1とレポーターイオン強度の間の線形関係を推定することにより、ノイズの多いスキャンにおける汚染されたy1イオン強度からの干渉レベルが導き出され、補正されます。
注:TMT標識トリプシンペプチドの場合、K-TMT残基とR残基は、MS2スペクトル中の2つの代表的なy1イオン(それぞれ376.27574 Daと175.11895 Da)です。y1 イオンが 1 つだけ検出され、同定されたペプチドと一致する場合、MS2 はクリーンスキャンと見なされます。両方のy1イオンが検出された場合、MS2はノイズの多いスキャンと見なされます。 - タンパク質定量値をスプレッドシートに転送して、さらに分析します。PCAやクラスタリング分析などの教師なしデータ分析手法を使用して、サンプルの分布を調査します。差次的に発現するタンパク質を同定するには、 t検定や分散分析(ANOVA)などの統計的手法を使用します。
7. MSデータの検証
注:時間のかかる生物学的実験を行う前に、MSデータの品質を評価するために、少なくとも1つの検証方法を使用してください。
- 目的のタンパク質の MS/MS スペクトルを手動で検査し、ペプチド配列と TMT レポーターイオン強度を検証します。
- 抗体ベースのアプローチ(ウェスタンブロッティングや免疫組織化学分析など)を使用して、タンパク質レベルの変化を確認します。ネイティブペプチドの存在を確認するには、合成ペプチドを内部標準物質として使用します。ペプチドの MS/MS スペクトルと LC-MS/MS 中の保持時間は、同じ条件下で同一である必要があります。
- ターゲットMSアプローチを使用して、タンパク質の変化を検証します。
結果
新たに開発されたTMT16のプロトコールは、標識反応、脱塩、およびLC-MS条件を含め、体系的に最適化されています41。さらに、11プレックス法と16プレックス法を直接比較し、それらを用いて同じヒトADサンプルを分析した41。TMT16 の主要なパラメーターを最適化した後、TMT11 と TMT16 の両方の分析法で、> 10,000 のヒトタンパク質中の 100,000 のペプチドに対して、同様のプロテオームカバレッジ、同定、定量>が得られました。
TMT16試薬はTMT11試薬よりも疎水性が高いため、TMT16標識ペプチドはTMT11標識ペプチドよりも疎水性が高い可能性が高く、RPLCでは保持時間(RT)が異なる可能性があります。そこで、TMT11標識ペプチドとTMT16標識ペプチド混合物をLC-MS/MSを用いて分析することにより、TMT11と比較したTMT16のペプチドRTへの影響を評価しました。その結果、TMT16は、疎水性が中程度のペプチドではRTに有意な影響を与えるが、疎水性が極めて高いまたは低いペプチドにはほとんど影響を与えないことがわかった。したがって、LCグラジエント中の同様の開始バッファーB濃度と終了バッファーB濃度を、異なるTMT標識ペプチドに使用できます。
次に、TMT16 標識サンプルのオンライン RPLC グラジエントを最適化しました。TMT16の勾配は、TMT11の勾配と非常によく似ています。開始バッファBと終了バッファBの割合は同じです(たとえば、18%から45%)。しかし、TMT11に使用されているのと同じグラジエントを使用すると、TMT16で同定されたペプチドの数が約40%バッファーBで急速に減少することに気づきました。したがって、グラジエントの時間を40%から45%の間でわずかに短縮しました。また、このグラジエントをさまざまなフラクションやサンプルごとに微調整しました。グラジエントの最適化後、同定されたペプチドはグラジエント全体に均一に分布しました(図 4A)。
TMT16法を用いて同定され、正確に定量されるタンパク質の数を最大化するために、前回のレポート41でTMT16標識サンプルの正規化コリジョンエネルギー(NCE)を最適化しました。さまざまな NCE(20% から 40%)を LC-MS/MS 分析中に質量分析計で試験しました。タンパク質の同定数とレポーターイオン強度のバランスを取り、TMT16 標識サンプルに使用する最適な HCD コリジョンエネルギーとして 30 〜 32.5% の NCE を選択しました。
共溶出する干渉イオンによって引き起こされる比率圧縮は、タンパク質定量のための同重体標識技術の限界でした。TMT11法を用いた以前に発表された研究では、広範なLCの事前分画、最適化されたMS設定、およびMS後のデータ補正戦略により、比率の圧縮をほぼ排除できることが示されています37。これらの戦略には、MS前の広範な分画(40の塩基性pH LCフラクション)、MS設定での狭い分離ウィンドウ(1 m/z)の適用、同じサンプルのTMT11およびTMT16プロテオーム分析でのy1イオン補正が含まれます。TMT11とTMT16のデータセット間のタンパク質の倍率変化の相関曲線を調べた結果、傾きは1に非常に近く、実験条件41ではTMT16の比率圧縮がTMT11のそれよりも目に見えて高くないことがわかりました。一貫した結果は、多重化レベルが11から1613,45に増加した場合、比率圧縮に違いはないことが報告されました。したがって、以前に発表された戦略を使用して比圧縮を緩和し、それによって定量精度を大幅に向上させることができる27,37,44,46。
最後に、TMT11 標識サンプルと TMT16 標識サンプルで定量された PSM、固有のペプチド、および固有のタンパク質の数を比較しました(図 4B)。結果は、両方の方法のPSMが同等であることを示しています。ただし、定量されたタンパク質とペプチドはTMT16メソッドではわずかに低く、これは他の報告12,13と一致しています。私たちの結果は、TMT16プロセスの改善と最適化されたLC-MSパラメーターの使用により、生体サンプルのハイスループットで深いプロテオームプロファイリングが可能になることを示しています。
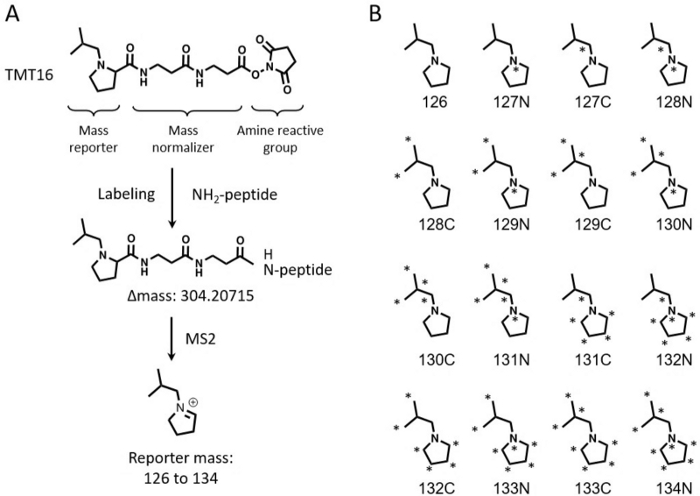
図1:16プレックスTMT試薬の構造。 (A)16-plex TMT試薬の構造、標識プロセス、標識後の質量シフト、レポーターイオンの質量を示しています。(B)TMT16試薬のレポーターイオンの重同位体標識構造。 この図の拡大版を表示するには、ここをクリックしてください。
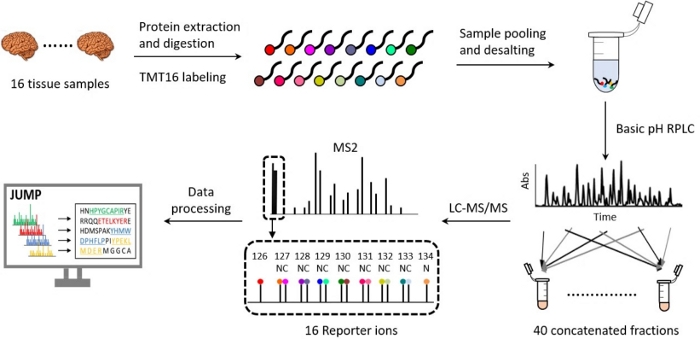
図2:16プレックスTMT-LC/LC-MS/MSによるプロテオームプロファイリングのワークフロー。 16種類の生体組織サンプルから抽出したタンパク質を消化し、16種類のTMTタグで標識しました。16チャンネルからのサンプルを均等にプールし、混合物を分画し、オフラインの塩基性pH逆相液体クロマトグラフィー(RPLC)によって40のフラクションに連結します。各画分は、酸性RPLCと高分解能質量分析法を組み合わせてさらに分析します。MS/MS RAWファイルが処理されました。脳組織の画像は、いくつかの変更を加えて Medium.com から引用されています。 この図の拡大版を表示するには、ここをクリックしてください。
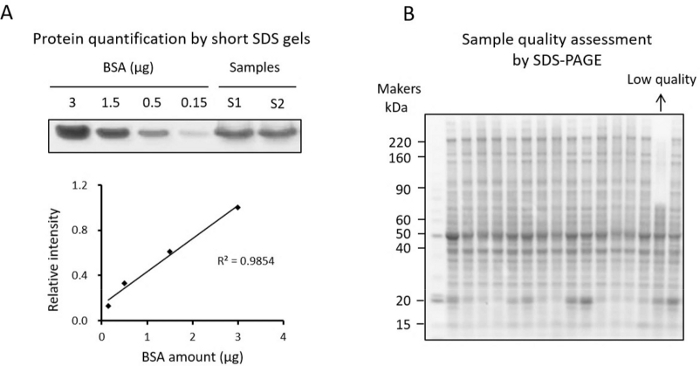
図3:タンパク質の品質管理。 (A)BSAを標準とする短いSDSゲル上の組織から抽出されたタンパク質の定量。標準曲線は、定量に使用したBSA濃度とクマシー染色タンパク質バンド強度をプロットしたものです。(B)タンパク質品質アッセイに用いるSDSゲル。 この図の拡大版を表示するには、ここをクリックしてください。
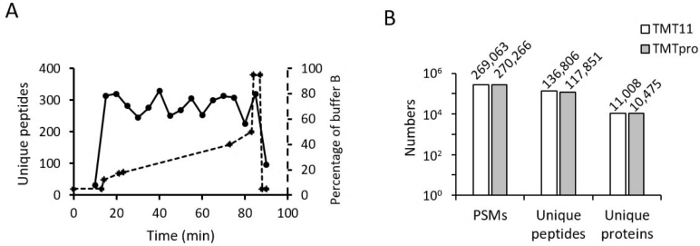
図4:代表的な結果。 (A)酸性LCにおけるペプチド分布。デッドボリュームの補正後のバッファーBの最適化されたグラジエントは、同じプロットに整列されます。(B)ヒストグラムは、TMT11およびTMT16メソッドで定量化されたPSM、ユニークペプチド、およびユニークタンパク質の数を示しています。 この図の拡大版を表示するには、ここをクリックしてください。
| 1回目(50μl、1回目のミックスで50%を使用) | 2番目(混合物を調整して10%節約) | 3番目(最終調整) | |||||||||||
| チャンネル | 記者 | ミックスボリューム(μL) | 強度(単位) | 濃度(単位/μL) | 予想強度(単位) | 追加容量(μL) | 総容量(μL) | 強度(単位) | 濃度(単位/μL) | 予想強度(単位) | 追加容量(μL) | 総容量(μL) | 強度(単位) |
| 1 | SIG126 | 25 | 94.7 | 3.8 | 122.1 | 7.2 | 32.2 | 99.6 | 3.1 | 105.3 | 1.8 | 34.1 | 100 |
| 2 | シグ127N | 25 | 83 | 3.3 | 122.1 | 11.8 | 36.8 | 101.1 | 2.7 | 105.3 | 1.5 | 38.3 | 98 |
| 3 | sig127C | 25 | 86 | 3.4 | 122.1 | 10.5 | 35.5 | 99.9 | 2.8 | 105.3 | 1.9 | 37.4 | 99.9 |
| 4 | sig128N | 25 | 103.9 | 4.2 | 122.1 | 4.4 | 29.4 | 102.1 | 3.5 | 105.3 | 0.9 | 30.3 | 97.2 |
| 5 | sig128Cの | 25 | 90.8 | 3.6 | 122.1 | 8.6 | 33.6 | 103.3 | 3.1 | 105.3 | 0.7 | 34.3 | 98.3 |
| 6 | sig129N | 25 | 82.8 | 3.3 | 122.1 | 11.9 | 36.9 | 99 | 2.7 | 105.3 | 2.4 | 39.3 | 98.7 |
| 7 | sig129C | 25 | 101.3 | 4.1 | 122.1 | 5.1 | 30.1 | 98.5 | 3.3 | 105.3 | 2.1 | 32.2 | 102.1 |
| 8 | シグ130N | 25 | 98.9 | 4 | 122.1 | 5.9 | 30.9 | 100.1 | 3.2 | 105.3 | 1.6 | 32.5 | 99.7 |
| 9 | シグ130C | 25 | 86.3 | 3.5 | 122.1 | 10.4 | 35.4 | 96 | 2.7 | 105.3 | 3.4 | 38.8 | 99.3 |
| 10 | sig131N | 25 | 87 | 3.5 | 122.1 | 10.1 | 35.1 | 95.3 | 2.7 | 105.3 | 3.7 | 38.8 | 101.5 |
| 11 | sig131Cの | 25 | 119.1 | 4.8 | 122.1 | 0.6 | 25.6 | 100.9 | 3.9 | 105.3 | 1.1 | 26.7 | 100.2 |
| 12 | シグ132N | 25 | 86 | 3.4 | 122.1 | 10.5 | 35.5 | 95.3 | 2.7 | 105.3 | 3.7 | 39.2 | 99.6 |
| 13 | sig132Cの | 25 | 119.1 | 4.8 | 122.1 | 0.6 | 25.6 | 101.2 | 3.9 | 105.3 | 1 | 26.7 | 100 |
| 14 | シグ133N | 25 | 116.3 | 4.7 | 122.1 | 1.3 | 26.3 | 99.9 | 3.8 | 105.3 | 1.4 | 27.7 | 100.9 |
| 15 | sig133Cの | 25 | 122.1 | 4.9 | 122.1 | 0 | 25 | 101 | 4 | 105.3 | 1.1 | 26.1 | 101.9 |
| 16 | シグ134N | 25 | 121.3 | 4.9 | 122.1 | 0.2 | 25.2 | 105.3 | 4.2 | 105.3 | 0 | 25.2 | 101.3 |
表1:ステップ3.3のサンプルプーリングのプロセスを示す代表的なデータ。
ディスカッション
TMT16ベースのディーププロテオームプロファイリング用に最適化されたプロトコルは、以前の出版物12,13,41で成功裏に実装されています。この現在のプロトコルでは、最大16の異なるサンプルから10,000を超えるユニークなタンパク質を、1回の実験で高精度でルーチンに定量できます。
高品質の結果を得るには、プロトコル全体の重要なステップに注意を払うことが重要です。前回の記事27で説明したすべてのQCステップに加えて、TMT16プロセスに固有の重要なステップも追加されています。これらの手順は、実験を成功させるために重要です。例えば、TMT反応誘導体(例えば、ヒドロキシルアミン消光反応のTMTpro-NHOHやTMTヒドロキシル化のTMTpro-OH)は、LC-MS/MS分析による脱塩前に顕著な単一荷電イオンとして検出されます。脱塩ステップ中にそれらを取り除くことが重要です。我々は、異なる脱塩条件をテストし、10×床容量の3回の洗浄と組み合わせた通常の洗浄緩衝液に5%ACNを添加すると、誘導体41が効果的に除去されることを発見した。さらに、TMT16はTMT11に比べて質量が増加しているため、TMT16標識サンプルの全スキャン範囲はより高い m/z (410ではなく450)から始まります。さらに、ペプチドの最適なコリジョンエネルギーは、プリカーサーイオン21の質量電荷および電荷状態に依存するため、異なる化学的標識タグで標識されたペプチドは、異なる最適なコリジョンエネルギーを有する可能性がある。TMT16の場合、衝突エネルギーは30〜32.5%がTMT16に最適で、TMT11よりもわずかに低くなっています。
アイソバリックラベリングは、高いマルチプレックス機能を提供する強力な手法です。SILAC(細胞培養中のアミノ酸による安定同位体標識)47 やラベルフリーなどの他の技術は、タンパク質を定量するための代替戦略を提供します48が、スループットが低いという課題があります。TMT16は、理論的には16の異なる生体サンプルにわたってタンパク質を定量できます。しかし、これらのチャネルの一部を生物学的複製として使用することの方がはるかに一般的であり、より多くの統計的検出力を提供し、信頼性の高いデータを生成するのに役立ちます。反復または三重化を使用することは、特に予想されるタンパク質濃度の変化が公称であるシステムでは非常に重要です。適切な数の反復を含むように実験を設計する前に、システムの生物学を理解することが重要です。特定の生物学的システムは、このプロトコルの品質管理ステップの一部に理想的ではありません。プレミックス比試験は、タンパク質の変化が予想される割合が高いため、免疫沈降サンプルをプロトコールに使用する場合は使用されません。このような場合、プレミックステストでは結果が歪んでしまいます。これは、10個のサンプルのうち少なくとも1個がタンパク質発現が大きく異なると予想される場合(エンプティベクター、プロテアソーム阻害など)にも当てはまります。また、TMTチャネルを「内部参照」として使用し、その後、TMT16実験の複数のバッチを組み合わせるために使用することも推奨される49。
このプロトコールは、複雑な生体サンプルのハイスループットグローバルプロテオームプロファイリングに使用でき、発現差のあるタンパク質や細胞シグナル伝達経路の研究、疾患生物学の理解に役立てることができます。さらに、プロトコールにわずかな変更を加えることで、リン酸化、ユビキチン化、メチル化、アセチル化などの翻訳後修飾の研究に使用することができます。網羅的な大規模プロテオミクス解析と、ゲノミクス、トランスクリプトミクス、メタボロミクスなどの他のオミクスパイプラインを組み合わせた統合的なアプローチをとることで、複雑な生物学的システムの理解を深めるための洞察を得ることができます30,50。
開示事項
著者は何も開示していません。
謝辞
この研究は、国立衛生研究所(R01GM114260、R01AG047928、R01AG053987、RF1AG064909、およびU54NS110435)およびALSAC(American Lebanese Syrian Associated Charities)によって部分的に支援されました。MS解析は、NIH Cancer Center Support Grant(P30CA021765)の支援を受けているSt. Jude Children's Research HospitalのCenter of Proteomics and Metabolomicsで行われました。内容は著者の責任であり、必ずしも国立衛生研究所の公式見解を表すものではありません。
資料
| Name | Company | Catalog Number | Comments |
| 10% Criterion TGX Precast Midi Protein Gel | Biorad | 5671035 | |
| 10X TGS (Tris/Glycine/SDS) Buffer | BioRad | 161-0772 | |
| 4–20% Criterion TGX Precast Midi Protein Gel | Biorad | 5671095 | |
| 50% Hydroxylamine | Thermo Scientific | 90115 | |
| 6 X SDS Sample Loading Buffer | Boston Bioproducts Inc | BP-111R | |
| Ammonium Formate (NH4COOH) | Sigma | 70221-25G-F | |
| Ammonium Hydroxide, 28% | Sigma | 338818-100ml | |
| Bullet Blender | Next Advance | BB24-AU | |
| Butterfly Portfolio Heater | Phoenix S&T | PST-BPH-20 | |
| C18 Ziptips | Harvard Apparatus | 74-4607 | Used for desalting |
| Dithiothreitol (DTT) | Sigma | D5545 | |
| DMSO | Sigma | 41648 | |
| Formic Acid | Sigma | 94318 | |
| Fraction Collector | Gilson | FC203B | |
| Gel Code Blue Stain Reagent | Thermo | 24592 | |
| Glass Beads | Next Advance | GB05 | |
| HEPES | Sigma | H3375 | |
| HPLC Grade Acetonitrile | Burdick & Jackson | AH015-4 | |
| HPLC Grade Water | Burdick & Jackson | AH365-4 | |
| Iodoacetamide (IAA) | Sigma | I6125 | |
| Lys-C | Wako | 125-05061 | |
| Mass Spectrometer | Thermo Scientific | Q Exactive HF | |
| MassPrep BSA Digestion Standard | Waters | 186002329 | |
| Methanol | Burdick & Jackson | AH230-4 | |
| Nanoflow UPLC | Thermo Scientific | Ultimate 3000 | |
| Pierce BCA Protein Assay kit | Thermo Scientific | 23225 | |
| ReproSil-Pur C18 resin, 1.9um | Dr. Maisch GmbH | r119.aq.0003 | |
| Self-Pack Columns | New Objective | PF360-75-15-N-5 | |
| SepPak 1cc 50mg | Waters | WAT054960 | Used for desalting |
| Sodium Deoxycholate | Sigma | 30970 | |
| Speedvac | Thermo Scientific | SPD11V | |
| TMTpro 16plex Label Reagent Set | Thermo Scientific | A44520 | |
| Trifluoroacetic Acid (TFA) | Applied Biosystems | 400003 | |
| Trypsin | Promega | V511C | |
| Ultra-micro Spin Column,C18 | Harvard apparatus | 74-7206 | Used for desalting |
| Urea | Sigma | U5378 | |
| Xbridge Column C18 column | Waters | 186003943 | Used for basic pH LC |
参考文献
- Levy, M. J., Washburn, M. P., Florens, L. Probing the sensitivity of the orbitrap lumos mass spectrometer using a standard reference protein in a complex background. Journal of Proteome Research. 17 (10), 3586-3592 (2018).
- Bekker-Jensen, D. B., et al. An optimized shotgun strategy for the rapid generation of comprehensive human proteomes. Cell Systems. 4 (6), 587-599 (2017).
- Mertins, P., et al. Proteogenomics connects somatic mutations to signalling in breast cancer. Nature. 534 (7605), 55-62 (2016).
- Frost, D. C., Greer, T., Li, L. High-Resolution Enabled 12-Plex DiLeu Isobaric Tags for Quantitative Proteomics. Analytical Chemistry. 87 (3), 1646-1654 (2015).
- Moulder, R., Bhosale, S. D., Goodlett, D. R., Lahesmaa, R. Analysis of the plasma proteome using iTRAQ and TMT-based Isobaric labeling. Mass Spectrometry Reviews. 37 (5), 583-606 (2018).
- Wang, H., et al. Deep multiomics profiling of brain tumors identifies signaling networks downstream of cancer driver genes. Nature Communications. 10 (1), 3718(2019).
- Rauniyar, N., Yates, J. R. Isobaric labeling-based relative quantification in shotgun proteomics. Journal of Proteome Research. 13 (12), 5293-5309 (2014).
- Hogrebe, A., et al. Benchmarking common quantification strategies for large-scale phosphoproteomics. Nature Communications. 9 (1), 1045(2018).
- Dayon, L., et al. Relative quantification of proteins in human cerebrospinal fluids by MS/MS using 6-plex isobaric tags. Analytical Chemistry. 80 (8), 2921-2931 (2008).
- Stepanova, E., Gygi, S. P., Paulo, J. A. Filter-based protein digestion (FPD): A detergent-free and scaffold-based strategy for TMT workflows. Journal of Proteome Research. 17 (3), 1227-1234 (2018).
- McAlister, G. C., et al. Increasing the multiplexing capacity of TMTs using reporter ion isotopologues with isobaric masses. Analytical Chemistry. 84 (17), 7469-7478 (2012).
- Thompson, A., et al. TMTpro: Design, synthesis, and initial evaluation of a proline-based isobaric 16-plex tandem mass tag reagent set. Analytical Chemistry. 91 (24), 15941-15950 (2019).
- Li, J., et al. TMTpro reagents: a set of isobaric labeling mass tags enables simultaneous proteome-wide measurements across 16 samples. Nature Methods. 17 (4), 399-404 (2020).
- Arul, A. B., Robinson, R. A. S. Sample Multiplexing Strategies in Quantitative Proteomics. Analytical Chemistry. 91 (1), 178-189 (2019).
- Labib, M., Kelley, S. O. Single-cell analysis targeting the proteome. Nature Reviews Chemistry. 4 (3), 143-158 (2020).
- Ren, R. J., Dammer, E. B., Wang, G., Seyfried, N. T., Levey, A. I. Proteomics of protein post-translational modifications implicated in neurodegeneration. Translational Neurodegeneration. 3 (1), 23(2014).
- Pagel, O., Loroch, S., Sickmann, A., Zahedi, R. P. Current strategies and findings in clinically relevant post-translational modification-specific proteomics. Expert Review of Proteomics. 12 (3), 235-253 (2015).
- Mertins, P., et al. Reproducible workflow for multiplexed deep-scale proteome and phosphoproteome analysis of tumor tissues by liquid chromatography-mass spectrometry. Nature Protocols. 13 (7), 1632-1661 (2018).
- Aebersold, R., Mann, M. Mass-spectrometric exploration of proteome structure and function. Nature. 537 (7620), 347-355 (2016).
- Bai, B., et al. Deep multilayer brain proteomics identifies molecular networks in Alzheimer's disease progression. Neuron. 105 (6), 975-991 (2020).
- Kelstrup, C. D., et al. Rapid and deep proteomes by faster sequencing on a benchtop quadrupole ultra-high-field orbitrap mass spectrometer. Journal of Proteome Research. 13 (12), 6187-6195 (2014).
- Meier, F., et al. Online parallel accumulation - serial fragmentation (PASEF) with a novel trapped ion mobility mass spectrometer. Molecular & Cellular Proteomics. 17 (12), (2018).
- Schweppe, D. K., et al. Full-featured, real-time database searching platform enables fast and accurate multiplexed quantitative proteomics. Journal of Proteome Research. 19 (5), 2026-2034 (2020).
- Wang, H., et al. Systematic optimization of long gradient chromatography mass spectrometry for deep analysis of brain proteome. Journal of Proteome Research. 14 (2), 829-838 (2015).
- Dey, K. K., et al. Deep undepleted human serum proteome profiling toward biomarker discovery for Alzheimer's disease. Clinical Proteomics. 16, 16(2019).
- Bai, B., et al. Deep profiling of proteome and phosphoproteome by isobaric labeling, extensive liquid chromatography, and mass spectrometry. Methods in Enzymology. 585, 377-395 (2017).
- High, A. A., et al. Deep proteome profiling by isobaric labeling, extensive liquid chromatography, mass spectrometry, and software-assisted quantification. Journal of Visualized Experiments. (129), e56474(2017).
- Chick, J. M., et al. Defining the consequences of genetic variation on a proteome-wide scale. Nature. 534 (7608), 500-505 (2016).
- Wang, Z., et al. Quantitative phosphoproteomic analysis of the molecular substrates of sleep need. Nature. 558 (7710), 435-439 (2018).
- Tan, H., et al. Integrative proteomics and phosphoproteomics profiling reveals dynamic signaling networks and bioenergetics pathways underlying T cell activation. Immunity. 46 (3), 488-503 (2017).
- Eden, E., et al. Proteome Half-Life Dynamics in Living Human Cells. Science. 331 (6018), 764(2011).
- Kleiman, L. B., Maiwald, T., Conzelmann, H., Lauffenburger, D. A., Sorger, P. K. Rapid phospho-turnover by receptor tyrosine kinases impacts downstream signaling and drug binding. Molecular Cell. 43 (5), 723-737 (2011).
- Mertins, P., et al. Ischemia in tumors induces early and sustained phosphorylation changes in stress kinase pathways but does not affect global protein levels. Molecular & Cellular Proteomics. 13 (7), 1690(2014).
- Xu, P., Duong, D. M., Peng, J. Systematical optimization of reverse-phase chromatography for shotgun proteomics. Journal of Proteome Research. 8 (8), 3944-3950 (2009).
- Wang, Y., et al. Reversed-phase chromatography with multiple fraction concatenation strategy for proteome profiling of human MCF10A cells. Proteomics. 11 (10), 2019-2026 (2011).
- Yang, F., Shen, Y., Camp, D. G., Smith, R. D. High-pH reversed-phase chromatography with fraction concatenation for 2D proteomic analysis. Expert Review of Proteomics. 9 (2), 129-134 (2012).
- Niu, M., et al. Extensive peptide fractionation and y(1) ion-based interference detection method for enabling accurate quantification by isobaric labeling and mass spectrometry. Analytical Chemistry. 89 (1), 2956-2963 (2017).
- Wang, X., et al. A tag-based database search tool for peptide identification with high sensitivity and accuracy. Molecular & Cellular Proteomics. 13 (12), 3663(2014).
- Li, Y., et al. JUMPg: An integrative proteogenomics pipeline identifying unannotated proteins in human brain and cancer cells. Journal of Proteome Research. 15 (7), 2309-2320 (2016).
- Elias, J. E., Gygi, S. P. Target-decoy search strategy for increased confidence in large-scale protein identifications by mass spectrometry. Nature Methods. 4 (3), 207-214 (2007).
- Wang, Z., et al. 27-plex tandem mass tag mass spectrometry for profiling brain proteome in Alzheimer's disease. Analytical Chemistry. 92 (10), 7162-7170 (2020).
- Ow, S. Y., et al. iTRAQ underestimation in simple and complex mixtures: "The good, the bad and the ugly". Journal of Proteome Research. 8 (11), 5347-5355 (2009).
- Karp, N. A., et al. Addressing accuracy and precision issues in iTRAQ quantitation. Molecular & Cellular Proteomics. 9 (9), 1885-1897 (2010).
- Ting, L., Rad, R., Gygi, S. P., Haas, W. MS3 eliminates ratio distortion in isobaric multiplexed quantitative proteomics. Nature Methods. 8 (11), 937-940 (2011).
- Gygi, J. P., et al. A triple knockout isobaric-labeling quality control platform with an integrated online database search. Journal of The American Society for Mass Spectrometry. 31 (7), 1344-1349 (2020).
- Savitski, M. M., et al. Measuring and managing ratio compression for accurate iTRAQ/TMT quantification. Journal of Proteome Research. 12 (8), 3586-3598 (2013).
- Ong, S. E., et al. Stable isotope labeling by amino acids in cell culture, SILAC, as a simple and accurate approach to expression proteomics. Molecular & Cellular Proteomics. 1 (5), 376(2002).
- Cox, J., et al. Accurate proteome-wide label-free quantification by delayed normalization and maximal peptide ratio extraction, termed MaxLFQ. Molecular & Cellular Proteomics. 13 (9), 2513(2014).
- Brenes, A., Hukelmann, J., Bensaddek, D., Lamond, A. I. Multibatch TMT reveals false positives, batch effects and missing values. Molecular & Cellular Proteomics. 18 (10), 1967-1980 (2019).
- Yu, J., Peng, J., Chi, H. Systems immunology: Integrating multi-omics data to infer regulatory networks and hidden drivers of immunity. Current Opinion in Systems Biology. 15, 19-29 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved