Method Article
פרופיל תפוקה גבוהה ופרוטאום עמוק על ידי תיוג תג מסה טנדם 16-plex יחד עם כרומטוגרפיה דו-ממדית וספקטרומטריית מסה
* These authors contributed equally
In This Article
Summary
מוצג כאן פרוטוקול אופטימלי בעל תפוקה גבוהה שפותח עם ריאגנטים של תגי מסה טנדם של 16 plex, המאפשר פרופיל פרוטאום כמותי של דגימות ביולוגיות. פיצול pH בסיסי נרחב ו-LC-MS/MS ברזולוציה גבוהה מפחיתים את דחיסת היחס ומספקים כיסוי פרוטאום עמוק.
Abstract
תיוג תג מסה טנדם איזוברי (TMT) נמצא בשימוש נרחב בפרוטאומיקה בגלל יכולת הריבוב הגבוהה שלו וכיסוי פרוטאום עמוק. לאחרונה הוצגה שיטת TMT מורחבת של 16 פלקסים, מה שמגדיל עוד יותר את התפוקה של מחקרים פרוטאומיים. בכתב יד זה, אנו מציגים פרוטוקול אופטימלי לפרופיל פרוטאום עמוק מבוסס 16 plex TMT, כולל הכנת דגימות חלבון, עיכול אנזימטי, תגובת תיוג TMT, פיצול כרומטוגרפיה נוזלית דו-ממדית בשלב הפוך (LC/LC), ספקטרומטריית מסה טנדם (MS/MS) ועיבוד נתונים חישוביים. מודגשים שלבי בקרת האיכות והשיפורים המכריעים בתהליך הספציפי לניתוח 16-plex TMT. תהליך מרובה זה מציע כלי רב עוצמה לפרופיל מגוון דגימות מורכבות כגון תאים, רקמות ודגימות קליניות. ניתן לכמת יותר מ-10,000 חלבונים ושינויים לאחר תרגום כגון זרחון, מתילציה, אצטילציה ו-ubiquitination בדגימות ביולוגיות מורכבות ביותר מעד 16 דגימות שונות בניסוי יחיד, המספק כלי רב עוצמה למחקר בסיסי וקליני.
Introduction
התפתחויות מהירות בטכנולוגיית ספקטרומטריית מסה אפשרו להשיג רגישות גבוהה וכיסוי פרוטאום עמוק ביישומי פרוטאומיקה 1,2. למרות התפתחויות אלה, ריבוב הדגימות נותר צוואר הבקבוק עבור חוקרים המטפלים בניתוח של קבוצת מדגם גדולה.
טכניקות תיוג איזובריות מרובות משמשות באופן נרחב לכימות יחסי רחב פרוטאום של קבוצות גדולות של דגימות 3,4,5,6. כימות מבוסס תגי מסה טנדם (TMT) הוא בחירה פופולרית בשל יכולת הריבוב הגבוהה שלו 7,8. ריאגנטים TMT הושקו בתחילה כערכת 6-plex המסוגלת לכמת עד 6 דגימות בו זמנית9. טכנולוגיה זו הורחבה עוד יותר לכימות 10-11 דגימות10,11. ריאגנטים 16-plex TMTpro שפותחו לאחרונה (להלן TMT16) הגדילו עוד יותר את יכולת הריבוב ל-16 דגימות בניסוי יחיד12,13. ריאגנטים TMT16 משתמשים בקבוצת דיווחים מבוססת פרולין, בעוד ש-11-plex TMT מיישם קבוצת דיווחים שמקורה בדימתילפיפרידין. גם TMT11 וגם TMT16 משתמשים באותה קבוצה תגובתית, אך קבוצת מאזן המסה של TMT16 גדולה מזו של TMT11, מה שמאפשר לשילוב של 8 איזוטופים יציבים C13 ו-N15 ביונים המדווחים להשיג 16 מדווחים (איור 1).
הגידול ביכולת הריבוב מספק פלטפורמה לתכנון ניסויים עם שכפולים מספיקים כדי להתגבר על אתגרים סטטיסטיים14. יתר על כן, הערוצים הנוספים ב-16-plex TMT עוזרים להפחית את הכמות הכוללת של חומר התחלתי לכל ערוץ, מה שעשוי לסייע בפיתוח פרוטאומיקה מתפתחת של תאיחיד 15. יכולת הריבוב הגבוהה תהיה בעלת ערך גם בכימות של שינויים לאחר התרגום, מה שדורש בדרך כלל כמויות גבוהות של חומר התחלתי16,17.
זרימות עבודה פרוטאומיות המשתמשות בטכנולוגיית TMT התייעלו 18,19,20, והן התפתחו משמעותית בעשור האחרון במונחים של הכנת דגימות, הפרדת כרומטוגרפיה נוזלית, רכישת נתונים ספקטרומטריים מסה וניתוח חישובי 21,22,23,24,25,26. המאמר הקודם שלנו מספק סקירה מעמיקה של פלטפורמת 10-plex TMT27. הפרוטוקול המתואר כאן מציג שיטה מפורטת וממוטבת עבור TMT16, כולל מיצוי ועיכול חלבונים, תיוג TMT16, איגום דגימות והתפלה, pH בסיסי ו-pH חומצי פאזה הפוכה (RP) LC, MS ברזולוציה גבוהה ועיבוד נתונים (איור 2). הפרוטוקול גם מדגיש את שלבי בקרת האיכות העיקריים ששולבו להשלמת ניסוי פרוטאומיקה כמותי בהצלחה. ניתן להשתמש בפרוטוקול זה באופן שגרתי כדי לזהות ולכמת יותר מ-10,000 חלבונים בעלי יכולת שחזור גבוהה, כדי לחקור מסלולים ביולוגיים, תהליכים תאיים והתקדמות מחלה 20,28,29,30.
Protocol
רקמות אנושיות למחקר הושגו עם אישורים מתוכנית תרומת המוח והגוף במכון המחקר Banner Sun Health.
1. מיצוי חלבון מרקמות ובקרת איכות
הערה: כדי להפחית את ההשפעה של קצירת דגימות על הפרוטאום, חיוני לאסוף דגימות בזמן מינימלי בטמפרטורה נמוכה במידת האפשר31. זה חשוב במיוחד כאשר מנתחים שינויים לאחר תרגום מכיוון שהם בדרך כלל לא יציבים, למשל, לחלק מאירועי הזרחן יש רק כמה שניות של זמן מחצית חיים32,33.
- בלו ושקילת דגימות רקמה
- טרפו צינור מיקרו-צנטריפוגה בנפח 1.5 מ"ל באמצעות איזון אנליטי וקררו מראש את הצינור על קרח יבש.
- חותכים רקמה קפואה (למשל, רקמת מוח אנושית, ~10 מ"ג) מאזור מוגדר לחתיכות קטנות ומעבירים את חלקי הרקמה לתוך הצינור שהתקרר מראש מיד.
הערה: כדי להפחית את ההטרוגניות של הדגימה, חשוב להשתמש בגדלים הומוגניים ובאזורים אנטומיים עבור כל 16 הדגימות. כמות החלבון המתקבלת מהרקמה היא בדרך כלל 5-10% ממשקל הרקמה. - שקלו את הצינור יחד עם הטישו והניחו את הצינור מיד על קרח יבש. עבד את 15 הדגימות הנותרות באותו הליך. שמור את הדגימות בקרח יבש מיד לאחר החיתוך, ואחסן בטמפרטורה של ˗80 מעלות צלזיוס.
- דגימות רקמת ליז
- הכן מאגר ליזה טרי (50 מ"מ HEPES pH 8.5, 8 מ' אוריאה ו-0.5% נתרן דאוקסיכולאט) ביום הניסוי. יש להוסיף מעכבי פוספטאז למאגר הליזיס כדי לשמר את מצב הזרחן של חלבונים.
הערה: הנח את מאגר הליזיס בטמפרטורת החדר לפני השימוש בו, מכיוון ש-8 M אוריאה תשקע על קרח, מה שעלול לגרום לדנטורציה לא שלמה של חלבון במהלך ליזיס הדגימה ולהפחית את יעילות עיכול החלבון. - הוסף את מאגר הליזיס (הוסף מאגר ליזה של 100 מיקרוליטר לכל רקמה של 10 מ"ג כדי להשיג ריכוז חלבון סופי של 5 עד 10 מיקרוגרם/מיקרוליטר) וחרוזי זכוכית (~20% מנפח הליזאט, קוטר 0.5 מ"מ) לכל דגימה.
- ליז את הרקמה בבלנדר בטמפרטורה של 4 מעלות צלזיוס עם הגדרת מהירות 8 למשך 30 שניות, לנוח 5 שניות, לחזור על הפעולה עד שהדגימות הומוגניות (~ 5 מחזורים).
- הכן מאגר ליזה טרי (50 מ"מ HEPES pH 8.5, 8 מ' אוריאה ו-0.5% נתרן דאוקסיכולאט) ביום הניסוי. יש להוסיף מעכבי פוספטאז למאגר הליזיס כדי לשמר את מצב הזרחן של חלבונים.
- הכן ציטוטים של הליזטים.
- הכן לפחות שתי מכסות לכל דגימה. אליקוט קטן (~10 מיקרוליטר) משמש לניתוח ריכוז החלבון ולהערכת איכות החלבון (למשל, אימות כתמים מערביים של חלבוני בקרה חיובית). אליקוט גדול יותר (~50 מיקרוליטר) משמש לניתוח פרוטאום.
- מקפיאים את הנוזלים מיד על קרח יבש, ושומרים בטמפרטורה של -80 מעלות צלזיוס עד לשימוש נוסף.
- למדוד את ריכוז החלבון
הערה: ניתן למדוד את ריכוז החלבון על ידי בדיקת BCA או שיטת צביעת ג'ל SDS קצרה34 (איור 3A). מכיוון שהרכיבים שאינם מפחיתים חלבון בליזאט הרקמה עשויים להשפיע על המדידה בבדיקת BCA, המשתמשים עשויים לאמת את ריכוז החלבון בשיטת צביעת ג'ל SDS קצרה. שיטת צביעת הג'ל הקצרה SDS מוצגת כאן.- יש לדלל 16 דגימות מצוטות פי 10 ולהכין את תקן BSA (למשל, טיטרציות BSA של 0.15, 0.5, 1.5 ו-3 מיקרוגרם).
- יש להריץ את הדגימות ואת תקן ה-BSA על ג'ל 10% SDS-PAGE (26 באר) עם ג'ל ערימה עד שכל החלבונים נודדים כ-3 מ"מ לתוך הג'ל.
- מכתים את הג'ל בכחול Coomassie למשך שעה, ומכתימים את הג'ל עד שהרקע באזור הריק ברור.
- סרוק את הג'ל כדי למדוד את העוצמות של רצועות חלבון מוכתמות בקומאסי, על ידי ImageJ וצור עקומה סטנדרטית של BSA בהתאם למדידות.
- חשב את ריכוז החלבון המוחלט לפי העקומה הסטנדרטית.
הערה: ריכוז החלבון הסופי עבור כל דגימה בניסוי זה היה ~5-10 מיקרוגרם/מיקרוליטר. לניתוח פרוטאומיקה מבוסס TMT16, 50 מיקרוגרם חלבון לדגימה (סה"כ 0.8 מ"ג חלבון לניתוח פרוטאום שלם) מספיקים.
- בקרת איכות לדוגמא
הערה: שלב בקרת איכות זה הוא קריטי לזיהוי דגימות באיכות נמוכה לפני ביצוע ניתוח TMT. עבור דגימות עם שינוי חלבון ידוע, מוצע לאמת את השינוי על ידי כתמים מערביים. ניתוח SDS-PAGE סטנדרטי מומלץ גם כדי לבחון דפוסי חלבון ולא לכלול דגימות עם דרגות פירוק גבוהות (איור 3B).- קח ~10 מיקרוגרם מכל דגימה מהמנה הקטנה והעביר דגימות על ג'ל SDS-PAGE שיפוע עד שהצבע הכחול ברומופנול מגיע לתחתית הג'ל.
- מכתימים את הג'ל בכחול Coomassie ומסירים את הכתמים מהג'ל. בדוק את איכות החלבון כדי להסיר דגימות חלבון פגומות מאוד.
הערה: ניתן לזהות דגימות מושפלות ככאלה שיש להן מעט מאוד רצועות חלבון באזור המשקל המולקולרי הגבוה ורצועות מוגברות באזור המשקל המולקולרי הנמוך (איור 3B).
2. עיכול חלבון בתמיסה, הפחתת פפטידים ואלקילציה, בדיקת יעילות עיכול והתפלת פפטידים
- עיכול חלבונים על ידי Lys-C וטריפסין
- קח ~50 מיקרוגרם חלבון מהכמות הגדולה של כל דגימה והוסף מאגר ליזה ל-50 מיקרוליטר.
- הוסף 100% אצטוניטריל (ACN) כדי להגיע לריכוז סופי של 10%.
- בצע את עיכול Lys-C על ידי הוספת Lys-C ביחס חלבון:Lys-C של 100:1 (w/w) ודגירה בטמפרטורת החדר למשך 3 שעות.
- הדגימות מדוללות כדי להכיל ריכוז סופי של 2 M אוריאה על 50 מ"מ HEPES (pH 8.5).
- הוסף טריפסין לכל דגימה ביחס חלבון:טריפסין של 50:1 (w/w) ובצע את העיכול בטמפרטורת החדר למשך 3 שעות או למשך הלילה.
- הפחתת פפטידים ואלקילציה
- הוסף תמיסת דיתיותרייטול (1 M DTT) שהוכנה טרי לריכוז סופי של 1 מ"מ ודגר למשך שעה בטמפרטורת החדר כדי להפחית את קשרי הדיסולפיד.
- הוסף תמיסת יודואצטמיד (1 M IAA) שהוכנה טרי לריכוז סופי של 10 מ"מ למשך 30 דקות בחושך לשאריות ציסטאין אלקילט.
- להרוות את ה-IAA שלא הגיב על ידי הוספת 1M DTT לריכוז סופי של 30 מ"מ ולדגור בטמפרטורת החדר למשך 30 דקות נוספות.
- בחן את יעילות העיכול
- קח ~1 מיקרוגרם מכל דגימה והמלח באמצעות קצות פיפטה מצופים שרף C18 בהתאם לפרוטוקול היצרן.
- נתח כל דגימה על ידי ריצת LC-MS/MS קצרה בשיפוע (ראה פרטים נוספים בשלב 5).
- בצע חיפוש במסד נתונים גולמיים של MS (ראה פרטים נוספים בשלב 6). חשב את אחוז הפפטידים שזוהו עם אתר מחשוף טריפסין אחד לפחות. האחוז הוא בדרך כלל מתחת ל-15%.
- אם האחוז גדול מ-15%, הוסף טריפסין נוסף לדגימות כדי לחזור על העיכול.
- לאחר העיכול, יש להחמיץ את הדגימות על ידי הוספת TFA ל-0.5% (v/v). בדוק את ה-pH על ידי רצועת pH כדי לוודא שה-pH נמוך מ-3.
- התפלת פפטידים
- צנטריפוגה את הפפטידים המחומצים ב-21,000 x גרם למשך 10 דקות. העבירו את הסופרנטנטים לצינור חדש.
- שטפו את עמודי ההתפלה C18 (~25 מיקרוליטר שרף) פעמיים עם 250 מיקרוליטר של 100% מתנול על ידי צנטריפוגה ב-500 x גרם למשך 30 שניות.
הערה: כדי להפחית את אובדן הפפטידים במהלך תהליך ההתפלה, בחר עמודות התפלה עם יכולת קשירה התואמת את כמות הקלט. - שטפו את העמודות פעמיים באמצעות 250 מיקרוליטר של מאגר פליטה (60% ACN, 0.1% TFA) על ידי צנטריפוגה ב-500 x גרם למשך 30 שניות.
- אזנו את העמודות פעמיים עם 250 מיקרוליטר של שיווי משקל ומאגר כביסה (0.1% TFA) על ידי צנטריפוגה ב-500 x גרם למשך 30 שניות.
- טען דוגמאות על העמודות המאוזנות מראש. תן לדגימות להיקשר לעמודות על ידי סיבוב ב-100 x גרם למשך 6 דקות. ודא שכל הפתרון עבר דרך העמודה.
- שטפו את העמודים שלוש פעמים עם 250 מיקרוליטר שיווי משקל ושטפו את המאגר על ידי צנטריפוגה ב -500 x גרם למשך 30 שניות.
- יש לסלק את הפפטידים על ידי הוספת 125 מיקרוליטר של חוצץ פליטה לכל עמודה וסיבוב ב-100 x גרם למשך 3 דקות. ודא שהעמודה אינה מכילה שאריות של תמיסה.
- יבש את הפפטידים המופשטים ברכז ואקום ואחסן את הפפטידים בטמפרטורה של -80 מעלות צלזיוס לתיוג TMT עתידי.
3. תיוג TMT16 של פפטידים, בדיקת יעילות תיוג, איגום דגימות והתפלת פפטידים מסומנים
- תיוג TMT16 של פפטידים
- השעו מחדש כל דגימת פפטיד מותפלת ב-50 מיקרוליטר של 50 מ"מ HEPES (pH 8.5) על ידי מערבולת מספר פעמים או המסה קולית ולאחר מכן שימוש ברצועת pH כדי לאמת את ה-pH.
הערה: הדגימה עשויה להיות חומצית אם לא מיובשת לחלוטין לפני התיוג, מה שמשפיע לרעה על יעילות התיוג. ודא שה-pH הוא בין 7 ל-8. - קח ~1 מיקרוגרם של פפטידים לא מסומנים מכל דגימה כבקרות שליליות לבדיקת יעילות התיוג TMT.
- ממיסים ריאגנטים TMT16 ב-ACN נטול מים. בצע את תגובת התיוג על ידי הוספת הריאגנטים ביחס TMT:חלבון של 1.5:1 (w/w) ודגירה בטמפרטורת החדר למשך 30 דקות.
הערה: יחס ה-TMT:חלבון המשמש ל-TMT16 גבוה ב-50% מהיחס המשמש ל-TMT11. פער קטן זה עשוי לנבוע מכך שהמסה המולקולרית של TMT16 גדולה יותר (פי 1.2) מזו של ריאגנטים TMT11. כמות החלבון מוערכת מהדגימות מבלי לקחת בחשבון את האובדן במהלך ההתפלה.
- השעו מחדש כל דגימת פפטיד מותפלת ב-50 מיקרוליטר של 50 מ"מ HEPES (pH 8.5) על ידי מערבולת מספר פעמים או המסה קולית ולאחר מכן שימוש ברצועת pH כדי לאמת את ה-pH.
- בדיקת יעילות תיוג
- קח ~1 מיקרוגרם של פפטידים מסומנים מכל דגימה לבדיקת יעילות התיוג. שים את הדגימות הנותרות בטמפרטורה של -80 מעלות צלזיוס מבלי להרוות את התגובה.
- מלח ~ 1 מיקרוגרם כל אחת מדגימות מסומנות TMT16 וללא תווית על ידי קצות פיפטה מצופים שרף C18 על פי פרוטוקול היצרן.
- נתח את הדגימות לפי LC-MS/MS (ראה סעיף 5, למעט שהשיפוע הוא 10 דקות).
- הערך את יעילות התיוג על ידי ניתוח הפחתת עוצמת MS1 של פפטידים ללא תווית בין דגימות ללא תווית ומסומנות. בחר 6 עד 10 פפטידים שונים כדי לאמת את יעילות התיוג כדי להבטיח שכל הפפטידים מסומנים. לתיוג מלא, לא נצפים פפטידים ללא תווית.
הערה: חשוב להבטיח תיוג מלא של כל הדגימות לזיהוי וכימות מדויקים של חלבונים במורד הזרם. - אם התיוג לא הושלם, הוסף ריאגנטים נוספים של TMT כדי לתייג את הפפטידים הנותרים ובדוק שוב את יעילות התיוג לפני המרווה. לאחר סימון הדגימה במלואה, יש להרוות את התגובה בטמפרטורת החדר על ידי הוספת הידרוקסילאמין לריכוז סופי של 0.5% ולדגור בטמפרטורת החדר למשך 15 דקות.
- דוגמאות איגום והתפלה
- יש לחבר מחצית מכל דגימה המסומנת ב-TMT כדי ליצור תערובת.
- קח 1 מיקרוגרם מהתערובת והמלח על ידי קצות פיפטה מצופים שרף C18, ולאחר מכן נתח על ידי LC-MS/MS באמצעות שיפוע קצר (~30 דקות).
- חשב את הריכוז היחסי באמצעות העוצמה הממוצעת של כל יון מדווח TMT16 והשוואת הפערים בין 16 הערוצים. כדי להשיג ערבוב שווה של כל ערוץ, הוסף את שאר הדגימות המסומנות ב-TMT לתערובת בהתאם לעוצמה הממוצעת המחושבת. חזור על ההתאמה עד שכל הדגימות יתערבבו באופן שווה. נתונים מייצגים המציגים את תהליך איגום הדגימה מוצגים בטבלה 1.
הערה: מכיוון ששגיאות פיפטינג עשויות להשפיע על דיוק הריכוזים וכימות החלבון, חשוב לוודא את כמות האיגום הנכונה. הפערים בעוצמה בין 16 דגימות צריכים להיות פחות מ-5%.
- התפלת פפטידים עם תווית
הערה: מכיוון שנגזרות הרקע בתגובת התיוג TMT16 (למשל, TMTpro-NHOH מתגובת המרווה הידרוקסילאמין, ו-TMTpro-OH מהידרוקסילציה של TMT) הן הידרופוביות, נעשה שימוש בתנאי שטיפה נרחבים עבור דגימות המסומנות ב-TMT16 כדי להסיר ביעילות את הנגזרות. נעשה שימוש בתוספת של 5% ACN במאגר הכביסה הרגיל (0.1% TFA) ונפחי מיטה פי 10 של מאגר כביסה.- החמצת הדגימה המאוגדת על ידי הוספת 10% TFA ל-pH < 3.
- צנטריפוגה את הדגימה המאוגדת ב-21,000 x גרם למשך 10 דקות והכניסה את הסופרנטנט לצינור חדש.
- יבש את הדגימה באמצעות רכז ואקום להסרת ACN.
- מרכך מראש מחסנית מיצוי בשלב מוצק המכילה עמוד סופג של 50 מ"ג על ידי שטיפת העמודה עם 2 מ"ל של 100% מתנול ואחריו 2 מ"ל של מאגר פליטה (60% ACN בתוספת 0.1% TFA) ולבסוף 2 מ"ל של מאגר כביסה (0.1% TFA).
- טען את הדוגמה בעמודה. התאם את קצב הזרימה ל-~100 מיקרוליטר לדקה כדי להבטיח את מלוא ההיקף של קשירת הפפטיד. שמור את הזרימה.
- שטפו את העמוד שלוש פעמים עם מאגר כביסה של 1 מ"ל.
- יש להוציא פפטידים עם מאגר פליטה של 1 מ"ל.
- יבש את הפפטידים המופשטים ברכז ואקום ואחסן את הפפטידים בטמפרטורה של -80 מעלות צלזיוס לפיצול נוסף.
4. פיצול מקדים של pH LC בסיסי לא מקוון
- הכנת מערכת פיצול
- הכן מאגר A (פורמט אמוניום 10 מ"מ, pH 8.0) ומאגר B (פורמט אמוניום 10 מ"מ, 90% ACN, pH 8.0) למערכת LC בעלת ביצועים גבוהים בזרימת מיקרוליטר.
- הגדר עמודת HPLC המכילה חלקיקי אתילן היברידיים מגושרים (גודל חלקיקים של 3.5 מיקרומטר, 4.6 מ"מ × 25 ס"מ) במערכת LC בעלת ביצועים גבוהים בזרימת מיקרוליטר לפיצול.
- התקן לולאת דגימה של 100 מיקרוליטר ושטוף את הלולאה ב-300 מיקרוליטר של מתנול, מים ומאגר A, ברצף.
- השתמש ב-100 מיקרוליטר של יחס של 1:1:1:1 של איזופרופנול: מתנול: אצטוניטריל: מים לשטיפת העמוד. לאחר מכן, אזנו עוד יותר את העמודה למשך 0.5 שעות ב-95% ממאגר A.
- הכנת מדגם
- ממיסים את דגימת ה-TMT16 המאוגדת והמומלחת ב-70 מיקרוליטר של מאגר A. ודא שה-pH של הדגימה הוא ~ 8.0. אם הוא עדיין חומצי, התאם את ה-pH ל-8.0 באמצעות 28% אמוניום הידרוקסיד (NH4OH).
הערה: כדי למנוע אובדן דגימה, נפח הדגימה צריך להיות פחות מ-70% מנפח הלולאה. - צנטריפוגה את הדגימה ב-21,000 x גרם למשך 10 דקות להסרת משקעים.
- ממיסים את דגימת ה-TMT16 המאוגדת והמומלחת ב-70 מיקרוליטר של מאגר A. ודא שה-pH של הדגימה הוא ~ 8.0. אם הוא עדיין חומצי, התאם את ה-pH ל-8.0 באמצעות 28% אמוניום הידרוקסיד (NH4OH).
- פיצול ושרשור
הערה: לפני פיצול דגימה אמיתי, מומלץ מאוד לבצע ניסוי פיילוט כדי להבטיח שמערכת ה-LC במצב טוב. ניתן לבצע זאת עם כמות קטנה מהדגימה האמיתית שלך (~5%) או עם תערובת פפטידים שאינה מסומנת TMT.- הזרקו את הדגימה וחלקו אותה לפי השיפוע הבא: 5% מאגר B למשך 10 דקות, 5-15% מאגר B למשך 2 דקות, 15-45% מאגר B למשך 148 דקות ו-45-95% מאגר B למשך 5 דקות. השתמש בקצב זרימה של 0.4 מ"ל לדקה.
- הגדר את אספן השברים לאסוף שברים כל דקה ולשרשר 160 שברים בחזרה ל-40 שברים ב-4 מחזורים.
הערה: השרשור מתבצע על ידי שילוב של שברי LC מוקדמים, אמצעיים ומאוחרים שנפלטו מאותו זמן פנימי לשבר משורשר. לשברים המשורשרים יש חפיפה מועטה בממד הראשון של LC ובכך מגדילים את השימוש היעיל בחלון הפליטה בממד השני LC. בנוסף, באמצעות מספר סבבי שרשור, ניתן לפזר את הפפטידים באופן שווה על פני כל השברים המשורשרים. גישה זו הוכחה כמגדילה את כיסוי הפרוטאום בהשוואה לניתוח של שברים בודדים35,36. - יבש את כל השברים המשורשרים ברכז ואקום ואחסן את הדגימות המיובשות ב-80 מעלות צלזיוס להמשך ניתוח LC-MS/MS.
5. ניתוח pH RPLC-MS/MS חומצי
- הכנת מערכת pH RPLC-MS/MS חומצית
- ארוז עמודה ריקה (75 μm ID עם פתח קצה של 15 μm) עם שרף C18 של 1.9 μm באורך של 10-15 ס"מ.
- מחממים את העמוד ב-65 מעלות צלזיוס באמצעות מחמם תיק פרפרים כדי להפחית את הלחץ האחורי.
- שטפו את העמודה היטב עם 95% חיץ B (3% דימתיל סולפוקסיד, 0.2% חומצה פורמית ו-67% ACN). לאחר מכן, יש לאזן לחלוטין את העמודה במאגר 95% A (3% דימתיל סולפוקסיד ו-0.2% חומצה פורמית).
- בדוק את הביצועים של מערכת LC-MS/MS על ידי הפעלת 100 ננוגרם של פפטידים ממוח חולדות או פפטידי BSA לפני ניתוח דגימות הניסוי.
- ניתוח LC-MS/MS של שברים משורשרים
- הרכיבו מחדש את הפפטידים המיובשים משברי ה-pH הבסיסיים ב-5% FA, וצנטריפוגה ב-21,000 × גרם למשך 5 דקות. העבירו את הסופרנטנט של כל דגימה לתוספת בקבוקון HPLC.
- טען ~ 1 מיקרוגרם פפטידים מכל שבר על העמודה. הפפטידים נפלטים בקצב זרימה של 0.25 μL/min עם שיפוע של 60 דקות של 18-45% מאגר B.
הערה: כדי לקבל מספרי זיהוי גבוהים, הפעל שבר אחד והתאם את השיפוע עבור השברים הנותרים בהתבסס על ההפעלה הראשונה. השיפוע הטוב ביותר צריך להכיל פפטידים מפוזרים באופן שווה על פני כל השיפוע (איור 4A). - הפעל את ספקטרומטר המסה עם הפרמטרים הבאים לניתוח דגימות המסומנות ב-TMT16: סריקות MS1 (טווח סריקת MS מלא: 450-1600 m/z; רזולוציית אורביטרפ: 60,000; יעד בקרת רווח אוטומטי: 1 x 106; זמן יונים מרבי: 50 אלפיות השנייה) ו-20 סריקות MS2 תלויות נתונים (רזולוציית Orbitrap: 60,000; יעד AGC: 1 x 105; זמן יונים מקסימלי: 110 אלפיות השנייה; אנרגיית התנגשות מנורמלת HCD: 32%; חלון בידוד: 1.0 m/z; היסט בידוד: 0.2 m/z; אי הכללה דינמית: 10 שניות).
הערה: הפרמטרים המשמשים כאן מותאמים לסוג אחד של ספקטרומטר מסה (ראה טבלת חומרים). עבור מכשירי MS שונים, על המשתמשים לכוונן את פרמטרי המכשיר כדי להשיג תוצאות באיכות גבוהה. הגדרה אחת היא לנטר אנרגיית התנגשות HCD מנורמלת, מכיוון שהאנרגיה האופטימלית עשויה להשתנות בין מכשירים כמו גם בין TMT11 ל-TMT16.
6. עיבוד נתונים
הערה: ניתוח הנתונים בוצע באמצעות חבילת תוכנה JUMP 37,38,39 הכוללת מנוע חיפוש היברידי של מסד נתונים (מבוסס תבניות ותגים), תוכנת סינון השולטת בשיעור גילוי השווא (FDR) של פפטידים/חלבונים שזוהו, ותוכנת כימות עבור מערכי נתונים TMT. בהתאם למצבו של המשתמש, ניתוח נתונים יכול להיעשות באמצעות תוכנות מסחריות אחרות או זמינות בחינם.
- חיפוש במאגרי מידע
- המר את קבצי ה-.raw ממכשיר MS לקבצי .mzXML, וחפש ספקטרום MS2 מול מסד נתונים שאינו מיותר של פיתוי מטרה40 שנוצר מרצפי חלבונים אנושיים של UniProt (או מסד נתונים מתאים אחר ספציפי למין) כדי לחשב את ה-FDR של חלבונים שזוהו.
הערה: צור את מסד הנתונים הלא מיותר על ידי שילוב רצפי חלבונים ממאגרי Swiss-Prot ו-TrEMBL. אפשר גם להוסיף רצפי חלבונים מותאמים אישית שאינם כלולים במאגרי המידע הללו, כולל חלבונים שסועים בפרוטאז, חלבונים עם פולימורפיזמים של נוקלאוטידים בודדים ומזהמים נפוצים. - בצע חיפושים באמצעות הפרמטרים הבאים. סובלנות מסה למבשר: 10 עמודים לדקה; סובלנות מסה ליוני מוצר: 15 עמודים לדקה; מקסימום מחשופים שהוחמצו: 2; אתרי שינוי מקסימליים: 3; שינויים סטטיים: 304.20715 Da עבור תגי TMT16 על שאריות Lys ו-N termini, 57.02146 Da עבור קרבמידומתילציה על שאריות Cys; שינוי דינמי: 15.99492 Da לחמצון ב-Met.
- המר את קבצי ה-.raw ממכשיר MS לקבצי .mzXML, וחפש ספקטרום MS2 מול מסד נתונים שאינו מיותר של פיתוי מטרה40 שנוצר מרצפי חלבונים אנושיים של UniProt (או מסד נתונים מתאים אחר ספציפי למין) כדי לחשב את ה-FDR של חלבונים שזוהו.
- סינון תוצאות החיפוש
- סנן את התאמות ספקטרום הפפטידים (PSMs) המתקבלות לפי אורך הפפטיד (>6 חומצות אמינו), דיוק המסה של יון המבשר וציוני התאמה מבוססי JUMP (Jscore ו-ΔJn). לאחר מכן מקובצים פפטידים לפי אורך פפטיד, קצוות טריפטיים, שינויים, אתרי מחשוף שהוחמצו ומצב טעינה.
- סנן את הנתונים עוד יותר עם ציוני ההתאמה כדי להשיג FDR מתחת ל-1% ברמת החלבון (ניתוח פרוטאום שלם) או פפטיד (ניתוח פוספו-פרוטאום).
הערה: אם חסרים פפטידים/חלבונים בשליטה חיובית בשלבי הסינון, ניתן להגדיל את ה-FDR לרמה סבירה כדי שניתן יהיה להציל את הפפטידים/חלבונים הללו. - עבור הפפטידים המשותפים ליותר מחבר אחד במשפחת חלבונים, אשכול את החברים המתאימים לקבוצה אחת.
הערה: לפי כלל החסכנות, הקבוצה מיוצגת על ידי החלבון ההומולוגי עם המספר הגבוה ביותר של פפטידים משותפים וחלבונים אחרים המותאמים לפפטידים ייחודיים.
- כימות חלבון
- כימות חלבונים באמצעות תוכנית מובנית של חבילת תוכנה סטטיסטית לסיכום עוצמות היונים של מדווח TMT על פני כל ה-PSMs התואמים.
- חלץ את עוצמות היונים של מדווח TMT מכל PSM מקובל ותקן את העוצמות הגולמיות בהתאם להתפלגות האיזוטופית של כל ריאגנט תיוג (למשל, TMT16-126 מייצר 92.6%, 7.2% ו-0.2% של יוני 126, 127C ו-128C m/z, בהתאמה) וסנן PSMs בעוצמה נמוכה ו/או רועש מאוד על בסיס סף המוגדר על ידי המשתמש. נרמל את נתוני הכימות באמצעות עוצמות ממוצעות חתוכות (או חציוניות) של דגימות כדי לתקן הטיית טעינה.
- עבור כל חלבון שזוהה, חשב את העוצמות הממוצעות הממוקדות על פני דגימות (כלומר, עוצמות יחסיות) של PSMs תואמים וסכם את העוצמות היחסיות של ה-PSMs על ידי לקיחת ממוצע לפי דגימה. המר את האותות היחסיים לאותות מוחלטים על ידי הכפלת העוצמה הממוצעת הכוללת של שלושת ה-PSMs התואמים הנפוצים ביותר.
- תיקון הפרעות כימות באמצעות גישת תיקון יונים y1 שדווחה בעבר37 המניחה שעוצמת היונים y1 מתואמת לעוצמת היונים המדווחת. על ידי הערכת הקשר הליניארי בין y1 לעוצמות יונים מדווח מסריקות נקיות, רמת ההפרעה מעוצמת היונים y1 המזוהמת בסריקות רועשות נגזרת ומתוקנת.
הערה: עבור פפטידים טריפטיים המסומנים ב-TMT, שאריות K-TMT ו-R הן שני יוני y1 מייצגים (376.27574 Da ו-175.11895 Da, בהתאמה) בספקטרום MS2. אם זוהה רק יון y1 אחד ותואם את הפפטיד המזוהה, אז ה-MS2 נחשב לסריקה נקייה. אם שני יוני y1 מזוהים, אז ה-MS2 נחשב לסריקה רועשת. - העבר את ערכי כימות החלבון לגיליון אלקטרוני להמשך ניתוח. השתמש בשיטות ניתוח נתונים לא מפוקחות כגון PCA או ניתוח אשכולות כדי לחקור את התפלגות הדגימות. כדי לזהות חלבונים המתבטאים באופן דיפרנציאלי, השתמש בשיטות סטטיסטיות כגון בדיקת t וניתוח שונות (ANOVA).
7. אימות נתוני MS
הערה: לפני ביצוע ניסויים ביולוגיים גוזלי זמן, השתמש לפחות בשיטת אימות אחת כדי להעריך את איכות נתוני הטרשת הנפוצה.
- בדוק ידנית את ספקטרום MS/MS של חלבונים מעניינים כדי לאמת את רצף הפפטידים ואת עוצמות היונים המדווח על TMT.
- השתמש בגישות מבוססות נוגדנים (למשל, כתמים מערביים או ניתוח אימונוהיסטוכימיה) כדי לאמת שינויים ברמות החלבון. כדי לאשר את נוכחותם של פפטידים מקומיים, השתמש בפפטידים סינתטיים כתקנים פנימיים. ספקטרום MS/MS וזמן השמירה של הפפטידים במהלך LC-MS/MS צריכים להיות זהים באותם תנאים.
- השתמש בגישה ממוקדת של טרשת נפוצה כדי לאמת שינויים בחלבון.
תוצאות
הפרוטוקול עבור ה-TMT16 שפותח לאחרונה, כולל תגובת תיוג, התפלה ותנאי LC-MS, עבר אופטימיזציה שיטתית41. יתר על כן, השווינו ישירות את שיטות 11-plex ו-16-plex על ידי שימוש בהן כדי לנתח את אותן דגימות AD אנושיות41. לאחר אופטימיזציה של הפרמטרים העיקריים עבור TMT16, שתי שיטות TMT11 ו-TMT16 מניבות כיסוי פרוטאום, זיהוי וכימות דומה >-100,000 פפטידים >-10,000 חלבונים אנושיים.
מכיוון שריאגנטים TMT16 הם הידרופוביים יותר מאשר ריאגנטים TMT11, פפטידים המסומנים ב-TMT16 עשויים להיות הידרופוביים יותר מפפטידים המסומנים ב-TMT11, מה שעשוי להסביר זמן שמירה שונה (RT) ב-RPLC. לפיכך, הערכנו את ההשפעה של TMT16 על פפטיד RT בהשוואה ל-TMT11 על ידי ניתוח תערובת הפפטידים המסומנת TMT11 ו-TMT16 באמצעות LC-MS/MS. מצאנו של-TMT16 יש השפעה משמעותית על RT לפפטידים עם הידרופוביות בינונית, אך יש לו השפעה מועטה על פפטידים בעלי הידרופוביות גבוהה או נמוכה במיוחד. לכן, ניתן להשתמש בריכוזי המאגר ההתחלתי והסיום הדומים B בשיפוע LC עבור פפטידים שונים המסומנים ב-TMT.
לאחר מכן ביצענו אופטימיזציה של שיפוע ה-RPLC המקוון עבור מדגם עם תווית TMT16. השיפוע של TMT16 דומה מאוד לזה של TMT11. אחוז המאגר ההתחלתי והסיום B זהים (למשל, 18% עד 45%). אבל שמנו לב שמספר הפפטידים שזוהו ב-TMT16 ירד במהירות בסביבות 40% מאגר B כאשר משתמשים באותו שיפוע המשמש ל-TMT11. לפיכך, הפחתנו מעט את זמן השיפוע בין 40% ל-45%. ביצענו גם התאמות קלות בשיפוע זה עבור שברים שונים ודגימות שונות. לאחר אופטימיזציית השיפוע, הפפטידים שזוהו התפזרו באופן שווה לאורך השיפוע (איור 4A).
כדי למקסם את מספר החלבונים שזוהו וכימתו במדויק בשיטת TMT16, ביצענו אופטימיזציה של אנרגיית ההתנגשות המנורמלת (NCE) עבור הדגימות המסומנות ב-TMT16 בדוח הקודם שלנו41. NCEs שונים (מ-20% עד 40%) נבדקו על ספקטרומטר המסה במהלך ריצות LC-MS/MS. באיזון מספר זיהויי החלבון ועוצמת היונים המדווחים, NCE של 30-32.5% נבחר כאנרגיית התנגשות HCD האופטימלית לשימוש עבור דגימות המסומנות ב-TMT16.
דחיסת יחס הנגרמת על ידי יונים מפריעים במשותף הייתה מגבלה של טכניקות התיוג האיזובריות לכימות חלבונים. מחקר שפורסם בעבר בשיטת TMT11 הראה כי ניתן כמעט לבטל דחיסת יחס על ידי פיצול מקדים נרחב של LC, הגדרות MS אופטימליות ואסטרטגיות תיקון נתונים לאחר MS37. השתמשנו באסטרטגיות אלה כולל פיצול נרחב לפני טרשת נפוצה (40 שברי pH LC בסיסיים), יישום חלון בידוד צר (1 m/z) בהגדרת MS, ותיקון יונים y1 בניתוח פרוטאום TMT11 ו-TMT16 של אותן דגימות. לאחר בחינת עקומת המתאם של שינוי קפלי החלבון בין מערכי הנתונים של TMT11 ו-TMT16, מצאנו שהשיפוע היה קרוב מאוד ל-1, מה שמצביע על כך שדחיסת היחס ב-TMT16 לא הייתה גבוהה באופן ניכר מזו של TMT11 בתנאי הניסוי שלנו41. התוצאות העקביות דווחו כי לדחיסת היחס אין הבדל כאשר רמת הריבוב הוגדלה מ-11 ל-1613,45. לפיכך, ניתן להשתמש באסטרטגיות שפורסמו בעבר כדי להקל על דחיסת היחס, ובכך לשפר משמעותית את דיוק הכימות 27,37,44,46.
לבסוף, השווינו את מספר ה-PSMs, הפפטידים הייחודיים והחלבונים הייחודיים שכומתו בדגימות TMT11 לעומת TMT16 (איור 4B). התוצאות מראות כי PSMs של שתי השיטות ניתנות להשוואה; עם זאת, החלבונים והפפטידים הכמותיים נמוכים מעט בשיטת TMT16, מה שעולה בקנה אחד עם דיווחים אחרים12,13. התוצאות שלנו מצביעות על כך שהשיפורים בתהליך TMT16 יחד עם השימוש בפרמטרים אופטימליים של LC-MS מספקים פרופיל פרוטאום עמוק בתפוקה גבוהה של דגימות ביולוגיות.
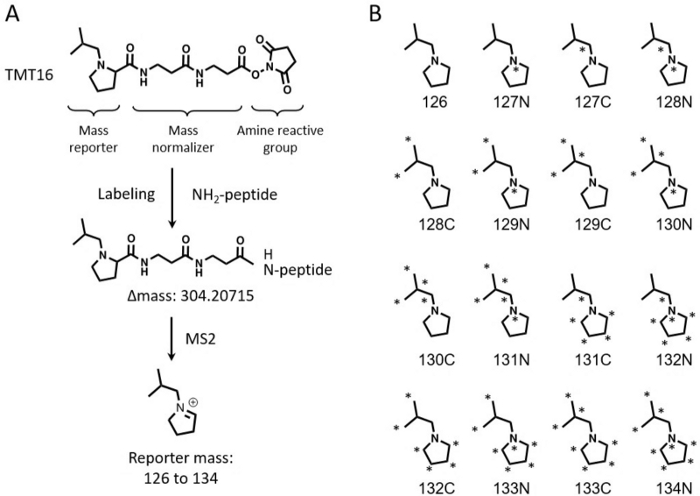
איור 1: המבנה של מגיב TMT 16-plex. (A) מוצג מבנה של מגיב TMT 16-plex, תהליך התיוג, שינוי המסה לאחר התיוג והמסה של יון המדווח. (B) מבנים מסומנים באיזוטופים כבדים של יוני המדווחים של ריאגנטים TMT16. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
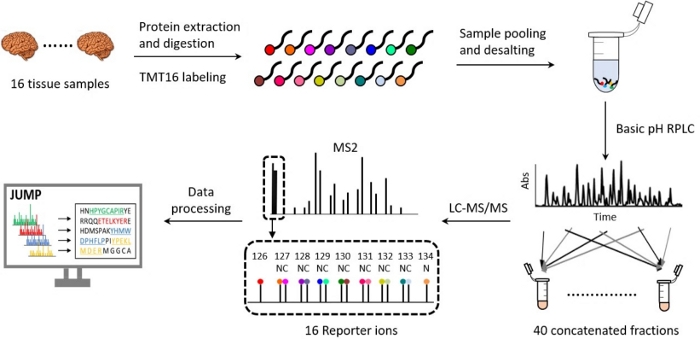
איור 2: זרימת עבודה של פרופיל פרוטאום על ידי 16-plex TMT-LC/LC-MS/MS. חלבון שהופק מ-16 דגימות רקמה ביולוגית עוכל וסומן ב-16 תגי TMT שונים. דגימות מ-16 ערוצים מאוגדות באופן שווה, והתערובת מפוצלת ומשורשרת ל-40 שברים על ידי כרומטוגרפיה נוזלית בסיסית לא מקוונת (RPLC). כל שבר מנותח עוד יותר על ידי RPLC חומצי יחד עם ספקטרומטריית מסה ברזולוציה גבוהה. קבצי ה-MS/MS הגולמיים עובדו. תמונת רקמת המוח מצוטטת מ-Medium.com עם כמה שינויים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
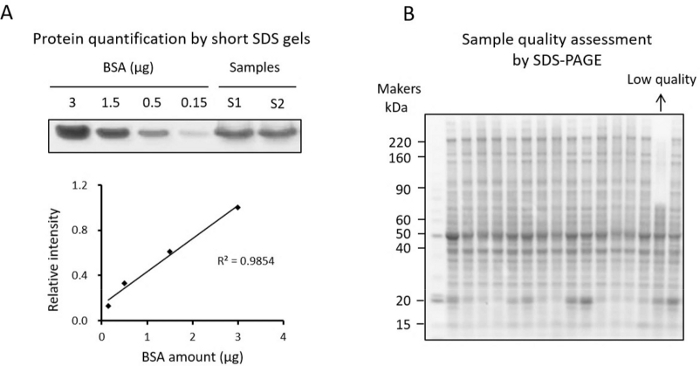
איור 3: בקרת איכות חלבון. (A) כימות של חלבון המופק מרקמה על ג'ל SDS קצר עם BSA כסטנדרט. העקומה הסטנדרטית משרטטת את ריכוז ה-BSA ואת עוצמת פס החלבון המוכתמת בקומאסי, המשמשת לכימות. (B) ג'ל SDS המשמש לבדיקת איכות חלבון. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
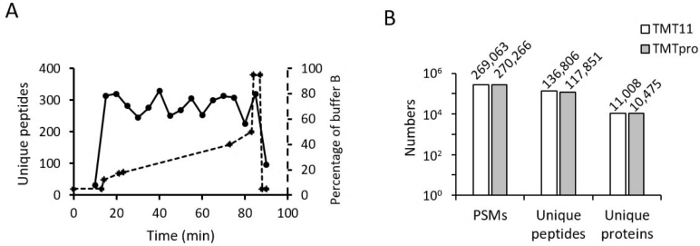
איור 4: תוצאות מייצגות. (A) התפלגות פפטידים ב-LC חומצי. השיפוע האופטימלי של מאגר B לאחר תיקון נפח מת מיושר באותה חלקה. (B) ההיסטוגרמה מראה את מספר ה-PSM המכומת, הפפטיד הייחודי והחלבון הייחודי בשיטות TMT11 ו-TMT16. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| ראשון (50 מיקרוליטר, השתמש ב-50% בתערובת הראשונה) | 2 (התאימו את התערובת וחסכו 10%) | שלישי (התאמה סופית) | |||||||||||
| ערוצי | עיתונאים | מיקס ווליום (μL) | עוצמה (יחידות) | Conc. (יחידה/מיקרוליטר) | עוצמה צפויה (יחידות) | תוספת נפח (μL) | סה"כ נפח (μL) | עוצמה (יחידות) | Conc. (יחידה/מיקרוליטר) | עוצמה צפויה (יחידות) | תוספת נפח (μL) | סה"כ נפח (μL) | עוצמה (יחידות) |
| 1 | סיג126 | 25 | 94.7 | 3.8 | 122.1 | 7.2 | 32.2 | 99.6 | 3.1 | 105.3 | 1.8 | 34.1 | 100 |
| 2 | sig127N | 25 | 83 | 3.3 | 122.1 | 11.8 | 36.8 | 101.1 | 2.7 | 105.3 | 1.5 | 38.3 | 98 |
| 3 | סיג127ג | 25 | 86 | 3.4 | 122.1 | 10.5 | 35.5 | 99.9 | 2.8 | 105.3 | 1.9 | 37.4 | 99.9 |
| 4 | sig128N | 25 | 103.9 | 4.2 | 122.1 | 4.4 | 29.4 | 102.1 | 3.5 | 105.3 | 0.9 | 30.3 | 97.2 |
| 5 | סיג128ג | 25 | 90.8 | 3.6 | 122.1 | 8.6 | 33.6 | 103.3 | 3.1 | 105.3 | 0.7 | 34.3 | 98.3 |
| 6 | sig129N | 25 | 82.8 | 3.3 | 122.1 | 11.9 | 36.9 | 99 | 2.7 | 105.3 | 2.4 | 39.3 | 98.7 |
| 7 | סיג129ג | 25 | 101.3 | 4.1 | 122.1 | 5.1 | 30.1 | 98.5 | 3.3 | 105.3 | 2.1 | 32.2 | 102.1 |
| 8 | sig130N | 25 | 98.9 | 4 | 122.1 | 5.9 | 30.9 | 100.1 | 3.2 | 105.3 | 1.6 | 32.5 | 99.7 |
| 9 | סיג130ג | 25 | 86.3 | 3.5 | 122.1 | 10.4 | 35.4 | 96 | 2.7 | 105.3 | 3.4 | 38.8 | 99.3 |
| 10 | sig131N | 25 | 87 | 3.5 | 122.1 | 10.1 | 35.1 | 95.3 | 2.7 | 105.3 | 3.7 | 38.8 | 101.5 |
| 11 | סיג131ג | 25 | 119.1 | 4.8 | 122.1 | 0.6 | 25.6 | 100.9 | 3.9 | 105.3 | 1.1 | 26.7 | 100.2 |
| 12 | sig132N | 25 | 86 | 3.4 | 122.1 | 10.5 | 35.5 | 95.3 | 2.7 | 105.3 | 3.7 | 39.2 | 99.6 |
| 13 | סיג132ג | 25 | 119.1 | 4.8 | 122.1 | 0.6 | 25.6 | 101.2 | 3.9 | 105.3 | 1 | 26.7 | 100 |
| 14 | sig133N | 25 | 116.3 | 4.7 | 122.1 | 1.3 | 26.3 | 99.9 | 3.8 | 105.3 | 1.4 | 27.7 | 100.9 |
| 15 | סיג133ג | 25 | 122.1 | 4.9 | 122.1 | 0 | 25 | 101 | 4 | 105.3 | 1.1 | 26.1 | 101.9 |
| 16 | sig134N | 25 | 121.3 | 4.9 | 122.1 | 0.2 | 25.2 | 105.3 | 4.2 | 105.3 | 0 | 25.2 | 101.3 |
טבלה 1: נתונים מייצגים המציגים את תהליך איגום הדגימות בשלב 3.3.
Discussion
פרוטוקול אופטימלי לפרופיל פרוטאום עמוק מבוסס TMT16 יושם בהצלחה בפרסומים קודמים 12,13,41. עם פרוטוקול זה, ניתן לכמת באופן שגרתי יותר מ-10,000 חלבונים ייחודיים מעד 16 דגימות שונות בניסוי יחיד בדיוק גבוה.
כדי להשיג תוצאות איכותיות, חשוב לשים לב לשלבים קריטיים לאורך הפרוטוקול. בנוסף לכל שלבי ה-QC שנדונו במאמר הקודם שלנו27, אנו כוללים שלבים חיוניים נוספים ספציפיים לתהליך TMT16. שלבים אלה חשובים להבטחת ניסוי מוצלח. לדוגמה, נגזרות תגובת TMT (למשל, TMTpro-NHOH מתגובת מרווה הידרוקסילאמין ו-TMTpro-OH מהידרוקסילציה של TMT) מזוהות כיונים טעונים בודדים בולטים לפני התפלה על ידי ניתוח LC-MS/MS. זה קריטי להסיר אותם בשלב ההתפלה. בדקנו תנאי התפלה שונים ומצאנו שתוספת של 5% ACN במאגר כביסה רגיל בשילוב עם 10 נפחי מיטה × שטיפה שלוש פעמים הסירה ביעילות את הנגזרות41. בנוסף, ל-TMT16 יש מסה מוגברת בהשוואה ל-TMT11, ולכן טווח הסריקה המלא מתחיל מ-m/z גבוה יותר (450 במקום 410) עבור דגימות המסומנות ב-TMT16. יתר על כן, מכיוון שאנרגיית ההתנגשות האופטימלית עבור פפטיד תלויה במצב המסה לטעינה והטעינה של יון המבשר21, הפפטידים המסומנים בתגי תיוג כימיים שונים עשויים להיות בעלי אנרגיות התנגשות אופטימליות שונות. עבור TMT16, אנרגיית ההתנגשות של 30-32.5% היא אופטימלית עבור TMT16, שהיא מעט נמוכה יותר מ-TMT11.
תיוג איזוברי הוא טכניקה רבת עוצמה המספקת יכולת ריבוב גבוהה. למרות שטכניקות אחרות כגון SILAC (תיוג איזוטופים יציבים על ידי חומצות אמינו בתרבית תאים)47 וללא תוויות מספקות אסטרטגיות חלופיות לכימות חלבונים48, הן סובלות מתפוקה נמוכה. TMT16 יכול לכמת חלבונים על פני 16 דגימות ביולוגיות שונות בתיאוריה. עם זאת, הרבה יותר נפוץ להשתמש בחלק מהערוצים הללו כשכפולים ביולוגיים, המספקים כוח סטטיסטי רב יותר ומסייעים בהפקת נתונים אמינים. שימוש בשכפולים או אפילו משולשים הוא קריטי מאוד, במיוחד במערכות שבהן השינוי הצפוי בריכוז החלבון הוא נומינלי. חשוב להבין את הביולוגיה של המערכת לפני תכנון הניסוי כך שיכלול את המספר המתאים של שכפולים. מערכות ביולוגיות מסוימות אינן מתאימות באופן אידיאלי לחלק משלבי בקרת האיכות בפרוטוקול זה. בדיקת יחס הפרמיקס אינה משמשת בעת שימוש בדגימות משקעים חיסוניים לפרוטוקול בשל האחוז הגדול של החלבונים הצפויים להשתנות. במקרים אלה, התוצאות היו מוטות עם בדיקת premix. זה נכון גם במקרים שבהם לפחות 1 מתוך 10 הדגימות צפויות להשתנות מאוד בביטוי החלבון (וקטור ריק, עיכוב פרוטאזום וכו'). כמו כן, מוצע להשתמש בערוץ TMT כ"ייחוס פנימי" שניתן להשתמש בו לאחר מכן כדי לשלב מספר קבוצות של ניסויי TMT1649.
פרוטוקול זה יכול לשמש לפרופיל פרוטאום גלובלי בעל תפוקה גבוהה של דגימות ביולוגיות מורכבות כדי לחקור חלבונים המתבטאים באופן דיפרנציאלי ומסלולי איתות תאים ולהבין את הביולוגיה של המחלה. בנוסף, עם שינויים קלים בפרוטוקול, ניתן להשתמש בו כדי לחקור שינויים לאחר תרגום כגון זרחון, אוביקוויטינציה, מתילציה ואצטילציה. נקיטת גישה משולבת המשלבת ניתוח פרוטאומי ממצה בקנה מידה גדול יחד עם צינורות אומיקס אחרים כגון גנומיקה, טרנסקריפטומיקה ומטבולומיקה יכולה לספק תובנות להרחבת ההבנה של מערכות ביולוגיות מורכבות30,50.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה באופן חלקי על ידי המכונים הלאומיים לבריאות (R01GM114260, R01AG047928, R01AG053987, RF1AG064909 ו-U54NS110435) ו-ALSAC (ארגוני צדקה אמריקאים לבנוניים סוריים). ניתוח הטרשת הנפוצה בוצע במרכז לפרוטאומיקה ומטבולומיקה של בית החולים למחקר לילדים סנט ג'וד, הנתמך בחלקו על ידי מענק התמיכה של מרכז הסרטן של NIH (P30CA021765). התוכן הוא באחריות המחברים בלבד ואינו מייצג בהכרח את העמדות הרשמיות של המכונים הלאומיים לבריאות.
Materials
| Name | Company | Catalog Number | Comments |
| 10% Criterion TGX Precast Midi Protein Gel | Biorad | 5671035 | |
| 10X TGS (Tris/Glycine/SDS) Buffer | BioRad | 161-0772 | |
| 4–20% Criterion TGX Precast Midi Protein Gel | Biorad | 5671095 | |
| 50% Hydroxylamine | Thermo Scientific | 90115 | |
| 6 X SDS Sample Loading Buffer | Boston Bioproducts Inc | BP-111R | |
| Ammonium Formate (NH4COOH) | Sigma | 70221-25G-F | |
| Ammonium Hydroxide, 28% | Sigma | 338818-100ml | |
| Bullet Blender | Next Advance | BB24-AU | |
| Butterfly Portfolio Heater | Phoenix S&T | PST-BPH-20 | |
| C18 Ziptips | Harvard Apparatus | 74-4607 | Used for desalting |
| Dithiothreitol (DTT) | Sigma | D5545 | |
| DMSO | Sigma | 41648 | |
| Formic Acid | Sigma | 94318 | |
| Fraction Collector | Gilson | FC203B | |
| Gel Code Blue Stain Reagent | Thermo | 24592 | |
| Glass Beads | Next Advance | GB05 | |
| HEPES | Sigma | H3375 | |
| HPLC Grade Acetonitrile | Burdick & Jackson | AH015-4 | |
| HPLC Grade Water | Burdick & Jackson | AH365-4 | |
| Iodoacetamide (IAA) | Sigma | I6125 | |
| Lys-C | Wako | 125-05061 | |
| Mass Spectrometer | Thermo Scientific | Q Exactive HF | |
| MassPrep BSA Digestion Standard | Waters | 186002329 | |
| Methanol | Burdick & Jackson | AH230-4 | |
| Nanoflow UPLC | Thermo Scientific | Ultimate 3000 | |
| Pierce BCA Protein Assay kit | Thermo Scientific | 23225 | |
| ReproSil-Pur C18 resin, 1.9um | Dr. Maisch GmbH | r119.aq.0003 | |
| Self-Pack Columns | New Objective | PF360-75-15-N-5 | |
| SepPak 1cc 50mg | Waters | WAT054960 | Used for desalting |
| Sodium Deoxycholate | Sigma | 30970 | |
| Speedvac | Thermo Scientific | SPD11V | |
| TMTpro 16plex Label Reagent Set | Thermo Scientific | A44520 | |
| Trifluoroacetic Acid (TFA) | Applied Biosystems | 400003 | |
| Trypsin | Promega | V511C | |
| Ultra-micro Spin Column,C18 | Harvard apparatus | 74-7206 | Used for desalting |
| Urea | Sigma | U5378 | |
| Xbridge Column C18 column | Waters | 186003943 | Used for basic pH LC |
References
- Levy, M. J., Washburn, M. P., Florens, L. Probing the sensitivity of the orbitrap lumos mass spectrometer using a standard reference protein in a complex background. Journal of Proteome Research. 17 (10), 3586-3592 (2018).
- Bekker-Jensen, D. B., et al. An optimized shotgun strategy for the rapid generation of comprehensive human proteomes. Cell Systems. 4 (6), 587-599 (2017).
- Mertins, P., et al. Proteogenomics connects somatic mutations to signalling in breast cancer. Nature. 534 (7605), 55-62 (2016).
- Frost, D. C., Greer, T., Li, L. High-Resolution Enabled 12-Plex DiLeu Isobaric Tags for Quantitative Proteomics. Analytical Chemistry. 87 (3), 1646-1654 (2015).
- Moulder, R., Bhosale, S. D., Goodlett, D. R., Lahesmaa, R. Analysis of the plasma proteome using iTRAQ and TMT-based Isobaric labeling. Mass Spectrometry Reviews. 37 (5), 583-606 (2018).
- Wang, H., et al. Deep multiomics profiling of brain tumors identifies signaling networks downstream of cancer driver genes. Nature Communications. 10 (1), 3718(2019).
- Rauniyar, N., Yates, J. R. Isobaric labeling-based relative quantification in shotgun proteomics. Journal of Proteome Research. 13 (12), 5293-5309 (2014).
- Hogrebe, A., et al. Benchmarking common quantification strategies for large-scale phosphoproteomics. Nature Communications. 9 (1), 1045(2018).
- Dayon, L., et al. Relative quantification of proteins in human cerebrospinal fluids by MS/MS using 6-plex isobaric tags. Analytical Chemistry. 80 (8), 2921-2931 (2008).
- Stepanova, E., Gygi, S. P., Paulo, J. A. Filter-based protein digestion (FPD): A detergent-free and scaffold-based strategy for TMT workflows. Journal of Proteome Research. 17 (3), 1227-1234 (2018).
- McAlister, G. C., et al. Increasing the multiplexing capacity of TMTs using reporter ion isotopologues with isobaric masses. Analytical Chemistry. 84 (17), 7469-7478 (2012).
- Thompson, A., et al. TMTpro: Design, synthesis, and initial evaluation of a proline-based isobaric 16-plex tandem mass tag reagent set. Analytical Chemistry. 91 (24), 15941-15950 (2019).
- Li, J., et al. TMTpro reagents: a set of isobaric labeling mass tags enables simultaneous proteome-wide measurements across 16 samples. Nature Methods. 17 (4), 399-404 (2020).
- Arul, A. B., Robinson, R. A. S. Sample Multiplexing Strategies in Quantitative Proteomics. Analytical Chemistry. 91 (1), 178-189 (2019).
- Labib, M., Kelley, S. O. Single-cell analysis targeting the proteome. Nature Reviews Chemistry. 4 (3), 143-158 (2020).
- Ren, R. J., Dammer, E. B., Wang, G., Seyfried, N. T., Levey, A. I. Proteomics of protein post-translational modifications implicated in neurodegeneration. Translational Neurodegeneration. 3 (1), 23(2014).
- Pagel, O., Loroch, S., Sickmann, A., Zahedi, R. P. Current strategies and findings in clinically relevant post-translational modification-specific proteomics. Expert Review of Proteomics. 12 (3), 235-253 (2015).
- Mertins, P., et al. Reproducible workflow for multiplexed deep-scale proteome and phosphoproteome analysis of tumor tissues by liquid chromatography-mass spectrometry. Nature Protocols. 13 (7), 1632-1661 (2018).
- Aebersold, R., Mann, M. Mass-spectrometric exploration of proteome structure and function. Nature. 537 (7620), 347-355 (2016).
- Bai, B., et al. Deep multilayer brain proteomics identifies molecular networks in Alzheimer's disease progression. Neuron. 105 (6), 975-991 (2020).
- Kelstrup, C. D., et al. Rapid and deep proteomes by faster sequencing on a benchtop quadrupole ultra-high-field orbitrap mass spectrometer. Journal of Proteome Research. 13 (12), 6187-6195 (2014).
- Meier, F., et al. Online parallel accumulation - serial fragmentation (PASEF) with a novel trapped ion mobility mass spectrometer. Molecular & Cellular Proteomics. 17 (12), (2018).
- Schweppe, D. K., et al. Full-featured, real-time database searching platform enables fast and accurate multiplexed quantitative proteomics. Journal of Proteome Research. 19 (5), 2026-2034 (2020).
- Wang, H., et al. Systematic optimization of long gradient chromatography mass spectrometry for deep analysis of brain proteome. Journal of Proteome Research. 14 (2), 829-838 (2015).
- Dey, K. K., et al. Deep undepleted human serum proteome profiling toward biomarker discovery for Alzheimer's disease. Clinical Proteomics. 16, 16(2019).
- Bai, B., et al. Deep profiling of proteome and phosphoproteome by isobaric labeling, extensive liquid chromatography, and mass spectrometry. Methods in Enzymology. 585, 377-395 (2017).
- High, A. A., et al. Deep proteome profiling by isobaric labeling, extensive liquid chromatography, mass spectrometry, and software-assisted quantification. Journal of Visualized Experiments. (129), e56474(2017).
- Chick, J. M., et al. Defining the consequences of genetic variation on a proteome-wide scale. Nature. 534 (7608), 500-505 (2016).
- Wang, Z., et al. Quantitative phosphoproteomic analysis of the molecular substrates of sleep need. Nature. 558 (7710), 435-439 (2018).
- Tan, H., et al. Integrative proteomics and phosphoproteomics profiling reveals dynamic signaling networks and bioenergetics pathways underlying T cell activation. Immunity. 46 (3), 488-503 (2017).
- Eden, E., et al. Proteome Half-Life Dynamics in Living Human Cells. Science. 331 (6018), 764(2011).
- Kleiman, L. B., Maiwald, T., Conzelmann, H., Lauffenburger, D. A., Sorger, P. K. Rapid phospho-turnover by receptor tyrosine kinases impacts downstream signaling and drug binding. Molecular Cell. 43 (5), 723-737 (2011).
- Mertins, P., et al. Ischemia in tumors induces early and sustained phosphorylation changes in stress kinase pathways but does not affect global protein levels. Molecular & Cellular Proteomics. 13 (7), 1690(2014).
- Xu, P., Duong, D. M., Peng, J. Systematical optimization of reverse-phase chromatography for shotgun proteomics. Journal of Proteome Research. 8 (8), 3944-3950 (2009).
- Wang, Y., et al. Reversed-phase chromatography with multiple fraction concatenation strategy for proteome profiling of human MCF10A cells. Proteomics. 11 (10), 2019-2026 (2011).
- Yang, F., Shen, Y., Camp, D. G., Smith, R. D. High-pH reversed-phase chromatography with fraction concatenation for 2D proteomic analysis. Expert Review of Proteomics. 9 (2), 129-134 (2012).
- Niu, M., et al. Extensive peptide fractionation and y(1) ion-based interference detection method for enabling accurate quantification by isobaric labeling and mass spectrometry. Analytical Chemistry. 89 (1), 2956-2963 (2017).
- Wang, X., et al. A tag-based database search tool for peptide identification with high sensitivity and accuracy. Molecular & Cellular Proteomics. 13 (12), 3663(2014).
- Li, Y., et al. JUMPg: An integrative proteogenomics pipeline identifying unannotated proteins in human brain and cancer cells. Journal of Proteome Research. 15 (7), 2309-2320 (2016).
- Elias, J. E., Gygi, S. P. Target-decoy search strategy for increased confidence in large-scale protein identifications by mass spectrometry. Nature Methods. 4 (3), 207-214 (2007).
- Wang, Z., et al. 27-plex tandem mass tag mass spectrometry for profiling brain proteome in Alzheimer's disease. Analytical Chemistry. 92 (10), 7162-7170 (2020).
- Ow, S. Y., et al. iTRAQ underestimation in simple and complex mixtures: "The good, the bad and the ugly". Journal of Proteome Research. 8 (11), 5347-5355 (2009).
- Karp, N. A., et al. Addressing accuracy and precision issues in iTRAQ quantitation. Molecular & Cellular Proteomics. 9 (9), 1885-1897 (2010).
- Ting, L., Rad, R., Gygi, S. P., Haas, W. MS3 eliminates ratio distortion in isobaric multiplexed quantitative proteomics. Nature Methods. 8 (11), 937-940 (2011).
- Gygi, J. P., et al. A triple knockout isobaric-labeling quality control platform with an integrated online database search. Journal of The American Society for Mass Spectrometry. 31 (7), 1344-1349 (2020).
- Savitski, M. M., et al. Measuring and managing ratio compression for accurate iTRAQ/TMT quantification. Journal of Proteome Research. 12 (8), 3586-3598 (2013).
- Ong, S. E., et al. Stable isotope labeling by amino acids in cell culture, SILAC, as a simple and accurate approach to expression proteomics. Molecular & Cellular Proteomics. 1 (5), 376(2002).
- Cox, J., et al. Accurate proteome-wide label-free quantification by delayed normalization and maximal peptide ratio extraction, termed MaxLFQ. Molecular & Cellular Proteomics. 13 (9), 2513(2014).
- Brenes, A., Hukelmann, J., Bensaddek, D., Lamond, A. I. Multibatch TMT reveals false positives, batch effects and missing values. Molecular & Cellular Proteomics. 18 (10), 1967-1980 (2019).
- Yu, J., Peng, J., Chi, H. Systems immunology: Integrating multi-omics data to infer regulatory networks and hidden drivers of immunity. Current Opinion in Systems Biology. 15, 19-29 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved