Method Article
電気生理学的フィールド記録によるインターラメラ海馬CA1における長期シナプス可塑性の調査
要約
我々は、長手方向海馬脳スライスの記録と刺激電極を使用し、生体内の背中海馬における縦方向に位置決めされた記録および刺激電極を用いて、細胞外のポストシナプスの可能性を呼び起こし、実証した。縦方向の中間ラメラCA1に沿った長期シナプス可塑性。
要約
海馬におけるシナプス可塑性の研究は、CA3-CA1ラメラネットワークの使用に焦点を当てている。縦方向のインターラメラCA1-CA1ネットワークにはあまり注意が払われていない。しかし最近,CA1-CA1ピラミッド型ニューロン間の関連性が示されている.したがって、海馬の縦方向インターラメラCA1-CA1ネットワークがシナプス可塑性をサポートしているかどうかを調る必要がある。
我々は、生体内およびインビトロの両方の電気生理学的フィールド記録を用いて、海馬間CA1ネットワークにおける長期シナプス可塑性の有無を調査するプロトコルを設計した。生体内細胞外の記録では、記録および刺激電極を縦方向の角度で後部海馬の中枢側軸に配置し、フィールド興奮ポストシナプス電位を呼び起こす。インビトロ細胞外視野記録では、海馬縦断スライスを中時間平面と平行に切断した。記録および刺激電極は、縦軸に沿って海馬の地層ラジエータム(S.O)および地層放射(S.R)に配置した。これにより、誘発された興奮性ポストシナピティの方向性と層特異性を調べ取ることを可能にした。既に確立されたプロトコルは、インビボとインビトロの両方で長期増強(LTP)および長期うつ病(LTD)を誘導するために使用された。我々の結果は、縦方向の中間ラメラCA1ネットワークが指向性または層特異性なしでN-メチル-D-アスパラギン酸(NMDA)受容体依存性長期増強(LTP)をサポートすることを実証した。しかし、横断ラメラネットワークとは対照的に、インターラメラネットワークは有意な長期うつ病(LTD)を有しなかった。
概要
海馬は認知研究1、2、3で広く使用されている。横軸の海馬ラメラネットワークは、歯状のジャイル、CA3、およびCA1領域から構成される三シナプス回路を形成する。ラメラネットワークは、平行で独立したユニット4、5であると考えられている。このラメラの視点は、海馬の生体内およびインビトロ電気生理学的研究の両方に対する横方向と横スライスの使用に影響を与えました。新しい研究に照らして、ラメラ仮説は6を再評価され、海馬の中間ラメラネットワークにも注意が払われています。海馬間ネットワークに関しては、CA3領域は長い間調査されてきた7、8、9、10、しかし、縦方向のCA1海馬領域は受け取った最近まで比較的注意が払わなされなくなっき。CA1インターラメラネットワークに関しては、ラットのドルソベンストラ縦海馬CA1軸に沿った短期的なシナプス特性が11変化することが示されている。また、ラットにおける海馬の縦軸に沿って系統的に配置された相及び場所に応答する海馬細胞のクラスターが、短期記憶タスク12を受けていることが判明した。また、てんかん発作活動は、縦軸13に沿って海馬全体に沿って同期していることが判明した。
しかし、縦方向のCA1海馬領域のほとんどの研究は、CA3からCA1領域への入力を利用している11、14、15.独自のプロトコルを使用して縦方向の脳スライスを作成し、我々の前の研究は、縦軸に沿ったCA1ピラミッド状ニューロンの関連性を実証し、ニューロンシグナル伝達を効果的に処理する能力16を関与した。しかし、横入力のない縦軸に沿ったCA1ピラミッド状ニューロンが長期シナプス可塑性をサポートできるかどうかを判断する必要がある。この知見は海馬に関する神経学的問題の調査に別の角度を追加することができます。.
情報伝達の有効性を適応させるニューロンの能力は、シナプス可塑性として知られています。シナプス可塑性は、学習および記憶17、18、19、20などの認知プロセスの基礎となるメカニズムとして関与している。長期シナプス可塑性は、神経応答の強化を表す長期増強(LTP)、または神経応答の弱体化を表す長期うつ病(LTD)のいずれかとして実証される。海馬の横軸では長期シナプス可塑性が研究されている。しかし、これはCA1ピラミッド型ニューロンの海馬縦軸における長期シナプス可塑性を実証する最初の研究である。
Yang et al.16によって使用されるプロトコルから構築し、CA1 ピラミッド型ニューロンの海馬縦軸で LTP および LTD を実証するプロトコルを設計しました。我々は、インビトロ実験のために5〜9週齢と生体内実験のために6-12週齢の間の年齢を有するC57BL6雄マウスを使用した。この詳細な記事は、インビトロ記録のためにマウスから得られた縦海馬脳スライスの方法と、生体内記録が縦軸に記録された方法を示す。インビトロ録音では、海馬の中隔末端と時間的な末端を標的にして縦方向CA1シナプス可塑性の指向性特異性を調べた。また、海馬の地層オリエンスと地層放射体からの記録により、縦方向CA1シナプス可塑性の層特異性を調べました。生体内記録では、海馬の長方向に最も適した角度を調べました。
インビボとインビトロ細胞外視野の両方を用いて、LTPではなくLTPで提示された縦方向に接続されたCA1ピラミッドニューロンを観察した。ただし、CA3 ニューロンと CA1 ニューロンの両方を含む横方向は、LTP と LTD の両方をサポートします。海馬の横方向と縦方向のシナプス機能の区別は、その機能的接続性の違いを推測的に示す可能性がある。シナプス能力の違いを解読するには、さらなる実験が必要です。
プロトコル
すべての動物は、国立衛生研究所の動物ケアと使用のガイドラインと規制に従って治療されました。ここに記載されているすべての方法は、香港市立大学と仁川国立大学の機関動物管理利用委員会(IACUC)によって承認されています。
1. インビボフィールド記録
- 動物の準備
- ウレタン(25g当たり0.06g)を食後に注射し、マウスを麻酔する。アトロピンの筋肉内注射でサプリメント (0.05 mg/kg).完全な麻酔が有効になるまで、暗い静かな場所にマウスを保管してください。
注意:ウレタンは発癌性の可能性があります。露出した皮膚との接触を避けるために、注意して取り扱い、防護服を着用してください。
注:あるいは、イソファルランは麻酔として使用することができる。 - 麻酔の完全な外科面が有効になるまで、間欠的に麻酔の深さをチェックしてください。つま先のピンチ、耳のピンチ、テールピンチ、角膜タッチテストを行い、マウスの物理的な刺激に対する反応を観察することにより、麻酔の深さを確認します。
注:マウスが麻酔の完全な外科面にある場合、反射または自発的な動きは観察されるべきではありません。 - つま先のピンチテストでは、マウスの後ろまたは前脚を伸ばし、鈍い鉗子または指でしっかりとつまみます。マウスは、脚を引き出したり、体を揺らしたり、呼吸速度が増加したり、声を出したりする場合、完全な麻酔のために確認されません。
- 耳のピンチテストのために、ピンナの端を鈍い鉗子または指のペアでしっかりとつまみます。マウスがウィスカーを前方に動かしたり、頭を振ったり、声を出したり、呼吸数が増加したりする場合、完全な麻酔は確認されません。
- テールピンチテストでは、マウスの尾を優しくしっかりとつまみ、鈍い鉗ポンまたは指でつまみます。手術のために完全に麻酔を行った場合、尾の動き、声の音、または呼吸数の増加が観察されない。
- 角膜タッチテストの場合は、綿の芯でマウスの角膜を優しく触れます。眼瞼の動き、ひげの動き、または呼吸数の観察可能な増加は、手術のために完全に麻酔を受けたときに観察されるべきである。
- マウスの首と頭蓋骨の毛を剃ります。
- 完全麻酔マウスを37°Cに設定した加熱パッドに置き、直腸温度プローブを直腸に挿入します。これにより、加熱パッドによって発生する熱は、マウスの体温の変化に応じて調整することができます。
- マウスの目を湿らせる目のゲルを適用します。
- 鉗子を使用して唇の側面に舌を引き出し、2つの前歯を立体計測器の2番目または3番目の歯の穴に固定します。アイクランプを使用してマウスの頭蓋骨をしっかりと固定します。
注:または、立体的なイヤークランプを使用することもできます。 - 顕微鏡下で観察し、マウスの頭蓋骨と後頭骨の末端にある皮下組織と筋肉をメスで分離し、シスターナマグナを露出させる。綿棒で乾燥したデュラ母子をブロット。
- 鋭い尖ったメスの刃で浅い切り口を作ることによって静骨のマグナを穏やかに穿刺し、脳脊髄液(CSF)を排出する。綿棒を取り付けて、CSFを排出し続けます。
- ウレタン(25g当たり0.06g)を食後に注射し、マウスを麻酔する。アトロピンの筋肉内注射でサプリメント (0.05 mg/kg).完全な麻酔が有効になるまで、暗い静かな場所にマウスを保管してください。
- 開頭術
- 鉗子で頭皮の皮膚を保持し、切り取り、外科的なはさみで皮膚を取り除く。頭皮にブレグマとラムダのマークを露出するのに十分な皮膚をカットします。露出した領域を乾燥させたままにします。
- マウスのクランプされた頭蓋骨を調整して、ブレグマポイントとラムダポイントを同じような高さの水平レベルに揃えます。前後位置または中間横位置のいずれかで頭を傾けないようにします。
- バーニエキャリパーの助けを借りて海馬領域に対応するポイントをマークします。正確な座標を決定するために、座標図図帳のマウス脳を参照として使用します。
注:海馬の切開をマークする位置は、ブレグマを基準点として使用する前部後部(AP)と呼ばれる中間線上の1mm x 3 mm、中線上の点を接続するために中線に垂直な3mm x 3 mmです。立体座標は(AP:1,3およびML:3,3)として与えられる。 - 顕微鏡下で観察しながら、メスまたは高速ドリルを使用して、マークされたポイントに沿って海馬の後部領域の上に頭蓋骨の切開を行います。
注:切開後に2mm x 3mmの大きさの長方形の開口部を得る必要があります。脳への損傷を避けるために、露出した領域を清潔に保ちます。 - 慎重に鉗子で緩い頭蓋骨を取り出し、デュラマターを露出させ、シリンジまたはスポイトを使用して、表面を湿らせる生理的生理的生理的生理的な生理的な生理的な生理的な生理的な溶液を穏やかに適用します。
- 針または鋭い尖った先端の鉗子で慎重にデュラ母子を取り外します。
注:開頭術中に脳組織に損傷を与えないように注意してください。これは、脳の腫れにつながるし、結果に影響を与えます. - スポイトや注射器を使用して生理食生または不活性油を適用することにより、露出した脳組織を湿らせておきます。
- インビボ録音
- 刺激を固定し、ステレオタクティックホルダーにしっかりと電極を記録します。CA1後海馬の上の刺激および記録電極のための対応するAPおよびML座標の位置に従って立体化器械を調節する。
注:後方縦方向CA1海馬領域の座標を見つけるガイドとして、立体座標でマウス脳を使用します。たとえば、CA1 海馬領域の立体座標は、記録電極の場合は(AP 1.5、ML 1.0)、刺激電極の場合は(AP 1.7、ML 1.5)になります。 - 刺激電極を縦方向に記録電極に向ける。
メモ:使用前に刺激と記録電極の両方がクリーンであることを確認してください。これにより、録音時のノイズの発生を防ぐことができます。 - 記録には、マルチチャンネル電極を使用します。まず、最初のチャネルを使用して CA1 海馬領域の立体座標を見つけます。残りの電極を配置し、刺激および記録電極の角度がブレグマ点からの中線に対して30°~60°の範囲にあるような位置に置きます。
注: この角度は、CA1 海馬領域の縦方向に対応します。 - 対照として、CA1領域の上に記録電極と、後部海馬のCA3領域の上に刺激電極を見つける。例えば、マウス脳を立体座標に導き出し、CA1-CA3海馬領域の立体座標は記録電極の場合(AP 1.8、ML 1.0)、刺激電極の場合は(AP 1.5、ML 1.5)になります。
注: この手順は代替制御であり、別の実験で行う必要があります。 - 参照電極を露出した脳領域の遠位部分またはマウスの皮膚の下に置きます。
- 記録システムの電源を入れます。
- 記録およびデータ取得用のソフトウェアを開きます。
注:異なるラボには、記録およびデータ取得のための好ましいソフトウェアがあります。 - 顕微鏡下で観察し、マイクロマニピュレータを使用してゆっくりと記録と刺激電極を下げ、脳の表面に触れるまで。海馬領域への正確な深さの計算を開始するには、点をゼロ点としてマークします。
メモ:マイクロマニピュレータを使用すると、電極が挿入される深さをいつでも監視できます。電極が脳表面に触れたときだけインピーダンスの増加を観察します。 - CA1海馬の選択した立体座標に対応する近似深さまで電極をゆっくりと下げる。
注: マウスの脳を立体座標で使用すると、選択した立体座標に対応する近似深度を取得できます。 - 刺激(100 μsの持続時間、30秒間隔で繰り返される)を与え、安定した誘発場興奮ポストシナジー電位(fEPSP)が観察されるまで、50 μm以下のステップで電極深度を調整する。
注:20 μAの刺激は、通常、観察可能な応答を呼び起こすのに十分です。 - 刺激強度を変化させることによって、安定したfEPSPが引き起こされたことを確認します。fEPSPの傾きまたは振幅の顕著な増加は、各増加刺激強度で観察されるべきである。これは、入力出力曲線と呼ばれる。入力出力(I-O)曲線を作成して、呼び出された fEPSP の傾きがこれ以上増加しない最大刺激強度を検出します(図 6)。
注:実験中に繊維ボレーが消失した場合は、データを破棄し、電極の位置を変更します。 - 入力出力曲線を使用して、ベースライン強度を最大値の 40 ~ 50% に設定します。ベースライン記録には、対応する刺激強度を使用します。
- ローカル フィールドの電位を 20 ~ 30 分のベースラインとして記録します。
- 同じ入力出力曲線を使用して、高周波刺激(HFS)または破傷風を呼び起こす刺激強度を最大強度の 75% に設定します。あるいは、長期うつ病を誘発する場合、低周波刺激(LFS)を呼び起こす際にベースラインを記録するために使用されるのと同じ刺激強度を維持する。
- LTPを誘導するために100 Hzパルスの破谷刺激を100Hzパルスを4回10秒間隔で適用します。
注: このプロトコルは、長期の増強実験で作業する場合にのみ使用してください。 - 5 Hz (3 分の間に 900 刺激)、1 Hz LFS (15 分の間に 900 刺激)、または 1 Hz ペアパルスパルス (50 ミリ秒のペアパルス間隔、15 分の間に 900 ペアの刺激) の低周波刺激を適用して、既に確立されたプロトコルに従って LTD を誘導します。
注: これらのプロトコルは、長期的なうつ病実験に取り組んでいる場合にのみ使用してください。 - 代わりに、HFS または LFS の後に 1 時間のローカル・フィールド・ポテンシャルを記録します。
- データをエクスポートし、ソフトウェアを使用して分析します。
- 記録および刺激電極の位置を確認するには、記録された領域に対して30sの10 μA電流の刺激を与えることによって、4%のパラホルムアルデヒドでマウスをトランスファーに浸透させ、クレシルバイオレットでスライスと染色のために脳を収穫する。
- 実験後の子宮頸部脱臼または致死麻酔薬の注射によりマウスを安楽死させる。
- 刺激を固定し、ステレオタクティックホルダーにしっかりと電極を記録します。CA1後海馬の上の刺激および記録電極のための対応するAPおよびML座標の位置に従って立体化器械を調節する。
2. インビトロフィールド記録
- 酸素化スライスおよび人工脳脊髄液(ACSF)溶液の準備
- 2Lのスライス液の場合は、容積フラスコに約1Lの二重蒸留水を加え、攪拌板で激しくかき混ぜます。
- 以下のスライス液成分(mM)を追加する:87.0 NaCl、2.5 KCl、1.3NaH2 PO 4、25.0 NaHCO3、25.0ブドウ糖、75.0スクロース、7.0 MgCl2.6H2Oおよび0.5 CaCl2∙2H2O(表1)。
注:または、MgCl2∙6H2OおよびCaCl 2∙2H2Oは、この段階で除外し、後でボリュームを使用する準備ができて追加することができます。 - 激しく攪拌しながら、二重蒸留水で2Lまでトップ。
- ACSFの2Lの場合は、容積フラスコに約1Lの二重蒸留水を加え、攪拌板で激しくかき混ぜます。
- 以下のACSF溶液成分(mM)を追加する:125.0 NaCl、2.5 KCl、1.3NaH2PO 4、25.0 NaHCO 3、25ブドウ糖、1.0 MgCl2∙6H2Oおよび2.0 CaCl2×2H2O(表1)。
注:または、MgCl2.6H2OおよびCaCl 2∙2H2Oは、この段階で除外し、後でボリュームを使用する準備ができて追加することができます。 - 激しく攪拌しながら、二重蒸留水で2Lまでトップ。
- セットアップと脳のスライス
- 既に調製したスライス液の400mLを別のフラスコに注ぎ、酸素化(95%O 2/5%CO2)を約20分間注ぎます。
- 残りの1.6L溶液を4°Cの冷蔵庫に保管します。真菌の成長を避けるために使用しない場合は廃棄する必要がある1週間後に溶液を維持します。
- フラスコに酸素化スライス液の200 mLを注ぎ、パラフィルムで覆い、-80°C冷凍庫に約20分間移してスラッシュを作ります。
- 残りの200mLのスライス液を脳スライス保持室に注ぎ、連続的なバブリングで32°Cの水浴に保管します。
- スライス用のベンチを準備します。ペーパータオルを置き、手術用具をベンチの上に置きます。迅速かつ効率的なプロセスを容易にするために、外科的ツールを使用順に配置します(図7)。
- 冷凍庫から冷やしたスライス液を取り出し、ビーカーに約50mLを注ぎます。フィルターペーパーを含むペトリ皿に約10mLを注ぎ、湿らせます。解剖区域の氷の上に置きます。
- スライスチャンバーに残りのスライス液を注ぎ、ビブラートに固定します。
- 動物のケアに関するガイドラインや規制、国立衛生研究所の研究室の使用、および香港市立大学と仁川国立市立大学の施設動物使用・ケア委員会の承認された方法を用いて、イソファランでマウスを麻酔する大学。
- 麻酔マウスをハサミで切断し、ティッシュペーパーの上に頭を置きます。マウスの頭蓋骨を覆う皮膚を切り取り、皮膚の筋肉をはさみで切ります。外科用はさみを使って、中線に沿って頭蓋骨を後頭骨に切る。
- 頭蓋骨を鈍い鉗子で開いて脳を露出させる。へらで脳をそっとすくい取り、ビーカーの冷やしたスライス液に入れ。30sぐらい待ちます。
- スプーンを使って脳を取り出し、ペトリ皿の以前に湿ったフィルターペーパーの上に慎重に置きます。
- メスブレードで中線に沿って2つの脳半球を分離します。海馬をへらで皮質からそっと切り離して分離し、湿ったフィルターペーパーの上に慎重に置きます。メスを使用して、孤立した海馬の中隔および側的な端を切り取ります。
- 鈍いへらとブラシを使用して孤立した海馬を拾います。余分な水を取り除くためにティッシュペーパーにへらをそっと塗ります。
- ビブラートムのスライスプレートに少量の接着剤を塗布します。
- 縦方向のCA1海馬スライスの場合は、海馬のCA3領域を接着剤でスライスプレートに取り付けます。冷蔵酸素スライス液を含むビブラートムのスライスチャンバーに素早く慎重に置きます。
- コントロールとして機能する横スライスの場合は、海馬の腹部端をビブラートムのスライスプレートに取り付けます。迅速かつ慎重に冷蔵酸素解剖液を含むスライス室に置きます。
注: この手順は上記の手順に代わるものであり、個別に実行する必要があります。 - ブレード角度を90°にします。ビブラートメパラメータを0.05 mm/sの速度、1.20 mm の振幅、および 400 μm のスライス厚さに設定します。
- 付属の海馬をビブラームでスライスします。
注:良好な縦方向のCA1海馬脳スライスは、CA1の1層と歯状のジャイルの2層を持つことになります。最大2つの良い海馬のスライスが得られます。あるいは、横の海馬脳スライスは、歯状のジャイル、CA3およびCA1領域をそのまま持つことになります。 - ピペットでビブラートから縦海馬の脳スライスを転送し、水浴中の脳スライス保持室でそれをインキュベートします。
- 水浴中のスライスを32°Cの温度で20分間インキュベートし、30分間の回復のために室温に引き出します。
注:または、水浴から出るときに脳スライスを移し、30分間の回復のために32°Cの温度で流れる酸素化ACSFと記録室に穏やかに置きます。 - 水浴中にインキュベートしながら、ACSF溶液の400 mLを別のフラスコに注ぎ、酸素化(95%O2/5%CO2)を約20〜30分間注入してから、脳スライスを記録室に移します。ACSFを2 mL/minの速度で記録室内に連続的にスーパーフリュースします。
- 温度コントローラをオンにして、流れるACSFを32°Cに加熱します。
- 残りの1.6L溶液を4°Cの冷蔵庫に保管します。真菌の成長を避けるために使用しない場合は、廃棄する必要がある1週間まで溶液を維持します。
- インビトロ録音
- 必要なすべてのハードウェアをオンにして、記録リグを設定します。
- スライス保持室から記録室に脳スライスを転送します。鈍い鉗子で脳のスライスの位置を調整し、ハープで所定の位置に保持します。ACSF を少なくとも 20 分間実行できるようにします。これにより、記録前に脳のスライスが安定します。
- 内部ソリューションとして ACSF を記録ピペットに塗りつぶします。
- 指定されたソフトウェアで録音ピペット抵抗を確認してください。記録ピペット抵抗は3-5 MΩの範囲内でなければなりません。
- データ取得用のソフトウェアをオンにします。このソフトウェアは、前に示したインビボ記録と同様の方法でデータ集録を可能にする同様の機能を持っている必要があります。
- 記録と刺激電極を立体器ホルダーにしっかりと固定します。基準電極をACSF内の記録室内に置く。
- 縦方向のスライスの場合は、層オリエンス(S.O.)に刺激と記録電極を配置します。電極間の距離を約 300 ~ 500 μm に保つ. 刺激電極を脳スライスの中隔側または時間側に配置し、同じ層から記録します (図8)。
- あるいは、刺激および記録電極を地層放射(S.R.)に配置する。刺激電極を脳スライスの中隔側または側側に配置します。
- コントロールとしての横方向スライスの場合は、刺激電極をCA3(シャファー担保経路)領域に配置し、CA1領域上の記録電極を配置します(図9)。
注: これは代替制御ステップであり、別の実験で実行する必要があります。 - 絶縁された刺激発生器をオンにし、刺激を与えます(100 μsの持続時間、30秒間隔で繰り返します)。記録電極の深さおよび/または位置を安定して誘発された興奮性ポストシナプス電位が観察されるまで調整する。
- 刺激強度を変化させることによって、安定したfEPSPが引き起こされたことを確認します。fEPSPの傾きの顕著な変化は、刺激強度の変化のたびに観察されるべきである。これは、入力出力曲線と呼ばれる。入力出力 (I-O) カーブを作成して、FEPSP の勾配がこれ以上増加しない最大刺激強度を検出します (図6)。
注:実験中に繊維ボレーが消失した場合は、データを破棄し、電極の位置を変更します。 - 入力出力曲線を使用して、ベースライン記録の刺激強度を設定し、高周波刺激(HFS)または破傷風を最大呼び起こし fEPSP の 30 ~ 40% に呼び出します。
- または、LTD に関する実験では、入力出力曲線を使用してベースライン記録のベースライン強度を設定し、低周波刺激(LFS)を最大呼び出した fEPSP の最大値の 70% に呼び出します。
- ローカル・フィールド・ポテンシャルを20~30分のベースラインとして記録します。
- LTPを誘導するために30秒間隔で100 HzパルスのHFSを2回適用します。
- あるいは、LTD実験では、5Hz(3分間に900刺激)または1Hz LFS(15分間に900刺激)または1Hz対パルス(50ミリ秒対パルス間隔、15分間に900組の刺激)の低周波刺激を適用し、すでにLTDに従ってLTDを誘導する。確立されたプロトコル。
- HFS または LFS の後に 1 時間のローカル・フィールド・ポテンシャルを記録します。
- データをエクスポートして分析します。
結果
我々は、生体内とインビトロの両方の細胞外記録を用いて海馬の縦CA1ピラミッド型ニューロンの長期シナプス可塑性を調べた。LTPおよびLTDは、海馬の横軸において一方向であることが実証されている長期シナプス可塑性のファセットである。
ここでは、縦方向海馬脳スライスを用いて、海馬のCA1縦軸にLTPがあることを示した。横のスライスに対して垂直である中立軸に沿って海馬の縦方向のスライスを調製した(図1)。海馬のCA1領域からの記録を用いて、方向特異的ではないLTPの存在を示した。縦海馬脳スライスの中隔または時間(図2)側からの記録には統計的に有意な差はなかった。我々はまた、層固有ではないLTPの存在を示した。したがって、両層ラジエータムと地層オリエンス(図2)からの記録は、縦方向の脳スライスにおけるLTPの誘導に成功したことを示した。NMDARアンタゴニストであるD-AP5を用いて、誘導されたLTPがNMDA受容体に依存していることを実証した(図3)。インビトロで起こることは必ずしも生体内条件に反映されないため、生体内でLTPを調べた。図 4aは、生体内のCA1領域の縦軸に沿って後部海馬に位置する刺激および記録電極の概略図を示す。記録および刺激に使用する電極の位置を病変痕および結晶紫色染色によって確認した(図4a)。縦方向のCA1領域における生体内におけるLTPの存在を実証した(図4b)。
LTDを誘導するために既に確立されたプロトコルを使用して、我々は正常にインビボとインビトロの両方でLTDを誘導することができなかった(図5)。

図 1.横および縦方向の海馬脳スライスの概略図。この図は、Sun et al. 201821から適応および変更されています。この図のより大きなバージョンを表示するには、ここをクリックしてください。
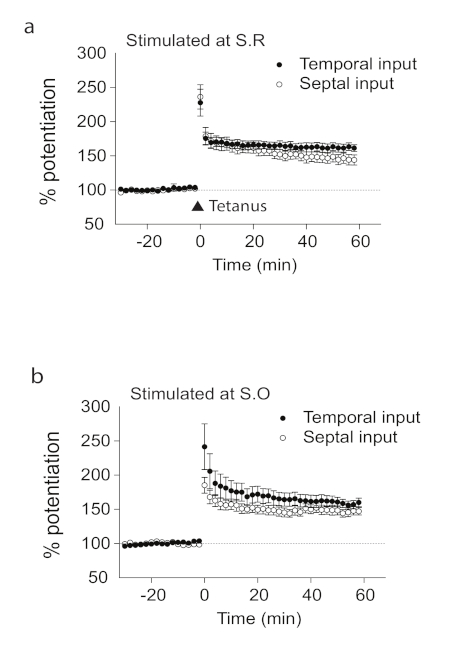
図 2.縦方向のスライスの LTP。縦方向のスライスにおけるS.R.(a)またはS.O.(b)におけるシナプス応答は、時間的および中隔入力(S.R./時間的(n =12、c)、S.R./中隔(n=12、c)、S.O./テンポラル(n.O./テンポラル)の両方で破傷風刺激の直後に増強される。9、d)。
n はスライスの数を表します。誤差余数は SE を表します。この図は、Sun et al. 201821から適応および変更されています。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図 3.縦方向スライスの NMDAR 依存 LTP。(a,b)時間方向および中隔方向におけるLTP誘導は、50 μM D-AP5(時間、n=6、a)(中隔、n=5、b)によってブロックされる。(c,d)時間方向および中隔方向のLTP誘導もD-AP5によってブロックされる。n はスライスを表します。誤差余数は SE を表します。この図は、Sun et al. 201821から適応および変更されています。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図 4.インターラメラネットワークにおける生体内LTP。(a) 麻酔動物における記録および刺激電極の概略図。記録(CA1の中隔側)および刺激電極(CA1の側側)の遺伝子座は、病変マークによって同定された。(b)LTPは、100Hz高周波刺激(HFS)(n=10マウス)によって中間ラメラ接続で誘導される。カラートレース:HFSの前(黒)と後(赤)。誤差余数は SE を表します。この図は、Sun et al. 201821から適応および変更されています。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図 5.インターラメラCA1ネットワークにおけるインビボおよびインビトロLTDの不在。(a) 1 Hz-pp LFS は、vivo LTD. (b) 1 Hz pp-LTP, (c) 5 Hz LFS, および (d) 1 Hz LFS は、縦方向の脳スライスの側側または中隔側のいずれにも LTD を生成しません。LTDは、横スライスで1 Hz pp-LFSによって誘導されます:一時的(n = 8)、中隔(n = 11)および横(n = 6)と1 Hz pp-LFSを有する。5 Hz LFS を持つ時間 (n = 3) と中隔 (n = 3)1 Hz LFS を持つ時間 (n = 3) と中隔 (n = 3) です。n はスライスを表します。誤差余数は SE を表します。この図は、Sun et al. 201821から適応および変更されています。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図 6.海馬脳スライスにおける刺激入力の増加に応じてfEPSP傾斜を示す入力出力曲線。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図 7.体外脳スライス中の海馬分離に使用される外科用ツール。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図 8.記録の準備ができて縦方向の脳のスライス。刺激電極および記録ピペットは、層放射体に挿入される。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図 9.録音の準備ができて横断海馬の脳のスライス。刺激電極はシャッファー担保CA3領域に挿入され、記録ピペットはCA1領域に挿入される。この図のより大きなバージョンを表示するには、ここをクリックしてください。
| 化合 物 | スライスソリューション(mM) | ACSF (mM) |
| CaCl2.2H2O | 0.5 | 2 |
| グルコース | 25 | 25 |
| Kcl | 2.5 | 2.5 |
| MgCl2.6H2O | 7 | 1 |
| 塩化 ナトリウム | 87 | 125 |
| NaH2PO4 | 1.3 | 1.3 |
| ナーコ3 | 25 | 25 |
| ショ糖 | 75 |
表1:脳スライスおよび人工脳脊髄液溶液中の化合物の濃度。
ディスカッション
このプロトコルは、インビトロの海馬の縦方向CA1-CA1軸における脳スライスと同様に、生体内での長期シナプス可塑性を誘導する方法を示す。概要を説明した手順は、実験者が縦方向の海馬CA1-CA1接続でLTPとLTDを調査するのに十分な詳細を与える。フィールドの興奮性の可能性を正常に記録するために必要なスキルを磨くためには、練習が必要です。
練習が必要なだけでなく、良い結果を得るために不可欠な重要な手順がいくつかあります。まず、脳のスライスが作られた角度は、海馬16のCA1-CA1領域におけるピラミッド型ニューロンの縦方向の突起を切り捨てるか、または保存することができることが以前に示された。縦方向のピラミッド型ニューロンは、ほぼ垂直な角度で横ニューロンから投影します。CA1ニューロンが海馬内で多様な角度で伝播するにつれて、それらの間の縦方向の接続は海馬の背筋軸に沿ってレイアウトされます。したがって、インビトロ記録のために、実験者は背部腹部軸に沿って孤立した海馬組織を切断することによって、縦軸に沿ってCA1-CA1海馬ニューロンを正確に標的にすることを念頭に置く必要があります。また、生体内記録では、刺激と記録電極が配置される角度によって、得られた結果が縦軸を表すか、横軸と縦方向軸の両方が混在しているのかが決まります。CRISPR-Cas9を利用したさらなる調査は、CA1およびCA3領域の両方からの応答の混合物である可能性があるため、呼び出された応答がCA1領域からのみであるかどうかを確認するために行うことができる。
第二に、インビトロ実験では、実験者は、脳スライス溶液、ACSF、ワークベンチ、および脳スライスに接触するすべての機器または器具に汚染物質がないことを確認する必要があります。汚染の任意のフォームは、脳のスライスの完全性または死の悪化につながります.きれいな電極表面を維持することは、インビトロとインビボ実験の両方に良好で安定した記録を保証します。
我々は、縦方向海馬CA1ネットワークがNMDAR依存性LtPを示すが、LTDを示さないことを示した。しかし、トリシナプス回路は、LTPとLTD22、23の両方で提示されます。これは、縦方向のCA1ネットワークと三シナプス回路に固有の特徴があることを意味します。私たちのプロトコルは、電気生理学的な記録のみを使用し、したがって、これらの2つのネットワークの違いを見つけるのに制限されています。
統合失調症などの脳疾患の治療法の探求は続いています。CA1海馬サブ領域の減少または変形は、いくつかの統合失調症症状24,25と関連している。我々のプロトコルの適用は、基本的ではあるが、CA1縦海馬サブ領域のユニークなシナプス能力を明るくした。この知識は、海馬の縦方向のCA1軸に沿ってこの衰弱性脳疾患をさらに調査できる実験の設計に有用である。
開示事項
何も開示することはない
謝辞
この研究は仁川国立大学(国際協同組合)研究助成金の支援を受けています。データ収集を手伝ってくださったチョイさんに感謝申し上げます。
資料
| Name | Company | Catalog Number | Comments |
| Atropine Sulphate salt monohydrate, ≥97% (TLC), crystalline | Sigma-Aldrich | 5908-99-6 | Stored in Dessicator |
| Axon Digidata 1550B | |||
| Calcium chloride | Sigma-Aldrich | 10035-04-8 | |
| Clampex 10.7 | |||
| D-(+)-Glucose ≥ 99.5% (GC) | Sigma-Aldrich | 50-99-7 | |
| Eyegel | Dechra | ||
| Isoflurane | RWD Life Sciences | R510-22 | |
| Magnesium chloride hexahydrate, BioXtra, ≥99.0% | Sigma-Aldrich | 7791-18-6 | |
| Matrix electrodes, Tungsten | FHC | 18305 | |
| Multiclamp 700B Amplifier | |||
| Potassium chloride, BioXtra, ≥99.0% | Sigma-Aldrich | 7447-40-7 | |
| Potassium phosphate monobasic anhydrous ≥99% | Sigma-Aldrich | 7778-77-0 | Stored in Dessicator |
| Pump | Longer precision pump Co., Ltd | T-S113&JY10-14 | |
| Silicone oil | Sigma-Aldrich | 63148-62-9 | |
| Sodium Bicarbonate, BioXtra, 99.5-100.5% | Sigma-Aldrich | 144-55-8 | |
| Sodium Chloride, BioXtra, ≥99.5% (AT) | Sigma-Aldrich | 7647-14-5 | |
| Sodium phosphate monobasic, powder | Sigma-Aldrich | 7558-80-7 | |
| Sucrose, ≥ 99.5% (GC) | Sigma-Aldrich | 57-50-1 | |
| Temperature controller | Warner Instruments | TC-324C | |
| Tungsten microelectrodes | FHC | 20843 | |
| Urethane, ≥99% | Sigma-Aldrich | 51-79-6 | |
| Vibratome | Leica | VT-1200S | |
| Water bath | Grant Instruments | SAP12 |
参考文献
- Levy, W. B. A sequence predicting CA3 is a flexible associator that learns and uses context to solve hippocampal-like tasks. Hippocampus. 6 (6), 579-590 (1996).
- Eldridge, L. L., Knowlton, B. J., Furmanski, C. S., Bookheimer, S. Y., Engel, S. A. Remembering episodes: A selective role for the hippocampus during retrieval. Nature Neuroscience. 3 (11), 1149-1152 (2000).
- Sullivan Giovanello, K., Schnyer, D. M., Verfaellie, M. A critical role for the anterior hippocampus in relational memory: evidence from an fMRI study comparing associative and item recognition. Hippocampus. 14 (1), 5-8 (2004).
- Andersen, P., Bland, B., Dudar, J. D. Organization of the hippocampal output. Experimental Brain Research. 17 (2), 152-168 (1973).
- Andersen, P., Bliss, T. V. P., Skrede, K. K. Lamellar organization of hippocampal excitatory pathways. Experimental Brain Research. 13 (2), 222-238 (1971).
- Sloviter, R., Lømo, T. Updating the Lamellar Hypothesis of Hippocampal Organization. Frontiers in Neural Circuits. 6 (102), (2012).
- Ishizuka, N., Weber, J., Amaral, D. G. Organization of intrahippocampal projections originating from CA3 pyramidal cells in the rat. Journal of Comparative Neurology. 295 (4), 580-623 (1990).
- Tamamaki, N., Nojyo, Y. Crossing fiber arrays in the rat hippocampus as demonstrated by three-dimensional reconstruction. Journal of Comparative Neurology. 303 (3), 435-442 (1991).
- Swanson, L., Wyss, J., Cowan, W. An autoradiographic study of the organization of intrahippocampal association pathways in the rat. Journal of Comparative Neurology. 181 (4), 681-715 (1978).
- Rebola, N., Carta, M., Mulle, C. Operation and plasticity of hippocampal CA3 circuits: implications for memory encoding. Nature Reviews Neuroscience. 18 (4), 208(2017).
- Papaleonidopoulos, V., Trompoukis, G., Koutsoumpa, A., Papatheodoropoulos, C. A gradient of frequency-dependent synaptic properties along the longitudinal hippocampal axis. BMC Neuroscience. 18 (1), 79(2017).
- Hampson, R. E., Simeral, J. D., Deadwyler, S. A. Distribution of spatial and nonspatial information in dorsal hippocampus. Nature. 402, 610(1999).
- Umeoka, S. C., Lüders, H. O., Turnbull, J. P., Koubeissi, M. Z., Maciunas, R. J. Requirement of longitudinal synchrony of epileptiform discharges in the hippocampus for seizure generation: a pilot study. Journal of Neurosurgery. 116 (3), 513-524 (2012).
- Fanselow, M. S., Dong, H. W. Are the dorsal and ventral hippocampus functionally distinct structures. Neuron. 65, (2010).
- Milior, G., et al. Electrophysiological properties of CA1 pyramidal neurons along the longitudinal axis of the mouse hippocampus. Scientific Reports. 6, (2016).
- Yang, S., et al. Interlamellar CA1 network in the hippocampus. Proceedings of the National Academy of Sciences. 111 (35), 12919-12924 (2014).
- Tsien, J. Z., Huerta, P. T., Tonegawa, S. The Essential Role of Hippocampal CA1 NMDA Receptor–Dependent Synaptic Plasticity in Spatial Memory. Cell. 87 (7), 1327-1338 (1996).
- Bliss, T., Collingridge, G. A synaptic model of memory: long-term potentiation in the hippocampus. Nature. 361, 31-39 (1993).
- Roman, F., Staubli, U., Lynch, G. Evidence for synaptic potentiation in a cortical network during learning. Brain Research. 418 (2), 221-226 (1987).
- McNaughton, B., Barnes, C., Rao, G., Baldwin, J., Rasmussen, M. Long-term enhancement of hippocampal synaptic transmission and the acquisition of spatial information. Journal of Neuroscience. 6 (2), 563-571 (1986).
- Sun, D. -g, et al. Long term potentiation, but not depression, in interlamellar hippocampus CA1. Scientific Reports. 8 (1), 5187(2018).
- Stepan, J., Dine, J., Eder, M. Functional optical probing of the hippocampal trisynaptic circuit in vitro: network dynamics, filter properties, and polysynaptic induction of CA1 LTP. Frontiers in Neuroscience. 9, 160(2015).
- Milner, A. J., Cummings, D. M., Spencer, J. P., Murphy, K. P. Bi-directional plasticity and age-dependent long-term depression at mouse CA3-CA1 hippocampal synapses. Neuroscience Letters. 367 (1), 1-5 (2004).
- Bogerts, B., et al. Hippocampal CA1 deformity is related to symptom severity and antipsychotic dosage in schizophrenia. Brain. 136 (3), 804-814 (2013).
- Ho, N. F., et al. Progressive Decline in Hippocampal CA1 Volume in Individuals at Ultra-High-Risk for Psychosis Who Do Not Remit: Findings from the Longitudinal Youth at Risk Study. Neuropsychopharmacology. 42, 1361(2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved