Method Article
Untersuchung der langfristigen synaptischen Plastizität im Interlamellar Hippocampus CA1 durch elektrophysiologische Feldaufzeichnung
In diesem Artikel
Zusammenfassung
Wir verwendeten Aufnahme- und Stimulationselektroden in Längs-Hippocampus-Gehirnscheiben und längs positionierten Aufnahme- und Stimulationselektroden im dorsalen Hippocampus in vivo, um extrazelluläre postsynaptische Potenziale zu evozieren und langfristige synaptische Plastizität entlang des Längsinterlamellars CA1.
Zusammenfassung
Die Untersuchung der synaptischen Plastizität im Hippocampus konzentrierte sich auf die Nutzung des CA3-CA1-Lamellarers. Weniger Aufmerksamkeit wurde dem Längsinterlamellar-Netzwerk CA1-CA1 gewidmet. Kürzlich wurde jedoch eine Assoziation zwischen CA1-CA1 Pyramidenneuronen gezeigt. Daher muss untersucht werden, ob das Längsinterlamellar-Netzwerk CA1-CA1 des Hippocampus die synaptische Plastizität unterstützt.
Wir haben ein Protokoll entwickelt, um das Vorhandensein oder Fehlen einer langfristigen synaptischen Plastizität im interlamellalaren Hippocampus-CA1-Netzwerk unter Verwendung elektrophysiologischer Feldaufzeichnungen sowohl in vivo als auch in vitro zu untersuchen. Für in vivo extrazelluläre Feldaufnahmen wurden die Aufnahme- und Stimulationselektroden in einer septal-zeitlichen Achse des dorsalen Hippocampus in einem Längswinkel platziert, um felderregende postsynaptische Potenziale zu evozieren. Für extrazelluläre In-vitro-Feldaufzeichnungen wurden hippocampale Längsschnitte parallel zur septal-temporalen Ebene geschnitten. Aufnahme- und Stimulationselektroden wurden in den Schichtenorien (S.O) und der Schicht radiatum (S.R) des Hippocampus entlang der Längsachse platziert. Dies ermöglichte es uns, die Richtungs- und Schichtspezifität evozierter exzitatorischer postsynaptischer Potenziale zu untersuchen. Bereits etablierte Protokolle wurden verwendet, um Langzeitpotenzierung (LTP) und Langzeitdepression (LTD) sowohl in vivo als auch in vitro zu induzieren. Unsere Ergebnisse zeigten, dass das Längsinterlamellar-CA1-Netzwerk N-Methyl-D-Aspartat (NMDA)-Rezeptor-abhängige Langzeitpotenzierung (LTP) ohne Richtungs- oder Schichtspezifität unterstützt. Das Interlamellar-Netz hatte jedoch im Gegensatz zum transversalen Lamellennetz keine signifikante Langzeitdepression (LTD).
Einleitung
Der Hippocampus wurde in kognitiven Studien weit verbreitet1,2,3. Das Hippocampus-Lamellellennetz in der Querachse bildet die trisynaptische Schaltung, die aus den Dentate-Gyrus-, CA3- und CA1-Regionen besteht. Das Lamellennetz gilt als parallele und unabhängige Einheit4,5. Dieser lamellare Blickwinkel hat die Verwendung von Querausrichtung und Querscheiben sowohl für in vivo- als auch für in vitro elektrophysiologische Studien des Hippocampus beeinflusst. Angesichts aufkommender Forschungen wird die Lamell-Hypothese neu bewertet6 und auch das interlamellare Netzwerk des Hippocampus. In Bezug auf das hippocampale Interlamellar-Netzwerk wurde die CA3-Region seit langem untersucht7,8,9,10, aber die Längs-CA1-Hippocampus-Region hat bis vor kurzem relativ wenig Aufmerksamkeit. In Bezug auf das CA1-Interlamellar-Netzwerk haben sich die kurzfristigen synaptischen Eigenschaften entlang der dorsoventralen Längs-Hippocampus-Achse von Ratten als varial11erwiesen. Auch, Cluster von Hippocampus-Zellen, die auf die Phase und den Ort reagieren, wurden gefunden, systematisch entlang der Längsachse des Hippocampus bei Ratten angeordnet werden, unterziehen eine kurzfristige Gedächtnisaufgabe12. Auch, epileptische Anfallsaktivitäten wurden gefunden, um entlang des gesamten Hippocampus entlang der Längsachse13synchronisiert werden.
Die meisten Studien der Längs-CA1-Hippocampus-Region haben jedoch Input aus dem CA3 in die CA1-Regionen11,14,15verwendet. Mit einem einzigartigen Protokoll, um Längsschnitte im Gehirn herzustellen, demonstrierte unsere vorherige Arbeit die Assoziationskonnektivität von CA1-Pyramidenneuronen entlang der Längsachse und implizierte ihre Fähigkeit, neuronale Signalisierung effektiv zu verarbeiten16. Es muss jedoch festgestellt werden, ob die CA1-Pyramidenneuronen entlang der Längsachse ohne Quereingaben eine langfristige synaptische Plastizität unterstützen können. Dieser Befund kann einen weiteren Blickwinkel auf Untersuchungen zu neurologischen Fragen im Zusammenhang mit dem Hippocampus hinzufügen.
Die Fähigkeit der Neuronen, die Wirksamkeit des Informationstransfers anzupassen, wird als synaptische Plastizität bezeichnet. Synaptische Plastizität ist als zugrunde liegender Mechanismus für kognitive Prozesse wie Lernen und Gedächtnis17,18,19,20beteiligt. Langfristige synaptische Plastizität wird entweder als langfristige Potenzierung (LTP) nachgewiesen, die die Stärkung der neuronalen Reaktion darstellt, oder als Langzeitdepression (LTD), die die Schwächung der neuronalen Reaktion darstellt. Die langfristige synaptische Plastizität wurde in der Querachse des Hippocampus untersucht. Dies ist jedoch die erste Studie, die langfristige synaptische Plastizität in der hippocampalen Längsachse von CA1-Pyramidenneuronen zeigt.
Aufbauend auf einem Protokoll, das von Yang et al.16verwendet wurde, haben wir das Protokoll entworfen, um LTP und LTD in der hippocampalen Längsachse von CA1-Pyramidenneuronen zu demonstrieren. Wir verwendeten C57BL6 männliche Mäuse im Alter zwischen 5-9 Wochen für In-vitro-Experimente und 6-12 Wochen alt für In-vivo-Experimente. Dieser ausführliche Artikel zeigt, wie Längsschnitte des Hippocampus von Mäusen für In-vitro-Aufnahmen gewonnen wurden und wie In-vivo-Aufnahmen in der Längsachse aufgezeichnet wurden. Für In-vitro-Aufnahmen untersuchten wir die Richtungsspezifität der längsigen CA1-Synaptischen Plastizität, indem wir das septale und zeitliche Ende des Hippocampus ins Visier nahmen. Wir untersuchten auch die Schichtspezifität der längsigen SYNaptischen Plastizität CA1, indem wir aus den Schichtenorien und stratum radiatum des Hippocampus aufzeichneten. Für In-vivo-Aufnahmen untersuchten wir die Winkel, die am besten der Längsrichtung des Hippocampus entsprechen.
Anhand von in vivo- und in vitro extrazellulären Feldaufzeichnungen beobachteten wir, dass die längs verbundenen CA1-Pyramidenneuronen mit LTP und nicht mit LTD. Die Querausrichtung, an der sowohl CA3- als auch CA1-Neuronen beteiligt sind, unterstützt jedoch sowohl LTP als auch LTD. Die Unterscheidung in den synaptischen Fähigkeiten zwischen der Quer- und der Längsausrichtung des Hippocampus könnte spekulativ Unterschiede in ihrer funktionellen Konnektivität bedeuten. Weitere Experimente sind notwendig, um die Unterschiede in ihren synaptischen Fähigkeiten zu entschlüsseln.
Protokoll
Alle Tiere wurden in Übereinstimmung mit den Richtlinien und Vorschriften der Tierpflege und Verwendung des Labors des National Institute of Health behandelt. Alle hier beschriebenen Methoden wurden vom Institutional Animal Care and Use Committee (IACUC) der City University of Hong Kong und der Incheon National University genehmigt.
1. In-vivo-Feldaufzeichnung
- Tierzubereitung
- Injizieren Sie Urethan (0,06 g pro 25 g Gewicht) intraperitoneal zur Anästhesisierung der Maus. Ergänzung mit intramuskulärer Injektion von Atropin (0,05 mg/kg). Halten Sie die Maus an einem dunklen ruhigen Fleck, bis die Vollanästhesie wirksam wird.
VORSICHT: Urethan hat ein krebserregendes Potenzial. Behandeln Sie es mit Sorgfalt und tragen Sie Schutzkleidung, um kontaktieren mit exponierter Haut zu vermeiden.
HINWEIS: Alternativ kann Isofluran als Anästhesie verwendet werden. - Überprüfen Sie die Tiefe der Anästhesie zeitweise, bis eine vollständige chirurgische Ebene der Anästhesie wirksam wird. Überprüfen Sie die Tiefe der Anästhesie, indem Sie Zehenkneifen, Ohrzange, Schwanzkneifen und Hornhaut-Touch-Tests durchführen, um die Reaktion der Maus auf körperliche Reize zu beobachten.
HINWEIS: Ein Reflex oder eine freiwillige Bewegung sollte nicht beobachtet werden, wenn sich die Maus auf einer vollständigen chirurgischen Ebene der Anästhesie befindet. - Für den Zehen-Pinch-Test, verlängern Sie entweder das Hinter- oder Vorderbein der Maus und kneifen Sie fest mit einem Paar stumpfer Zange oder Finger. Die Maus ist nicht für Vollanästhesie bestätigt, wenn sie das Bein zurückzieht oder den Körper schüttelt, eine beobachtbare erhöhte Atemfrequenz hat oder Stimmgeräusche macht.
- Für den Ohr-Pinch-Test die Enden der Pinna mit einem Paar stumpfer Zange oder Finger fest kneifen. Eine Vollanästhesie wird nicht bestätigt, wenn die Maus die Schnurrhaare nach vorne bewegt, den Kopf schüttelt, Stimmgeräusche macht oder eine beobachtbare erhöhte Atemfrequenz hat.
- Halten Sie den Schwanz der Maus für den Schwanz der Maus sanft und fest mit einem stumpfen Kraft- oder Finger eingeklemmt. Keine Schwanzbewegung, Stimmton oder beobachtete Erhöhung der Atemfrequenz sollte beobachtet werden, wenn vollständig für chirurgische Verfahren beästheisiert.
- Für den Hornhaut-Touch-Test, berühren Sie die Hornhaut der Maus sanft, mit einem Baumwolldocht. Bei vollständiger Beägung zur Operation sollte keine Augenlidbewegung, Schnurrbartbewegung oder beobachtbare Erhöhung der Atemfrequenz beobachtet werden.
- Rasieren Sie die Haare auf den Hals und Schädel der Maus.
- Legen Sie die voll beeinte Maus auf ein Auf 37 °C eingestelltes Heizpad und legen Sie die rektale Temperatursonde in das Rektum ein. Dadurch kann sich die vom Heizkissen erzeugte Wärme als Reaktion auf Veränderungen der Körpertemperatur der Maus anpassen.
- Tragen Sie Augengel auf, um die Augen der Maus zu befeuchten.
- Ziehen Sie die Zunge vorsichtig mit Zangen zur Seite der Lippen heraus und fixieren Sie die beiden Vorderzähne in das zweite oder dritte Zahnloch des stereotaktischen Instruments. Fixieren Sie den Schädel der Maus fest mit der Augenklemme.
HINWEIS: Alternativ kann eine stereotaktische Ohrklemme verwendet werden. - Unter dem Mikroskop beobachten, trennen Sie das Subkutangewebe und die Muskeln am Ende des interparietalen und okzipitalen Knochens der Maus mit einem Skalpell, um die Zisterne magna freizulegen. Die Dura mater mit einem Wattestäbchen trocknen lassen.
- Die Zisterne magna sanft durchstechen, indem Sie einen flachen Schnitt mit einer scharfen spitzen Skalpellklinge machen, um die Zerebrospinalflüssigkeit (CSF) zu entwässern. Befestigen Sie einen Wattestäbchen, um das GFK weiter zu entleeren.
- Injizieren Sie Urethan (0,06 g pro 25 g Gewicht) intraperitoneal zur Anästhesisierung der Maus. Ergänzung mit intramuskulärer Injektion von Atropin (0,05 mg/kg). Halten Sie die Maus an einem dunklen ruhigen Fleck, bis die Vollanästhesie wirksam wird.
- Kraniotomie
- Halten Sie die Haut auf der Kopfhaut mit Zange, schneiden und entfernen Sie die Haut mit einer chirurgischen Schere. Schneiden Sie genug Haut, um die Bregma und Lambda-Markierungen auf der Kopfhaut zu belichten. Halten Sie die exponierte Region trocken.
- Passen Sie den geklemmten Schädel der Maus an, damit die Bregma- und Lambdapunkte in einer horizontalen Ebene ähnlicher Höhe ausgerichtet werden können. Vermeiden Sie das Kippen des Kopfes in der vorderen-hinteren Position oder in der medialen Seitenposition.
- Markieren Sie die Punkte, die der Hippocampusregion entsprechen, mit Hilfe eines Vernier-Sattels. Verwenden Sie das Maushirn in einem stereotaktischen Koordinatenbuch als Referenz, um die genauen Koordinaten zu bestimmen.
ANMERKUNG: Die Position, die für den Einschnitt für den Hippocampus markiert werden soll, ist 1 mm x 3 mm auf der Mittellinie, die als vorder-posterior (AP) bezeichnet wird, unter Verwendung des Bregmas als Bezugspunkt, und 3 mm x 3 mm senkrecht zur Mittellinie (ML), um die Punkte auf der Mittellinie zu verbinden. Die stereotaktischen Koordinaten werden als angegeben (AP: 1,3 und ML: 3,3). - Machen Sie einen Schnitt im Schädel über der dorsalen Region des Hippocampus entlang der markierten Punkte mit einem Skalpell oder Hochgeschwindigkeitsbohrer unter dem Mikroskop beobachten.
HINWEIS: Nach dem Einschnitt sollte eine rechteckige Öffnung mit einer Größe von 2 mm x 3 mm erhalten werden. Halten Sie den exponierten Bereich sauber, um Verletzungen des Gehirns zu vermeiden. - Nehmen Sie vorsichtig den lockeren Schädel mit Zangen heraus, um die Dura mater freizulegen, und verwenden Sie eine Spritze oder einen Tredas, um die physiologische Salzlösung sanft anzuwenden, um die Oberfläche feucht zu halten.
- Entfernen Sie die Dura mater vorsichtig mit Nadel oder scharf spitze Spitze Zange.
HINWEIS: Achten Sie darauf, während der Kraniotomie keine Schäden am Hirngewebe zu verursachen. Dies führt zur Schwellung des Gehirns und wirkt sich auf die Ergebnisse aus. - Halten Sie das exponierte Hirngewebe feucht, indem Sie physiologische Kochsalz- oder Inertöl mit einem Trsetzer oder einer Spritze auftragen.
- In-vivo-Aufnahme
- Fixieren und positionieren Sie die Stimulations- und Aufnahmeelektrode fest im stereotaktischen Halter. Passen Sie das stereotaktische Instrument entsprechend der Position der entsprechenden AP- und ML-Koordinaten für die Stimulation und Aufzeichnung von Elektroden über dem ca1 dorsalen Hippocampus an.
HINWEIS: Verwenden Sie das Maushirn in stereotaktischen Koordinaten als Leitfaden bei der Suche nach den Koordinaten für die dorsale Längs-CA1-Hippocampus-Region. Beispielsweise wird eine stereotaktische Koordinate für die CA1-Hippocampusregion (AP 1.5, ML 1.0) für die Aufnahmeelektrode und (AP 1.7, ML 1.5) für die Stimulationselektrode sein. - Lokalisieren Sie die stimulierende Elektrode seitlich zur Aufnahmeelektrode in Längsrichtung.
HINWEIS: Stellen Sie sicher, dass sowohl Stimulations- als auch Aufzeichnungselektroden vor dem Gebrauch sauber sind. Dies verhindert das Einbringen von Rauschen bei der Aufnahme. - Verwenden Sie für Aufnahmen Mehrkanalelektroden. Suchen Sie zunächst die stereotaktischen Koordinaten für die Hippocampusregion CA1 mithilfe des ersten Kanals. Positionieren Sie die verbleibenden Elektroden so, dass der Stimulationswinkel und die Aufnahmeelektroden im Bereich von 30° bis 60° im Verhältnis zur Mittellinie vom Bregmapunkt entfernt liegen.
HINWEIS: Dieser Winkel entspricht der Längsausrichtung der Hippocampusregion CA1. - Als Steuerung können Sie die Aufnahmeelektrode oberhalb des CA1-Bereichs und die Stimulationselektrode über dem CA3-Bereich des dorsalen Hippocampus lokalisieren. Zum Beispiel wird die Verwendung des Maushirns in stereotaktischen Koordinaten als Leitfaden eine stereotaktische Koordinate für die Hippocampusregion CA1-CA3 (AP 1.8, ML 1.0) für die Aufnahmeelektrode und (AP 1.5, ML 1.5) für die Stimulationselektrode sein.
HINWEIS: Dieser Schritt ist eine alternative Steuerung und sollte in einem separaten Experiment durchgeführt werden. - Platzieren Sie die Referenzelektrode an einem distalen Teil der exponierten Hirnregion oder unter die Haut der Maus.
- Schalten Sie das Aufzeichnungssystem ein.
- Öffnen Sie die Software für die Aufzeichnung und Datenerfassung.
HINWEIS: Verschiedene Laboratorien haben ihre bevorzugte Software für die Aufzeichnung und Datenerfassung. - Unter dem Mikroskop beobachten, senken Sie die Aufnahme- und Stimulationselektroden langsam mit dem Mikromanipulator, bis er nur die Oberfläche des Gehirns berührt. Markieren Sie den Punkt als Nullpunkt, um mit der Berechnung der genauen Tiefe der Hippocampusregion zu beginnen.
HINWEIS: Der Mikromanipulator kann verwendet werden, um die Tiefe zu überwachen, in der die Elektrode zu einem bestimmten Zeitpunkt eingesetzt wird. Beobachten Sie eine Erhöhung der Impedanz, wenn die Elektrode die Gehirnoberfläche berührt. - Senken Sie die Elektroden langsam auf die ungefähre Tiefe, die den gewählten stereotaktischen Koordinaten für CA1 Hippocampus entspricht.
HINWEIS: Verwenden Sie das Maushirn in stereotaktischen Koordinaten als Leitfaden, um die ungefähre Tiefe zu erhalten, die den gewählten stereotaktischen Koordinaten entspricht. - Geben Sie Stimulation (100 s Dauer, in 30 s Intervallen wiederholt) und stellen Sie die Elektrodentiefe in Schritten von 50 m oder weniger ein, bis ein stabiles evozitationsfreies postsynaptisches Potential (fEPSP) beobachtet wird.
ANMERKUNG: Ein Stimulus von 20 A reicht in der Regel aus, um eine beobachtbare Reaktion zu evozieren. - Stellen Sie sicher, dass ein stabiles fEPSP durch Variation der Stimulusintensität evoziert wurde. Bei jeder erhöhten Stimulusintensität ist eine deutliche Erhöhung der Steigung oder Amplitude des fEPSP zu beobachten. Dies wird als Eingabe-Output-Kurve bezeichnet. Erstellen Sie eine Input-Output-Kurve (I-O), um die maximale Stimulusintensität zu erkennen, bei der die Steigung des evozierten fEPSP nicht mehr erhöht wird (Abbildung 6).
HINWEIS: Verwerfen Sie Daten und ändern Sie die Elektrodenposition, wenn der Faservolley während des Experiments verschwindet. - Verwenden Sie die Eingabe-Output-Kurve, um die Basisintensität auf 40 - 50 % des Maximums festzulegen. Verwenden Sie die entsprechende Stimulusintensität für die Basisaufzeichnung.
- Zeichnen Sie das lokale Feldpotenzial als Basisfür 20 - 30 min auf.
- Verwenden Sie dieselbe Input-Output-Kurve, um die Stimulusintensität für die Evokierung von Hochfrequenzstimulation (HFS) oder Tetanus auf 75 % der maximalen Intensität einzustellen. Alternativ können Sie bei der Induktion einer Langzeitdepression die gleiche Stimulusintensität beibehalten, die für die Aufzeichnung der Basislinie verwendet wird, wenn sie eine niederfrequente Stimulation (LFS) heraufbeschwört.
- Wenden Sie eine tetanische Stimulation von 100 Hz Impulsen 4 mal mit einem 10 s Intervall an, um LTP zu induzieren.
HINWEIS: Verwenden Sie dieses Protokoll nur, wenn Sie an einem Langzeitpotenzierungsexperiment arbeiten. - Wenden Sie niederfrequente Stimulation von 5 Hz (900 Reize während 3 min), 1 Hz LFS (900 Reize während 15 min) oder 1 Hz paargekoppelten Puls (50 ms gepaartes Pulsintervall, 900 Paare von Reizen während 15 min) an, um LTD nach bereits etablierten Protokollen zu induzieren.
HINWEIS: Verwenden Sie diese Protokolle nur, wenn Sie an einem Langzeit-Depressionsexperiment arbeiten. - Zeichnen Sie das lokale Feldpotenzial für 1 h nach HFS oder AKE auf, alternativ.
- Exportieren Sie Daten und analysieren Sie mit der Software.
- Überprüfen Sie die Position der Aufnahme- und Stimulationselektrode, indem Sie eine Stimulation von 10 A Strom für 30 s geben, um die aufgezeichneten Bereiche zu läsion. Transkardisch durchdringen Sie die Maus mit 4% Paraformaldehyd und ernten das Gehirn zum Schneiden und Färben mit Cresyl Violet nach.
- Euthanisieren Sie Maus durch Zervixdislokation oder Injektion von tödlicher Anästhesie Dosierung nach dem Experiment.
- Fixieren und positionieren Sie die Stimulations- und Aufnahmeelektrode fest im stereotaktischen Halter. Passen Sie das stereotaktische Instrument entsprechend der Position der entsprechenden AP- und ML-Koordinaten für die Stimulation und Aufzeichnung von Elektroden über dem ca1 dorsalen Hippocampus an.
2. In-vitro-Feldaufzeichnung
- Herstellung von sauerstoffhaltigen Schneid- und künstlichen Zerebrospinalflüssigkeitslösungen (ACSF)
- Für 2 L Schneidlösung ca. 1 L doppelt destilliertes Wasser in einen volumetrischen Kolben geben und kräftig auf einer Rührplatte rühren.
- Fügen Sie die folgenden Trennlösungskomponenten (in mM) hinzu: 87,0 NaCl, 2,5 KCl, 1.3 NaH2PO4, 25.0 NaHCO3, 25.0 Glukose, 75.0 Saccharose, 7.0 MgCl2.6H2O und 0.5 CaCl2'2H2O (Tabelle 1).
HINWEIS: Alternativ können mgCl26H2O und CaCl22H2O in dieser Phase ausgeschlossen und später in einem gebrauchsfertigen Volumen hinzugefügt werden. - Auf 2 L mit doppelt destilliertem Wasser unter kräftigem Rühren aufladen.
- Für 2 L ACSF ca. 1 L doppelt destilliertes Wasser in einen volumetrischen Kolben geben und kräftig auf einer Rührplatte rühren.
- Fügen Sie die folgenden ACSF-Lösungskomponenten (in mM) hinzu: 125,0 NaCl, 2,5 KCl, 1.3 NaH2PO4, 25.0 NaHCO3, 25 Glukose, 1.0 MgCl2'6H2O und 2.0 CaCl2'2H2O ' (Tabelle 1).
HINWEIS: Alternativ können MgCl2.6H2O und CaCl22H2O in dieser Phase ausgeschlossen und später in einem gebrauchsfertigen Volume hinzugefügt werden. - Auf 2 L mit doppelt destilliertem Wasser unter kräftigem Rühren aufladen.
- Setup und Gehirnschneiden
- 400 ml bereits vorbereitete Schneidlösung ca. 20 min in einenseparaten Kolben gießen und sauerstoffhaltiges (95% O 2/5% CO2) gießen.
- Den Rest der 1,6-Liter-Lösung in einem 4 °C-Kühlschrank aufbewahren. Halten Sie Lösung bis zu 1 Woche, nach dem es verworfen werden muss, wenn nicht verwendet, um Pilzwachstum zu vermeiden.
- 200 ml der sauerstoffhaltigen Schneidlösung in den Kolben gießen, mit Parafilm abdecken und ca. 20 min in einen Gefrierschrank von -80 °C geben, um einen Schlamm zu machen.
- Die restlichen 200 ml Schneidlösung in eine Hirnscheiben-Haltekammer gießen und in einem 32 °C-Wasserbad mit kontinuierlichem Sprudeln aufbewahren.
- Bereiten Sie die Bank für das Schneiden vor. Legen Sie Papiertücher und chirurgische Werkzeuge auf die Bank. Ordnen Sie die chirurgischen Werkzeuge in der Reihenfolge ihrer Verwendung an, um einen schnellen und effizienten Prozess zu ermöglichen (Abbildung 7).
- Nehmen Sie die gekühlte Schneidlösung aus dem Gefrierschrank und gießen Sie ca. 50 ml in ein Becherglas. Gießen Sie ca. 10 ml in eine Petrischale mit Filterpapier, um sie zu befeuchten. Legen Sie sie auf Eis durch die Sezierfläche.
- Gießen Sie den Rest der geschliffenen Schneidlösung in die Schneidkammer und fixieren Sie sie am Vibratom.
- Anästhetisieren Sie die Maus mit Isoflurane mit Richtlinien und Vorschriften über Tierpflege und Die Verwendung von Labor des National Institute of Health, und die genehmigten Methoden der Institutionellen Tierverwendung und Pflege Ausschuss der City University of Hong Kong und Incheon National universität.
- Enthaupten Sie die anästhesierte Maus mit einer Schere und legen Sie den Kopf auf Tissuepapier. Schneiden Sie die Haut, die den Schädel der Maus bedeckt und schneiden Sie durch die hautförmigen Muskeln mit einer Schere. Schneiden Sie die Schädelplatten entlang der Mittellinie zum Okzipitalknochen mit einer chirurgischen Schere.
- Öffnen Sie den Schädel mit stumpfer Zange, um das Gehirn freizulegen. Das Gehirn vorsichtig mit einem Spachtel aushöhlen und in die gekühlte Schneidlösung in den Becher legen. Warten Sie ca. 30 s.
- Nehmen Sie das Gehirn mit dem Löffel heraus und legen Sie es vorsichtig auf das zuvor befeuchtete Filterpapier in der Petrischale.
- Trennen Sie die beiden Gehirnhälften entlang der Mittellinie mit einer Skalpellklinge. Isolieren Sie den Hippocampus, indem Sie ihn vorsichtig mit einem Spachtel vom Kortex lösen und vorsichtig auf das befeuchtete Filterpapier legen. Schneiden Sie das septale und zeitliche Ende des isolierten Hippocampus mit dem Skalpell aus.
- Nehmen Sie den isolierten Hippocampus mit einem stumpfen Spachtel und Pinsel auf. Den Spachtel vorsichtig auf ein Tissuepapier tupfen, um überschüssiges Wasser zu entfernen.
- Tragen Sie eine kleine Menge Kleber auf die Schneidplatte des Vibratome auf.
- Für eine Längs-CA1-Hippocampusscheibe den CA3-Bereich des Hippocampus mit dem Kleber an der Schneidplatte befestigen. Legen Sie es schnell, aber sorgfältig in die Schneidkammer des Vibratom, das die gekühlte sauerstoffhaltige Schneidlösung enthält.
- Für die Querscheibe, die als Kontrolle dienen wird, befestigen Sie das ventrale Ende des Hippocampus an der Schneidplatte des Vibratom. Schnell, aber sorgfältig in die Schneidkammer mit der gekühlten sauerstoffhaltigen Dissektionslösung legen.
HINWEIS: Dieser Schritt ist eine Alternative zum obigen Schritt und sollte separat ausgeführt werden. - Positionieren Sie den Klingenwinkel auf 90°. Stellen Sie die Vibramme-Parameter auf eine Geschwindigkeit von 0,05 mm/s, eine Amplitude von 1,20 mm und eine Scheibendicke von 400 mm ein.
- Schneiden Sie den beigefügten Hippocampus mit dem Vibratome.
HINWEIS: Eine gute Längs-CA1-Hippocampus-Gehirnscheibe wird eine Schicht CA1 und 2 Schichten Dentat-Gyrus haben. Es können maximal 2 gute Hippocampusscheiben erhalten werden. Alternativ hat eine transversale Hippocampus-Gehirnscheibe die Dentate-Gyrus-, CA3- und CA1-Regionen intakt. - Übertragen Sie die Längs-Hippocampus-Gehirnscheiben aus dem Vibratome mit einer Pipette und inkubieren Sie es in der Gehirnscheibe Haltekammer im Wasserbad.
- Inkubieren Sie Scheiben im Wasserbad für 20 min bei einer Temperatur von 32 °C und bringen Sie auf Raumtemperatur für 30 min erholung.
HINWEIS: Alternativ können Sie die Gehirnscheibe aus dem Wasserbad übertragen und vorsichtig in die Aufnahmekammer mit fließendem sauerstoffhaltigem ACSF bei einer Temperatur von 32 °C für 30 min Erholung legen. - Während der Inkubation im Wasserbad 400 ml ACSF-Lösung in einen separaten Kolben gießenund (95% O 2/5% CO2 ) ca. 20 - 30 min, bevor sie die Hirnscheibe in die Aufnahmekammer überträgt. Den ACSF mit einer Geschwindigkeit von 2 ml/min kontinuierlich in die Aufnahmekammer überziehen.
- Schalten Sie den Temperaturregler ein, um den fließenden ACSF auf 32 °C zu erwärmen.
- Den Rest der 1,6-Liter-Lösung in einem 4 °C-Kühlschrank aufbewahren. Halten Sie die Lösung bis zu einer Woche, nach der sie verworfen werden muss, wenn sie nicht verwendet wird, um Pilzwachstum zu vermeiden.
- In-vitro-Aufzeichnung
- Richten Sie ein Aufnahmegerät ein, indem Sie alle benötigte Hardware einschalten.
- Übertragen Sie die Hirnscheibe aus der Scheibenhaltekammer in die Aufnahmekammer. Stellen Sie die Position der Gehirnscheibe mit stumpfer Zange ein und halten Sie sie mit einer Harfe an Ort und Stelle. Lassen Sie den ACSF mindestens 20 min laufen. Dadurch kann das Gehirnvorscheibe vor der Aufnahme stabil sein.
- Füllen Sie die Aufnahmepipette mit ACSF als interne Lösung.
- Überprüfen Sie den Aufzeichnungspipettenwiderstand mit der dafür vorgesehenen Software. Der Aufnahmepipettenwiderstand sollte im Bereich von 3-5 Mio. % liegen.
- Schalten Sie die Software für die Datenerfassung ein. Diese Software sollte ähnliche Funktionen haben, die die Datenerfassung in ähnlicher Weise ermöglichen wie die zuvor gezeigten In-vivo-Aufnahmen.
- Fixieren Sie die Aufnahme und die Stimulationselektroden fest im stereotaktischen Instrumentenhalter. Legen Sie die Referenzelektrode in die ACSF in der Aufnahmekammer.
- Positionieren Sie bei Längsschnitten die Stimulations- und Aufnahmeelektrode in den Stratum-Oriens (S.O.). Halten Sie den Abstand zwischen den Elektroden auf etwa 300 bis 500 m. Legen Sie die Stimulationselektrode entweder auf die septale oder zeitliche Seite der Gehirnscheibe und nehmen Sie von der gleichen Schicht auf (Abbildung 8).
- Alternativ positionieren Sie die Stimulations- und Aufnahmeelektrode im Stratum radiatum (S.R.). Legen Sie die Stimulationselektrode entweder auf die septale oder zeitliche Seite der Hirnscheibe.
- Positionieren Sie bei Querscheiben als Steuerung die stimulierende Elektrode auf dem CA3-Bereich (Schaffer-Kollateralweg) und die Aufnahmeelektrode im CA1-Bereich (Abbildung 9).
HINWEIS: Dies ist ein alternativer Steuerungsschritt und sollte in einem separaten Experiment durchgeführt werden. - Schalten Sie den isolierten Stimulusgenerator ein und geben Sie Stimulation (100 s Dauer, wiederholt in 30 s Intervallen). Passen Sie die Aufnahmeelektrodentiefe und/oder -position an, bis ein stabiles evozitatorisches postsynaptisches Feldpotential beobachtet wird.
- Stellen Sie sicher, dass ein stabiles fEPSP durch Variation der Stimulusintensität evoziert wurde. Bei jeder Änderung der Stimulusintensität sollte eine bemerkenswerte Veränderung der Steigung des fEPSP beobachtet werden. Dies wird als Eingabe-Output-Kurve bezeichnet. Erstellen Sie eine Input-Output-Kurve (I-O), um die maximale Stimulusintensität zu erkennen, bei der die Steigung des FEPSP nicht mehr zunimmt (Abbildung 6).
HINWEIS: Verwerfen Sie Daten und ändern Sie die Elektrodenposition, wenn der Faservolley während des Experiments verschwindet. - Verwenden Sie die Eingangs-Output-Kurve, um die Stimulusintensität für die Basisaufzeichnung und für die Evokierung von Hochfrequenzstimulation (HFS) oder Tetanus auf 30-40% des maximal evozierten psP einzustellen.
- Alternativ können Sie für Experimente in Bezug auf LTD die Eingangs-Output-Kurve verwenden, um die Ausgangsintensität für die Basisaufzeichnung und für die Herbeigangsstimulation (Low Frequency Stimulation, LFS) auf 70 % des maximal evozierten eEPSP festzulegen.
- Zeichnen Sie das lokale Feldpotenzial als Basisfür 20 - 30 min auf.
- Tragen Sie HFS von 100 Hz-Impulsen zweimal mit einem 30 s Intervall auf, um LTP zu induzieren.
- Alternativ können Sie für LTD-Experimente eine niederfrequente Stimulation von 5 Hz (900 Stimuli während 3 min) oder 1 Hz LFS (900 Stimuli während 15 min) oder 1 Hz paargekoppelten Puls (50 ms gepaartes Pulsintervall, 900 Reizpaare während 15 min) anwenden, um LTD nach bereits etabliertes Protokoll.
- Zeichnen Sie das lokale Feldpotenzial für 1 h nach HFS oder AKE auf.
- Exportieren Sie Daten und analysieren Sie.
Ergebnisse
Wir untersuchten die langfristige synaptische Plastizität von Längs-CA1-Pyramidenneuronen des Hippocampus mit extrazellulären Feldaufzeichnungen sowohl in vivo als auch in vitro. LTP und LTD sind Facetten der langfristigen synaptischen Plastizität, die in der Querachse des Hippocampus als unidirektional nachgewiesen wurden.
Wir haben hier gezeigt, dass es mit Längs-Hippocampus-Gehirnscheiben LTP in der CA1-Längsachse des Hippocampus gibt. Wir bereiteten Längsschnitte des Hippocampus entlang der septotemporalen Achse vor, die senkrecht zu den Querscheiben ist (Abbildung 1). Anhand von Aufnahmen aus der CA1-Region des Hippocampus zeigten wir das Vorhandensein von LTP, das nicht richtungsspezifisch war. Es gab keine statistisch signifikanten Unterschiede in den Aufnahmen von der septalen oder zeitlichen (Abbildung 2) Seite der Längs-Hippocampus-Gehirnscheibe. Wir haben auch das Vorhandensein von LTP gezeigt, das nicht schichtspezifisch war; So zeigten Aufnahmen sowohl aus Stratum radiatum als auch aus Stratum-Oriens (Abbildung 2) erfolgreich induzierte LTP in der Längshirnscheibe. Wir verwendeten D-AP5, einen NMDAR-Antagonisten, um zu zeigen, dass die induzierte LTP von NMDA-Rezeptoren abhängig war (Abbildung 3). Was in vitro geschieht, spiegelt nicht unbedingt in vivo-Bedingungen wider, daher haben wir LTP in vivo untersucht. Abbildung 4 a zeigt ein schematisches Diagramm der Stimulations- und Aufzeichnungselektrode, die im dorsalen Hippocampus entlang der Längsachse des CA1-Bereichs in vivo positioniert ist. Die Position der Elektroden, die für die Aufnahme und Stimulation verwendet wurden, wurde durch Läsionsmarkierungen und kristallviolette Färbung überprüft (Abbildung 4a). Wir haben das Vorhandensein von LTP in vivo in der Längs-CA1-Region demonstriert (Abbildung 4b).
Mit bereits etablierten Protokollen zur Induktion von LTD konnten wir LTD sowohl in vivo als auch in vitro erfolgreich induzieren (Abbildung 5).

Abbildung 1 . Eine schematische Zeichnung von transversalen und längs hippocampalen Gehirnscheiben. Diese Zahl wurde von Sun et al. 201821angepasst und modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
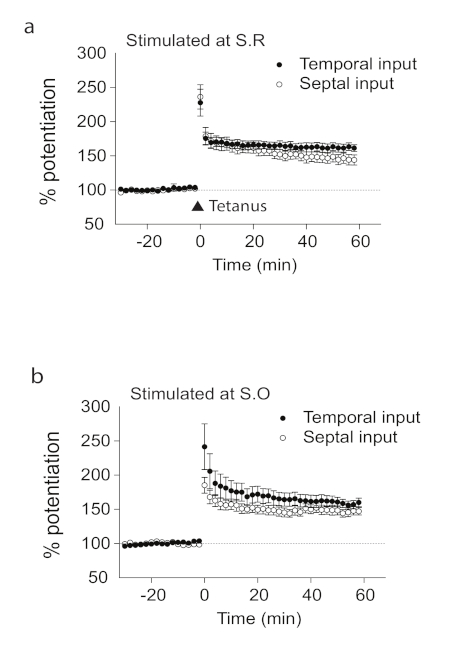
Abbildung 2 . LTP in Längsscheiben. Synaptische Reaktionen bei S.R. (a) oder S.O. (b) in Längsscheiben werden direkt nach Tetanusstimulation mit zeitlichen und septalen Eingängen potenziert (S.R./temporal (n = 12, c), S.R./septal (n = 12, c), S.O./temporal (n = 10, d), S.O./septal (n = 9, d).
Das n steht für die Anzahl der Slices. Fehlerbalken stellen SE dar. Diese Zahl wurde von Sun et al. 201821angepasst und modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3 . NMDAR-abhängige LTP in Längsschnitten. (a,b) Die LTP-Induktion in zeitlicher und septaler Richtung wird durch 50 'M D-AP5 (temporal, n = 6, a) (septal, n = 5, b) blockiert. (c,d) Die LTP-Induktion in zeitlicher und septaler Richtung wird ebenfalls durch D-AP5 blockiert. Das n steht für Scheiben. Fehlerbalken stellen SE dar. Diese Zahl wurde von Sun et al. 201821angepasst und modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4 . In vivo LTP im interlamellar-Netzwerk. (a) Eine schematische Zeichnung von Aufnahme- und Stimulationselektroden bei anästhesierten Tieren. Die Loci der Aufnahme (auf der Septalseite von CA1) und stimulierenden Elektroden (auf der zeitlichen Seite von CA1) wurden durch Läsionsmarkierungen identifiziert. (b) LTP wird in der interlamellen Verbindung durch 100 Hz Hochfrequenzstimulation (HFS) (n = 10 Mäuse) induziert. Farbspuren: vor (schwarz) und nach (rot) HFS. Fehlerbalken stellen SE dar. Diese Zahl wurde von Sun et al. 201821angepasst und modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5 . Fehlen von in vivo und in vitro LTD im Interlamellar CA1 Netzwerk. (a) 1 Hz-pp AKE induzieren nicht in vivo LTD. (b) 1 Hz pp-LTP, (c) 5 Hz LFS und (d) 1 Hz LFS produzieren keine LTD auf den zeitlichen oder septalen Seiten der Längshirnscheibe. während LTD durch 1 Hz pp-LFS in Querscheiben induziert wird: zeitlich (n = 8), septal (n = 11) und quer (n = 6) mit 1 Hz pp-LFS; zeitlich (n = 3) und septal (n = 3) mit 5 Hz AKE; zeitlich (n = 3) und septal (n = 3) mit 1 Hz AKE. Das n steht für Scheiben. Fehlerbalken stellen SE dar. Diese Zahl wurde von Sun et al. 201821angepasst und modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6 . Input-Output-Kurve mit fEPSP-Neigung als Reaktion auf die Erhöhung der Stimulus-Eingabe in Hippocampus-Gehirnscheibe. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7 . Chirurgische Werkzeuge für die Hippocampus-Isolierung während des In-vitro-Gehirnschneidens. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 8 . Eine Längshirnscheibe, die zur Aufnahme bereit ist. Stimulationselektrode und Aufnahmepipette werden in das Stratum radiatum eingesetzt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 9 . Eine transversale Hippocampus-Gehirnscheibe, die zur Aufnahme bereit ist. Stimulationselektrode wird in Schaffer Collateral CA3 Region eingesetzt und Aufzeichnung Pippette wird im CA1-Bereich eingesetzt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| umzäuntes grundstück | Slicing Solution(mM) | ACSF (mM) |
| CaCl2.2H2O | 0.5 | 2 |
| glukose | 25 | 25 |
| Kcl | 2.5 | 2.5 |
| MgCl2.6H2O | 7 | 1 |
| Nacl | 87 | 125 |
| NaH2PO4 | 1.3 | 1.3 |
| NaHCO3 | 25 | 25 |
| sacharose | 75 |
Tabelle 1: Konzentrationen von Verbindungen in Gehirnscheiben und künstlichen Zerebrospinalflüssigkeitslösungen.
Diskussion
Das Protokoll demonstriert die Methode zur Induzieren der langfristigen synaptischen Plastizität in vivo sowie aus Hirnscheiben in der Längsachse CA1-CA1 des Hippocampus in vitro. Die skizzierten Schritte geben genügend Details für einen Experimentator, um LTP und LTD in einer Längs-Hippocampus-CA1-CA1-Verbindung zu untersuchen. Es ist Übung erforderlich, um die Fähigkeiten zu verbessern, die erforderlich sind, um Felderregererfolgreichpotenziale erfolgreich aufzuzeichnen.
Zusätzlich zur Notwendigkeit der Praxis gibt es mehrere wichtige Schritte, die für gute Ergebnisse unerlässlich sind. Zunächst wurde gezeigt, dass der Winkel, in den die Gehirnscheiben gemacht wurden, die Längsprojektionen der pyramidenförmigen Neuronen im CA1-CA1-Bereich des Hippocampus16entweder abschneiden oder erhalten konnte. Die Längspyramiden-Neuronen projizieren aus den transversalen Neuronen in einem Winkel, der fast senkrecht ist. Während sich die CA1-Neuronen in verschiedenen Winkeln innerhalb des Hippocampus ausbreiten, liegt die Längsverbindung zwischen ihnen entlang der dorsoventralen Achse des Hippocampus. Daher muss der Experimentator bei der In-vitro-Aufzeichnung dies im Auge behalten, um die CA1-CA1 Hippocampus-Neuronen entlang der Längsachse genau anzugreifen, indem er das isolierte Hippocampusgewebe entlang der dorsal-ventralen Achse schneidet. Auch bei In-vivo-Aufnahmen bestimmt der Winkel, in dem die Stimulation und die Aufnahmeelektroden positioniert sind, ob die erzielten Ergebnisse repräsentativ für die Längsachse oder eine Mischung aus Quer- und Längsachse sind. Weitere Untersuchungen unter Verwendung von CRISPR-Cas9 können durchgeführt werden, um zu bestätigen, ob die evozierte Antwort ausschließlich aus der CA1-Region stammt, da es sich um eine Mischung von Antworten sowohl aus der CA1- als auch aus der CA3-Region entwickeln könnte.
Zweitens muss der Experimentator bei In-vitro-Experimenten sicherstellen, dass die Gehirnschneidlösung, ACSF, der Arbeitsplatz und alle Geräte oder Instrumente, die mit der Hirnscheibe in Berührung kommen, frei von Verunreinigungen sind. Jede Form der Kontamination führt zur Verschlechterung der Integrität oder zum Tod der Hirnscheibe. Die Aufrechterhaltung einer sauberen Elektrodenoberfläche gewährleistet gute und stabile Aufnahmen für In-vitro- und In-vivo-Experimente.
Wir haben gezeigt, dass das Längs-Hippocamp-Netzwerk CA1 NMDAR-abhängige LTPs aufweist, aber keine LTDs. Die trisynaptische Schaltung präsentiert sich jedoch sowohl mit LTP als auch mit LTD22,23. Dies impliziert, dass das Längs-CA1-Netzwerk und die tri-synaptische Schaltung einzigartige Eigenschaften haben. Unser Protokoll verwendet nur elektrophysiologische Aufnahmen und ist daher bei der Ermittlung des Unterschieds zwischen diesen beiden Netzwerken begrenzt.
Die Suche nach einem Heilmittel für Hirnerkrankungen wie Schizophrenie geht weiter. Rückgang oder Deformität der CA1 Hippocampus Subregionen wurden mit einigen schizophrenen Symptomenverbunden 24,25. Die Anwendung unseres Protokolls, obwohl einfach, hat eine einzigartige synaptische Fähigkeit der CA1 Längs-Hippocampus-Subregion ans Licht gebracht. Dieses Wissen ist nützlich bei der Entwicklung von Experimenten, die diese schwächende Hirnerkrankung entlang der Längsachse CA1 des Hippocampus weiter untersuchen können.
Offenlegungen
Wir haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde vom Incheon National University (International Cooperative) Research Grant unterstützt. Wir danken Frau Gona Choi für die Unterstützung bei der Datenerhebung.
Materialien
| Name | Company | Catalog Number | Comments |
| Atropine Sulphate salt monohydrate, ≥97% (TLC), crystalline | Sigma-Aldrich | 5908-99-6 | Stored in Dessicator |
| Axon Digidata 1550B | |||
| Calcium chloride | Sigma-Aldrich | 10035-04-8 | |
| Clampex 10.7 | |||
| D-(+)-Glucose ≥ 99.5% (GC) | Sigma-Aldrich | 50-99-7 | |
| Eyegel | Dechra | ||
| Isoflurane | RWD Life Sciences | R510-22 | |
| Magnesium chloride hexahydrate, BioXtra, ≥99.0% | Sigma-Aldrich | 7791-18-6 | |
| Matrix electrodes, Tungsten | FHC | 18305 | |
| Multiclamp 700B Amplifier | |||
| Potassium chloride, BioXtra, ≥99.0% | Sigma-Aldrich | 7447-40-7 | |
| Potassium phosphate monobasic anhydrous ≥99% | Sigma-Aldrich | 7778-77-0 | Stored in Dessicator |
| Pump | Longer precision pump Co., Ltd | T-S113&JY10-14 | |
| Silicone oil | Sigma-Aldrich | 63148-62-9 | |
| Sodium Bicarbonate, BioXtra, 99.5-100.5% | Sigma-Aldrich | 144-55-8 | |
| Sodium Chloride, BioXtra, ≥99.5% (AT) | Sigma-Aldrich | 7647-14-5 | |
| Sodium phosphate monobasic, powder | Sigma-Aldrich | 7558-80-7 | |
| Sucrose, ≥ 99.5% (GC) | Sigma-Aldrich | 57-50-1 | |
| Temperature controller | Warner Instruments | TC-324C | |
| Tungsten microelectrodes | FHC | 20843 | |
| Urethane, ≥99% | Sigma-Aldrich | 51-79-6 | |
| Vibratome | Leica | VT-1200S | |
| Water bath | Grant Instruments | SAP12 |
Referenzen
- Levy, W. B. A sequence predicting CA3 is a flexible associator that learns and uses context to solve hippocampal-like tasks. Hippocampus. 6 (6), 579-590 (1996).
- Eldridge, L. L., Knowlton, B. J., Furmanski, C. S., Bookheimer, S. Y., Engel, S. A. Remembering episodes: A selective role for the hippocampus during retrieval. Nature Neuroscience. 3 (11), 1149-1152 (2000).
- Sullivan Giovanello, K., Schnyer, D. M., Verfaellie, M. A critical role for the anterior hippocampus in relational memory: evidence from an fMRI study comparing associative and item recognition. Hippocampus. 14 (1), 5-8 (2004).
- Andersen, P., Bland, B., Dudar, J. D. Organization of the hippocampal output. Experimental Brain Research. 17 (2), 152-168 (1973).
- Andersen, P., Bliss, T. V. P., Skrede, K. K. Lamellar organization of hippocampal excitatory pathways. Experimental Brain Research. 13 (2), 222-238 (1971).
- Sloviter, R., Lømo, T. Updating the Lamellar Hypothesis of Hippocampal Organization. Frontiers in Neural Circuits. 6 (102), (2012).
- Ishizuka, N., Weber, J., Amaral, D. G. Organization of intrahippocampal projections originating from CA3 pyramidal cells in the rat. Journal of Comparative Neurology. 295 (4), 580-623 (1990).
- Tamamaki, N., Nojyo, Y. Crossing fiber arrays in the rat hippocampus as demonstrated by three-dimensional reconstruction. Journal of Comparative Neurology. 303 (3), 435-442 (1991).
- Swanson, L., Wyss, J., Cowan, W. An autoradiographic study of the organization of intrahippocampal association pathways in the rat. Journal of Comparative Neurology. 181 (4), 681-715 (1978).
- Rebola, N., Carta, M., Mulle, C. Operation and plasticity of hippocampal CA3 circuits: implications for memory encoding. Nature Reviews Neuroscience. 18 (4), 208(2017).
- Papaleonidopoulos, V., Trompoukis, G., Koutsoumpa, A., Papatheodoropoulos, C. A gradient of frequency-dependent synaptic properties along the longitudinal hippocampal axis. BMC Neuroscience. 18 (1), 79(2017).
- Hampson, R. E., Simeral, J. D., Deadwyler, S. A. Distribution of spatial and nonspatial information in dorsal hippocampus. Nature. 402, 610(1999).
- Umeoka, S. C., Lüders, H. O., Turnbull, J. P., Koubeissi, M. Z., Maciunas, R. J. Requirement of longitudinal synchrony of epileptiform discharges in the hippocampus for seizure generation: a pilot study. Journal of Neurosurgery. 116 (3), 513-524 (2012).
- Fanselow, M. S., Dong, H. W. Are the dorsal and ventral hippocampus functionally distinct structures. Neuron. 65, (2010).
- Milior, G., et al. Electrophysiological properties of CA1 pyramidal neurons along the longitudinal axis of the mouse hippocampus. Scientific Reports. 6, (2016).
- Yang, S., et al. Interlamellar CA1 network in the hippocampus. Proceedings of the National Academy of Sciences. 111 (35), 12919-12924 (2014).
- Tsien, J. Z., Huerta, P. T., Tonegawa, S. The Essential Role of Hippocampal CA1 NMDA Receptor–Dependent Synaptic Plasticity in Spatial Memory. Cell. 87 (7), 1327-1338 (1996).
- Bliss, T., Collingridge, G. A synaptic model of memory: long-term potentiation in the hippocampus. Nature. 361, 31-39 (1993).
- Roman, F., Staubli, U., Lynch, G. Evidence for synaptic potentiation in a cortical network during learning. Brain Research. 418 (2), 221-226 (1987).
- McNaughton, B., Barnes, C., Rao, G., Baldwin, J., Rasmussen, M. Long-term enhancement of hippocampal synaptic transmission and the acquisition of spatial information. Journal of Neuroscience. 6 (2), 563-571 (1986).
- Sun, D. -g, et al. Long term potentiation, but not depression, in interlamellar hippocampus CA1. Scientific Reports. 8 (1), 5187(2018).
- Stepan, J., Dine, J., Eder, M. Functional optical probing of the hippocampal trisynaptic circuit in vitro: network dynamics, filter properties, and polysynaptic induction of CA1 LTP. Frontiers in Neuroscience. 9, 160(2015).
- Milner, A. J., Cummings, D. M., Spencer, J. P., Murphy, K. P. Bi-directional plasticity and age-dependent long-term depression at mouse CA3-CA1 hippocampal synapses. Neuroscience Letters. 367 (1), 1-5 (2004).
- Bogerts, B., et al. Hippocampal CA1 deformity is related to symptom severity and antipsychotic dosage in schizophrenia. Brain. 136 (3), 804-814 (2013).
- Ho, N. F., et al. Progressive Decline in Hippocampal CA1 Volume in Individuals at Ultra-High-Risk for Psychosis Who Do Not Remit: Findings from the Longitudinal Youth at Risk Study. Neuropsychopharmacology. 42, 1361(2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten