Method Article
Investigación de la plasticidad sináptica a largo plazo en Interlamellar Hippocampus CA1 por grabación de campo electrofisiológica
En este artículo
Resumen
Utilizamos electrodos de grabación y estimulación en rodajas longitudinales del cerebro del hipocampo y electrodos de registro y estimulación posicionados longitudinalmente en el hipocampo dorsal in vivo para evocar potenciales postsinápticos extracelulares y demostrar plasticidad sináptica a largo plazo a lo largo del interlamellar longitudinal CA1.
Resumen
El estudio de la plasticidad sináptica en el hipocampo se ha centrado en el uso de la red lamelar CA3-CA1. Se ha prestado menos atención a la red interlamellar longitudinal CA1-CA1. Recientemente, sin embargo, se ha demostrado una conexión asociativo entre las neuronas piramidales CA1-CA1. Por lo tanto, existe la necesidad de investigar si la red interlamellar longitudinal CA1-CA1 del hipocampo soporta plasticidad sináptica.
Diseñamos un protocolo para investigar la presencia o ausencia de plasticidad sináptica a largo plazo en la red interlamellar hippocampal CA1 utilizando grabaciones electrofisiológicas de campo tanto in vivo como in vitro. Para las grabaciones de campo extracelulares in vivo, los electrodos de grabación y estimulación se colocaron en un eje septal-temporal del hipocampo dorsal en un ángulo longitudinal, para evocar potenciales postsinápticos excitatorios de campo. Para las grabaciones de campo extracelulares in vitro, las rodajas longitudinales hipocampales se cortaron paralelas al plano septal-temporal. Los electrodos de grabación y estimulación se colocaron en el estrato oriens (S.O) y el estrato radiatum (S.R) del hipocampo a lo largo del eje longitudinal. Esto nos permitió investigar la especificidad direccional y de capa de potenciales postsinápticos excitatorios evocados. Se utilizaron protocolos ya establecidos para inducir la potenciación a largo plazo (LTP) y la depresión a largo plazo (LTD) in vivo e in vitro. Nuestros resultados demostraron que la red interlamellar longitudinal CA1 admite la potenciación a largo plazo dependiente del receptor N-metil-D-aspartato (NMDA) (LTP) sin especificidad direccional o de capa. La red interlamelare, sin embargo, a diferencia de la red lamelar transversal, no presentó ninguna depresión significativa a largo plazo (LTD).
Introducción
El hipocampo ha sido ampliamente utilizado en estudios cognitivos1,2,3. La red lamelar del hipocampo en el eje transversal forma el circuito trisináptico que se compone de las regiones de giro dentado, CA3 y CA1. La red lamelar se considera una unidadparalela e independiente 4,5. Este punto de vista lamelare ha influido en el uso de la orientación transversal y las rodajas transversales para estudios electrofisiológicos in vivo e in vitro del hipocampo. A la luz de la investigación emergente, la hipótesis lamelar se está reevaluando6 y también se está prestando atención a la red interlamellar del hipocampo. Con respecto a la red interlamellar hipocampal, la región CA3 ha sido investigada durante mucho tiempo7,8,9,10, sin embargo la región longitudinal del hipocampo CA1 ha recibido relativamente poca atención hasta hace poco. Con respecto a la red interlamellar CA1, se ha demostrado que las propiedades sinápticas a corto plazo a lo largo del eje dorsoventral longitudinal del hipocampo CA1 de ratas varían11. Además, se encontraron racimos de células del hipocampo que respondían a la fase y el lugar que se organizaba sistemáticamente a lo largo del eje longitudinal del hipocampo en ratas, sometiendo a una tarea de memoria a corto plazo12. Además, se encontró que las actividades de convulsiones epilépticas se sincronizaban a lo largo de todo el hipocampo a lo largo del eje longitudinal13.
La mayoría de los estudios de la región longitudinal del hipocampo CA1, sin embargo, han utilizado la entrada del CA3 a lasregionesCA1,14,15. Utilizando un protocolo único para hacer rebanadas longitudinales del cerebro, nuestro trabajo anterior demostró la conectividad asociacional de las neuronas piramidales CA1 a lo largo del eje longitudinal e implicó su capacidad para procesar la señalización neuronal de manera efectiva16. Sin embargo, hay una necesidad de determinar si las neuronas piramidales CA1 a lo largo del eje longitudinal sin entrada transversal pueden apoyar la plasticidad sináptica a largo plazo. Este hallazgo puede añadir otro ángulo en las investigaciones de problemas neurológicos relacionados con el hipocampo.
La capacidad de las neuronas para adaptar la eficacia de la transferencia de información se conoce como plasticidad sináptica. La plasticidad sináptica está implicada como mecanismo subyacente para procesos cognitivos como el aprendizaje y la memoria17,18,19,20. La plasticidad sináptica a largo plazo se demuestra como potenciación a largo plazo (LTP), que representa el fortalecimiento de la respuesta neuronal, o depresión a largo plazo (LTD), que representa el debilitamiento de la respuesta neuronal. La plasticidad sináptica a largo plazo se ha estudiado en el eje transversal del hipocampo. Sin embargo, este es el primer estudio para demostrar plasticidad sináptica a largo plazo en el eje longitudinal del hipocampo de las neuronas piramidales CA1.
Construyendo a partir de un protocolo utilizado por Yang et al.16, diseñamos el protocolo para demostrar LTP y LTD en el eje longitudinal hipocampal de las neuronas piramidales CA1. Utilizamos ratones macho C57BL6 con edades que oscilan entre 5-9 semanas de edad para experimentos in vitro y 6-12 semanas de edad para experimentos in vivo. Este artículo detallado muestra cómo se obtuvieron rebanadas longitudinales del cerebro del hipocampo de ratones para grabaciones in vitro y cómo se registraron las grabaciones in vivo en el eje longitudinal. Para las grabaciones in vitro, investigamos la especificidad direccional de la plasticidad sináptica longitudinal CA1 apuntando al extremo septal y temporal del hipocampo. También investigamos la especificidad de la capa de la plasticidad sináptica longitudinal CA1 mediante el registro del estrato oriens y el estrato radiatum del hipocampo. Para las grabaciones in vivo, investigamos los ángulos que mejor corresponden a la dirección longitudinal del hipocampo.
Utilizando grabaciones de campo extracelulares in vivo e in vitro, observamos que las neuronas piramidales CA1 conectadas longitudinalmente se presentaron con LTP, no LTD. La orientación transversal que implica las neuronas CA3 y CA1, sin embargo, soporta LTP y LTD. La distinción en las capacidades sinápticas entre el transversal y la orientación longitudinal del hipocampo podría significar especulativamente diferencias en su conectividad funcional. Se necesitan más experimentos para descifrar las diferencias en sus capacidades sinápticas.
Protocolo
Todos los animales fueron tratados de acuerdo con las directrices y regulaciones del Animal Care and Use of Laboratory of National Institute of Health. Todos los métodos descritos aquí han sido aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC) de la Universidad de la Ciudad de Hong Kong y la Universidad Nacional de Incheon.
1. Grabación in vivo sobre el terreno
- Preparación animal
- Inyectar uretano (0,06 g por 25 g de peso) por vía intraperitoneal para anestesiar al ratón. Suplemento con inyección intramuscular de atropina (0,05 mg/kg). Mantenga el ratón en un lugar oscuro y silencioso hasta que la anestesia completa surta efecto.
ADVERTENCIA: El uretano tiene potencial carcinogénico. Manéjalo con cuidado y usa ropa protectora para evitar el contacto con la piel expuesta.
NOTA: Alternativamente, el isoflurano se puede utilizar como anestesia. - Compruebe la profundidad de la anestesia de forma intermitente hasta que se tome efecto un plano quirúrgico completo de anestesia. Compruebe la profundidad de la anestesia realizando pellizcos en los dedos, pellizcos para la oreja, pellizcos de cola y pruebas táctiles corneales para observar la respuesta del ratón a los estímulos físicos.
NOTA: No se debe observar un movimiento reflejo o voluntario cuando el ratón está en un plano quirúrgico completo de anestesia. - Para la prueba de pellizco de puntera, extienda la parte trasera o la pata delantera del ratón y pellizque firmemente con un par de fórceps o dedos contundentes. El ratón no está confirmado para la anestesia completa si retira la pierna o agita el cuerpo, tiene un aumento observable de la frecuencia respiratoria o hace sonidos vocales.
- Para la prueba de pellizco de oído, pellizca los extremos de la pinna con un par de fórceps contundentes o dedos firmemente. La anestesia completa no se confirma si el ratón mueve los bigotes hacia adelante, agita la cabeza, hace sonidos vocales o tiene un aumento observable de la frecuencia respiratoria.
- Para la prueba de pellizco de cola, sostenga suavemente la cola del ratón con un felpa o un dedo contundentes. No se debe observar movimiento de cola, sonido vocal ni aumento observado en la frecuencia respiratoria cuando se anestesia completamente para procedimientos quirúrgicos.
- Para la prueba táctil de la córnea, toque suavemente la córnea del ratón, con una mecha de algodón. No se debe observar movimiento de los párpados, movimiento del bigote o aumento observable en la frecuencia respiratoria cuando se anestesia completamente para la cirugía.
- Afeitar el cabello en el cuello y el cráneo del ratón.
- Coloque el ratón completamente anestesiado sobre una almohadilla de calentamiento establecida a 37 oC e inserte la sonda de temperatura rectal en el recto. Esto permite que el calor producido por la almohadilla de calentamiento se ajuste en respuesta a los cambios de la temperatura corporal del ratón.
- Aplicar gel para los ojos para humedecer los ojos del ratón.
- Tire de la lengua hacia el lado de los labios suavemente usando fórceps y fije los dos dientes frontales en el segundo o tercer agujero de los dientes del instrumento estereotáctico. Fije el cráneo del ratón firmemente usando la abrazadera de los ojos.
NOTA: Alternativamente, se puede utilizar una abrazadera estereotáctica para el oído. - Observando bajo un microscopio, separe el tejido subcutáneo y los músculos al final del hueso interparietal y occipital del ratón con un bisturí para exponer la cisterna magna. Blot la dura mater seca con un hisopo de algodón.
- Perfore suavemente la cisterna magna haciendo un corte superficial con una cuchilla de bisturí puntiaguda para drenar el líquido cefalorraquídeo (LCR). Coloque un hisopo de algodón para seguir drenando el CSF.
- Inyectar uretano (0,06 g por 25 g de peso) por vía intraperitoneal para anestesiar al ratón. Suplemento con inyección intramuscular de atropina (0,05 mg/kg). Mantenga el ratón en un lugar oscuro y silencioso hasta que la anestesia completa surta efecto.
- Craneotomía
- Sosteniendo la piel en el cuero cabelludo con fórceps, cortar y quitar la piel con un par de tijeras quirúrgicas. Corta suficiente piel para exponer las marcas de bregma y lambda en el cuero cabelludo. Mantenga la región expuesta seca.
- Ajuste el cráneo sujeto del ratón para permitir que los puntos bregma y lambda se alineen en un nivel horizontal de altura similar. Evite inclinar la cabeza en la posición anterior-posterior o en la posición lateral medial.
- Marque los puntos correspondientes a la región del hipocampo con la ayuda de una pinza Vernier. Utilice el cerebro del ratón en un libro de coordenadas estereotácticas como referencia para ayudar a determinar las coordenadas exactas.
NOTA: La ubicación a marcar para la incisión para el hipocampo es de 1 mm x 3 mm en la línea media denominada anterior-posterior (AP) utilizando el bregma como punto de referencia, y 3 mm x 3 mm perpendicular a la línea media (ML) para conectar los puntos de la línea media. Las coordenadas estereotácticas se dan como (AP: 1,3 y ML: 3,3). - Haga una incisión en el cráneo por encima de la región dorsal del hipocampo a lo largo de los puntos marcados usando un bisturí o un taladro de alta velocidad mientras observa bajo un microscopio.
NOTA: Se debe obtener una abertura rectangular con un tamaño de 2 mm x 3 mm después de la incisión. Mantenga el área expuesta limpia para evitar lesiones en el cerebro. - Saque cuidadosamente el cráneo suelto con fórceps para exponer la dura mater y use una jeringa o gotero para aplicar suavemente la solución salina fisiológica para mantener la superficie húmeda.
- Retire el dura mater cuidadosamente con aguja o fórceps puntiagudos.
NOTA: Tenga cuidado de no causar ningún daño al tejido cerebral durante la craneotomía. Esto conducirá a la hinchazón del cerebro y afectará los resultados. - Mantenga el tejido cerebral expuesto húmedo aplicando aceite fisiológico de salina o inerte utilizando un gotero o una jeringa.
- Grabación in vivo
- Fijar y colocar el electrodo de estimulación y grabación firmemente en el soporte estereotáctico. Ajuste el instrumento estereotáctico de acuerdo con la posición de las coordenadas AP y ML correspondientes para la estimulación y grabación de electrodos por encima del hipocampo dorsal CA1.
NOTA: Utilice el cerebro del ratón en coordenadas estereotácticas como guía para localizar las coordenadas de la región del hipocampo longitudinal CA1 dorsal. Por ejemplo, una coordenada estereotáctica para la región del hipocampo CA1 será (AP 1.5, ML 1.0) para el electrodo de grabación y (AP 1.7, ML 1.5) para el electrodo de estimulación. - Localice el electrodo estimulante lateral al electrodo de registro en una dirección longitudinal.
NOTA: Asegúrese de que los electrodos de estimulación y grabación estén limpios antes de su uso. Esto evita la introducción de ruido al grabar. - Para grabaciones, utilice electrodos multicanal. Primero, localice las coordenadas estereotácticas para la región del hipocampo CA1 utilizando el primer canal. Coloque los electrodos restantes de tal manera que el ángulo de estimulación y los electrodos de grabación estén en el rango de 30 a 60o en relación con la línea media desde el punto de bregma.
NOTA: Este ángulo corresponde a la orientación longitudinal de la región del hipocampo CA1. - Como control, localice el electrodo de grabación por encima de la región CA1 y el electrodo de estimulación por encima de la región CA3 del hipocampo dorsal. Por ejemplo, utilizando el cerebro del ratón en coordenadas estereotácticas como guía, una coordenada estereotáctica para la región del hipocampo CA1-CA3 será (AP 1.8, ML 1.0) para el electrodo de grabación y (AP 1.5, ML 1.5) para el electrodo de estimulación.
NOTA: Este paso es un control alternativo y debe realizarse en un experimento independiente. - Coloque el electrodo de referencia en una parte distal de la región cerebral expuesta o debajo de la piel del ratón.
- Encienda el sistema de grabación.
- Abra el software para la grabación y la adquisición de datos.
NOTA: Los diferentes laboratorios tienen su software preferido para el registro y la adquisición de datos. - Observando bajo un microscopio, baje los electrodos de grabación y estimulación lentamente usando el micromanipulador hasta que solo toque la superficie del cerebro. Marque el punto como el punto cero para empezar a calcular la profundidad exacta de la región del hipocampo.
NOTA: El micromanipulador se puede utilizar para controlar la profundidad a la que se inserta el electrodo en un momento dado. Observe un aumento en la impedancia justo cuando el electrodo toca la superficie del cerebro. - Baje lentamente los electrodos a la profundidad aproximada correspondiente a las coordenadas estereotácticas elegidas para el hipocampo CA1.
NOTA: Utilice el cerebro del ratón en coordenadas estereotácticas como guía para obtener la profundidad aproximada correspondiente a las coordenadas estereotácticas elegidas. - Dar estimulación (100 s de duración, repetida a intervalos de 30 s) y ajustar la profundidad del electrodo en pasos de 50 m o menos hasta que se observe un potencial postsináptico excitatorio de campo evocado estable (fEPSP).
NOTA: Por lo general, un estímulo de 20 oA es suficiente para evocar una respuesta observable. - Asegúrese de que un fEPSP estable ha sido evocado por la variación de la intensidad del estímulo. Se debe observar un aumento notable en la pendiente o amplitud del fEPSP con cada aumento de la intensidad del estímulo. Esto se denomina curva de entrada-salida. Cree una curva de entrada-salida (I-O) para detectar la intensidad máxima de estímulo en la que no haya más aumento en la pendiente del fEPSP evocado (Figura6).
NOTA: Deseche los datos y cambie la posición del electrodo si la volea de fibra desaparece durante el experimento. - Utilice la curva de entrada-salida para establecer la intensidad de línea base en 40 - 50% del máximo. Utilice la intensidad de estímulo correspondiente para el registro de línea base.
- Registre el potencial de campo local como una línea de base de 20 - 30 min.
- Utilice la misma curva de entrada-salida para establecer la intensidad de estímulo para evocar estimulación de alta frecuencia (HFS) o tétanos al 75% de la intensidad máxima. Alternativamente, al inducir la depresión a largo plazo, mantenga la misma intensidad de estímulo utilizada para registrar la línea de base al evocar estimulación de baja frecuencia (LFS).
- Aplicar una estimulación tetánica de pulsos de 100 Hz 4 veces con un intervalo de 10 s para inducir LTP.
NOTA: Utilice este protocolo solo cuando trabaje en un experimento de potenciación a largo plazo. - Aplique estimulación de baja frecuencia de 5 Hz (900 estímulos durante 3 min), 1 Hz LFS (900 estímulos durante 15 min) o 1 Hz de pulso emparejado (intervalo de pulso emparejado de 50 ms, 900 pares de estímulos durante 15 min) para inducir LTD de acuerdo con protocolos ya establecidos.
NOTA: Utilice estos protocolos solo cuando trabaje en un experimento de depresión a largo plazo. - Registre el potencial de campo local durante 1 h después de HFS o LFS, alternativamente.
- Exportar datos y analizar utilizando el software.
- Verificar la posición del electrodo de grabación y estimulación dando una estimulación de corriente de 10 oA durante 30 s para lesionar las áreas registradas. Transcardialmente perfumar el ratón con 4% de paraformaldehído y cosechar el cerebro para cortar y manchar con Cresyl Violet según.
- Eutanasia del ratón por luxación cervical o inyección de dosis anestésica letal después del experimento.
- Fijar y colocar el electrodo de estimulación y grabación firmemente en el soporte estereotáctico. Ajuste el instrumento estereotáctico de acuerdo con la posición de las coordenadas AP y ML correspondientes para la estimulación y grabación de electrodos por encima del hipocampo dorsal CA1.
2. Grabación in vitro sobre el terreno
- Preparación de soluciones de corte oxigenado y líquido cefalorraquídeo artificial (ACSF)
- Para 2 L de solución de corte, agregue aproximadamente 1 L de agua destilada doble en un matraz volumétrico y revuelva vigorosamente sobre una placa de agitación.
- Agregue los siguientes componentes de la solución de corte (en mM): 87,0 NaCl, 2,5 KCl, 1,3 NaH2PO4, 25,0 NaHCO3, 25,0 glucosa, 75,0 sacarosa, 7,0 MgCl 2,6H2O y 0,5 CaCl2x 2H2O (Tabla 1).
NOTA: Alternativamente, MgCl2s6H2O y CaCl2x 2H2O se pueden excluir en esta etapa y añadir más adelante en un volumen listo para usar. - Cubra hasta 2 L con agua destilada doble mientras revuelve vigorosamente.
- Para 2 L de ACSF, agregue aproximadamente 1 L de agua destilada doble en un matraz volumétrico y revuelva vigorosamente en una placa de agitación.
- Añadir los siguientes componentes de la solución ACSF (en mM): 125,0 NaCl, 2,5 KCl, 1,3 NaH2PO4, 25,0 NaHCO3, 25 glucosa, 1,0 MgCl26H2O y 2,0 CaCl222H2O (Tabla1).
NOTA: Alternativamente, MgCl2.6H2O y CaCl2x 2H2O se pueden excluir en esta etapa y añadir más adelante en un volumen listo para usar. - Cubra hasta 2 L con agua destilada doble mientras revuelve vigorosamente.
- Configuración y corte cerebral
- Vierta 400 ml de solución de corte ya preparada en un matraz separado y oxigenar (95% O2/5% CO2) durante aproximadamente 20 min.
- Conservar el resto de la solución de 1,6 L en una nevera de 4oC. Mantenga la solución hasta 1 semana después de la cual debe desecharse si no se utiliza para evitar el crecimiento de hongos.
- Vierta 200 ml de la solución de corte oxigenada en el matraz, cubra con parafilm y transfiera a un congelador de -80 oC durante aproximadamente 20 minutos para hacer un purina.
- Vierta los 200 ml restantes de solución de corte en una cámara de retención de rodajas cerebrales y manténgase en un baño de agua de 32oC con burbujeo continuo.
- Preparen el banco para cortar. Coloque toallas de papel y herramientas quirúrgicas en la parte superior del banco. Organizar las herramientas quirúrgicas en orden de uso para facilitar un proceso rápido y eficiente (Figura7).
- Saque la solución de corte refrigerada del congelador y vierta aproximadamente 50 ml en un vaso de precipitados. Vierta aproximadamente 10 ml en una placa Petri que contenga papel de filtro para humedecerla. Colóquelos en hielo junto al área de disección.
- Vierta el resto de la solución de corte en la cámara de corte y fíjela en el vibratome.
- Anestetizar el ratón con isoflurano utilizando directrices y regulaciones sobre el cuidado de los animales y el uso del laboratorio del Instituto Nacional de Salud, y los métodos aprobados del Comité Institucional de Uso y Cuidado de Animales de la Universidad de la Ciudad de Hong Kong e Incheon National Universidad.
- Decapita el ratón anestesiado con un par de tijeras y coloca la cabeza sobre papel tisú. Cortar la piel que cubre el cráneo del ratón y cortar a través de los músculos cutáneos con tijeras. Cortar las placas del cráneo a lo largo de la línea media hasta el hueso occipital usando tijeras quirúrgicas.
- Abre el cráneo con fórceps contundentes para exponer el cerebro. Saca suavemente el cerebro con una espátula y colócalo en la solución de corte fría en el vaso de precipitados. Espera unos 30 s.
- Saque el cerebro con la cuchara y colóquelo cuidadosamente en el papel de filtro previamente humedecido en la placa Petri.
- Separe los dos hemisferios cerebrales a lo largo de la línea media con una cuchilla de bisturí. Aísle el hipocampo desprendiéndolo suavemente de la corteza con una espátula y colóquelo cuidadosamente sobre el papel de filtro humedecido. Corte el extremo septal y temporal del hipocampo aislado usando el bisturí.
- Recoge el hipocampo aislado usando una espátula contundente y un cepillo. Coloque suavemente la espátula en un papel tisú para eliminar el exceso de agua.
- Aplique una pequeña cantidad de pegamento a la placa de corte del vibratome.
- Para una rebanada longitudinal del hipocampo CA1, adjunte la región CA3 del hipocampo a la placa de corte con el pegamento. Colóquelo rápidamente pero cuidadosamente en la cámara de corte del vibratome que contiene la solución de corte oxigenada refrigerada.
- Para la rebanada transversal que servirá como control, conecte el extremo ventral del hipocampo a la placa de corte del vibratome. Colóquelo rápidamente pero cuidadosamente en la cámara de corte que contiene la solución de disección oxigenada refrigerada.
NOTA: Este paso es una alternativa al paso anterior y debe realizarse por separado. - Coloque el ángulo de la hoja a 90o. Ajuste los parámetros del vibratomo a una velocidad de 0,05 mm/s, una amplitud de 1,20 mm y un espesor de corte de 400 m.
- Corta el hipocampo unido con el vibratome.
NOTA: Una buena rebanada longitudinal de cerebro del hipocampo CA1 tendrá una capa de CA1 y 2 capas de gyrus dentado. Se puede obtener un máximo de 2 buenas rodajas de hipocampo. Alternativamente, una rebanada de cerebro hipocampal transversal tendrá intacta el gyrus dentado, CA3 y CA1. - Transfiera las rebanadas longitudinales del cerebro del hipocampo del vibratoma con una pipeta e incubarla en la cámara de retención de la rebanada cerebral en el baño de agua.
- Incubar rodajas en el baño de agua durante 20 minutos a una temperatura de 32 oC y sacar a temperatura ambiente durante 30 minutos de recuperación.
NOTA: Alternativamente, transfiera la rebanada cerebral cuando esté fuera del baño de agua y colóquela suavemente en la cámara de registro con ACSF oxigenado que fluye a una temperatura de 32 oC durante 30 minutos de recuperación. - Durante la incubación en el baño de agua, vierta 400 ml de solución ACSF en un matraz separado y oxigenar (95% O2/5% CO2) durante aproximadamente 20 - 30 minutos antes de transferir la rebanada cerebral a la cámara de grabación. Superfuse continuamente el ACSF en la cámara de grabación a una velocidad de 2 ml/min.
- Encienda el controlador de temperatura para calentar el ACSF que fluye a 32 oC.
- Conservar el resto de la solución de 1,6 L en una nevera de 4oC. Mantenga la solución hasta una semana después de la cual debe desecharse si no se utiliza para evitar el crecimiento de hongos.
- Grabación in vitro
- Configure un equipo de grabación encendiendo todo el hardware necesario.
- Transfiera la rebanada cerebral de la cámara de sujeción de la rebanada a la cámara de grabación. Ajuste la posición de la rebanada cerebral con fórceps contundentes y sosténgula en su lugar con un arpa. Permita que el ACSF se ejecute por lo menos 20 min. Esto permite que la rebanada del cerebro sea estable antes de grabar.
- Llene la pipeta de grabación con ACSF como solución interna.
- Compruebe la resistencia de la pipeta de grabación con el software designado. La resistencia de la pipeta de grabación debe estar dentro del rango de 3-5 M.
- Active el software para la adquisición de datos. Este software debe tener características similares que permiten la adquisición de datos de una manera similar a las grabaciones in vivo mostradas anteriormente.
- Fije la grabación y los electrodos de estimulación firmemente en el soporte del instrumento estereotáctico. Coloque el electrodo de referencia en el ACSF en la cámara de grabación.
- Para rodajas longitudinales, coloque el electrodo de estimulación y registro en los oriens de estrato (S.O.). Mantenga la distancia entre los electrodos a unos 300 a 500 m. Coloque el electrodo de estimulación en el lado septal o temporal de la rebanada cerebral y registre desde la misma capa (Figura8).
- Alternativamente, coloque el electrodo de estimulación y registro en el estrato radiatum (S.R.). Coloque el electrodo de estimulación en el lado septal o temporal de la rebanada cerebral.
- Para las rebanadas transversales como control, coloque el electrodo estimulante en la región CA3 (vía colateral de Schaffer) y el electrodo de grabación en la región CA1 (Figura9).
NOTA: Este es un paso de control alternativo y debe realizarse en un experimento independiente. - Encienda el generador de estímulo aislado y dé estimulación (duración de 100 os, repetida a intervalos de 30 s). Ajuste la profundidad y/o posición del electrodo de grabación hasta que se observe un potencial de campo postsináptico excitatorio evocado estable.
- Asegúrese de que un fEPSP estable ha sido evocado por la variación de la intensidad del estímulo. Se debe observar un cambio notable en la pendiente del fEPSP con cada cambio de intensidad de estímulo. Esto se denomina curva de entrada-salida. Cree una curva de entrada-salida (I-O) para detectar la intensidad máxima de estímulo en la que no haya más aumento en la pendiente del FEPSP (Figura6).
NOTA: Deseche los datos y cambie la posición del electrodo si la volea de fibra desaparece durante el experimento. - Utilice la curva de entrada-salida para establecer la intensidad de estímulo para el registro de línea base y para evocar estimulación de alta frecuencia (HFS) o tétanos en 30-40% del fEPSP máximo evocado.
- Alternativamente, para experimentos con LTD, utilice la curva de entrada-salida para establecer la intensidad de línea base para el registro de línea base y para evocar la estimulación de baja frecuencia (LFS) en el 70% del fEPSP máximo evocada.
- Registre el potencial de campo local como la línea de base de 20 - 30 min.
- Aplique HFS de pulsos de 100 Hz dos veces con un intervalo de 30 s para inducir LTP.
- Alternativamente, para experimentos LTD, aplique estimulación de baja frecuencia de 5 Hz (900 estímulos durante 3 min) o 1 Hz LFS (900 estímulos durante 15 min) o 1 Hz de pulso emparejado (intervalo de pulso emparejado de 50 ms, 900 pares de estímulos durante 15 min) para inducir LTD según ya protocolo establecido.
- Registre el potencial de campo local durante 1 h después de HFS o LFS.
- Exportar datos y analizarlos.
Resultados
Exploramos la plasticidad sináptica a largo plazo de las neuronas piramidales longitudinales CA1 del hipocampo utilizando registros de campo extracelulares tanto in vivo como in vitro. LTP y LTD son facetas de plasticidad sináptica a largo plazo que se han demostrado en el eje transversal del hipocampo para ser unidireccional.
Aquí mostramos que usando rebanadas longitudinales del cerebro del hipocampo, hay LTP en el eje longitudinal CA1 del hipocampo. Preparamos rodajas longitudinales del hipocampo a lo largo del eje septotemporal, que es perpendicular a las rodajas transversales (Figura1). Utilizando grabaciones de la región CA1 del hipocampo, mostramos la presencia de LTP que no era específica de la dirección. No hubo diferencias estadísticamente significativas en las grabaciones desde el lado septal o temporal (Figura2) de la rebanada longitudinal del cerebro del hipocampo. También mostramos la presencia de LTP que no era específica de la capa; por lo tanto, las grabaciones tanto del estratoradiato como de los oriens del estrato (Figura 2) mostraron LTP inducida con éxito en la rebanada longitudinal del cerebro. Utilizamos D-AP5, un antagonista NMDAR para demostrar que el LTP inducido dependía de los receptores NMDA (Figura3). Lo que sucede in vitro no refleja necesariamente condiciones in vivo, por lo que investigamos LTP in vivo. Figura 4 a muestra un diagrama esquemático del electrodo de estimulación y registro colocado en el hipocampo dorsal a lo largo del eje longitudinal de la región CA1 in vivo. La posición de los electrodos utilizados para la grabación y estimulación fue verificada por marcas de lesiones y manchas violetas cristalinas (Figura4a). Demostramos la presencia de LTP in vivo en la región longitudinal CA1 (Figura4b).
Utilizando protocolos ya establecidos para inducir LTD, no logramos inducir con éxito LTD in vivo e in vitro (Figura5).

Figura 1 . Un dibujo esquemático de rebanadas de cerebro de hipocampo transversales y longitudinales. Esta cifra está adaptada y modificada a partir de Sun et al. 201821. Haga clic aquí para ver una versión más grande de esta figura.
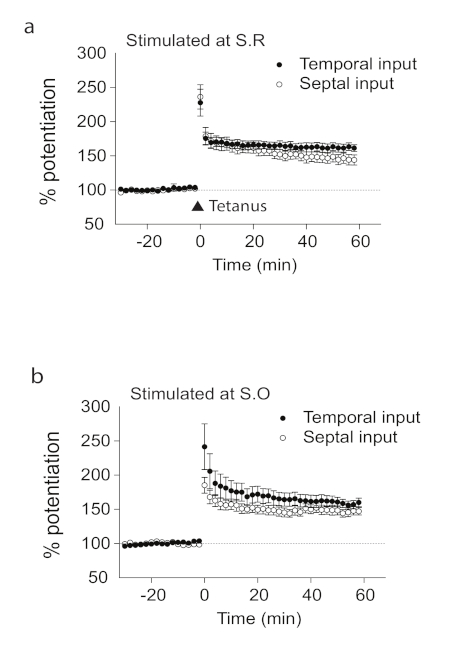
Figura 2 . LTP en rodajas longitudinales. Las respuestas sinápticas en S.R. (a) o S.O. (b) en rodajas longitudinales se potencian justo después de la estimulación del tétanos con entradas temporales y septales (S.R./temporal (n.o 12, c), S.R./septal (n a 12, c), S.O./temporal (n.o 10, d), S.O./septal (n.o 12, c), S.O./temporal (n.o 10, d), S.O./septal (n.o 12, c), S.O./septal (n.o 12, c), S.O./temporal (n.o 10, d), S.O./septal (n. 9, d).
La n significa el número de rebanadas. Las barras de error representan SE. Esta cifra está adaptada y modificada a partir de Sun et al. 201821. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3 . LTP dependiente de NMDAR en rodajas longitudinales. (a ,b) La inducción de LTP en dirección temporal y septal está bloqueada por 50 M D-AP5 (temporal, n a 6, a) (septal, n a 5, b). (c,d) La inducción LTP en dirección temporal y septal también está bloqueada por D-AP5. La n significa rodajas. Las barras de error representan SE. Esta cifra está adaptada y modificada a partir de Sun et al. 201821. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4 . In vivo LTP en la red interlamellar. (a) Un dibujo esquemático de electrodos de registro y estimulación en animales anestesiados. Los loci de registro (en el lado septal de CA1) y los electrodos estimulantes (en el lado temporal de CA1) fueron identificados por marcas de lesiones. (b) LTP se induce en la conexión interlamellar mediante estimulación de alta frecuencia de 100 Hz (HFS) (n a 10 ratones). Rastros de color: antes (negro) y después (rojo) HFS. Las barras de error representan SE. Esta cifra está adaptada y modificada a partir de Sun et al. 201821. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5 . Ausencia de LTD in vivo e in vitro en la red Interlamellar CA1. (a ) 1 Hz-pp LFS no induce in vivo LTD. (b) 1 Hz pp-LTP, (c) 5 Hz LFS, y (d) 1 Hz LFS no produce LTD ni en los lados temporal o septal de la rebanada longitudinal del cerebro. mientras que la LTD es inducida por 1 Hz pp-LFS en rodajas transversales: temporal (n x 8), septal (n a 11) y transversal (n a 6) con 1 Hz pp-LFS; temporal (n a 3) y septal (n a 3) con 5 Hz LFS; temporal (n a 3) y septal (n a 3) con 1 Hz DE LFS. La n significa rodajas. Las barras de error representan SE. Esta cifra está adaptada y modificada a partir de Sun et al. 201821. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6 . Curva de entrada-salida que presenta la pendiente fEPSP en respuesta al aumento de la entrada de estímulo en la rebanada del cerebro del hipocampo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7 . Herramientas quirúrgicas utilizadas para el aislamiento del hipocampo durante el corte cerebral in vitro. Haga clic aquí para ver una versión más grande de esta figura.

Figura 8 . Una rebanada longitudinal del cerebro lista para grabar. El electrodo de estimulación y la pipeta de registro se insertan en el radiatum del estrato. Haga clic aquí para ver una versión más grande de esta figura.

Figura 9 . Una rebanada transversal del cerebro del hipocampo lista para su grabación. El electrodo de estimulación se inserta en la región CA3 colateral de Schaffer y la pippette de grabación se inserta en la región CA1. Haga clic aquí para ver una versión más grande de esta figura.
| Compuesto | Solución de corte (mM) | ACSF (mM) |
| CaCl2.2H2O | 0.5 | 2 |
| Glucosa | 25 | 25 |
| Kcl | 2.5 | 2.5 |
| MgCl2.6H2O | 7 | 1 |
| Nacl | 87 | 125 |
| NaH2PO4 | 1.3 | 1.3 |
| NaHCO3 | 25 | 25 |
| Sacarosa | 75 |
Tabla 1: Concentraciones de compuestos en la rebanada cerebral y soluciones de líquido cefalorraquídeo artificial.
Discusión
El protocolo demuestra el método para inducir la plasticidad sináptica a largo plazo in vivo, así como a partir de rodajas cerebrales en el eje longitudinal CA1-CA1 del hipocampo in vitro. Los pasos descritos dan suficientes detalles para que un experimentador investigue LTP y LTD en una conexión longitudinal CA1-CA1 hipocampal. Se necesita práctica para perfeccionar las habilidades necesarias para registrar con éxito los potenciales excitatorios del campo.
Además de necesitar práctica, hay varios pasos críticos que son esenciales para obtener buenos resultados. En primer lugar, se demostró anteriormente que el ángulo al que se hicieron las rebanadas cerebrales podía truncar o preservar las proyecciones longitudinales de las neuronas piramidales en la región CA1-CA1 del hipocampo16. Las neuronas piramidales longitudinales se proyectan desde las neuronas transversales en un ángulo que es casi perpendicular. A medida que las neuronas CA1 se propagan en diversos ángulos dentro del hipocampo, la conexión longitudinal entre ellas se extiende a lo largo del eje dorsoventral del hipocampo. Por lo tanto, para el registro in vitro, el experimentador debe tener esto en cuenta para apuntar con precisión a las neuronas del hipocampo CA1-CA1 a lo largo del eje longitudinal cortando el tejido aislado del hipocampo a lo largo del eje dorsal-ventral. Además, para las grabaciones in vivo, el ángulo en el que se colocan la estimulación y los electrodos de registro determina si los resultados obtenidos son representativos del eje longitudinal o de una mezcla tanto del eje transversal como longitudinal. Se pueden realizar nuevas investigaciones utilizando CRISPR-Cas9 para confirmar si la respuesta evocada es únicamente de la región CA1, ya que podría ser una mezcla de respuestas tanto de la CA1 como de las regiones CA3.
En segundo lugar, para los experimentos in vitro, el experimentador debe asegurarse de que la solución de corte cerebral, ACSF, banco de trabajo y todos los equipos o instrumentos que entran en contacto con la rebanada del cerebro están libres de contaminantes. Cualquier forma de contaminación conducirá al deterioro de la integridad o la muerte de la rebanada cerebral. Mantener una superficie de electrodo limpia garantizará grabaciones buenas y estables para experimentos in vitro e in vivo.
Hemos demostrado que la red longitudinal CA1 del hipocampo exhibe LTPs dependientes de NMDAR, pero no LTD. El circuito trisináptico, sin embargo, se presenta con LTP y LTD22,23. Esto implica que la red longitudinal CA1 y los circuitos trisinápticos tienen características únicas. Nuestro protocolo sólo hace uso de grabaciones electrofisiológicas y por lo tanto está limitado en la búsqueda de la diferencia entre estas dos redes.
Continúa la búsqueda de una cura para enfermedades cerebrales como la esquizofrenia. La disminución o deformidad de las subregiones del hipocampo CA1 se han relacionado con algunos síntomas esquizofrénicos24,25. La aplicación de nuestro protocolo, aunque básico, ha sacado a la luz una capacidad sináptica única de la subregión del hipocampo longitudinal CA1. Este conocimiento es útil en el diseño de experimentos que pueden investigar aún más esta enfermedad cerebral debilitante a lo largo del eje longitudinal CA1 del hipocampo.
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
Este trabajo fue apoyado por la Beca de Investigación de la Universidad Nacional de Incheon (Cooperativa Internacional). Nos gustaría dar las gracias a la Sra. Gona Choi por ayudar con la recopilación de datos.
Materiales
| Name | Company | Catalog Number | Comments |
| Atropine Sulphate salt monohydrate, ≥97% (TLC), crystalline | Sigma-Aldrich | 5908-99-6 | Stored in Dessicator |
| Axon Digidata 1550B | |||
| Calcium chloride | Sigma-Aldrich | 10035-04-8 | |
| Clampex 10.7 | |||
| D-(+)-Glucose ≥ 99.5% (GC) | Sigma-Aldrich | 50-99-7 | |
| Eyegel | Dechra | ||
| Isoflurane | RWD Life Sciences | R510-22 | |
| Magnesium chloride hexahydrate, BioXtra, ≥99.0% | Sigma-Aldrich | 7791-18-6 | |
| Matrix electrodes, Tungsten | FHC | 18305 | |
| Multiclamp 700B Amplifier | |||
| Potassium chloride, BioXtra, ≥99.0% | Sigma-Aldrich | 7447-40-7 | |
| Potassium phosphate monobasic anhydrous ≥99% | Sigma-Aldrich | 7778-77-0 | Stored in Dessicator |
| Pump | Longer precision pump Co., Ltd | T-S113&JY10-14 | |
| Silicone oil | Sigma-Aldrich | 63148-62-9 | |
| Sodium Bicarbonate, BioXtra, 99.5-100.5% | Sigma-Aldrich | 144-55-8 | |
| Sodium Chloride, BioXtra, ≥99.5% (AT) | Sigma-Aldrich | 7647-14-5 | |
| Sodium phosphate monobasic, powder | Sigma-Aldrich | 7558-80-7 | |
| Sucrose, ≥ 99.5% (GC) | Sigma-Aldrich | 57-50-1 | |
| Temperature controller | Warner Instruments | TC-324C | |
| Tungsten microelectrodes | FHC | 20843 | |
| Urethane, ≥99% | Sigma-Aldrich | 51-79-6 | |
| Vibratome | Leica | VT-1200S | |
| Water bath | Grant Instruments | SAP12 |
Referencias
- Levy, W. B. A sequence predicting CA3 is a flexible associator that learns and uses context to solve hippocampal-like tasks. Hippocampus. 6 (6), 579-590 (1996).
- Eldridge, L. L., Knowlton, B. J., Furmanski, C. S., Bookheimer, S. Y., Engel, S. A. Remembering episodes: A selective role for the hippocampus during retrieval. Nature Neuroscience. 3 (11), 1149-1152 (2000).
- Sullivan Giovanello, K., Schnyer, D. M., Verfaellie, M. A critical role for the anterior hippocampus in relational memory: evidence from an fMRI study comparing associative and item recognition. Hippocampus. 14 (1), 5-8 (2004).
- Andersen, P., Bland, B., Dudar, J. D. Organization of the hippocampal output. Experimental Brain Research. 17 (2), 152-168 (1973).
- Andersen, P., Bliss, T. V. P., Skrede, K. K. Lamellar organization of hippocampal excitatory pathways. Experimental Brain Research. 13 (2), 222-238 (1971).
- Sloviter, R., Lømo, T. Updating the Lamellar Hypothesis of Hippocampal Organization. Frontiers in Neural Circuits. 6 (102), (2012).
- Ishizuka, N., Weber, J., Amaral, D. G. Organization of intrahippocampal projections originating from CA3 pyramidal cells in the rat. Journal of Comparative Neurology. 295 (4), 580-623 (1990).
- Tamamaki, N., Nojyo, Y. Crossing fiber arrays in the rat hippocampus as demonstrated by three-dimensional reconstruction. Journal of Comparative Neurology. 303 (3), 435-442 (1991).
- Swanson, L., Wyss, J., Cowan, W. An autoradiographic study of the organization of intrahippocampal association pathways in the rat. Journal of Comparative Neurology. 181 (4), 681-715 (1978).
- Rebola, N., Carta, M., Mulle, C. Operation and plasticity of hippocampal CA3 circuits: implications for memory encoding. Nature Reviews Neuroscience. 18 (4), 208(2017).
- Papaleonidopoulos, V., Trompoukis, G., Koutsoumpa, A., Papatheodoropoulos, C. A gradient of frequency-dependent synaptic properties along the longitudinal hippocampal axis. BMC Neuroscience. 18 (1), 79(2017).
- Hampson, R. E., Simeral, J. D., Deadwyler, S. A. Distribution of spatial and nonspatial information in dorsal hippocampus. Nature. 402, 610(1999).
- Umeoka, S. C., Lüders, H. O., Turnbull, J. P., Koubeissi, M. Z., Maciunas, R. J. Requirement of longitudinal synchrony of epileptiform discharges in the hippocampus for seizure generation: a pilot study. Journal of Neurosurgery. 116 (3), 513-524 (2012).
- Fanselow, M. S., Dong, H. W. Are the dorsal and ventral hippocampus functionally distinct structures. Neuron. 65, (2010).
- Milior, G., et al. Electrophysiological properties of CA1 pyramidal neurons along the longitudinal axis of the mouse hippocampus. Scientific Reports. 6, (2016).
- Yang, S., et al. Interlamellar CA1 network in the hippocampus. Proceedings of the National Academy of Sciences. 111 (35), 12919-12924 (2014).
- Tsien, J. Z., Huerta, P. T., Tonegawa, S. The Essential Role of Hippocampal CA1 NMDA Receptor–Dependent Synaptic Plasticity in Spatial Memory. Cell. 87 (7), 1327-1338 (1996).
- Bliss, T., Collingridge, G. A synaptic model of memory: long-term potentiation in the hippocampus. Nature. 361, 31-39 (1993).
- Roman, F., Staubli, U., Lynch, G. Evidence for synaptic potentiation in a cortical network during learning. Brain Research. 418 (2), 221-226 (1987).
- McNaughton, B., Barnes, C., Rao, G., Baldwin, J., Rasmussen, M. Long-term enhancement of hippocampal synaptic transmission and the acquisition of spatial information. Journal of Neuroscience. 6 (2), 563-571 (1986).
- Sun, D. -g, et al. Long term potentiation, but not depression, in interlamellar hippocampus CA1. Scientific Reports. 8 (1), 5187(2018).
- Stepan, J., Dine, J., Eder, M. Functional optical probing of the hippocampal trisynaptic circuit in vitro: network dynamics, filter properties, and polysynaptic induction of CA1 LTP. Frontiers in Neuroscience. 9, 160(2015).
- Milner, A. J., Cummings, D. M., Spencer, J. P., Murphy, K. P. Bi-directional plasticity and age-dependent long-term depression at mouse CA3-CA1 hippocampal synapses. Neuroscience Letters. 367 (1), 1-5 (2004).
- Bogerts, B., et al. Hippocampal CA1 deformity is related to symptom severity and antipsychotic dosage in schizophrenia. Brain. 136 (3), 804-814 (2013).
- Ho, N. F., et al. Progressive Decline in Hippocampal CA1 Volume in Individuals at Ultra-High-Risk for Psychosis Who Do Not Remit: Findings from the Longitudinal Youth at Risk Study. Neuropsychopharmacology. 42, 1361(2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados