Method Article
Investigating Long-term Synaptic Plasticity in Interlamellar Hippocampus CA1 par Electrophysiological Field Recording
Dans cet article
Résumé
Nous avons utilisé des électrodes d'enregistrement et de stimulation dans des tranches de cerveau hippocampal longitudinales et des électrodes d'enregistrement et de stimulation positionnelles longitudinale dans l'hippocampe dorsal in vivo pour évoquer les potentiels postsynaptiques extracellulaires et démontrer plasticité synaptique à long terme le long de l'interlamellar longitudinal CA1.
Résumé
L'étude de la plasticité synaptique dans l'hippocampe s'est concentrée sur l'utilisation du réseau lamellar CA3-CA1. Moins d'attention a été accordée au réseau interlamellar longitudinal CA1-CA1. Récemment cependant, une connexion associationentre les neurones pyramidaux CA1-CA1 a été montrée. Par conséquent, il est nécessaire d'étudier si le réseau interlamellar longitudinal CA1-CA1 de l'hippocampe soutient la plasticité synaptique.
Nous avons conçu un protocole pour étudier la présence ou l'absence de plasticité synaptique à long terme dans le réseau hippocampal CA1 interlamellar utilisant des enregistrements électrophysiologiques de champ in vivo et in vitro. Pour les enregistrements extracellulaires in vivo de champ, les électrodes d'enregistrement et de stimulation ont été placées dans un axe septal-temporel de l'hippocampe dorsal à un angle longitudinal, pour évoquer des potentiels postsynaptic excitatoires de champ. Pour les enregistrements extracellulaires in vitro de champ, les tranches longitudinales hippocampal ont été coupées parallèlement au plan septal-temporel. Des électrodes d'enregistrement et de stimulation ont été placées dans la stratum oriens (S.O) et la stratum radiatum (S.R) de l'hippocampe le long de l'axe longitudinal. Cela nous a permis d'étudier la spécificité directionnelle et de la couche des potentiels postsynaptiques excitatoires évoqués. Des protocoles déjà établis ont été utilisés pour induire la potentialisation à long terme (LTP) et la dépression à long terme (LTD) in vivo et in vitro. Nos résultats ont démontré que le réseau interlamellar CA1 longitudinal soutient la potentialisation à long terme à long terme (LTP) dépendante des récepteurs N-méthyl-D(NMDA) sans spécificité directionnelle ou de couche. Le réseau interlamellar, cependant, contrairement au réseau lamellar transversal, ne s'est présenté avec aucune dépression à long terme significative (LTD).
Introduction
L'hippocampe a été largement utilisé dans les études cognitives1,2,3. Le réseau lamellar hippocampal dans l'axe transversal forme les circuits tri-synaptiques qui sont constitués des régions de ntate gyrus, CA3, et CA1. Le réseau lamellar est considéré comme une unité parallèle et indépendante4,5. Ce point de vue lamellar a influencé l'utilisation de l'orientation transversale et des tranches transversales pour les études électrophysiologiques in vivo et in vitro de l'hippocampe. À la lumière de la recherche émergente, l'hypothèse lamellar est réévaluée6 et l'attention est également donnée au réseau interlamellar de l'hippocampe. En ce qui concerne le réseau interlamellar hippocampal, la région CA3 a longtemps fait l'objet d'une enquête7,8,9,10, cependant la région hippocampique longitudinale CA1 a reçu relativement peu d'attention jusqu'à récemment. En ce qui concerne le réseau interlamellar CA1, les propriétés synaptiques à court terme le long de l'axe hippocampique longitudinal dorsoventranal CA1 des rats ont été montrés pour varier11. En outre, des groupes de cellules hippocampales répondant à la phase et à l'endroit se sont avérés être disposés systématiquement le long de l'axe longitudinal de l'hippocampe chez les rats, subissant une tâche de mémoire à court terme12. En outre, les activités de saisie épileptique se sont avérées synchronisées le long de l'hippocampe entier le long de l'axe longitudinal13.
La plupart des études de la région hippocampique longitudinale CA1 cependant, ont utilisé l'apport de la CA3 aux régions CA111,14,15. Utilisant un protocole unique pour faire des tranches de cerveau longitudinales, nos travaux précédents ont démontré la connectivité associationnelle des neurones pyramidaux de CA1 le long de l'axe longitudinal et ont impliqué sa capacité à traiter la signalisation neuronale effectivement16. Cependant, il est nécessaire de déterminer si les neurones pyramidaux CA1 le long de l'axe longitudinal sans entrée transversale peuvent soutenir la plasticité synaptique à long terme. Cette conclusion peut ajouter un autre angle dans des investigations des issues neurologiques se rapportant à l'hippocampe.
La capacité des neurones à adapter l'efficacité du transfert d'information est connue sous le nom de plasticité synaptique. La plasticité synaptique est impliquée comme mécanisme sous-jacent pour les processus cognitifs tels que l'apprentissage et la mémoire17,18,19,20. La plasticité synaptique à long terme est démontrée comme potentialisation à long terme (LTP), qui représente le renforcement de la réponse neuronale, ou dépression à long terme (LTD), qui représente l'affaiblissement de la réponse neuronale. La plasticité synaptique à long terme a été étudiée dans l'axe transversal de l'hippocampe. Cependant, c'est la première étude à démontrer la plasticité synaptique à long terme dans l'axe longitudinal hippocampal des neurones pyramidaux de CA1.
En nous appuyant sur un protocole utilisé par Yang et coll.16, nous avons conçu le protocole pour démontrer le LTP et le LTD dans l'axe longitudinal hippocampal des neurones pyramidaux CA1. Nous avons utilisé des souris mâles C57BL6 dont l'âge varie entre 5 et 9 semaines pour des expériences in vitro et de 6 à 12 semaines pour les expériences in vivo. Cet article détaillé montre comment des tranches de cerveau hippocampal longitudinales de souris ont été obtenues pour des enregistrements in vitro et comment des enregistrements in vivo ont été enregistrés dans l'axe longitudinal. Pour les enregistrements in vitro, nous avons étudié la spécificité directionnelle de la plasticité synaptique longitudinale de CA1 en ciblant l'extrémité septale et temporelle de l'hippocampe. Nous avons également étudié la spécificité de couche de la plasticité synaptique longitudinale de CA1 en enregistrant des oriens de stratum et du radiatum de stratum de l'hippocampe. Pour les enregistrements in vivo, nous avons étudié les angles qui correspondent le mieux à la direction longitudinale de l'hippocampe.
Utilisant des enregistrements extracellulaires in vivo et in vitro de champ, nous avons observé que les neurones pyramidaux longitudinaux reliés de CA1 se sont présentés avec LTP, pas LTD. L'orientation transversale impliquant les neurones CA3 et CA1, cependant, soutient le LTP et le LTD. La distinction dans les capacités synaptiques entre la transversale et l'orientation longitudinale de l'hippocampe pourrait signifier de façon spéculative des différences dans leur connectivité fonctionnelle. D'autres expériences sont nécessaires pour déchiffrer les différences dans leurs capacités synaptiques.
Protocole
Tous les animaux ont été traités conformément aux lignes directrices et aux règlements du Laboratoire de soins aux animaux et d'utilisation du Laboratoire de l'Institut national de la santé. Toutes les méthodes décrites ici ont été approuvées par le Comité institutionnel de soins et d'utilisation des animaux (IACUC) de la City University de Hong Kong et de l'Université nationale d'Incheon.
1. Enregistrement in vivo sur le terrain
- Préparation animale
- Injecter de l'uréthane (0,06 g par poids de 25 g) par voie intrapéritone pour anesthésier la souris. Supplément avec injection intramusculaire d'atropine (0,05 mg/kg). Gardez la souris dans un endroit sombre et calme jusqu'à ce que l'anesthésie complète prenne effet.
CAUTION: L'uréthane a un potentiel cancérogène. Manipulez-le avec soin et portez des vêtements de protection pour éviter tout contact avec la peau exposée.
REMARQUE: Alternativement, l'isoflurane peut être utilisé comme anesthésie. - Vérifiez la profondeur de l'anesthésie par intermittence jusqu'à ce qu'un plan chirurgical complet de l'anesthésie prenne effet. Vérifiez la profondeur de l'anesthésie en effectuant le pincement d'orteil, le pincement d'oreille, le pincement de queue et les essais cornéens de contact pour observer la réponse de la souris aux stimulus physiques.
REMARQUE : Un mouvement réflexe ou volontaire ne doit pas être observé lorsque la souris est à un plan chirurgical complet d'anesthésie. - Pour l'essai de pincement d'orteil, étendre l'arrière ou l'avant-jambe de la souris et pincer fermement avec une paire de forceps émoussés ou des doigts. La souris n'est pas confirmée pour une anesthésie complète si elle retire la jambe ou secoue le corps, a une augmentation observable de la fréquence respiratoire ou fait des sons vocaux.
- Pour le test de pincement de l'oreille, pincez fermement les extrémités de la pinna avec une paire de forceps émoussés ou les doigts. L'anesthésie complète n'est pas confirmée si la souris déplace les moustaches vers l'avant, secoue la tête, émet des sons vocaux ou a une augmentation observable de la fréquence respiratoire.
- Pour l'essai de pincement de la queue, maintenez la queue de la souris doucement et fermement pincer avec un forcep émoussé ou un doigt. Aucun mouvement de la queue, son vocal ou augmentation observée de la fréquence respiratoire ne doit être observé lorsqu'il est entièrement anesthésié pour les interventions chirurgicales.
- Pour le test cornéen, touchez doucement la cornée de la souris, avec une mèche de coton. Aucun mouvement de paupière, mouvement de moustaches ou augmentation observable de la fréquence respiratoire ne devrait être observé une fois entièrement anesthésié pour la chirurgie.
- Raser les cheveux sur le cou et le crâne de la souris.
- Placez la souris entièrement anesthésiée sur un coussin chauffant réglé à 37 oC et insérez la sonde de température rectale dans le rectum. Cela permet à la chaleur produite par le coussin chauffant de s'ajuster en réponse aux changements de température corporelle de la souris.
- Appliquer du gel pour les yeux pour humidifier les yeux de la souris.
- Retirez doucement la langue sur le côté des lèvres à l'aide de forceps et fixez les deux dents avant dans le deuxième ou troisième trou de dents de l'instrument stéréotaxique. Fixer le crâne de la souris fermement à l'aide de la pince oculaire.
REMARQUE : Alternativement, une pince d'oreille stéréotaxique peut être employée. - En observant au microscope, séparer le tissu sous-cutané et les muscles à l'extrémité de l'os interpariétual et occipital de la souris avec un scalpel pour exposer la cisterna magna. Blot le dura mater sec avec un coton-tige.
- Perforez doucement la cisterna magna en faisant une coupe peu profonde avec une lame pointue pointue de scalpel pour drainer le fluide céphalo-rachidien (CSF). Fixer un coton-tige pour continuer à égoutter le FSC.
- Injecter de l'uréthane (0,06 g par poids de 25 g) par voie intrapéritone pour anesthésier la souris. Supplément avec injection intramusculaire d'atropine (0,05 mg/kg). Gardez la souris dans un endroit sombre et calme jusqu'à ce que l'anesthésie complète prenne effet.
- Craniotomie
- Tenir la peau sur le cuir chevelu avec des forceps, couper et enlever la peau avec une paire de ciseaux chirurgicaux. Couper assez de peau pour exposer les marques de bregma et lambda sur le cuir chevelu. Gardez la région exposée au sec.
- Ajustez le crâne serré de la souris pour permettre aux points bregma et lambda d'être alignés dans un niveau horizontal de hauteur similaire. Évitez d'incliner la tête dans la position antérieure-postérieure ou la position latérale médiale.
- Marquez les points correspondant à la région hippocampique à l'aide d'un étrier Vernier. Utilisez le cerveau de la souris dans un livre de coordonnées stéréotaxiques comme référence pour aider à déterminer les coordonnées exactes.
REMARQUE : L'emplacement à marquer pour l'incision pour l'hippocampe est 1 mm x 3 mm sur la ligne médiane appelée antérieure-postérieure (AP) utilisant le bregma comme point de référence, et 3 mm x 3 mm perpendiculaire à la ligne médiane (ML) pour relier les points sur la ligne médiane. Les coordonnées stéréotaxiques sont données comme (AP: 1,3 et ML: 3,3). - Faire une incision dans le crâne au-dessus de la région dorsale de l'hippocampe le long des points marqués à l'aide d'un scalpel ou d'une perceuse à grande vitesse tout en observant sous un microscope.
REMARQUE : Une ouverture rectangulaire de forme avec une taille de 2 mm x 3 mm devrait être obtenue après l'incision. Gardez la zone exposée propre pour éviter les blessures au cerveau. - Sortez soigneusement le crâne lâche avec des forceps pour exposer le dura mater et utilisez une seringue ou un goutte-à-goutte pour appliquer doucement la solution saline physiologique pour garder la surface humide.
- Retirez soigneusement la dura mater à l'aide d'aiguilles ou de pointes pointues pointues.
REMARQUE: Veillez à ne pas causer de dommages au tissu cérébral pendant la craniotomie. Cela conduira à l'enflure du cerveau et affectera les résultats. - Gardez le tissu cérébral exposé humide en appliquant de l'huile physiologique saline ou inerte à l'aide d'un goutte-à-goutte ou d'une seringue.
- Enregistrement in vivo
- Fixez et placez fermement l'électrode de stimulation et d'enregistrement dans le support stéréotaxique. Ajustez l'instrument stéréotaxique en fonction de la position des coordonnées AP et ML correspondantes pour la stimulation et l'enregistrement des électrodes au-dessus de l'hippocampe dorsal CA1.
REMARQUE : Utilisez le cerveau de la souris dans les coordonnées stéréotaxiques comme guide pour localiser les coordonnées de la région hippocampique longitudinale dorsilale CA1. Par exemple, une coordonnées stéréotaxiques pour la région hippocampique CA1 sera (AP 1.5, ML 1.0) pour l'électrode d'enregistrement et (AP 1.7, ML 1.5) pour l'électrode de stimulation. - Localiser l'électrode stimulante latérale à l'électrode d'enregistrement dans une direction longitudinale.
REMARQUE : Assurez-vous que les électrodes de stimulation et d'enregistrement sont propres avant utilisation. Cela empêche l'introduction du bruit lors de l'enregistrement. - Pour les enregistrements, utilisez des électrodes multicanaux. Tout d'abord, localiser les coordonnées stéréotaxiques pour la région hippocampique CA1 en utilisant le premier canal. Placez les électrodes restantes de telle sorte que l'angle de stimulation et d'enregistrement des électrodes se situe entre 30 et 60 degrés par rapport à la ligne médiane à partir du point de bregma.
REMARQUE : Cet angle correspond à l'orientation longitudinale de la région hippocampal de CA1. - Pour contrôler, localiser l'électrode d'enregistrement au-dessus de la région CA1 et l'électrode de stimulation au-dessus de la région CA3 de l'hippocampe dorsal. Par exemple, en utilisant le cerveau de la souris dans les coordonnées stéréotaxiques comme guide, une coordonnées stéréotaxiques pour la région hippocampique CA1-CA3 sera (AP 1.8, ML 1.0) pour l'électrode d'enregistrement et (AP 1.5, ML 1.5) pour l'électrode de stimulation.
REMARQUE : Cette étape est un contrôle alternatif et doit être effectuée dans une expérience distincte. - Placez l'électrode de référence à une partie distale de la région du cerveau exposée ou sous la peau de la souris.
- Activez le système d'enregistrement.
- Ouvrez le logiciel pour l'enregistrement et l'acquisition de données.
REMARQUE : Différents laboratoires ont leur logiciel préféré pour l'enregistrement et l'acquisition de données. - En observant au microscope, abaisser lentement les électrodes d'enregistrement et de stimulation à l'aide du micromanipulateur jusqu'à ce qu'il touche juste la surface du cerveau. Marquez le point comme le point zéro pour commencer à calculer la profondeur précise à la région hippocampal.
REMARQUE : Le micromanipulateur peut être utilisé pour surveiller la profondeur à laquelle l'électrode est insérée à un moment donné. Observez une augmentation de l'impédance juste au moment où l'électrode touche la surface du cerveau. - Baissez lentement les électrodes à la profondeur approximative correspondant aux coordonnées stéréotaxiques choisies pour l'hippocampe CA1.
REMARQUE : Utilisez le cerveau de la souris dans des coordonnées stéréotaxiques comme guide pour obtenir la profondeur approximative correspondant aux coordonnées stéréotaxiques choisies. - Donner de la stimulation (durée de 100 degrés, répétée à des intervalles de 30 s) et ajuster la profondeur de l'électrode par étapes de 50 m ou moins jusqu'à ce qu'un potentiel postynaptique excitatoire de champ évoqué stable (fEPSP) soit observé.
REMARQUE : Un stimulus de 20 A est habituellement suffisant pour évoquer une réponse observable. - Assurez-vous qu'un fEPSP stable a été évoqué en variant l'intensité de stimulus. Une augmentation notable de la pente ou de l'amplitude du fEPSP devrait être observée à chaque augmentation de l'intensité de stimulation. C'est ce qu'on appelle la courbe entrée-sortie. Créer une courbe d'entrée-sortie (I-O) pour détecter l'intensité maximale de stimulus à laquelle il n'y a plus d'augmentation de la pente du fEPSP évoqué (figure 6).
REMARQUE : Jetez les données et changez la position de l'électrode si la volée de fibres disparaît pendant l'expérience. - Utilisez la courbe entrée-sortie pour définir l'intensité de base à 40 - 50% du maximum. Utilisez l'intensité de stimulus correspondante pour l'enregistrement de base.
- Enregistrez le potentiel de terrain local comme référence de 20 à 30 min.
- Utilisez la même courbe entrée-sortie pour définir l'intensité de stimulus pour évoquer la stimulation à haute fréquence (HFS) ou le tétanos à 75% de l'intensité maximale. Alternativement, en induisant la dépression à long terme, maintenez la même intensité de stimulus utilisée pour enregistrer la ligne de base en évoquant la stimulation à basse fréquence (LFS).
- Appliquer une stimulation tetanique de 100 impulsions Hz 4 fois avec un intervalle de 10 s pour induire Le LTP.
REMARQUE : Utilisez ce protocole uniquement lorsque vous travaillez sur une expérience de potentialisation à long terme. - Appliquer une stimulation à basse fréquence de 5 Hz (900 stimuli pendant 3 min), 1 Hz LFS (900 stimuli pendant 15 min), ou 1 Hz paired-pulse (50 ms d'intervalle d'impulsion sappariée, 900 paires de stimuli pendant 15 min) pour induire l'LTD selon des protocoles déjà établis.
REMARQUE : Utilisez ces protocoles uniquement lorsque vous travaillez sur une expérience de dépression à long terme. - Enregistrez le potentiel de champ local pour 1 h après HFS ou LFS, alternativement.
- Exporter des données et analyser à l'aide du logiciel.
- Vérifier la position de l'électrode d'enregistrement et de stimulation en donnant une stimulation de 10 à un courant pour 30 s pour lésionr les zones enregistrées. Perfuse transcardialement la souris avec 4% de paraformaldéhyde et de récolter le cerveau pour trancher et tacher avec Cresyl Violet selon.
- Euthanasier la souris par luxation cervicale ou injection de dosage anesthésique mortel après l'expérience.
- Fixez et placez fermement l'électrode de stimulation et d'enregistrement dans le support stéréotaxique. Ajustez l'instrument stéréotaxique en fonction de la position des coordonnées AP et ML correspondantes pour la stimulation et l'enregistrement des électrodes au-dessus de l'hippocampe dorsal CA1.
2. Enregistrement in vitro sur le terrain
- Préparation de solutions de découpe oxygénée et de liquide céphalo-rachidien artificiel (ACSF)
- Pour 2 L de solution de découpage, ajouter environ 1 L d'eau double distillée dans un flacon volumétrique et remuer vigoureusement sur une plaque d'agitation.
- Ajouter les composants suivants de la solution de tranchage (en mM): 87,0 NaCl, 2,5 KCl, 1,3 NaH2PO4, 25,0 NaHCO3, 25,0 glucose, 75,0 sucrose, 7,0 MgCl2.6H2O et 0,5 CaCl22H2O (Tableau 1).
REMARQUE : Alternativement, mgCl26H2O et CaCl2x 2H2O peuvent être exclus à ce stade et ajoutés plus tard dans un volume prêt à l'emploi. - Garnir jusqu'à 2 L d'eau double distillée en remuant vigoureusement.
- Pour 2 L d'ACSF, ajouter environ 1 L d'eau double distillée dans un flacon volumétrique et remuer vigoureusement sur une plaque d'agitation.
- Ajouter les composants suivants de la solution ACSF (en mM): 125,0 NaCl, 2,5 KCl, 1,3 NaH2PO4, 25,0 NaHCO3, 25 glucose, 1,0 MgCl26H2O et 2,0 CaCl2'2H2O (Tableau 1).
REMARQUE : Alternativement, MgCl2.6H2O et CaCl22H2O peuvent être exclus à ce stade et ajoutés plus tard dans un volume prêt à l'emploi. - Garnir jusqu'à 2 L d'eau double distillée en remuant vigoureusement.
- Configuration et découpage du cerveau
- Verser 400 ml de solution de découpe déjà préparée dans un flacon séparé et oxygéner (95 % O2/5 % CO2) pendant environ 20 min.
- Conserver le reste de la solution de 1,6 L dans un réfrigérateur de 4 oC. Gardez la solution jusqu'à 1 semaine après laquelle elle doit être jetée si elle n'est pas utilisée pour éviter la croissance fongique.
- Verser 200 ml de la solution de tranchage oxygénée dans le flacon, couvrir de parafilm et transférer dans un congélateur de -80 oC pendant environ 20 min pour faire une neige fondante.
- Verser les 200 ml restants de solution de découpe dans une chambre de retenue de tranche de cerveau et conserver dans un bain d'eau de 32 oC avec bouillonnement continu.
- Préparer le banc pour trancher. Placez les serviettes en papier vers le bas et les outils chirurgicaux sur le dessus du banc. Disposer les outils chirurgicaux par ordre d'utilisation pour faciliter un processus rapide et efficace (figure 7).
- Sortez la solution de coupe réfrigérée du congélateur et versez environ 50 ml dans un bécher. Verser environ 10 ml dans un plat Petri contenant du papier filtre pour l'humidifier. Placez-les sur la glace près de la zone de dissection.
- Verser le reste de la solution de tranchage glissée dans la chambre de tranchage et la fixer sur le vibratome.
- Anesthésiez la souris à l'isoflurane en utilisant des lignes directrices et des règlements sur les soins aux animaux et l'utilisation du laboratoire du National Institute of Health, et les méthodes approuvées du Comité institutionnel d'utilisation et de soins des animaux de l'Université de la ville de Hong Kong et d'Incheon National université.
- Décapiter la souris anesthésiée avec une paire de ciseaux et placer la tête sur du papier de soie. Couper la peau couvrant le crâne de la souris et couper à travers les muscles cutanés avec des ciseaux. Couper les plaques du crâne le long de la ligne médiane à l'os occipital à l'aide de ciseaux chirurgicaux.
- Ouvrez le crâne avec des forceps émoussés pour exposer le cerveau. Retirez délicatement le cerveau à l'œil d'une spatule et placez-le dans la solution de coupe réfrigérée dans le bécher. Attendez environ 30 s.
- Sortez le cerveau à l'aide de la cuillère et placez-le soigneusement sur le papier filtre préalablement humidifié dans le plat Petri.
- Séparez les deux hémisphères cérébraux le long de la ligne médiane avec une lame de scalpel. Isolez l'hippocampe en le détachant doucement du cortex à l'' air d'une spatule et placez-le soigneusement sur le papier filtre humidifié. Découpez l'extrémité septale et temporelle de l'hippocampe isolé à l'aide du scalpel.
- Ramassez l'hippocampe isolé à l'aide d'une spatule émoussée et d'une brosse. Tamponner doucement la spatule sur un papier de soie pour enlever l'excès d'eau.
- Appliquer une petite quantité de colle sur la plaque de tranchage du vibratome.
- Pour une tranche hippocampal ca1 longitudinale, attachez la région CA3 de l'hippocampe à la plaque de tranchage avec la colle. Placez-le rapidement mais soigneusement dans la chambre de tranchage du vibratome contenant la solution de découpe oxygénée réfrigérée.
- Pour la tranche transversale qui servira de contrôle, attachez l'extrémité ventrale de l'hippocampe à la plaque de tranchage du vibratome. Placez-le rapidement mais soigneusement dans la chambre de tranchage contenant la solution de dissection oxygénée réfrigérée.
REMARQUE : Cette étape est une alternative à l'étape ci-dessus et doit être effectuée séparément. - Placez l'angle de la lame à 90 degrés. Définiz les paramètres vibratomes à une vitesse de 0,05 mm/s, une amplitude de 1,20 mm et une épaisseur de tranche de 400 m.
- Trancher l'hippocampe attaché avec le vibratome.
REMARQUE: Une bonne tranche de cerveau hippocampal longitudinal CA1 aura une couche de CA1 et 2 couches de gyrus denté. Un maximum de 2 bonnes tranches hippocampales peuvent être obtenues. Alternativement, une tranche transversale de cerveau hippocampal aura les régions de dentation de gyrus, CA3 et CA1 intactes. - Transférer les tranches de cerveau hippocampal longitudinales du vibratome avec une pipette et l'incuber dans la chambre de retenue de tranche de cerveau dans le bain d'eau.
- Incuber les tranches dans le bain d'eau pendant 20 min à une température de 32 oC et les faire sortir à la température ambiante pendant 30 min de récupération.
REMARQUE : Sinon, transférez la tranche de cerveau lorsqu'elle sort du bain d'eau et placez-la délicatement dans la chambre d'enregistrement avec l'ACSF oxygéné qui coule à une température de 32 oC pendant 30 min de récupération. - Pendant l'incubation dans le bain d'eau, versez 400 mL de solution ACSF dans un flacon séparé et oxygéner (95% O2/5% CO2) pendant environ 20 - 30 min avant de transférer la tranche de cerveau dans la chambre d'enregistrement. Surfillez continuellement l'ACSF dans la chambre d'enregistrement à une vitesse de 2 ml/min.
- Allumez le contrôleur de température pour chauffer l'ACSF qui coule à 32 oC.
- Conserver le reste de la solution de 1,6 L dans un réfrigérateur de 4 oC. Gardez la solution jusqu'à une semaine après laquelle elle doit être jetée si elle n'est pas utilisée pour éviter la croissance fongique.
- Enregistrement in vitro
- Configurez une plate-forme d'enregistrement en allumant tout le matériel nécessaire.
- Transférer la tranche de cerveau de la chambre de retenue de tranche dans la chambre d'enregistrement. Ajuster la position de la tranche de cerveau avec des forceps émoussés et la maintenir en place avec une harpe. Laisser l'ACSF fonctionner pendant au moins 20 min. Cela permet à la tranche de cerveau d'être stable avant l'enregistrement.
- Remplissez la pipette d'enregistrement avec ACSF comme solution interne.
- Vérifiez la résistance à la pipette d'enregistrement avec le logiciel désigné. La résistance à la pipette d'enregistrement doit être dans la plage de 3-5 M.
- Activez le logiciel pour l'acquisition de données. Ce logiciel doit avoir des fonctionnalités similaires qui permettent l'acquisition de données d'une manière similaire à celle des enregistrements in vivo montrés précédemment.
- Fixez fermement l'enregistrement et les électrodes de stimulation dans le support de l'instrument stéréotaxique. Placez l'électrode de référence dans l'ACSF dans la chambre d'enregistrement.
- Pour les tranches longitudinales, positionnez l'électrode de stimulation et d'enregistrement dans la strate oriens (S.O.). Maintenez la distance entre les électrodes à environ 300 à 500 m. Placez l'électrode de stimulation sur le côté septal ou temporel de la tranche cérébrale et enregistrez à partir de la même couche (figure 8).
- Sinon, placez l'électrode de stimulation et d'enregistrement dans le radiatum de strate (S.R.). Placez l'électrode de stimulation sur le côté septal ou temporel de la tranche cérébrale.
- Pour les tranches transversales comme commande, placez l'électrode stimulante sur la région CA3 (voie collatérale Schaffer) et l'électrode d'enregistrement sur la région CA1 (figure 9).
REMARQUE : Il s'agit d'une étape de contrôle alternative et doit être effectuée dans une expérience distincte. - Allumez le générateur de stimulus isolé et donnez la stimulation (durée de 100 euros, répétée à des intervalles de 30 s). Ajuster la profondeur et/ou la position de l'électrode d'enregistrement jusqu'à ce qu'un potentiel de champ postsynaptique excitateur éminencitant stable soit observé.
- Assurez-vous qu'un fEPSP stable a été évoqué en variant l'intensité de stimulus. Un changement notable dans la pente du fEPSP devrait être observé à chaque changement d'intensité de stimulus. C'est ce qu'on appelle la courbe entrée-sortie. Créer une courbe d'entrée-sortie (I-O) pour détecter l'intensité maximale de stimulation à laquelle il n'y a plus d'augmentation de la pente du FEPSP (figure 6).
REMARQUE : Jetez les données et changez la position de l'électrode si la volée de fibres disparaît pendant l'expérience. - Utilisez la courbe entrée-sortie pour définir l'intensité de stimulation pour l'enregistrement de ligne de base et pour évoquer la stimulation à haute fréquence (HFS) ou le tétanos à 30-40% du fEPSP maximum évoqué.
- Alternativement, pour les expériences concernant ltd, utilisez la courbe d'entrée-sortie pour définir l'intensité de base pour l'enregistrement de ligne de base et pour évoquer la stimulation à basse fréquence (LFS) à 70% de la fEPSP maximale évoquée.
- Enregistrez le potentiel de terrain local comme référence de 20 à 30 min.
- Appliquer HFS de 100 impulsions Hz deux fois avec un intervalle de 30 s pour induire LTP.
- Alternativement, pour les expériences LTD, appliquer la stimulation à basse fréquence de 5 Hz (900 stimuli pendant 3 min) ou 1 Hz LFS (900 stimuli pendant 15 min) ou 1 Hz paired-pulse (50 ms d'intervalle d'impulsion sappariée, 900 paires de stimuli pendant 15 min) pour induire LTD selon déjà protocole établi.
- Enregistrez le potentiel de terrain local pour 1 h après HFS ou LFS.
- Données d'exportation et d'analyse.
Résultats
Nous avons exploré la plasticité synaptique à long terme des neurones pyramidaux longitudinals de CA1 de l'hippocampe utilisant des enregistrements extracellulaires de champ in vivo et in vitro. Le LTP et le LTD sont des facettes de plasticité synaptique à long terme qui ont été démontrées dans l'axe transversal de l'hippocampe pour être unidirectionnelles.
Nous avons montré ici que l'utilisation de tranches de cerveau hippocampal longitudinales, il y a LTP dans l'axe longitudinal ca1 de l'hippocampe. Nous avons préparé des tranches longitudinales de l'hippocampe le long de l'axe septotemporal, qui est perpendiculaire aux tranches transversales (Figure 1). En utilisant des enregistrements de la région CA1 de l'hippocampe, nous avons montré la présence de LTP qui n'était pas la direction spécifique. Il n'y avait aucune différence statistiquement significative dans les enregistrements du côté septal ou temporel (figure 2) de la tranche longitudinale de cerveau hippocampal. Nous avons également montré la présence de LTP qui n'était pas spécifique à la couche; ainsi, les enregistrements du radiatum de strate et des oriens de stratum (figure 2) ont montré avec succès induit lTP dans la tranche longitudinale de cerveau. Nous avons utilisé D-AP5, un antagoniste NMDAR pour démontrer que le LTP induit dépendait des récepteurs NMDA (Figure 3). Ce qui se passe in vitro ne reflète pas nécessairement les conditions in vivo, alors nous avons étudié le LTP in vivo. Figure 4 a montre un diagramme schématique de l'électrode de stimulation et d'enregistrement positionnée dans l'hippocampe dorsal le long de l'axe longitudinal de la région de CA1 in vivo. La position des électrodes utilisées pour l'enregistrement et la stimulation a été vérifiée par des marques de lésions et des taches de violette cristalline (Figure 4a). Nous avons démontré la présence de LTP in vivo dans la région longitudinale CA1 (Figure 4b).
En utilisant des protocoles déjà établis pour induire la Ltd, nous n'avons pas réussi à induire la Ltd in vivo et in vitro (Figure 5).

Figure 1 . Un dessin schématique des tranches de cerveau hippocampal transversales et longitudinales. Ce chiffre est adapté et modifié à partir de Sun et coll. 201821. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
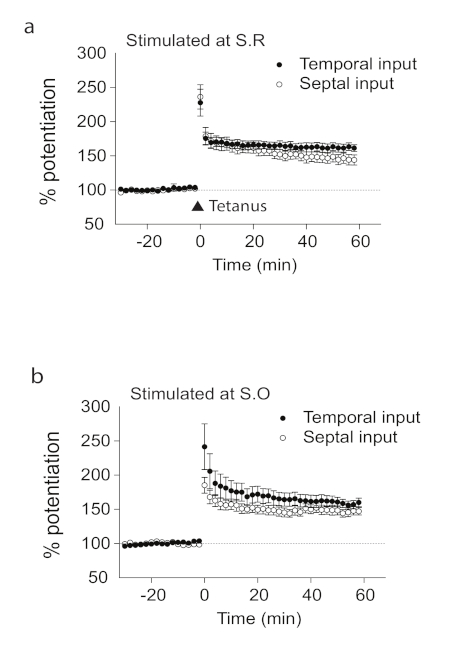
Figure 2 . LTP en tranches longitudinales. Les réponses synaptiques à S.R. (a) ou S.O. (b) dans les tranches longitudinales sont potentialisées juste après stimulation du tétanos avec des entrées temporelles et septales (S.R./temporal (n - 12, c), S.R./septal (n ' 12, c), S.O./temporal (n . 9, d).
Le n représente le nombre de tranches. Les barres d'erreur représentent SE. Ce chiffre est adapté et modifié à partir de Sun et coll. 201821. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 3 . LTP dépendant de NMDAR en tranches longitudinales. (a,b) L'induction de LTP dans la direction temporelle et septale est bloquée par 50 M D-AP5 (temporel, n '6, a) (septal, n '5, b). (c,d) L'induction de LTP dans la direction temporelle et septale est également bloquée par D-AP5. Le n signifie des tranches. Les barres d'erreur représentent SE. Ce chiffre est adapté et modifié à partir de Sun et coll. 201821. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 4 . LTP in vivo dans le réseau interlamellar. (a) Un dessin schématique d'électrodes d'enregistrement et de stimulation chez les animaux anesthésiés. Les loci de l'enregistrement (sur le côté septal de CA1) et des électrodes stimulantes (sur le côté temporel de CA1) ont été identifiés par des marques de lésion. (b) Le LTP est induit dans la connexion interlamellar par une stimulation à haute fréquence de 100 Hz (HFS) (n - 10 souris). Traces de couleurs : avant (noir) et après (rouge) HFS. Les barres d'erreur représentent SE. Ce chiffre est adapté et modifié à partir de Sun et coll. 201821. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 5 . Absence de LTD in vivo et in vitro dans le réseau Ca1 d'Interlamellar. (a) 1 Hz-pp LFS n'induise pas in vivo LTD. (b) 1 Hz pp-LTP, (c) 5 Hz LFS, et (d) 1 Hz LFS ne produisent pas ltd sur les côtés temporels ou septaux de la tranche cérébrale longitudinale. tandis que la LTD est induite par 1 Hz pp-LFS en tranches transversales : temporelle (n ' 8), septale (n - 11) et transversale (n - 6) avec 1 Hz pp-LFS; temporel (n - 3) et septal (n - 3) avec 5 Hz LFS; temporel (n - 3) et septal (n - 3) avec 1 Hz LFS. Le n signifie des tranches. Les barres d'erreur représentent SE. Ce chiffre est adapté et modifié à partir de Sun et coll. 201821. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 6 . Courbe d'entrée-sortie présentant la pente de fEPSP en réponse à l'entrée croissante de stimulus dans la tranche hippocampal de cerveau. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 7 . Outils chirurgicaux utilisés pour l'isolement hippocampique pendant le découpage in vitro de cerveau. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 8 . Une tranche de cerveau longitudinale prête pour l'enregistrement. L'électrode de stimulation et la pipette d'enregistrement sont insérées dans le radiatum de strate. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 9 . Une tranche de cerveau hippocampal transversale prête pour l'enregistrement. L'électrode de stimulation est insérée dans la région CA3 collatérale de Schaffer et la pippette d'enregistrement est insérée dans la région de CA1. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
| enceinte | Solution de découpage(mM) | ACSF (mM) |
| CaCl2.2H2O | 0.5 | 2 |
| glucose | 25 | 25 |
| Kcl | 2.5 | 2.5 |
| MgCl2.6H2O | 7 | 1 |
| Nacl | 87 | 125 |
| NaH2PO4 | 1.3 | 1.3 |
| NaHCO3 Annonces | 25 | 25 |
| Saccharose | 75 |
Tableau 1 : Concentrations de composés dans les tranches de cerveau et les solutions artificielles de fluide céphalo-rachidien.
Discussion
Le protocole démontre la méthode pour induire la plasticité synaptique à long terme in vivo aussi bien que des tranches de cerveau dans l'axe longitudinal de CA1-CA1 de l'hippocampe in vitro. Les étapes décrites donnent assez de détails pour qu'un expérimentateur étudie le LTP et le LTD dans une connexion longitudinale hippocampal CA1-CA1. La pratique est nécessaire pour parfaire les compétences requises pour enregistrer avec succès les potentiels excitatoires sur le terrain.
En plus d'avoir besoin de pratique, il y a plusieurs étapes critiques qui sont essentielles pour obtenir de bons résultats. Tout d'abord, il a été démontré précédemment que l'angle auquel les tranches de cerveau ont été faites pourrait soit tronquer ou préserver les projections longitudinales des neurones pyramidaux dans la région CA1-CA1 de l'hippocampe16. Les neurones pyramidaux longitudinals projettent des neurones transversaux à un angle qui est presque perpendiculaire. Comme les neurones CA1 se propagent sous divers angles dans l'hippocampe, la connexion longitudinale entre eux s'étend le long de l'axe dorsoventral de l'hippocampe. Ainsi, pour l'enregistrement in vitro, l'expérimentateur doit garder cela à l'esprit pour cibler avec précision les neurones hippocampiques CA1-CA1 le long de l'axe longitudinal en coupant le tissu isolé de l'hippocampe le long de l'axe dorsal-ventral. En outre, pour les enregistrements in vivo, l'angle auquel la stimulation et les électrodes d'enregistrement sont positionnés détermine si les résultats obtenus sont représentatifs de l'axe longitudinal ou d'un mélange de l'axe transversal et longitudinal. D'autres enquêtes utilisant CRISPR-Cas9 peuvent être faites pour confirmer si la réponse évoquée provient uniquement de la région CA1 puisqu'il pourrait s'agit d'un mélange de réponses des régions CA1 et CA3.
Deuxièmement, pour les expériences in vitro, l'expérimentateur doit s'assurer que la solution de découpe du cerveau, l'ACSF, le banc de travail et tous les équipements ou instruments qui entrent en contact avec la tranche de cerveau sont exempts de contaminants. Toute forme de contamination entraînera la détérioration de l'intégrité ou la mort de la tranche de cerveau. Le maintien d'une surface d'électrode propre assurera des enregistrements bons et stables pour les expériences in vitro et in vivo.
Nous avons montré que le réseau longitudinal hippocampal CA1 présente des LTP dépendants des NMDAR, mais pas des LTD. Le circuit trisynaptique, cependant, présente avec lTP et LTD22,23. Cela implique que le réseau longitudinal CA1 et les circuits tri-synaptiques ont des caractéristiques uniques. Notre protocole n'utilise que des enregistrements électrophysiologiques et est donc limité à trouver la différence entre ces deux réseaux.
La recherche d'un remède pour les maladies du cerveau telles que la schizophrénie se poursuit. Le déclin ou la déformation des sous-régions hippocampiques CA1 ont été liés à certains symptômes schizophrènes24,25. L'application de notre protocole, bien que de base, a mis en lumière une capacité synaptique unique de la sous-région hippocampique longitudinale CA1. Cette connaissance est utile en concevant des expériences qui peuvent étudier plus avant cette maladie débilitante de cerveau le long de l'axe longitudinal de CA1 de l'hippocampe.
Déclarations de divulgation
Nous n'avons rien à divulguer.
Remerciements
Ce travail a été soutenu par Incheon National University (International Cooperative) Research Grant. Nous tenons à remercier Mme Gona Choi d'avoir aidé à la collecte de données.
matériels
| Name | Company | Catalog Number | Comments |
| Atropine Sulphate salt monohydrate, ≥97% (TLC), crystalline | Sigma-Aldrich | 5908-99-6 | Stored in Dessicator |
| Axon Digidata 1550B | |||
| Calcium chloride | Sigma-Aldrich | 10035-04-8 | |
| Clampex 10.7 | |||
| D-(+)-Glucose ≥ 99.5% (GC) | Sigma-Aldrich | 50-99-7 | |
| Eyegel | Dechra | ||
| Isoflurane | RWD Life Sciences | R510-22 | |
| Magnesium chloride hexahydrate, BioXtra, ≥99.0% | Sigma-Aldrich | 7791-18-6 | |
| Matrix electrodes, Tungsten | FHC | 18305 | |
| Multiclamp 700B Amplifier | |||
| Potassium chloride, BioXtra, ≥99.0% | Sigma-Aldrich | 7447-40-7 | |
| Potassium phosphate monobasic anhydrous ≥99% | Sigma-Aldrich | 7778-77-0 | Stored in Dessicator |
| Pump | Longer precision pump Co., Ltd | T-S113&JY10-14 | |
| Silicone oil | Sigma-Aldrich | 63148-62-9 | |
| Sodium Bicarbonate, BioXtra, 99.5-100.5% | Sigma-Aldrich | 144-55-8 | |
| Sodium Chloride, BioXtra, ≥99.5% (AT) | Sigma-Aldrich | 7647-14-5 | |
| Sodium phosphate monobasic, powder | Sigma-Aldrich | 7558-80-7 | |
| Sucrose, ≥ 99.5% (GC) | Sigma-Aldrich | 57-50-1 | |
| Temperature controller | Warner Instruments | TC-324C | |
| Tungsten microelectrodes | FHC | 20843 | |
| Urethane, ≥99% | Sigma-Aldrich | 51-79-6 | |
| Vibratome | Leica | VT-1200S | |
| Water bath | Grant Instruments | SAP12 |
Références
- Levy, W. B. A sequence predicting CA3 is a flexible associator that learns and uses context to solve hippocampal-like tasks. Hippocampus. 6 (6), 579-590 (1996).
- Eldridge, L. L., Knowlton, B. J., Furmanski, C. S., Bookheimer, S. Y., Engel, S. A. Remembering episodes: A selective role for the hippocampus during retrieval. Nature Neuroscience. 3 (11), 1149-1152 (2000).
- Sullivan Giovanello, K., Schnyer, D. M., Verfaellie, M. A critical role for the anterior hippocampus in relational memory: evidence from an fMRI study comparing associative and item recognition. Hippocampus. 14 (1), 5-8 (2004).
- Andersen, P., Bland, B., Dudar, J. D. Organization of the hippocampal output. Experimental Brain Research. 17 (2), 152-168 (1973).
- Andersen, P., Bliss, T. V. P., Skrede, K. K. Lamellar organization of hippocampal excitatory pathways. Experimental Brain Research. 13 (2), 222-238 (1971).
- Sloviter, R., Lømo, T. Updating the Lamellar Hypothesis of Hippocampal Organization. Frontiers in Neural Circuits. 6 (102), (2012).
- Ishizuka, N., Weber, J., Amaral, D. G. Organization of intrahippocampal projections originating from CA3 pyramidal cells in the rat. Journal of Comparative Neurology. 295 (4), 580-623 (1990).
- Tamamaki, N., Nojyo, Y. Crossing fiber arrays in the rat hippocampus as demonstrated by three-dimensional reconstruction. Journal of Comparative Neurology. 303 (3), 435-442 (1991).
- Swanson, L., Wyss, J., Cowan, W. An autoradiographic study of the organization of intrahippocampal association pathways in the rat. Journal of Comparative Neurology. 181 (4), 681-715 (1978).
- Rebola, N., Carta, M., Mulle, C. Operation and plasticity of hippocampal CA3 circuits: implications for memory encoding. Nature Reviews Neuroscience. 18 (4), 208(2017).
- Papaleonidopoulos, V., Trompoukis, G., Koutsoumpa, A., Papatheodoropoulos, C. A gradient of frequency-dependent synaptic properties along the longitudinal hippocampal axis. BMC Neuroscience. 18 (1), 79(2017).
- Hampson, R. E., Simeral, J. D., Deadwyler, S. A. Distribution of spatial and nonspatial information in dorsal hippocampus. Nature. 402, 610(1999).
- Umeoka, S. C., Lüders, H. O., Turnbull, J. P., Koubeissi, M. Z., Maciunas, R. J. Requirement of longitudinal synchrony of epileptiform discharges in the hippocampus for seizure generation: a pilot study. Journal of Neurosurgery. 116 (3), 513-524 (2012).
- Fanselow, M. S., Dong, H. W. Are the dorsal and ventral hippocampus functionally distinct structures. Neuron. 65, (2010).
- Milior, G., et al. Electrophysiological properties of CA1 pyramidal neurons along the longitudinal axis of the mouse hippocampus. Scientific Reports. 6, (2016).
- Yang, S., et al. Interlamellar CA1 network in the hippocampus. Proceedings of the National Academy of Sciences. 111 (35), 12919-12924 (2014).
- Tsien, J. Z., Huerta, P. T., Tonegawa, S. The Essential Role of Hippocampal CA1 NMDA Receptor–Dependent Synaptic Plasticity in Spatial Memory. Cell. 87 (7), 1327-1338 (1996).
- Bliss, T., Collingridge, G. A synaptic model of memory: long-term potentiation in the hippocampus. Nature. 361, 31-39 (1993).
- Roman, F., Staubli, U., Lynch, G. Evidence for synaptic potentiation in a cortical network during learning. Brain Research. 418 (2), 221-226 (1987).
- McNaughton, B., Barnes, C., Rao, G., Baldwin, J., Rasmussen, M. Long-term enhancement of hippocampal synaptic transmission and the acquisition of spatial information. Journal of Neuroscience. 6 (2), 563-571 (1986).
- Sun, D. -g, et al. Long term potentiation, but not depression, in interlamellar hippocampus CA1. Scientific Reports. 8 (1), 5187(2018).
- Stepan, J., Dine, J., Eder, M. Functional optical probing of the hippocampal trisynaptic circuit in vitro: network dynamics, filter properties, and polysynaptic induction of CA1 LTP. Frontiers in Neuroscience. 9, 160(2015).
- Milner, A. J., Cummings, D. M., Spencer, J. P., Murphy, K. P. Bi-directional plasticity and age-dependent long-term depression at mouse CA3-CA1 hippocampal synapses. Neuroscience Letters. 367 (1), 1-5 (2004).
- Bogerts, B., et al. Hippocampal CA1 deformity is related to symptom severity and antipsychotic dosage in schizophrenia. Brain. 136 (3), 804-814 (2013).
- Ho, N. F., et al. Progressive Decline in Hippocampal CA1 Volume in Individuals at Ultra-High-Risk for Psychosis Who Do Not Remit: Findings from the Longitudinal Youth at Risk Study. Neuropsychopharmacology. 42, 1361(2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon