Method Article
In Situ ハイブリダイゼーションアステュアナクス胚の Wholemount
要約
このプロトコルは、胚のアステュアナクス血脈遺伝子発現可視化を実現。 にします。このアプローチは非特異染色を最小限に抑えながら遺伝子式信号を最大の目標としてきた.
要約
近年、たくさんの遺伝子のシーケンスの身元を明かす、盲目のメキシコの血脈 (アステュアナクス メキシコ) のゲノムがリリースされています。この新たなモデル システムに先行研究は、様々 な洞窟を伴う表現型に関連付けられている多数の量的形質遺伝子座 (QTL) を識別した広範囲のゲノム広い調査の資本金。ただし、表現型変化の遺伝の基礎に興味のある遺伝子を接続する能力は重要な課題です。Troglomorphic の進化の役割のより深い理解を容易にすることができます 1 つの方法は、ホール マウント in situ ハイブリダイゼーションです。この手法を実装して、直接洞窟と表面の住居形態の間の遺伝子発現を比較、確立された QTL を根底にある遺伝子の候補者を指名、次世代シーケンシングの研究から興味のある遺伝子を識別または他を開発できます。検出ベースのアプローチ。このレポートで広く研究から開発されたシステムを越えての使用のために合わせることができる柔軟性の高いチェックリストによってサポートされている単純なプロトコルを提案します。このプロトコルのアステュアナクスコミュニティの内外に広範なリソースとして使用できることが望まれます。
概要
In situ ハイブリダイゼーションは、遺伝子発現パターン1を視覚化する固定ティッシュの汚損のための一般的な方法です。この手法を他の伝統的な2および非伝統的な3モデル システムでは、さまざまな生物学的研究の年行った。ただし、いくつかの手順と試薬は、この手順を正常に実行する必要です。この手法を実行したことがない者は、プロセスを開始する多くの手順のおかげで威圧的なことができます。さらに、この手順の長い性質は、トラブルシューティングに挑戦することができます技術的なエラーに適しています。
この記事の全体的な目標は、幅広い視聴者にアクセス可能なこの交配の技術を表示するシンプルで簡単な方法を提示することです。エラーの概要を減らすためには、質の高い遺伝子式染色が得られますし、非固有バック グラウンド信号を最小限に抑える簡単な方法を提案する.この手順は、他の動脈分布4などの伝統的なモデル システム開発のアプローチに似ています。ここでは、慎重に慎重に実装されたプロトコルを促進するためにダウンロード可能なチェックリスト (補足ファイル 1) を使用して各ステップの実装を容易にするために目指しています。これを行うための理論的根拠は、この手順に関与する多くのステップを介して組織を促進することです。この記事が、初期胚ホール マウント in situ ハイブリダイゼーションを行うに興味がある研究者の適切な手順をまだ実行していません。アステュアナクス研究者の選択した方法の利点はことそれが試され、血脈の表層魚群モーフ、これにより比較表現の分析を促進します。アステュアナクスおよび他のシステムの研究で研究者によって提示されたメソッドを使用できます。
プロトコル
ここで説明したすべてのメソッドは、機関動物ケアおよび使用委員会 (IACUC) シンシナティ大学 (プロトコル #10-01-21-01) によって承認されています。
1. 固定
- 飼育槽からアステュアナクス メキシコ胚の適切な数を特定し、一度に 50 〜 胚を修正します。胚は大きく、古い場合も固定して時に 25 を修正する必要があります。
- 胚の年齢に応じて麻酔 IACUC 承認法を活用します。機能系と古い胚のため麻酔薬過量投与による胚を犠牲に。したがって、痛みや有機体のための不快感を最小限に抑える (pH 7.4 にバッファリング) ~ 1 %tricaine 溶液に胚を配置します。
- 胚が反応するタッチ、tricaine を含むシステム水を交換し、リン酸緩衝生理食塩水 (PBS、pH 7.4) x 1 〜 1 mL を追加します。
- PBS のソリューションを削除し、4% パラホルムアルデヒド (PFA) の 1 つの mL を追加します。4 ° C で一晩胚を修正します。
注意: PFA は (すなわち、それは可燃性と皮膚と肺の刺激) は危険、取り扱い注意。
2. 脱水症状
- 胚を脱水、固定液 1 mL の PBS ですすいでください。リンス中にプラットフォーム シェーカーに角度 (30 ° と 45 °) の間でバイアルを胚芽入りを配置します。胚は 2 回、洗浄あたり 5 分を洗浄し続けます。
- 胚では、絨毛膜がある、すべて 50 胚を 100 mm × 25 mm シャーレに置き、この慎重に顕微鏡下で時計職人の鉗子 (#5 鉗子など) の 2 つのセットを使用して絨毛からそれらを分離します。
注: 手順とプロトコルの残りのため中から慎重に取り外しますすべて液体クリーンを使用して前の手順、次の解決策を追加する前にガラス パスツール ピペット - メタノール (メタノール) 下記のますます集中している洗浄のシリーズで胚を脱水します。希釈は、各 4 mL バイアルに入る液の 500 μ L で 1 mL の容量に基づいています。シェーカーのプラットフォームに室温 (RT) ですべての脱水の手順を実行します。
- PBS ソリューションを慎重に取り外します。25% メタノール溶液 (メタノールの 250 μ L) + 750 μ L の PBS を追加します。軽く 5 分プラットフォーム シェーカーを振る。
- 25% メタノール溶液を慎重に取り外します。50% メタノール溶液 (メタノール 500 μ L) + 500 μ L の PBS を追加します。軽く 5 分プラットフォーム シェーカーを振る。
- 50% メタノール溶液を慎重に取り外します。75% メタノール溶液 (メタノールの 750 μ L) + 250 μ L の PBS を追加します。軽く 5 分間プラットフォーム シェーカーを振る。
- 75% メタノール溶液を慎重に取り外します。100% メタノール溶液 (1 mL のメタノール) を追加します。軽く 5 分 3 回ステップを繰り返してくださいプラットフォーム シェーカーを振る。
- この時点で、ストアは胚、-20 ° C (長期) で彼らのガラスの瓶で、必要に応じて水分を取り除かれます。また、プロトコルの 1 日目に進みます。
3. 1 日目: 水分補給
- -20 ° C のフリーザーから脱水の胚を得る (または 2.5 のステップから直接続行)。
- パスツール ピペットを用いた胚を並べ替えます。1 つは (すなわち、洞窟または表面) に基づいて morphotype を並べ替えることができ、遺伝子の数が各実験で評価しました。一度ソート バイアルあたり通常これ以上より 12 の胚があります。組織を維持するためにバイアルおよび各遺伝子用ピペットを指定するのに色ラボ テープを使用します。胚は、プロトコル全体を通して同じバイアルに滞在します。
注: 100% のパスツール ピペットの先端の場所の間のそれを殺菌するエタノールを使用します。 - 揺れ水浴を後の手順で使用される 70 ° C に設定します。慎重に、並べ替えられた胚のバイアルにメタノールを引き出すし、置き換える新しい 100% を 500 μ l 添加メタノール。簡単に (~ 1 分) を洗うプラットフォーム シェーカー。
- プラットフォーム シェーカーで Tween 20 (PBT、下記参照) と 1x PBS の増加濃度の胚を水分補給します。希釈は、各バイアルに入る 500 μ L で 1 mL 最終希釈量に基づいています。
- 25 %pbt ソリューション (PBT、MeOH の 750 μ L の 250 μ L) を追加します。軽く 5 分プラットフォーム シェーカーを振る。
- 25% ・ PBT ・ ソリューションを慎重に取り外します。50 %pbt ソリューション (PBT、MeOH の 500 μ L の 500 μ L) を追加します。軽く 5 分プラットフォーム シェーカーを振る。
- 50% ・ PBT ・ ソリューションを慎重に取り外します。75 %pbt ソリューション (PBT、MeOH の 250 μ L 750 μ L) を追加します。軽く 5 分プラットフォーム シェーカーを振る。
- 75% ・ PBT ・ ソリューションを慎重に取り外します。100 %pbt ソリューション (PBT の 1 mL) を追加します。軽く 5 分 3 回ステップを繰り返してくださいプラットフォーム シェーカーを振る。
4. 1 日目: 消化と固定
- プロティナーゼ K (PK) ソリューションを準備するには、PBT の 2 mL に PK (20 mg/mL) の 1 μ L を追加します。
- 以降の手順を見越して、-20 ° C での保存から交配バッファー (Hyb - と Hyb +;補足ファイル 2 ファイル 3 の補足を参照してください)、PFA の冷凍の因数を取得します。
- 室温解凍する PFA を許可します。
- 回転 70 ° C の水浴中 Hyb - と Hyb + の因数を配置します。すべて試薬及び試薬容器小浮水風呂装置内部メッシュの下「ガスケット」の内部に配置します。これによりチューブと回転 70 ° C の水浴からバイアルの単純な追加および削除できます。
- すべての組織を確保する胚のバイアルに PK ソリューションがソリューションで完全に覆われている優しく追加します。~ 12 分での PK 作業ソリューション プラットフォームのシェーカーのための胚を消化します。
注: 最適な結果を確保するための調査官によって消化の長さを変えることができます。 - PK 溶液をゆっくりと引いて、簡単に任意の残りのパークを希釈する PBT でバイアルの洪水
- PBT ソリューションをオフに描画し、新しい PBT 500 μ L に置き換えます。5 分間プラットフォーム シェーカーで洗浄するソリューションを許可します。
- PBT をオフに描画し、解凍の 4% の 500 μ L に置き換えます PFA。プラットフォーム シェーカー室温で 20 分間インキュベートする胚を許可します。
- 4% をオフに描画 PFA と簡単に任意の残りの PFA を希釈する PBT でバイアルを洪水します。PBT をオフに描画し、新鮮な PBT 500 μ L に置き換えます。プラットフォーム シェーカー上で 5 分間洗浄する胚を許可します。この手順 4 複数回繰り返します。
5. 1 日目: Prehybridization
- バイアルに予め温めておいた Hyb ソリューションの場所 500 μ L。慎重に、70 ° C 水 (ガスケット) 内風呂なし5 分、揺れにバイアルを配置します。
- Hyb ソリューションを描画し、予め温めておいた Hyb + ソリューションの 500 μ L でバイアルの洪水します。70 ° C の水浴 (40 回転) を振動にバイアルを配置します。いずれかの 4 時間インキュベートまたは一晩します。
注: 4 時間培養は合計で 4 日間完全なその場でのプロトコルになります。ここでは、この手順は、一晩インキュベート、合計 5 日間続くプロトコルをもたらすとして提示されます。
6 2 日目: 交配
- 5 分間揺れお湯浴に-20 ° C のフリーザーから Hyb + の因数を配置します。
- バイアルから Hyb + 引き、予め温めておいた Hyb + 500 μ L に置き換えます。このソリューションを慎重に 2 μ L の RNA プローブを各バイアルに追加します。プローブの均一な分布を確実にバイアルを軽く旋回します。
- 70 ° C の湯浴で Hyb + (追加調査) のソリューションを 40 rpm で震えながら一晩インキュベートします。
注: 1 つは、Hyb + (プローブ) のソリューションを再利用できます。このため、Hyb + プローブを最初から実行から取る-20 ° C のフリーザーと場所交換 Hyb + 1 日目から 5 分間湯浴 Hyb + プローブのプロトコル、湯浴で一晩インキュベートを許可します。
7 日 3: ソリューションの準備
- 「遺伝子の関心」RNA プローブの付いた Hyb + マイクロ遠心チューブ用を準備します。3 日目に使用される希薄のシリーズを準備します。
- 6 の個別のチューブを使用して、Hyb と生理食塩水クエン酸ナトリウム (SSC、0 ~ 100%) の希釈液の次のシリーズを準備します。風呂の水揺れ 70 ° C で 1 mL ボリューム、および場所: チューブ 1 = 100 %hyb - (Hyb の 1 mL): 2 = 25% をチューブ 2 x SSC (250 μ L 2 の x SSC、Hyb 750 μ L);3 = 50 %2 x SSC をチューブ (2 x SSC、Hyb 500 μ L の 500 μ L);4 = 75 %2 x SSC をチューブ (2 x SSC、Hyb の 250 μ L 750 μ L);チューブ 5 = 100 %2 x SSC (2 x SSC の 1 mL);6 = 100 %0.2 x SSC (0.2 x SSC の 2 mL) をチューブします。
注: 警戒、SSC の濃度の 2 倍から 0.2 に変更、x。 - 4 を使用してチューブを分離、PBT、SSC の 1 mL 量の希釈液の次のシリーズを準備し、RT に配置: 1 = 25% をチューブ PBT (250 μ L 750 μ L 0.2 の PBT の x SSC);2 = 50 %pbt をチューブ (PBT、0.2 x SSC を 500 μ l 添加の 500 μ L);3 = 75 %pbt をチューブ (PBT、0.2 x SSC の 250 μ L 750 μ L);4 = 100 %pbt 樹脂 (PBT の 1 mL) をチューブします。
- 管 2 mL のトゥイーン 20 (MABT) 実用的なソリューションを含むマレイン酸バッファーを準備します。
- ソリューションをブロックの 2 つの 15 mL の円錐管を準備します。各チューブの MABT 10 mL にブロッキング試薬の 0.2 g を追加 (補足ファイル 4を参照)。(最大 3 h) ソリューションで完全に溶解までならびにミキサー (またはプラットフォーム シェーカー) 両方のチューブを配置します。
- 6 の個別のチューブを使用して、Hyb と生理食塩水クエン酸ナトリウム (SSC、0 ~ 100%) の希釈液の次のシリーズを準備します。風呂の水揺れ 70 ° C で 1 mL ボリューム、および場所: チューブ 1 = 100 %hyb - (Hyb の 1 mL): 2 = 25% をチューブ 2 x SSC (250 μ L 2 の x SSC、Hyb 750 μ L);3 = 50 %2 x SSC をチューブ (2 x SSC、Hyb 500 μ L の 500 μ L);4 = 75 %2 x SSC をチューブ (2 x SSC、Hyb の 250 μ L 750 μ L);チューブ 5 = 100 %2 x SSC (2 x SSC の 1 mL);6 = 100 %0.2 x SSC (0.2 x SSC の 2 mL) をチューブします。
8 日 3: プローブの除去
- Hyb + (プローブ) とガラス パスツール ピペットで溶液を描画し、遠心チューブをラベル、滅菌にそれを配置します。(プローブ標識が成功した) 場合は、将来の使用のため-20 ° C のフリーザーの筒を保持します。
- 暖かい SSC/Hyb-希釈 (下記) を 500 μ l 添加を慎重に追加します。70 ° C の振動水お風呂に 10 分間以下の解決策のそれぞれで孵化させなさい。
- 100% と順次孵化 Hyb - (Hyb の 1 mL) 25 %2 x SSC (2 の 250 μ L x SSC、Hyb 750 μ L), 50 %2 x SSC (500 μ L の 2 x SSC、Hyb 500 μ L), 75 %2 x SSC (750 μ L 2 の Hyb の 250 μ L x SSC)、100 %2 x SSC (2 の 1 mL x SSC)、100 %0.2 x SSC (0.2 2 mL x SSC)。
- 次の最後のステップでは、各 10 分ずつの次のソリューションで孵化させなさい。プラットフォーム シェーカーで RT で場所を取る次の孵化のすべて: 25 %pbt (250 μ L 750 μ L 0.2 の PBT の x SSC)、50 %pbt (500 μ L PBT、0.2 を 500 μ l 添加の x SSC), 75 %pbt (PBT、0.2 の 250 μ L 750 μ L x SSC)、100 %pbt (PBT の 1 mL)。
- 10 分間インキュベーション後削除 100 %pbt、各バイアルに MABT を 500 μ l 添加し、。5 分の 2 回、この手順を繰り返します。
9 3 日目: ブロック
- 各バイアルからの洪水 (7.1.4 の手順で準備) 管のいずれかから予ブロッキング液で MABT を削除します。室温 〜 4 時間ならびにミキサーにバイアルを配置します。
- 追加 2 μ L 抗 DIG AP Fab のフラグメントの第 2 バイアル 10 mL (7.1.4 の手順で準備) ソリューションと簡単に渦をブロックするのです。
- ソリューション (~ 5 mL) ブロック各バイアルでほぼ完全に満たし、4 ° C で冷蔵庫で一晩ならびにミキサーに配置
10 4 日目: MABT リンス
- MABT で 10% ヤギ血清 (NGS) のストック バイアルを準備 (MABT の 900 μ L に NGS の 100 μ L を追加)。
- 各バイアルにブロッキング液をオフに描画し、各バイアルに NGS/MABT 混合物の 500 μ L を追加します。プラットフォーム シェーカーで RT で 25 分間インキュベートする胚を許可します。
- 500 μ L 100% の NGS/MABT 混合物に置き換える MABT。プラットフォーム シェーカーで RT で 30 分間インキュベートします。このリンス 11 回以上終日 30 分ごとを実行します。
- 100 %mabt、4 ° C で冷蔵庫やウォークイン商工会議所で一晩ならびにミキサー上の場所と、バイアルを満たし
11 日は 5: プローブの可視化
- アルカリフォスファターゼ (AP) バッファーの 50 mL の約数を準備 (補足のファイル 5を参照)。50 mL の円錐管に包まれた光の露出を制限するアルミ箔で次の結合: 1 M トリス (pH 9.5) 50 mm MgCl2, 5 mL の 1 %5 mL の 5 mL トゥイーン 20、1 M nacl、30 mL ddH2O の 5 mL。
- MABT を削除し、1 mL の AP バッファー (チューブに包まれた箔) で置き換えます。それは 5 分間洗ってみましょう。MABT の完全な除去を確実に 2 回これを行います。
- Ap 通信バッファーを削除し、3.5 μ 5-bromo-4-chloro-3'-indolyphosphate AP バッファー (BCIP) および 4.5 の 1 mL に置き換える、ニトロ ブルー テトラゾリウム (NBT) の μ L。作りたて AP バッファー/NBT/BCIP 反応まで 1 時間おきが完了したら置き換えます。呈色反応染色の必要なレベルを達成するまで場所を取ることを許可するように、15 分毎にチェックを密接に監視します。沈殿物は、フォームに開始された場合は、早くソリューションを取り付けます。
- (背景の汚損の最小限の量) と信号の最適なレベルが達成されるまで (NBT/BCIP) なしの新鮮な 100 %ap バッファーで胚を洗浄によって PBT で 5 分続行リンスの呈色反応を停止します。Ap 通信バッファーの PBT の希釈液を次のように増加の標本をリンスし続ける: 25 %pbt (PBT、ap 通信バッファーの 750 μ L の 250 μ L)、リンス 5 分。50 %pbt 樹脂 (PBT、ap 通信バッファーの 500 μ L の 500 μ L)、リンス 5 分。75 %pbt 樹脂 (PBT、ap 通信バッファーの 250 μ L 750 μ L)、5 分間洗浄します。
- ならびにミキサー必要最低限の背景を汚すまでの PBT に達する 100% 〜 5 mL に胚をすすいでください。スイッチ アウト新鮮な PBT で数回。これは数日取ることができます。
- 500 μ L のプラットフォーム シェーカーで滅菌 PBS で洗浄、完全な胚が洗浄します。5 分の 2 回このすすぎを実行します。4% の 500 μ L の試料を後修正 PBS 洗浄後、PFA プラットフォーム シェーカーで RT で 1 時間。また、一晩 4 %1 mL に修正 4 ° C で冷蔵庫に PFA
- 定着剤を交換して、新鮮な滅菌 PBS。100% 滅菌 PBS の 〜 4 mL の胚を 5 分場所に対して 2 回以上このすすぎを実行し、4 ° C で長期保存
12. イメージング
- 3% の agarose と TAE バッファーを使用してシャーレにイメージング プレートを確認します。
注: 量は、どのように多くのプレートが必要に依存します。プレートは、数回を再利用できます。プレートに胚を含むのための不況を作成するためにゲルを冷却しながら、ペトリ皿に浅い長方形型を格納することをお勧めします。 - PBS のプレートに胚を配置します。
注: そっと注ぎ、彼らはプラスチック製のピペットの中に固執することを発見したので、それらをピペットではなくプレートの上に胚をお勧めします。 - それぞれの胚を視覚化するために光学顕微鏡を使用します。目的の位置に胚を操縦するのに鈍プローブを使用します。
- 目的の位置、胎児のときに、イメージを取る。汚れの潜在的な劣化を避けるために完成した染色の数週間内の胚の画像を取ることが重要であるに注意してください。
結果
本報告では、高品質遺伝子発現解析のための胚のアステュアナクス標本のラベル付けを実行するシンプルで簡単なアプローチを提供します。この手法は、4 つまたは 5 日間で行うことが、各主要なステップの手順では、色分けされたフローチャート (図 1) で表されます。完了すると、ステンド グラスの胚は興味の特定の遺伝子を表現する組織の暗い紫色色ラベルを抱く必要があります。我々 は Pachón 血脈 (図 2 a-B, E) と表層魚群 (図 2-D, F) 胚の両方でこのプロトコルを実装しました。
血脈の胚は、そのラベルの初期神経の頂上の組織、 Sox9とTfap2a5,62 つの転写因子の染色された.Sox9式のラベルの胚は、発展途上の鰓のアーチと胸鰭 (黄色の矢印、図 2 a) 明確なラベリングをデモンストレーションします。染色が事実上存在しないことに注意してください卵黄嚢または側面 (図 2 a) に発展途上の体節で。同様に、 Tfap2a式の胚の背側腹部に沿って早期移行神経堤細胞 (図 2 b, 矢印) と同様、開発の頭の部分で明らかです。毒胚の提示第 3 の代表的な遺伝子は、 Phf20a、骨芽細胞分化7のマーカーです。染色する体節中胚葉と骨組織 (図 2 e矢印) を生じさせる運命にある後部の頭の部分に注意してください。
表面魚類胚におけるCXCR、 Adcyap1a、およびSox10遺伝子のプローブが私たち。CXCRエンコード バインド CXC ケモカイン8G タンパク質膜結合型受容体です。肯定的なラベリング、頭側面 (図 2 f矢印) と卵黄嚢を覆ういくつかの個々 のセルの隔離された地域に存在。遺伝子アデニル酸シクラーゼ活性化ポリペプチド、 Adcyap1aは、下垂体細胞を含む中枢神経系の領域で表現されます。胚の背側面にセルのペア、二国間のクラスターの特異性の高い表現に注意してくださいだけでなく、正中線式 (図 2矢印) の大きい地域。最後に、どのラベル初期神経堤細胞とオリゴデンドロ サイト細胞10提案Sox10、転写因子の発現。特異性の高い染色陽性は、左側の神経の頂上の早いマーカーと背側胚 (図 2 D矢印の右側は明らかです。
他の研究者が発生する可能性があります交絡の問題の 2 つのタイプのそれぞれを提案します。1 つの定期的に出会い最初の問題は、非固有のラベルの点状の斑点です。これらの斑点着色反応最終 MABT リンスや ap 通信バッファーから、沈殿物として生じる。この非固有のラベルの例は、 Pnp4aの式のステンド グラス表面魚胚の卵黄嚢に明らか。この遺伝子は、虹色色素沈着11の生産を容易にする酵素 (プリンのヌクレオシドのホスホリラーゼ) をエンコードします。この遺伝子は明らかに発展途上の目と膀胱を泳ぐ最初です。いくつかの表面の標本 (図 3 a) にみられる点状の斑点は、頻繁に洗浄およびプロトコル (図 3 b) の最終段階で AP バッファー + NBT/BCIP の交換によって排除されました。1 つの定期的に出会い 2 番目の問題は、それ以外の場合、明確な表現パターンを生成する遺伝子のびまん性、非特定の主式です。1 つの例は遺伝子BMP4、(図 3) 供試体全体に存在する発色の低レベルで大きく拡散パターンとして表示されます。ような場合、一般的に遺伝子の異なる領域を識別、ベクトルに増幅し、新しいプローブ合成を実行 (補足ファイル 6参照)。コントロール (ないプローブ) 標本 (図 3 D) の例は、失敗した私たちBMP4プローブのびまん性および非固有の性質を説明するために提供されます。
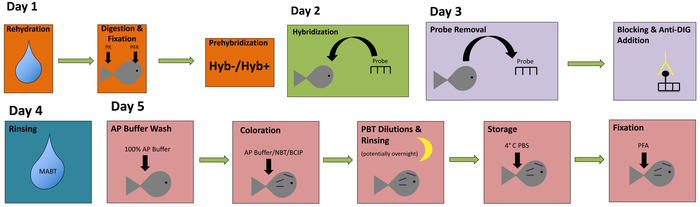
図 1: ホール マウント in situ ハイブリダイゼーションの簡単なフローチャートです。このフローチャートは、in situ ハイブリダイゼーションの主な手順を示すために色分けを採用しています。この図の拡大版を表示するのにはここをクリックしてください。
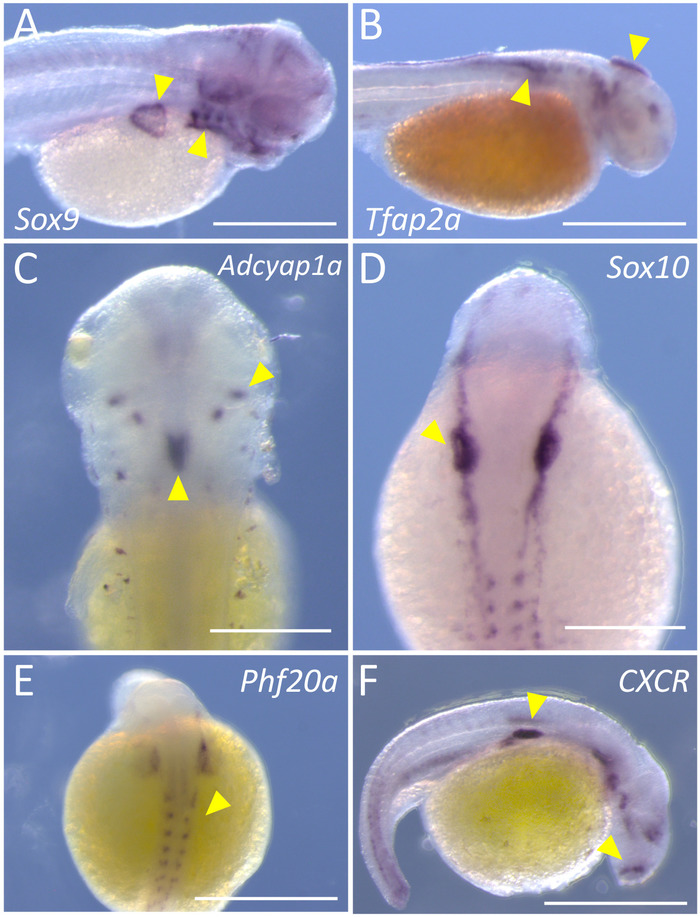
図 2: 代表的な染色洞窟とアステュアナクスの表面のモーフを使用して六つの遺伝子.(A) 図の特定の汚損 (黄色の矢印) 72 時間後受精 (hpf) 右外側側Sox9の Pachón 血脈 (45 x)。(B) を、36 の右の側面に明らかにTfap2aのための特定の染色 hpf Pachón 血脈 (45 x)。(C) 二国間及び正中線は、 Adcyap1aの (黄色の矢印) を染色 hpf の 72 面魚 (100 x) の背側領域に表示されます。(D) Sox10 24 hpf 表面魚 (100 x) の神経堤体内の染色。(E) Phf20a 24 の背の地域で式のかすかな、しかし、明確なパターンに示します hpf Pachón 血脈 (100 x)。(F)、サイトカイン受容体、 CXCRは、hpf の 24 面魚 (100 x) の右の側面の異なる領域で表されます。スケール バー、B、E、f = 0.5 mm;C, D はバーをスケール = 2.5 mm.この図の拡大版を表示するのにはここをクリックしてください。
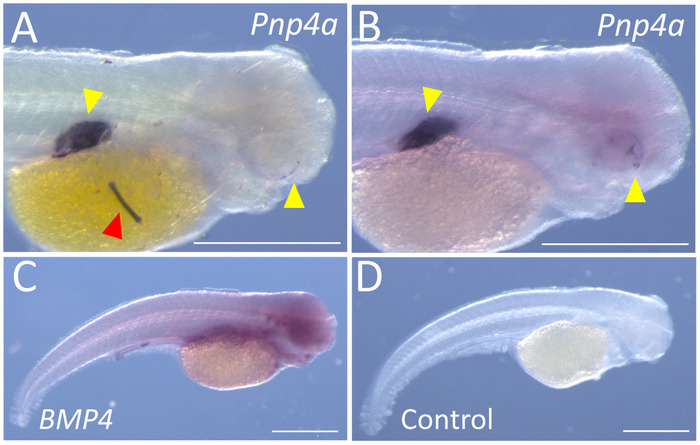
図 3: ホール マウント in situ ハイブリダイゼーションのサブ最適な結果の代表的な例です。(A) 特定の染色は非固有の沈殿物および/または破片 (赤矢印)、72 の右外側面に並んで明らか hpf Pachón 血脈 (100 x)。(B) A の可視化プローブ、沈殿物の有無、72 の背景パターン同じ染色を描いた hpf Pachón 血脈 (100 x)。(C)、72 の右外側側面 hpf Pachón 血脈が 45 倍の倍率でBMP4のびまん性、非特定の染色を示します。(D) A 72 hpf Pachón 血脈プローブ (45 x) 添加することがなく、このプロトコルを受けます。スケール バー = 0.5 mm.この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
劣化する RNA の脆弱性によりプロトコルの最も重要な手順の 1 つは RNA プローブの滅菌の合成にかかわる。ただし、プローブが生成されます慎重に良い結果を提供し場合、は、その後染色反応では使用できます。2 番目の重要なステップは、プロトコルで使用されるすべての試薬の慎重な生産です。このプロトコルには、数日、多くの小さなステップが含まれているのでそれが必要し、滅菌方法で格納されているすべての試薬が正確にであります。さらに、調査官がプロトコルの各ステップの追跡をします、根本的に重要です。我々 は、手順のチェックリストこのプロトコルの各側面の正確かつ正確な完成を確保する上で非常に役に立つことを発見しました。
私たちはしばしば、私たちがここで提示されたプロトコルを変更しません。ただし、捜査官が示唆されたものよりも異なる温プローブ孵化を実行可能性があります (すなわち、70 ° C)。ハイブリダイゼーション温度のわずかな変化は RNA プローブの結合に影響を与え、最適な交配の温度を求めることができる染色の品質に影響積極的にしたがって。トラブルシューティングに関してはこの記事 (補足ファイル 1) にあるチェックリストを利用する他の研究者強く勧めします。レコード高品質の染色を確保するために必要な最初のステップは、注意を維持します。ロッキングせずに最終的な呈色反応を実行することです 2 番目のマイナー変更が示唆された (例えば、プラットフォーム シェーカーまたは nutator 上に置いた) なし。この理由は、定期的に我々 は注意おそらく AP 緩衝液から発生する沈殿物の生産です。この沈殿物は通常暗い色に overstains し、ステンド グラスの組織に点状 (無指定) 背景を作成します。この沈殿物の生産を最小限に抑えるためには、各反応の直前に滅菌の ap 通信バッファーを準備します。さらに、NBT と BCIP をバッファーに追加すると、我々 は交換して新鮮なバッファー、NBT/BCIP 呈色反応が完了するまで 1 時間ごと。
提案手法に制限は、クロマチック汚れを利用した遺伝子発現可視化です。費用対効果のみを可視化する光学顕微鏡検査が必要ですので、我々 はこの方法を好みます。1 つは量的差異の評価に興味を持っていた、彼らは蛍光の呈色反応を使用してお勧めします。これは実験間の表現の相対的な蛍光単位の比較を通してたとえば、半定量を有効にされます。
広く web12,13、上だけでなく、科学的な出版物のままの交配のためのプロトコルがあります。提案するプロトコルは、私たちのモデルのシステム、アステュアナクス メキシコ専用に開発されました。我々 は、多数の遺伝子の発現を汚し、感じるそれは一貫して高品質の結果を提供しますこのプロトコルを使用しています。このプロトコルの重要な利点は、調査担当者が、このプロトコルの手順のそれぞれの正確な完成を確保しながら、複数のタスクを実行できるようにする項目の手順のチェックリストです。このプロトコルをフィールド内外の他の研究者に有益な情報源として機能し、この一般的な実験手法が将来発見ブラインド メキシコ血脈表現型遺伝子のリンクをサポートすることが予想されると思います。
開示事項
著者が明らかに何もありません。
謝辞
この原稿の有用なコメントのための総研究室のメンバーを感謝致します。2017、2018、クリスティン曹、マイケル ・ ウォーデン、安芸李デビッド ヌワンコなど夏のインターンシップ中にこのプロトコルを利用する 4 つの高校生を認識したいです。HL は 2017 年の夏カリフォルニア大学生物学幹交わりによって支えられました。この作品は全米科学財団 (デブ 1457630 JBG に)、国立機関歯科・頭蓋顔面研究所 (NIH; からの補助金によって支えられました。JBG に DE025033)。
資料
| Name | Company | Catalog Number | Comments |
| 10 mL Serological Pipette | VWR | 89130-888 | |
| 1000 mL Filtration Unit | VWR | 89220-698 | |
| 15 mL Conical | VWR-Greiner | 82050-278 | |
| 25 mL Serological Pipette | VWR | 89130-890 | |
| 250 mL Filtration Unit | VWR | 89220-694 | |
| 5 mL Serological Pipette | VWR | 89130-886 | |
| 50 mL Conical | VWR-Falcon | 21008-940 | |
| 500 mL Filtration Unit | VWR | 89220-696 | |
| Anti-Digoxigenin-AP, Fab fragments | Sigma-Roche | 11093274910 | |
| BCIP | Sigma-Aldrich | B8503-1G | 1 g |
| Blocking Solution | Sigma-Roche | 11 096 176 001 | 50 g |
| Citric Acid | Fisher Scientific | A104-500 | 500 g |
| DIG RNA Labeling Kit (SP6/T7) | Sigma-Roche | 11175025910 | |
| Eppendorf Tubes | VWR | 20170-577 | |
| Ethanol | Fisher-Decon | 04-355-223 | 1 Gal |
| Formamide | Thermo Fisher Scientific | 17899 | 100 mL |
| Glass dram vials | VWR | 66011-041 | 1 Dr |
| Glass Pipettes | Fisher Scientific | 13-678-8A | |
| HCl | Thermal-ScientificPharmco-AAPER | 284000ACS | 500 mL |
| Heparin | Sigma | H3393-25KU | |
| Magnesium Chloride-crystalline | Fisher Scientific | M33-500 | 500 g |
| Maleic Acid | Sigma | M0375-100g | 100g |
| Methanol | Fisher Scientific | A452-4 | 4L |
| Molecular-grade Water (RNase-free) | VWR | 7732-18-5 | 500 mL |
| NaCl | Fisher Scientific | S271-3 | 3 kg |
| NaOH pellets | Fisher Scientific | S318-500 | 500 g |
| NBT Substrate powder | ThermoFisher Scientific | 34035 | 1 g |
| Normal Goat Serum | Fisher-Invitrogen | 31873 | |
| Nutating Mixer | VWR | 82007-202 | |
| Paraformaldehyde | Sigma | 158127-500g | 500 g |
| PBS 10x | Fisher Scientific | BP399-20 | 20L |
| Proteinase K (200mg/10ml) | Qiagen | 19133 | 10 mL |
| Plastic Pipettes | VWR-Samco | 14670-147 | |
| RNAse | Sigma | R2020-250mL | 250 mL |
| Shaking Water Bath 12 L | VWR | 10128-126 | 12 L |
| Standard Analog Shaker | VWR | 89032-092 | |
| Tris | Sigma Millipore-OmniPur | 9210-500GM | 500 g |
| tRNA Yeast | Fisher-Invitrogen | 15401011 | 25 mg |
| Tween 20 | Sigma | P9416-50mL | 50 mL |
| Vortex-Genie 2 | Fisher Scientific-Scientific Industries, Inc | 50-728-002 | |
| Lithium Chloride (LiCl) | Sigma-Aldrich | 203637-10G | 10 g |
参考文献
- Valentino, K. L., Eberwine, J. H., Barchas, J. D. . In situ hybridization: Application to neurobiology. , (1987).
- Mugrauer, G., Alt, F. W., Ekblom, P. N-myc proto-oncogene expression during organogenesis in the developing mouse as revealed by in situ hybridization. The Journal of Cell Biology. 107 (4), 1325-1335 (1988).
- Kerney, R., Gross, J. B., Hanken, J. Early cranial patterning in the direct‐developing frog Eleutherodactylus coqui revealed through gene expression. Evolution & Development. 12 (4), 373-382 (2010).
- Thisse, C., Thisse, B. High-resolution in situ hybridization to whole-mount zebrafish embryos. Nature Protocols. 3 (1), 59-69 (2008).
- Cheung, M., Briscoe, J. Neural crest development is regulated by the transcription factor Sox9. Development. 130 (23), 5681-5693 (2003).
- Knight, R. D., Nair, S., Nelson, S. S., Afshar, A., Javidan, Y., Geisler, R., Rauch, G. J., Schilling, T. F. lockjaw encodes a zebrafish tfap2a required for early neural crest development. Development. 130 (23), 5755-5768 (2003).
- Yang, J. W., Jeong, B. C., Park, J., Koh, J. T. PHF20 positively regulates osteoblast differentiation via increasing the expression and activation of Runx2 with enrichment of H3K4me3. Scientific Reports. 7 (1), 8060 (2017).
- Ganju, R. K., Brubaker, S. A., Meyer, J., Dutt, P., Yang, Y., Qin, S., Newman, W., Groopman, J. E. The α-chemokine, stromal cell-derived factor-1α, binds to the transmembrane G-protein-coupled CXCR-4 receptor and activates multiple signal transduction pathways. Journal of Biological Chemistry. 273 (36), 23169-23175 (1998).
- Cai, Y., Xin, X., Yamada, T., Muramatsu, Y., Szpirer, C., Matsumoto, K. Assignments of the genes for rat pituitary adenylate cyclase activating polypeptide (Adcyap1) and its receptor subtypes (Adcyap1r1, Adcyap1r2, and Adcyap1r3). Cytogenetic and Genome Research. 71 (2), 193-196 (1995).
- Stolt, C. C., Rehberg, S., Ader, M., Lommes, P., Riethmacher, D., Schachner, M., Bartsch, U., Wegner, M. Terminal differentiation of myelin-forming oligodendrocytes depends on the transcription factor Sox10. Genes & Development. 16 (2), 165-170 (2002).
- Kimura, T., Takehana, Y., Naruse, K. pnp4a is the causal gene of the Medaka Iridophore mutant guanineless. G3: Genes, Genomes, Genetics. 7 (4), 1357-1363 (2017).
- Monsoro-Burq, A. H. A rapid protocol for whole-mount in situ hybridization on Xenopus embryos. Cold Spring Harbor Protocols. (8), pp.pdb-prot4809 (2007).
- Schulz, C. In situ hybridization to Drosophila testes. Cold Spring Harbor Protocols. (8), pp.pdb-prot4764 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved