Method Article
誘導多能性幹細胞由来肝細胞を用いた家族性高コレステロール血症ひと肝臓キメラマウス モデル
* これらの著者は同等に貢献しました
要約
ここでは、ひと誘導多能性幹細胞由来肝細胞を用いた家族性高コレステロール血症のひと肝臓キメラマウス モデルを生成するためのプロトコルを提案する.高コレステロール血症の新しい治療法をテストするための貴重なモデルです。
要約
家族性高コレステロール血症 (FH) 主因は低比重リポ蛋白受容体 (来す) 突然変異によって、血液中の LDL コレステロール (LDL-C) のマーク付きの上昇のための早期発症心血管疾患のリスクが増加します。スタチン系薬剤は FH と他の種類、高コレステロール血症の治療のための脂質低下薬の最初の行が、新しいアプローチで浮上している、今臨床試験でテストされている特定の PCSK9 抗体。FH、新しい薬や新しい製剤の新しい治療法を探索するには、は、体内モデル適切な必要があります。しかし、人間と比較して脂質代謝の違いは FH.の利用可能な動物モデルの重要な問題この問題に対処するための FH の誘導多能性幹細胞 (iPSC) を用いたひと肝臓キメラマウス モデルを生成-肝細胞 (iHeps) を派生しました。我々 は、移植されたひと細胞の免疫拒絶反応を回避して来すの効果を評価するために/来す-/-/Rag2-/-/Il2rg-/- (LRG) マウスを使用-を来すの欠乏 iHeps null 背景。移植の FH iHeps アルブミン染色に基づいて LRG マウス肝臓の 5-10% を再作成します。また、明らかな移植 iHeps は脂質低下薬に応答し、スタチン系薬剤と比較して PCSK9 抗体の効果の臨床的観察を締めくくっています。私たち人間の肝臓のキメラ モデル従って FH に新しい治療法の臨床試験の役に立つかもしれない。他の FH の遺伝子変異やその他の継承された肝疾患に対応する突然変異の同じプロトコル、類似したひと肝臓キメラマウスを使用しても生成される可能性があります。
概要
低比重リポ蛋白受容体 (来す) は、肝臓でのコレステロールの合成を調節する血中 LDL コレステロール (LDL-C) をキャプチャします。来す遺伝子の変異は、家族性高コレステロール血症 (FH)1の最も頻繁な原因です。スタチン系薬剤は伝統的に FH と高コレステロール血症 (継承または取得) の他のタイプの治療に薬の最初の行をされています。スタチン系薬剤は、3-ヒドロキシ-3-methylglutaryl-補酵素2の肝臓のコレステロール合成を下げる還元酵素を阻害します。さらに、スタチン系薬剤は、血漿 LDL-C のクリアランスを促進するために肝細胞表面を来すレベルを上げます。しかし、スタチンによる治療の主な注意点は、同時にするプロタンパク質転換酵素サチライシン/禾欣 9 (PCSK9) を来すにその劣化3を促進するために結合する酵素の発現を誘導することです。この効果は多くの患者にみられるスタチンに不十分またはも null 応答を担当です。このメカニズムを勉強しては、高コレステロール血症を治療する別の方法の発見につながっている、予期せず。PCSK9 抗体最近の FDA によって承認された臨床試験で現在使用されている、高い治療効果を示し、スタチン4より優れた耐久。PCSK9 抗体の成功はまた、高コレステロール血症患者における (PCSK9) 以外を来す分解経路を調節する他の治療上の可能性があることを意味します。同様に、PCSK9 抗体、たとえば、siRNA oligos5以外新規阻害剤の開発に関心があります。
FH と高コレステロール血症の一般的なその他の種類の新しい治療法をテストするため生体内で適切なモデルが必要です。現在生体内での主要な問題のモデルは、ほとんどマウス6と7、ウサギ人間との生理学的な相違点は。重大に、これらの問題は、異なる脂質代謝プロファイルを含みます。ひと肝キメラ動物8世代この注意点を克服するために役立つかもしれない。ひと肝臓キメラマウスは、ひと肝細胞、たとえば、プライマリひと肝細胞 (pHH)9の肝「ヒト」のマウスの一種です。PHH の問題はすぐに拡大されたex vivoをすることはできません限られたソースは、分離時にその機能を失います。PHH に代わる誘導多能性幹細胞 (iPSC) の使用である-肝細胞 (iHeps)10を派生しました。特に、Ips は患者固有であり、オンデマンドで新鮮な pHH 上重要な利点である iHeps を作り出すことができるので、いつまでも育てることができます。また、どの Ips も、デザイナーの核酸を修正したりより忠実な比較11ように同質遺伝子背景の突然変異を導入すると簡単に遺伝子組み換えできますでまた。
明らかな移植 pHH とひと肝臓キメラマウスは、肝臓の代謝プロファイル、薬物応答と肝炎ウイルス感染12薬剤感受性の人間に類似点を示します。これは生体内で高脂血症を勉強する良いモデルをさせます。最も広く使用されているマウス モデルは、 Fah-/-/Rag2-/-/Il2rg-/- (ドイツ連邦共和国) のマウス13と uPA トランスジェニック マウス8、pHH によってマウスの 95% まで肝臓を置き換えることができますに基づいています。興味深いことに、最近の報告書は、人間 FH 肝臓キメラマウス (ドイツ連邦共和国のマウスに基づく) ホモを来す変異14を運ぶ患者から pHH とを説明します。このモデルで再作成されるひと肝細胞が機能を来すをなかったが、残留マウス肝細胞は、生体内で薬を来す経路依存のテストを実行するためのユーティリティを減らします。
を来す-/-/Rag2-/-/Il2rg-/- (LRG) マウス肝臓に FH iHeps を接がの最近出版された仕事15に基づく詳細なプロトコルを報告する.このひと肝臓キメラマウスは FH をモデリングおよび薬剤のテストの実行に役立つ体内。
プロトコル
動物の使用を含む、ここで説明したすべてのメソッドは、使用の住んでいる動物の教育および研究 (CULATR) の香港大学の委員会によって承認されています。
1. マウスの調製及び表現型検査
-
免疫不全を来すノックアウト (KO) マウスの世代。
- マウス系統を来す-/-、 Rag2-/-、および使用Il2rg-/- (材料の表を参照してください)。
- Rag2-/-を生成するIl2rg-/-マウスとRag2-/-マウスのクロス/ Il2rg-/-マウスは、クロスを来す Rag2-/--/-マウス/ Il2rg-/- マウス/を来す-/-/Rag2-/-/Il2rg-/- (LRG) マウス15を生成します。3 〜 4 週間の年齢、PCR とシーケンスで遺伝子型を決定するための耳から DNA を収集します。
- 8 〜 12 週間の年齢でひと肝臓キメラマウスを生成するのに iHeps の受信者として男性の LRG マウスを使用します。
- IHep 高コレステロール血症を開発するために移植前に 7 日間、高脂肪、高コレステロール (HFHC) 食事とマウスを供給します。
- 肝臓に明らかな移植 iHeps の増殖を容易に肝障害を誘導して、滅菌容器にマウスを置き、3 Gy 24 時間生着前の用量で γ 線とガンマ照射器を使用してそれらを照射します。その後、マウスを住宅ケージに戻ります。これらの放射線照射したマウスの健康状態は、自分の体重を測定することによって監視できます。 以上 20% 減量を持つマウスが安楽死します。
2. iHep 分化と解離
(+/-)を来すheterozygous KO またはホモ KO (-/-) 人間 Ipsを来す(FH Ips) ヘテロ接合性変異と FH 患者 Ips を使用して、iHeps を生成します。+/-を来すの生成または-/- Ips FH Ips が私たちの以前のレポート15に記載されています。
- IHeps に Ips の分化
注: 人間 Ips の iHeps への分化のメソッドは、以前のレポート16から変更されます。- 分化 (日-3)、種子の前に 3 日間細胞外マトリックスに Ips 細胞/ウェル人間 iPSC 用培地 (参照材料表の 1.5 mL (今後) の 300,000 の密度で 6 ウェル プレート (材料の表を参照) をコーティング) 5 μ M ROCK 阻害剤 (Y27632) を添加しました。37 ° c 5% CO2加湿インキュベーターで培養します。通常、6 ウェル プレートから iHeps は 5 マウスを接がに十分です。
- (日-2) 24 時間後と 48 時間後 (日-1)、ROCK 阻害剤なしの新鮮な人間の iPSC メンテナンス中に媒体を変更します。
注: 分化前に Ips は、OCT4、NANOG は、定量的 RT-PCR、蛍光抗体法、またはフローサイトメトリーによって調べることができますの高レベルを表現する必要があります。 - 分化の日 0、RPMI 1640 でセルを一度洗浄し、100 ng/mL アクチビン A と 25 ng/mL WNT3a RPMI 1640 を追加します。
- 1 日目、2 日目分化の 100 ng/ml のアクチビン a. RPMI 1640 の媒体を変更します。
注: この段階であまりにも多くの細胞死があるかどうか (日 0-3)、細胞生存率を改善するために媒体を最大 0.5% ウシ胎児血清 (FBS) を追加できます。ただし、過剰な FBS も分化に影響を与える特定の iPSC 行ごとに追加される FBS の最小限の量のテストをお勧めします。 - 3 日目、DMEM に細胞を一度洗うし、2ndステージ中 (20% 血清交換、1 x 非本質的なアミノ酸、L-グルタミン 2 M、0.1 M β-メルカプトエタノール、DMEM 培地で 1% ジメチルスルホキシド) に切り替えてください。10 日目まで毎日媒体を変更します。
注: 7 日、合流および明確なエッジを表示セルを達している必要があります。この段階で表示されるいくつかの未分化の領域がある可能性があります。これらの区域の割合が小さい場合は、それらを無視します。割合が高い場合、0 日で Ips の合流点を減らすし、分化の第一段階で使用される FBS の量を減らします。 - 10 日に肝細胞基本培地で細胞を一度洗って、20 ng/mL のひと肝成長因子と 20 ng/mL オンコスタチン M iHep 成熟を促進するために補われる肝細胞培養液に切り替えてください。一日おきに媒体を変更します。
注: この段階で > 細胞の 90% は蛍光染色または流れ cytometry によると HNF4A の肯定的なする必要があります。 - 日 15-17、細胞生着の準備が整いました。必要に応じて、細胞培養上清を収集し、iHeps によって分泌されたアルブミン (ALB) の定量化-80 ° C で保存可能性があります。
注: この段階で > 80% iHeps HNF4A、ALB、免疫蛍光染色によると α 1-アンチトリプシン (AAT) にプラスのはず。約日 17 iHeps の 60-70% はフローサイトメトリーによって示すように、ASGPR の肯定的なする必要があります。私たちの手では、この時期 iHeps はマウス肝臓を再作成するのに最適な能力を持っています。iHeps は、ALB 体外のより高いレベルを分泌するかもしれませんが、また老年期に、生着が遅延した場合。
- 解離とインスリン注射器への iHeps の読み込み
- 必要な試薬および材料を準備します。
- 生着、前に 24 時間解凍必要量 (V = 40 μ L * マウス数) 氷における細胞外マトリックスの寒い部屋にし、インスリン注射器と 200 μ L チップ ボックスを 4 ° C 冷蔵庫に入れます。
- 1 時間、生着前細胞解離酵素 50 μ G/ml DNase 私部屋の温度に添加温かく氷の上の 20% 血清交換 RPMI 1640 培を配置します。
- 細胞の形態、成長、細胞密度など、自分の状態を記録する iHeps の位相コントラスト画像 (100 X、200 X) を取る。
- IHeps 2 ml/室温 Ca2 +と Mg2 +のもを洗う-PBS を 2 回、無料、細胞解離酵素の 1 mL は各ウェルに私を 50 μ g/ml の DNase 補足を追加。8-10 分のためのインキュベーターに細胞を戻します。
注: 細胞分離酵素と細胞解離を高めるためには、Ca2 +と Mg2 +のセルを洗浄して-無料の PBS。セル実行可能性の最大化、一度にバッチごとの以上 6 井戸を解離をお勧めします。さらに、10 分以内に細胞解離酵素治療を制限することをお勧めします。 - 顕微鏡下で細胞の形態を監視します。細胞の大部分はラウンドになると、各ウェルに 20% 血清交換と冷たい RPMI 1640 の等しいボリュームを追加、優しく、プレートからデタッチする細胞をピペット、新しい 15 mL チューブに細胞懸濁液を転送します。
注: この手順は、収穫された細胞の生存にとって重要です。セルのプレートからデタッチするのには困難な場合、一部のセルが残っている場合してもかまいません。セルは、単分子膜の大きな正方形としてデタッチ、ピペット、優しく単一細胞懸濁液を取得する遠心分離後。 - よく接続されているほぼすべての細胞が収集されるまで、各手順 2.2.4。200 x gで 4 ° C で 3 分間遠心
- 上澄みを除去し、2 ml の冷 PBS 15 mL チューブの細胞を再懸濁します。単一細胞懸濁液を入手し、1 mL の最終巻に冷 PBS を追加に優しく細胞をピペット * 解離井戸の数。最後に、集計を削除するには、40 μ m セルこし器を通って細胞を通過します。
注: 通常 1-2 106細胞/ウェル x がフィルタ リング後収穫できます。 - 20 μ L 分注細胞懸濁液 0.4% トリパン ブルー溶液 20 μ L を追加、自動化された細胞カウンターを使用してセルをカウントし、"C"として細胞懸濁液の濃度を記録。必要なボリュームを計算 (V1 = [106 * (n + 1)]/C、n はしみ込んであるマウスの数) 細胞懸濁液 (100 万/マウス) 脾内注入のための。
- 因数 15 mL チューブ 200 x gで 4 ° C で 3 分間遠心し、細胞懸濁液の必要量
- 上澄みを除去、細胞懸濁液 (n + 1) のボリュームに冷 PBS の適切な量の細胞を再懸濁します * 55/2 μ L (n = マウスの数)、し、細胞懸濁液 (n + 1) の最終巻をする細胞外マトリックスの等しい量を追加 * 55 μ L。
- 氷の冷たいインスリン注射用の針を場所、ピストンを外し、注射器に細胞懸濁液の 55 μ L を転送、ピストンを戻します。泡を慎重に放電し、氷に戻って注射器を置きます。
- 2.3.10 を繰り返してすべての注射器がセルで読み込まれています。注射器は注射の準備が整いました。
注: セル実行可能性を最大にするには、解離した後氷の上細胞を維持をお勧めします。上記の手順 2.2.4–2.2.11 を確認してくださいすべての試薬は、使用する前に 2-8 ° C で保持されます。
- 必要な試薬および材料を準備します。
3. 脾内注入 iHeps
- ケタミン (100 mg/kg) とキシラジン (10 mg/kg 腹腔内注射マウスを麻酔します。麻酔中には、乾燥を防ぐためにマウスの目に獣医軟膏を入れて、麻酔の効果を観察し、痛みを評価する彼らの筋肉の反射を監視します。
- マウスは、刺激に対する筋反射を失っている、一度右側臥の位置に配置します。5-8 分の左側腹部切開領域に脱毛クリームの厚い層を適用します。その後、水でぬらしたガーゼのパッドを使用して領域を拭くことによって脱毛クリームと髪を削除します。
- 左のわき腹ポビドン ヨードまたは、代わりに、3 回続けてポビドン ヨード消毒剤浸漬最終 70% エタノールをスクラブします。
- キャビネット レベル 2 バイオで左脇腹で透過的に視覚化することし、皮膚と腹壁を切開し、脾臓の位置 0.5-1 cm 外在脾臓先のとがったを使用してそれに近い優しく脂肪を抜く鉗子。やさしく綿棒を使用して脾臓を安定させます。
- 脾実質内にインスリン注射器 3-4 mm の針を挿入し、優しく細胞懸濁液の約 50 μ L を注入します。針を撤回し、出血を防ぐために 1 分および材料の流出の注射部位に綿棒を配置します。
- 腹膜に脾臓を戻り、5-0 ナイロン縫合糸で傷を閉じる。その後、3-16 h、正常な体温に戻るそれらとそれらを復活させるための暖かい商工会議所/インキュベーターでマウスを維持します。他の動物は、完全に回復するまでの会社には、手術を受けているマウスは返されません。
- 飲料水にメロキシカム (26 μ g/mL) を追加し、それぞれ抗炎症薬や鎮痛薬としてブプレノルフィン (50 μ g/kg) を筋肉内注射します。モニター外科傷、炎症を防ぐために毎日を。
注: すべての機器および 4-7 の手順で使用される供給が滅菌されていることを確認します。
4. 血漿 LDL-C のテスト
- 0、7、14、21、28 日後の生着に両手拘束を用いた頭部のサイド ・ ツー ・ サイド動きを最小限に抑えるために密に LRG マウスを抑制し、ランセットを使用して顔面静脈を穿刺します。血液は、ランセットを除去した後流れ始めます。1 μ L の EDTA を含む 1.5 mL チューブに血液の約 50 μ L を収集します。
注: グリップがあまりにもタイトな場合、収集した血液量になることがあります、マウスが呼吸困難のため死ぬことがあります。 - 優しく数回チューブの反転によって血をミックスし、950 × gで 15 分間遠心培養上清を収集し、すぐに-80 ° C で保存します。
- すべてのサンプルが収集されると、常温プラズマを解凍し、製造元のマニュアルに従って LDL-C 検出キットを用いた LDL-C レベルをテストします。
5 しますin Vivo薬物検査で +/-を来すと FH iHeps キメラ マウスにしみ込んで。
- 高コレステロール血症を誘発するには、マウスを供給 HFHC ダイエット生着前 7 日間。
- 7 日後の生着の車両 (PBS、皮下注射)、10 mg/kg をマウスの各グループの治療/週 PCSK9 抗体 (あまりにも皮下注射、PCSK9 に対するモノクローナル抗体の臨床グレード定式化)、10 mg/kg/日シンバスタチン (40 mg/L mg/水を飲んで mL)、か PCSK9 抗体とシンバスタチンの結合します。
- 0 (生着の日)、14、21、28 日後の生着マウス プラズマを収集します。-80 ° c のサンプルをすぐに保存します。
- すべてのサンプルが利用可能な製造元のマニュアルに従って LDL-C 検出キットを使用して血漿 LDL レベルをテストします。
6. 血管内皮機能検査
血管内皮機能は、FH の初期段階で影響を受けるし、重症度、病気やさまざまな治療法で改善を評価するための指標としてマウス モデルでテストできます。Stereomicrocope、剥離鉗子、ハサミ、ワイヤー第 1 報、集録ハードウェア (材料の表を参照)、これにはコンピューターが必要と。
- フェノバルビ タール 100 mg/kg 腹腔内投与によるマウスを犠牲に。内臓を削除下行大動脈の背骨に平行が表示され、一緒に隣接する組織と心臓のはさみによってを解剖することができます。良いはさみを使用して結果を分析し、冷たい酸素クレブス ソリューションに配置 (mM: 4.7 119 塩化ナトリウム、KCl、2.5 CaCl2、1 MgCl2、25 NaHCO3、1.2 KH2PO4、および 11 D-グルコース)。
- シリコーン コーティングのシャーレにクレブス ソリューションの気嚢を転送します。ピン結合組織それを伸ばすことがなく大動脈の位置を修正します。実体顕微鏡、使用微細鉗子はさみを春と血管壁を損傷することがなく周囲の脂肪と外の組織から無料の大動脈の解剖を下に切って 1.5 ~ 2 mm 長さセグメント。
- カット、約 2 cm 長く、40 μ m 厚ステンレス ワイヤと大動脈内腔をそっと。ワイヤーを保持することによって酸素のクレブス液でいっぱい線第 1 報室セグメントに転送します。
- 収縮性を勉強して、大動脈の線分の長さを測定するには、マイクロメータに顎と読む (D1) のレコードの間に垂直に各セグメントを配置します。セグメントを削除し一緒に顎を移動し、(D0) 読書を記録します。セグメントの長さは L になる = D1-D0。
- ワイヤーをクランプし、顎の間にセグメントを配置しながらドライバーで固定するユーザー ガイドに従ってくださいが未延伸されたまま。
- 実験前に正規化、ばねの位置でゼロに第 1 報を設定します。ゆっくりと離れての顎を移動し、3 mN に到達するまで変更大動脈緊張を観察します。15 分後、第 1 報室からソリューションをドレインし新鮮なクレブスによるソリューションに置き換え、15 分待つし、再び 3 mN にテンションを調整します。
- 標準のクレブス ソリューションを 60 mM 3 回少なくとも 15 分リンス新鮮なクレブス ソリューションのための収縮を誘発するクレブスの KCl を含むソリューションに変更します。
- 追加 (Phe; フェニレフリンの濃度を上げる例えば、10 から 100 μ m まで nM)。クレブスの標準液を洗い流すし、最大収縮前の収縮からの 〜 70% で単一 Phe 濃度を追加します。収縮が安定したときに、アセチルコリン (ACh; の濃度を上げるを追加例えば、10 または 30 μ M に 1 または 3 の nM から) 血管拡張を誘発します。ACh は、約 2 分間隔で追加されます。
注: 小さな Phe 収縮といくつかの大動脈のセグメントの例では KCl の 30% より小さい収縮、U46619 (別血管収縮薬) 1 から濃度 30 nM の 70% よりも大きく、安定した収縮を誘発する nM を使用できます塩化カリウムによる収縮。 - 製造元のマニュアルに従って第 1 報をクリーンアップします。
- データ分析ソフトウェアを使用して (材料の表を参照)、レコードの薬のすべての付加の後の力 (F)。基底の緊張にマーカーを引く (F基底) 相対的な測定として FPhePhe 後最高点に矢印を移動および FAChと ACh のすべての付加の後の最も低いポイントに移動します。% 緩和によるアセチルコリンによる内皮依存性血管 (EDV) を計算 = (FACh基底)/(PheF基底) y 軸に。X 軸上 log10 M 濃度の値を使用して統計ソフトウェアの濃度反応曲線を準備します。
- 統計の違いを分析するには、1 つのマウスから各セグメントの曲線の下の領域を使用して、一方向の分散分析を使用して、グループの中で曲線下面積の違いを分析します。必要な場合は、個々 のポイントを分析もできます。
7. iHep マウス肝における再作成の証拠
- エンドポイントでは、フェノバルビ タール 100 mg/kg を腹腔内注射することによって、マウスを犠牲に。
- 心臓穿刺によってプラズマを収集します。眼科用はさみを使って肝臓の葉を解剖し、10 cm ペリ-皿に肝臓を入れて、生理食塩水で 2 回洗浄します。吸水紙と肝表面から生理食塩水を削除し、0.6 cm 部分の周りに葉をカットします。10% ホルマリンで肝臓の葉を修正します。
- パラフィン、製造元の指示に従って、それぞれ処理システムおよび滑走式ミクロトームのティッシュを使用してセクションに固定の肝臓を埋め込みます。
- 60 ° C 1 時間ワックスを溶かすためにスライドを加熱します。キシレン 5 分用のスライドを 2 回、没頭し、連続して 100%、90%、70% エタノールをティッシュに水分補給します。
- スライド室の抗原検索ソリューションの約 50 mL を含むし、圧力鍋、120 ° C、5 分間水をパイプで軽くスライド 1.5 分洗浄に商工会議所にスライドを浸します。
- 一次抗体 (約 100 μ L/セクション) ヒト ALB (ハルブ) とヒトの核抗原 (hNA) ターゲットのセクションを染色します。その後、蛍光ラベルまたは西洋わさびペルオキシダーゼ (DAB 検出キットと反応) すると二次抗体で染色。
- ハルブ + エリアと hNA + 細胞の割合を計算するには、アンチ」と抗 hNA 染色し、セクション全体の画像を得るためのシステムをスキャン自動スライドを使用して軽くたたくと反応したスライドをスキャンします。
注: 全体セクション スキャン画像、ハルブ + エリアまたは hNA + 免疫組織化学染色の肝臓細胞に基づく公平な方法で再作成される効率を計算するのに役立ちます。IHep 再作成効率を監視する代替方法として血漿アルブミン人間特定 ALB ELISA キットを使用してテストできます。 - 5 X のビューの下でソフトウェアを表示する関連付けられたデジタル スライドを使用してスライドの全体をカバーするためのスナップショット画像を取る。ハルブ + の割合を定量化するには、エリア、各スナップショット イメージの顕微鏡イメージング ソフトウェアを使用して肯定的な領域 (P) とイメージの総面積 (T) を修飾してイメージ J を使用して空白の領域 (B) を修飾します。ハルブ + エリアの割合は P/(T-B) で表されます * 100%。グループごとに、少なくとも 3 のマウスを選択してください。各マウスの肝臓の位置の違いから、少なくとも 4 つのセクションを選択する必要があります。
- HNA + の割合を定量化するには、セル、各スナップショット画像処理ソフトウェア、イメージ領域の 1/16 をランダムに選択し、総核 (T) と hNA + 核 (N) の数を手作業で数えます。HNA + の割合は N/T で表されます * 100%。グループごとに、少なくとも 3 のマウスを選択してください。各マウス肝臓の位置の違いから、少なくとも 4 つのセクションを選択してください。
結果
IHeps に監督人間の分化 Ips
70% の合流点に達すると、人間の Ips が 3 ステップ プロトコル16 (図 1上部パネル) と iHeps に区別されます。内胚葉分化の 3 日後、iPSC の植民地なるを緩め、完全合流点 (図 1下段) に 。その後、2ndステージ中、hepatoblasts 表示し、増殖します。これらの細胞は混雑しているが、この段階 (日 7、図 1下のパネル) で明確なエッジを表示します。分化の 17 日は、典型的な六角形の形態と偏波 iHeps 表示されます (図 1下段)。これらの iHeps は、AAT と ALB (図 2 a) を含む pHH マーカーを表現します。また、流れの cytometry (図 2 b)15によって測定される ASGPR + iHeps の比率は比較的高いはずです。
FH で生体疾患モデルを用いた FH iHeps の生成
LRG マウス高コレステロール血症の開発のため、私たちと一緒にそれらを供給 HFHC ダイエット生着 (-7 日) の前に 7 日間。生着 (0 日目) の日、LRG マウスは約 3 倍血漿 LDL C レベル (約 600 mg/dL が、図 3 b) を表示します。15-17 iHeps に脾内注射を介して LRG マウスにしみ込んでいる日これらの iHeps はすぐに肝実質内に存在し、増殖が (図 3 a)。これらのキメラ マウスの肝臓は、収集し固定、ハルブと hNA、ハルブと hNA (図 4 a-E) 染色に基づいて LRG マウス肝臓における iHep を介した肝再作成の明確な証拠を示す必要がありますどちらのステンド グラスします。私たちの手で、+/-を来すと FH iHeps プラズマ LDL-C レベル大幅 21 日後移植 (図 4 階) を減らすことができます。この時点で、FH ひと肝臓キメラマウスは、FH の治療法をテストする使用できます。
使用可能な薬品を用いた FH ひと肝臓キメラマウス モデルの検証
我々 のモデルを検証するため、2 のよく知られている LDL コレステロール低下薬、シンバスタチン、PCSK9 抗体 (図 5 a) を使用しました。我々 のデータ、治療後 21 日 PCSK9 抗体がある証明能力を強化 LDL の低下および EDV の FH キメラマウス (図 5 bD) シンバスタチンより。特に、PCSK9 抗体 FH キメラマウスの LDL C プラズマの観測割合の減少は臨床試験4で報告に似ています。FH の新薬の前臨床テスト用 FH iHeps としみ込んで LRG キメラマウスの潜在的な有用性が示されました。

図 1: iHeps.Top パネルに人間の分化 Ips を監督、iPSC iHeps; 分化のためのタイムライン.の各段階の重要なサイトカインとメディアが表示します。(下のパネル)IHep 分化の異なる時点の代表的な位相コントラスト画像。KSR: ノックアウト血清交換;ホーチミン: 肝細胞培養培地;HGF: 肝細胞増殖因子;OSM: オンコスタチン m.この図の拡大版を表示するのにはここをクリックしてください。

図 2: iHeps 分化プロトコルの変更と生産の特性。(A) 蛍光の分化の各段階で iHeps。核はマージされた組成の青のステンド グラスします。フローサイトメトリーによって測定される、ASGPR + iHeps の派生の割合を示しています (B) バーは、17 日に取得。サンプル 3 の独立した実験で測定しました。平均値が表示され、エラーバーは標準偏差 (SD) を示します。この図の拡大版を表示するのにはここをクリックしてください。

図 3: iHeps FH体内疾患モデル創成。(A) 時間は LRG マウスに FH iHeps の脾内注入によるひと肝臓キメラマウスの世代のラインします。(B) バー グラフ、HFHC ダイエットと LRG マウスを餌に大幅リードを示しています LDL-C レベルの増加 (n = 10)。P値は、図に示されているし、対になっていない t 検定; を使用して得られました。平均値が表示され、エラー バー (SEM) 平均値の標準誤差を示します。パネル B は以前レポート15.の図 3 iから変更します。この図の拡大版を表示するのにはここをクリックしてください。
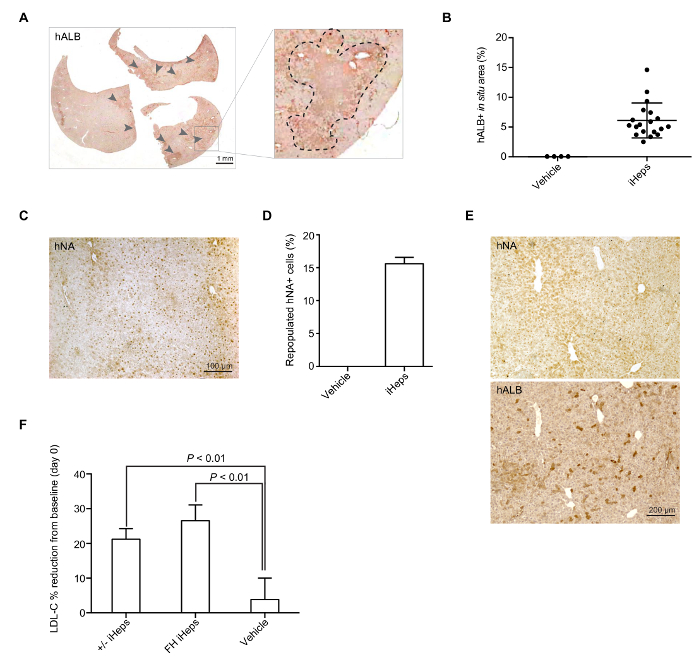
図 4: iHep 介した LRG マウス肝臓のインデックスを再作成します。(A) 代表的な全体セクション スキャン画像再来すiHeps +/-マウス肝臓における染色ハルブの。矢印は、マウス肝臓にしみ込んで人間 iHeps のクラスターを示します拡大されたセクションは、右側のパネルに表示されます。(B) 散布図グラフの割合を示していますが再作成」+ (から異なるドナー Ips) マウス肝臓における iHep 含む領域に対応する、計算の全体のセクションのスキャンされたイメージに基づいていた (n = 19)。平均値が表示され、エラー バーを示す明らかな移植 FH iHeps とマウスの肝臓における hNA の免疫染色の SD. (C) 代表的なイメージ。(D) バー グラフは、マウス肝臓 LRG の再作成される hNA + (異なるドナー Ips) から iHeps の割合を示しています (n = 3)。平均値が表示され、誤差範囲を示す (E) の SD ハルブと hNA 野生型 iHeps のマウス肝の 2 つの連続したセクションに染色します。(F) 棒グラフは、21 日後の生着; でプラズマのベースラインからの LDL C 低減の割合を示しますn = 5を来す+/iHeps と n = 6 FH iHeps の車両。P値は、図に示されているし、対になっていない t 検定; を使用して得られました。誤差範囲を示す SEM. パネル B、D、および E は図 3から変更された値が表示されますを意味する-3 i私たちの以前の報告15.この図の拡大版を表示するのにはここをクリックしてください。

図 5: PCSK9 抗体は強力な LDL のひと肝キメラ LRG マウスにおけるシンバスタチンより能力を低下を示す。(A)生体内で薬物検査の FH ひと肝臓キメラマウスを用いたアプローチの模式図。(BとC) 14、21、および FH キメラマウス HFHC 飼料し、示された薬の投与で 28 日に血漿 LDL-C のベースラインからの変化率n は、マウスの数を示します。クラスカル-ウォリス検定; を使用して得られたP値平均値が表示され、エラー バーを示す SEM. ACh 濃度の増加に応えて EDV (D)。P値は、示された濃度については、図で示されます。二元 · ダネットの多重比較; で調整を使用して得られたP値誤差範囲を示す SEM.図 5は、図 4 a-4 Cと図 5A前レポート15.から変更この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
齧歯動物で iHeps を使った過去の研究は、彼らが継承された肝疾患17を研究する効果的な方法を確認しました。さらにこの技術の使用を拡大し、現在 FH 動物モデルは最適ではないので、LRG マウスに FH iHeps にしみ込んで明らかな移植を来す± またはヘテロ接合体を来すことを示した-変異 FH iHeps マウス血漿 LDL-C を減らすことができます生体内で薬の脂質低下に対応。
IHeps を使用して人間の FH 肝臓キメラマウスを生成するためのプロトコルで 3 つの重要なステップがあります。
1) 分化を通じて高品質 iHeps の生産。IPSC 行18間クローンの変動を考えると、それは適切な比較に同質の Ips を使用するエンジニア リング部門と、生着を実行する前に母細胞ラインの iHep 分化効率をテストすることが重要です。
2) 正しい iHep 注射器にアップロードします。他のプロトコルから異なる 50% の細胞外マトリックス (最終濃度, v/v) iHeps、再懸濁しますを使用し、インスリン注射器にアップロードします。細胞外マトリックスが細胞を保護し、脾臓から肝臓に iHep 移行を容易にする環境を提供するいますと考えています。泡は手術のため致死因子を注射器で完全に避けるべきであります。
3) 明らかな移植細胞数を修正します。セルのオーバー ロードは、高い致死率につながることができます。25-30 g マウスあたり 100 万 iHeps を接がをお勧めします。
我々 のプロトコルもいくつかの制限があります: 照射誘起肝障害は中等度および単回投与と私たちの iHeps の成熟状態は pHH に匹敵します。両方考慮事項に関連して、我々 のモデルのキメリズムの程度はNOD/Lt-SCID/IL-2Rγ−/−マウスまたは iPSC 由来 iHeps17,19にしみ込んで Gunn ラットを記述する最近のレポートに似ています、がドイツ連邦共和国のマウスや pHH としみ込んで uPA トランスジェニック マウスよりも有意に低かった。一方で、この注意点を克服するために 1 つはさらに iHeps の成熟を図る肝分化プロトコルを最適化でした。その一方で、LRG マウスは来す-/-/Fah-/-/Rag2-/-/Il2rg-/-マウスを生成するドイツ連邦共和国のマウスと交配でした。
要約すると、ここで FH iHeps とひと肝キメラ動物を生成するため、明らかな移植の iHeps の機能のテストのための詳しいプロトコルを説明しました。重要なは、これらのキメラ マウスは生体内での薬物検査に使用できます。私たちのモデルは、iHeps の機能の改善や追加の遺伝子をノックアウトして可能性が高い最適化ことができます (e.g、 Fah) 受信者 LRG のマウス、およびそれ役に立つでしょう、疾患の病理メカニズムを調査し、前臨床試験を実行するには。研究。
開示事項
H. エフティ、ナショナルコーディネーターとサノフィ ・ Regeneron 医薬品主催オデッセイ成果調査官です。
謝辞
この作品は、深セン科学技術評議会基礎研究プログラム (JCYJ20150331142757383)、中国科学 (XDA16030502)、香港研究助成協議会テーマに基づいて研究院の戦略的な重点研究課題に支えられスキーム (T12-705/11)、香港特別行政区協議会研究助成金およびチーム プロジェクト広東省自然科学 (N-HKU730/12 と 81261160506) 研究中国の国家自然科学基金の協力プログラム財団 (2014A030312001)、広州技術プログラム (201607010086) と広東省科学技術プログラム (2016B030229007 および 2017B050506007)。
資料
| Name | Company | Catalog Number | Comments |
| Materials | |||
| 40 µm Cell strainer | BD | B4-VW-352340 | |
| 6-Well plate | Thermofisher | 140675 | Extracellular matrix coated |
| Accutase | Millipore | SCR005 | |
| Acetylcholine | Sigma Aldrich | A6625 | Dissolve in water |
| Antigen retrieval solution | IHC World | IW-1100-1L | |
| Calcium chloride | Sigma Aldrich | C8106 | CaCl2 |
| Cell dissociation enzyme | Thermofisher | 12604-013 | TrypLE |
| D-glucose | Sigma Aldrich | D8270 | |
| Dimethyl sulfoxide | Sigma Aldrich | D5879 | DMSO |
| DMEM | Thermofisher | 10829 | Knockout DMEM |
| DNase I | Roche | 11284932001 | |
| EDTA | USB | 15694 | 0.5 M, PH=8.0 |
| Extracellular matrix (for cell suspension) | Corning | 354234 | Matrigel |
| Extracellular matrix (for iHep differentiation) | Corning | 354230 | Matrigel |
| Hepatocyte basal medium | Lonza | CC-3199 | |
| Hepatocyte culture medium | Lonza | CC-3198 | |
| High-fat and high-cholesterol diet | Research Diet | D12079B | |
| Human Activin A | Peprotech | 120-14E | |
| Human hepatocyte growth factor | Peprotech | 100-39 | |
| Human iPSC maintenance medium | STEMCELL Technologies | 5850 | mTeSR1 |
| Human oncostatin M | Peprotech | 300-10 | |
| Ketamine 10% | Alfasan | N/A | |
| L-glutamine | Thermofisher | 35050 | |
| LDL-C detection kit | WAKO | 993-00404 and 993-00504 | |
| Magnesium chloride | VWR | P25108 | MgCl2 |
| Meloxicam | Boehringer Ingelheim | NADA 141-213 | |
| Monopotassium phosphate | USB | S20227 | KH2PO4 |
| Non-essential amino acids | Thermofisher | 11140 | |
| PBS | GE | SH30256.02 | Calcium and magnesium-free |
| PCSK9 antibodies | Sanofi and Regeneron Pharmaceuticals | SAR236553/REGN727 | Alirocumab |
| Phenobarbital | Alfamedic company | 013003 | |
| Phenylephrine | RBI | P-133 | Dissolve in water |
| Potassium chloride | Sigma Aldrich | P9333 | KCl |
| Povidone-iodine | Mundipharma | Betadine | |
| Recombinant mouse Wnt3a | R&D Systems | 1324-WN-500/CF | |
| ROCK inhibitor Y27632 | Sigma Aldrich | Y0503-5MG | |
| RPMI 1640 | Thermofisher | 21875 | |
| Serum replacement | Thermofisher | 10828 | |
| Silicone coated petri dish | Dow Corning | Sylgard 184 silicone elastomer kit | |
| Simvastatin | Merck Sharp & Dohme | ZOCOR | |
| Sodium bicarbonate | Sigma Aldrich | S6297 | NaHCO3 |
| Sodium chloride | Sigma Aldrich | S7653 | NaCl |
| Trypan blue solution 0.4% | Thermofisher | 15250061 | |
| U-46619 | Cayman | 16450 | Dissolve in DMSO |
| Xylazine 2% | Alfasan | N/A | |
| β-mercaptoethanol | Thermofisher | 31350 | |
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| AAT | DAKO | A0012 | 1:400 |
| ALB | Bethyl Laboratories | A80-129 | 1:200 |
| ASGPR | Santa Cruz | Sc-28977 | 1:100 |
| HNF4A | Santa Cruz | Sc-6557 | 1:35 |
| NANOG | Stemgent | 09-0020 | 1:200 |
| OCT4 | Stemgent | 09-0023 | 1:200 |
| Name | Company | Catalog Number | Comments |
| Mice | |||
| Il2rg-/- | Jacson lab | 003174 | |
| Ldlr-/- | Jacson lab | 002077 | |
| Rag2-/- | Jacson lab | 008449 | |
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Automated cell counter | Invitrogen | Countess | |
| Gamma irradiator | MDS Nordion | Gammacell 3000 Elan II | |
| Insulin syringe | BD | 324911 | |
| Powerlab | ADInstruments | Model 8/30 | |
| Slides scanning system | Leica biosystems | Aperio scanScope system | |
| Sliding Microtome | Leica biosystems | RM2125RT | |
| Stereomicrocope | Nikon | SMZ800 | |
| Tissue processing system | Leica biosystems | ASP200S | |
| Wire myograph | DMT | 610M | |
| Name | Company | Catalog Number | Comments |
| Softwares | |||
| Digital slide viewing software | Leica | Aperio ImageScope Version 12.3.2 | |
| Image J | NIH | Version 1.51e | |
| Image processing software | Adobe | Photoshop CC Version 2015 | |
| Microscope imaging software | Carl Zeiss | AxioVision LE Version 4.7 |
参考文献
- Brown, M. S., Goldstein, J. L. A receptor-mediated pathway for cholesterol homeostasis. Science. 232 (4746), 34-47 (1986).
- Endo, A. The discovery and development of HMG-CoA reductase inhibitors. J Lipid Res. 33 (11), 1569-1582 (1992).
- Dubuc, G., et al. Statins upregulate PCSK9, the gene encoding the proprotein convertase neural apoptosis-regulated convertase-1 implicated in familial hypercholesterolemia. Arterioscler Thrombo Vasc Biol. 24 (8), 1454-1459 (2004).
- Robinson, J. G., et al. Efficacy and safety of alirocumab in reducing lipids and cardiovascular events. N Engl J Med. 372 (16), 1489-1499 (2015).
- Fitzgerald, K., et al. Effect of an RNA interference drug on the synthesis of proprotein convertase subtilisin/kexin type 9 (PCSK9) and the concentration of serum LDL cholesterol in healthy volunteers: a randomised, single-blind, placebo-controlled, phase 1 trial. Lancet. 383 (9911), 60-68 (2014).
- Ishibashi, S., et al. Hypercholesterolemia in low density lipoprotein receptor knockout mice and its reversal by adenovirus-mediated gene delivery. J Clin Invest. 92 (2), 883-893 (1993).
- Watanabe, Y. Serial inbreeding of rabbits with hereditary hyperlipidemia (WHHL-rabbit). Atherosclerosis. 36 (2), 261-268 (1980).
- Carpentier, A., et al. Engrafted human stem cell-derived hepatocytes establish an infectious HCV murine model. J Clin Invest. 124 (11), 4953-4964 (2014).
- Tateno, C., et al. Near completely humanized liver in mice shows human-type metabolic responses to drugs. Am J Pathol. 165 (3), 901-912 (2004).
- Basma, H., et al. Differentiation and transplantation of human embryonic stem cell-derived hepatocytes. Gastroenterology. 136 (3), 990-999 (2009).
- Soldner, F., et al. Generation of isogenic pluripotent stem cells differing exclusively at two early onset Parkinson point mutations. Cell. 146 (2), 318-331 (2011).
- Bissig, K. D., et al. Human liver chimeric mice provide a model for hepatitis B and C virus infection and treatment. J Clin Invest. 120 (3), 924-930 (2010).
- Azuma, H., et al. Robust expansion of human hepatocytes in Fah(-/-)/Rag2(-/-)/Il2rg(-/-) mice. Nat Biotechnol. 25 (8), 903-910 (2007).
- Bissig-Choisat, B., et al. Development and rescue of human familial hypercholesterolaemia in a xenograft mouse model. Nat Commun. 6, 7339 (2015).
- Yang, J., et al. Generation of human liver chimeric mice with hepatocytes from familial hypercholesterolemia induced pluripotent stem cells. Stem Cell Rep. 8 (3), 605-618 (2017).
- Kajiwara, M., et al. Donor-dependent variations in hepatic differentiation from human-induced pluripotent stem cells. Proc Natl Acad Sci USA. 109 (31), 12538-12543 (2012).
- Chen, Y., et al. Amelioration of hyperbilirubinemia in gunn rats after transplantation of human induced pluripotent stem cell-derived hepatocytes. Stem Cell Rep. 5 (1), 22-30 (2015).
- Ortmann, D., Vallier, L. Variability of human pluripotent stem cell lines. Curr Opin Genet Dev. 46, 179-185 (2017).
- Liu, H., Kim, Y., Sharkis, S., Marchionni, L., Jang, Y. Y. In vivo liver regeneration potential of human induced pluripotent stem cells from diverse origins. Sci Transl Med. 3 (82), 82ra39 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved