Method Article
Eine familiäre Hypercholesterinämie menschlichen Leber chimärer Maus-Modell mit induzierten pluripotenten Stammzellen gewonnenen Hepatozyten
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Hier präsentieren wir ein Protokoll, um eine menschliche Leber chimärer Maus-Modell der Familiäre Hypercholesterinämie mit menschlichen induzierten pluripotenten Stammzellen gewonnenen Hepatozyten zu generieren. Dies ist ein wertvolles Modell zum Testen neuer Therapien für Hypercholesterinämie.
Zusammenfassung
Familiäre Hypercholesterinämie (FH) wird meist von geringer Dichte Lipoprotein (LDLR)-Rezeptor-Mutationen verursacht und führt zu einem erhöhten Risiko für kardiovaskuläre Erkrankungen früh einsetzende durch deutliche Erhöhung von LDL-Cholesterin (LDL-C) im Blut. Statine sind die erste Zeile von lipidsenkenden Medikamenten zur Behandlung von FH und andere Arten von Hypercholesterinämie, aber neue Ansätze entstehen in bestimmten PCSK9-Antikörpern, die nun in klinischen Studien getestet werden. Um neue therapeutische Ansätze für FH, neue Medikamente oder neue Rezepturen erforschen müssen wir in Vivo Modelle geeignet. Bestehen jedoch Unterschiede in der Lipid-Stoffwechselprofile im Vergleich zu Menschen ein zentrales Problem der verfügbaren Tiermodellen der FH. Um dieses Problem zu beheben, haben wir eine menschliche Leber chimärer Mausmodell mit FH induzierte pluripotente Stammzellen (iPSC) erzeugt-Hepatozyten (iHeps) abgeleitet. Wir verwendeten/Ldlr- / -/Rag2- / -/Il2rg- / - (LRG) Mäuse Immunabwehr von transplantierten menschlichen Zellen zu vermeiden und Beurteilung der Wirkung des LDLR-mangelhafte iHeps in ein LDLR null Hintergrund. Transplantierten FH iHeps könnte wieder zu bevölkern ca. 5-10 % der LRG Maus Leber basierend auf menschliches Albumin-Färbung. Darüber hinaus die eingepflanzt iHeps reagierte auf Lipidsenker und rekapitulierte klinische Beobachtungen der erhöhte Wirksamkeit der PCSK9 Antikörper gegenüber Statinen. Unsere menschlichen Leber Chimäre Modell könnte somit für präklinischen Erprobung neuer Therapien zur FH nützlich sein. Mit dem dasselbe Protokoll, ähnlich wie menschliche Leber chimeric Mäuse für andere FH genetische Varianten oder Mutationen, die entsprechend andere erblichen Erkrankungen der Leber kann auch generiert werden.
Einleitung
Low density Lipoprotein-Rezeptor (LDLR) fängt LDL-Cholesterin (LDL-C) im Blut, Cholesterinsynthese in der Leber zu modulieren. Mutationen im LDLR-Gen sind die häufigste Ursache für Familiäre Hypercholesterinämie (FH)1. Statine wurden traditionell die erste Zeile von Medikamenten zur Behandlung von FH und andere Arten von Hypercholesterinämie (vererbt oder erworben). Statine hemmen 3-hydroxy-3-Methylglutaryl-Coenzym eine Reduktase Cholesterinsynthese in der Leber2zu senken. Darüber hinaus erhöht die Statine LDLR-Ebenen auf der Oberfläche der Hepatozyten, Plasma LDL-C-Abstand zu fördern. Eine große Einschränkung der Behandlung mit Statinen ist jedoch, dass sie gleichzeitig induzieren die Expression von proprotein Konvertase Subtilisin/hexin 9 (PCSK9), ein Enzym, das LDLR bindet seinen Abbau3zu fördern. Dieser Effekt ist verantwortlich für die unzureichende oder sogar null Reaktion auf Statine bei vielen Patienten beobachtet. Dieser Mechanismus zu studieren, unerwartet, zur Entdeckung der eine alternative Möglichkeit zur Behandlung von Hypercholesterinämie führte. PCSK9-Antikörper, die kürzlich von der FDA zugelassen sind derzeit in klinischen Studien eingesetzt und zeigen höhere Wirksamkeit und bessere Verträglichkeit als Statine4. Der Erfolg von PCSK9 Antikörpern impliziert auch, dass möglicherweise gibt es andere Therapiemöglichkeiten den LDLR-Abbau-Weg (neben PCSK9) bei Patienten mit Hypercholesterinämie zu modulieren. Ebenso gibt es Interesse an der Entwicklung neuer Inhibitoren des PCSK9 als Antikörper, z. B. SiRNA Oligos5.
Um zu testen, neue Therapien für FH und im Allgemeinen jede andere Art von Hypercholesterinämie, sind geeignete in-Vivo -Modelle notwendig. Ein Hauptproblem der aktuellen in-Vivo -Modelle, meist Mäuse6 und7, Kaninchen sind ihre physiologische Unterschiede mit den Menschen. Entscheidend ist, gehören diese Probleme eine unterschiedliche metabolische Lipidprofil. Die Generation der menschlichen Leber Chimären Tiere8 könnte helfen, diese Einschränkung zu überwinden. Die menschliche Leber Chimäre Maus ist eine Art von "humanisierte" Maus mit seiner Leber aufgefüllt mit humanen Hepatozyten, z. B. primären humanen Hepatozyten (pHH)9. Ein Problem mit pHH ist, dass sie schnell erweiterte Ex Vivo, nicht verlieren ihre Funktion bei der Isolierung und eine begrenzte Quelle sind. Eine Alternative zu pHH ist die Verwendung von induzierten pluripotenten Stammzellen (iPSC)-abgeleitet von Hepatozyten (iHeps)10. Vor allem iPSCs sind patientenspezifischen und auf unbestimmte Zeit, so dass iHeps on Demand produziert werden kann, ist ein wesentlicher Vorteil gegenüber frischen pHH angebaut werden können. Darüber hinaus können iPSCs auch leicht gentechnisch werden mit Designer Nukleasen zu korrigieren oder Mutationen in einem isogenen Hintergrund erlauben mehr Treue Vergleiche11vorstellen.
Menschlichen Leber chimärer Maus mit eingepflanzt pHH zeigen Ähnlichkeiten zu den Menschen in der Leber Stoffwechselprofile, Medikament Antworten und Anfälligkeit für Hepatitis-Virus-Infektion-12. Dadurch haben sie ein gutes Modell, Hyperlipidämie in Vivozu studieren. Die am häufigsten verwendete Mausmodelle basieren auf der/Fah- / -/Rag2- / -/Il2rg- / - (BRD) Maus13 und der uPA transgenen Maus8, in dem bis zu 95 % der Maus Leber durch pHH ersetzt werden kann. Ein kürzlich veröffentlichter Bericht beschriebenen Interessanterweise eine menschliche Leber FH Chimäre Maus (bezogen auf die BRD-Maus) mit pHH von einem Patienten mit einem homozygot LDLR Mutation14. In diesem Modell Waldlandschaften humanen Hepatozyten hatte keine funktionale LDLR, aber die restlichen Maus Hepatozyten haben, wodurch das Dienstprogramm für die Durchführung von in-Vivo Tests von Medikamenten unter Berufung auf die LDLR-Weg.
Hier berichten wir über ein detailliertes Protokoll basierend auf unserer kürzlich veröffentlichtes Werk15 für FH-iHeps in die/Ldlr- / -/Rag2- / -/Il2rg- / - (LRG) Maus Leber Einpflanzen. Diese menschlichen Leber chimärer Maus eignet sich für die FH Modellierung und Durchführung von Drogentests in-vivo.
Protokoll
Alle hier beschriebene Methoden, bei denen die Verwendung von Tieren wurden vom Ausschuss für Verwendung von Leben Tiere in Lehre und Forschung (CULATR) von der University of Hong Kong genehmigt.
1. Vorbereitung und phänotypische Tests Maus
-
Generation von immungeschwächte Ldlr -Knockout (KO)-Mäusen.
- Verwenden Sie die Mäuse Stämme Ldlr- / -, Rag2- /-und Il2rg- / - (siehe Tabelle der Materialien).
- Überqueren Sie Rag2- / - Mäuse mit Il2rg- / - Mäusen zu generieren Rag2- / -/ Il2rg- / - Mäusen, überqueren dann Ldlr- / - Mäuse mit Rag2- / - / Il2rg- / - Mäuse, Ldlr- / -/Rag2- / -/Il2rg- / - (LRG) Mäuse15zu generieren. Im Alter von 3 bis 4 Wochen sammeln Sie genomischen DNA aus dem Ohr des Genotyps durch PCR und Sequenzierung zu bestimmen.
- Verwenden Sie im Alter von 8 bis 12 Wochen männliche LRG Mäuse als Empfänger für iHeps zum menschlichen Leber chimeric Mäuse generieren.
- Füttern Sie die Mäuse mit eine fettreiche und cholesterinreiche Diät (HFHC) 7 Tage vor der Transplantation iHep Hypercholesterinämie entwickeln.
- Zur Schädigung der Leber zu induzieren, der erleichtert die Verbreitung von eingepflanzt iHeps in der Leber, legen Sie die Mäuse in einen sterilen Behälter und bestrahlen sie mit einem Gamma-Strahler mit γ-Strahlen in einer Dosierung von 3 Gy 24 h vor Engraftment. Kehren Sie die Mäuse zu ihren Käfigen Gehäuse. Der gesunde Status dieser bestrahlten Mäuse kann überwacht werden, indem Sie ihr Gewicht messen. Mäuse mit 20 % Gewichtsverlust oder größer werden eingeschläfert werden.
2. iHep Differenzierung und Dissoziation
LDLR heterozygot KO (+/-) oder homozygot KO (- / -) menschlichen iPSCs oder FH Patienten-iPSCs mit heterozygoten Mutationen in LDLR (FH iPSCs) werden verwendet, um iHeps zu produzieren. Die Generation der LDLR + /- oder- / - iPSCs und FH iPSCs ist in unserem vorherigen Bericht15beschrieben.
- Gerichtete Differenzierung der iPSCs in iHeps
Hinweis: Die Methode zur Differenzierung der menschlichen iPSCs in iHeps ist aus einem früheren Bericht16geändert.- Drei Tage vor der Differenzierung (Tag-3), Samen beschichtet die iPSCs auf extrazelluläre Matrix 6-Well-Platten (siehe Tabelle der Materialien) in einer Dichte von 300.000 Zellen/Brunnen in 1,5 mL (auch im folgenden) menschlichen iPSC Wartung Medium (siehe Tabelle der Materialien ) mit 5 µM-ROCK-Inhibitor (Y27632) ergänzt. Kultur der Zellen bei 37 ° C in einem 5 % CO2 befeuchteten Inkubator. Normalerweise reichen iHeps aus einer 6-Well-Platte 5 Mäusen einheilungschancen.
- 24 Stunden später (Tag-2) und 48 h später (Tag-1), das Medium zu frischem menschlichen iPSC Wartung Medium ohne ROCK-Hemmer verändern.
Hinweis: iPSCs vor Differenzierung sollte zum Ausdruck bringen hohe OCT4 und NANOG, die durch quantitative RT-PCR, Immunfluoreszenz oder Durchflusszytometrie geprüft werden kann. - Am Tag 0 der Differenzierung waschen Sie die Zellen mit RPMI 1640 einmal und dann fügen Sie RPMI 1640 mit 100 ng/mL Activin A und 25 ng/mL WNT3a ergänzt hinzu.
- Am Tag 1 und Tag 2 der Differenzierung verändern Sie das Medium für RPMI 1640 ergänzt mit 100 ng/mL Activin A.
Hinweis: Wenn in diesem Stadium gibt es zuviel Zelltod (0 – 3 Tage), bis zu 0,5 % fetalen bovine Serum (FBS) kann das Medium zur Verbesserung der Zellviabilität hinzugefügt werden. Wir empfehlen jedoch, testen die minimale Menge an FBS für jede spezifische iPSC-Zeile hinzugefügt werden, da überschüssige FBS auch die Differenzierung beeinflussen kann. - Am 3. Tag waschen Sie die Zellen mit DMEM einmal und wechseln Sie zu 2Nd Stufe Mittel (20 % Serum Ersatz, 1 X nicht-essentiellen Aminosäuren, 2 M L-Glutamin, 0,1 M Beta-Mercaptoethanol und 1 % Dimethyl Sulfoxid in DMEM Medium). Verändern Sie das Medium jeden zweiten Tag bis 10. Tag.
Hinweis: Am Tag 7, die Zellen sollten Confluence und Display klare Kanten erreicht haben. Möglicherweise gibt es einige undifferenzierte Bereiche erscheinen in diesem Stadium; ignorieren sie, wenn der Prozentsatz dieser Bereiche klein ist. Wenn der Anteil hoch ist, reduzieren Sie den Zusammenfluss von iPSCs am Tag 0 und die Höhe der FBS verwendet in der ersten Phase der Differenzierung. - Am 10. Tag waschen Sie die Zellen mit Hepatozyten basal Medium einmal und wechseln Sie zu Hepatozyten Kulturmedium ergänzt mit 20 ng/mL menschlichen hepatischen Wachstumsfaktor und 20 ng/mL Oncostatin M iHep Reifung zu fördern. Verändern Sie das Medium täglich.
Hinweis: in diesem Stadium > 90 % der Zellen nach Immunfluoreszenz-Färbung oder Flow-zytometrie für HNF4A, positiv sein sollte. - Am Tag 15 – 17 sind die Zellen für Engraftment bereit. Optional kann der Überstand der Zellkultur gesammelt und bei-80 ° C zur Quantifizierung der sekretierten Albumin (ALB) von iHeps gespeichert.
Hinweis: in diesem Stadium > 80 % iHeps für HNF4A, ALB und α1-Antitrypsin (AAT) nach Immunfluoreszenz Färbung positiv sein sollte. Rund sollten 60 – 70 % der Tag 17 iHeps positiv für ASGPR, Durchflusszytometrie gezeigt. In unseren Händen haben iHeps zu dieser Zeit optimalen Kapazität die Maus Leber wieder zu bevölkern; iHeps kann sezernieren höhere in-vitro-ALB aber auch alternde verzögert das Engraftment geworden.
- Dissoziation und Laden des iHeps in eine Insulin-Spritze
- Bereiten Sie den erforderlichen Reagenzien und Materialien:
- 24 h vor Engraftment, tauen die erforderliche Menge (V = 40 µL * Mäuse Zahl) der extrazellulären Matrix in ein Eis-box in einem kalten Raum und 4 ° C Kühlschrank der Insulin Spritze und eine Schachtel mit 200 µL Tipps umgesetzt.
- Eine Stunde vor Engraftment, warme Zelle Dissoziation Enzyms ergänzt mit 50 µg/mL DNase ich auf Raumtemperatur und das RPMI 1640 Medium ergänzt mit 20 % Serum Ersatz auf Eis legen.
- Nehmen Sie Kontrast Phasenbilder (100 X und 200 X) des iHeps ihren Status, einschließlich der Zellmorphologie, Wachstum und Zelldichte aufzeichnen.
- IHeps mit 2 mL/auch der Raumtemperatur Ca2 + und Mg2 +waschen-PBS zweimal frei, und fügen Sie 1 mL der Zelle Dissoziation Enzym ergänzt mit 50 µg/mL DNase ich in jede Vertiefung. Die Zellen in den Brutkasten für 8 – 10 min zurücklegen.
Anmerkung: Zur Verbesserung der Zelle Dissoziation mit Zelle Dissoziation Enzym waschen Sie die Zellen mit Ca2 + und Mg2 +-freie PBS. Zur Maximierung der Zellviabilität empfiehlt es sich, nicht mehr als 6 Brunnen pro Charge gleichzeitig abkoppelt. Darüber hinaus empfehlen wir die Zelle Dissoziation Enzymbehandlung auf weniger als 10 Minuten zu beschränken. - Monitor Zellmorphologie unter die Lupe genommen. Wenn die meisten Zellen Runden werden, fügen Sie ein gleiches Volumen an kalten RPMI 1640 ergänzt mit 20 % Serum Ersatz in jede Vertiefung, pipette die Zellen sanft, von der Platte zu lösen und übertragen die Zellsuspension auf eine neue 15 mL Tube.
Hinweis: Dieser Schritt ist wichtig für die geernteten Zellen überleben. Wenn die Zellen schwer von der Platte zu lösen sind, ist es egal, ob einige der Zellen übrig geblieben sind. Wenn die Zellen wie große Quadrate der Monolage lösen, dann pipette vorsichtig nach Zentrifugation, eine einzelne Zelle Suspension zu erhalten. - Wiederholen Sie Schritt 2.2.4 für gut, bis fast alle angeschlossene Zellen gesammelt werden. Zentrifuge bei 200 X g für 3 min bei 4 ° C.
- Entfernen Sie den überstand und Aufschwemmen Sie Zellen mit 2 mL kaltem PBS in einer 15 mL Tube. Die Zellen vorsichtig, um zu erhalten eine einzellige Suspension und fügen Sie dann kaltem PBS zu einem Endvolumen von 1 mL Pipette * Anzahl der dissoziierten Brunnen. Zu guter Letzt durchlaufen Sie die Zellen ein 40 µm Zelle Sieb um Aggregate zu entfernen.
Hinweis: Normalerweise können 1-2 x 106 Zellen/Well nach Filterung geerntet werden. - Aliquoten 20 µL der Zell-Aussetzung und 20 µL 0,4 % Trypan blau Lösung hinzufügen, dann zählen Sie die Zellen mit einem automatisierten Zelle Zähler und erfassen die Konzentration der Zellsuspension als "C". Berechnen Sie das benötigte Volumen (V1 = [106 * (n + 1)] / C, wo n ist die Anzahl der Mäuse zu aufgeprägt werden) der Zellsuspension (1 Million/Maus) für die intrasplenic Injektion.
- Aliquoten das erforderliche Volumen der Zellsuspension in 15 mL-Tuben und Zentrifuge bei 200 X g für 3 min bei 4 ° C.
- Entfernen den überstand, Aufschwemmen der Zellen in das entsprechende Volumen der kaltem PBS zu das Volumen der Zellsuspension (n + 1) * 55/2 µL (n = Anzahl der Mäuse), und fügen Sie dann ein gleiches Volumen der extrazellulären Matrix zu der letzte Band der Zellsuspension (n + 1) * 55 µL.
- Die kalte Insulin Spritze auf Eis legen, ziehen Sie den Kolben, 55 µL Zellsuspension in die Spritze zu übertragen und dann wieder den Kolben. Luftblasen vorsichtig zu entladen und die Spritze wieder auf Eis gelegt.
- 2.3.10 zu wiederholen, bis alle Spritzen mit den Zellen geladen wurden. Die Spritzen sind nun fertig für die Injektion.
Hinweis: Um die Zellviabilität zu maximieren, empfehlen wir die halten der Zellen auf dem Eis nach Dissoziation. Stellen Sie für die oben genannten Schritte 2.2.4–2.2.11 sicher alles, was die Reagenzien vor Gebrauch bei 2 – 8 ° C gehalten werden.
- Bereiten Sie den erforderlichen Reagenzien und Materialien:
3. Intrasplenic Injektion von iHeps
- Die Mäuse mit Ketamin (100 mg/kg) und Xylazin (10 mg/kg) intraperitoneal injiziert zu betäuben. Tierarzt Salbe auf Mäuse Augen Trockenheit während des Anästhesie-Verfahrens zu verhindern, und überwachen Sie ihre Muskel-Reflexe um die Narkose Wirkung beobachten und beurteilen, Schmerzen.
- Wenn Mäuse muskelreflex Stimulation verloren haben, legen Sie sie in der rechten Ecke, die seitlichen Dekubitus zu positionieren. Die Schnitt-Bereich in der linken Flanke für 5 – 8 min eine dicke Schicht von Enthaarungscreme zuweisen. Dann entfernen Sie die Enthaarungscreme und Haar durch den Bereich mit einem Wasser angefeuchteten Tupfer abwischen.
- Schrubben Sie die linke Flanke mit Povidon-Jod oder alternativ mit 70 % Ethanol 3 Mal gefolgt von einer endgültigen Einweichen mit Povidon-Jod zur Desinfektion.
- In einer Stufe 2 Biosafety Kabinett, platzieren Sie die Milz, die in der linken Flanke transparent visualisiert werden kann, und dann Einschneiden der Haut und Bauchdecke für 0,5 – 1 cm. Exteriorize die Milz durch Herausziehen das Fettgewebe sanft in der Nähe von es mit Spitzen Zange. Die Milz, die mit einem Tupfer vorsichtig zu stabilisieren.
- Stechen Sie die Nadel der Spritze Insulin 3 – 4 mm in das Parenchym der Milz und injizieren Sie etwa 50 µL Zellsuspension sanft zu. Zurückziehen der Nadelöhrs und einem Wattestäbchen über die Injektionsstelle für 1 Minute, um Blutungen zu verhindern und Auslaufen des Materials.
- Die Milz, das Peritoneum zurück und schließen Sie die Wunde mit 5: 0-Nylon-Fäden. Dann halten Sie Mäuse in einem warmen Kammer/Inkubator für 3 – 16 h sie wieder ihre normale Körpertemperatur und sie wiederbeleben. Mäuse, die operiert wurden sind nicht an die Gesellschaft anderer Tiere bis vollständig erholt zurückgegeben.
- Das Trinkwasser Meloxicam (26 μg/mL) hinzu und injizieren Sie Buprenorphin (50 μg/kg) intramuskulär als entzündungshemmendes Medikament und Schmerzmittel, beziehungsweise. Monitor chirurgische Wunden täglich um eine Entzündung zu verhindern.
Hinweis: Stellen Sie sicher, dass alle Instrumente und Zubehör für die Schritte 4 bis 7 steril sind.
4. Test der LDL-C-Plasmaspiegel
- Am Tag 0, 7, 14, 21 und 28 nach Engraftment Zurückhalten der LRG Mäuse fest-seitliche Bewegung des Kopfes mit Two-Handed Restrain Methode zu minimieren, dann Punktion der Vena facialis mit der Lanzette. Blut wird nach der Entfernung der Lanzette zu fließen beginnen. Sammeln Sie rund 50 µL Blut in 1,5 mL Röhrchen mit 1 µL EDTA.
Hinweis: Wenn der Griff zu eng ist, kann das gesammelte Blutvolumen reduziert werden und Mäuse können wegen Atemnot sterben. - Das Blut durch invertieren die Röhren mehrmals vorsichtig mischen und dann Zentrifuge bei 950 X g für 15 min. die Überstände zu sammeln und sofort bei-80 ° C aufbewahren.
- Sobald die Proben gesammelt werden, das Plasma bei Raumtemperatur Auftauen und der LDL-C-Level mit einem LDL-C Detection Kit laut Handbuch des Herstellers zu testen.
5. in Vivo Drogentests in Chimeric Mäuse pfropfte mit LDLR + /- und FH-iHeps
- Hypercholesterinämie induzieren, füttern Sie die Mäuse eine HFHC Diät 7 Tage vor Engraftment.
- Bei 7 Tage nach dem Engraftment behandeln jede Gruppe von Mäusen mit Fahrzeug (PBS, subkutan injiziert), 10 mg/kg/Woche PCSK9 Antikörper (eine klinische Grade Formulierung PCSK9 monoklonaler Antikörper, auch subkutan injiziert), 10 mg/kg/Tag Simvastatin (40 mg/L mg / mL im Trinkwasser), oder kombinierte PCSK9 Antikörper und Simvastatin.
- Maus-Plasma bei 0 (der Tag des Engraftment), 14, 21 und 28 Tagen nach dem Engraftment zu sammeln. Speichern Sie die Proben bei-80 ° C sofort.
- Sobald die Proben zur Verfügung stehen, testen Sie das Plasma LDL Niveau mit einem LDL-C Detection Kit, laut Handbuch des Herstellers.
6. endotheliale Funktionstest
Endotheliale Funktion ist früh im FH betroffen und als Indikator für die Schwere der Krankheit oder zur Bewertung der Verbesserung mit verschiedenen Behandlungen in unserem Mausmodell getestet werden kann. Ein Stereomicrocope, Dissektion Pinzetten, Scheren, Draht Myograph, Datenerfassungshardware (siehe Tabelle der Materialien), und ein Computer sind dafür erforderlich.
- Die Mäuse durch intraperitoneale Injektion von 100 mg/kg Phenobarbital zu opfern. Inneren Organe zu entfernen, so dass die absteigende Aorta parallel zur Wirbelsäule sichtbar ist und durch Schere zusammen mit angrenzenden Gewebe und Herz zergliedert werden kann. Betrachten, die mit einer feinen Schere zu sezieren und legen Sie sie in kalten sauerstoffhaltigen Krebs-Lösung (mM: 119 NaCl, 4.7 KCl, 2,5 CaCl2, 1 MgCl2, 25 Nahco33, 1.2 KH2PO4und 11 D-Glucose).
- Übertragen Sie betrachten in Krebs-Lösung auf einer Petrischale silikonbeschichteten. Heften Sie das Bindegewebe um die Aorta Position fixieren ohne dehnen. Unter einem Stereomikroskop, Verwendung feinen Pinzette Frühling die Schere und die Aorta, die frei von Fett und adventitial Gewebes zu sezieren, ohne Beschädigung der Gefäßwand, dann schneiden Sie es in 1,5 bis 2 mm Länge Segmente.
- Schneiden Sie einen ca. 2 cm lang und 40 μm dicken Edelstahl Draht und legte sanft durch das Lumen der Aorta. Übertragen Sie das Segment der Draht Myograph Kammer gefüllt mit Sauerstoff angereichertes Krebs Lösung halten den Draht.
- Um die Länge der Segmente betrachten Messen beim Studium der Kontraktilität, legen Sie jedes Segment senkrecht zwischen Kiefer und Aufzeichnung der Lesung (D1) auf den Mikrometer. Segment zu entfernen und die Backen zusammen zu bewegen und Aufzeichnung der Lesung (D0). Die Länge des Segments wäre L = D1-D-0.
- Befolgen Sie die Anleitung um den Draht Spannen und sichern Sie es mit dem Schraubendreher, während das Segment zwischen die Backen zu platzieren, aber lassen Sie es ungedehnt.
- Für Normalisierung vor dem Experiment die Myograph die ungedehnten Position auf NULL gesetzt. Dann langsam bewegen Sie die Kiefer auseinander und beobachten Sie die Aorta Spannung ändern bis 3 min zu erreichen. Nach 15 Minuten abtropfen lassen Sie die Lösung aus der Kammer Myograph und ersetzen Sie durch neue Krebs-Lösung, 15 min. warten Sie und stellen Sie die Spannung wieder auf 3 Mio.
- Ändern Sie die Standardlösung Krebs Krebs KCl enthaltende Lösung induzieren eine Kontraktion für mindestens 15 min. Spülen mit frischen Krebs Lösung 3 x 60 mm.
- Fügen Sie steigende Konzentrationen von Phenylephrin (Phe; z. B.von 10 nM bis 100 μm). Auswaschen mit Krebs-Standardlösung und Hinzufügen einer einzigen Konzentration von Phe bei ~ 70 % der maximalen Kontraktion bei der vorherigen Kontraktion. Wenn die Kontraktion stabil ist, fügen Sie steigende Konzentrationen von Acetylcholin (ACh; z.B.1 oder 3 nm bis 10 oder 30 µM), Vasodilatation zu induzieren. ACh wird in ca. 2 min Intervall hinzugefügt.
Hinweis: In einigen Aortenstenose mit kleinen Phe-induzierten Kontraktion z. B. kleiner als 30 % KCl induzierte Kontraktion, U46619 (ein weiterer Vasokonstriktor) in einer Konzentration von 1 nM bis 30 nM kann verwendet werden, um eine stabile Kontraktion induzieren, die größer als 70 % der KCl-induzierten Kontraktion. - Reinigen Sie die Myograph laut Handbuch des Herstellers.
- Mit Daten-Analyse-Software (siehe Tabelle der Materialien), Aufzeichnung der Kraft (F) nach jeder Zugabe von Medikamenten. Zeichnen die Markierung zum basalen Spannung (Fbasale) für relativmessung, bewegen Sie den Pfeil auf dem höchsten Punkt nach Phe als FPheund dann bis zum tiefsten Punkt nach jeder Zugabe von ACh als FACh. Berechnen Sie die ACh-induzierte Endothel-abhängige Vasodilatation (EDV) durch % Entspannung = (FACh-Fbasale) / (FPhe-Fbasale) auf der Y-Achse. Bereiten Sie eine Konzentrationskurve Antwort auf Statistiksoftware mit log10 Wert der Konzentration in M auf der X-Achse.
- Um die Statistische Differenz zu analysieren, nutzen Sie die Fläche unter der Kurve der einzelnen Segmente von einer Maus, und analysieren Sie die Differenz der Fläche unter der Kurve unter Gruppen verwenden einfache ANOVA. Einzelne Punkte können auch analysiert werden, wenn nötig.
7. Nachweis der iHep Wiederbesiedlung in der Maus-Leber
- Am Endpunkt Opfern Sie die Mäuse durch die intraperitoneale Injektion von 100 mg/kg Phenobarbital.
- Sammeln Sie Plasma durch Herzpunktion. Sezieren Sie Lappen der Leber mit ophthalmologischen Schere, dann Leber in ein 10-cm-Peri-Gericht und zweimal mit Kochsalzlösung waschen. Saline von der Leber Oberfläche mit Küchenpapier entfernen, dann die Lappen in um Länge von 0,6 cm Stücke schneiden. Befestigen Sie die Lappen der Leber in 10 % Formalin.
- Betten Sie die festen Lebern in Paraffin und Abschnitt mit einem Gewebe Verarbeitung System und eine gleitende Mikrotom bzw. nach Herstellerangaben ein.
- Erhitzen Sie die Folien auf 60 ° C für 1 h bis das Wachs zu schmelzen. Dann Tauchen Sie die Folien in Xylol für 5 min zweimal, und rehydrieren Sie das Gewebe mit 100 %, 90 % und 70 % Ethanol sukzessive.
- Tauchen Sie die Folien in der Dia-Kammer, enthält etwa 50 mL Antigen-Retrieval-Lösung und setzen Sie dann die Kammer in den Schnellkochtopf, 120 ° C 1,5 min. waschen die Folien vorsichtig mit Rohr für 5 Minuten Wasser.
- Färben Sie die Abschnitte mit primären Antikörper (rund 100 µL/Abschnitt) auf menschliche ALB (hALB) und menschlichen Zellkerne Antigen (hNA). Dann Fleck mit sekundären Antikörper konjugiert mit einem fluoreszierenden Etikett oder Meerrettich-Peroxidase (die mit dem DAB Detection Kit reagiert).
- Um den Prozentsatz der hALB + Gebiete und hNA + Zellen berechnen, Scannen Sie die Dias mit Anti-hALB und Anti-hNA befleckt und reagierten mit DAB mit einer automatisierten Folie Abtastsystem ganzer Abschnitt Bilder zu bekommen.
Hinweis: Ganze Abschnitt gescannten Bilder sind hilfreich, um Waldlandschaften Effizienz basierend auf hALB + Bereiche oder hNA +-Zellen in der Leber Immunohistochemistry gebeizt unvoreingenommen zu berechnen. Als eine alternative Methode zur iHep Wiederbesiedlung Effizienz zu überwachen kann menschliches Albumin-Plasmaspiegel mit einem menschlichen spezifische ALB ELISA-Kit getestet werden. - Nehmen Sie Schnappschüsse um die ganze Folie mit dem zugehörigen digitalen Schieber Viewer-Software unter 5 X Ansicht zu decken. Zur Quantifizierung des Prozentsatz der hALB + Bereiche für jedes Snapshotbild, das Mikroskop imaging-Software verwenden, um den positiven Bereich (P) und die Gesamtfläche (T) des Bildes zu qualifizieren und Bild J verwenden, um den leeren Bereich (B) zu qualifizieren. Der Anteil der hALB + Bereiche wird ausgedrückt als P/(T-B) * 100 %. Für jede Gruppe sollte mindestens 3 Mäuse ausgewählt werden. Und für jede Maus mindestens 4 Abschnitte aus verschiedenen Positionen der Leber gewählt werden.
- Zur Quantifizierung des Prozentsatz der hNA + Zellen für jedes Snapshotbild, nach dem Zufallsprinzip auswählen 1/16 des Bereichs mit einer Bildverarbeitungs-Software, und dann manuell die Anzahl der insgesamt Kerne (T) und hNA + Kerne (N). Der Anteil der hNA + wird ausgedrückt als N/T * 100 %. Für jede Gruppe sollte mindestens 3 Mäuse ausgewählt werden. Für jede Maus sollte mindestens 4 Abschnitte aus verschiedenen Positionen der Leber ausgewählt werden.
Ergebnisse
Gerichtete Differenzierung der menschlichen iPSCs in iHeps
Beim Zusammenfluss von 70 % zu erreichen, werden menschliche iPSCs in iHeps mit einem 3-Stufen-Protokoll16 (Abbildung 1 obere Leiste) unterschieden. Nach 3 Tagen Entoderm Differenzierung werden iPSC Kolonien gelockert und breitete sich auf volle Zusammenfluss (Abbildung 1 untere Leiste). Dann mit 2Nd Stufe Mittel, Hepatoblasts erscheinen und vermehren sich. Diese Zellen sind überfüllt, aber zeigen klare Kanten in diesem Stadium (Tag 7, Abbildung 1 untere Leiste). Nach 17 Tagen der Differenzierung polarisierte iHeps mit typisch Sechsecks Morphologie angezeigt (Abbildung 1 untere Leiste). Diese iHeps express pHH Markierungen, einschließlich AAT und ALB (Abbildung 2A). Darüber hinaus sollte das Verhältnis von ASGPR + iHeps relativ hoch, gemessen an Flow Cytometry (Abb. 2 b)15.
Generation von einer FH In Vivo Krankheit Modell verwenden FH-iHeps
LRG Mäuse Hypercholesterinämie entwickeln helfen, füttern wir sie mit einer HFHC Diät 7 Tage vor Engraftment (Tag -7). Am Tag des Engraftment (Tag 0) zeigt LRG Mäuse rund 3-fold Plasma LDL-C-Ebene (ca. 600 mg/dL, Abb. 3 b). Tag 15 – 17 iHeps in LRG Mäuse durch intrasplenic Injektion aufgeprägt sind; Diese iHeps bald in das Leberparenchym wohnen und sich dort vermehren (Abb. 3A). Am Endpunkt Lebern dieser chimeric Mäuse gesammelt und fixiert, dann gefärbt mit hALB und hNA, beide mit klaren Beweis von iHep-vermittelten Leber Wiederbesiedlung in LRG Maus Leber anhand der Färbung für hALB und hNA (Abbildung 4A-E) angezeigt werden soll. In unseren Händen könnte LDLR + /- und FH-iHeps Plasma LDL-C Ebene deutlich 21 Tage nach dem Engraftment (Abbildung 4F) reduzieren. An dieser Stelle können FH menschlichen Leber chimeric Mäuse verwendet werden, um Therapien für FH zu testen.
Validierung der FH menschlichen Leber chimärer Maus-Modell mit verfügbaren Medikamente
Um unser Modell zu validieren, verwendeten wir 2 bekannte LDL-C senkende Medikamente, Simvastatin und PCSK9 Antikörper (Abb. 5A). Unsere Daten zeigen, dass 21 Tage nach der Behandlung PCSK9 Antikörper eine stärkere Fähigkeit für LDL-senkende und EDV als Simvastatin in FH chimeric Mäuse (Abbildung 5 b-D haben). Bemerkenswert ist, ähnelt der beobachteten prozentuale Reduzierung des Plasma-LDL-C mit PCSK9 Antikörper in FH chimeric Mäuse, die in klinischen Studien4gemeldet. Diese Ergebnisse zeigen den potenziellen Nutzen von LRG chimeric Mäuse mit FH-iHeps für präklinischen Erprobung neuartiger Medikamente für FH aufgeprägt.

Abbildung 1: Differenzierung der menschlichen iPSCs in iHeps.Top Panel Geleitet, Timeline für iPSC Differenzierung in iHeps; wichtigsten Zytokine und Medien ergeben sich für jede Stufe. (Untere Leiste) Repräsentative Phase kontrastreiche Bilder von verschiedenen Zeitpunkten von iHep Differenzierung. KSR: Ko-Serum Ersatz; HCM: Hepatozyten Kulturmedium; HGF: Hepatozyten-Wachstumsfaktor; OSM: Oncostatin M. Klicken Sie bitte hier, um eine größere Version dieser Figur.

Abbildung 2: Charakterisierung der iHeps produziert mit Differenzierung-Protokoll geändert. (A) Immunfluoreszenz von iHeps in verschiedenen Stadien der Differenzierung. Kerne sind in den zusammengeführten Kompositionen blau gefärbt. (B) Bar Graph zeigt den Prozentsatz der ASGPR + iHeps abgeleitet erhielt am Tag 17, gemessen mittels Durchflusszytometrie. Proben wurden in 3 unabhängigen Experimenten gemessen; Mittelwerte werden dargestellt und Fehlerbalken zeigen die Standardabweichung (SD). Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3: Generation ein Krankheitsmodell FH In Vivo mit iHeps. (A) Zeit Linie für die Erzeugung von menschlichen Leber chimeric Mäuse durch intrasplenic Injektion von FH iHeps in LRG Mäuse. (B) Bar Graph zeigt, dass die Fütterung von LRG Mäuse mit HFHC Ernährung führt zu deutlich erhöhte LDL-C (n = 10). P -Werte wurden sind auf der Abbildung angegeben und mit einem ungepaarten t-Test; Mittelwerte werden dargestellt und Fehler Balken Standardfehler des Mittelwertes (SEM). Zentrale B wird aus Abbildung 3I unserer vorherigen Bericht15. geändert. Bitte klicken Sie hier für eine größere Version dieser Figur.
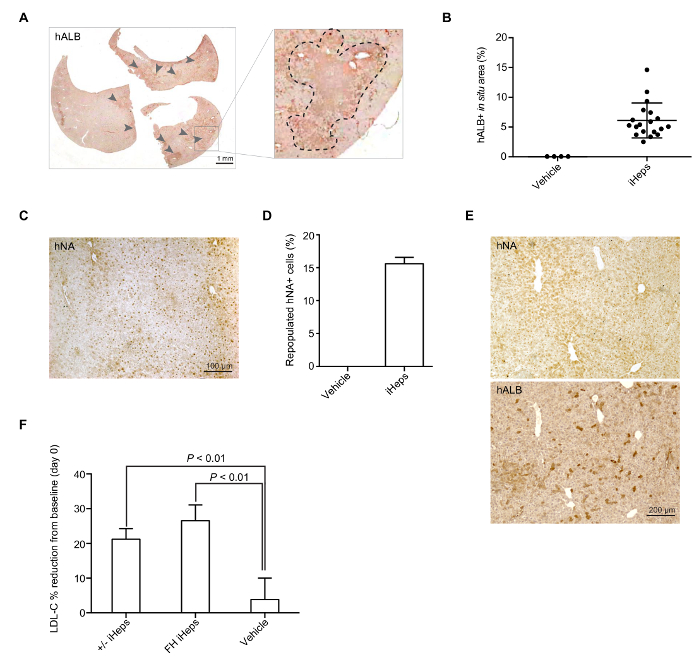
Abbildung 4: iHep Mediated Wiederbesiedlung von LRG Mäuse Leber. (A) repräsentativen ganzen Abschnitt gescannt Bild hALB Färbung in eine Maus Leber aufgefüllt mit LDLR + /-iHeps. Pfeile zeigen Gruppen von menschlichen iHeps in der Maus Leber aufgeprägt; vergrößerten Abschnitte werden im rechten Fensterbereich angezeigt. (B) Scatter Plot-Diagramm den Prozentsatz der zeigt wieder bevölkert hALB + iHep-enthaltenden Bereiche in einem Maus-Leber (aus verschiedenen Spender iPSCs) entspricht, Berechnung stützte sich auf ganze Kapitel gescannt Bilder (n = 19). Mittelwerte werden dargestellt und Fehler Balken SD (C) repräsentative Bilder der immunhistochemischen Färbung für hNA in eine Maus Leber mit eingepflanzt FH iHeps. (D) Balkendiagramm zeigt den Prozentsatz der Waldlandschaften hNA + iHeps (aus verschiedenen Spender iPSCs) in LRG Maus Lebern (n = 3). Mittelwerte werden gezeigt und Fehlerbalken zeigen SD (E) hALB und hNA auf zwei aufeinander folgende Abschnitte der Maus Leber aufgefüllt mit Wildtyp-iHeps Färbung. (F) Balkendiagramm zeigt den Prozentsatz der Plasma LDL-C Reduktion gegenüber dem Ausgangswert am 21. Tag nach dem Engraftment; n = 5 für LDLR + /-iHeps und n = 6 für FH-iHeps und das Fahrzeug. P -Werte wurden sind auf der Abbildung angegeben und mit einem ungepaarten t-Test; meine Werte werden angezeigt, Fehlerbalken anzugeben, SEM Platten B, D und E sind aus Abbildung 3geändert-3I von unserem letzten Bericht15. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 5 : PCSK9 Antikörper zeigen stärkere LDL senken Fähigkeit als Simvastatin in der menschlichen Leber Chimären LRG Mäuse. (A) schematische Darstellung der der in Vivo Drogentests Ansatz mit FH menschlichen Leber chimeric Mäuse. (B und C) prozentuale Veränderung des Plasma LDL-C vom Ausgangswert Tage 14, 21 und 28 in FH chimeric Mäuse mit HFHC Diät gefüttert und behandelt mit der angegebenen Medikamente; n gibt die Anzahl der Mäuse. P -Werte wurden mit einem Kruskal-Wallis-Test; Mittelwerte werden dargestellt und Fehler Balken SEM (D) EDV als Reaktion auf die steigenden Konzentrationen von ACh. P -Werte sind auf der Abbildung angegebenen Konzentration angegeben. P -Werte wurden mit zwei-Wege-ANOVA mit Dunnett mehrere Vergleich eingestellt; Fehlerbalken zeigen, dass SEM. Abbildung 5 aus Abbildung 4A-4 C und Abbildung 5A von unseren vorherigen Bericht15. geändert wird Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Frühere Studien mit iHeps bei Nagetieren haben bestätigt, dass sie ein wirksames Mittel zur Leber Erbkrankheiten17zu studieren sind. Weiter erweitern den Einsatz dieser Technologie und weil aktuelle FH Tiermodelle suboptimal sind, wir pfropfte FH iHeps in LRG Mäuse und zeigte, dass die eingepflanzt LDLR + / oder heterozygot LDLR-mutierte FH iHeps können Mäuse Plasma LDL-C Ebene reduzieren und reagieren auf Lipid-senkende Medikamente in Vivo.
Es gibt 3 wichtige Schritte in unserem Protokoll für die Erzeugung von menschlichen Leber FH chimeric Mäuse mit iHeps:
(1) Produktion von qualitativ hochwertigen iHeps durch gezielte Differenzierung. Angesichts die klonale Variabilität zwischen iPSC Linien18, ist es wichtig isogenen iPSCs für richtige Vergleiche zu verwenden und die iHep Differenzierung Effizienz der Mutterzelle Linie testen vor der Ausführung der Technik und den Engraftment.
(2) korrekte iHep Upload in die Spritze. Anders als in anderen Protokollen wir verwenden 50 % extrazelluläre Matrix (Endkonzentration, V/V) iHeps aufschwemmen und laden Sie diese dann in die Insulin-Spritze. Wir glauben, dass die extrazelluläre Matrix Zellen schützt und sorgt für eine Mikroumgebung, die iHep Migration in die Leber aus der Milz erleichtert. Luftblasen sind eine tödliche Faktor für Chirurgie und vollständig in der Spritze vermieden werden.
(3) die richtige Anzahl von Zellen eingepflanzt. Überlastung der Zellen kann auch zu hohe Letalität Rate führen. Es wird empfohlen, 1 Million iHeps pro 25 – 30 g Maus Einpflanzen.
Unser Protokoll hat auch einige Einschränkungen: die Schädigung der Leber induziert durch Bestrahlung ist gemäßigt und Einzel-Dosis, und die Reifung unserer iHeps ist nicht vergleichbar mit pHH. Bezogen auf beide Aspekte, ist der Grad der Chimerism unseres Modells ähnlich wie bei den letzten Berichte beschreiben NOD/Lt-SCID/IL-2Rγ−/− Mäusen oder Gunn Ratten pfropfte mit iPSC-abgeleitete iHeps17,19 , aber deutlich niedriger als BRD Mäuse oder uPA Transgene Mäuse mit pHH aufgeprägt. Um diese Einschränkung auf der einen Seite zu überwinden könnte einer der hepatischen Differenzierung Protokoll zur Verbesserung der Reifung der iHeps weiter optimieren. Auf der anderen Seite konnte LRG Mäuse mit BRD Mäusen Ldlr- / -/Fah- / -/Rag2- / -/Il2rg- / - Mäuse generieren überquert werden.
Zusammenfassend lässt sich sagen haben hier wir ein detailliertes Protokoll für die Erzeugung von menschlichen Leber Chimären Tiere mit FH-iHeps und zum Testen der Funktionalität von eingepflanzt iHeps beschrieben. Wichtig ist, können diese chimeric Mäuse für in Vivo Drogentests verwendet werden. Unser Modell kann wahrscheinlich durch Verbesserung der Funktionalität des iHeps oder zusätzliche Gene ausschlagen optimiert werden (zB., Fah) in den Empfängerländern LRG Mäuse, und es wird sinnvoll sein, pathologische Mechanismen der Krankheit zu untersuchen und präklinischen durchführen Studien.
Offenlegungen
H.-F.T ist NATIONALKOORDINATOR und Leiter der Odyssee Ergebnisse Studie gesponsert von Sanofi und Regeneron Pharmaceuticals.
Danksagungen
Diese Arbeit wurde vom Shenzhen Science and Technology Rat Basic Research Program (JCYJ20150331142757383), strategische Priorität Forschungsprogramm der chinesischen Akademie der Wissenschaften (XDA16030502), Hong Kong Research Grant Rates Theme Based Research unterstützt. Schema (T12-705/11), Kooperationsprogramm von Zuschüssen Forschungsrat der Sonderverwaltungsregion Hongkong und die National Natural Science Foundation von China (N-HKU730/12 und 81261160506), Team Forschungsprojekt der Guangdong-Naturwissenschaft Stiftung (2014A030312001), Guangzhou Wissenschaft und Technologie-Programm (201607010086), Provinz Guangdong Wissenschaft und Technologieprogramm (2016B030229007 und 2017B050506007).
Materialien
| Name | Company | Catalog Number | Comments |
| Materials | |||
| 40 µm Cell strainer | BD | B4-VW-352340 | |
| 6-Well plate | Thermofisher | 140675 | Extracellular matrix coated |
| Accutase | Millipore | SCR005 | |
| Acetylcholine | Sigma Aldrich | A6625 | Dissolve in water |
| Antigen retrieval solution | IHC World | IW-1100-1L | |
| Calcium chloride | Sigma Aldrich | C8106 | CaCl2 |
| Cell dissociation enzyme | Thermofisher | 12604-013 | TrypLE |
| D-glucose | Sigma Aldrich | D8270 | |
| Dimethyl sulfoxide | Sigma Aldrich | D5879 | DMSO |
| DMEM | Thermofisher | 10829 | Knockout DMEM |
| DNase I | Roche | 11284932001 | |
| EDTA | USB | 15694 | 0.5 M, PH=8.0 |
| Extracellular matrix (for cell suspension) | Corning | 354234 | Matrigel |
| Extracellular matrix (for iHep differentiation) | Corning | 354230 | Matrigel |
| Hepatocyte basal medium | Lonza | CC-3199 | |
| Hepatocyte culture medium | Lonza | CC-3198 | |
| High-fat and high-cholesterol diet | Research Diet | D12079B | |
| Human Activin A | Peprotech | 120-14E | |
| Human hepatocyte growth factor | Peprotech | 100-39 | |
| Human iPSC maintenance medium | STEMCELL Technologies | 5850 | mTeSR1 |
| Human oncostatin M | Peprotech | 300-10 | |
| Ketamine 10% | Alfasan | N/A | |
| L-glutamine | Thermofisher | 35050 | |
| LDL-C detection kit | WAKO | 993-00404 and 993-00504 | |
| Magnesium chloride | VWR | P25108 | MgCl2 |
| Meloxicam | Boehringer Ingelheim | NADA 141-213 | |
| Monopotassium phosphate | USB | S20227 | KH2PO4 |
| Non-essential amino acids | Thermofisher | 11140 | |
| PBS | GE | SH30256.02 | Calcium and magnesium-free |
| PCSK9 antibodies | Sanofi and Regeneron Pharmaceuticals | SAR236553/REGN727 | Alirocumab |
| Phenobarbital | Alfamedic company | 013003 | |
| Phenylephrine | RBI | P-133 | Dissolve in water |
| Potassium chloride | Sigma Aldrich | P9333 | KCl |
| Povidone-iodine | Mundipharma | Betadine | |
| Recombinant mouse Wnt3a | R&D Systems | 1324-WN-500/CF | |
| ROCK inhibitor Y27632 | Sigma Aldrich | Y0503-5MG | |
| RPMI 1640 | Thermofisher | 21875 | |
| Serum replacement | Thermofisher | 10828 | |
| Silicone coated petri dish | Dow Corning | Sylgard 184 silicone elastomer kit | |
| Simvastatin | Merck Sharp & Dohme | ZOCOR | |
| Sodium bicarbonate | Sigma Aldrich | S6297 | NaHCO3 |
| Sodium chloride | Sigma Aldrich | S7653 | NaCl |
| Trypan blue solution 0.4% | Thermofisher | 15250061 | |
| U-46619 | Cayman | 16450 | Dissolve in DMSO |
| Xylazine 2% | Alfasan | N/A | |
| β-mercaptoethanol | Thermofisher | 31350 | |
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| AAT | DAKO | A0012 | 1:400 |
| ALB | Bethyl Laboratories | A80-129 | 1:200 |
| ASGPR | Santa Cruz | Sc-28977 | 1:100 |
| HNF4A | Santa Cruz | Sc-6557 | 1:35 |
| NANOG | Stemgent | 09-0020 | 1:200 |
| OCT4 | Stemgent | 09-0023 | 1:200 |
| Name | Company | Catalog Number | Comments |
| Mice | |||
| Il2rg-/- | Jacson lab | 003174 | |
| Ldlr-/- | Jacson lab | 002077 | |
| Rag2-/- | Jacson lab | 008449 | |
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Automated cell counter | Invitrogen | Countess | |
| Gamma irradiator | MDS Nordion | Gammacell 3000 Elan II | |
| Insulin syringe | BD | 324911 | |
| Powerlab | ADInstruments | Model 8/30 | |
| Slides scanning system | Leica biosystems | Aperio scanScope system | |
| Sliding Microtome | Leica biosystems | RM2125RT | |
| Stereomicrocope | Nikon | SMZ800 | |
| Tissue processing system | Leica biosystems | ASP200S | |
| Wire myograph | DMT | 610M | |
| Name | Company | Catalog Number | Comments |
| Softwares | |||
| Digital slide viewing software | Leica | Aperio ImageScope Version 12.3.2 | |
| Image J | NIH | Version 1.51e | |
| Image processing software | Adobe | Photoshop CC Version 2015 | |
| Microscope imaging software | Carl Zeiss | AxioVision LE Version 4.7 |
Referenzen
- Brown, M. S., Goldstein, J. L. A receptor-mediated pathway for cholesterol homeostasis. Science. 232 (4746), 34-47 (1986).
- Endo, A. The discovery and development of HMG-CoA reductase inhibitors. J Lipid Res. 33 (11), 1569-1582 (1992).
- Dubuc, G., et al. Statins upregulate PCSK9, the gene encoding the proprotein convertase neural apoptosis-regulated convertase-1 implicated in familial hypercholesterolemia. Arterioscler Thrombo Vasc Biol. 24 (8), 1454-1459 (2004).
- Robinson, J. G., et al. Efficacy and safety of alirocumab in reducing lipids and cardiovascular events. N Engl J Med. 372 (16), 1489-1499 (2015).
- Fitzgerald, K., et al. Effect of an RNA interference drug on the synthesis of proprotein convertase subtilisin/kexin type 9 (PCSK9) and the concentration of serum LDL cholesterol in healthy volunteers: a randomised, single-blind, placebo-controlled, phase 1 trial. Lancet. 383 (9911), 60-68 (2014).
- Ishibashi, S., et al. Hypercholesterolemia in low density lipoprotein receptor knockout mice and its reversal by adenovirus-mediated gene delivery. J Clin Invest. 92 (2), 883-893 (1993).
- Watanabe, Y. Serial inbreeding of rabbits with hereditary hyperlipidemia (WHHL-rabbit). Atherosclerosis. 36 (2), 261-268 (1980).
- Carpentier, A., et al. Engrafted human stem cell-derived hepatocytes establish an infectious HCV murine model. J Clin Invest. 124 (11), 4953-4964 (2014).
- Tateno, C., et al. Near completely humanized liver in mice shows human-type metabolic responses to drugs. Am J Pathol. 165 (3), 901-912 (2004).
- Basma, H., et al. Differentiation and transplantation of human embryonic stem cell-derived hepatocytes. Gastroenterology. 136 (3), 990-999 (2009).
- Soldner, F., et al. Generation of isogenic pluripotent stem cells differing exclusively at two early onset Parkinson point mutations. Cell. 146 (2), 318-331 (2011).
- Bissig, K. D., et al. Human liver chimeric mice provide a model for hepatitis B and C virus infection and treatment. J Clin Invest. 120 (3), 924-930 (2010).
- Azuma, H., et al. Robust expansion of human hepatocytes in Fah(-/-)/Rag2(-/-)/Il2rg(-/-) mice. Nat Biotechnol. 25 (8), 903-910 (2007).
- Bissig-Choisat, B., et al. Development and rescue of human familial hypercholesterolaemia in a xenograft mouse model. Nat Commun. 6, 7339 (2015).
- Yang, J., et al. Generation of human liver chimeric mice with hepatocytes from familial hypercholesterolemia induced pluripotent stem cells. Stem Cell Rep. 8 (3), 605-618 (2017).
- Kajiwara, M., et al. Donor-dependent variations in hepatic differentiation from human-induced pluripotent stem cells. Proc Natl Acad Sci USA. 109 (31), 12538-12543 (2012).
- Chen, Y., et al. Amelioration of hyperbilirubinemia in gunn rats after transplantation of human induced pluripotent stem cell-derived hepatocytes. Stem Cell Rep. 5 (1), 22-30 (2015).
- Ortmann, D., Vallier, L. Variability of human pluripotent stem cell lines. Curr Opin Genet Dev. 46, 179-185 (2017).
- Liu, H., Kim, Y., Sharkis, S., Marchionni, L., Jang, Y. Y. In vivo liver regeneration potential of human induced pluripotent stem cells from diverse origins. Sci Transl Med. 3 (82), 82ra39 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten