Method Article
Un modello di Mouse chimerici del fegato umano di ipercolesterolemia familiare facendo uso degli epatociti derivati da cellule staminali pluripotenti indotte
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Qui, presentiamo un protocollo per generare un modello del mouse chimerici del fegato umano di hypercholesterolemia familiare facendo uso degli epatociti derivati da cellule staminali pluripotenti indotte umane. Si tratta di un modello valido per testare nuove terapie per ipercolesterolemia.
Abstract
Ipercolesterolemia familiare (FH) è principalmente causata da mutazioni del recettore (LDLR) di lipoproteina a bassa densità e si traduce in un aumentato rischio di malattia cardiovascolare precoce a causa di profonda elevazione del colesterolo LDL (LDL-C) nel sangue. Le statine sono la prima linea di farmaci ipolipemizzanti per il trattamento di altri tipi di ipercolesterolemia e FH, ma stanno emergendo nuovi approcci, in particolari anticorpi di PCSK9, che sono ora in fase di sperimentazione in studi clinici. Per esplorare nuovi approcci terapeutici per FH, nuovi farmaci o nuove formulazioni, abbiamo bisogno del caso in vivo modelli. Tuttavia, le differenze nei profili del lipido metabolica rispetto agli esseri umani sono un problema chiave dei modelli animali disponibili di FH. Per risolvere questo problema, abbiamo generato un modello di topo chimerico del fegato umano utilizzando cellule staminali pluripotenti FH indotta (iPSC)-derivato epatociti (iHeps). Abbiamo usato i topi/Ldlr- / -/Rag2- / -/Il2rg- / - (LRG) per evitare il rigetto immunitario delle cellule umane trapiantate e per valutare l'effetto di LDLR-iHeps carente in un LDLR null sfondo. IHeps FH trapiantati potrebbe ripopolare 5-10% del fegato del topo LRG basato sulla macchiatura di albumina umana. Inoltre, la iHeps engrafted ha risposto ai farmaci ipolipemizzanti e ricapitolato osservazioni cliniche di efficacia aumentata di PCSK9 anticorpi rispetto alle statine. Nostro modello chimerico del fegato umano potrebbe così essere utile per i test preclinici di nuove terapie per FH. Utilizzando il protocollo stesso, topi chimerici del fegato umani simili per altre varianti genetiche FH, o mutazioni corrispondenti alle altre malattie ereditarie del fegato, può essere generato anche.
Introduzione
Del ricevitore della lipoproteina a bassa densità (LDLR) acquisisce il colesterolo di LDL (LDL-C) nel sangue di modulare la sintesi del colesterolo nel fegato. Le mutazioni nel gene LDLR sono la causa più frequente di ipercolesterolemia familiare (FH)1. Le statine sono state tradizionalmente la prima linea del farmaco per il trattamento di FH e altri tipi di ipercolesterolemia (ereditato o acquisito). Le statine inibiscono 3-idrossi-3-methylglutaryl-coenzyme una riduttasi per abbassare la sintesi del colesterolo nel fegato2. Inoltre, le statine aumentano i livelli LDLR sulla superficie dell'epatocita per promuovere del plasma LDL-C liquidazione. Tuttavia, un avvertimento importante del trattamento con statine è che simultaneamente inducono l'espressione di proteina convertasi subtilisin/hexin 9 (PCSK9), un enzima che si lega al LDLR per promuovere la sua degradazione3. Questo effetto è responsabile per la risposta insufficiente o anche null alle statine osservate in molti pazienti. Studiando questo meccanismo ha, inaspettatamente, ha portato alla scoperta di un modo alternativo per il trattamento di ipercolesterolemia. PCSK9 anticorpi recentemente approvati dalla FDA sono attualmente utilizzati negli studi clinici e mostrano più alta efficacia e migliore tolleranza quanto le statine4. Il successo di PCSK9 anticorpi implica anche che ci possono essere altre possibilità terapeutiche di modulare la via di degradazione di LDLR (oltre PCSK9) in pazienti con ipercolesterolemia. Allo stesso modo, c'è interesse nello sviluppo di nuovi inibitori di PCSK9 diverso da anticorpi, ad esempio, siRNA oligos5.
Per testare nuove terapie per FH e in generale qualsiasi altro tipo di ipercolesterolemia, appropriato in vivo modelli sono necessari. Un grave problema di corrente in vivo modelli, per lo più topi6 ed i conigli7, sono loro differenze fisiologiche con gli esseri umani. Fondamentalmente, questi problemi includono un profilo metabolico dei lipidi differenti. La generazione di animali chimerici del fegato umano8 potrebbe aiutare a superare questo avvertimento. Il mouse chimerico del fegato umano è un tipo di mouse "umanizzato" con il suo fegato ripopolato con epatociti umani, ad esempio, epatociti umani primari (pHH)9. Un problema con pHH è che non possono essere espanse ex vivo, rapidamente perdono la loro funzione all'isolamento, e sono una fonte limitata. Un'alternativa a pHH è l'uso di cellule staminali pluripotenti indotte (iPSC)-derivato di epatociti (iHeps)10. In particolare, iPSCs sono paziente-specifici e possono essere coltivate all'infinito, così iHeps può essere prodotta su richiesta, che è un vantaggio significativo rispetto pHH fresco. Inoltre, iPSCs può anche essere facilmente geneticamente con design nucleasi di correggere o introdurre mutazioni in un background isogeniche per consentire più fedele confronti11.
Umano del fegato mouse chimerici con engrafted pHH mostrano somiglianze agli esseri umani in profili metabolici del fegato, le risposte farmacologiche e suscettibilità all' infezione di epatite virus12. Questo li rende un buon modello per studiare iperlipidemia in vivo. I modelli di mouse più ampiamente usati sono basati il/Fah- / -/Rag2- / -/Il2rg- / - (RFG) del mouse13 e l'uPA topo transgenico8, in cui fino al 95% del mouse fegato può essere sostituito da pHH. È interessante notare che, un recente rapporto descritto un umano FH del fegato chimerico topo (basato sul mouse RFG) con pHH da un paziente che trasporta una mutazione di omozigoti LDLR 14. In questo modello, gli epatociti umani ripopolati non avevano nessun LDLR funzionale, ma gli epatociti residua del mouse fatto, riducendo così l'utilità per l'esecuzione di test in vivo di farmaci basandosi sulla via di LDLR.
Qui, segnaliamo un protocollo dettagliato basato sul nostro lavoro recentemente pubblicato15 per capacità di integrazione iHeps FH in fegato del topo/Ldlr- / -/Rag2- / -/Il2rg- / - (LRG). Questo mouse chimerico del fegato umano è utile per la modellazione FH ed esecuzione di test anti-droga in vivo.
Protocollo
Tutti i metodi descritti qui che implicano l'uso di animali sono stati approvati dalla Commissione per utilizzare degli animali vivono nell'insegnamento e nella ricerca (CULATR) dell'Università di Hong Kong.
1. preparazione e test fenotipici il mouse
-
Generazione di topi knockout (KO) di Ldlr immunodeficienti.
- Utilizzare il topi ceppi Ldlr- / - Rag2- / -e Il2rg- / - (Vedi Tabella materiali).
- Attraversare Rag2- / - topi con Il2rg- / - mouse per generare Rag2- / -/ Il2rgtopi- / - , poi attraversare Ldlr- / - topi con Rag2- / - / Il2rg- / - mouse per generare topi/Ldlr- / -/Rag2- / -/Il2rg- / - (LRG)15. All'età di 3-4 settimane, è necessario raccogliere DNA genomic dall'orecchio per determinare il genotipo mediante PCR e sequenziamento.
- All'età di 8-12 settimane, è necessario utilizzare topi maschi LRG come destinatari per iHeps per generare topi chimerici del fegato umani.
- Nutrire i topi con una dieta di grassi e ricca in colesterolo (HFHC) 7 giorni prima del trapianto iHep per aiutarli a sviluppare ipercolesterolemia.
- Per indurre danno epatico che facilita la proliferazione di engrafted iHeps nel fegato, collocare i topi in un contenitore sterile e irradiare loro utilizzando un irradiatore di gamma con raggi γ ad una dose di 3 Gy 24 h prima dell'attecchimento. Quindi, restituire i topi nelle loro gabbie di alloggiamento. Lo stato integro di questi topi irradiati possa essere monitorato misurando il loro peso. Topi con perdita di peso del 20% o maggiore saranno essere euthanized.
2. iHep differenziazione e dissociazione
LDLR KO eterozigote (+ /-) o omozigoti KO (- / -) umano iPSCs o FH paziente-iPSCs con mutazioni eterozigoti LDLR (FH iPSCs) vengono utilizzati per produrre iHeps. La generazione di LDLR + /- o- / - iPSCs e FH iPSCs è descritto nel nostro precedente report15.
- Differenziazione diretto di iPSCs in iHeps
Nota: Il metodo per la differenziazione delle iPSCs umane in iHeps viene modificato da una precedente relazione16.- Tre giorni prima della differenziazione (giorno -3), seme iPSCs sulla matrice extracellulare rivestito di piastre da 6 pozzetti (Vedi Tabella materiali) ad una densità di 300.000 cellule/pozzetto in 1,5 mL (anche in seguito) di iPSC umano mezzo di manutenzione (Vedi tabella materiali ) completati con inibitore di 5 µM ROCK (Y27632). Coltura le cellule a 37 ° C in un incubatore di 5% CO2 . Normalmente, iHeps da una piastra a 6 pozzetti sono sufficienti per attecchire 5 topi.
- 24 ore più tardi (giorno -2) e 48 ore più tardi (giorno -1), cambiare il mezzo per mezzo di manutenzione iPSC umano fresco senza inibitore di roccia.
Nota: iPSCs prima differenziazione dovrebbe esprimono alti livelli di OCT4 e NANOG, che può essere esaminato tramite RT-PCR quantitativa, immunofluorescenza o citometria a flusso. - Al giorno 0 di differenziazione, lavare le cellule con RPMI 1640 una volta e quindi aggiungere RPMI 1640 completati con 100 ng/mL activina A e 25 ng/mL WNT3a.
- Al giorno 1 e giorno 2 di differenziazione, cambiare il mezzo per RPMI 1640 completati con 100 ng/mL Activin A.
Nota: Se c'è troppa morte delle cellule in questa fase (giorni 0 – 3), fino a 0,5% siero bovino fetale (FBS) possa essere aggiunti al mezzo per migliorare la vitalità cellulare. Tuttavia, vi suggeriamo di prova la quantità minima di FBS da aggiungere per ogni linea specifica iPSC, come FBS in eccesso può anche influenzare la differenziazione. - Al giorno 3, lavare le cellule con DMEM una volta e quindi passare alla 2nd stage medio (sostituzione di 20% di siero, 1 x non essenziali aminoacidi, 2 M L-Glutammina, 0.1 M beta-mercaptoetanolo e 1% dimetilsolfossido in mezzo DMEM). Cambiare il mezzo ogni due giorni fino al giorno 10.
Nota: Il giorno 7, dovrebbero aver raggiunto le cellule confluenza e bordi chiaro display. Potrebbero esserci alcune aree indifferenziate che compaiono in questa fase; ignorarli se la percentuale di queste aree è piccolo. Se la percentuale è alta, ridurre la confluenza di iPSCs al giorno 0 e ridurre la quantità di FBS usato nella prima fase di differenziazione. - Al giorno 10, lavare le cellule con sostanza basale dell'epatocita una volta e quindi passare alla cultura dell'epatocita supplementato con fattore crescita epatico umano 20 ng/mL e 20 ng/mL oncostatin M per promuovere iHep maturazione. Modificare il mezzo ogni altro giorno.
Nota: in questa fase, > 90% delle cellule dovrebbe essere positivo per HNF4A, secondo immunofluorescenza colorazione o flusso cytometry. - Al giorno 15 – 17, le cellule sono pronte per l'attecchimento. Facoltativamente, il supernatante di coltura delle cellule può essere raccolti e conservato a-80 ° C per quantificare la secreta albumina (ALB) da iHeps.
Nota: in questa fase, > 80% iHeps dovrebbe essere positivo per HNF4A, ALB e α1-antitripsina (AAT) secondo la colorazione di immunofluorescenza. Circa 60 – 70% del giorno 17 iHeps dovrebbe essere positivo per ASGPR, come mostrato da citometria a flusso. Nelle nostre mani, iHeps in questo periodo hanno capacità ottimale per ripopolare il fegato di topo; iHeps può secernere i livelli elevati di ALB in vitro ma anche diventano senescenti se l'attecchimento è in ritardo.
- Dissociazione e caricamento del iHeps in una siringa da insulina
- Preparare i reagenti richiesti e i materiali:
- 24 h prima dell'attecchimento, scongelare la quantità necessaria (V = 40 µ l * numero di topi) di matrice extracellulare in un ghiaccio casella in una stanza fredda e mettere la siringa di insulina e una scatola di punte di 200 µ l in un frigorifero a 4 ° C.
- Un'ora prima dell'attecchimento, caldo l'enzima di dissociazione delle cellule completati con 50 µ g/mL dnasi a temperatura ambiente e posizionare il medium RPMI 1640 supplementato con 20% sostituzione di siero sul ghiaccio.
- Prendere immagini di contrasto di fase (100 X e 200x) di iHeps per registrare il loro stato, inclusa la morfologia delle cellule, la crescita e la densità delle cellule.
- Lavare iHeps con 2 mL/bene di temperatura Ca2 + e Mg2 +-liberare PBS due volte e quindi aggiungere 1 mL di enzima di dissociazione della cellula completati con 50 µ g/mL dnasi I in ciascun pozzetto. Rimettere le cellule in incubatrice per 8 – 10 min.
Nota: Per migliorare la dissociazione di cella con enzima dissociazione della cellula, lavare le cellule con Ca2 + e Mg2 +-gratis PBS. Per massimizzare la vitalità cellulare, ti consigliamo di dissociare i pozzi non più di 6 per ogni batch in un momento. Si consiglia inoltre di limitare il trattamento enzimatico di dissociazione delle cellule a meno di 10 minuti. - Monitorare la morfologia delle cellule sotto il microscopio. Quando la maggior parte delle cellule diventano rotonda, aggiungere un volume equivalente di freddo RPMI 1640, integrato con la sostituzione del 20% di siero in ciascun pozzetto, dispensare le cellule delicatamente per staccare dalla piastra e trasferire la sospensione cellulare ad un nuovo tubo da 15 mL.
Nota: Questo passaggio è fondamentale per attuabilità delle cellule raccolte. Se le cellule sono difficili da staccare dalla piastra, non importa se alcune celle sono lasciati. Se le cellule si staccano come grandi piazze di monostrato, quindi pipettare delicatamente dopo centrifugazione per ottenere una sospensione di singola cellula. - Ripetere il passaggio 2.2.4 per ogni bene fino a quando quasi tutte le cellule sono raccolti. Centrifuga a 200 x g per 3 min a 4 ° C.
- Rimuovere il supernatante e risospendere le cellule con 2 mL di PBS freddo in una provetta da 15 mL. Pipettare le cellule delicatamente per ottenere una sospensione di singola cellula e quindi aggiungere PBS freddo ad un volume finale di 1 mL * numero di pozzi dissociate. Infine, è possibile passare le cellule attraverso un colino di cella 40 µm per rimuovere aggregati.
Nota: Normalmente 1-2 x 106 cellule/pozzetto può essere raccolto dopo il filtraggio. - Aliquota 20 µ l di sospensione di cella e aggiungere 20 µ l di soluzione di blu di trypan 0,4%, poi contare le celle utilizzando un contatore di cellule automatizzato e registrare la concentrazione della sospensione delle cellule come "C". Calcolare il volume richiesto (V1 = [106 * (n + 1)] / C, dove n è il numero di topi per essere innestati) di sospensione cellulare (1 milione/topo) per iniezione intrasplenic.
- Aliquotare il volume richiesto di sospensione cellulare in provette da 15 mL e centrifugare a 200 x g per 3 min a 4 ° C.
- Eliminare il surnatante, risospendere le cellule nel volume appropriato di PBS freddo per rendere il volume della sospensione di cellule (n + 1) * 55/2 µ l (n = numero di topi) e quindi aggiungere un volume uguale di matrice extracellulare per rendere il volume finale della sospensione di cellule (n + 1) * 55 µ l.
- Posizionare la siringa di insulina fredda su ghiaccio, scollegare il pistone, trasferire 55 µ l di sospensione cellulare nella siringa e poi rimettere il pistone. Bolle di scarico con attenzione e mettere la siringa sul ghiaccio.
- 2.3.10 Ripetere tutte le siringhe sono stati caricati con le cellule. Le siringhe sono pronte per l'iniezione.
Nota: Per massimizzare la vitalità cellulare, si consiglia di mantenere le cellule sul ghiaccio dopo dissociazione. Per la 2.2.4–2.2.11 di passaggi sopra, assicurarsi che tutti i reagenti sono conservati a 2 – 8 ° C prima dell'uso.
- Preparare i reagenti richiesti e i materiali:
3. intrasplenic iniezione di iHeps
- Anestetizzare i topi con ketamina (100 mg/kg) e xilazina (10 mg/kg) iniettato intraperitonealmente. Mettere pomata veterinario sugli occhi di topi per prevenire la secchezza durante la procedura di anestesia e monitorare i loro riflessi di muscolo per effetto di anestesia di osservare e valutare il dolore.
- Una volta che i topi hanno perso il riflesso del muscolo alla stimolazione, metterli in posizione decubitus laterale a destra. Applicare uno spesso strato di crema depilatoria per l'area di incisione nel fianco di sinistra per 5 – 8 min. Quindi, rimuovere la crema depilatoria e capelli pulendo la zona con un tampone di garza inumidita in acqua.
- Strofinare il fianco sinistro con povidone-iodio o, in alternativa, con etanolo al 70% 3 volte seguita da una macerazione finale con povidone-iodio per la disinfezione.
- In una livello 2 di biosicurezza, individuare la posizione della milza, che può essere visualizzata in modo trasparente nel fianco di sinistra e poi incise la pelle e la parete addominale per 0,5 – 1 cm. esternare la milza tirando fuori il tessuto adiposo delicatamente vicino utilizzando a punta forcipe. Stabilizzare la milza usando un tampone delicatamente.
- Inserire l'ago della siringa insulina 3 – 4 mm nel parenchima della milza e iniettare circa 50 µ l di sospensione cellulare delicatamente. Ritirare l'ago e mettere un batuffolo di cotone sul sito di iniezione per 1 minuto per prevenire le emorragie e la fuoriuscita di materiale.
- Restituire la milza al peritoneo e chiudere la ferita con suture in nylon 5-0. Quindi, tenere topi in camera/incubatore a caldo per 3 – 16 h per restituirli alla loro temperatura corporea normale e farli rivivere. Topi che hanno subito la chirurgia non vengono restituiti alla compagnia di altri animali fino a quando completamente recuperato.
- Aggiungere meloxicam (26 μg/mL) per l'acqua potabile e iniettare buprenorfina (50 μg/kg) per via intramuscolare come farmaco anti-infiammatorio e analgesico, rispettivamente. Monitor chirurgico ferite giornalmente per prevenire qualsiasi infiammazione.
Nota: Assicurarsi che tutti gli strumenti e i materiali di consumo utilizzati nei passaggi 4-7 sono sterili.
4. test del livello del Plasma LDL-C
- Ai giorni 0, 7, 14, 21 e 28 post-attecchimento, trattenere i topi LRG strettamente per ridurre al minimo movimento laterale della testa usando metodo trattenga a due mani, quindi forare la vena facciale utilizzando il lancet. Sangue comincerà a scorrere dopo la rimozione della lancetta. Raccogliere circa 50 µ l di sangue in provette da 1,5 mL contenente 1 µ l di EDTA.
Nota: Se la presa è troppo stretta, può essere ridotto il volume di sangue prelevato e topi possono morire a causa di difficoltà di respirazione. - Mescolare delicatamente il sangue capovolgendo le provette diverse volte e poi Centrifugare a 950 x g per 15 min. raccogliere i supernatanti e conservarli a-80 ° C immediatamente.
- Una volta che tutti i campioni sono raccolti, scongelare il plasma a temperatura ambiente e verificare il livello di LDL-C utilizzando un kit di rilevazione di LDL-C secondo il manuale del produttore.
5. in Vivo test anti-droga in Engrafted di topi chimerici con LDLR + /- e FH iHeps
- Per indurre ipercolesterolemia, nutrire i topi una dieta HFHC 7 giorni prima dell'attecchimento.
- post-All'attecchimento 7 giorni, trattare ogni gruppo dei topi con il veicolo (PBS, iniettato per via sottocutanea), 10 mg/kg/settimana PCSK9 anticorpi (una formulazione di uso clinico degli anticorpi monoclonali PCSK9, iniettato per via sottocutanea troppo), 10 mg/kg/giorno simvastatina (40 mg/L mg / mL in acqua potabile), o combinato PCSK9 anticorpi e simvastatina.
- Raccogliere plasma mouse post-all'attecchimento giorni 0 (il giorno del engraftment), 14, 21 e 28. Conservare i campioni a-80 ° C immediatamente.
- Una volta che tutti i campioni sono disponibili, è possibile verificare il livello del plasma LDL utilizzando un kit di rilevazione di LDL-C, secondo il manuale del produttore.
6. Test di funzione endoteliale
La funzione endoteliale è interessata all'inizio del FH e possa essere verificata nel nostro modello del mouse come un indicatore della gravità della malattia o per valutare il miglioramento con trattamenti differenti. Un stereomicrocope, pinze per dissezione, forbici, un myograph di filo, hardware di acquisizione (Vedi Tabella materiali), e un computer sono necessari per questo.
- Sacrificare i topi tramite l'iniezione intraperitoneale di fenobarbital 100 mg/kg. Rimuovere gli organi interni in modo che l'aorta discendente parallela alla colonna vertebrale è visibile e può essere sezionato fuori dal forbici insieme al tessuto adiacente e cuore. Sezionare i aortae utilizzando forbici bene e metterli in soluzione di Krebs ossigenata fredda (mM: 119 NaCl, 4.7 KCl, 2,5 CaCl2, 1 MgCl2, 25 NaHCO3, 1,2 KH2PO4e 11 D-glucosio).
- Trasferire i aortae in soluzione di Krebs una capsula Petri rivestito di silicone. Perno del tessuto connettivo per fissare la posizione di aorta senza esagerare. Sotto un microscopio stereoscopico, uso una pinzetta per le forbici di primavera e sezionare l'aorta gratuito dal tessuto grasso e adventitial circostante senza danneggiare la parete del vaso, poi tagliarlo in 1.5-2 mm segmenti di lunghezza.
- Tagliare un circa 2 cm lungo e 40 μm spessore filo di acciaio inossidabile e delicatamente messo attraverso il lume dell'aorta. Trasferimento del segmento alla camera di myograph filo riempita con soluzione di Krebs ossigenata tenendo il filo.
- Per misurare la lunghezza dei segmenti aortae quando si studia la contrattilità, posizionare ogni segmento perpendicolarmente tra le mascelle e registrare la lettura (D1) sul micrometro. Rimuovere il segmento e le mandibole si muovono insieme e registrare la lettura (D0). La lunghezza del segmento sarebbe L = D1-D0.
- Segui la Guida utente per bloccare il filo e fissarlo con il cacciavite, mentre il segmento tra le ganasce, ma lasciarlo non deformato.
- Per la normalizzazione prima dell'esperimento, impostare il myograph a zero nella posizione non stirata. Poi, lentamente muovere la mascella apart e osservare la tensione di aorta cambiare fino a 3 mN. Dopo 15 minuti, scolare la soluzione dalla camera di myograph e sostituire con soluzione di Krebs fresca, aspettare 15 minuti e regolare nuovamente la tensione a 3 mN.
- Cambiare la soluzione di Krebs standard a 60 mM soluzione di Krebs contenenti KCl per indurre una contrazione per almeno 15 min, risciacquo con soluzione di Krebs fresca 3 volte.
- Aggiungere le concentrazioni aumentanti di fenilefrina (Phe; ad esempio, da 10 nM a 100 μM). Lavare con soluzione di Krebs standard e aggiungere un'unica concentrazione di Phe in circa il 70% di contrazione massima dalla contrazione precedente. Quando la contrazione è stabile, aggiungere le concentrazioni aumentanti di acetilcolina (ACh; ad esempio, da 1 o 3 nM a 10 o 30 µM) per indurre vasodilatazione. ACh è aggiunto intervalli di circa 2 min.
Nota: In alcuni segmenti aortici con piccola contrazione indotta da Phe, ad esempio inferiore al 30% di KCl indotta contrazione, U46619 (un altro vasocostrittore) ad una concentrazione da 1 nM a 30 nM può essere utilizzato per indurre una contrazione stabile che è più grande di 70% di Contrazione indotta da kCl. - Pulire il myograph secondo il manuale del produttore.
- Utilizzando software di analisi dati record (Vedi Tabella materiali), la forza (F) dopo ogni aggiunta di farmaci. Disegnare l'indicatore di tensione basale (Fbasale) per misura relativa, spostare la freccia al punto più alto dopo Phe come FPhee quindi spostare il punto più basso dopo ogni aggiunta di ACh come FACh. Calcolare la vasodilatazione endotelio-dipendente indotta da ACh (EDV) da rilassamento % = (F.ACh-Fbasale) / (F.Phe-Fbasale) sull'asse y. Preparare una curva di risposta di concentrazione su software statistico utilizzando valore log10 della concentrazione in M sull'asse x.
- Per analizzare la differenza statistica, utilizzare l'area sotto la curva di ogni segmento da un mouse e analizzare la differenza dell'area sotto la curva tra i gruppi usando il One-way ANOVA. Singoli punti possono essere analizzati anche se necessario.
7. la prova di iHep ripopolamento in fegato del topo
- Negli endpoint, è necessario sacrificare i topi iniettando intraperitonealmente fenobarbital 100 mg/kg.
- Raccogliere plasma dalla puntura cardiaca. Sezionare i lobi del fegato usando le forbici oftalmiche, poi mettere fegati in un peri-piatto di 10 cm e lavare due volte con soluzione fisiologica. Rimuovere la soluzione salina dalla superficie del fegato con carta assorbente, quindi tagliare i lobi in intorno pezzi di 0,6 cm di lunghezza. Difficoltà i lobi del fegato in formalina al 10%.
- Incorporare i fegati fissi nella sezione utilizzando un lavorazione sistema e un microtomo scorrevole, rispettivamente, secondo le istruzioni del produttore del tessuto e paraffina.
- Riscaldare le diapositive a 60 ° C per 1 h a sciogliere la cera. Quindi immergere i vetrini in xilene per 5 min due volte e reidratare il tessuto con etanolo 100%, 90% e 70% successivamente.
- Immergere i vetrini nella camera di diapositiva contenente circa 50 mL di soluzione di ricupero dell'antigene e poi mettere la camera in pentola a pressione, 120 ° C per 1,5 min. lavare i vetrini delicatamente con tubo acqua per 5 minuti.
- Macchia le sezioni con gli anticorpi primari (circa 100 µ l/sezione) targeting umano ALB (hALB) e dell'antigene umano nuclei (hNA). Quindi, macchia con gli anticorpi secondari coniugati con perossidasi di rafano (che reagisce con il kit di rilevazione di DAB) un'etichetta fluorescente.
- Per calcolare la percentuale di zone hALB + e cellule hNA +, scansione diapositive colorate con anti-hALB e anti-hNA e ha reagito con DAB utilizzando una diapositiva automatizzata sistema di scansione per ottenere immagini di tutta la sezione.
Nota: Intero immagini digitalizzate di sezione sono utili per calcolare l'efficienza ripopolato in modo imparziale, basato su zone hALB + o cellule hNA + nei fegati macchiato di immunohistochemistry. Come metodo alternativo per monitorare l'efficienza del ripopolamento iHep, livello di albumina umana del plasma possa essere testato utilizzando un kit di ALB ELISA specifico umano. - Scattare foto istantanee per coprire l'intera diapositiva utilizzando la diapositiva digitale associata software sotto Vista X 5 di visualizzazione. Per quantificare la percentuale di hALB + zone, per ogni immagine snapshot, utilizzano il microscopio software di imaging per qualificare l'area positiva (P) e l'area totale (T) dell'immagine e utilizzano Image J per qualificare l'area vuota (B). La percentuale di zone hALB + è espressa come P/(T-B) * 100%. Per ogni gruppo, è necessario selezionare almeno 3 topi. E per ogni mouse, almeno 4 sezioni da diverse posizioni del fegato devono essere selezionate.
- Per quantificare la percentuale di hNA + cellule, per ogni immagine snapshot, selezionare casualmente 1/16 della zona con una software di elaborazione di immagine e quindi manualmente contano il numero di nuclei totali (T) e hNA + nuclei (N). La percentuale di hNA + è espressa come N/T * 100%. Per ogni gruppo, è necessario selezionare almeno 3 topi. Per ogni mouse, almeno 4 sezioni da diverse posizioni del fegato dovrebbero essere selezionate.
Risultati
Differenziazione di umano diretto iPSCs in iHeps
Quando si raggiunge il 70% confluenza, iPSCs umane sono differenziati in iHeps con un protocollo 3-passo16 (Figura 1 pannello superiore). Dopo 3 giorni di differenziazione endoderma, iPSC colonie diventano allentati e diffusa in piena confluenza (Figura 1 pannello inferiore). Poi, con 2nd stage medio, hepatoblasts apparire e proliferare. Queste cellule sono affollate ma mostrano margini netti in questa fase (giorno 7, pannello inferiore di Figura 1 ). Dopo 17 giorni di differenziazione, iHeps polarizzati con morfologia tipica esagono appaiono (Figura 1 pannello inferiore). Questi iHeps esprimono marcatori pHH, tra cui AAT e ALB (Figura 2A). Inoltre, il rapporto di ASGPR + iHeps dovrebbe essere relativamente elevato, come misurato tramite flusso cytometry (Figura 2B)15.
Generazione di un iHeps di FH In Vivo malattia modello utilizzando FH
Per aiutare LRG topi sviluppare ipercolesterolemia, noi li alimentano con una dieta HFHC 7 giorni prima dell'attecchimento (giorno -7). Il giorno di attecchimento (giorno 0), topi LRG visualizzare il livello di LDL-C (circa 600 mg/dL, Figura 3B) circa 3 volte del plasma. Giorno che 15 – 17 iHeps sono innestate in topi LRG via intrasplenic iniezione; questi iHeps presto risiedono nel parenchima del fegato e proliferare ci (Figura 3A). Nel punto finale, fegati di questi topi chimerici sono raccolti e fisso, quindi colorati con hALB e hNA, entrambi i quali dovrebbe mostrare la prova evidente di ripopolamento del fegato iHep-mediata nel fegato di topo LRG basato sulla macchiatura per hALB e hNA (Figura 4A-E). Nelle nostre mani, sia LDLR + /- e FH iHeps potrebbe ridurre LDL-C del plasma livello significativamente 21 giorni post-il engraftment (Figura 4F). A questo punto, topi chimerici del fegato umani di FH possono essere utilizzati per verificare le terapie per FH.
Validazione del modello di Mouse chimerici del fegato umano FH utilizzando farmaci disponibili
Per convalidare il nostro modello, abbiamo usato 2 ben noti farmaci ipoglicemizzanti di LDL-C, la simvastatina e PCSK9 anticorpi (Figura 5A). I nostri dati dimostrano che 21 giorni dopo il trattamento, PCSK9 gli anticorpi hanno una più forte capacità per abbassamento del LDL ed EDV di simvastatina in topi chimerici FH (figura 5B-D). In particolare, la riduzione di percentuale osservata del plasma LDL-C con gli anticorpi di PCSK9 in topi chimerici FH è simile a quella riportata in studi clinici4. Questi risultati dimostrano l'utilità potenziale di topi chimerici LRG innestate con FH iHeps per i test preclinici di nuovi farmaci per FH.

Figura 1: diretto iPSCs differenziazione dei diritti dell'uomo in pannello di iHeps.Top, Timeline per differenziazione iPSC in iHeps; media e citochine chiave è indicati per ogni fase. (Pannello inferiore) Immagini di contrasto di fase rappresentativa dei diversi momenti di differenziazione iHep. KSR: sostituzione knockout del siero; HCM: terreno di coltura di epatociti; HGF: fattore di crescita dell'epatocita; OSM: oncostatin M. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: caratterizzazione di iHeps prodotto con protocollo di differenziazione per volta. (A) immunofluorescenza di iHeps nelle varie fasi di differenziazione. Nuclei sono colorati in blu nelle composizioni Unite. (B) Bar grafico rappresenta la percentuale di ASGPR + iHeps derivati ottenuti al giorno 17, come misurati tramite flusso cytometry. I campioni sono stati misurati in 3 esperimenti indipendenti; vengono mostrati i valori medi e le barre di errore indicano deviazione standard (SD). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Generazione di un modello di malattia FH In Vivo con iHeps. (A) tempo linea per la generazione di topi chimerici del fegato umani iniettando intrasplenic FH iHeps in topi LRG. (B) Bar grafico mostra che LRG topi d'alimentazione con dieta HFHC conduce ad significativamente aumentato livello di LDL-C (n = 10). Valori di P sono indicati sulla figura e sono stati ottenuti utilizzando un test t spaiato; vengono mostrati i valori medi e le barre di errore indicano errore standard della media (SEM). Pannello B viene modificato da 3I figura della nostra precedente relazione15. Clicca qui per visualizzare una versione più grande di questa figura.
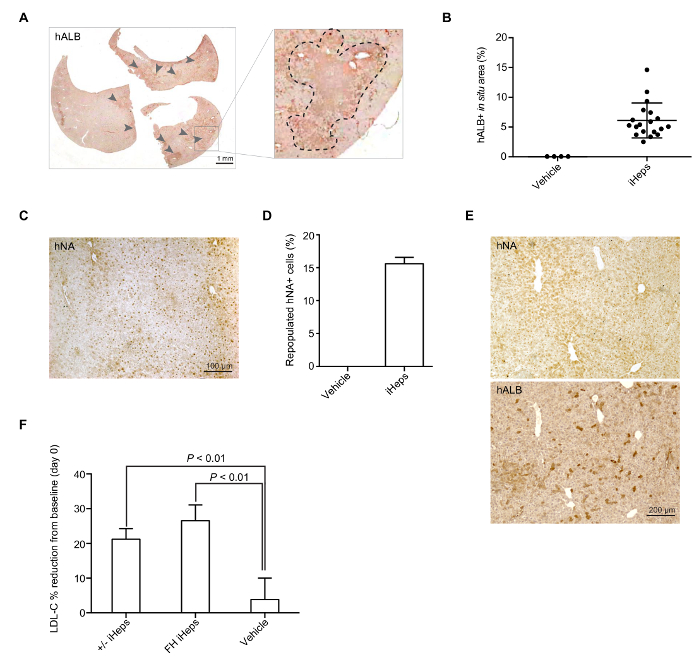
Figura 4: iHep mediata ripopolamento del fegato di topi LRG. (A) immagine intera sezione-scansionati rappresentativa di hALB colorazione in un fegato di topo ripopolato con LDLR + /-iHeps. Le frecce indicano i cluster di iHeps umana innestati in fegato del topo; ingrandita sezioni vengono visualizzati nel pannello di destra. (B) Scatter plot grafico rappresenta la percentuale di ripopolato hALB + corrispondenti alle aree contenenti iHep in un fegato di topo (da donatore diverso iPSCs), calcolo si basava sulle immagini di intera sezione-analizzati (n = 19). Vengono mostrati i valori medi e le barre di errore indicano immagini rappresentative di SD. (C) di macchiatura immunohistochemical per hNA in un fegato di topo con engrafted FH iHeps. (D) grafico a barre Mostra la percentuale di ripopolato hNA + iHeps (da donatore diverso iPSCs) in LRG fegati del topo (n = 3). Vengono visualizzati i valori medi e barre di errore indicano hALB SD. (E) e hNA colorazione su due sezioni consecutive di un fegato di topo ripopolata con wild-type iHeps. (F) grafico a barre Mostra la percentuale del plasma LDL-C riduzione rispetto al basale post-all'attecchimento giorno 21; n = 5 per LDLR + /-iHeps e n = 6 per FH iHeps e il veicolo. Valori di P sono indicati sulla figura e sono stati ottenuti utilizzando un test t spaiato; significa che i valori sono mostrati barre di errore indicano SEM. pannelli B, D ed E vengono modificati dalla Figura 3-3I della nostra precedente relazione15. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5 : Gli anticorpi PCSK9 Visualizza LDL più forte abbassamento capacità di simvastatina in topi LRG chimerico del fegato umano. (A) rappresentazione schematica del farmaco in vivo test approccio utilizzando topi chimerici del fegato umani di FH. (B e C) variazione percentuale del plasma LDL-C dal basale a giorni 14, 21 e 28 in topi chimerici FH alimentati con dieta HFHC e trattati con i farmaci indicati; n indica il numero di topi. Valori di P sono stati ottenuti utilizzando un test di Kruskal-Wallis; vengono mostrati i valori medi e le barre di errore indicano SEM. (D), EDV in risposta all'aumento delle concentrazioni di ACh. Valori di P sono indicati sulla figura per la concentrazione indicata. Valori di P sono stati ottenuti mediante ANOVA a due vie regolata con confronto tra più di Dunnett; barre di errore indicano che sem. Figura 5 è stato modificato da Figura 4A-4C e Figura 5A della nostra precedente relazione15. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Gli studi precedenti utilizzando iHeps in roditori hanno confermato che sono un modo efficace per studiare malattie ereditate del fegato17. Ulteriormente espandere l'uso di questa tecnologia e perché attuali modelli animali di FH sono suboptimali, abbiamo engrafted FH iHeps in topi LRG e ha dimostrato che il engrafted LDLR + /- o eterozigoti LDLR-mutato FH iHeps può ridurre il livello di LDL-C del plasma di topi e rispondere alla riduzione dei lipidi droga in vivo.
Ci sono 3 fasi critiche nel nostro protocollo per la generazione umani topi chimerici FH del fegato utilizzando iHeps:
1) la produzione di iHeps di alta qualità attraverso differenziazione diretto. Data la variabilità clonale tra iPSC linee18, è importante utilizzare iPSCs isogeniche per confronti corretta e per testare l'efficienza di differenziazione iHep della linea madre cellulare prima di eseguire l'ingegnerizzazione e l'attecchimento.
2) iHep corretto caricamento nella siringa. Diversamente da altri protocolli, abbiamo utilizzare il 50% della matrice extracellulare (concentrazione finale, v/v) per risospendere iHeps e poi caricarli nella siringa dell'insulina. Noi crediamo che la matrice extracellulare protegge le cellule e fornisce un microambiente che facilita la migrazione di iHep nel fegato dalla milza. Le bolle sono un fattore letale per chirurgia e dovrebbero essere evitate completamente nella siringa.
3) numero di celle engrafted corretto. Sovraccarico delle cellule può anche portare a tasso di letalità elevata. Si consiglia 1 milione iHeps per topo di 25 – 30 g di capacità di integrazione.
Il nostro protocollo ha anche alcune limitazioni: il disturbo al fegato indotto da irradiazione è moderata e dose singola, e lo stato di maturazione del nostro iHeps non è paragonabile a pHH. Relativo a due considerazioni, il grado di chimerismo del nostro modello è simile a rapporti recenti che descrivono NOD/Lt-SCID/IL-2Rγ−/− topi o ratti Gunn innestate con iPSC-derivati iHeps17,19 , ma significativamente più bassa di RFG topi o uPA topi transgenici innestati con pHH. Per ovviare a questo inconveniente, da un lato, uno potrebbe ottimizzare ulteriormente il protocollo di differenziazione epatica per migliorare la maturazione dei iHeps. D'altra parte, LRG topi potrebbero essere incrociati con topi FRG per generare topi Ldlr- / -/Fah- / -/Rag2- / -/Il2rg- / .
In sintesi, qui abbiamo descritto un protocollo dettagliato per la generazione di animali chimerici del fegato umani con FH iHeps e per verificare la funzionalità dell'iHeps engrafted. D'importanza, questi topi chimerici possono essere utilizzati per droga test in vivo . Il nostro modello probabilmente può essere ottimizzato migliorando le funzionalità di iHeps o buttando giù altri geni (ad es., Fah) nel destinatario LRG topi e sarà utile per studiare i meccanismi patologici della malattia ed eseguire preclinici studi.
Divulgazioni
H.-F.T. è il coordinatore nazionale e sperimentatore dello studio ODYSSEY risultati sponsorizzato da Sanofi e Regeneron Pharmaceuticals.
Riconoscimenti
Questo lavoro è stato supportato dalla Shenzhen scienza e tecnologia del Consiglio programma Basic Research (JCYJ20150331142757383), programma di ricerca strategico prioritario dell'Accademia cinese delle scienze (XDA16030502), Hong Kong Research Grant Consiglio tema basato su ricerca Schema (T12-705/11), programma di cooperazione del Consiglio di sovvenzioni di ricerca della regione amministrativa speciale di Hong Kong e la Fondazione nazionale di scienze naturali di Cina di (N-HKU730/12 e 81261160506), progetto di Team di ricerca di scienze naturali di Guangdong Foundation (2014A030312001), Guangzhou Science e Technology Program (201607010086) e nella provincia del Guangdong scienza e tecnologia programma (2016B030229007 e 2017B050506007).
Materiali
| Name | Company | Catalog Number | Comments |
| Materials | |||
| 40 µm Cell strainer | BD | B4-VW-352340 | |
| 6-Well plate | Thermofisher | 140675 | Extracellular matrix coated |
| Accutase | Millipore | SCR005 | |
| Acetylcholine | Sigma Aldrich | A6625 | Dissolve in water |
| Antigen retrieval solution | IHC World | IW-1100-1L | |
| Calcium chloride | Sigma Aldrich | C8106 | CaCl2 |
| Cell dissociation enzyme | Thermofisher | 12604-013 | TrypLE |
| D-glucose | Sigma Aldrich | D8270 | |
| Dimethyl sulfoxide | Sigma Aldrich | D5879 | DMSO |
| DMEM | Thermofisher | 10829 | Knockout DMEM |
| DNase I | Roche | 11284932001 | |
| EDTA | USB | 15694 | 0.5 M, PH=8.0 |
| Extracellular matrix (for cell suspension) | Corning | 354234 | Matrigel |
| Extracellular matrix (for iHep differentiation) | Corning | 354230 | Matrigel |
| Hepatocyte basal medium | Lonza | CC-3199 | |
| Hepatocyte culture medium | Lonza | CC-3198 | |
| High-fat and high-cholesterol diet | Research Diet | D12079B | |
| Human Activin A | Peprotech | 120-14E | |
| Human hepatocyte growth factor | Peprotech | 100-39 | |
| Human iPSC maintenance medium | STEMCELL Technologies | 5850 | mTeSR1 |
| Human oncostatin M | Peprotech | 300-10 | |
| Ketamine 10% | Alfasan | N/A | |
| L-glutamine | Thermofisher | 35050 | |
| LDL-C detection kit | WAKO | 993-00404 and 993-00504 | |
| Magnesium chloride | VWR | P25108 | MgCl2 |
| Meloxicam | Boehringer Ingelheim | NADA 141-213 | |
| Monopotassium phosphate | USB | S20227 | KH2PO4 |
| Non-essential amino acids | Thermofisher | 11140 | |
| PBS | GE | SH30256.02 | Calcium and magnesium-free |
| PCSK9 antibodies | Sanofi and Regeneron Pharmaceuticals | SAR236553/REGN727 | Alirocumab |
| Phenobarbital | Alfamedic company | 013003 | |
| Phenylephrine | RBI | P-133 | Dissolve in water |
| Potassium chloride | Sigma Aldrich | P9333 | KCl |
| Povidone-iodine | Mundipharma | Betadine | |
| Recombinant mouse Wnt3a | R&D Systems | 1324-WN-500/CF | |
| ROCK inhibitor Y27632 | Sigma Aldrich | Y0503-5MG | |
| RPMI 1640 | Thermofisher | 21875 | |
| Serum replacement | Thermofisher | 10828 | |
| Silicone coated petri dish | Dow Corning | Sylgard 184 silicone elastomer kit | |
| Simvastatin | Merck Sharp & Dohme | ZOCOR | |
| Sodium bicarbonate | Sigma Aldrich | S6297 | NaHCO3 |
| Sodium chloride | Sigma Aldrich | S7653 | NaCl |
| Trypan blue solution 0.4% | Thermofisher | 15250061 | |
| U-46619 | Cayman | 16450 | Dissolve in DMSO |
| Xylazine 2% | Alfasan | N/A | |
| β-mercaptoethanol | Thermofisher | 31350 | |
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| AAT | DAKO | A0012 | 1:400 |
| ALB | Bethyl Laboratories | A80-129 | 1:200 |
| ASGPR | Santa Cruz | Sc-28977 | 1:100 |
| HNF4A | Santa Cruz | Sc-6557 | 1:35 |
| NANOG | Stemgent | 09-0020 | 1:200 |
| OCT4 | Stemgent | 09-0023 | 1:200 |
| Name | Company | Catalog Number | Comments |
| Mice | |||
| Il2rg-/- | Jacson lab | 003174 | |
| Ldlr-/- | Jacson lab | 002077 | |
| Rag2-/- | Jacson lab | 008449 | |
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Automated cell counter | Invitrogen | Countess | |
| Gamma irradiator | MDS Nordion | Gammacell 3000 Elan II | |
| Insulin syringe | BD | 324911 | |
| Powerlab | ADInstruments | Model 8/30 | |
| Slides scanning system | Leica biosystems | Aperio scanScope system | |
| Sliding Microtome | Leica biosystems | RM2125RT | |
| Stereomicrocope | Nikon | SMZ800 | |
| Tissue processing system | Leica biosystems | ASP200S | |
| Wire myograph | DMT | 610M | |
| Name | Company | Catalog Number | Comments |
| Softwares | |||
| Digital slide viewing software | Leica | Aperio ImageScope Version 12.3.2 | |
| Image J | NIH | Version 1.51e | |
| Image processing software | Adobe | Photoshop CC Version 2015 | |
| Microscope imaging software | Carl Zeiss | AxioVision LE Version 4.7 |
Riferimenti
- Brown, M. S., Goldstein, J. L. A receptor-mediated pathway for cholesterol homeostasis. Science. 232 (4746), 34-47 (1986).
- Endo, A. The discovery and development of HMG-CoA reductase inhibitors. J Lipid Res. 33 (11), 1569-1582 (1992).
- Dubuc, G., et al. Statins upregulate PCSK9, the gene encoding the proprotein convertase neural apoptosis-regulated convertase-1 implicated in familial hypercholesterolemia. Arterioscler Thrombo Vasc Biol. 24 (8), 1454-1459 (2004).
- Robinson, J. G., et al. Efficacy and safety of alirocumab in reducing lipids and cardiovascular events. N Engl J Med. 372 (16), 1489-1499 (2015).
- Fitzgerald, K., et al. Effect of an RNA interference drug on the synthesis of proprotein convertase subtilisin/kexin type 9 (PCSK9) and the concentration of serum LDL cholesterol in healthy volunteers: a randomised, single-blind, placebo-controlled, phase 1 trial. Lancet. 383 (9911), 60-68 (2014).
- Ishibashi, S., et al. Hypercholesterolemia in low density lipoprotein receptor knockout mice and its reversal by adenovirus-mediated gene delivery. J Clin Invest. 92 (2), 883-893 (1993).
- Watanabe, Y. Serial inbreeding of rabbits with hereditary hyperlipidemia (WHHL-rabbit). Atherosclerosis. 36 (2), 261-268 (1980).
- Carpentier, A., et al. Engrafted human stem cell-derived hepatocytes establish an infectious HCV murine model. J Clin Invest. 124 (11), 4953-4964 (2014).
- Tateno, C., et al. Near completely humanized liver in mice shows human-type metabolic responses to drugs. Am J Pathol. 165 (3), 901-912 (2004).
- Basma, H., et al. Differentiation and transplantation of human embryonic stem cell-derived hepatocytes. Gastroenterology. 136 (3), 990-999 (2009).
- Soldner, F., et al. Generation of isogenic pluripotent stem cells differing exclusively at two early onset Parkinson point mutations. Cell. 146 (2), 318-331 (2011).
- Bissig, K. D., et al. Human liver chimeric mice provide a model for hepatitis B and C virus infection and treatment. J Clin Invest. 120 (3), 924-930 (2010).
- Azuma, H., et al. Robust expansion of human hepatocytes in Fah(-/-)/Rag2(-/-)/Il2rg(-/-) mice. Nat Biotechnol. 25 (8), 903-910 (2007).
- Bissig-Choisat, B., et al. Development and rescue of human familial hypercholesterolaemia in a xenograft mouse model. Nat Commun. 6, 7339 (2015).
- Yang, J., et al. Generation of human liver chimeric mice with hepatocytes from familial hypercholesterolemia induced pluripotent stem cells. Stem Cell Rep. 8 (3), 605-618 (2017).
- Kajiwara, M., et al. Donor-dependent variations in hepatic differentiation from human-induced pluripotent stem cells. Proc Natl Acad Sci USA. 109 (31), 12538-12543 (2012).
- Chen, Y., et al. Amelioration of hyperbilirubinemia in gunn rats after transplantation of human induced pluripotent stem cell-derived hepatocytes. Stem Cell Rep. 5 (1), 22-30 (2015).
- Ortmann, D., Vallier, L. Variability of human pluripotent stem cell lines. Curr Opin Genet Dev. 46, 179-185 (2017).
- Liu, H., Kim, Y., Sharkis, S., Marchionni, L., Jang, Y. Y. In vivo liver regeneration potential of human induced pluripotent stem cells from diverse origins. Sci Transl Med. 3 (82), 82ra39 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon