Method Article
Un modèle de souris chimériques du foie humain de l’hypercholestérolémie utilisant des hépatocytes de dérivés de cellules souches pluripotentes induites
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Nous présentons ici un protocole visant à créer un modèle de souris chimériques du foie humain de l’hypercholestérolémie familiale à l’aide des hépatocytes de dérivés de cellules souches humaines pluripotentes induites. Il s’agit d’un modèle précieux pour tester de nouvelles thérapies pour l’hypercholestérolémie.
Résumé
Hypercholestérolémie familiale (FH) est principalement causé par des mutations du récepteur (LDLR) lipoprotéine de basse densité et entraîne un risque accru de maladie cardiovasculaire précoce en raison d’une élévation marquée du cholestérol LDL (LDL-C) dans le sang. Statins sont la première ligne de médicaments hypolipidémiants pour traiter les FH et autres types d’hypercholestérolémie, mais de nouvelles approches font leur apparition, en particulier PCSK9 anticorps, qui sont actuellement testés dans des essais cliniques. Afin d’explorer de nouvelles approches thérapeutiques pour FH, soit de nouveaux médicaments ou de nouvelles formulations, nous avons besoin approprié en vivo modèles. Toutefois, les différences dans les profils métaboliques de lipides par rapport à l’homme sont un problème clé des modèles animaux disponibles de FH. Pour résoudre ce problème, nous avons généré un modèle de souris chimériques du foie humain à l’aide de FH induite par les cellules souches pluripotentes (CISP)-dérivé des hépatocytes (iHeps). Nous avons utilisé des souris/Ldlr- / -/Rag2- / -/Il2rg- / - (GRL) pour éviter le rejet immunitaire des cellules humaines transplantées et d’évaluer l’effet du gène LDLR-iHeps déficientes dans un gène LDLR null fond. Transplanté FH iHeps pourrait repeupler 5 à 10 % de la foie de souris LRG basé sur la coloration de l’albumine humaine. En outre, l’iHeps implantée a répondu aux médicaments hypolipidémiants et récapitulées observations cliniques d’efficacité accrue de PCSK9 anticorps comparée aux statines. Notre modèle chimérique du foie humain pourrait donc être utile pour les tests précliniques de nouvelles thérapies à FH. En utilisant le même protocole, semblables humains souris chimériques du foie pour d’autres variantes génétiques FH, ou correspondant aux autres maladies du foie héréditaires, des mutations peut-être également être généré.
Introduction
Récepteur de lipoprotéines de basse densité (LDLR) capte le cholestérol LDL (LDL-C) dans le sang pour moduler la synthèse du cholestérol dans le foie. Des mutations dans le gène LDLR sont la cause la plus fréquente de l’hypercholestérolémie familiale (FH)1. Statins sont traditionnellement la première ligne de médicaments pour traiter les FH et autres types d’hypercholestérolémie (hérité ou acquis). Statines inhibent la 3-hydroxy-3-méthylglutaryl-coenzyme A réductase pour diminuer la synthèse du cholestérol dans le foie2. En outre, statines augmentent les niveaux de LDLR sur la surface des hépatocytes pour promouvoir plasma clairance du LDL-C. Toutefois, un bémol majeur du traitement par statines est qu’ils induisent simultanément l’expression de la proprotéine convertase subtilisine/hexin 9 (PCSK9), une enzyme qui se lie à LDLR pour promouvoir sa dégradation3. Cet effet est responsable des interventions insuffisantes ou même nulle aux statines observées chez de nombreux patients. Étudier ce mécanisme a, contre toute attente, conduit à la découverte d’une autre façon de traiter l’hypercholestérolémie. Les anticorps de PCSK9 récemment approuvés par la FDA sont actuellement utilisés dans les essais cliniques et montrent une efficacité plus élevée et meilleure tolérance que les statines4. Le succès de PCSK9 anticorps implique aussi qu’il peut y avoir d’autres possibilités thérapeutiques pour moduler la voie de dégradation LDLR (en dehors de PCSK9) chez les patients atteints d’hypercholestérolémie. De même, il y a intérêt à développer de nouveaux inhibiteurs de PCSK9 autres que des anticorps, par exemple, siARN oligos5.
Pour tester les nouvelles thérapies de FH et en général tout autre type d’hypercholestérolémie, approprié en vivo modèles sont nécessaires. Un problème majeur de l’actuelle en vivo modèles, pour la plupart des souris6 et7, les lapins sont leurs différences physiologiques chez l’homme. Fondamentalement, ces problèmes sont notamment un profil métabolique de différents lipides. La génération des animaux chimériques du foie humain8 pourrait aider à surmonter cette mise en garde. La souris chimérique du foie humaine est un type de « humanisé » souris avec son foie repeuplée avec des hépatocytes humains, par exemple, des hépatocytes humains primaires (pHH)9. Un problème avec pHH, c’est qu’ils ne peuvent pas être expansion ex vivo, rapidement perdre leur fonction à l’isolement, et sont une source limitée. Une alternative à pHH est l’utilisation des cellules souches pluripotentes induites (CISP)-dérivé des hépatocytes (iHeps)10. Notamment, CISP est spécifiques à un patient et peut être cultivés indéfiniment, aussi iHeps peut-elle être produite sur demande, qui est un avantage important sur pHH fraîche. En outre, CISP peut également être facilement modifié génétiquement avec des nucléases concepteur de corriger ou d’introduire des mutations dans un contexte isogénique pour permettre le plus fidèle des comparaisons11.
Homme souris chimérique du foie avec pHH implantée présentent des similitudes avec les humains en profils métaboliques du foie, réponses de drogue et la susceptibilité à l’hépatite virus infection12. Cela fait d’eux un bon modèle pour étudier hyperlipidémie in vivo. Les modèles de souris plus largement utilisé sont inspirent de la/Fah- / -/Rag2- / -/Il2rg- / - (RFA) souris13 et l’uPA souris transgéniques8, dans lequel jusqu'à 95 % de la souris le foie peut être remplacé par pHH. Fait intéressant, un récent rapport décrit une humain FH foie chimérique souris (basée sur la souris de la RFA) avec pHH provenant d’un patient portant un homozygote de mutation de gène LDLR 14. Dans ce modèle, les hépatocytes humains regarnis n’eu aucun LDLR fonctionnelle, mais les hépatocytes de souris résiduelle faisaient, réduisant ainsi l’utilitaire permettant d’effectuer en vivo analyse de drogues en s’appuyant sur le parcours du LDLR.
Nous rapportons ici un protocole détaillé basé sur notre ouvrage récemment publié15 de faire une exception FH iHeps dans le foie de souris/Ldlr- / -/Rag2/ -/Il2rg- / - (GRL). Cette souris chimérique du foie humaine est utile pour la modélisation de FH et effectuer le dépistage des drogues in vivo.
Protocole
Toutes les méthodes décrites ici qui impliquent l’utilisation d’animaux ont été approuvés par le Comité sur l’utilisation des animaux vivants dans l’enseignement et de recherche (CULATR) de l’Université de Hong Kong.
1. préparation et analyse phénotypique de souris
-
Génération d’un déficit immunitaire Ldlr chez des souris knockout (KO).
- Utilisez la souris souches Ldlr- / -, Rag2- / -et Il2rg- / - (voir Table des matières).
- Croix- / - souris Rag2 Il2rg- / - souris à générer Rag2- / -/ Il2rg- / - souris, puis traverser Ldlr- / - souris avec Rag2- / - / Il2rg- / - souris pour générer de souris/Ldlr- / -/Rag2- / -/Il2rg- / - (GRL)15. À l’âge de 3 à 4 semaines, recueillir l’ADN génomique de l’oreille afin de déterminer le génotype par PCR et séquençage.
- À l’âge de 8 à 12 semaines, utiliser des souris mâles LRG comme bénéficiaires pour iHeps pour générer des souris chimériques du foie humains.
- Nourrir les souris avec une alimentation riche en graisses et riche en cholestérol de (a) 7 jours avant la transplantation iHep pour les aider à développer l’hypercholestérolémie.
- Pour induire des lésions hépatiques qui facilite la prolifération des iHeps implantée dans le foie, placez les souris dans un récipient stérile et irradier à l’aide d’un irradiateur gamma avec rayons γ à une dose de 3 Gy 24 h avant la prise de greffe. Ensuite, les souris regagner leurs camps de logement. La bonne situation de ces souris irradiées peut être contrôlée par la mesure de leur poids. Souris avec perte de poids de 20 % ou plus vont être euthanasiés.
2. iHep différenciation et Dissociation
LDLR KO hétérozygote (+/-) ou homozygotes KO (- / -) humaine CISP ou FH patient-CISP avec des mutations hétérozygotes dans le gène LDLR (FH CISP) sont utilisés pour produire l’iHeps. La génération de LDLR +/-ou- / - CISP et FH CISP est décrit dans notre précédent rapport15.
- Différenciation dirigée de CISP en iHeps
Remarque : La méthode de différenciation des humains CISP en iHeps est modifiée d’un précédent rapport16.- Trois jours avant les semences de la différenciation (journée -3), le CISP sur matrice extracellulaire enduit plaques 6 puits (voir Table des matières) à une densité de 300 000 cellules/puits dans 1,5 mL (également ci-après) de support de maintenance iPSC humaine (voir Table des matières ) additionné de 5 inhibiteur de ROCK µM (Y27632). La culture des cellules à 37 ° C dans une étuve humide de2 CO 5 %. Normalement, iHeps d’une plaque de 6 puits sont suffisants pour greffer 5 souris.
- 24 heures plus tard (jour -2) et 48 h plus tard (jour -1), changer le support au milieu de maintenance iPSC humain frais sans inhibiteur de la roche.
NOTE : CISP avant la différenciation devrait exprimer des niveaux élevés de OCT4 et NANOG, qui peut être examinée par RT-PCR quantitative, par immunofluorescence ou par cytométrie en flux. - Au jour J0 de différenciation, laver les cellules avec RPMI 1640 une fois et puis ajoutez RPMI 1640 additionné de 100 ng/mL activine A et 25 ng/mL WNT3a.
- Au jour 1 et jour 2 de différenciation, changer le milieu pour RPMI 1640 additionné de 100 ng/mL Activin A.
Remarque : Si à ce stade, il est trop la mort cellulaire (jours 0-3), jusqu'à 0,5 % sérum fœtal (SVF) peut être ajouté à moyen et à améliorer la viabilité des cellules. Cependant, nous proposons de tester la quantité minimale de FBS à ajouter pour chaque ligne de l’iPSC spécifique, comme excès FBS peuvent également influer sur la différenciation. - Au 3e jour, laver les cellules avec DMEM une fois, puis passer à 2 médiums de scènend (remplacement de 20 % de sérum, 1 acides aminés non-essentiels de x, 2 M L-glutamine, du bêta-mercaptoéthanol 0,1 M et 1 % diméthylsulfoxyde dans un milieu DMEM). Changer le support de tous les deux jours jusqu’au jour 10.
Remarque : Le jour 7, les cellules doivent avoir atteint confluence et affichage clair bords. Il pourrait y avoir certaines zones indifférenciées qui apparaît à ce stade ; les ignorer si le pourcentage de ces zones est faible. Si le pourcentage est élevé, réduire la confluence du CISP au jour J0 et réduire la quantité de FBS utilisé dans la première étape de la différenciation. - Au jour 10, laver les cellules avec le milieu de base hépatocyte une fois et puis passez au milieu de culture des hépatocytes additionné de facteur de croissance hépatique humain ng/mL 20 et 20 ng/mL oncostatine M pour favoriser la maturation iHep. Changer le support de tous les autres jours.
Remarque : À ce stade, > 90 % des cellules devrait être positif pour HNF4A, selon immunofluorescence coloration ou écoulement cytometry. - Jour 15-17, les cellules sont prêts pour la prise de greffe. Éventuellement, le surnageant de culture cellulaire peut-être être collecté et stocké à-80 ° C pour quantifier l’albumine sécrétée (ALB) par iHeps.
Remarque : À ce stade, > 80 % iHeps devrait être positif pour HNF4A, ALB et α1-antitrypsine (AAT) selon l’immunofluorescence souillant. Environ 60 à 70 % du jour 17 iHeps devrait être positif pour ASGPR, comme indiqué par cytométrie en flux. Dans nos mains, iHeps à cette période ont une capacité optimale de repeupler le foie de souris ; iHeps peuvent sécréter des niveaux plus élevés d’ALB in vitro mais aussi deviennent sénescentes si la greffe est retardée.
- Dissociation et chargement de l’iHeps dans une seringue à insuline
- Préparer les réactifs nécessaires et le matériel :
- 24 h avant la prise de greffe, décongeler la quantité nécessaire (V = 40 µL * nombre de souris) de matrice extracellulaire dans une glace boîte dans une pièce froide et mettre la seringue d’insuline et une boîte de 200 conseils µL dans un réfrigérateur à 4 ° C.
- Une heure avant la prise de greffe, chaud l’enzyme de dissociation cellulaire additionné de 50 µg/mL DNase I à température de la pièce et placez le milieu RPMI 1640 additionné de remplacement de sérum de 20 % sur la glace.
- Prendre des images de contraste de phase (100 X et 200 X) d’iHeps pour enregistrer leur statut, y compris la morphologie cellulaire, la croissance et la densité des cellules.
- Laver l’iHeps avec 2 mL/puits de température ambiante Ca2 + et Mg2 +-sans PBS deux fois et puis ajouter 1 mL d’enzyme de dissociation cellulaire additionné de 50 µg/mL DNase I dans chaque puits. Remettre les cellules dans l’incubateur pendant 8 à 10 min.
Remarque : Pour améliorer la dissociation cellulaire avec enzyme de dissociation cellulaire, laver les cellules avec Ca2 + et Mg2 +-gratuit PBS. Pour maximiser la viabilité cellulaire, nous suggérons dissociant pas plus de 6 puits par lot à la fois. En outre, nous vous suggérons de restreindre le traitement d’enzyme de dissociation cellulaire à moins de 10 minutes. - Surveiller la morphologie des cellules au microscope. Quand la plupart des cellules devenue ronde, ajouter un volume égal de froid RPMI 1640, additionné de remplacement de 20 % de sérum dans chaque puits, pipette les cellules doucement à se détacher de la plaque et transférer la suspension cellulaire dans un nouveau tube de 15 mL.
Remarque : Cette étape est critique pour la viabilité des cellules récoltées. Si les cellules sont difficiles à se détacher de la plaque, il n’importe pas si certaines cellules sont laissés. Si les cellules se détachement comme grands carrés de monocouche, puis pipetez doucement après centrifugation afin d’obtenir une suspension de cellules du même. - Répétez l’étape 2.2.4 pour chaque bien, jusqu'à ce que presque tout attaché de cellules est recueilli. Centrifuger à 200 x g pendant 3 min à 4 ° C.
- Retirez le surnageant et remettre en suspension les cellules avec 2 mL de PBS froid dans un tube de 15 mL. Pipetter les cellules doucement afin d’obtenir une suspension de cellules individuelles, puis ajoutez les PBS froid pour un volume final de 1 mL * nombre de puits dissociées. Enfin, passez les cellules à travers un tamis de cellule 40 µm pour éliminer les agrégats.
Remarque : Normalement 1-2 x 106 cellules/puits peuvent être récoltées après filtrage. - Aliquote de 20 µL de suspension de cellules et ajouter 20 µL de solution de bleu de trypan de 0,4 %, puis compter les cellules à l’aide d’un compteur de cellules automatisées et noter la concentration de suspension cellulaire que « C ». Calculer le volume requis (V1 = [106 * (n + 1)] / C, où n est le nombre de souris pour être greffés) de suspension de cellules (1 million/souris) pour injection intra-splénique.
- Aliquote le volume requis de suspension cellulaire dans des tubes de 15 mL et centrifuger à 200 x g pendant 3 min à 4 ° C.
- Retirer le surnageant, remettre en suspension les cellules dans le volume approprié de PBS froid pour transformer le volume de suspension cellulaire (n + 1) * 55/2 µL (n = nombre de souris), puis ajouter un volume égal de matrice extracellulaire pour faire le dernier volume de suspension cellulaire (n + 1) * 55 µL.
- Placer la seringue à insuline froid sur la glace, débranchez le piston, transférer 55 µL de suspension cellulaire dans la seringue et puis remettre le piston. Décharge des bulles soigneusement et remettre la seringue sur glace.
- Répétez 2.3.10 jusqu'à ce que toutes les seringues ont été chargés avec les cellules. Les seringues sont maintenant prêts pour l’injection.
Remarque : Nous recommandons afin de maximiser la viabilité cellulaire, gardant les cellules sur la glace après dissociation. Pour la 2.2.4–2.2.11 des étapes ci-dessus, vérifiez que tous les réactifs sont conservés entre 2 et 8 ° C avant utilisation.
- Préparer les réactifs nécessaires et le matériel :
3. intra-splénique Injection d’iHeps
- Anesthésier les souris avec la kétamine (100 mg/kg) et de xylazine (10 mg/kg) injecté par voie intrapéritonéale. Mettre pommade vétérinaire sur les yeux de la souris pour prévenir le dessèchement pendant la procédure d’anesthésie et de surveiller leurs réflexes musculaires pour observer l’effet de l’anesthésie et évaluer la douleur.
- Une fois que les souris ont perdu le réflexe musculaire à la stimulation, les placer en position de décubitus latéral à droite. Appliquez une couche épaisse de crème dépilatoire à la zone de l’incision dans le flanc gauche pour 5 à 8 min. Puis, retirez la crème dépilatoire et les cheveux en frottant la zone avec une compresse de gaze imbibé d’eau.
- Frottez le flanc gauche avec la povidone iodée ou, alternativement, avec de l’éthanol 70 % 3 fois suivi d’un trempage final avec la polyvidone iodée pour la désinfection.
- Dans un niveau 2 de biosafety armoire, localiser la position de la rate, qui peut être visualisée de manière transparente dans le flanc gauche et puis incise la peau et la paroi abdominale pour 0,5 à 1 cm. extérioriser la rate en tirant sur le tissu adipeux doucement près de lui à l’aide de pointu forceps. Stabiliser la rate à l’aide d’un écouvillon doucement.
- Introduire l’aiguille de la seringue à insuline 3 – 4 mm dans le parenchyme de la rate et injecter environ 50 µL de la suspension cellulaire doucement. Retirer l’aiguille et placez un coton-tige sur le site d’injection pendant 1 minute pour prévenir les saignements et les déversements de matières.
- Retourner la rate le péritoine et refermer la plaie avec des sutures de nylon 5-0. Puis, continuez à souris dans un chaleureux chambre/incubateur pendant 3 – 16 h pour les retourner à leur température normale du corps et de faire revivre. Les souris qui ont subi une intervention chirurgicale ne sont pas retournés à la compagnie des autres animaux jusqu'à ce que complètement guéri.
- Ajouter le meloxicam (26 µg/mL) à l’eau potable et injecter la buprénorphine (50 μg/kg) par voie intramusculaire comme anti-inflammatoire et analgésique, respectivement. Moniteur chirurgicale plaies tous les jours pour éviter toute inflammation.
Remarque : Assurez-vous que tous les instruments et les fournitures utilisés dans les étapes 4 à 7 sont stériles.
4. test de C-LDL plasmatique
- Aux jours 0, 7, 14, 21 et 28 post greffe, empêcher les souris LRG étroitement afin de minimiser le mouvement à côté de la tête à l’aide de la méthode retenue à deux mains, puis percer la veine faciale avec la lancette. Sang commencera à couler après le retrait de la lancette. Recueillir environ 50 µL de sang dans des tubes de 1,5 mL contenant 1 µL d’EDTA.
Remarque : Si la poignée est trop serrée, le volume de sang peut être réduit et souris peuvent mourir à cause de difficultés respiratoires. - Mélanger le sang doucement en retournant les tubes plusieurs fois et puis centrifuger à 950 x g pendant 15 min. récupérer le surnageant et rangez-les immédiatement à-80 ° C.
- Une fois que tous les échantillons sont prélevés, décongeler le plasma à la température ambiante et tester le niveau de LDL-C à l’aide d’un kit de détection de LDL-C selon le manuel du constructeur.
5. in Vivo Drug Testing dans chimériques souris greffée avec LDLR +/-et FH iHeps
- Pour provoquer l’hypercholestérolémie, donner les souris d’une nourriture a 7 jours avant la prise de greffe.
- Au greffe après 7 jours, traiter chaque groupe de souris avec véhicule (PBS, injecté par voie sous-cutanée), 10 mg/kg/semaine PCSK9 anticorps (une formulation de qualité clinique des anticorps monoclonaux de PCSK9, injecté par voie sous-cutanée trop), 10 mg/kg/jour de simvastatine (40 mg/L mg / mL dans l’eau potable), ou combiné des anticorps de PCSK9 et simvastatine.
- Recueillir la souris plasma au greffe après 0 (le jour de prise de greffe), 14, 21 et 28 jours. Stocker les échantillons à-80 ° C immédiatement.
- Une fois que tous les échantillons sont disponibles, vérifier le niveau de plasma LDL à l’aide d’un kit de détection de LDL-C, selon le manuel du constructeur.
6. Test de la fonction endothéliale
La fonction endothéliale est affectée au début de la FH et peut être testée dans notre modèle de souris comme un indicateur de la sévérité de la maladie ou pour évaluer l’amélioration avec différents traitements. Un stereomicrocope, pince de dissection, ciseaux, un myographe fils, matériel d’acquisition (voir Table des matières), et un ordinateur sont nécessaires pour cela.
- Sacrifier les souris par injection intrapéritonéale de phénobarbital 100 mg/kg. Enlever les organes internes pour que l’aorte parallèle à la colonne vertébrale est visible et peut être découpé dehors par ciseaux ainsi que les tissus adjacents et coeur. Disséquer les aortes à l’aide des ciseaux et les placer dans une solution froide de Krebs oxygénée (mM : 119 NaCl, 4,7 KCl, 2,5 CaCl2, 1 MgCl2, 25 NaHCO3, 1,2 KH2PO4et 11 D-glucose).
- Transférer les aortes dans une solution de Krebs à revêtement silicone Pétri. Épinglez le tissu conjonctif pour fixer la position de l’aorte sans l’étirer. Sous un stéréomicroscope, utilisation fine pince à ressort les ciseaux et disséquer l’aorte contre le tissu environnant de la graisse et adventitiels sans endommager la paroi des vaisseaux, puis le couper en 1,5 à 2 mm des segments de longueur.
- Couper un environ 2 cm μm de long et 40 inox fil épais et mettre doucement à travers la lumière de l’aorte. Transférer le segment dans la chambre de myographe fil remplie avec une solution de Krebs oxygénée en tenant le fil.
- Pour mesurer la longueur des segments aortes lorsqu’il étudiait la contractilité, posez chaque segment perpendiculairement entre les mâchoires et de la lecture (D1) sur le micromètre. Retirer le segment et les mâchoires se déplacent et enregistrent la lecture (D0). La longueur du segment serait L = D1-D0.
- Suivez le guide de l’utilisateur pour serrer le fil et le fixer avec le tournevis tout en plaçant le segment entre les mâchoires, mais laisser sans étirement.
- De normalisation avant l’expérience, définissez le myographe à zéro dans la position non étirée. Puis, lentement, déplacer la mâchoire apart et observer la tension de l’aorte à changer jusqu'à 3 mN. Après 15 minutes, égoutter la solution de la chambre myographe et remplacer par une solution fraîche de Krebs, attendre 15 min et régler la tension à 3 mN à nouveau.
- Changer la solution étalon de Krebs à 60 mM une solution de KCl contenant Krebs pour induire une contraction pendant au moins 15 min. rincer avec la solution de Krebs fraîchement 3 fois.
- Ajouter des concentrations croissantes de la phényléphrine (Phe ; par exemple, de 10 nM à 100 μM). Laver avec une solution standard de Krebs et ajouter une seule concentration de Phe à ~ 70 % de la contraction maximale de la contraction précédente. Lorsque la contraction est stable, ajouter des concentrations croissantes de l’acétylcholine (ACh ; par exemple, de 1 ou 3 nM à 10 ou 30 µM) pour induire une vasodilatation. ACh est ajouté à intervalle de 2 min environ.
Remarque : Dans certains segments aortiques avec petite contraction induite par le Phe, par exemple inférieure à 30 % de KCl induits par contraction, U46619 (un autre vasoconstricteur) à une concentration de 1 nM à 30 nM peut être utilisé pour induire une contraction stable qui est plus grande que 70 % des Contraction induite par le kCl. - Nettoyer le myographe selon le manuel du constructeur.
- Utilisant le logiciel d’analyse de données (voir Table des matières), compte rendu la force (F) après chaque ajout de médicaments. Dessiner le marqueur à tension basale (Fbasale) pour une mesure relative, déplacez la flèche vers le point culminant après Phe comme FPheet puis déplacez le point le plus bas après chaque addition d’ACh comme FACh. Pour calculer l’endothélium-dépendante la vasodilatation induite par l’ACh (EDV) % relaxation = (AChet Fbasale) / (Pheet Fbasale) sur l’axe y. Préparer une courbe de réponse de concentration sur le logiciel de statistique en utilisant la valeur log10 de la concentration en M sur l’axe des abscisses.
- Pour analyser la différence statistique, utiliser l’aire sous la courbe de chaque segment d’une souris et d’analyser la différence de l’aire sous la courbe entre les groupes à l’aide d’ANOVA à. Points individuels peuvent également être analysées si nécessaire.
7. preuve de l’iHep repeuplement dans le foie de souris
- Au point de terminaison, sacrifier les souris en injectant du phénobarbital 100 mg/kg par voie intrapéritonéale.
- Collecte de plasma par ponction cardiaque. Disséquer les lobes du foie à l’aide de ciseaux ophtalmique, puis mettre les foies dans un péri-plat de 10 cm et laver deux fois avec une solution saline. Supprimer une solution saline de la surface du foie avec du papier absorbant, puis couper les lobes dans autour de morceaux de 0,6 cm-longueur. Difficulté les lobes du foie dans les 10 % de formol.
- Incorporez les foies fixes en paraffine et section à l’aide d’un mouchoir en papier traitement système et un microtome coulissant, respectivement, conformément aux instructions du fabricant.
- Faire chauffer les diapositives à 60 ° C pendant 1 h faire fondre la cire. Ensuite, plonger les lames dans le xylène pendant 5 minutes deux fois et réhydrater les tissus avec de l’éthanol 100 %, 90 % et 70 % successivement.
- Plonger les lames dans la chambre-diapositive contenant environ 50 mL de solution de l’antigène et la chambre, puis mis dans la marmite à pression, 120 ° C pendant 1,5 min. laver les lames doucement avec des tuyaux d’eau pendant 5 minutes.
- Tacher les sections avec des anticorps primaires (environ 100 µL/section) ciblant humaine ALB (hALB) et l’antigène humain de noyaux (hNA). Puis, détachant avec anticorps secondaires conjugués avec une étiquette fluorescent ou la peroxydase de raifort (qui réagit avec le kit de détection DAB).
- Pour calculer le pourcentage de hALB + zones et cellules hNA +, scanner les diapositives colorées avec anti-hALB et anti-hNA et réagit avec DAB à l’aide d’un système de balayage automatique pour lames pour obtenir toute la section images.
NOTE : Ensemble images numérisées de section sont utiles pour calculer l’efficacité regarnie de manière impartiale basée sur hALB + zones ou hNA + cellules dans le foie de coloration immunohistochimique. Comme méthode alternative pour surveiller l’efficacité du repeuplement iHep, taux d’albumine humaine plasmatique peut être testée en utilisant un kit de ALB ELISA spécifique humain. - Prendre des clichés pour couvrir la diapositive entière à l’aide de la glissière numérique associée Regarde un logiciel sous 5 X vue. Pour quantifier le pourcentage de hALB + zones, pour chaque image de la capture instantanée, utilisent le microscope logiciel d’imagerie pour qualifier la zone positive (P) et la superficie totale (T) de l’image et utilisent Image J pour qualifier la zone vide (B). Le pourcentage des superficies hALB + exprimé sous la forme P/(T-B) * 100 %. Pour chaque groupe, au moins 3 souris doivent être sélectionnés. Et pour chaque souris, au moins 4 sections de différentes positions du foie devraient être choisies.
- Pour quantifier le pourcentage de hNA + cellules, pour chaque image de la capture instantanée, sélectionnez au hasard 1/16 de la région avec une logiciel de traitement d’image et manuellement, alors comptent le nombre de noyaux totales (T) et hNA + noyaux (N). Le pourcentage de hNA + est exprimé en N/T * 100 %. Pour chaque groupe, au moins 3 souris doivent être sélectionnés. Pour chaque souris, au moins 4 sections de différentes positions du foie doivent être sélectionnées.
Résultats
Dirigée CISP la différenciation de l’homme en iHeps
Lorsque vous atteignez 70 % confluence, CISP humaine est différenciées en iHeps avec un protocole de 3 étapes16 (du haut dela Figure 1 ). Après 3 jours de différenciation de l’endoderme, iPSC colonies devient desserrés et répartis à confluence complet (panneau inférieur dela Figure 1 ). Puis, avec 2 milieu de scène dend , canalicule apparaître et se multiplient. Ces cellules sont bondés, mais présentent des bords clairs à ce stade (jour 7, panneau inférieur de la Figure 1 ). Après 17 jours de différenciation, iHeps polarisées avec une morphologie typique à six pans creux apparaissent (panneau inférieur dela Figure 1 ). Ces iHeps expriment des marqueurs de pHH, y compris les AAT et ALB (Figure 2 a). En outre, le rapport de ASGPR + iHeps doit être relativement élevé, telle que mesurée par l’écoulement cytometry (Figure 2 b)15.
Génération d’un iHeps FH In Vivo maladie modèle à l’aide de FH
Pour aider LRG souris développent hypercholestérolémie, nous nourrir avec une alimentation a 7 jours avant la prise de greffe (journée -7). Le jour de prise de greffe (jour 0), souris LRG affichent plasma environ 3 fois le niveau de LDL-C (environ 600 mg/dL, la Figure 3 b). Jour que 15 – 17 iHeps sont implantés chez des souris LRG par injection intra-splénique ; Ces iHeps bientôt résident dans le parenchyme hépatique et prolifèrent là (Figure 3 a). À la fin, foies de ces souris chimériques sont recueillies et fixe, puis colorées avec hALB et hNA, qui devraient montrer une preuve évidente de l’iHep-mediated de repeuplement du foie dans le foie de souris LRG basé sur la coloration pour hALB et hNA (Figure 4 a-E). Dans nos mains, les LDLR +/-et FH iHeps pourrait réduire plasma LDL-C niveau sensiblement 21 jours après greffe (Figure 4F). À ce stade, les souris chimériques du foie humains de FH peuvent être utilisés pour tester des thérapies pour FH.
Validation du modèle de souris chimériques du foie humain FH à l’aide de médicaments disponibles
Pour valider notre modèle, nous avons utilisé 2 anticorps PCSK9 (Figure 5 a), simvastatine et bien connu de C-LDL abaissement médicaments. Nos résultats démontrent que 21 jours après le traitement, PCSK9 anticorps ont une plus forte capacité pour abaisser la LDL et EDV que la simvastatine chez les souris chimériques FH (Figure 5 b-D). Notamment, la réduction du pourcentage observé de plasma LDL-C avec des anticorps chez des souris chimériques FH PCSK9 est similaire à celle rapportée dans les essais cliniques4. Ces résultats démontrent l’utilité potentielle des souris chimériques LRG greffée avec FH iHeps pour les essais précliniques de nouveaux médicaments pour FH.

Figure 1 : réalisé CISP la différenciation de l’homme dans le panneau de iHeps.Top, chronologie d’une différenciation iPSC iHeps ; médias et cytokines clés sont indiqués pour chaque étape. (Panneau inférieur) Images de contraste phase représentative des différents points de différenciation iHep. KSR : remplacement de sérum knockout ; HCM : hépatocytes milieu de culture ; HGF : facteur de croissance des hépatocytes ; OSM : oncostatine M. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : caractérisation de l’iHeps produit avec protocole de différenciation modifiés. (A) Immunofluorescence d’iHeps à différents stades de différenciation. Les noyaux sont colorés en bleu dans les compositions fusionnées. (B) barre graphique montre le pourcentage de ASGPR + iHeps dérivés obtenus au jour 17, telle que mesurée par cytométrie en flux. Des échantillons ont été mesurées en 3 expériences indépendantes ; valeurs moyennes sont affichées et les barres d’erreur indiquent la déviation standard (SD). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : Génération d’un modèle de maladie FH In Vivo avec iHeps. (A) Time line pour la génération de souris chimériques du foie humains par injection intra-splénique de FH iHeps dans souris LRG. (B) barre graphe montre que nourrir souris GRL avec alimentation a conduit à considérablement augmenté le niveau de LDL-C (n = 10). Les valeurs de P sont indiqués sur la figure et ont été obtenues à l’aide d’un t-test non apparié ; valeurs moyennes sont affichées et les barres d’erreur indiquent erreur type de la moyenne (SEM). Le groupe B est modifié par rapport à 3I Figure de notre précédent rapport15. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
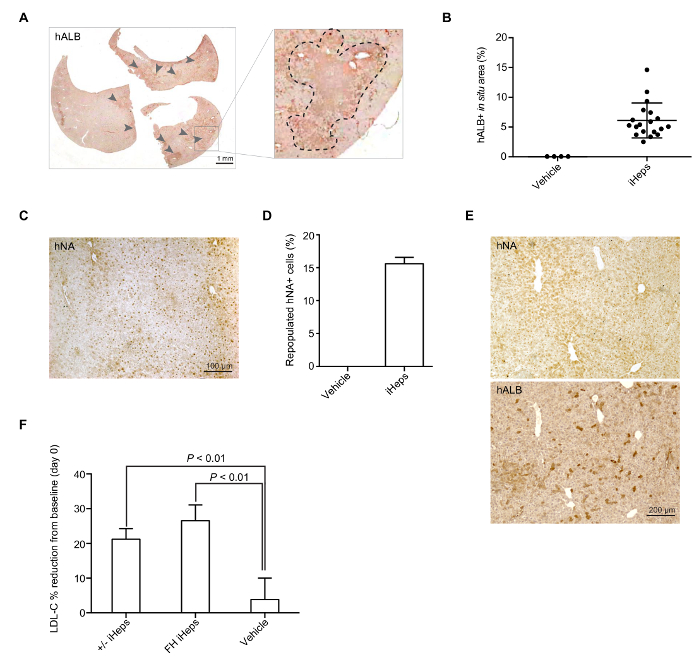
Figure 4 : iHep médiation repeuplement de foie de souris LRG. (A) image scannée toute section représentative de hALB coloration dans le foie de souris repeuplé avec LDLR +/-iHeps. Les flèches indiquent les grappes d’iHeps humaine implanté dans le foie de souris ; avec zoom sont indiqués dans le panneau de droite. (B) Scatter plot graphique montre le pourcentage de repeuplée hALB + correspond à des zones contenant de l’iHep dans le foie de souris (à partir de différents donateurs CISP), le calcul s’appuie sur des images numérisées-section entière (n = 19). Valeurs moyennes sont indiqués et les barres d’erreur indiquent les images représentatives SD. (C) d’immunohistochemical souillant pour hNA dans le foie de souris avec implantée FH iHeps. (D) graphique à barres montre le pourcentage de repeuplements hNA + iHeps (à partir de différents donateurs CISP) dans GRL foies de souris (n = 3). Valeurs moyennes sont affichées et barres d’erreur indiquent hALB SD. (E) et hNA coloration sur deux sections consécutives d’un foie de souris repeuplée avec iHeps de type sauvage. (F) graphique à barres montre le pourcentage de plasma réduction du LDL-C de base à la prise de greffe après 21 jours ; n = 5 pour LDLR +/-iHeps et n = 6 pour iHeps FH et le véhicule. Les valeurs de P sont indiqués sur la figure et ont été obtenues à l’aide d’un t-test non apparié ; signifie que les valeurs sont affichées barres d’erreur indiquent SEM. panneaux B, D et E sont modifiés de la Figure 3-3I de notre précédent rapport15. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 5 : PCSK9 anticorps montrent des LDL plus fort abaissement de capacité que la simvastatine chez les souris LRG chimérique du foie humain. (A) vue schématique de la drogue en vivo test approche à l’aide de la souris chimériques du foie humains de FH. (B et C) Variation du plasma LDL-C de base au jour 14, 21 et 28 chez les souris chimériques FH nourris avec la diète a et traités avec les médicaments indiqués ; n indique le nombre de souris. P valeurs ont été obtenues à l’aide d’un test de Kruskal-Wallis ; valeurs moyennes sont affichées et les barres d’erreur indiquent SEM. (D), EDV en réponse à l’augmentation des concentrations d’ACh. Les valeurs de P sont indiqués sur la figure pour la concentration indiquée. Les valeurs de P ont été obtenues par ANOVA bidirectionnelle ajusté avec comparaison multiple de Dunnett ; barres d’erreur indiquent que SEM. Figure 5 est modifiée de la Figure 4 a-4C et 5 a Figure de notre précédent rapport15. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Des études antérieures à l’aide d’iHeps chez les rongeurs ont confirmé qu’ils sont un moyen efficace pour étudier les maladies du foie héréditaires17. Afin d’étendre l’utilisation de cette technologie et parce que les modèles animaux actuels FH sont pas optimaux, nous greffée FH iHeps dans des souris LRG et a montré que l’implantée LDLR +/-ou hétérozygotes LDLR-muté FH iHeps peut réduire la concentration plasmatique LDL-C de souris et répondre aux hypolipidémiant drogue in vivo.
Il y a 3 étapes cruciales dans notre protocole pour la génération humaines souris chimériques FH du foie à l’aide d’iHeps :
1) production d’iHeps de haute qualité par le biais de différenciation dirigée. Compte tenu de la variabilité clonale entre iPSC lignes18, il est important d’utiliser CISP isogéniques de comparaison approprié et pour tester l’efficacité iHep de différenciation d’une lignée cellulaire de mère avant de procéder à l’ingénierie et la prise de greffe.
2) Télécharger iHep correcte dans la seringue. Différemment des autres protocoles, nous utilisons la matrice extracellulaire de 50 % (concentration finale, v/v) pour remettre en suspension iHeps et puis téléchargez-les dans la seringue d’insuline. Nous croyons que la matrice extracellulaire protège les cellules et fournit un micro-environnement qui facilite la migration iHep dans le foie de la rate. Bulles sont un facteur létal pour chirurgie et devraient être évitées complètement dans la seringue.
3) corriger le nombre de cellules implantées. Surcharge des cellules peut aussi conduire à des taux de létalité élevé. Nous vous recommandons de faire une exception iHeps 1 million par souris de 25 à 30 g.
Notre protocole présente également des limites : les lésions hépatiques induites par l’irradiation sont modérée et dose unique, et l’état de maturation de nos iHeps n’est pas comparable à pHH. Associés à ces deux considérations, le degré de chimérisme de notre modèle est similaire à récents rapports décrivant les souris NOD/Lt-SCID/IL-2Rγ−/− ou rat Gunn greffée avec dérivés iPSC iHeps17,19 , mais significativement plus faible que la RFA souris ou des souris transgéniques uPA greffés avec pHH. Pour remédier à cet inconvénient, d’une part, on pourrait optimiser davantage le protocole de différenciation hépatique pour améliorer la maturation de l’iHeps. En revanche, souris LRG pourraient être croisés avec la souris de RFA pour générer des souris Ldlr- / -/Fah- / -/Rag2- / -/Il2rg- / .
En résumé, ici nous avons décrit un protocole détaillé pour la génération humaines animaux chimériques du foie avec FH iHeps et pour tester les fonctionnalités de l’iHeps implantée. Ce qui est important, ces souris chimériques peuvent être utilisés pour le dépistage des drogues en vivo . Notre modèle peut probablement être optimisé en améliorant les fonctionnalités d’iHeps ou assommant de gènes supplémentaires (p. ex.., Fah) chez le receveur LRG souris et il sera utile d’étudier les mécanismes pathologiques de la maladie et effectuer préclinique études.
Déclarations de divulgation
H.-F.T. est le Coordonnateur National et l’investigateur de l’étude de résultats Odyssée parrainée par Sanofi et Regeneron Pharmaceuticals.
Remerciements
Ce travail a été soutenu par la Science de Shenzhen et de la technologie Conseil base Research Programme (JCYJ20150331142757383), programme de recherche stratégique prioritaire de l’Académie chinoise des Sciences (XDA16030502), Hong Kong Research Grant Conseil thème recherche Régime (T12-705/11), programme de coopération du Soviet de subventions de recherche de la région Administrative spéciale de Hong Kong et de la Fondation nationale des sciences naturelles de Chine (N-HKU730/12 et 81261160506), l’équipe projet de recherche des sciences naturelles de Guangdong Foundation (2014A030312001), Guangzhou Science et Technology Program (201607010086) et la Province de Guangdong programme Science et technologie (2016B030229007 et 2017B050506007).
matériels
| Name | Company | Catalog Number | Comments |
| Materials | |||
| 40 µm Cell strainer | BD | B4-VW-352340 | |
| 6-Well plate | Thermofisher | 140675 | Extracellular matrix coated |
| Accutase | Millipore | SCR005 | |
| Acetylcholine | Sigma Aldrich | A6625 | Dissolve in water |
| Antigen retrieval solution | IHC World | IW-1100-1L | |
| Calcium chloride | Sigma Aldrich | C8106 | CaCl2 |
| Cell dissociation enzyme | Thermofisher | 12604-013 | TrypLE |
| D-glucose | Sigma Aldrich | D8270 | |
| Dimethyl sulfoxide | Sigma Aldrich | D5879 | DMSO |
| DMEM | Thermofisher | 10829 | Knockout DMEM |
| DNase I | Roche | 11284932001 | |
| EDTA | USB | 15694 | 0.5 M, PH=8.0 |
| Extracellular matrix (for cell suspension) | Corning | 354234 | Matrigel |
| Extracellular matrix (for iHep differentiation) | Corning | 354230 | Matrigel |
| Hepatocyte basal medium | Lonza | CC-3199 | |
| Hepatocyte culture medium | Lonza | CC-3198 | |
| High-fat and high-cholesterol diet | Research Diet | D12079B | |
| Human Activin A | Peprotech | 120-14E | |
| Human hepatocyte growth factor | Peprotech | 100-39 | |
| Human iPSC maintenance medium | STEMCELL Technologies | 5850 | mTeSR1 |
| Human oncostatin M | Peprotech | 300-10 | |
| Ketamine 10% | Alfasan | N/A | |
| L-glutamine | Thermofisher | 35050 | |
| LDL-C detection kit | WAKO | 993-00404 and 993-00504 | |
| Magnesium chloride | VWR | P25108 | MgCl2 |
| Meloxicam | Boehringer Ingelheim | NADA 141-213 | |
| Monopotassium phosphate | USB | S20227 | KH2PO4 |
| Non-essential amino acids | Thermofisher | 11140 | |
| PBS | GE | SH30256.02 | Calcium and magnesium-free |
| PCSK9 antibodies | Sanofi and Regeneron Pharmaceuticals | SAR236553/REGN727 | Alirocumab |
| Phenobarbital | Alfamedic company | 013003 | |
| Phenylephrine | RBI | P-133 | Dissolve in water |
| Potassium chloride | Sigma Aldrich | P9333 | KCl |
| Povidone-iodine | Mundipharma | Betadine | |
| Recombinant mouse Wnt3a | R&D Systems | 1324-WN-500/CF | |
| ROCK inhibitor Y27632 | Sigma Aldrich | Y0503-5MG | |
| RPMI 1640 | Thermofisher | 21875 | |
| Serum replacement | Thermofisher | 10828 | |
| Silicone coated petri dish | Dow Corning | Sylgard 184 silicone elastomer kit | |
| Simvastatin | Merck Sharp & Dohme | ZOCOR | |
| Sodium bicarbonate | Sigma Aldrich | S6297 | NaHCO3 |
| Sodium chloride | Sigma Aldrich | S7653 | NaCl |
| Trypan blue solution 0.4% | Thermofisher | 15250061 | |
| U-46619 | Cayman | 16450 | Dissolve in DMSO |
| Xylazine 2% | Alfasan | N/A | |
| β-mercaptoethanol | Thermofisher | 31350 | |
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| AAT | DAKO | A0012 | 1:400 |
| ALB | Bethyl Laboratories | A80-129 | 1:200 |
| ASGPR | Santa Cruz | Sc-28977 | 1:100 |
| HNF4A | Santa Cruz | Sc-6557 | 1:35 |
| NANOG | Stemgent | 09-0020 | 1:200 |
| OCT4 | Stemgent | 09-0023 | 1:200 |
| Name | Company | Catalog Number | Comments |
| Mice | |||
| Il2rg-/- | Jacson lab | 003174 | |
| Ldlr-/- | Jacson lab | 002077 | |
| Rag2-/- | Jacson lab | 008449 | |
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Automated cell counter | Invitrogen | Countess | |
| Gamma irradiator | MDS Nordion | Gammacell 3000 Elan II | |
| Insulin syringe | BD | 324911 | |
| Powerlab | ADInstruments | Model 8/30 | |
| Slides scanning system | Leica biosystems | Aperio scanScope system | |
| Sliding Microtome | Leica biosystems | RM2125RT | |
| Stereomicrocope | Nikon | SMZ800 | |
| Tissue processing system | Leica biosystems | ASP200S | |
| Wire myograph | DMT | 610M | |
| Name | Company | Catalog Number | Comments |
| Softwares | |||
| Digital slide viewing software | Leica | Aperio ImageScope Version 12.3.2 | |
| Image J | NIH | Version 1.51e | |
| Image processing software | Adobe | Photoshop CC Version 2015 | |
| Microscope imaging software | Carl Zeiss | AxioVision LE Version 4.7 |
Références
- Brown, M. S., Goldstein, J. L. A receptor-mediated pathway for cholesterol homeostasis. Science. 232 (4746), 34-47 (1986).
- Endo, A. The discovery and development of HMG-CoA reductase inhibitors. J Lipid Res. 33 (11), 1569-1582 (1992).
- Dubuc, G., et al. Statins upregulate PCSK9, the gene encoding the proprotein convertase neural apoptosis-regulated convertase-1 implicated in familial hypercholesterolemia. Arterioscler Thrombo Vasc Biol. 24 (8), 1454-1459 (2004).
- Robinson, J. G., et al. Efficacy and safety of alirocumab in reducing lipids and cardiovascular events. N Engl J Med. 372 (16), 1489-1499 (2015).
- Fitzgerald, K., et al. Effect of an RNA interference drug on the synthesis of proprotein convertase subtilisin/kexin type 9 (PCSK9) and the concentration of serum LDL cholesterol in healthy volunteers: a randomised, single-blind, placebo-controlled, phase 1 trial. Lancet. 383 (9911), 60-68 (2014).
- Ishibashi, S., et al. Hypercholesterolemia in low density lipoprotein receptor knockout mice and its reversal by adenovirus-mediated gene delivery. J Clin Invest. 92 (2), 883-893 (1993).
- Watanabe, Y. Serial inbreeding of rabbits with hereditary hyperlipidemia (WHHL-rabbit). Atherosclerosis. 36 (2), 261-268 (1980).
- Carpentier, A., et al. Engrafted human stem cell-derived hepatocytes establish an infectious HCV murine model. J Clin Invest. 124 (11), 4953-4964 (2014).
- Tateno, C., et al. Near completely humanized liver in mice shows human-type metabolic responses to drugs. Am J Pathol. 165 (3), 901-912 (2004).
- Basma, H., et al. Differentiation and transplantation of human embryonic stem cell-derived hepatocytes. Gastroenterology. 136 (3), 990-999 (2009).
- Soldner, F., et al. Generation of isogenic pluripotent stem cells differing exclusively at two early onset Parkinson point mutations. Cell. 146 (2), 318-331 (2011).
- Bissig, K. D., et al. Human liver chimeric mice provide a model for hepatitis B and C virus infection and treatment. J Clin Invest. 120 (3), 924-930 (2010).
- Azuma, H., et al. Robust expansion of human hepatocytes in Fah(-/-)/Rag2(-/-)/Il2rg(-/-) mice. Nat Biotechnol. 25 (8), 903-910 (2007).
- Bissig-Choisat, B., et al. Development and rescue of human familial hypercholesterolaemia in a xenograft mouse model. Nat Commun. 6, 7339 (2015).
- Yang, J., et al. Generation of human liver chimeric mice with hepatocytes from familial hypercholesterolemia induced pluripotent stem cells. Stem Cell Rep. 8 (3), 605-618 (2017).
- Kajiwara, M., et al. Donor-dependent variations in hepatic differentiation from human-induced pluripotent stem cells. Proc Natl Acad Sci USA. 109 (31), 12538-12543 (2012).
- Chen, Y., et al. Amelioration of hyperbilirubinemia in gunn rats after transplantation of human induced pluripotent stem cell-derived hepatocytes. Stem Cell Rep. 5 (1), 22-30 (2015).
- Ortmann, D., Vallier, L. Variability of human pluripotent stem cell lines. Curr Opin Genet Dev. 46, 179-185 (2017).
- Liu, H., Kim, Y., Sharkis, S., Marchionni, L., Jang, Y. Y. In vivo liver regeneration potential of human induced pluripotent stem cells from diverse origins. Sci Transl Med. 3 (82), 82ra39 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon